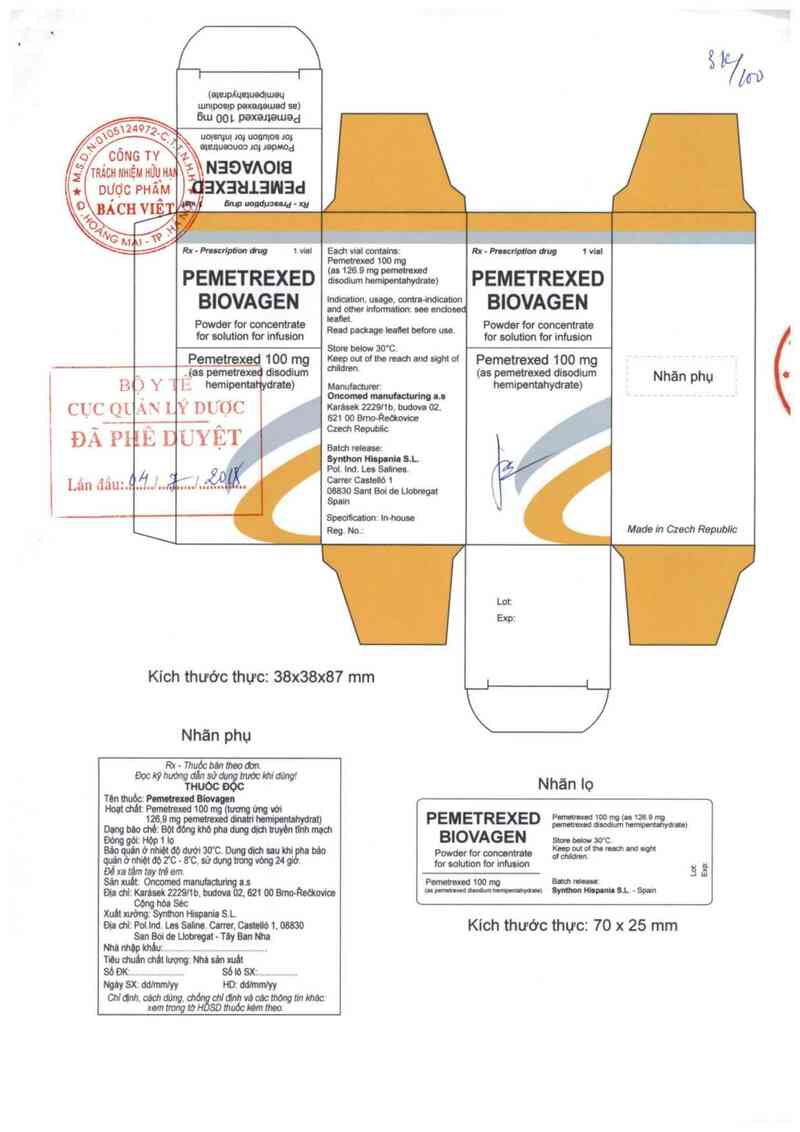






(at…
…MP MM u)
6… om ……d
} NBSVAOIG
xamawaa
1Vhl
PEMETREXED
BIOVAGEN
P…foromcuúrate
for solution forle
CỤC Q1AN LÝ oUợc
( ĐÃ P E DUYỆT
lÍI..I..Ậ ..
Lãn dãuz..…
l BỀ
\
Eodwhlconhhc:
P… 100mg
(n126.9n1oW
disodium Wmhydnơe)
IMiatbn.mage.
nMolherhũo…zm
…
Roodpodugelonlelbdoreuu.
sm…maưc.
Kupoưoftntudundúnhtot
m.
Kích thước thực: 38x38x87 mm
m-nmm 1…
PEMETREXED
BIOVAGEN
PơwdetforconoeMate
fotooủtbnforintusion
Pemetrexed 100 mg
(as pemetrexed disodium
hemìpentahydtate)
`Ỉv
_8Ĩẩ
@
Nhãn phụ
Made in Czeoh Republic
W…
Nhản phụ
966ker mơỂu› mm… !
… …“ổ'ãc “"“ Nhãnlọ
Ề"umtrnmmmo ' …
izs.omwmgẵdủmiẵwyuno PEMETREXED ……wommmm ’
mmat'nocmmmmqmmùmmm °'"““”ffl"
Êẳ'“ffl%…ụu mun … … BIOVAGEN ỀmỂỄ-mmm
m24 Powderformm
ưmơưc ơc sử - d… .
%w… °”… … gg
' WINm m…:
ena-mzzzmn.moz 82166… ……mm» m…n-w
. HspminS.L
ĐilddzPot.lnd. LuSủie Can c…1.omo
s…eamumm ma…m
mmnmh
Tiouenuindmwm: Wsửmút
SỒĐIC ....................... SỒIOSX: .................
Ngays›cudnmvyy mơn…m
Ợĩl ,cảch dnhvủcúc h'nkhảc:
“"" …fẳ'áftfflsomóum m
Kích thước thực: 70 x 25 mm
Rx
PEMETREXED BIOVAG .
THUỐC ĐỌC -, 1
Đề xa tẩm tay trỀ em. * DƯỢC PHA.M f
Đọc kỹ hướng dân sử dụng trước khi dùng ~
Thuỏc nảy chi bản theo đơn thuốc.
micu u…ệu HỮU m `-
TIịÀNH PHÀN
Môi lọ Pegnetrexed Biovagen 100 mg chửa:
Thảnh pháp hoạt chẩt: Pemetrexed dinatri hemipentahydrat 126,9 mg (tương đương 100 mg pemetrexed)
Thảnh phân tá dược: Manitol 105,0 mg, acid hydrocloric, natri hydroxid.
Mỗi lọ Pegnetrexed Ẹiovagen 500 mg chứa:
Thảnh phận hoạt chât: Pemetrexed dinatri hemipentahydrat 604,1 mg (tương đương 500 mg pemetrexed)
Thảnh phân tá duợc: Manitol 500,0 mg, acid hydrocloric, natri hydroxid.
DẠNG BÀO CHẾ ,
Bột đông khô mảư trâng đến hơi vảng.
cni ĐỊNH
U trung biếu mô mảng phổi ảc tính
Pemetrexed kết hợp với cisplatin được chỉ định điều trị cho bệnh nhân có n tnmg biểu mô mảng phổi ác tinh
không thể phẫu thuật cẳt bó chưa từng hóa trị liệu.
Ung thư phổi không tế bâo nhỏ
Pemetrexed kết hợp với cisplatin được chỉ định như liệu phảp đầu ta cho bệnh nhân ưng thư phối không tế
bảo nhỏ tiển triền tại chỗ hoặc đã di căn, không phải Ioại chủ yếu là te bảo hinh vảy theo mô học.
Pemetrexed được chỉ định đơn trị liệu để điều trị duy trì ung thư phổi không tế bảo nhỏ tiến triền tại chỗ hoặc
đã di căn, không phải loại chủ yếu là tế bảo hình vảy theo mô học ở những bệnh nhân không tiến triền ngay
sau khi hóa trị với platin.
Pemetrexed được sử dụng đơn trị liệu cho liệu phảp tha thể đề điểu trị ung thư phồi không tế bảo nhỏ tiến
triến tại chỗ hoặc đã di căn, không phải Ioại chủ yếu là te bảo hinh vảy theo mô học.
LIÊU LƯỢNG VÀ CÁCH DÙNG
Liều lggg:
Pemetrexed chi được sử dụng khi có sự giảm sát y khoa của một bảc sĩ có trình độ trong việc sử dụng hóa trị
liệu chống ung thư.
Pemetrexed kêt hgp với cisplatin
Liều khuyến cảo cùa pemetrexed là 500 mglm2 diện tích bề mặt cơ thể (BSA), truyền tĩnh mạch trong 10
phút vảo ngảy thứ nhat của mỗi chu kỳ điều trị 21 ngảy. Liều khưyến cảo cùa cisplatin là 75 mg/m2 BSA
truyền trong 2 giờ sau khi truyền pemetrexed khoảng 30 phủt vảo ngảy đầu tiên của mỗi chu kỳ 21 ngảy.
Bênh nhân hải đư c điều tr' thuốc chốn nôn để đủ và bù nước thích h trước vả/ho c sau khi sử d n
cisplatin.
Pemetrexed đơn tn“ liệu
Ở bệnh nhân điều trị ưng thư phổi không tế bảo nhô ngay sau khi hỏa trị, liều khuyến cáo cùa pemetrexed lả
500 mấmỉ BSA truyền tĩnh mạch trong vòng 10 phủt vảo ngảy đầu tiên cùa mỗi chu kỳ điều trị 21 ngảy.
ẸhỦJIẢQ
Để giảm tần suất vả mức độ nghiêm ưọng các phản ửng trên da, một corticosteroid nên được sử dụng vảo
một ngảy trước, trong, và ngay sau ngây truyền pemetrexed. Nên uống corticosteroid với liếc tương đương 4
mg dexamethason 2 lầnlngảy. `
Đê giảm độc tính, bệnh nhân được điếu trị bãng pemetrexed cần được bổ sung vitamin. Bệnh nhân phải uống
acid folic hoặc hỗn hợp vitamin chứa acid folic (350 đểu 1000 ụg) hảng ngảy. It nhât 5 liêu acid folic phải
được uống trong 7 ngảy trước liếu đầu tiên của pemetrexed, và phải được tiep tục trong suốt quá trinh điêu
trị 21 ngảy vả 21 ngảy sau liếu pemetrexed cuối cùng. Bệnh nhân cũng phải được tiêm băp vitamin Ba (1000
pg) vảo tuần trước khi sử dụng liếu pemetrexed đẫu tiên và mỗi 3 chu kỳ tiếp theo. Cảc liếu Vitamin B12 tiêp
theo có thế được tiêm vảo cùng ngảy với pemetrexed.
Theo dõi `
Bệnh nhân điều trị với pemetrexed nên được theo dõi trước mỗi liêu với một xét nghiệm công thức mảư toân
phần, bao gồm số lượng các loại bạch cầu (WCG) và số lượng tiếu câu. Trước môi lân hóa trị, xét nghiệm
Page 1 of 16
sinh hóa mảư nên được tiển hảnh đế đảnh giá chức nãng gan và thận. Trước khi bắt đầu một chu kỳ hóa trị,
bệnh nhân cần đạt được các thông số sau: bạch cầu đa nhân trung tính (ANC) 2 1.500 tế bảo/mm3 và tiểu cầu
2 100.000 tế bảo/mmồ.
Độ thanh thải creatinin 2 45 ml/phủt.
Bilirubin toản phần 5 1,5 lần giới hạn trên cùa mức bình thường. Phosphatase kiềm (AP), aspartat
aminotransferase (AST hoặc SGOT) vả alanin aminotransferase (ALT hoặc SGPT) S 3 lần giới hạn trên cùa
mức bình thường. Phosphatase kiêm, AST vả ALT S 5 lần giới hạn trên của mức bình thường có thể được
chấp nhận nếu gan có khối u.
Điệu chinh liếu
Điếu chinh liêu khi bắt đầu của chu ` tỉếp theo nên được dựa trên kết guả xét nghiệm công thức mảư thẩp
nhât hoặc độc tính không liên quan đen huyết học lởn nhẩt từ chu kỳ đieu trị trước. Điều trị có thể được trì
hoãn đế bệnh nhân có đủ thời gian hổi phục. Sau khi phục hổi, bệnh nhân nên được tái điều trị sử dụng
hướng dẫn điếu trị ở bảng 1, 2 và 3, ảp dụng cho pemetrexed sử dụng đơn độc hoặc kết hợp với cisplatin.
Bâng 1 - Bãng điều chinh liều cho pemetrexed (sử dụng đơn độc hoặc kết hợp) và cisplatin - Độc tính huyết
học
ANC thẫp nhất < 500/mm3 và số lượng tiểu cầu
I 0 . À 6 : . - \ . .
thâp nhất 2 50.000/mm3 75 A hen dung tnrơc cua (ca pemetrexed va c1splatm)
Số lượng tiến cầu thẩp nhẩt < 50.000/mm3 bất kể
ANC 75% liếu dùng trước của (cả pemetrexed vả cỉsplatin)
Số lượng tiền cầu thấp nhất < 50.000Jmm3 và có
’ ' v 0 . 1 t : o . ` . .
xuât huyết“, bât kê ANC 50/o lieu dung tmơc cua (ca pemetrexed va ctsplatm)
X
' Tiêu chuẩn nảy phù hợp với đinh nghĩa xuat huyết 2 mức độ CTC — 2 trong tiêu chuẩn độc tính chung cùa
Viện Ung thư Quoc Gia (CTC v2.0; NC] 1998).
Nếu bệnh nhân xuất hiện độc tính không liên quan tởi hụyết học 2 mức độ 3 (tn`r độc tinh thần kinh),
pemetrexed nên được tạm dùng đến khi có giải phảp đưa vê rnức độc tính thấp hon hơn hoặc tương đương
với giá trị trước khi điểu trị cùa bệnh nhân. Điêu trị nên được tiêp tục theo hướng dân trong bảng 2.
Bảng 2 — Điều chỉnh liều cho pemetrexed (sử dụng đơn đ'c hoặc phối hợp) vã cisplatin — Độc tính không
liên quan tới huyet học" "
' Liều pemetrexed (mẺf) Liều cisplatinẸgl_mồ
BĨ“ k.y. đỌ°.Ĩ'"h mưc đọ 3 "… 4 75% liều dùng trước 75% liều dùng trước
trư v1em mem mạc
Tiêu chảy bẫt kỳ cần nhập viện
(bất cứ mức độ nảo) hoặc tiêu 75% lỉều dùng trưởc 75% liều dùng trước
chảy mức độ 3 hoặc 4
Viêm niêm mạc mửc độ 3 hoặc 4 50% liều dùng trước 100% liều dùng trước
3Tiêu chuẩn độc tính chung của Viện Ung thư Quốc gia (CTC v2.0; NC! 1998)
" Ngoại trừ độc tính thẫn kinh
Trong trường hợp xuất hiện độc tính thần kinh, điểu chinh liều khuyến cảo của pemetrexed vả cisplatin được
Ă
trình bây trong Bảng 3. Nên ngịmg đieu trị nếu bệnh nhân xuất hiện độc tính thần kinh bậc 3 hoặc 4.
Bâng 2 — Bâng điều chinh liền cho pemetrexed (sử dụng đơn độc hoặc phối hợp) và cisplatin - Độc tính
thần kinh
Bậc CTC' Liều pemetrexed (nịg/in2) Liều cisplatin (ugịmz)
o — 1 100% liều dùng trước 100% liều dùng trước
2 100% liều dùng trước 50% liều dùng trước
' Tiêu chuẩn độc tính chung theo Viện Ung thư Quốc Gia (CTC v2.0; NCI 1998)
Dừng điều trị với pemetrexed nếu bệnh nhân gặp phải bất cứ độc tinh liên quan hoặc không liên quan tới
huyết học bậc 3 hoặc 4 sau 2 lẫn giảm liếu hoặc ngay lập tức nếu độc tính thần kinh bậc 3 hoặc 4 xuất hiện.
Người cao tuốt“: '
Các nghiên cứu lâm sảng không chỉ ra rằng bệnh nhân trên 65 tuổi hoặc nhiều tuôi hơn có nguy cơ cao gặp
tảc dụng không mong muốn so với bệnh nhân dưới 65 tuồi. Không cần thiết phải giảm liều ở nhóm bệnh
nhân nảy.
Trẻ em:
Pemetrexed không sử dụng trên trẻ em trong điều trị 11 trung biếu mô mảng phổi ảc tính và ung thư phối
không tế bảo nhò.
Suy thận `
(Đảnh giá dựa vảo công thửc Cockroft — Gault tiêu chuẩn hoặc mức độ lọc câu thận thông qua theo dõi độ
thanh thải Tc99m-DPTA huyết thanh): Pemetrexed bị thải trừ chủ yếu dưới dạng không đôi qua thận. Trong
Page 2 of 16
các nghiên cứu lâm sảng, bệnh nhân có độ thanh thải creatinin Z 45 mVphủt không cần hiệu chính liều.
Không có đây đủ dữ liệu vê việc sử dụng pemetrexed ở bệnh nhân có độ thanh thải creatinin dưới 45
mVphủt; vì vậy việc sử dụng pemetrexed không được khuyến cảo.
Suy gan '
Không có môi liên quan giữa nồng độ AST (SGOT), ALT (SGPT), hoặc bilirubin toản phần với dược động
học của pemetrexed. Tuy nhiên, việc sử dụng pemetrexed những bệnh nhân suy gan có nổng độ bilirubin >
1,5 lần giởi hạn tten bình thường vâ/ hoặc aminotransferase › 3,0 lần giới hạn trên bình thường (không có u
ở gan) hoặc > 5 lân giới hạn trên binh thường (có khối u ở gan) chưa được nghiên cứu cụ thề.
Cảch dùng
Những chủ ý trước khi hoản nguyên hoặc sử dụng pemetrexed,
Pemetrexed nên được truyền tĩnh mạch trong vòng 10 phủt vảo ngảy đầu tiên của mỗi chu kỳ 21 ngảy.
Hướng dân hoản nguyên và pha loãng pemetrexed trước khi sử dụng. Sau khi hoản nguyên sẽ thu được dung
dịch trong suốt và cỏ mảư tử không mèu tới vâng hoặc vảng xanh.
Cách hoãn nguyên:
1. Sử dụng kỹ thuật vô trùng trong quả trinh hoản nguyên pemetrexed và pha Ioãng tiếp theo để sử dụng
đường truyền tĩnh mạch.
2.Tính toán liều và số lọ pemetrexed cần thiết.
3. Hoản nguyên lọ 100 mg trong 4,2 ml dung dịch natri clorid 9 mng (0,9%) dùng pha tiêm, không có chất
' )
bảo quản, thu được dung dịch pemetrexed co nong độ 25 mglml. Lắc nhẹ đến khi bột tan hoản toản. Dung
dịch thu được trong suốt và có mảư từ không mảư tởi vảng hoặc vảng xanh. Giá trị pH của dung dịch sau khi
hoản nguyên từ 6,6 đến 7,8. Dung dịch cần tiếp tục pha loãng.
Hoản nguyên lọ 500 mg trong 20 ml dưng dịch natri clorid 9 mglml (0,9%) dùng pha tiêm, không có chất
bảo quản, thu được dung dịch pemetrexed có nồng độ 25 mg/ml. Lắc nhẹ đển khi bột tan hoản toản. Dung
dịch thu được trong suốt, có mảư từ không mảư tới vảng hoặc vảng xanh. Giá trị pH của dung dịch sau khi
hoản nguyên từ 6,6 đển 7,8. Dung địch cần tiếp tục pha loãng. ,
4. Thể tích thích hợp cùa dung dịch pemetrexed sau khi hoản nguyên cần được pha Ioãng đên 100 ml với
dung dịch natri clorid pha tiêm 9 mglml (0,9%) không có chất bảo quản, và truyền tĩnh mạch trong vòng 10
phủt
5. Dung dịch truyền pemetrexed được chuẩn bị như hướng dẫn trên phù hợp với bộ ống và tủi truyền
polyvinyl clorid vả polyolefin.
6. Sản phầm sử dụng đường tĩnh mạch cần được kiềm tra bằng cảm quan để phảt hiện tiếu phân và sự biến
mảư trước khi sử dụng. Nếu xuất hiện tiền phân thì không được sử dụng.
7. Dung dịch pemetrexed chỉ dùng một lần. Phần không dùng hoặc vật liệu thải phải được vứt bỏ theo yêu
cầu của địa phương.
Chú ý khi chuẩn bị và sử dụng: Như cảc thuốc chống ung thư có khả nãng gây độc khảc, cẩn cẩn thận khi
vận chuyển và chuẩn bị dung dịch truyền pcmetrexeđ. Khuyến cảo sử dụng gãng tay. Nếu dung dịch
pemetrexed tìếp xúc vởi đa, rừa ngay lập tức và hoản toản với nước và xả phòng. Nếu dung dịch pemetrexed
tiếp xúc với niêm mạc, rửa kỳ với nước. Pemetrexed không gây rộp da. Không có thưốc giải độc trong
trường hợp pemetrexed bị thoát mạch. Có một số ít ca pemetrexed bị thoảt mạch được bảo cảo nhưng không
được đảnh giả ở mức độ nghiêm trọng bởi cảc nhà nghiên cứu. Sự ri ra nên được kiêm soát theo tiêu chuẩn
thực hảnh địa phương như những thuốc không gây rộp da khác.
cụoNc cni ĐỊNH _ /
Mân cảm với hoạt chất hoặc bât kỳ tá dược nảo cùa thuốc.
Phụ nữ đang cho con bú.
Sử dụng đồng thời với vacin bệnh sốt vảng.
CÁNH BÁO VÀ THẬN TRỌNG
Pemetrexed có thế ức chế chức năng tùy xương, biểu hiện như giảm bạch cầu, giảm tiếu cầu vả thiểu mảư
(hoặc giảm ba dòng tế bảo mảư ngoại vi). Suy tùy thường là độc tính xgiới hạn liểư. Bệnh nhân nên được theo
dõi suy tủy trong khi điêu trị và nên ngừng pemetrexed cho đến khi so lượng bạch cầu trung tính (ANC) tãng
2 1.500 tê bảo/mm² vả số lượng tiều cầu 2 100.000 tế bảo/mm’. Giảm liêu 6 các chu kỳ tiếp theo dựa vảo
ANC thấp nhất, số lượng tiểu cau và độc tính tối đa không liên quan tới huyết học ghi nhận được ở cảc chu
kỳ trước.
Bổ sung acid folic vả vitamin Biz trước khi điều trị giúp giảm tần suất gặp và mức độ nghiêm trọng cùa độc
tính huyết học không liên quan đến huyết học mức độ 3/4 như giâm bạch cầu đa nhân trung tính, sốt rẻt giảm
Page 3 01`16
If:btơ
bạch cầu đa nhân trung tính vả nhiễm trùng có triệu chứng giảm bạch cầu đa nhân trung tính mức đó 3/4. Vì
vậy, tất cả bệnh nhân điêu trị với pemetrexed phải được hướng dẫn dự phòng bằng acid folic vả vitamin Biz
để giảm độc tính khi điều trị.
Cặc phản ứng da được báo cáo ở những bệnh nhân khôn sử dụng corticoid trước khi điều tri. Dự phòng
ẵăng dexamethason (hoặc tương đương) có thẻ lâm giảm tan suất và mức độ nghiêm trọng của cảc phản ứng
a.
Chỉ một số lượng nhỏ bệnh nhân có độ thanh thải creatinin dưới 45 ml/phủt được được nghiên cửu. Vì vậy,
sử dụng pemetrexed ở những bệnh nhân có độ thanh thải creatinin < 45 mVphủt không được khuyến cáo.
Bệnh nhân suy thận nhẹ đến trung binh (độ thanh thải creatinin từ 45 đến 79 ml/phủt) nên trảnh sử dụng cảc
thuốc chống viêm không steroid (NSAID) như ibuprofen, vả aspirin (> 1,3g hâng ngảy) 2 ngảy trước, trong,
và 2 ngảy sau truyền pemetrexed. Bệnh nhân suy thận nhẹ đển trung bình điều trị với pemetrexed: nên tạm
dừng sử dụng NSAID có thời gian bản thải dải ít nhất 5 ngảy trước, trong và it nhất 2 ngảy sau khi tmyền
pemetrexed.
Những biến chứng nghiêm trọng trên thận, bao gồm suy thận cấp, đã được bảo cáo khi điều trị pemetrexed
đơn độc hoặc phôi hợp với cảc thuốc hóa trị liệu khác. Nhiếu bệnh nhân trong số nảy đã có những yếu tố
nguy cơ tiến triền cảc tai biến trên thận như mất nước, cao huyết áp hoặc tiến đường.
Anh hưởng tạo thảnh khoang dịch thứ 3 như trản dịch mảng phối hoặc cố chướng khi sử dụng pemetrexed
chưa được xảc định. Một nghiên cứu pha 2 của pemetrexed trên 31 bệnh nhân ung thư có khối u rắn có
khoang dịch thứ 3 ốn định cho thấy không có sự khác biệt về nổng độ thuốc trong huyết tương hoặc độ thanh
thải của pemetrexed so với bệnh nhân không có khoang dịch thứ 3. Vì vặy, việc rủt bớt dịch ở khoang thứ 3
trước khi điếu trị với pemetrexed nên được cân nhắc, nhưng có thể là không cần thiểt.
Do độc tính trên đường tiêu hóa của pemetrexed khi sử dụng kết hợp với cisplatin như mất nước nghiếm
trọng đã được ghi nhận. Vì vậy bệnh nhân cần được điều trị thuốc chống nôn đầy đủ vả bù nước thích hợp
trước vải hoặc sau khi điếu trị.
Cảc biến chứng tim mạch nghiêm trọng bao gồm nhồi mảư cơ tim và tai bỉến mạch não ít khi xảy ra trong
các nghiên cứu lâm sảng với pemetrexed, thường gặp khi kết hợp với một thuốc gây độc tế bảo khác. nè…
hết lá các bệnh nhân đều có sẵn các yếu to nguy cơ tim mạch.
Tinh trạng suy giảm miễn dịch thường xuất hiện ở bệnh nhân ung thư. Vì vậy, không khuyến cáo sử dụng
đồng thời với cảc vẳc xin sống gỉâm độc lực.
Cảo trường hợp viêm phổi do xạ trị được bảo cáo 6 những bệnh nhân xạ trị trước, trong hoặc sau khi điều trị
với pemetrexed. Cấn đặc biệt chủ ý đến cảc bệnh nhân nảy và thận trọng khi phối hợp với cảc thuốc nhạy
cảm với phỏng xạ khác.
Cảc trường hợp phản ứng trên da nghiêm trọng do xạ trị được ghi nhận ở những bệnh nhân xạ trị những tuần
hoặc những năm trước đó.
Lọ 100mg: Sản phấm nảy chứa ít hơn 1 mmoi natri (23 mg) mỗi lọ, nghĩa là về cơ bản "không có natri".
Lọ 500mg: Sản phầm nảy có chứa khoảng S4mg natri mỗi lọ. Cần cân nhắc ở những bệnh nhân đang tuân
thủ chế độ ăn kiêng giảm natri.
sử DỤNG THUỐC cno PHỤ NỮ có THAI VÀ CHO CON BÚ
Tránh thai ở nam và nữ
Phụ nữ có khả năng mang thai cần sử dụng phương phảp tránh thai hiệu quả khi điều trị với pemetrexed.
Pemetrexed gây ảnh hưởng tới đi truyền. Nam giới trong độ tuối sinh sản không nên có con trong quá trình
điểu tri và 6 thảng sau đó. Các phương phảp tránh thai hoặc kiêng giao hợp được khuyến cảo.
Mang thai
Không có thông tin về điều trị pemetrexed ở phụ nữ mang thai nhưng pemetrexed bị nghi ngờ có khả nãng
gây ra quải thai nghiêm trọng khi sử dụng ở phụ nữ mang thai tương tự cảc thuốc khảng chuyền hóa khảc.
Nghiên cứu trên động vật cho thấy có độc tính trên quá trình sinh sản. Pemetrexed không nên được sử dụng
trong khi mang thai trừ khi thật sự cần thiết, sau quá trình cân nhắc kỹ lưỡng về nhu cầu của người mẹ vả
nguy cơ đến thai nhi.
Cho con bú
Không rõ pemetrexed có bảì tiết vâo sữa mẹ hay không cũng như không loại trừ tảc dụng phụ có thể xây ra ở
trẻ bú mẹ. Cần dùng cho trẻ bú khi sử dụng liệu phảp pemetrexed.
Khả năng sinh sản
Pemetrexed gây ảnh hưởng tới di truyền. Nam giới trong độ tuổi sinh sản không nên có con trong quá trình
điểu trị và 6 thảng sau đó. Cảc phương pháp tránh thai hoặc kiêng giao hợp được khuyến cảo. Do điều trị
bằng pemetrexed có khả năng gây vô sinh không hồi phục, nam giởi cân được tư vân bảo quản tinh trùng
trước khi tiển hảnh điều trị.
Page 4 of 16
.g..
ẨNHHƯỞNG TRÊN KHẶNĂNG LÁIXE VÀ VẶN HÀNH MÁY MÓC
Không có nghiên cứu nâo vế tảc dụng cùa thuốc đến khả năng lải xe và vận hảnh mảy móc được tiến hảnh
Tuy nhiên, pemetrexed được ghi nhận là có thể gây mệt mỏi. Vì vậy, bệnh nhân cân thận trọng khi lái xe
hoặc vận hảnh mảy móc nểu triệu chứng xuất hiện.
TƯỢNG TÁC, TƯỜNG KY CỦA THUỐC
Tương tác
Pemetrexed chủ yểu bị thải trừ dưới dạng không đối qua thận bởi bải tiết ở ống thận và một phần ít hơn
thông qua lọc cầu thận. Việc sử dụng đổng thời các thuốc gây độc thận (như aminoglycosid, thuốc lợi tiều
quai, hợp chất platin, cyclosporin) có thể dẫn tới việc chặm thải trừ pemetrexed. Cần thận trọng khi phối hợp
các thuốc nảy với pemetrexedì Theo dõi chặt chẽ độ thanh thải creatinin nếu cân thiết.
Sử dựng đồng thời với các chất cũng được bải tiết qua ống thận (như probenecid, penicillin) cũng có thể dẫn
tới chậm thải trừ pemetrexed. Cần thận trọng khi phối hợp các thuốc nảy với pemetrexed. Theo dõi chặt chẽ
độ thanh thải creatinin nếu cần thiết
Ở bệnh nhân có chức nãng thận bình thường (độ thanh thải creatinin_ > 80 mVphủt), liều cao các thuốc chống
viêm không steroid (NSAID, như ibuprofen > 1.600 mg/ngảy) vả aspirin liều cao (> 1,3 glngảy) có thề lảm
giảm thải trừ pemetrexed, dẫn tới tảng nguy cơ gặp tác dụng không mong muốn Vì vậy, cân thận trọng khi
sử dựng cảc NSAID vả aspirin liều cao ở bệnh nhân có chức năng thận binh thường (độ thanh thải creatinin_ >
80m1/phút) đang điếu trị pemetrexed.
Ở bệnh nhân suy thận nhẹ đến trung binh (độ thanh thải creatinin từ 45 đến 79 ml/phút), nên trảnh sử dụng
pemetrexed đồng thời với cảc NSAID (như ibuprofen) hoặc aspirin liều cao 2 ngảy trưởo, trong, và 2 ngảy
sau ngảy truyền pemetrexed.
Do thiếu dữ liệu liên quan tới khả năng tương tảc với cảc NSAID có thời gian bán thải dải như piroxicam
hoặc rofecoxib, nên dừng sử dụng đồng thời với pemetrexed ở bệnh nhân suy thận nhẹ đến trung bình ít nhất
5 ngảy trước, trong, và 2 ngảy sau ngảy truyền pemetrexed. Nếu cần thiết phải kết hợp với cảc NSAID, bệnh
nhân nên được theo dõi chặt chẽ độc tính, đặc biệt là suy tùy và độc tính trên đường tiêu hóa.
Pemetrexed it bị chuyến hóa ở gan. Kết quả từ các nghiên cửu in vitro trên cảc microsom gan ở người cho
thấy pemetrexed ức chế không đảng kế quá trình chuyển hỏa, thải trừ cùa cảc thuốc chưyền hóa qua CYP3A
CYP2D6, CYP2C9, vả CYPIA2 trên lâm sảng.
Tương tảo hay gặp vởi tất cả cảc thuốc độc tế bâo:
Do sự gia tãng nguy cơ huyết khối ở bệnh nhân ung thư, các thuốc chống đông máu thường được sử dụng.
Do tinh trạng đông máu giữa cảc cá thể khảc nhau nhiều và khả nãng xảy ra tương tảc giữa cảc thuốc chống
đông mảư đường uống và thuốc hỏa trị chống ung thư, đòi hỏi tăng tan suất theo dõi INR (lntemational
Normalised Ratio — Chỉ số binh thường hóa quốc tế) nếu như bệnh nhân được chỉ định thuốc chống đông
đường uống.
Chống chỉ định sử dụng đồng thời với vắc xin bệnh sốt vảng: có nguy cơ gây tử vong.
Không khuyến cảo sử dụng đồng thời với vắc xin sống giảm độc lực (ngoại trừ bệnh sốt vảng, chống chỉ
định); do nguy cơ gặp các bệnh toản thân, có thể tử vong. Tăng nguy cơ với những bệnh nhân đã bị suy giảm
miên dịch bởi các bệnh tiếm ần. Sử dựng vắc xin bẩt hoạt nếu có (bệnh bại liệt)
Tương kỵ=
Pemetrexed tương kỵ vật lý với cảc chẩt pha loãng chứa calci, bao gổm dung dịch tiêm Ringer Iactat vả
Ringer. Do không có nghiên cứu tương kỵ khác, sản phẩm thuốc nảy không được trộn lẫn với các sản phẩm
dược phẩm khác.
TÁC DỤNG KHÔNG MONG MUỐN ` /
Tóm tắt về hồ sơ an toản
Cảc tảc dụng không mong muốn được bảo cảo nhiều nhất liên quan tới pemetrexed khi sử dụng đơn độc hay
phối hợp lả' ưc chế tủy xương, biểu hiện như thiếu máu, giảm bạch cầu trung tính, giảm bạch câu, giảm tiêu
cầu; độc tính tiêu hóa, biểu hiện thông qua triệu chứng chản ăn, buồn nôn, nôn, tiêu chảy, táo bón, viêm
họng, viêm niêm mạc, và viêm miệng. Cảc tác dụng không mong muốn khác bao gồm độc tính trên thận,
tăng enzym aminotransferase, rụng tỏc, mệt mòi, mất nước, phảt ban, nhiễm khuẩnl nhiễm trùng huyết, bệnh
thần kinh. Các biến chứng hiếm gặp là hội chứng Stevens— Johnson và hoại từ thượng bi nhiễm độc.
Bảng danh sách cảc tảc dgng không mong muốn
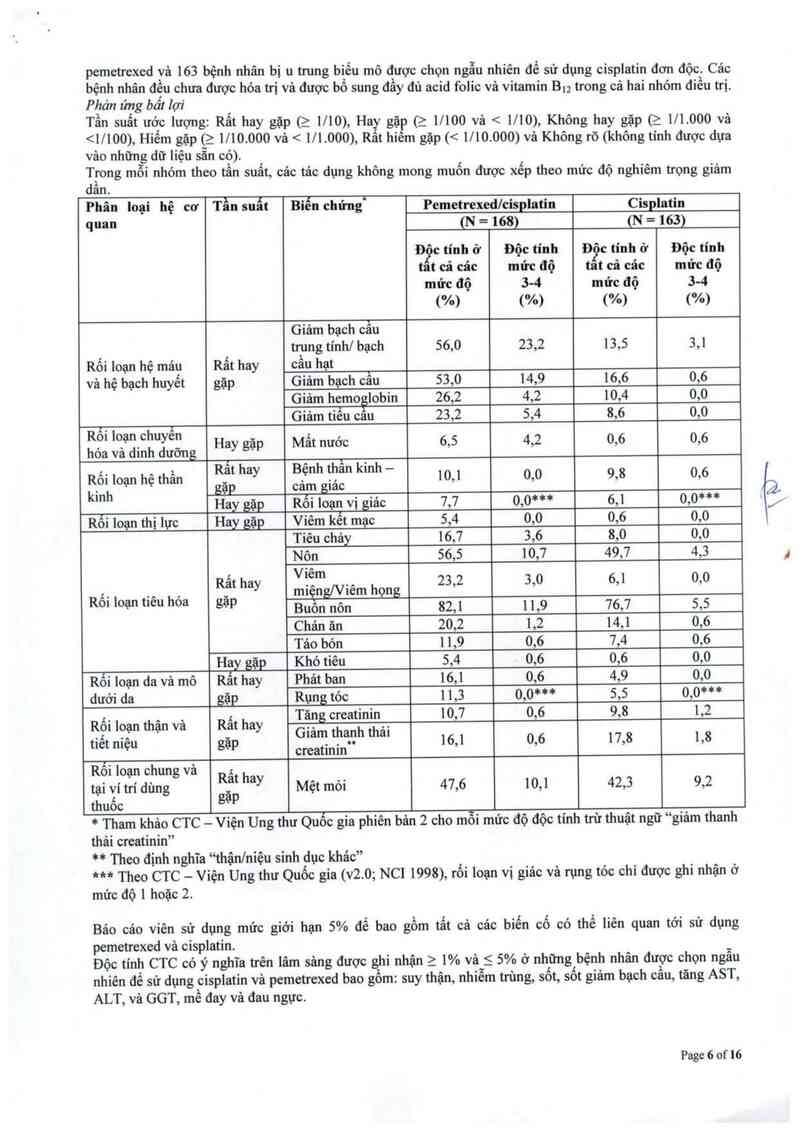
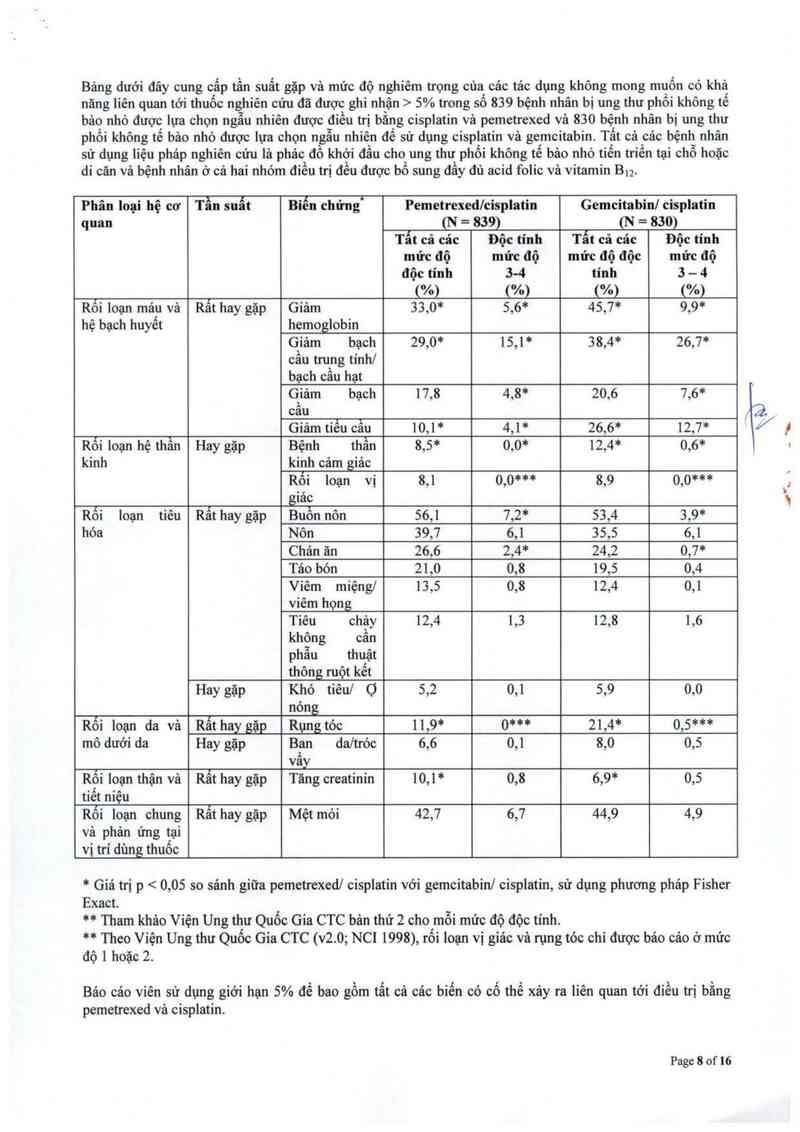
Bảng dưới đây cung cấp tần suất vả mức độ nghiêm trọng của các tảc dụng không mong muốn được ghi
nhận ở > 5% trong 168 bệnh nhân bị 11 trung biểu mô được chọn ngâu nhiên để sử dụng cisplatin vả
Page 5 of 16
`I\O
pemetrexed và 163 bệnh nhân bị 11 trung biếu mô được chọn ngẫu nhiên để sử dụng cisplatin đơn độc. Các
bệnh nhân đệu chưa được hóa trị và được bổ sung đầy đủ acid folic vả vitamin 13.2 trong cả hai nhóm điều trị.
Phán ứng bát lợi
Tân suất ước lượng: Rất hay gặp (2 1710), Ha gặp (2 11100 vả < 1710), Không hay gặp (2 1/1.000 vả
<1/100), Hiếm gặp (_z 1/ 10.000 và < 1/1.000), Rat hiêm gặp (< 1/ 10.000) và Không rõ (không tinh được dựa
vảo những dữ liệu săn có). '
ẫ`Ịong mỗi nhóm theo tần suât, các tảo dụng không mong muốn được xếp theo mức độ nghiêm trọng giảm
an.
Phân loại hệ cơ Tẫn suất Biến chứng“ Pemetrexedlcisplatỉn Cisplatin
quan (N = 168) (N = 163)
Độc tính ở Độc tính Đ“c tính ở Độc tính
tat cả các mức độ tat cả các mức độ
mức độ 34 mức độ 3-4
(%) (%) (%) (%)
Giám bạch cầu
trung tinh] bạch 56,0 23,2 13,5 3,1
Rối loạn hệ mảư Rất hay cẩu hạt
và hệ bạch huyết gặp Giảm bạch cầu 53,0 14,9 16,6 0,6
Giảm hemo lobin 26,2 4,2 10,4 0,0
1 Giảm tiều cau 23,2 5,4 8,6 0,0
Ệẵả LỆạẵiẵầuấễẵng Hay gặp Mất nước 6,5 4,2 0,6 0,6
Ă … X .
Rối loạn hệ thần RẺ“ hay B.ẹnh Ể“" k'"h " 10,1 0,0 9,8 0,6
kinh —Lạp °“,"f g'ac . .
Hffl R01 loạn vi ỉảc 7,7 0,0*** 6,1 0,0***
Roi loạn thị lực Hay gặp Viêm kết mạc 5,4 0,0 0,6 0,0
Tiêu chảy 16,7 3,6 8,0 0,0
Nôn 56,5 10,7 49,7 4,3
L Viêm
Rối ioạn tiêu hóa lgìặatt› hay miệnglViẽm họng 2332 3’0 6’1 050
Buon nôn 82,1 11,9 76,7 5,5
Chản ãn 20,2 1,2 14,1 0,6
Táo bón ] 1,9 0,6 7,4 0,6
Hay gặp Khó tiêu 5,4 0,6 0,6 0,0
Rối Ioạn da và mô Rất hay Phát ban 16,1 0,6 4,9 0,0
dưới da gặp Rụng tóc 1 1,3 0,0""""' 5,5 0,0***
Rối loạn thận và Rấ t hay Tặng creatintilrìip 10,7 0,6 9,8 1,2
tiết niệu gặp G'a'“. tỂ'ẳ'ầh a' 16,1 0,6 17,8 1,8
creatinin
Rối loạn chưng vả Rất h
tại vi tri dùng “y Mệt mới 47,6 10,1 42,3 9,2
thuốc gặp
* Tham khảo CTC — Viện Ung thư Quốc gia phiên bản 2 cho mỗi mức độ độc tính trừ thuật ngữ “giảm thanh
thải creatinin”
** Theo định nghĩa “thận/niệu sinh dục khảc”
*** Theo CTC — Viện Ung thư Quốc gia (v2.0; NCI 1998), rối loạn vị giác vả rựng tóc chi được ghi nhận ở
mức độ 1 hoặc 2.
Báo cảo viên sử dựng mức giới hạn 5% để bao gồm tất cả các biến cố có thể liên quan tới sử dựng
pemetrexed vả cisplatin.
Độc tính CTC có ý nghĩa trên lâm sảng được ghi nhận z 1
nhiên để sử dụng cisplatin vả pemetrexed bao gom: sưy
)1
ALT, vả GGT, mề đay vả đau ngực.
% và S 5% ở những bệnh nhân được chọn ngẫu
thận, nhiễm trùng, sốt, sốt giảm bạch cầu, tăng AST,
Page 6 of 16
Độc tính CTC có có ý nghĩa trên lâm sảng được ghi nhận < 1% bệnh nhân được lựa chọn ngẫu nhỉên để sử
dụng c1splatin vả pemetrexed bao gồm loạn nhịp tim và bệnh thân kinh vận động.
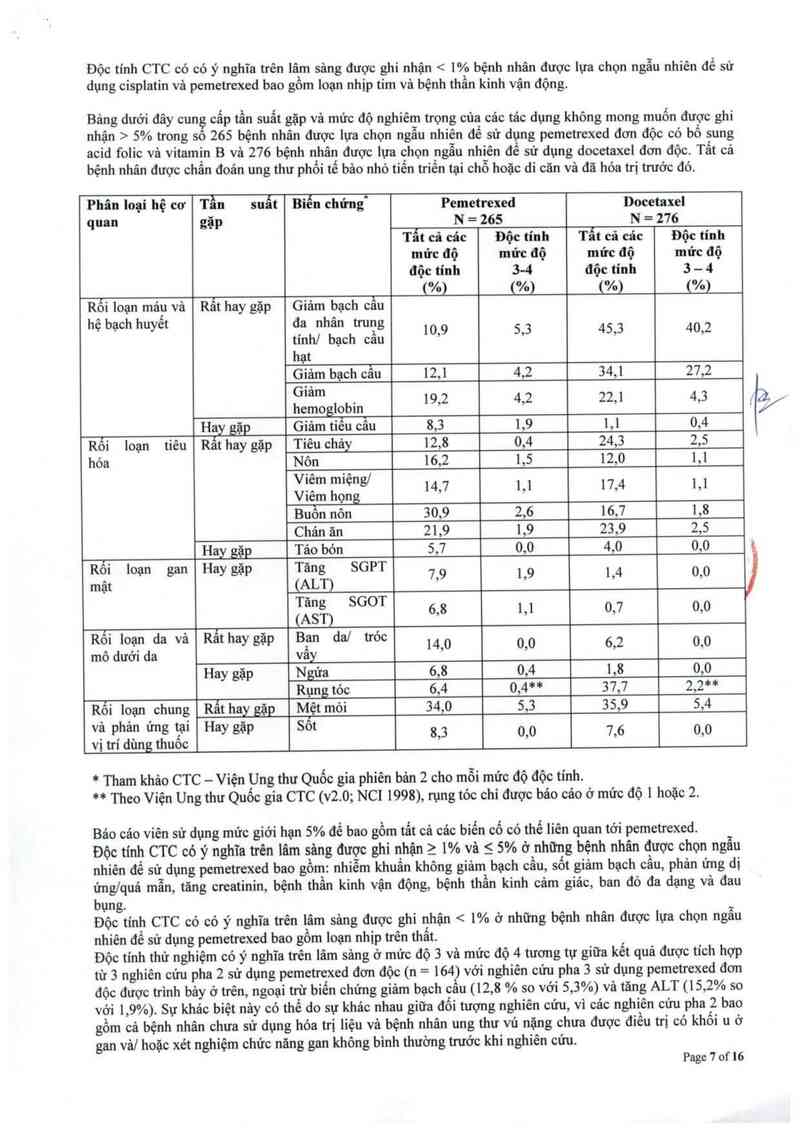
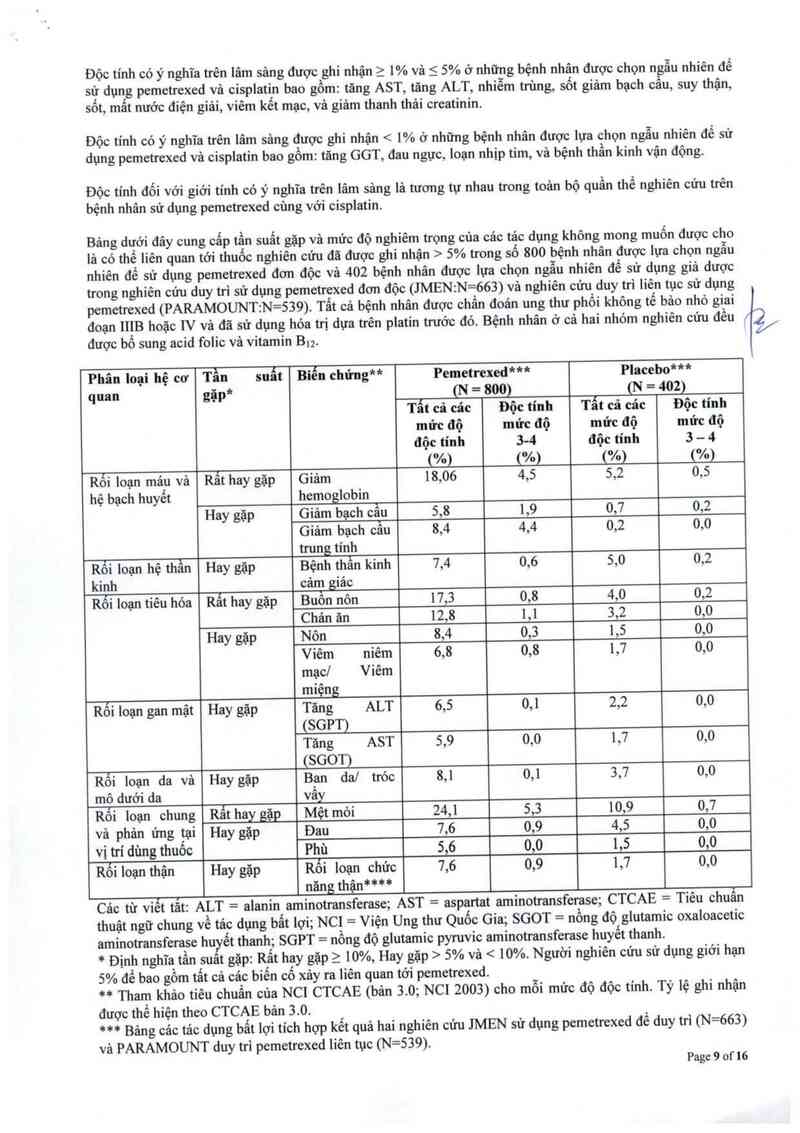
Bảng dưới đây cung cấp tần suất gặp và mức độ nghiêm trọng cùa các tảc dụng không mong muốn được ghi
nhận > 5% trong sô 265 bệnh nhân được lựa chọn ngẫu nhiên để sử dụng pemetrexed đơn độc có bổ sung
acid folic vả vitamin B và 276 bệnh nhân được lựa chọn ngẫu nhiên để sử dụng docetaxel đơn độc. Tất cả
bệnh nhân được chẩn đoản ung thư phổi tế bảo nhỏ tiến triền tại chỗ hoặc di căn và đã hóa trị trước đ6.
Phân Ioại hệ cơ Tần suất Biến chứng“ Pemetrexed Docetaxel
quan gặp N = 265 N = 276
Tất cả các Độc tính Tất cả cảc Độc tính
mức độ mửc độ mửc độ mức độ
độc tính 34 độc tính 3 - 4
, (%) (%) (%) (%)
Rôi loạn mảp vả Rất hay gặp Giảm bạch cẩu
hẹ bạc" huyet ỄỀJhỂỊChỪỀ'ẵỄ 10,9 5,3 45,3 40,2
hạt
Giảm bạch cẫu 12,1 4,2 34,1 27,2
Ệ'²m . 19,2 4,2 22,1 4,3
emogiobm
Hay gặị Giảm tiểu cầu 8,3 1,9 1,1 0,4
Rối loạn tiêu Rất hay gặp Tiêu chây 12,8 0,4 24,3 2,5
hóa Nôn 16,2 1,5 12,0 1,1
ỊÌỀm m'ẹ“gl 14,7 1,1 17,4 1,1
iem họng
Buồn nôn 30,9 2,6 16,7 1,8
Chán ăn 21,9 1,9 23,9 2,5
Hay gặp Táo bón 5,7 0,0 4,0 0,0
Roi Ioạn gan Hay gặp Tăng SGPT
mật (ALT) 7,9 1,9 1,4 0,0
Tăng SGOT
(AST) 6,8 1,1 0,7 0,0
Rếi IoIạn da và Rất hay gặp Bịan dal tróc 14’0 0’0 6,2 0’0
mo dươi da vay
Hay gặp Ngứa 6,8 0,4 1,8 0,0
Rụng tỏc 6,4 0,4** 37,7 2,2**
Rối loạn chung Rẫt hay go Mệt mới 34,0 5,3 35,9 5,4
và phản ứng tại Hay gặp Sốt 8 3 0 0 7 6 0 0
vị trí dùng thuốc ’ ’ ’ ’
* Tham khảo CTC — Viện Ung thư Quốc gia phiên bản 2 cho mỗi mức độ độc tính.
** Theo Viện Ung thư Quốc gia CTC (v2.0; NCI 1998), rụng tỏc chi được bảo cáo ở mức độ 1 hoặc 2.
Bảo cảo viên sử dụng mức giới hạn 5% để bao gồm tất cả cảc biến cố có thể liên quan tới pemetrexed.
Độc tinh CTC có ý nghĩa trên lâm sùng được ghi nhận 2 1% và S 5% ở những bệnh nhân được chọn ngẫu
nhiên để sử dụng pcmetrexed bao gồm: nhiễm khuẩn không giảm bạch cầu, sốt giảm bạch cầu, phản ửng dị
ứnglquả mẫn, tãng creatinin, bệnh thần kinh vận động, bệnh thần kinh cảm giác, ban đó đa dạng và đau
bụng.
Độc tính CTC có có ý nghĩa trên lâm sảng được ghi nhận < 1% ở những bệnh nhân được lựa chọn ngẫu
nhiên để sử dựng pemetrexed bao gồm Ioạn nhip trên thất.
Độc tinh thử nghiệm có ý nghĩa trên lâm sâng ở mức độ 3 và mức độ 4 tương tự giữa kết quả được tích hợp
từ 3 nghiên cứu pha 2 sử dụng pemetrexed đơn độc (n = 164) vởi nghiên cứu pha 3 sử dụng pemetrexed đơn
độc được trình bảy ở trên, ngoại trừ biến chứng giảm bạch cầu (12,8 % so với 5,3%) và tãng ALT (15,2% so
với 1,9%). Sự khảo biệt nảy có thế do sự khảc nhau giữa đối tượng nghíên cứu, vì các nghiên cứu pha 2 bao
gổm cả bệnh nhân chưa sử dụng hóa trị 1iệu vả bệnh nhân ung thư vú nặng chưa được điếu trị có khối 11 ở
gan vả] hoặc xét nghiệm chức nãng gan không binh thường trước khi nghiên cứu.
Page 7 of 16
Bảng dưới đây cung cấp tần suất gặp vả mức độ nghiêm trọng cùa các tác dụng không mong muốn có khả
năng liên quan tới thuốc nghiên cứu đã được ghi nhận > 5% trong số 839 bệnh nhân bị ung thư phổi không tế
bảo nhỏ được lựa chọn ngẫu nhiên được điếu trị bằng cisplatin vã pemetrexed và 830 bệnh nhân bị ung thư
phổi không tế bảo nhỏ được lựa chọn ngẫu nhiên để sử dụng cisplatin vả gemcitabỉn. Tất cả các bệnh nhân
sử dựng liệu phảp nghiên cứu là phác đồ khới đầu cho ung thư phồi không tế bảo nhỏ tiến triển tại chỗ hoặc
di căn và bệnh nhân ở cả hai nhóm điều trị đến được bổ sung đầy đủ acid folic vả vitamin Bu.
Phân loại hệ cơ Tần suẫt Biểu chứng' Pemetrexed/cisplatin Gemcitabin/ cisplatin
quan (N = 839) (N = 830)
Tẩt cã cảc Độc tỉnh Tẩt cả cảc Độc tính
mửc độ mửc độ mức độ độc mửc độ
độc tính 3-4 tính 3 — 4
(%) (%) ("/o) (%)
Rối loạn mảư vả Rất hay gặp Giám 33,0* 5,6* 45,7* 9,9*
hệ bạch huyết hemoglobin
Giảm bạch 29,0* 15,1 * 38,4* 26,7*
cầu trung tính]
bạch cầu hạt
Giảm bạch 17,8 4,8* 20,6 7,6*
cầu
Giảm tiểu cẩu 10,1* 4,1* 26,6* 12,7*
Rối loạn hệ thần Hay gặp Bệnh thần 8,5* 0,0* 12,4* 0,6*
kinh kinh cảm giác
Rối loạn vị 8,1 0,0… 8,9 0,0…
giảc
Rối loạn tiêu Rất hay gặp Buổn nôn 56,1 7,2* 53,4 3,9*
hóa Nôn 39,7 6,1 35,5 6,1
Chán ăn 26,6 2,4* 24,2 0,7*
Táo bón 21,0 0,8 19,5 0,4
Viêm miệng] 13,5 0,8 12,4 0,1
viêm họng
Tiêu chảy 12,4 1,3 12,8 1,6
không cần
phẫu thuật
thông ruột kết
Hay gặp Khó tiêu] 0 5,2 0,1 5,9 0,0
nóng
Rối loạn da và Rẩthay gặp Rụngtóc 11,9* o*** 21,4* 0,5***
mô dưới da Hay gặp Bẫm da/tróc 6,6 0,1 8,0 0,5
vay
Rối Ioạn thận và Rất hay gặp Tăng creatinin 10,1 * 0,8 6,9* 0,5
tiếtniệu
Rối loạn chung Rấthay gặp Mệtmỏi 42,7 6,7 44,9 4,9
và phản ứng tại
vị trí dùng thuốc
* Giá trị p < 0,05 so sánh giữa pemetrexedl cisplatin với gemcitabin/ cisplatin, sử dụng phương phảp Fisher
Exact.
** Tham khảo Viện Ung thư Quốc Gia CTC bản thứ 2 cho mỗi mức độ độc tính.
** Theo Viện Ung thư Quốc Gia CTC (v2. 0; NCI 1998), rối loạn vị giác và rụng tóc chi được bảo cáo ở mức
độ 1 hoặc 2.
Bảo cảo viên sử dụng giới hạn 5% để bao gồm tẩt cá cảc biến có cố thể xảy ra liên quan tới điểu trị bằng
pemetrexed vả cisplatin.
Page 8 of 16
Độc tính có ý nghĩa trên 1âm sảng được ghi nhận 2 1% vả S 5% ở những bệnh nhân được chọn ngẫu nhiên để
sư dụng pemetrexed vả cisplatin bao gồm: tăng AST, tãng ALT, nhiễm trùng, sôt giảm bạch cầu, suy thận,
sot, mat nước điện giải, viêm ket mạc, và giảm thanh thải creatinin.
Độc tinh có ý nghĩa trên lâm sảng được ghi nhận < 1% ở những bệnh nhân được lựa chọn ngẫu nhiên để sử
dụng pemetrexed vả cisplatin bao gồm: tãng GGT, đau ngực, loạn nhịp tim, vả bệnh thần kinh vận động.
Độc tính đối với giới tính có ý nghĩa trên lâm sâng là tương tự nhau trong toản bộ quần thể nghiên cứu trên
bệnh nhân sử dụng pemetrexed cùng với cisplatin.
Bảng dưới đây cung cấp tần suất gặp và mức độ nghiêm trọng của cảc tảc dụng không mong muốn được cho
là có thể liên quan tới thuốc nghiên cứu đã được ghi nhận > 5% trong số 800 bệnh nhân được lựa chọn ngẫu
nhiên để sử dụng pemetrexed đơn độc và 402 bệnh nhân được lựa chọn ngẫu nhiên để sử dụng giá dược
trong nghiên cứu duy trì sư dụng pemetrexed đơn độc (JMENzN=663) và nghiên cứu duy trì liên tục sử dụng
pemetrexed (PARAMOUNTzN=S39). Tất cả bệnh nhân được chẩn đoản ung thư phổi không tế bảo nhỏ giai
đoạn IIIB hoặc IV vẻ đã sử dụng hỏa trị dựa trên platin trước đó. Bệnh nhân ở cả hai nhóm nghiên cứu đều ,
được bổ sung acid folic vả vitamin Biz.
Phân loại hệ cơ Tầu suất Biến chứng** Pemetrex *** Placebo***
quan gặp* (N = 800) (N = 402)
Tẩt cả cảc Độc tinh Tẩt cả cảc Độc tính
mức độ mức độ mức độ mức độ
độc tính 3-4 độc tính 3 — 4
("/o) (%) (%) ("/o)
Rối loạn máu và Rất hay gặp Giảm 18,06 4,5 5,2 0,5
hệ bạch huyết hemoglobin
Hay gặp Giảm bạch cầu 5,8 1,9 0,7 0,2
Giâm bạch cầu 8,4 4,4 0,2 0,0
trung tính
Roi loạn hệ thần Hay gặp Bệnh thần kinh 7,4 0,6 5,0 0,2
kinh cảm giảc
Rối Ioạn tỉêu hóa Rất hay gặp Buồn nôn 17,3 0,8 4,0 0,2
Chản ăn 12,8 1,1 3,2 0,0
Hay gặp Nôn 8,4 0,3 1,5 0,0
Viêm niêm 6,8 0,8 1,7 0,0
mạc/ Viêm
miệng
Rối Ioạn gan mật Hay gặp Tăng ALT 6,5 0,1 2,2 0,0
(SGPT)
Tăng AST 5,9 0,0 1,7 0,0
(SGOT)
Roi loạn da và Hay gặp Ban dai tróc 8,1 0,1 3,7 0,0
mô dưới da vẩy
Rôi loạn chung Rất hay gặp Mệt mòi 24,1 5,3 10,9 0,7
và phản ứng tại Hay gặp Đau 7,6 0,9 4,5 0,0
vị trí dùng thuốc Phù 5,6 0,0 1,5 0,0
Roi loạn thận Hay gặp Rối 1oạn chức 7,6 0,9 1,7 0,0
nãng thận****
Cảc từ viết tắt: ALT = alanin aminotransferase; AST = aspartat aminotransferase; CTCAE = Tiêu chuẩn
thuật ngữ chung về tác dụng bất 1ợi;NCI = Viện Ung thư Quốc Gia; SGOT = nồng độ glutamic oxaloacetic
aminotransferase hu ết thanh; SGPT = nổng độ glutamic pyruvic aminotransferase huyết thanh.
* Định nghĩa tần suat gặp: Rẩt hay gặp 2 10%, Hay gặp > 5% và < 10%. Người nghiên cứu sử dụng giới hạn
5% để bao gồm tất cả các biến cố xảy ra liên quan tới pemetrexed.
** Tham khảo tiêu chuẩn cùa NCI CTCAE (bản 3.0; NCI 2003) cho mỗi mức độ độc tinh. Tỷ lệ ghi nhận
được thể hiện theo CTCAE bản 3.0. _
*** Bảng cảc tác dụng bất lợi tích hợp kết quá hai nghiên cứu JMEN sử dụng pemetrexed đê duy tri (N=663)
vả PARAMOUNT duy tri pemetrexed liên tục (N=539).
Page 9 of 16
**** Định nghĩa hỗn hợp bao gồm tăng nổng độ creatinin máu/ huyết tương, giảm tốc độ lọc cầu thận, suy
thận và cảc biến chứng thậnl niệu sinh dục khác.
Độc tinh CTC có ý nghĩa trên lâm sâng được ghi nhận 2 1% và S 5% bệnh nhân được chọn ngẫu nhiên để sử
dụng pemetrexed bao gồm: sôt giảm bạch cầu, nhiễm trùng, giảm tiểu cẩu, tiêu chảy, tảo bón, rụng tóc, ngứa,
sốt (không có giảm bạch cầu), bệnh trên bề mặt nhăn cầu (bao gồm cả viêm kết mạc), chảy nước mắt nhiều,
chóng mặt và bệnh thần kỉnh vận động.
Độc tính CTC có ý nghĩa trên lâm sảng được ghi nhận < 1% bệnh nhân được lựa chọn ngẫu nhiên để sử dụng
pcmetrexed vả cisplatin bao gồm: phản ứng dị ứngquá mẫn, ban đó đa dạng, ioạn nhip trên thất, nghẽn mạch
phôi.
Mức độ an toản được đảnh giá trên bệnh nhân được lựa chọn ngẫu nhiên để sử dụng pemetrexed (N = 800).
Tỷ lệ phản ứng bât lợi tãng lên ở những bệnh nhân điều trị 5 6 chu kỳ phác đồ pemetrexed duy trì (N=519)
so vởi bệnh nhân sử dụng > 6 chu kỳ pemetrexed (N = 281 ). Sự gia tãng phản ứng bất lợi (tẩt cả các mức độ)
được ghi nhận với thời gian sử dụng dải hơn. Tỷ lệ giảm bạch cầu mức độ 3l4 có thể liên quan tới thuốc
nghiên cứu tăng đáng kế được ghi nhận khi thời gian điều trị pemetrexed dải hơn (5 6 chu kỳ: 3,3%, > 6 chu
kỳ: 6.4%; p=0,046). Không có sự khảc biệt có ý nghĩa thống kê giữa các phản ứng bất lợi mức độ 3/4/5 khi
thời gian điều trị dải hơn.
Biến chứng tim mạch và mạch mảư não nghiêm trọng, bao gồm nhổi máu cơ tim, đau thẳt ngực, tai biến
mạch mảư năo, cơn thiếu máu cục bộ thoáng qua được bảo cảo không thường xuyên trong các nghiên cứu
lâm sảng với pemetrexed, vả thường gặp khi kểt hợp với một thuốc gây độc tế bảo khác. Hầu hết các bệnh
nhân có sự xuất hiện cảc biến chứng nảy có sẵn cảc yếu tố nguy cơ tim mạch.
Những ca viêm gan hiếm gặp có thế nghiêm trọng đã được báo cảo trong cảc nghiên cứu lâm sảng với
pemetrexed.
Giảm cả ba dòng tế bảo máu ngoại vi được bảo cảo không phổ biến trong cảc thử nghiệm lâm sảng với
pemetrexed.
Các trường hợp viêm đại trảng (bao gồm chây máu ruột và trực trảng, đôi khi gây tử vong, thủng một, hoại
tử ruột, và viêm manh trảng) được bảo các không phổ biến ở bệnh nhân điều trị bằng pemetrexed trong cảc
thử nghiệm lâm sảng.
Trong cảc nghiên cứu lâm sản , cảc trường hợp viêm phổi kẽ với suy hô hấp, đôi khi từ vong, được bảo cảo
không phổ biến ở bệnh nhân đieu trị với pemetrexed.
Cảc trường hợp phù nề được báo cảo không phổ biến ở bệnh nhân điếu trị với pemetrexed.
Viêm thực quản! viêm thực quản do xạ trị được bảo cảo không phổ biến trong cảc thử nghiệm lâm sảng với
pemetrexed.
Nhiễm trùng huyết đôi khi gãy tử vong được bảo cảo phổ biến trong cảc thử nghiệm lâm sảng với
pemetrexed.
Trong quá trinh theo dõi sau khi đưa ra thị trường, cảc phản ứng bất lợi dưới đây được ghi nhận ở bệnh nhân
điều trị với pemetrexed:
Các trường hợp suy thận cấp được báo cáo không phố biển ở bệnh nhân điểu trị pemetrexed đơn độc hoặc
phối hợp với các thuốc hóa trị liệu khác. `
Viêm phổi đo xạ trị được bảo cảo không phổ bỉển 6 bệnh nhân xạ trị trước, trong hoặc sau khi điêu trị với
pemetrexed.
Rất hiếm cảc trường hợp phản ứng trên da nghiêm trọng do xạ trị ở những bệnh nhân đã xạ trị trước đó được
ghi nhận.
Các trường hợp thiếu máu cục bộ ngoại vi đôi khi dẫn tới hoại từ chi được bảo cảo không phổ biến.
Các trường hợp tình trạng bóng nước trên da bao gổm hội chứng Stevens — Johnson vả hoại từ thượng bi
nhiễm độc, một số trường hợp dẫn tới tử vong đã được báo cảo hiêm gặp.
Thiếu mảư tan huyết đã được báo cáo hiếm gặp ở bệnh nhân điều trị bằng pemetrexed.
Sốc phản vệ được báo cảo hiếm gặp.
Phù ban đó chủ yếu ở chân được bảo cảo chưa rõ tằn suất. '
T hỏng báo cho bảc sỹ những tác dụng không mong muốn gặp phái khi dùng thuôc
QUẢ LIÊU
Triệu chứng quá liều được bảo cáo bao gồm giảm bạch cầu trung tinh, thiếu mảư, giảm tiểu cầu, viêm niêm
mạc, bệnh đa thần kinh cảm giảc và ban da. Các biến chứng quá liền được dự đoán bao gồm suy tủ biểu
hiện như giảm bạch cầu, giảm tỉều cầu, và thiếu máu. Ngoài ra, nhiễm trùng kèm hoặc không kèm sot, tiêu
chảy, vả/ hoặc viêm niêm mạc có thế được ghi nhận. Trong trường hợp nghi ngờ guá liều, bệnh nhân nên
được theo dõi công thức mảư và sử dụng câc liệu pháp hỗ trợ khi cẩn thiết. Cân nhăc sử dụng calci folinat/
acid folinic trong kiểm soát quá liều pemetrexed.
Page 10 of 16
DƯỢC LỰC HỌC
Nhóm dược lý: Chất đồng đắng của acid folic, mã ATC: LOIBAO4
Pemetrexed lá thuốc khảng folat chốn ung thư đa đích hoạt động theo cơ chế ngăn chặn quả trinh chuyến
hỏa quan ưọng phụ thuộc folat cần thiet cho sự nhân lên của tế bảo.
Nghiên cứu in vitro cho thẩy pemetrexed lá thuốc kháng folat đa đích bằng các ức chế enzym thymidylat
synthase (TS), dihydrofolat reductase (DHFR), vả glycinamid ribonucleotid formyl transferase (GARFT), là
các enzym quan trọng phụ thuộc folat trong quá trình sinh tổng hợp mới các nucleotid thymidin vả purin.
Pemetrexed được vận chuyền vảo trong tế bâo thông qua chẩt mang khử folat vả hệ thống vận chuyến folat
gắn protein mảng tế bảo. Khi vảo trong tế bảo, pemetrexed được chuyến đổi nhanh và với hiệu suất cao
thảnh dạng polyglutamat bởi cnzym folylpolyglutamat synthetase. Dạng polyglutamat được giữ lại trong tế
bảo vả còn là chât ức chế TS vả GARFT mạnh hơn. Sự đa glutamat hỏa là quá trinh phụ thuộc thời gian và
nồng độ xảy ra trong tế bảo ung thư và một phần ít hơn, trong cảc tế bâo bình thường. Cảc chất chuyến hóa
đa glutamat có thời gian bán thải trong tế bảo lâu hơn, dẫn đến kéo dâi thời gian tảc dụng của thuốc ở cảc tế
bảo' ac tính.
Cơ quan quản lý dược Châu Âu đã miễn trảch nhiệm nộp kểt quả các nghiến cứu pemetrexed trên nhóm đối
tượng trẻ em dựa trên những chỉ định đã được câp phép.
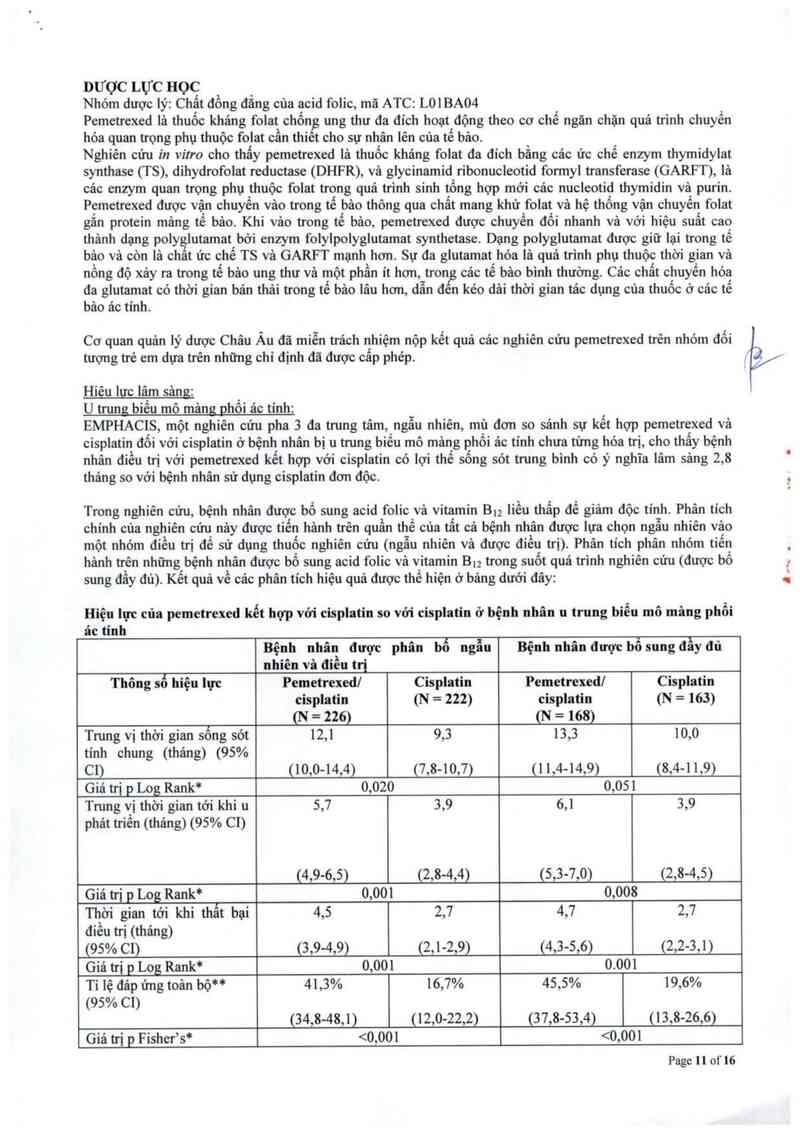
Hiệu lưc lâm sảng:
U trung biểu mô mâm: nhổi ac tinh:
EMPHACIS, một nghiên cứu pha 3 đa trung tâm, ngẫu nhiên, mù đơn sơ sảnh sự kết hợp pemetrexed vả
cisplatin đối với cisplatin ở bệnh nhân bị u trung biếu mô mảng phồi ac tinh chưa timg hỏa trị, cho thấy bệnh
nhân điếu trị với pemetrexed kểt hợp với cisplatin có lợi thể sống sỏt trung bình có ý nghĩa lâm sảng 2, 8
tháng so với bệnh nhân sử dụng cisplatin đơn độc
Trong nghiên cứu, bệnh nhân được bổ sung acid folic vả vitamin Bu liếu thẩp để giảm độc tinh Phân tích
chính của nghiên cứu nây được tiến hảnh trên quần thể cùa tẫt cả bệnh nhân được lựa chọn ngẫu nhiên vảo
một nhóm điếu trị để sử dụng thuốc nghiên cứu (ngẫu nhiến và được điếu trị). Phân tích phân nhóm tiến
hảnh trên những bệnh nhân được bổ sung acid folic vả vitamin Bu trong suốt quá trinh nghiên cứu (được bổ
sung đầy đủ). Kểt quả về cảc phân tich hiệu quả được thể hiện ở bảng dưới đây:
Hiệu lực cũa pemetrexed kết hợp vởi cisplatin so với cisplatin ở bệnh nhân 11 trung biểu mô măng phổi
ác tỉnh
Bệnh nhân được phân bố ngẫu Bệnh nhân được bổ sung đầy đủ
nhiên vã điều trị
Thông số hiệu lực Pemetrexed] Cisplatin Pemetrexed] Cisplatin
cisplatin (N = 222) cisplatin (N = 163)
(N = 226) (N = 168)
Trung vị thời gian sống sót 12,1 9,3 13,3 10,0
tính chung (tháng) (95%
C1) (10,0-14,4) (7,8-10,7) (1 1,4—14,9) (8,4-1 1,9)
Giá trị p Log Rank* 0,020 0,051
Trung vị thời gian tới khi 11 5,7 3,9 6,1 3,9
phảt triền (thảng) (95% C1)
(4,9-6,5) (2,8-4,4) (5,3-7,0) (2,8-4,5)
Giá trị p Log Rank* 0,00 0,008
Thời gian tới khi thẩt bại 4,5 2,7 4,7 2,7
điếu ưi (thảng)
(95% C1) (3,9-4,9) (2,1-2,9) (4,3-5,6) (2,2-3,1)
Giá trị p Log Rank* 0,00 0.001
Tỉ lệ đảp ứng toản bộ** 41,3% 16,7% 45,5% 19,6%
(95% C1)
(34,8-48,1) (12,0-22,2) (3 7,8-53,4) (13,8-26,6)
Giá trị p Fisher’s* <0,001 <0,001
Page 11 of 16
I…. .
Cảc từ viết tắt: Cl= khoảng tin cậy
* Trị số p so sánh giữa các nhỏm
** Trong nhóm pemetrexed/cisplatin, phân bố ngẫu nhiến vả điếu trị (N= 225) và bổ sung đầy đủ (N= 167).
Sư cải thiện có ý nghĩa thống kê các triệu chứng lâm sảng (đau và khó thờ) liến quan tới u trung biếu mô
mảng phổi ảc tinh ở nhánh sử dụng pcmetrcxedlcisplatin so với nhảnh sứ dụn cisplatin đơn độc dựa vảo
thang đo triệu chứng ung thư phối. Đã quan sát thấy sự khác nhau có ý nghĩa thong kê trong cảc xét nghiệm
chức năng phổi. Sự phân tách cảc nhánh điếu trị đạt được thế hiện qua việc cải thiện chức nãng phổi ở nhảnh
sử dụng pcmetrexed/cisplatin vả suy giảm chức năng phổi ở nhánh đối chứng theo thời gian
Dữ liệu về bệnh nhân bị u trung biếu mô mâng phổi ảc tính sử dụng pemetrexed đơn độc còn hạn chế.
Pemetrexed đơn độc, liêu 500 mg/m2 được tiến hảnh trên 64 bệnh nhân 11 trung biểu mô mảng phôi ảc chưa
từng hóa trị trước đó. Ti lệ đảp ứng chung là 14,1%.
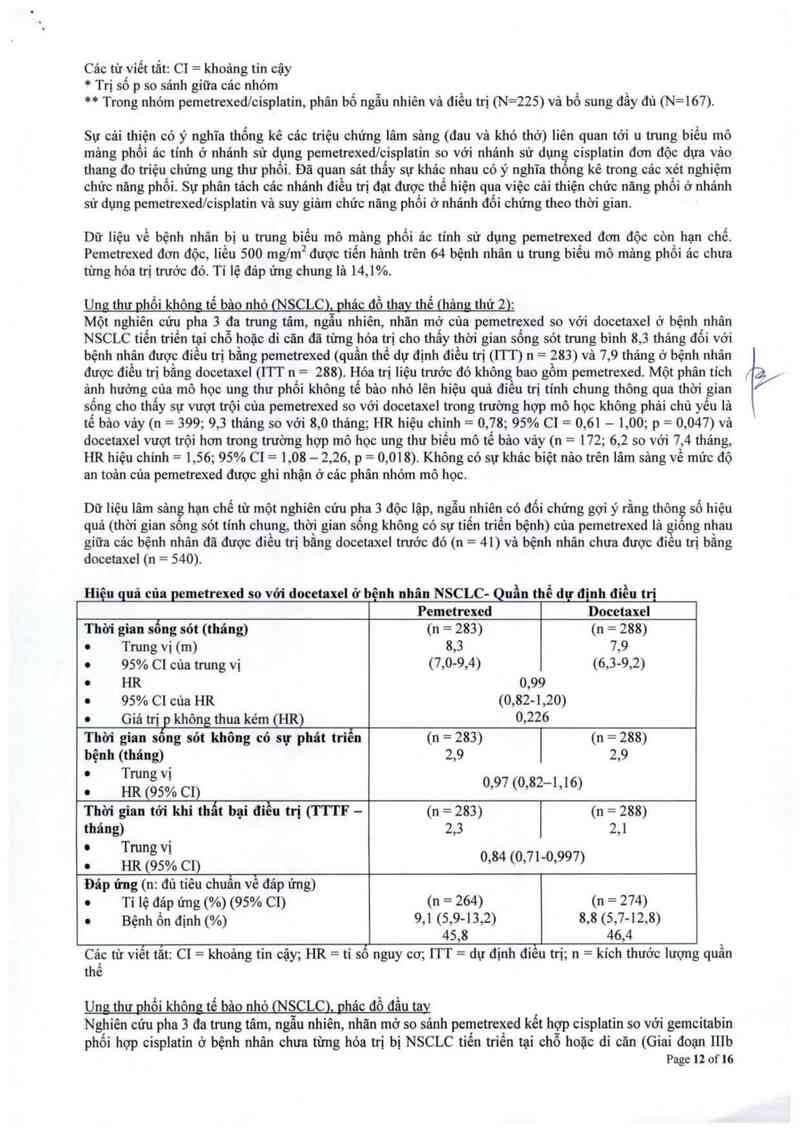
Unit thư phối không tế bảo nhỏ (NSCLC). phác đồ thav thế (hgg thứ 2):
Một nghiên cứu pha 3 đa trung tâm, ngẫu nhiến, nhãn mở của pemetrexed so vởi docetaxel ở bệnh nhân
NSCLC tiến triến tại chỗ hoặc di căn đã từng hóa trị cho thấy thời gian sống sót trung binh 8, 3 tháng đối với
bệnh nhân được điều trị bằng pemetrexed (quần thể dự định điều trị (1TT) n= 283) vả 7, 9 thảng ở bệnh nhân
được điếu trị bằng docetaxel (ITT n— = 288). Hóa trị liệu trước đó không bao gôm pemetrexed. Một phân tích
ảnh hưởng cùa mõ học ung thư phồi không tế bảo nhỏ lên hiệu quả điếu trị tính chung thông qua thời gian
sống cho thấy sự vượt trội của pcmetrexcd so với docetaxel trong tnrờng hợp mô học không phải chủ yếu là
tế bâo vảy (n = 399; 9,3 thâng so với 8,0 tháng; HR hiệu chỉnh = 0,78; 95% C1 = 0,61 — 1,00; p = 0,047) vả
docetaxel vượt trội hơn trong trường hợp mô học ung thư biếu mô tế bâo vảy (n = 172; 6,2 so với 7,4 tháng,
HR hiệu chinh = 1,56; 95% C] = 1,08 — 2,26, p = 0,018). Không có sự khảo biệt nảo trên lâm sảng về mức độ
an toản của pemetrexed được ghi nhận ở các phân nhóm mô học.
Dữ liệu lâm sân hạn chế từ một nghiến cứu pha 3 độc lập, ngẫu nhiên có đối chứng gợi ý rằng thôn số hiệu
quả (thời gian song sỏt tinh chung, thời gian sống không có sự tiến triển bệnh) của pemetrexed lả giong nhau
giữa cảc bệnh nhân đã được điếu trị bằng docetaxel tmớc đó (11 — 41) và bệnh nhân chưa được điêu trị bằng
docetaxel (n — 540)
Hiệu quả của pemetrexed so với docetaxel ở bệnh nhân NSCLC- Quần thể đự định điều trị
Pemetrexed Docetaxel
Thời gian sỗng sót (tháng) (11 = 283) (11 = 288)
o Trung vị (m) 8,3 7,9
0 95% C] cùa trung vị (7,0—9,4) (6,3-9,2)
0 HR 0,99
0 95% C1 cùa HR (0,82-1,20)
' Giá trị p không thua kém (HR) 0,226
Thời gian sống sót không có sự phát triển (11 = 283) (11 = 288)
bệnh (tháng) 2,9 2,9
0 Trung vị
° HR (95% C1) 0197 (0,82 1,16)
Thời gian tới khi thất bại điều trị (TTTF - (n = 283) (11 = 288)
tháng) 2,3 2,1
0 Trung vị
c HR (95% C1) 0,84 (0,71-0,997)
Đáp ứng (11: đủ tiêu chuẩn về đảp ứng)
. Tỉ iẹ đáp ứng (%) (95% C1) (n = 264) (n = 274)
. Bệnh ồn định (%) 9,1 (5,9-13,2) 8,8 (5,7-12,8)
45,8 46,4
Cảc từ viết tắt: c1 = khoảng tin cậy; HR = tỉ số nguy cơ; 1TT = dự định điếu trị; 11 = kích thước Iượng quần
thể
Ung thư phổi không tế bảo nhỏ ịNSCLC), phác đổ đầu tay
Nghiên cửu pha 3 đa tnmg tâm, ngẫu nhiên, nhãn mờ so sảnh pemetrexed kết hợp cisplatin so với gemcitabin
phối hợp cisplatin ở bệnh nhân chưa từng hóa trị bị NSCLC tiến triến tại chỗ hoặc di cãn (Giai đoạn 111b
Page 12 of 16
hoặc 1V) cho thấy pemetrexed phối hợp với cisplatin (quần thể dự định điếu trị (ITT) n = 862) đã đạt được
chi tiêu chính và thế hiện hiệu quả trên lâm sảng tương tự như gemcitabin phối hợp cisplatin (ITT n = 863)
về thời gian sống sót nói chung (tỉ số nguy cơ hiệu chỉnh 0,94; 95% C1 = 0, 84 — 1 ,.05) Tất cả bệnh nhân
tham gia nghiên cứu có khả năng thực hiện công việc ECOG là 0 hoặc 1.
Phân tich hiệu quả ohủ yếu dựa trên quần thể ITT Phân tích độ nhạy cảm của ohi tiêu hiệu quả chủ yếu cũng
được đánh giá trên quần thể đạt được đúng đề cương nghiên cứu (PQ) Phân tich hiệu quả trên quần thể PQ
tương đổng với phân tích trên quân thế ITT và thế hiện AC không thua kém so với GC.
Khả năng sống sót không có sự tiển trỉến bệnh (PFS) và tỉ lệ đáp ứng tính chung tương tự giữa oảo nhánh
điếu trị: trung vị PFS là 4, 8 tháng cho pemetrexed phối hợp cisplatin so với 5,1 tháng cho gemcitabin phối
hợp cisplatin (tỉ số nguy cơ hiệu chinh 1 ,;04 95% C1=
- 2—7,3— 33,9) cho pemetrexed phối hợp cisplatin so với 28,2% (95% C1=
hợp cisplatin Dữ liệu PFS được khắng định một phần thông qua một đánh giá độc lập (400/ 1725 bệnh nhân
được lựa chọn ngẫu nhiến để đánh giá). Phân tích ảnh hưởng của mô học NSCLC lên thời gian sống sót
chung chứng mính những khảo biệt trên lâm sâng về thời gian sống sót dựa trên mô học, xem bảng dưới đây:
0,94 — 1,15), và tỉ lệ đảp ứng chung là 30, 6% (95% C]
25,0— 31,4) oho gemcitabin phối
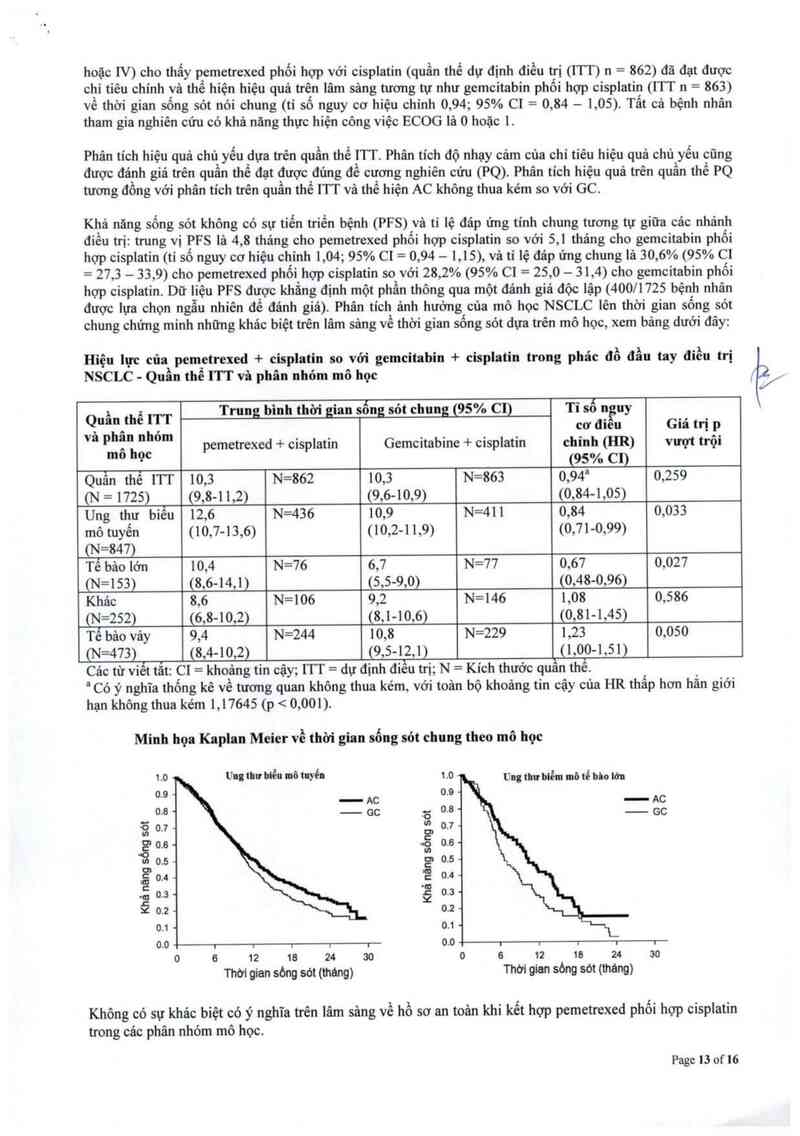
Hiệu lực của pemetrexed + cisplatiu so vởi gemcitabin + cisplatin trong phác đổ đầu tay điều trị
NSCLC- Quần thể ITT và phân nhỏm mô học
Quần thể ITT Trung bình thời gian sống sót chung (95% C1) Tỉ số n uy . ' .
â hân nhỏm . . . . . . cơ đ1eu Gla trị P.
v p ., pemetrexed + c1spiatm Gemc1tabme + c1splatm chinh (HR) vượt trọt
mo học (95% C1)
Quần thể ITT 10,3 N=862 10,3 N=863 0,94a 0,259
(N = 1725) (9,8-11,2) (9,6-10,9) (0,84~1,05)
Ung thư biểu 12,6 N=436 10,9 N=411 0,84 0,033
mô tuyến (10,7-13,6) (10,2-1 1,9) (0,71-0,99)
(N=847)
Tế bâo lớn 10,4 N=76 6,7 N=77 0,67 0,027
(N=153) (8,6-14,1) (5,5—9,0) (0,48-0,96)
Khảo 8,6 N=106 9,2 N=146 1,08 0,586
(N=252) (6,8-10,2) (8,1-10,6) (0,81-1,45)
Tể bảo vảy 9, 4 N=244 10,8 N=229 1,23 0,050
(N=473) (8,4- 10,2) (9,5— 12, 1) (1,00-1,51)
Các từ viểt tắt: C1= khoảng tin oậy; ITT= dự định điếu trị; N= Kich thước quan thể.
² Có ý nghĩa thống kê về tương quan không thua kém, với toản bộ khoảng tin cậy của HR thấp hơn hắn giới
hạn không thua kém 1,17645 (p < 0 ,.001)
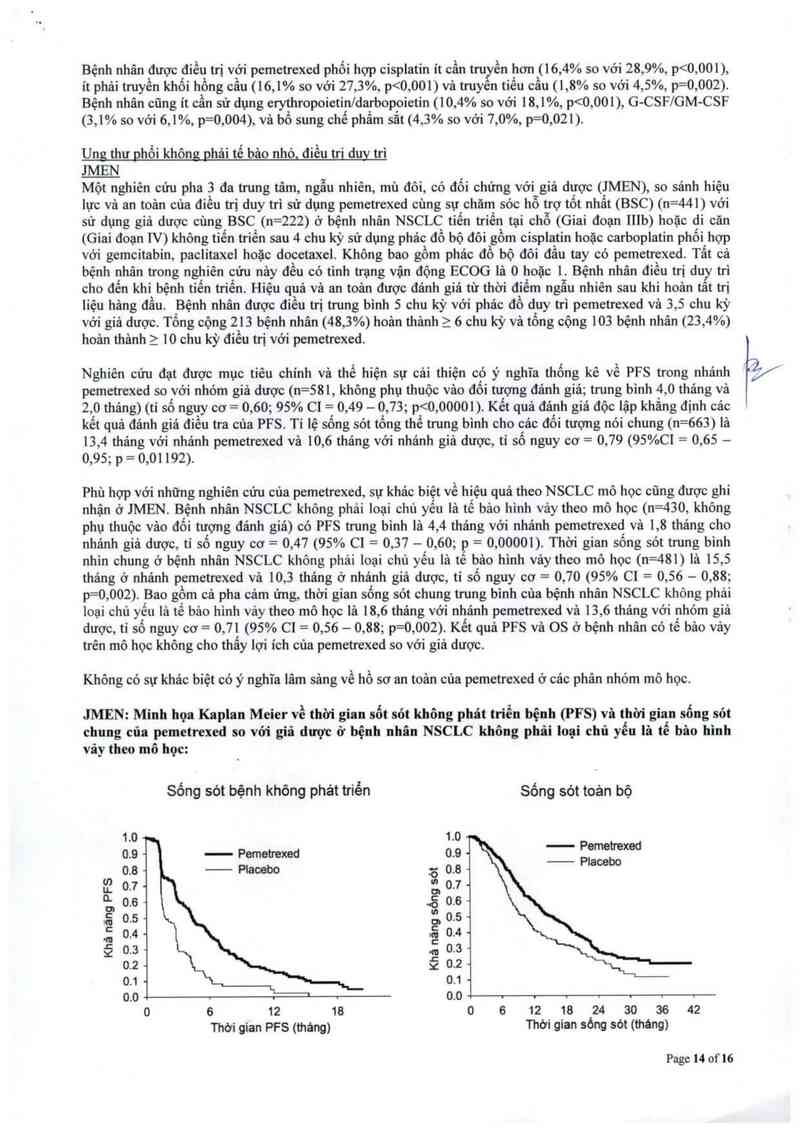
Minh họa Kaplan Meier về thời gian sống sỏt chung theo mô học
1.0 .
0.9 -
0.8 -
6 0.7 «
Ế 0.6-
111 0.5 -
ẵ0.4~
.0 0.3 -
Ế 0.2 «
0.1 -
o.o
Ulg thư btễu liõ tn_vến
——- GC
Khả nang sỏng sòt
O
\ I | I |
6 12 18 24 30
Thời gian sòng sót (tháng)
1.0
0.9 —
0.8 -
0.7 -
0.6 4
0.5 «
0.4 «
0,3 -
0.2 -
0.1 -
0.0
Ulg thư Mến nô tế Mo lớn
—GC
0
l
6
12
I
18 24
Thơi gian sóng sót (tháng)
1
30
Không có sự khảo biệt có ý nghĩa trên lâm sảng về hồ sơ an toân khi kết hợp pemetrexed phối hợp cisplatin
trong cảc phân nhóm mô học.
Page 13 01`16
Bệnh nhân được điều trị với pemetrexed phối hợp oisplatin ít cần truyền hơn (16,4% so với 28,9%, p 6 chu kỳ và tổng cộng 103 bệnh nhân (23,4%)
hoản thảnh > 10 chu kỳ điếu trị với pemetrexed
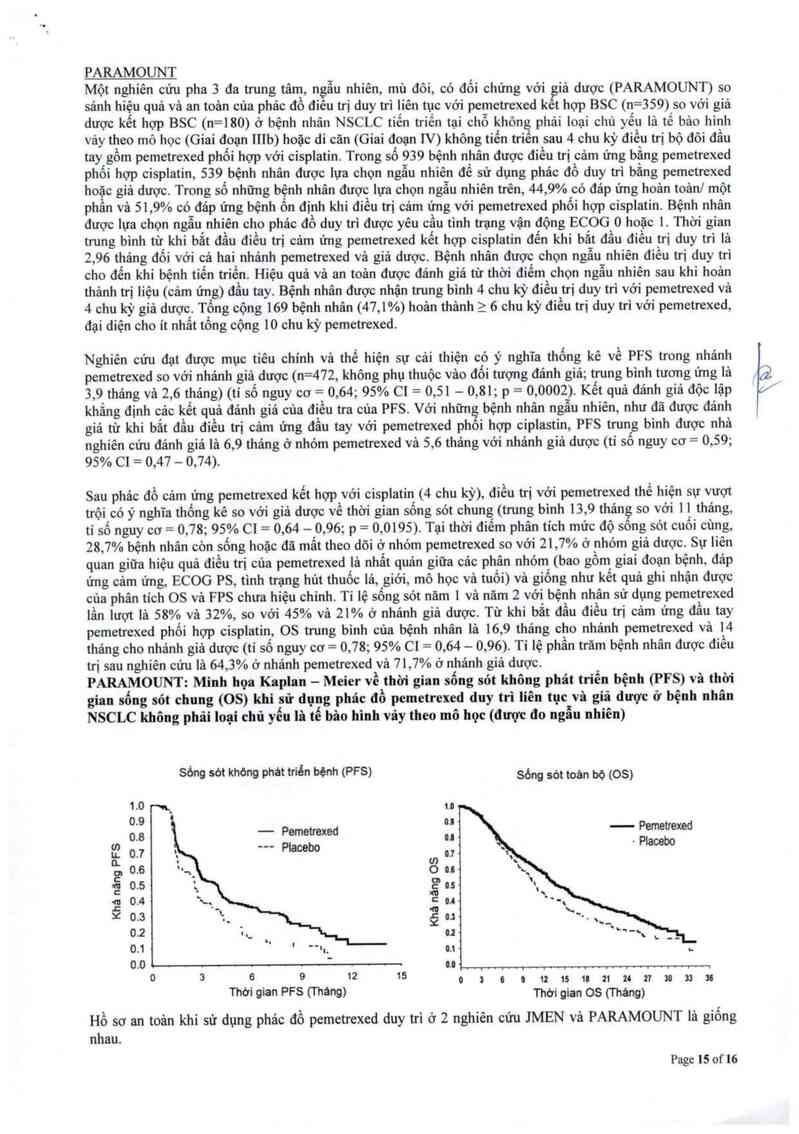
Nghiên cứu đạt được mục tiêu ohinh vả thế hiện sự cải thiện có ý nghĩa thống kê về PFS trong nhánh
pemetrexed so vởi nhóm giả dược (n=581, không phụ thuộc vảo đối tượng đảnh giá; trung binh 4, 0 tháng vả
2, 0 thảng) (tỉ số nguy cơ= 0,60; 95% C1— 0, 49— 0, 73, p
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng