






ỤỉCQFÌẺẸÝDUỢC
ẮỆ H E lĐtL IẦỂẸJJIon Ủndictne
l
ỉ LánđauẨg'ĩifflq
":
Jff'.
UỤYTÊ
ỷi/
ôuuoog amsdea auo:dua;aq
oos uonnog
`lowưon
Deferiprone capsule 500mg
ATRA PHARMACEUTICALS LTD
MY?
—85% Actual Size
Composltion:
Each capsule oontaìns Deteriprone 500 mg
Specificaũon: ln-house
"lndication. Dosage. Administration.
Preceution. Contra- indication': Refet to
pack insert.
Store in cool dry place below 30°C.
Protect from light.
Keep out of reach of children.
Carefully read the acoompanying
instructions before use.
Bt Proscriptinu Medicine
`ỈOVATỌR
Deferiprone capsule 500mg
ATRA PHARMACEUTICALS LTD
Manufactured in tndia by:
ATRA PHARMACEUTICALS LTD
H-19. M i.D.C.. Waluj.Aurangabad — 431133. INDIA.
CM K L150mmXWÁSmMXHSOmm
Rxl'huócbhnỡmodơn
uovnmm
prừtnủvùưuvgdnủDeíưưomámmụ
- ge.Mopsvínomrmg
-criam LAuetm.cmơm.nmumg Chòngđí
ủứtvùdclhôngmlứứ:mmHũSủkòmthm
-BủquhrmlơúmfflởnhnũủủưC Trirtilnh
-m
sỂỀIO SX, NSX, HD- … '8… No ' “Wu Dm', 'Exu
Dm'tlnbaobì
Nudmnyuim
nockfhmgđnsửqmguuocllưmng
-Sờimấtbùs AnthmrdqutLu!
500
Mfg. Lic. No.: AD/Ot1
Batch No.
Mtg.Date : ddlmmlyy
Exp.Date : ddlmmlyy
rLtB,MIDC,M.Aumad—cansa Anoọ ( :
:
_ `
uusm - Vì
O
Ộ
ư:
G
0
|.
<
>
Q
7
ơi
E
0
o
Ư")
1²
3
Vì
Q
R)
U
C)
C
c
_
Q
2
zu
...
m
g
Đọc kỹ hưởng dẫn sử dụng trước khi dùng
Nếu cẩn thêm thông tỉn xin hói ý kiến thầy thuốc
Đề xa tẩm với của trẻ em
NOVATOR 500
Viên nang Deferiprone 500 mg
THÀNH PHẨN
Mỗi viên nang chứa:
Deferỉprone ........................................ 500 mg.
Tá dươc: Tinh bột bắp, Tale tinh khiết, Aerosỉl
CÁC ĐẶC TÍNH DƯỢC LỰC HỌC
Hoạt chẩt chính là deferiprone (3-hydroxy-l,2-dimethylpyridin-4-one), một phức chắt hóa trị hai gắn
kêt vảo săt theo một tỉ lệ 3:l.
Nghiên cứu lâm sảng đã chứng minh rằng deferiprone hiệu quả trong việc đảo thải sắt, một iiều 25
mg/kg 3 lần /ngảy có thể ngăn ngừa tiến trình tích lũy sắt đảnh giả được bằng ferritin huyết thanh đối
vởi cảc bệnh nhân thalassaemia phụ thuộc truyền mảu. Tuy nhiên, liệu pháp chelat hóa có thế không
cân thiết bảo vệ chống lại việc hủy hoại cơ quan gây ra do sắt.
CÁC ĐẶC TÍNH DƯỢC ĐỘNG HỌC
Hấp thu
Deferiprone được hấp thu nhanh chóng từ phần trên cùa đường dạ dảy ruột. Nồng độ đỉnh trong huyết
thanh được bảo cáo từ 45 đến 60 phủt sau đơn liều ở bệnh nhân nhịn đói. Nồng độ đỉnh trong huyết
thanh có thể đạt được sau 2 giờ ở bệnh nhân ăn no.
Sau khi uống liều 25 mg/kg, nồng độ đinh trong huyết thanh được phảt hiện ở bệnh nhân ở điều kiện
ăn no (85 ụmoI/i) thấp hơn ở điều kiện nhịn đói (126 ụmoI/i), mặc dầu không có sự gỉảm lượng
deferiprone được hấp thu khi uống cùng với thức ăn.
Chuyến hóa
Deferỉprone được chuyến hóa chủ yếu qua liên hợp với acid glucuronic. Sản phấm chuyển hóa nảy
thỉếu khả năng kết hợp với sẳt do khử hoạttính nhóm 3—hydroxy của deferiprone. Nổng độ đỉnh của
dạng liên hợp với acid glucuronic trong huyêt thanh đạt được 2-3 gỉờ sau khi dùng deferiprone.
Đảo thải
Ở người, deferiprone được đảo thải chủ yếu qua thận; 75% đến 90% liều uống vảo được báo cáo phát
hiện được trong nước tiếu trong 24 gỉờ đầu, dưới dạng deferiprone tự do, dạng liên hợp với acid
glucuronic và phức hợp iron-deferiprone. Một lượng đảo thải qua phân thay đổi được báo cảo. Thời
gian bán thải ở hầu hết bệnh nhân là 2 đến 3 giờ.
cni ĐỊNH ạ/
Deferiprone được chỉ định quá liếu sắt chủ yếu ở bệnh nhân thalassaemia (bệnh thiếu máu vùng biển)
khi mà đỉêu trị với deferoxamine bi chông chỉ định hoặc không đù.
LIÊU LƯỢNG VÀ CÁCH DÙNG
T 11 uốc mìy chỉ dùng theo sự kê đơn của thẩy thuốc.
Dùng đường uống.
Ẩ..`\
Điều trị deferiprone nên được khờỉ đầu vả duy trì bởi bảo sĩ có kinh nghiệm điều trị bệnh nhân
thalassaemia.
Deferiprone thường được dùng dường uống ở liều 25 mg/kg thể trọng cơ thế, 3 iần/ngảy cho tổng liếu
hằng ngảy 75 mg/kg thể trọng cơ thể.
* Lưu ý: Thầy thuốc cần lựa chọn viên có hãm lượng phù hợp với liều dùng cho bệnh nhân, vì
viên NOVATOR 500 không phân liều được.
Liều trên 100 mg/kg/ngảy không được khuyến nghị bới vì khả năng tăng nguy cơ tảc dụng phụ; dùng
liều lâu dải hơn 2,5 lần liều khuyến nghị lớn nhất có liên quan dến rối loạn thằn kinh.
Vì tính chẳt nghiêm trọng của chứng mất bạch cầu hạt, nó có thể xảy ra với việc sử dụng deferiprone,
tất cả bệnh nhân cần được theo dõi đặc biệt. Phải thận trọng khi số lượng bạch cầu trung tính tuyệt đối
của bệnh nhân thấp, cũng như khi điếu trị cho bệnh nhân suy thận hoặc suy gan.
Nồng độ ferritin trong huyết thanh được khuyến nghị kiểm tra mỗi 2 đến 3 thảng để đánh giá hiệu quả
trong việc kiểm soát lượng sắt trong cơ thể. Cần điều chinh liều dựa vảo đáp ứng của bệnh nhân và
mục đích điếu trị (duy tri, giảm gảnh nặng sắt cho cơ thề). Ngừng đìều trị tạm thời deferiprone nếu
lượng ferritin trong huyết thanh xuống dưới 500 mcg/l.
Sử dụng cho trẻ em
Dữ liệu lâm sảng của việc sử dụng deferiprone ở trẻ em từ 6 đến 10 tuối hạn chế, và không có dữ liệu
việc sử dụng ở trẻ em dưới 6 tuổi.
Sử dụng cho người cao tuổi
Tính an toản và hiệu quả khi dùng cho người cao tuổi vẫn chưa được thiết lập. Cần thận trọng khi chọn
liều cho bệnh nhân cao tuổi, thông thường nên bắt đầu với mức giới hạn dưới trong khoảng iiều quy
định, do người cao tuổi thường có tần suất lớn hơn bị suy chức năng gan, thận, tim, mắc cảc bệnh khảc
và sử dụng cảc thuốc khảo kèm theo.
CHỐNG CHỈ ĐỊNH
Quả mẫn với hoạt chất hoặc bất kỳ tả dược nâo. ạ/
Tiền sử tải diễn giảm bạch cầu trung tính.
Tiền sử mất bạch cầu hạt.
Phụ nữ có thai hoặc cho con bú.
Do cơ chế của deferiprone gây giảm bạch cầu trung tính chưa được rõ, bệnh nhân không được dùng
những thuốc dược biết có liên quan đến giảm bạch cầu trung tính hoặc những thuốc có thể gây mất
bạch cầu hạt.
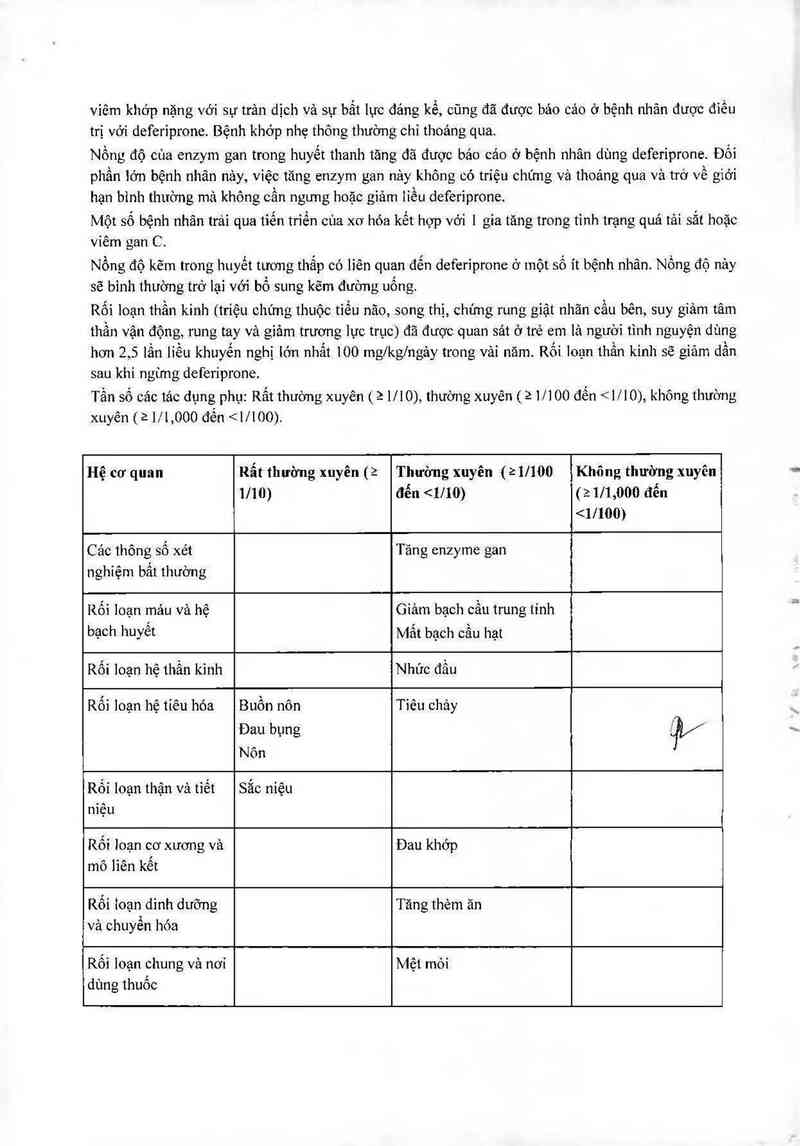
TÁC DỤNG KHÔNG MONG MUÔN
Phản ứng phụ nghiêm trọng hầu hết được bảo cảo trong cảc thử nghiệm lâm sảng với deferiprone iả
mất bạch cầu hạt (bạch cầu trung tính < 0,5x109/1), với tỉ lệ 1,1% (0,6 trường hợp mỗi 100 bệnh nhân
trong vải năm điều trị). Tỉ lệ quan sảt được của tảc dụng phụ giảm bạch cầu trung tinh ít nghiêm trọng
hơn (bạch cầu trung tính 0,5 x
109/L):
Hướng dẫn cho bệnh nhân ngưng ngay lập tửc deferiprone và tất cả thuốc khảo có khả năng gây gỉảm
bạch cầu trung tính. Bệnh nhân nên gỉởỉ hạn tiểp xúc với người khác để giảm nguy cơ nhiễm trùng.
Ngay lập tức đếm tế số lượng tế bảo máu toản phần, số lượng bạch cầu được sửa chữa bằng sự hiện
diện của các tế bảo hồng cầu có nhân, số lượng bạch cầu trung tính vả lượng tiều cầu dựa vảo chuẩn
đoán tác dụng phụ và sau đó lặp lại hằng ngảy. Khuyến cảo rằng sau khi tinh trạng giảm bạch cẩu
trung tinh được hồi phục, hảng tuần tiếp tục thực hỉện đếm tế bảo mảu toản bộ, lượng bạch cầu, lượng
bạch cầu trung tinh và tiếu cầu trong 3 tuần liên tiếp để đảm bảo bệnh nhân hồi phục hoản toản. Bất cứ
bằng chứng nảo cho thấy sự phảt triền nhiễm trùng xảy ra đồng thời với tình trạng giảm bạch cầu trung
tính thì phương phảp cấy vi khuẩn thích hợp vả phương pháp chuẩn đoản nên được thực hiện cùng với
một chế độ tti iiệu thích hợp.
Trường họp giảm bạch cầu lrung tính nặng hoặc mẩl bạch cầu hại (Số lượng bạch cầu lrtmg tính … ệ
đối «. 0,5 x 109/L):
Thực hiện cảc hướng dẫn trên và thực hiện liệu pháp thích hợp như iả tác nhân kích thích khuấn iạc
bạch cầu hạt, bắt đầu ngay khi các trường hợp trên được xác định; dùng hằng ngảy đển khi được khôi
phục. Cách ly bảo vệ vả nểu có chỉ định lâm sảng, chuyển bệnh nhân vảo bệnh víện.
Thông tin giới hạn về việc cho dùng thuốc trở lại. Vì thế, trong trường hợp gỉảm bạch cầu trung tính,
không khuyến nghị dùng lại thuốc. Trong trường hợp mẳt bạch cầu hạt, chống chỉ định dùng lại thuốc.
Khả năng gây ung lhư/tính gây đột biến/ ảnh hưởng lẽn khả năng sỉnh sản
Bởi vì khả năng gây ung thư, độc tính lẽn gen cùa deferiprone không thế được ioại trừ. Không có
nghiên cứu trên động vật để đảnh giá khả năng ảnh hướng cùa deferiprone lên khả năng sinh sán được
bảo cảo.
Nồng đó an+ huyết tương
Theo dõi nồng độ Zn²+ trong huyết tương vả khuyến cáo bổ sung trong trường hợp thiếu.
il
HIV dương lính hoặc bệnh nhân bị !ổn lhương mìễn dịch khác
Không có dữ liệu thích hợp về việc sử dụng deferiprone ở bệnh nhân bị HIV dương tinh hoặc tổn
thương hệ miễn dịch khác. Căn cứ vảo việc deferiprone có liên quan đến giảm bạch cầu trung tính và
mất bạch cầu hạt, không nên điều trị cho bệnh nhân bị tổn thương hệ miễn dịch trừ khi lợi ích vượt hẳn
nguy cơ tiềm ấn.
Suy thận hoặc suy gan vò xơ hóa gan
Không có dữ liệu thích hợp về việc sử dụng deferỉprone ở bệnh nhân suy gan hay suy thận. Bởi vì
deferiprone được đảo thải chủ yếu qua đường thận, có khả năng tăng nguy cơ biến chứng ở bệnh nhân
suy thận. Tương tự, bởi vì deferiprone được chuyển hóa qua gan, nên thận trọng ở bệnh nhân suy giảm
chức năng gan. Chức năng gan và thận nên được theo dõi ở bệnh nhân nảy trong khi điểu trị với
deferiprone. Nếu có tăng alanine aminotransferase (ALT) trong huyết thanh kéo dải, ngừng đỉều trị
deferiprone nên được xem xét.
Ở bệnh nhân thiếu mảu vùng biến có sự liên quan giữa xơ hóa gan và thừa sắt vả/hoặc viêm gan C.
Chăm sóc đặc biệt nên được thực hỉện để đảm bảo chelat hóa sắt ở bệnh nhân viêm gan C là tốt nhất.
Nên theo dõi cẳn thận mô học gan ở những bệnh nhân nảy
Biến mảu nước tiếu
Bệnh nhân nên được thông bảo rằng nước tiếu của họ có thể biến mảu thảnh hơi đỏ/nâu do sự bảo tiết
phức sắt-deferiprone.
Quá liều mãn tinh vả rối Ioạn !hần kình
Rối loạn thần kinh đã quan sảt được ở trẻ em điều trị với liếu gấp 2,5 đến 3 lẩn liều khuyến nghị trong
vòng vải năm. Người kế toa nến được nhắc nhớ rằng liều trên 100 mglkg/ngảy không được khuyến
nghị.
Phụ nữ có thai
Không có dữ liệu đầy đủ về việc sử dụng deferiprone ở phụ nữ có thai. Nghiên cứu trên động vật cho
thấy độc tính trên khả năng sinh sản. Nguy cơ tiềm ấn cho người chưa được biết.
Phụ nữ có khả năng sinh sản phải trảnh mang thai do khả năng gây quải thai và thay đổi gen của thuốc
nảy. Những phụ nữ nảy nên được khuyên dùng biện pháp trảnh thai và phải ngừng dùng thuốc ngay
lập tức nếu có thai hoặc dự định có thai.
Phụ nữ cho con bú
Không biết rằng deferiprone có được bải tiết vảo sữa người hay không. Không có nghiên cứu khả năng
sinh sản trước và sau khi sanh được tiến hảnh ở động vật. Deferiprone không được dùng cho phụ nữ
cho con bú. Nếu đỉều trị lả bắt buộc, phải ngừng cho con bú.
Tác dụng lên khả năng lái xe và vận hânh máy móc ậ/
Không có nghiên cứu ảnh hưởng lên khả năng lải xe và vận hảnh máy mỏc thực hiện.
TƯỜNG TÁC THUỐC
Tương tác giữa deferiprone và các thuốc khác chưa được bảo cảo. Tuy nhiên, do dcferiprone gắn kết
với các cation kim ioại, có khả năng tồn tại tương tảc giữa deferiprone và các thuốc phụ thuộc cation
hóa trị ba như thuốc khảng acid có gốc aluminium. Vì vậy, không khuyến nghị dùng đồng thời
deferiprone và thuốc kháng acid có gổc aluminium.
Tính an toản cho việc dùng đồng thời deferiprone vả vỉtamín C chưa được nghiên cứu chính thức. Dựa
trện tương tảc có hại được bảo cảo có thế xảy ra giữa deferoxamine vả vitamin C, thận trọng khi dùng
đông thời deferipronc vả vitamin C.
Do không rõ cơ chế của deferiprone gây ra giảm bạch cầu trung tính, bệnh nhân không nên chung với
các thuốc gây giảm bạch cầu trung tính hoặc gây mất bạch cầu hạt.
SỬ DỤNG QUÁ LIÊU:
Chưa có báo cảo quá liều cấp tính đối với deferỉpronc.
ĐÓNG GÓI: Hộp có 5 ví x 10 viên nang
HẠN DÙNG: 3 năm kế từ ngảy sản xuất.
BẢO QUẢN: Bảo quản nơi khô mảt ở nhiệt độ dưới 30°C. Tránh ảnh sáng.
TIÊU CHUẨN: Nhà sản xuất.
NHÀ SẢN XUẤT:
ATRA PHARMACEUTICALS PVT. LTD
H-l9 '
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng