












Ỉltuíllẩỉiẵl
I.H.B Ilẵ
UK 8 O ỉEnỂẽ IIS... _ Ê
íỄEI
ãỀI:ẽ
ỗÊ.o… ễ Eẵẵ cã …oẵ
a Soẩ ẳ
__
T
An
Ẹ
A "
Fi
….
A
EDUY
BỘYT
CỤC QUÁN LÝ i>tfớC
Lân dâuz.ZJử…ĩiả…nảwffl… \—
ĐÃPH
`B
®
<_p__f
i…. ớ 1……
.ffl mđ ……
JWJ [m …
im w …
. m
n…, ..
ả . uưmm
h M…… .m.mm
C [. n
M hẾfflủ
nffl.ủ m…Ủm
ID
\
:ẵẵEễ
: :ẵ:Ể ễ …ẫ uẫ ồẫ
ẵoBẩuoo …obco c
Ễẵễ
ẫIẤ 81312 ồEỂ
#: …:ẫo—ỗ Êẵ Sơ… 18
n:ẵẵ.ễc ễẵỉ. pnkưẵ
x... aooẩẫ S ẫầ: ồỄẵ
8nẫẫẵễxẵềẵ
Rxẳỉẩ<ẵẺ
: o8ẩ ẳ
… Ế 1 ẵ Ể S…ẫo:
?.. .:ĩnẵ:
… !oả-Ể …Ểẵo o… 822:
3. 23:63 Em
nâẵỡunẵu. Sễìầẵỉ
! ẵễẳsẵ …nu ẵnẫ
ưnÌ
a…ồ Ễ… ẳẫă
xmmtẵom.ỉm ẳ Q… ỄỂ
ẵ
IISỄ
uu
ẵỉ
….9.
B
.o:Ễ.B ễỄ osư:
l“l'f“f'FI’l“l'I-I-l-I-I-l“l“l"l“I—I-l-l-I'I'I'I'I'Pl'fl'l—l-J'PI-l-I-I—l'v ,
ụx.ụụụụụụụ\.ụụ\.\..ụụx-ụ\.ụx-ụụụụụụụụụụụụụụụụụụg`
!
ị
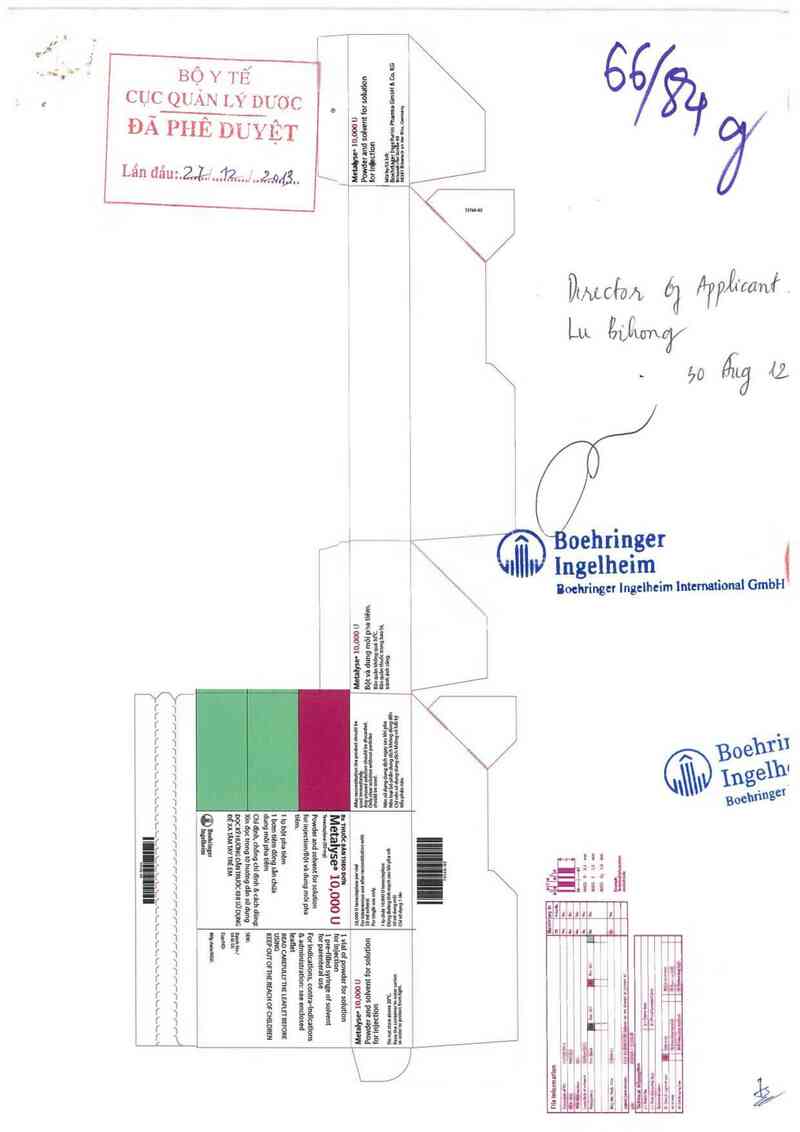
Metalyseo 10,000 U
Tonoctopllso _ _ _ _
Pơwde: for solution tot mịoctlơn/ _ 1 phi nim
10.000 0 tenemplnse per vnl/mặt
Fonntmenous use mer reccnsntunon with 10 ml solunt
Dũng đuờng ưnh much sau khi phu với 10 ml dung mõ!
Sonhnn rInẽolhoim Phlrml liml NMSỐlỒSỀ
GmbH Co. G. Getmuny
^ Boehringer
liil 1ngelheim
s…… dd.mm.yyyy
. . Mandatory in
File mformatton m mm
Issue dlte otTD: 01/Feb/2011 Yes Yes
PPM SKU: P007729 No Yes
PPM SKU venion: 003 No Yes
Issue date ot lnwulkz 2h/Feb/20H No Yes
Printcolon: Pan Black Pan 207 ' Pan 367 No Yes
Ỉ
Mat. No. Pidc Slte: 72538—02 Nu Yes
Luend cauversion: v3.0 O1l]UN/2010 (please do not change … iemov: it)
Plck~to—Editz 60175L | Ai
Technical information
: = Batth No. 1: = Expiry date
: ' Manufacturĩng date d = Price/Samplelũnic
Technical mlou
Bl-DiecutLegendcase . Free am Bl—Lacquer-iree
Bl-Braille \ | Bl-Function—vamish Bl-Spot-vamish
VcMciềoxv 6) Ồ’ff7.ffcanf
Lu ỂfW
30 Dug ZO/ỈL
Boehringer
Ingelheim
E
G
u.
]
MASS D 0.5
MASS E 1.5
MASS F 4.0
MASS GI 1,0
MASS G: 1.4
MASS H 1.5
MASS ] 1.0
Exam le
Techn cal tnlmmatton
cnntvnlcode
Boehringer Ingelheim lntemational GmbH
ca=cẵ
âggẳẩ ẵ 2
Ểẩ'"ẫa ~
aẵỀẵ"ẫ Ế a
ẩễ-ẵ'ổễ'gẳồ
Ễ' u“ a &
"ỂỂỆẳn-n'ẳ
Ệẫ 3.92 5
n ẳẵẵ s
ã ° :
ẵ n ² ’
8
gan dd.mm 90
gf°ẳề dd.mm. in:
m…lmmionmtldm
WWW…
<60
260—<70
z70-<80
280—<90
z9o
ks
. . . Mande in
File mfcrmatton … mủ
Issuedlte uITD: 13/1an]2011 Yes Yes
PPM SKU: P007730 No Ves
PPM SKU vetsion: 002 No Yes
Issue date of artwork: 2UFeblml 1 No Yes
Ffilt colors: Pan Black Pan 207 No Yes
Mat. No. Pack. Site: 58840-02 No Yes
Lepmt asevmion: v3.0 OIJIUN/ZONJ (please ơo not change or remuve ìt)
Pack-2-Edil: 601804 A1
Technical information
a - Batch No. |: - Explry date
c = Manufacturing date d = Price]SamplelCinic
Technical colors
Bl-Díecut-Legendcase ỆFvee area BI-Lacquet-tree
BI-Braiile l Bi-Function-vamish Bi—Spot—vamish
Ủừưcửh ớ} ảưfcmnf
Lụt ịlriỊỐiovxj
ệo ửỄ Ư/ ^
Boehrmger
Ingelheỉm
Boehtingcr lngelhcim International GmbH
MASS D 05
MASS E 1.5
MASS F L.0
MASS Gi 1.0
MASS G: i.A
MASS H 1.5
MASS ] 0 1.0
Example
Technical hlomutỉon
control code
»
METALYSE®
Tcnecteplase
Bột và dung môi pha dung dịch tiêm
THUỐC BÁN THEO ĐƠN BÁC SỸ
Thânh ohần
METALYSE 6.000 đơn vị:
Một lọ chứa 6.000 đơn vị (30 mg) tenecteplase
Một xy lanh đóng sẵn chứa 6 mL nuớc pha tiêm
METALYSE 8.000 đơn vị:
Một lọ chứa 8.000 đơn vị (40 m g) tenecteplase
Một xy lanh đóng sẳn chứa 8 mL nước pha tiêm
METALYSE 10.000 đơn vị:
Một lọ chứa 10.000 đơn vị (50 mg) tenecteplase
Một xy lanh đóng sẵn chứa 10 mL nước pha tiêm
Tá dược: L-arginin, acid phosphoric, polysorbat 20
Tốn dư dạng vết: gentamycin từ quy trinh sản xuất
Dung dịch sau khi pha chứa 1.000 đơn vị (5 mg) tenccteplase mỗi mL.
Hoạt lực cùa tenectcplase được thể hiện theo đơn vị (U) bằng cảch sử dụng tiêu chuẩn tham khảo
đặc hiệu đôi vởi tenecteplase và không tương ứng với các đon vị được sử dụng cho cảc thuôc tiêu
huyết khối khác.
Chỉ đinh
METALYSE được chỉ định diển ni tiêu huyết khối trong nhồi máu cơ tim cẩp (AMI). Nên tỉển hảnh
điêu trị cảng sớm cảng tốt ngay sau khi xuất hiện triệu chứng.
Liêu lương và cảch sử dung
METALYSE nên được sử dụng dựa trên khối lượng cơ thế, liếu tối da lả 10.000 đơn vị (50 mg
tenectcplase). Bảng dưới đây hướng dẫn cách tính thể tích dung dịch pha cần sử dụng để có liểu
dùng chính xảo:
, f-ễ`J
i_`~ \ì\~
Im Boehrinser
| Ingelheim
Gmì]
Tenecteplase Tcnecteplase Thể tích tương ứng cùa
Khối lượng cơ thể cùa (U) (mg) dung dịch sau khi pha
bệnh nhân (kg) (mL)
< 60 6,000 30 6
2 60 to < 70 7,000 35 7
2 70 to < 80 8,000 40 8
2 80 to < 90 9,000 45 9
2 90 10,000 50 10
Liều lượng cần dùng nên được tiêm tĩnh mạch nhanh môt lần duv nhất trong khoảng từ 5-10 giây.
Có thế sử dụng một đường truyền tĩnh mạch có sẵn mã đã dùng chỉ đề truyền dung dịch natriciorua
0,9% cho việc truyền METALYSE. Trong trường hợp dùng đường truyền, sau khi tiêm
METALYSE xong cần tráng sạch đường truyền nãy đễ đãm bảo lượng thuốc vân trong tĩnh
mạch hoản toản.
METALYSE tương kị với dung dịch dextrose.
Không được trộn lẫn METALYSE vởi cảc thuôc khác, kể cả vảo lọ dung dịch tỉẽm truyền hoặc
đường truyên (thậm chí ngay cả với hcparin).
Điều trị hỗ trợ
Liệu pháp hỗ trợ chống huyết khối được khuyến cáo theo các hưởng dẫn quốc tế híện hảnh về điều
trị bệnh nhân nhồi mảu cơ tim có đoạn ST chênh lên.
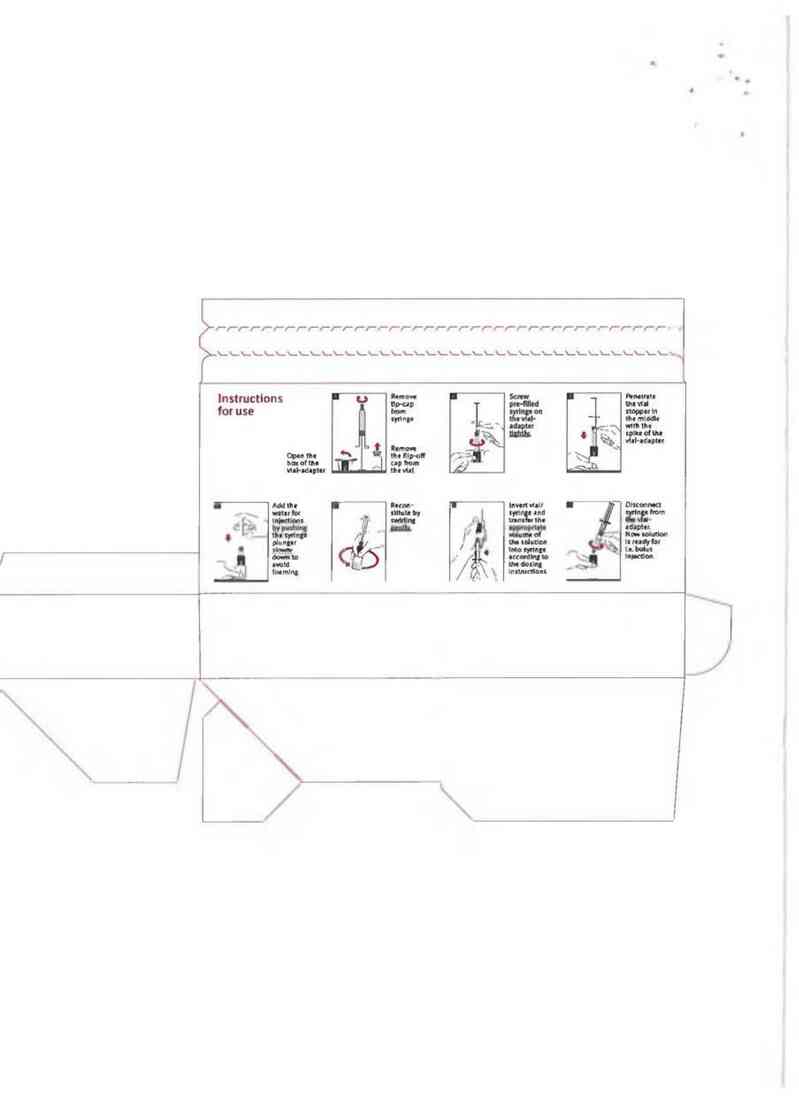
Hướng dẫn sử dung/Cảch nha chế
Nên pha METALYSE bằng cảch thêm toân bộ lượng dung môi chứa sẵn trong bơm tiêm vảo 1ọ
chứa bột đông khô.
1 Cần đảm bảo lựa chọn hảm lượng lọ phù hợp với khối lượng cơ thể cùa bệnh nhân (Xem liều
lượng và cách dùng).
2 Kiếm tra nắp nhôm bao ngoải, đảm bảo vẫn còn nguyên vẹn.
3 Bỏ nắp lọ thuốc.
4 Gỡ nắp đậy đầu bơm tiêm. Sau đó ngay lập tức xoay gắn đầu bơm tiêm vảo bộ phận tỉểp hợp
của lọ thuôc và xuyên qua chính gỉữa nút lọ bằng đầu nhọn cùa bộ phận tỉếp hợp.
5 Bom nước pha tiêm vảo trong lọ bằng cảch ấn cần đẳy của bơm tiêm xuống từ từ đề trảnh tạo
bọt.
6 Hòa thuốc bẳng cách xoay nhẹ lọ .
7 Chế phẩm sau khi hòa tan [ả dưng dịch trong suốt từ không mảu đển vảng nhạt. Chi sử dụng
dung dịch thu được trong suôt, không có bât cứ cặn nhỏ nảo.
\“Ù '
8 Ngay trưởc khi sử dụng, dốc ngược lọ thuốc trong khi vẫn gắn chặt bom tỉêm đề cho bơm tỉêm ở
phía dưới lọ thuôc.
9 Rút một thể tích phù hợp dung dịch METALYSE mới pha vảo trong bom tiêm, dựa trên khối
lượng cơ thể cùa bệnh nhân.
10 Rút bom tiêm ra khỏi bộ phận tiểp hợp cùa lọ thuốc.
11 Dung dịch METALYSE nên được sử dụng cho bệnh nhân theo đường tiêm tĩnh mạch trong
khoảng thời gian từ 5-10 giây. Không được đưa vảo cùng đường truyẽn có chứa dextrose.
12 Bỏ tất cả phần dung dịch không dùng đến (còn thừa).
15 Việc pha chế hòa tan thuốc có thể thực hiện theo một cảch khảo bằng cách dùng kỉm tiêm kèm
theo.
Chống chỉ đinh
Điều trị tiêu huyết khối thường liên quan đến nguy cơ chảy mảu. Do đó chống chỉ định
METALYSE cho cảc trường hợp sau:
— đang có rối loạn chảy máu đáng kế, hoặc trong vòng 6 thảng trước đó, có cơ địa dễ chảy ìÌ'
máu.
— cảc bệnh nhân hiện đang sử dụng thuốc chống đông đường uống (INR > 1,3).
— có tiền sử tổn thường ở hệ thần kỉnh trung ương (ví dụ: khối u, phình mạch, phẫu thuật nội
sọ, hoặc phẫu thuật cột sống).
— tăng huyết ảp động mạch nặng, không kiếm soát được.
— phẫu thuật lớn, sinh thỉết nhu mô các tạng hoặc có chấn thương đáng kể trong vòng 2 tháng
gẩn đây (bao gồm bẩt kỳ chắn thương nảo kết hợp với nhồi mảu cơ tim cẳp lẫn nây) chẳn
thương gần đây ở vùng đầu, sọ nảo.
— hồi sức cẩp cứu tim phối gây chấn thương hay kéo dải (> 2 phút) trong vòng 2 tuần gần đây.
— rối loạn chức năng gan nặng bao gồm cả suy gan, xơ gan, tăng áp lực tĩnh mạch cừa (gỉãn
tĩnh mạch thực quản) vả viêm gan tiến triền.
— loét đường tiêu hớa tiến triển.
— phình động mạch vả đã biết bị dị dạng động] tĩnh mạch.
-— khối u có nguy cơ tăng chảy mảu.
— viêm ngoại tâm mạc cấp vảlh0ặc viêm nội tảm mạc nhiễm khuẩn bán cẩp.
— vìêm tụy cấp.
— quả mẫn cảm với hoạt chẩt tenccteplase, gcntamycin (tồn dư dạng vết từ quy trình sản xuất)
hoặc bât kỳ tá dược nảo.
— Đột quỵ xuất huyết não, đột quỵ không rõ lý do ở bẩt cứ thời gian nảo.
— Đột quỵ thíếu máu cục bộ hoặc cơn thiếu mảu não thoáng qua (TIA) trong vòng 6 tháng.
E't’tt.
Thân trong và cảnh báo đăc biẽt
METALYSE nên được kê toa bởi các bác sỹ đã có kinh nghiệm trong việc sử dụng điểu trị tiêu
huyết khối và có phương tiện để theo dõi việc sử dụng nảy. Điều nảy không có nghĩa là không thế
sử dụng METALYSE trước khi nhập viện. Cũng như cảc thuốc tiêu huyết khối khác, khi sử dụng
METALYSE cần phải có các thuốc và thiết bị hồi sức chuẩn sẫn sảng trong mọi tinh huống.
Can thiên đông mach vảnh đua da tiên ohát (PCI)
Nếu can thiệp động mạch vảnh tiên phát được lên kế hoạch theo các hưởng dẫn đìều trị phù hợp
hiện hảnh, không nên sử dụng METALYSE như trong nghiên cứu ASSENT-4 PCI (tham khảo mục
“Đặc tính Dược lý học”).
Xuât huvêt
Biến chứng thông thường nhất gặp phải trong quá trình điều trị bằng METALYSE lả xuất huyết.
Việc sử dụng đồng thời khảng đông heparin có thể góp phần gây chảy mảu. Do fibrỉn bị tiêu hùy
trong qua'. trinh điều trị bằng METALYSE nên có thể xuất hiện chảy máu tại vị trí vừa mới tiêm,
chọc. Do đó, trong khi điều trị tiêu huyết khối cẳn phải theo dõi cân thận tất cả các vị trí có thể chảy
máu (bao gồm cảc vị trí đặt catheter sau dó, chọc động mạch và tĩnh mạch, bộc lộ tĩnh mạch vả
tỉẽm, chọc bằng kim), Cần tránh việc sử dụng các catheter cứng, tiêm bắp vả những thao tác không
cần thiết trên bệnh nhân trong quá trình điều trị bằng METALYSE.
Nếu xuất hiện chảy máu nặng, đặc biệt lả xuất huyết não, cằn chấm dt'rt ngay lập tức vỉệc sử dụng
heparin đồng thời Nên xem xét việc sử dụng protamine nếu heparin được sử dụng trong vòng 4 giờ
trước khi xuất hiện chảy mảu. Ở một số ít bệnh nhân không có đảp ứng dối vởi các biện pháp qui
ước nảy, có thế thận trọng chỉ định sử dụng các chế phẳm từ mảu. Nên cân nhắc truyền chất kết tủa
đông lạnh, huyết tương tươi đông lạnh và tiều cẩu cùng vởi việc đánh giá lại về mặt lâm sảng vả các
xét nghiệm sau mỗi lần dùng. Mức fibrinogen đích lg/l là mức mong muốn khi truyền chất kểt túa
dông lạnh. Các sân phầm chống tiêu sợi huyết cũng nên được xem xét sử dụng.
Ô cảc tình huống sau, cần đánh giá cẩn thận việc điều trị bằng METALYSE dế cân bằng giữa các
nguy cơ chảy mảu tiềm tảng và các lợi ích mong đợi.
0 Huyết áp tâm thu > 160 mmHg.
0 Xuất huyết ở đường tiêu hóa hay đường tìết niệu sinh dục gần đây (trong vòng 10 ngảy gần đây).
n Bắt kỳ trường hợp tiêm bắp nảo được ghi nhận gần đây (trong vòng 2 ngảy gần đây).
0 Tuổi cao, nghĩa là trên 75 tuổi.
0 Nhẹ cân (< 60 kg).
o Bệnh mạch mảu não.
Loan nhip tim
Điều trị tiêu huyết khối ở mạch vảnh có thể dẫn đển loạn nhịp liên quan tởi sự tái tưới máu.
Loạn nhịp tải tưới máu có thể dẫn đến ngừng tim, có thể đe doạ tính mạng và có thể đòi hới phải sử
dụng liệu phảp chống loạn nhịp quy ước.
Các thuốc đối khảng leco -nrotein IIb/Hla
Sử dụng đông thời thuôc đôi khảng GPIIb/Iiia lảm tăng nguy cơ chảy máu
Thuvên tắc huvết khối
Víệc sử dụng METALYSE có thể lảm tăng nguy cơ thuyên tắc huyết khối ớ bệnh nhân có huyết
khối ở tím trải ví dụ: hẹp van 2 lá hay rung nhĩ.
Ouá mâu
Chưa ghi nhận thấy sự hinh thảnh kháng thể vởỉ tenecteplase sau khi điều trị. Tuy nhiên, chưa có
kinh nghiệm về vỉệc tái sử dụng METALYSE.
Phản ứng giống phản vệ líên quan đến việc sử dụng METALYSE hiếm khi xảy ra vả có thể do quá
mẫn vởi hoạt chẩt tenecteplase, gentamycin (tồn dư lượng rẩt nhỏ từ quy trình sán xuất) hoặc vởi
bất kỳ tả dược nảo. Nếu phản ứng giống phản vệ xảy ra, nên ngừng tiêm thuốc và đỉểu trị phù họp.
Tương tác
Chưa có các nghiên cứu chinh thức về tương tác giữa METALYSE và các thuốc thường được sử
dụng ở bệnh nhân nhồi mảu cơ tim cấp. Tuy nhỉên, vỉệc phân tích cảc dữ liệu từ hơn 12.000 bệnh
nhân được đỉếu trị trong cảc giai đoạn I, II, III đã không cho thẩy bẳt kỳ một tưong tảo có ý nghĩa
lâm sảng nảo giữa METALYSE vả các thuốc thường được sư dụng ở bệnh nhân bị nhồi máu cơ tim
cap.
Các thuốc lảm ảnh hướng tới quá trình đông mảu hay những thuốc lảm thay đồi chức năng tìếu cầu
có thẻ iảm tăng nguy cơ chảy mảu trước, trong vả sau khi điêu trị vởi METALYSE.
Thai kỳ và cho con bú
Chưa có kinh nghiệm sử dụng METALYSE cho phụ nữ mang thai. Cần đảnh giả lợi ich cùa việc
điều trị với nguy cơ tiêm tâng ở trường hợp nhồi mảu cơ tim trong thai kỳ. Vẫn chưa biêt liệu
tenecteplase có được bải tiêt qua sữa mẹ hay không.
Ảnh hưởng trên khả năng lãi xe và vân hảnh máỵ móc
Không liên quan.
Tác đung ghu
Cũng như với cảc thuốc lảm tìêu huyết khối khảc, chảy máu lả tác dụng không mong muốn thường
gập nhât líên quan tởi vỉệc sử dụng METALYSE. Chảy máu tại bât kỳ vị trí hoặc khoang cơ thê nảo
đên có thẻ xảy ra vả dẫn đến các tinh trạng đe dọa đên tính mạng, gây tản phê vĩnh viễn hoặc tử
vong.
Dạng xuất huyết liên quan đến việc điều trị thuốc Iảm tiêu huyết khối có thể chia thảnh hai nhóm
lởn:
- Chảy mảu bề mặt, thường từ vi tri tiêm.
- Xuất huyết nội tại bất kỳ vị trí nảo hoặc khoang cơ thể
Có thế có các triệu chứng cùa xuất huyết nội sọ như ngủ gả, mắt vận ngôn, liệt nứa người, co giật.
Rối loan hê miễn dich
- phản ứng giống phản vệ bao gồm
0 ban
o mề đay
0 co thẳt phế quản
o phù thanh quản
'@
Ấ'Ĩ'“ “&.`
Rối loan hê thần kinh
- Xuất huyết nội sọ như
0 xuất huyết não
o tụ máu năo
o đột quỵ do xuất huyết não
o dột quỵ chuyền dạng chảy máu
0 tự mảu nội sọ
0 xuất huyết dưới nhện.
Rối Ioan về mắt
- Chảy máu mảt
Rối loan tim
- loạn nhịp tái tưới mảu như
0 vô tâm thu
loạn nhịp tự thẩt tỉến triển
loạn nhịp tim, ngoại tâm thu
rung nhĩ
bloc nhĩ thẳt độ 1 - bloc nhĩ thất hoản toản
nhịp tim chậm, nhịp tim nhanh
loạn nhịp thẳt, rung thất
0 nhịp nhanh thất
xảy ra có liên chặt về mặt thời gian với điều trị bằng METALYSE.
OOOOOO
Loạn nhịp tải tưới mảu có thể dẫn đến ngừng tìm, có thể đe doạ tính mạng vả có thể đòi hòi sử dụng
liệu phảp chông loạn nhịp quy ước.
- xuất huyết ngoại tâm mạc
Rối loan mach
— chảy máu
- thuyên tăc mạch
Rối loan hê hô hắn, ngực và trung thất
- chảy mảu cam
- xuât huyêt phôi
Rối loan hệ tiêu hóa
- xuất huyết đường tỉêu hóa như
xuất huyết dạ dảy
xuất huyết do loét dạ dảy
xuất huyết trực trâng
nôn ra mảu
tiêu phân đen
xuất huyết trong miệng
0
00000
- nôn
- buôn nôn.
- Xuât huyêt sau phúc mạc như
\,_
- tụ máu sau phủc mạc
Rối loan da và mô dưới da
bâm mảu
Rối ioan thân vả hê tiết niẻu
… chảy máu đường niệu, sinh dục như
0 tỉếu ra máu
0 xuất huyết đường tiết nìệu
Rối loan chung và tai vi tri dùng thuốc
- chảy mảu tại vị trí tỉêm
- chảy máu tại vị trí tiêm, chọc.
Xét nghỉêm
- huyêt ảp giảm
- thân nhiệt tăng
Chấn ihuơnn. ncớ độc vả cảc bìến chứng thủ thuăt
» thuyên tăc do mỡ có thẻ dân đên các hậu quả tường ứng tại các cơ quan liên quan
Các thủ thuât nôi khoa và ngoai khoa
truyện mảu
Thông báo cho bác sỹ những tác dụng không m0ng muỗn gặp phải khi sử dụng thuốc.
Quả Iiều
Trong trường hợp quá lìều có thể có tăng nguy cơ xuất huyết. Ở các trường hợp xuất huyết nặng và
kéo dải, nên xem xét cảch điêu trị thay thê.
Các đăc tính dươc lý hoc
Tenectepiase lả một protein tải tổ hợp hoạt hóa plasminogen chọn lọc trên fibrin, được dẫn xuất từ
t-PA nguyên thủy bằng cảch thay đối ở 3 vị trí trong cẳu trúc protein. Nó gắn vảo thảnh phần fihrin
của cục máu đông vả chuyển đổi một cảch chọn lọc plasminogen gắn ở cục máu đông thảnh plasmin
vả phân rã mạng fibrín cùa cục máu đông. Tenecteplase có tính chọn lọc trên fibrin cao hơn vả có
sức đề khảng iớn hơn đối với sự bất hoạt bởi chất ức chế nội sinh (PAI-l) so với chất t-PA nguyên
thùy.
Người ta nhận thẳy rằng sau khi sử dụng tenecteplase, sự tỉêu thụ ớg-antiplasmin (chất ức chế
plasmin ở pha 1ỏng) phụ thuộc vảo liễu tenecteplase từ đó lảm gỉa tăng mức độ sản xưắt plasmin
toản thân. Nhận xét nảy phù hợp với hiệu quả theo chủ định cùa việc hoạt hóa plasminogcn. Cảo
nghiên cửu so sảnh, đã ghi nhận có sự giảm dưới 15% fibrinogen vả dưới 25% đối vởỉ plasminogen
ở các đối tưọng được điều trị với liều tối đa của tecnecteplase (10.000 IU, tương ửng 50 mg), trong
khi đó alteplase lảm giảm xẳp xỉ 50% nổng độ fibrinogen vả piasmỉnogen. Không phảt híện thẳy sự
tạo kháng thể có ý nghĩa lâm sảng trong vòng 30 ngây.
Các dữ liệu về thông thương mạch máu từ các nghiên cứu với mạch đồ giai đoạn 1 và 11 cho thấy
rằng, sử dụng tenecteplase bằng cách tỉêm tĩnh mạch liều duy nhất cho hỉệu quả tùy theo liều trong
việc lảm tan các cục máu đông ở động mạch liên quan đến nhồi mảu trên bệnh nhân bị nhồi máu cơ
tim cẩp.
Một thử nghiệm đánh giá tỷ lệ tử vong trên quy mô lớn (ASSENT 2) trên khoảng 17.000 bệnh nhân
đã cho thấy tenecteplase cho hỉệu quả tương đương với alteplase trong việc giảm tỷ lệ tử vong
(6,2% cho cả hai nhóm đỉều trị trong vòng 30 ngảy) vả vỉệc sử dụng tenectepiase cho tỷ lệ xuất
huyết không phải nội sọ thẩp hơn đáng kể (26,4% so với 28,9%, p = 0,0003). Giảm nguy cơ chảy
máu được cho là liên quan đến tinh tăng chọn lọc của tenecteplase vởí tibrìn vả phảc đồ điếu trị theo
cân nặng.
Điều nảy đưa đến nhu cầu truyền máu thấp hơn đáng kể (4,3% so với 5,5%, p = 0,0002). Xuất huyết
nội sọ xuất hiện với tỉ lệ là 0,93% với tenecteplase vả 0,94% với alteplase. Trong 475 bệnh nhân
được đỉếu trị sau 6 giờ, có một sự khác biệt về mặt số học theo hướng có lợi cho nhóm sử dụng
tenecteplase về tỷ lệ tử vong trong vòng 30 ngảy (4,3% so với 9,6%), đột quỵ (0,4% so vởi 3,3%) và
xuất huyết não (0% so với 1,7%).
Nghiên cứu ASSENT 3 nhằm tối ưu hóa chế độ điểu trị tenecteplase dùng đồng thời vởi thuốc điều
trị tiêu huyết khối theo hướng cải thiện tỷ lệ thông thương mạch máu sóm và duy trì tưới mảu, chủ
yếu để khẳc phục tác động tăng đông mảu nghịch lý phát sỉnh từ sự phóng thích thrombin bị bắt giữ
do ly giải cục mảu đông. Ba chế độ điều trị đồng thời với chẩt chống đông máu được so sảnh ở
6.095 bệnh nhân:
Tenccteplase đủ liều + heparin khỏng phân đoạn (UFH) so với tenccteplase đú liều + heparin phân
từ thấp (LMW) (enoxaparin) so với tenecteplase nứa liều + heparin không phân đoạn + abciximab
đủ líều.
UFH được sử dụng theo khuyến cáo bới Hướng dẫn AHA/ACC với liều thẩp điếu chinh theo khối
lượng cơ thể như sau: Một lỉếu duy nhất tiêm tĩnh mạch nhanh 60 lU/kg (tối đa 4000 IU) ngay sau
đó truyền tĩnh mạch 12 IU/kg/gỉờ (tối đa 1000 IU/giờ) trong 3 giờ đầu tiên, sau đó dùng theo kết
quả aPTT cho đến 48 giờ để duy trì aP’1T ở mức 50-70 giây. Tỷ lệ từ vong sau 30 ngảy tương ứng lả
6,0%, 5,4% và 6,6%, chảy mảy nặng khi đang ở trong viện (không phải xuất huyết não) 2,16%;
3,04% và 4,32% và xuất huyết nội sọ 0,93%; 0,88% và 0,94%.
Phác độ lìều thẳp heparin không phân đoạn được điều chinh theo khối lượng cơ thể theo khuyến cảo
ACC/AHA được sử dụng trong ASSENT 3 cùng với tenecteplase cho thẩy giảm chảy máu toản thân
nhưng tỷ lệ xuất huyết não gíống như khi dùng phác đồ liều tắn công mạnh hơn với heparin không
phân đoạn được sử dụng trong ASSENT 2 mã không lảm mất hiệu quả.
ASSENT 3 PLUS, một nghiên cứu vệ tinh của ASSENT 3, được thiết kế để tìm hiếu vìệc điều trị
trước khi nhập vỉện, Hiệu quả và tính an toản cùa tenecteplase đủ liều + heparin khỏng phân đoạn so
với tenecteplase đủ liểu + heparin phân tư thấp (LMW) (enoxaparỉn) đã được đánh gỉả trên 1639
bệnh nhân.
Thiết kế nghiên cứu vả liếu điều trị được sử dụng giống với nghỉên cứu ASSENT 3. Đìếu trị tái tưới
mảu trước khi nhập viện với tenecteplase vả UFH hoặc enoxaparin cho phép điểu trị trong vòng 2
giờ từ khi triệu chứng bắt đầu xuất hiện trong › 50% bệnh nhân bị STEMI.
Từ các nghiên cứu ASSENT 3 vả 3 PLUS, điều trị kết hợp vởi enoxaparin trước khi nhập viện cũng
như đang nầm viện lảm gíảm tỷ lệ các biến chứng đột quỵ khi so sánh với đíếu trị kết hợp cùng
UFH: tỷ lệ tiêu chí gộp về hiệu quả ở ngảy 30 (tử vong, tái nhồi mảu, thìếu máu cục bộ kháng trị)
tương ứng lả 11,4% so với 15,4% trong ASSEN'I` 3 và 14,2% so với 17,4% ở ASSENT 3 PLUS.
Tuy nhiên, trong việc điểu trị trước khi nhập viện, tenecteplase với enoxaparin ở liều được sử dụng
đi kèm với nguy co gia tăng bị chảy mảu nặng và xuât huyêt não ở những bệnh nhân trên 75 tuòi.
Sự thông thương mạch vảnh vả dữ liệu kểt quả lâm sảng còn hạn chế cho thẩy đỉềư trị có thề thảnh
công sau 6 giờ khời phát triệu chứng ở những bệnh nhân nhôi mảu cơ tim câp.
Nghiên cứu ASSENT-4 PCI được thìết kế để chứng mình trên 4000 bệnh nhân có nhồi máu cơ tim
diện rộng liều đỉều trị trước đó với tenecteplase đủ liếu vả heparin không phân đoạn, liếu duy nhẩt
lên đển 4000 IU tiêm nhanh IU, trước khi tiến hảnh can thiệp động mạch vảnh qua da (PCI) tiên
phát trong thời gian 60 đến 180 phủt, có cho kết quả tốt hon so với khi chỉ tiến hảnh PCI tiên phát.
Thử nghiệm nảy bị kết thủc sớm sau khi chọn ngẫu nhiên được 1667 bệnh nhân do tỷ lệ tử vong cao
hơn về mặt số học ở nhớm PCI được dùng thêm tenecteplase. Sự xuất hiện các biến cố của tiêu chí
chính, gồm tử vong hoặc sốc tim hoặc suy tim sung huyết trong vòng 90 ngảy, cao hơn đảng kể so
với nhóm dùng trị liệu thử nghiệm tcnecteplase trước khi tiến hảnh PCI khấn cấp thường quy:
18,6% (151/810) so vởi 13,4% (110/819) trong nhớm chỉ tiến hảnh PCI, p = 0,0045. Sự khảo biệt
đáng kể nây giữa các nhóm về tiêu chí chinh tại thời đíếm 90 ngảy cũng đã có khi đang nhập viện và
tại thời diềm 30 ngảy. vẻ mặt số học, tất cả các yếu tố cùa tiêu chí gộp lâm sản g ùng hộ cho phác đồ
chi có PCI lần lượt như sau: từ vong: 6,7% so với 4,9% p = 0,14; sốc tim: 6,3% so với 4,8% p =
0,19; suy tim sung huyết: 12,0% so với 9,2% p = 0,06. Các tiêu chỉ phụ tải nhồi máu và phải lặp lại
can thiệp tái tưởi máu mạch vảnh đích tăng đáng kế ở nhóm được đỉều trị trước đó vởi tenecteplase:
tải nhổi máu: 6,1% so với 3,7% p = 0,0279; lặp lại can thiệp tái tưởi máu: 6,6% so với 3,4% p =
0,004].
Cảo tác dụng ngoại ý sau đây xuất hiện với tần xuất cao hon khi dùng tenecteplase trước khi PCI:
xuất huyết nội sọ: 1% so với 0% p = 0,0037; đột quỵ: 1,8% so với 0% p < 0,0001; chảy máu nặng:
5,6% so với 4,4% p = 0,3118; chảy máu nhẹ: 25,3% so vởi 19,0% p = 0,0021; truyền mảu: 6,2% so
với 4,2% 13 = 0,0873; tắc mạch đột ngột: 1,9% so vởi 0,1% p = 0,0001.
Các đãc tinh dươi: đông hoc
Tenecteplase là một protein tái tổ hợp được sử dụng dưới dạng tiêm tĩnh mạch có tác dụng hoạt hóa
plasminogen. Tenecteplase được đảo thải ra khói tuần hoản bẳng cách gắn vảo các thụ thể đặc hiệu
ở gan, sau đó được chuyền hóa thảnh cảc peptides nhò. Tuy nhiên việc gắn kểt cùa tenecteplase vảo
cảc thụ thể ở gan thẳp hơn so với chất hoạt hớa plasminogen mô (t-PA) nguyên thủy, dẫn đến thời
gian bản thải kéo dải. Các dữ liệu về sự phân bố trong mô và sự thải trừ được thu thập từ cảc nghiên
cứu với tenecteplase được đánh dấu đồng vị phóng xạ trên chưột. Cơ quan chinh tenecteplase phân
bố tới lá gan. Người ta còn chưa bỉết được liệu tenecteplase có gắn vảo protein huyết tương ở ngưòi
hay không và tới mức độ nảo.
Sau khi tiêm tĩnh mạch nhanh 1iếu duy nhất tenecteplase ở cảc bệnh nhân có nhồi mảu cơ tìm cẳp,
khảng nguyên tenecteplase cho thấy sự đảo thải 2 pha ra khỏi huyết tương. Trong phạm vi liều điều
trị, độ thanh thải cùa tenecteplase lá không phụ thuộc theo liều. Thời gian bản thải ưu thế ở pha đầu
cùa tenecteplase là 24 t 5,5 phủt (giá trị trung bình i độ lệch chuẩn) dải hơn gấp 5 lần thời gian
tương ứng cùa t-PA cơ thề. Thời gian bản thải sau là 129 i 97 phút và độ thanh thải huyết tương là
119 i 49 mL/phút.
Tăng trỌng lượng cơ thể dẫn đến tăng vưa phải độ thanh thải của tenecteplase vả khi tuối tăng lên
dẫn đên giảm nhẹ độ thanh thải. Nhin chung, ở phụ nữ có độ thanh thải thâp hơn so với nam giới,
nhưng điêu nảy có thẻ được giải thich là do khôi lượng cơ thê cùa nữ thường thắp hơn nam.
Do tenecteplase được đảo thải qua gan, ít có khả năng suy chúc năng thận sẽ lảm ảnh hướng tới
dược động học cùa METALYSE. Điều nảy cũng được ùng hộ bởi các nghiên cứu trên động vật. Tưy
nhiên, sự ảnh hưởng cùa suy chức nãng gan vả thận lên dược động học cùa tenectcplase ở người vân
chưa được nghìên cúu một cách chuyên biệt.
Tương kv
METALYSE tương kỵ với dung dịch dextrose.
Không nên thêm bất kỳ thưốc nảo vảo dung địch tíêm hay đường trưyền dịch cùa tenecteplase.
Bão guản
Bảo quản ớ nhỉệt độ không quá 30°C. Giữ lọ thuốc tiêm trong hộp thuốc để tránh ảnh sáng
Dung dich đã pha:
Độ ốn định cùa thuốc về lý tính và hóa tinh gìữ được suốt 24 giờ ở nhìệt độ 2 - 8°C vả trong 8 giờ ớ
30°C.
Về mặt vi sinh học, thuốc nên được sử dụng ngay lập tức sau khi hòa tan. Nếu không dùng ngay lập
tức, thời gian bảo quản và tình trạng thuốc trước khi sử dụng lá do người sử dụng chịu trảch nhiệm
và thường không quá 24 giờ ở 2 - 8°C hoặc 8 giờ ở 30°C.
Trình bâv
Lọ 30 mg bột dề pha dung dịch tiêm +
Xy lanh đóng sẵn chứa 6 mL nước pha tiêm
Lọ 40 mg bột để pha dung dịch tiêm +
Xy lanh đóng sẵn 8 mL nước để pha tiêm
Lọ 50 mg bột để pha dung dịch tiêm +
Xy lanh đớng sẵn 10 mL nước để pha tiêm
Han dùng
24 thảng kế từ ngây sản xuất
Sản xuất bời
Boehringer Ingelheim Pharma GmbH & Co.KG,
Birkendorfer StraBe 65 88397
Bìberach an der Riss — Germany
ĐỀ XA TÀM TAY TRẺ EM
ĐỌC KỸ HƯỚNG DÃN sớ DỤNG TRƯỚC KHI DÙNG
NỄU CÀN THÊM THÔNG TIN, XIN HÔI Ý KIÊN BÁC SỸ
Director of Applicant
Ợ ,…, % ớJ
MsLu ong
Boehringer
11Ĩ11 Ingelheimg
" PHÓ cục TRUỚNG
Jiỷuyẫn Alfaền ẵẨamắ
llG—bu
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng