













Bộ Y TẾ
cục QUẢN LÝ Dượq_,
ĐÃPHÊDUYỆT
Lân dâu: ..... Z 2l00'3017 ........
…-Ql…
Mẫu nhãn MAXXTRIPLE
100% real size
p 10 viên nén bao phim (1 vi x 10 viên)
4UM—PIS'X 6/
29680
' AỀD\\
\
` mm:mmzmmaum
ĩWMl-m … Mmll WB WWÙlG
irsnoaiiivuiụ'yiơL . (ỘNG TY ẹ\ioouvudnv na
……mm — : Aau mmquu
wmm … 'd'l : ; _ : …: mu uox
ưJnn ũỉnjc pmịị MAIW
ummn ' . wuum
kitiiiCiiiii.ig
\bn, \ ơmo dxamn
. › ,/
\\Ọ'ACJỈJ _ f/,/ eieo MJXSN
" ’ onu_mealxsmọs
ONW/XGS
…nnmamau uaum m np
'…MMWWIDWV w…pwuđlumbuvsuuswm
nnsmnwmuưmsm ':mcwmttưuọmnlm
W…MSW 'Misupmnuiơxaobnohm
“l… ! … *Email 1… mc ! Im im ’IID na
mu … -s-b SUMDG WA : w … m u
) Wooe … ……» Jimiwu huons ~~~~~~~~~~~~ … iimdm Jim»:
Mooz mm…a … ...................................... WB
Mooo ........................................... …ma Moon ........................................... muma
(ĩ?) Thuốc bán theo dơn
MAXXTRIPLE
K K AMPHARCO U.S A
Etavirenz 600mg
Emtricitabin 200mg
Tenofovir disoproxil fumarat 300mg
IUMWWMIWmJIW
zw …… m … um nw =mí mu
Mẫu nhãn MAXXTRIPLE
Túi nhôm 10 viên nén bao phim (1 vi x 10 viên)
100% real size
. Mẫu nhản MAXXTRIPLE
Hộp 30 viên nén bao phim (3 vỉ x 10 viên)
90% real size
v's'n OQUVMdIV NN v~sn OOIVNdHV SN
mm…ủm'nmnwumn HMW'WUNMIMM
'…whu'atewmmu wwunt'cuoùmeiim
:mi n~n … n~n mm Jim u sim
1 m…unmm thmannm
1
' 1… 'th ICIH
ĩ°WO'ỦWIXSN
²'°NWEIXSOIỌS
ĩ'°NWI)IGS
…Bmmum ,
IJJIIAIIIJJ IIJI
Mum bun www:
wwmuuomilì m
uuanmhm
mũmun’mtom
*thmmmu
W "
m ............ W
ĩWWNUWUIMIMIIIỈỤN
k' K AMPHARCO U.S.A
1Ễx) Thuốc bán theo don
c, w—
MA)O(TRIPLE
Efavlrenz 600mg
Emtricitabin 200mg
Tenofovir disoproxil tumarat 300mg
\\
. VỈI
Mẫu nhãn MAXXTRIPLE
Túi nhôm 30 viên nén bao phỉm (3 vi x 10 viên)
100% real size
MW.
Wln
Onlfflh.
i:Xưhùmdnsũm.
Wmmaơc.
imtiíọvhúlnuk
I
n_mn—
MANRIPLE
Ehvironz 900mg
Emmembin zoning
Tonofovir dhcpmxii iu… 300mg
k' L“ AMPHARCO U.S.A
i'mimiecunmem J-~__
MA)O(TRIPLE
Etavirenz 600mg
Emtricihbin 200mg
Tenolovir disoproxil lumnrnt 300mg
mhfflfih_
ttI—lilliil
…nmm
……m
mvuuuumuu.
lumtmmmum
ỪƯ ẦUMGUJJ
[' k' AMPHARCO U.S.A
® "" "“““ ;:.,;
Etnvlrcnz 600mg
Emtricitabine 200mg
Tonotovir disoproxil iumaratc 300mg
_ d … … —
mun- ụnmnnunmm
z…ị WV iỈJ
GZỊS ịeei %gg
tuẹtA 0: x i^ Oi) …:ud oeq uẹu uẹiA oo: d9H
7.%
B“llelXXVW UBLIU nẾW
Mãu nhãn MAXXTRIPLE
Túi nhôm 100 viện nén bao phim (10 vĩ x 10 viên)
70% real size
Mẫu nhãn MAXXTRIPLE
Vĩ 10 viên nén bao phỉm
100% real size
_ Étavirenz 600mg
mtricitabỏne 200 qv Al-IỔ , tricitabin 200mg
Dxll fumarate 300mg _ ỷìr ỗịsppẢ-oxil fumarat 300mg
… L … u: … xuh [ … phóI MI:
acc u.u PJtc cơnw wma…oouaa
bnnncou.sa ưư u…ous.A
A)O(Tl
Efav
Emtrfc
fovir disoproxil fur
MAẦTRIPLE
Efavirenz 600mg ²-_ ._
Emtricitabine 200mg `
Tenofơvir dísoproxil fumarate 300mg
unmklm
cóuewcmn
k'L' AIMAMO
IPLE MA)O(TRIPLE MI
Irenz 600mg Eíavirenz 600mg
itabin 200mg Emtrícmabine 200m
marat 300mg Tenofovir disoproxil íumarate 300m Te
…. sò lo sx: HD: lộ
? ưu wo u SA
Wlbhlúmby:
WROOU.IAPJSC
h'I' IIIPNAOCOUSA
Q%ÔO
MAXXTRIPLE
Efavirenz 600 mg - Tenofovir disoproxil fumarat 300 mg - Emtricitabin 200 mg
Thuốc kê đơn
Đọc kỹ hướng dẫn sử dụng Irước Iihi dùng
Đểxa tẩm lay Ire' em
Thông báo ngay cho bác sỹ hoặc dược sỹ những tác dụng không mong muốn gặp phải khi sử dụng Ihuốc
]. Thânh ghần: Mỗi viên nén bao phim chứa:
Efavirenz .............................................................................. 600 mg
Emưicitabin .......................................................................... 200 mg
Tenofovir disoproxil .......
(dưới dạng Ienofovir disoproxilfumarat ........................... 300 mg)
T á duợc: Lactose. Microcrystalline cellulosei Povidon.
Pregelatinised starch Natri lanryl sulfat, Colloidal anhydrous
silica. Natri croscarmellose` Magnesi stearat, Opadry II white,
Opadry Il pink.
2. Quỵ cách đóng gỏi:
Vi bâm nhôm — PVC; 10 viêrư vi.
Hộp ] vi/ túi nhôm, 3 vi| tủi nhôm hoặclO vil tùi nhôm.
3. Tính chẩt
Mã A T C: JOSAROó
MAXXTRIPLE lả phối hợp lỉều cố đinh cùa các thuốc khảng
virus efavirenz. emtricitabin vả tenofovir disoproxil fumarat.
…
Efavirenz lệ một chắt ức chế đặc hiệu enzym sao chép ngược
khộng có câu trúc nucleosid (NNRTI) của HIV—1. Efavirenz ức
chê không cạnh tranh enzym sao chép ngược HIV-l vả ức chê
không đáng kê enzym sao chép ngược của virus suy giảm miên
dịch typ 2 ở người (HIV—2) hay enzym ADN polymerase cùa tê
bảo (0, [3. y và ô). Emtricitabin là một nucleosidỳtương tự cùa
cytidin. Tenofovir disoproxil fumarat được chuyên đôi in vivo
thảnh tenofovir. một nucleosid monophosphat (nucleotid) tương
tự cùa adenosin monophosphat.
Emtricitabin vả tcnofovir được phosphoryl hóa bởi cảc enzym
tế bảo thảnh emtricitabin triphosphat vả tenofovir diphosphat
tương ứng. Cảc nghiên cửu in vitro cho thấy cả emtricitabin vả
tenofovir có thế được phosphoryl hóa hoản toân khi kết hợp
với nhau trong các tế bảo. Emtricitabin triphosphai vả tenofovir
diphosphat ức chế cạnh tranh enzym sao chép ngược HlV—l,
dẫn đến kết thúc chuỗi ADN.
Cả emtricitabin ưiphosphat vả tenofovir diphosphat lá các chất
ức chế yếu enzym ADN polymerase cùa động vật hữu nhũ và
không có bằng chửng về độc tinh đối với ty thể in vitro và in
víva
Efavirenz đã cho thấy hoạt tính kháng virus chống lại hầu hết
cảc chùng virus B không phân nhánh (phân nhóm A, AE, AG,
C, D, F, G, J vả N) nhưng hoạt tính kháng virus chống lại virus
nhóm 0 giảm. Emtricitabin cho thắy hoạt tính kháng virus
chống lại HIV-l phân nhánh A, B, c, D, E, F và G. Tenofovir
cho thấy hoạt tính khảng virus chống lại HIV-l phân nhánh A,
B, C, D, E, F , G và 0. Cả emtricitabin vả tenofovir đều đã cho
thấy tác động đặc hiệu theo chủng virus chống lại HlV—2 và
hoạt tính kháng virus chống lại HBV.
Trong các nghiên cứu phối hợp đảnh gíá hoạt tinh kháng virus
in vitro của efavirenz cùng với emtricitabin, efavirenz cùng với
tenofovir vả emưicitabin cùng với tenofovir đã ghi nhận tác
dụng khảng virus cộng lực cho đến hiệp lực bội tăng.
Sư đề kháng thuốc:
Sự đề khảng với ẹfavirenz có thể được chọn lọc in vitro và dẫn
vvrIv . ……
nhiều nhắt trong sự thay dối enzym sao chép ngược (RT) ở
những chùng virus phân lập từ nhũng bệnh nhân đã hồi phục ở
tải lượng virus trong nghiên cứu lâm sảng cùa efavirenz. Sự
thay đổi tại RT trong cảc vị trí 98` 100. 101, 108, 138,188, 190
hoặc 225 cũng được quan sát` nhũng ở tỷ lệ thắp hơn vả chi
thường kết hợp với K103N. Những hồ sơ đề kháng chéo với
efavirenz, nevirapin vả delavirdin in vitro đã chứng minh rằng
sự thay đồi KlO3N 1ảm mất nhạy cảm với cả ba NNRTI.
Khả năng có sự đề kháng chéo giũa efavircnz vả NRTIs là thấp
do khác nhau về vi tri tác động và cơ chế tác hoạt động. Khả
năng có sự đề kháng chéo giữa efavirenz vả NRTIs là thấp vi
khác nhau về vị trí tác động trên emzym liên quan.
Đề khảng với emtricitabin hoặc tenofovir đã được thấy trong in
virro và trong một số bệnh nhân bị nhiễm HlV-l do sự phát
triền cùa thay đối M184V hoặc M1841 trong RT với
emtricitabin hoặc sự thay đồi KôSR trong RT với tenofovir.
Những virus đề khảng emtricitabin có đột biến M184V/1 thi đề
kháng chéo với lamivudin, nhưng lại nhạy cảm với didanosin.
stavudin, tenofovir vả zidovudin. Sự đột biển K65R cũng có
thể được chọn lọc bời abacavir hoặc didanosin và dẫn tới giảm
nhạy cảm với các thuốc nảy cộng thêm lamivudin, emtn'citabin
vả tenofovir. Tenofovir disoproxil fumatai nên nảnh dùng ở
những bệnh nhân nhiễm HIV—l chứa đột biến KôSR Cả hai sự
đột biến KGSR vả M184V/1 vẫn hoản toản nhạy cảm với
efavirenz. Ngoài ra, sự thay đối K7OE trong HIV—l RT đă được
chọn 1ọc bởi tenofovir vả dẫn tới giám nhạy cảm ở nống độ
thấp với abacavir, emn-ícítabin, lamivudin vả tenofovir.
Những bệnh nhân nhiễm HIV-l biểu hiện ba hoặc nhiều đột
biến liên quan tởi cảc dổng đắng cùa thymidin (TAMs) bao
gồm cả thay đổi M4lL vả L2IOW trong RT cho thấy giảm tính
nhạy cảm với tenofovir disoproxil fumarat.
Dfflc đậng hgc
HẩQ [hu
ớ nhũng bệnh nhân bị nhiễm HIV, nồng độ đình trong huyết
tương cùa efavirenz đạt được sau 5 giờ và nồng độ ở trạng thải
ồn định đạt được trong 6-7 ngảy.
Emtricitabin được hẩp … nhanh chóng với nồng độ đinh trong
huyết tương đạt được sau khi uống 1-2 giờ.
Sau khi các bệnh nhân nhỉễm HIV-l uống một liều đơn 300
mg tenofovir disoproxil fumarat trong tinh trạng bụng đói,
nồng độ tối đa cùa tenofovir đạt được trong vòng ^t giờ và
cảc giá trị cmax lả 296 :t 90 ng/m] (h^ ^' biến lẽn 30%) và
AUC lả 2.287 i 685 ng°hlml (hệ số bí '“ 30%). Sinh khả
dụng đường uống cùa tenofovir từ ten fo ir disoproxil fumarat
ở những bệnh nhân uống lủc bụng đói oảng 25%.
’
Anh hưởng của thức ãn:
MAXXTRIPLE chưa được đánh giá khi có sự hiện diện của
thức ăn.
Khi dùng viên nang efavirenz với bữa ăn nhiều chất béo lảm
tăng AUC vả Cmax trưng binh cùa efavirenz lân lượtiả 28% và
79% sp với dùng thuôc lủc nhịn ăn. So với dùng [huôc lủc nhịn
ăn, liêu cùa tenofovir disoproxil fumarat vả emtricitabin khi
dùng với bữa ăn nhiêu châỊ béo hoặc bữa ăn nhẹ lảm tăng AUC
trung bình của tenofovir lân lượt là 43,6% và 40,5%, vả Cmax
lần lượt lả 16°o vả 13. 5% mà không ánh hướng tới sự tiếp xúc
cùa emtricitabin.
MAXXTRIPLE được khu_\ ẻn cảo dùng khi dạ dảy rỗng vi thức
ăn có thế lảm tăng tiếp xức cùa efavirenz vả dẫn tới lảm tăng tỷ
lệ gặp các phản ứng không mong muốn. Sự tiếp xúc cùa
tenofovir (AUC) đã được biêt lả sẽ thắp hơn khoảng 30% khi
dùng MAXXTRIPLE lủc dạ dảy rỗng so với khi dùng
tenofovir disoproxil fumarat riêng lẻ kèm với thức ăn.
P__hán bố
Efavirenz gắn kết nhiều với protein nong huyết tương người (>
9°o) chủ yếu lả albumin.
In vitro tỷ lệ emtricitabin gắn kết với protein trong huyết tương
người < 4% vả không phụ thuộc vảo nông độ trong khoảng
0 02 đến 200 ụg/ml. Sau khi uõng, emtricitabin được phân bố
rộng khắp cơ thể. Tỷ lệ nồng độ trung bình trong huyết tương
so với trong máu xâp xi Ibằng 1 và tỷ lệ nông độ trung bình
trong tinh dịch so với huy et tương xẩp xi bảng 4.
In vitro, tỷ lệ tenofovir gắn kết với protein trong huyết tương
người < 0,7% hoặc trọng huyết thanh người 7,2%, trong
khoảng nổng độ 001 đến 25 ụg/m]. Sau khi uõng, tenofovir
dược phân bố rộng khắp cơ thể
Chỵỵển hóa
Các nghiên cứu ưến người vả các nghiên cứu in vitro sư dụng
vi thể tế bảo gan người đã chứng minh rằng efavirenz đuợc
chưyền hóa chủ yêu Ibời hệ thống CYP thánh cảc chất chuyển
hóa hydroxy! hóa, tiếp theo sau đó lả quá trình g1ucuronìc hóa
của cảc chất chuyền hóa hydroxy] hóa nảy. Các chắt chuyển
hóa nảy thực chắt khộng có hoạt tính kháng HIV- 1. Các nghiên
cứu in vitro cho thắy CYP3A4 vả CYP2Bó lá các isozym
chinh chịu trảch nhiệm chuyển hóa cfavirenz vả efavirenz ức
chế isozym CYP 2C9 2C19 vả 3A4. Trong các nghiên cứu in
vitro efavirenz không ức chế CYP2EI vả chi ức chế CYP2D6
vả CYPIA2 ở những nồng độ cao hơn nồng độ đạt được trên
lâm sảng.
Sự hiện diện cúa efavirenz trong huyết tương có thế tảng lên ở
những bệnh nhân có bỉến thể di ưuyên đồng họp tư GS]6T cùa
isozym CYP2B6. Hiện chưa rõ ý nghĩa trên lâm sảng cùa mối
liên hệ nảy; tuy nhiên không thế loại trừ khả năng tăng tần suất
vả mức độ nghiêm trọng của các tác dụng không mong muốn
liên quan dến efavirenz.
Efavirenz đã cho thấy có cảm ứng CYP3A4 vả CYP2B6, dẫn
đến sự cảm ứng chuyền hóa cùa chính nó, điều nảy có thế có
líên quan trên lâm sảng ở một số bệnh nhân.
Chuyền hóa cùa emtricitabin bị hạn chế. Chuyển dạng sinh học
cùa emtricitabin bao gồm quả m`nh oxy hóa cùa cảc phân tử
thiol để tạo thảnh cảc đống phân lập thế không đối quang 3'—
sulphoxid (khoảng 9% liếu dùng) vả liên hợp với acid
glucuronic để tạo thảnh 2'-O-glucuronid (khoảng 4% liếu
dùng). Cảc nghiên cứu in vitro đã xác định rằng cả tenofovir
disoproxil fi1marat vả tenofovir đến không phải 1ả chất nển cho
cảc enzym CYP. Cả emtricitabin vả tenofovir đếu không ức
chế chuyển hóa cùa thuốc in vitro qua trung gian cùa bắt kỳ
đồng dạng CYP chính nảo ở người liên quan đến chuyến dạng
sinh học cùa thuốc Emtricitabin cũng không ức chế enzym
uridin 5'-diphosphoglucuronyl transferase enzym chịu trách
nhiệm cho sự glucuronic hòa.
T_hải trừ
Efavirenz có thời gian bán thải tương đối dải it nhất 52 giờ sau
khi uống liều đơn và 40 đến 55 giờ sau khi uống đa liều.
Khoảng 14—34% liếu efavirenz đảnh dấu phóng xạ đã được tim
thấy trong nước tiều và dưới 1% liều dùng được bải tiết trong
nước tiều dưới dạng efavirenz không đổi
Sau khi uống, thời gian bán thải cùạ emtricitabin khọảng 10
giờ. Emtricitabin được đảo thải chủ yêu qua thận với liêu dùng
được tim thấy hoản toản trong nước tiều (khoảng 86%) vả
trong phân (khoảng 14° /o.) 13% 1iều emtricitabin được tim thấy
trong nước tiêu dưới dạng ba chắt chuyển hóa. Độ thanh thải
toản thân cùa emtricitabin trung binh 307 ml/phủt.
Sau khi ưống, thời gian bản thải cùa tenofovir khoảng 12 đến
18 giờ. Tenofovir dược bải tiết chủ yếu qua thận bằng cả hệ
thống lọc và vận chuyền chủ động qua ông thận với khoảng
70— 80% liều dùng được bải tiêt trong nước tiều dưới dạng
không đổi sau khi tiêm tĩnh mạch. Độ thanh thải biền kiến của
tenofovir trung bình khoảng 307 ml/phủt. Độ thanh thải qua
thận được ước tính khoảng 210 ml/phủt, vượt quá tốc dộ lọc
cầu thận Điều nảy chi ra rảng bải tiêt chủ động qua ống thận
đóng vai trò quan trọng trong thải trứ tenofovir.
M
Dược động học cùa efavirenz, emtricitabin vả tenofovir
disoproxil fumarat sau khi dùng đồng thời dưới dạng bảo chế
n'êng biệt hoặc dạng phối hợp như MAXXTRIPLE thì chưa
được nghiên cứu ở những bệnh nhân nhiễm HIV bị suy thận
Cảc thông số dược động học được xác định sau khi dùng đơn
1iếu các chế phẩm emtricitabin 200 mg hoặc tenofovir
disoproxil 245 mg cho những bệnh nhân không nhiễm HTV với
mức độ suy thận khảc nhau. Mức độ suy thận được xảc định
theo độ thanh thải creatinin (CrCl) (chức năng thận binh
thường khi CrC1 > 80mllphút: suy thận nhẹ có CrCl = 50-79
mllphút, suy thận vừa có CrCl = 30—49 ml/phúL suy thận nặng
có CrC1 = 10-29 ninhủt).
Sự tiếp xúc của emtricitabin (%CV) trung binh tảng từ 12
ịig'h’ml (25° Jb) ở những đối tượng có chức năng thận binh
thường đến 20 ụg'hlml (6%) 25 ụg-h/ml (23%) vả 34 ụg'h/ml
(6° o) lần lượt 0 những bệnh nhân suy thận nhẹ. vừa và nặng.
Sự tiếp xúc cùa tenofovir (%CV) trung bình tăng từ 2 185 0
ng°hfml (12%) ở nhũng đối tượng có chức năng thận binh ò
thường đến 3 064 ng—h/ml (30%), 6.009 ng—h/ml (42%) và
15. 985 ụgOh/ml (45° ’o) lần lượtớ những bệnh nhân suy thận
nhẹ vừa và nặng.
Ở những bệnh nhân suy thận giai doạn cuối (ESRD) cần phải
chạy thận nhân tạo sự tiếp xúc với thuốc giữa các lần thấm
tách Lăng đáng kể, sau 72 giờ tăng lên 53 pg'h/ml (19%) dối
với emtricitabin, và sau 48 giờ tăng lên 42, 857 ngh’ml (29%)
đối với tenofovir.
Dược động học cùa efavirenz chưa được nghiến cứu trên
những bệnh nhân suy thận. Tuy nhiên, dưới 1% liều efavirenz
được đảo thải qua nước tiếu dưới dạng chưa chưyền hoá, nên
ảnh hướng cùa suy thận lên sự tiếp xúc của efavirenz có thế lả
rất nhó.
MAXXTRIPLE không được khuyến cáo ở những bệnh nhân
suy thận vừa hoặc nặng (CrCl < 50 ml/phút).
Những bệnh nhân bị suy thận vừa hoặc nậng cần phải điều
chinh khoảng cách liều emtricitabin vả tenofovir disoproxil
fumarat thì không được dùng thuốc kết hợp nảy.
S.!VJỉffl
Dược động học cùa MAXXTRIPLE chưa
trên bệnh nhân nhiễm HIV bị suy gan.
dùng thận trọng ở những bệnh nhân suy gan
MAXXTRIPLE không được dùng ở những ”nh nhân suy gan
nặng vả không được khuyến cáo ở những bệnh nhân suy gan
vữn Trong một nghiên cứu đơn liều efavírenz, thời gian bán
thải đã tăng gấp đôi ở một bệnh nhân bị suy gan nặng (Child-
Pugh— —Turcotte (CPT) nhóm C) nói lến khả năng tích lũy lớn
hớn nhiều. Trong một nghiên cứu đa 1iếu efavirenz cho thấy
dược động học của efavirenz ớ nhũng bệnh nhân suy gan nhẹ
(CPT nhóm A) không bị ảnh hướng đáng kể so với nhóm
chứng. Không đủ dữ liệu để xác định xem suy gan vừa hoặc
c ghiên cứu
TRlPLE nên
ẹ.
\\
\ .
FA
nặng (CPT nhóm B hoặc C ) có ảnh hướng tới dược động học
cùa efavirenz hay không.
Dược động học cùa emtricitabin chưa được nghiên cứu trên
bệnh nhân không nhiễm HBV với mửc độ suy gan khảc nhau.
Nói chung. dược động học cùa emtricitabin ở bệnh nhân nhiễm
HBV cũng giống với người khóc mạnh vả bệnh nhân nhiễm
HIV.
Liều đơn tenofovir disoproxil fumarat 300mg được dùng cho
những bệnh nhân không nhiễm HIV với mức độ suy gan khảc
nhau được xác định theo phân loại CPT. Dược động học cùa
tenofovir không thay đối dáng kể ở những bệnh nhân suy gan
do đó không cần điếu chinh liều cùa tenofovir disoproxil
fumarat đối ở các bệnh nhân nảy.
4. Chỉ __đ__inh
MAXXTRIPLE được chỉ định để điều trị nhiễm virus suy giảm
miễn dịch ở người typ ] (H1V- 1) ớ người lớn từ 18 tuối trở lên
với sự ức chế virus đối với tải lượng HIV 1 ARN < 50
copieslml đang ở giai đoạn điểu tn“ kháng virus phối hợp trong
hơn ba tháng. Bệnh nhán phải khỏng bị thẳt bại trong bất kỳ
liệu phảp điêu trị kháng virus nảo trước đó và phải được biêt
không bị nhiễm các chủng virus ần có các đột biến gây đề
kháng đảng kề với bắt kỳ một trong ba thảnh phần cùa
MAXXTRIPLE trước khi bắt đấu phác đồ điếu trị kháng
retrovirus đầu tiên cùa họ.
Không có dữ liệu hỗ trợ sự kết hợp của MAXXTRIPLE với
các thuôc kháng retrovirus khác.
5. Liều lfflg—cá0h dùng
Liệu phảp điều trị nên dược bắt đầu bới một bác sĩ có kinh
nghiệm trong việc điêu tii nhiễm HIV.
Người Ión
Liều khuyến cảo cùa MAXXTRIPLE lả uống một vỉên một lằn
mỗi ngảy.
Nếu bệnh nhân quên uống một iiều MAXXTRIPLE trong vòng
12 giờ so với thời điếm thường uống, bệnh nhân nên uông
MAXXTRIPLE cảng sớm cảng tốt và tiếp tục lịch uống thuốc
bình thường. Nếu bệnh nhân quên uống một liều
MAXXTRIPLE quá 12 giờ và nó gần với thời gian uống liếu
tiếp theo, bệnh nhân không nên uống bù liều đã quên và chỉ cần
tiếp tục lịch uống thuốc thường lệ.
Nếu bệnh nhân bị nôn trong vòng 1 giờ uống MAXXTRIPLE,
bệnh nhân nên uông 1 viên khác. Nêu bệnh nhân bị nôn hơn 1
giờ sau khi uống MAXXTRIPLE, bệnh nhân không cẩn phải
dùng liều khảc.
MAXXTRIPLE được khuyến cáo nên uống lủc bụng đói vì
thức ân có thể lảm tảng sự hiện diện của efavirenz và có thể
dẫn đến gia tăng tần suất các tác dụng không mong muốn
Người ta dự báo rằng sự hiện diện cùa tenofovir (AUC) sẽ thấp
hợn khoảng 30% khi uống MAXXTRIPLE lúc bụng đói so với
uống tenofovir disoproxil fumarat riêng lẻ cùng với thức ăn.
Để cải thiện khả năng dung nạp cùa efavirenz đối với các tác
dựng không mong muốn trên hệ thần kinh, nên khuyến cảo
uông thuốc trước khi di ngù.
Trong trường hợp có chỉ định ngưng đỉểu trị với một trong các
thảnh phần cùa MAXXTRIPLE hoặc khi cần điều chinh liếu
dùng, hiện có sẵn cảc dạng bảo chế efav'ưenz, emưicitabin vả
tenofovir disoproxil fumarat riêng biệt.
Nếu ngưng điều trị với MAXXTRIPLE, cần xem xét đến thời
gian bán thải dải cùa efavirenz và thời gian bán thải nội bảo dải
của emtricitabin vả tenofovir. Bời vì có sự biến thiên về những
thông số nảy giữa cảc bệnh nhân và những quan ngại liên quan
đến sự phảt ưiến đề kháng thuốc, nên tham khảo các hướng
dẫn rìiẨu rri Ĩ-ÍỈV m'ĩnu như wwn vắf đẫn l\'.f dn nm`mn tÌ-mốr—
Điều chinh Iiều: nếu uống đồng thời MAXXTRIPLE với
rifampicin cho bệnh nhân nặng từ 50 kg trớ lên, có thể xem xét
bổ sung 200 mg efavirenz/ngảy (tổng cộng 800 mg).
Suy lhận: không khuyến cáo dùng MAXXTRIPLE cho bệnh
nhân suy thận vữa hoặc nặng (độ thanh thải creatinin (CrCi) <
50 ml/phứt) do phải điểu chinh khoảng thời gian liều dùng của
emưicitabin vả tenofovir disoproxil fumarat.
Suy gan: dược động học của MAXXTRIPLE chưa được nghiên
cửu ớ những bệnh nhân bị suy gan. co thể điều trị với liếu
MAXXTRIPLE bình thường cho những bệnh nhân bị bệnh gan
nhẹ (Chíld-Pugh-Turcotte ('CPT), nhóm A). Bệnh nhân cằn
được theo dõi cẩn thận các tảc dụng không mong muốn, đặc
biệt các triệu chứng trên hệ thẩn kinh liên quan đến efavỉrenz.
Nếu ngừng dùng MAXXTRIPLE ở những bệnh nhân nhiễm
đồng thời HIV vả HBV thì những bệnh nhân nảy nên được
theo dõi chặt chẽ bằng chứng cùa bùng phát viếm gan.
Agười giả: MAXXTRIPLE nên được dùng thận trọng ở những
bệnh nhân cao tuổi.
6. Chống chỉ đinh
- Quá mẫn với hoạt chẳt hoặc bắt kỳ tá dược nảo cùa thuốc.
- Suy gan nặng (Child—Pugh-Turcotte, nhóm C).
- Dùng dổng thời với terfenadin, astemizol, cisaptid,
midazolam, triazoiam pimozid bepridil hoặc thuốc chứa dẫn
chất alkaloid nấm cựa gả (ví dụ như ergotamin,
dihy droergotamin, ergonovin, vả methylergonovin).
- Dùng đồng thời với voriconazol.
- Dùng đồng thời với các chế phẳm thảo dược chứa cò St. John
(vaericzmz perforatum).
7. Cảnh báo và thân trgng
Khi phối hợp với cảc thuốc khác
Do lá thuốc kết hợp liều cố định, MAXXTRIPLE không được
dùng đổng thời với các thuốc có chứa hoạt chắt emtricitabin
hoặc tenofovir disoproxil fumarat MAXXTRIPLE không được
dùng đồng thời với thuốc có chứa efavircnz trừ khi cân phải
điếu chinh liều, ví dụ với rifampicin. Vì do tuơng tự với
emtricitab'm, nên MAXXTRIPLE không được dùng đồng thời
với các chất đồng đắng cùa cytidỉn, ví dụ như lamivudin.
MAXXTRIPLE không được dùng đồng thời với adefovir
dipivoxil hoặc các thuốc có chứa tcnofovir alafenamid
Việc dùng đồng thời MAXXTRIPLE vả didanosin lả khộng
nên do sự tiếp xúc cùa didanosin tăng đảng kể khi đùng đổng
thời với tenofovir disoproxil fumarat iảm tăng nguy cơ cùa cảc
phản ứng phụ liến quan tới didanosin. Hiếm gặp nhưng viêm
tụy và nhiễm acid 1actic đôi khi gây tử vong đã được báo cáo.
Không có dữ liệu sẳn có vệ độ an toản vả hiệưquả cùa
MAXXTRIPLE khi dùng đông thời với cảc thuôc kháng
retrovirus khác.
Việc dùng đồng thời với cảc chiết xuất từ Ginkgo biloba không
được khuyến cáo
Nhiễm acid lactic, gan to nhiễm mỡ nặng
Nhiễm acid lactic vả gan to nhiễm mỡ n e cả những
trướng hợp từ vong đã được báo cảo khi d` cảc chất tương
tự nucleosid, kể cả tenofovir disoproxil f arat một thảnh
phần của MAXXTRIPLE kết hợp với các thuốc kháng
retrovirus khác. Phẩn lớn các trường hợp nảy là phụ nữ Béo phì
và sử dụng nucleosid kéo dải có thế lá các yếu tố nguy cơ. Nên
lưu ý đặc biệt khi dùng cảc chất tương tự nucleosid cho bất kỳ
bệnh nhân nảo hay những ngưòi không bị nhiễm đã biết có cảc
yếu tố nguy cơ đối với bệnh gan; tuy nhiên, đã ghi nhận được
nhưng trường hợp bệnh nhân nhiễm HIV- ] không có yêu tố
nguy cơ. Nên tạm ngưng điều ni với MAXXTRIPLE cho bất
kỳ hênh nhân nân hav nhữno noưởỉ khôno hỉ nhiễm vỏ nhữno
i.ll
_
hay nhiễm độc gan rỏ rảng (bao gốm gan to vả nhiễm mỡ ngay
cả khi không có tảng ưansaminase rõ rệt).
Chuyển từ một phác đồ điếu trị kháng retrovirus dựa trên
các chẩt ức chế protease (Pl)
Dữ liệu hiện cớcho thắy xu hướng những bệnh nhân đang điều
trị với phác đô kháng retrovirus dựa trên cảc chât ức chế
protease (PI) chuyênsang dùng MAXXTRIPLE có thẻ dân đên
giảm đảp ứng với điêu trị. Những bệnh nhân nảy nên được theo
dõi cân thận việc tăng tải lượng virus, vì cảc tảc đụng không
mong muốn trong hồ sơ độ an toản cùa efavirenz khảc với các
thuốc ức chế protease
Nhiễm trùng cơ hội
Bệnh nhân ưống MẠXXTRIPLE hoặc bất kỳ l_iệu phảp kháng
retrovimsthảc có thế tiêp tục phát triến các nhiêm trùng cơ hội
vả cảc biên chứng khảc cùa nhiễm HIV, và do đó nên duy tn'
theo dội lâm sảng chặt chẽ bới cảc bảc sĩ có kinh nghiệm ưong
việc điêu trị các bệnh nhân bị bệnh 1iên quan đên HIV.
Nguy cơ lây truyền HIV
Khi hiệu quả ức chế vỉrus của liệu pháp khảng retrovirus được
chứng minh là lảm giám dáng kế nguy cơ lây tnty ến qua đường
tinh dục, thì nguy cơ còn lại không thể loạihữ. Những biện
pháp phòng ngữa đê ngăn chặn vỉệc lây truyền nẻn dược thực
hiện theo hướng dẫn quêc gia.
Ẩnh hướng của thủ ăn
Dùng MAXXTRIPLE củng với thức ăn có thề lám tăng sự tiếp
xúc cùa efavirean và dẫn đến 1ảm tảng tỷ lệ gặp những tảc dụng
không mong muốn. Nến MAXXTRIPLE được khuyến các lá
dùng lủc dạ dảy rỗng, tốt lả trước khi đi ngù.
Bệnh nhân nhiễm đồng thòi HIV và virus gây viêm gan B
(HBV) hoặc C (HCV)
Bệnh nhân bị viêm gan siêu vi B hay C mân tính vả điếu trị với
iiệu phảp điếu trị kháng retrovirus kết hợp (cART) có nguy co
gia tảng cảc tảc dụng phụ không mong muốn trên gan nặng vả
có khả năng gây tử vong.
Các bác sĩ nên tham khảo các hướng dẫn điều tnị HIV hiện hảnh
dễ kiếm soát tối ưu nhiễm mv ớ những bệnh nhân nhiễm đống
thời HBV.
Độ an toản và hiệu quả của MAXXTRIPLE dối với điều trị
nhiễm HBV mạn tính chưa được nghiên cứu. Emtricitabin vả
tenofovir riếng lẻ vả kết hợp dã cho thấy hoạt tính kháng HBV
trong cảc nghiên cứu dược động học. Kinh nghiệm lâm sảng
giới hạn cho thấy emtricitabin vả tenofovir disoproxil fi1marat
có tác dụng kháng HBV khi được sử đựng trong liệu phảp điều
trị phối hợp kháng retrovirus để kiềm soát nhiễm HIV. Ngưng
điếu trị vởi MAXXTRIPLE ở bệnh nhân nhiễm đồng thời HIV
vả HBV có thế liên quan đến các đợt cấp bùng phảt cùa viêm
gan. Bệnh nhân nhiễm dồng thời HIV và HBV ngmg dùng
MAXXTRIPLE phải được theo dõi chặt chẽ biếu hiện lâm sảng
và cận lâm sảng trong it nhất bốn tháng sau khi ngừng diếu trị
với MAXXTRIPLE. Nếu thích hợp, tiếp tục lại với 1iệu phảp
điều tnị kháng viêm gan B có thể đảm bảo. Ở những bệnh nhân
có bệnh gan hoặc xơ gan tiến triền, không khuyến cáo ngứng
điếu ui vi dợt bùng phát cùa viêm gan sau điều trị có thể dẫn
đến gan mất bù.
Suy gan hoặc bệnh gan
Chống chi định sử dụng MAXXTRIPLE ở bệnh nhân suy gan
nặng và không khuyến cảo sủ dụng cho bệnh nhân suy gan
trung bình.
Bệnh nhân suy gan nhẹ (Child- -Pu-gh -Turcotte (CPT), nhóm A)
có thể được diều trị với liểu khuyến cáo binh thường cùa
MAXXTRIPLE. Bệnh nhân cẩn được theo dõi cẩn thận cảc tác
dụng không mong muốn, đậc biệt là các trìệu chứng trên hệ
thẩn kinh liên quan đến efavirenz.
Bệnh nhân có rối Ioạn chức năng gan trước đó kể cả viếm gan
mãn tinh hoạt động có tẩn suât chức năng gan bắt thường gia
tăng trong thời gian diếu trị với Iiệu phảp điếu trị kháng
retrovirus kết hợp (cART) vả cẩn được theo dõi theo thực hảnh
lâm sảng thỏng thường. Nếu có bằng chứng bệnh gan xấu đi
hoặc tảng transaminase huyết thanh hơn 5 lần mức giới hạn trên
binh thường kéo dải, lợi ích của việc tiểp tục điều trị với
MAXXTRIPLE cần được cân nhắc với những khả nâng nguy
cơ độc tính đảng kể đối với gan. Ở những bệnh nhân nảy cân
xem xét đến việc giản đoạn hoặc ngừng điêu tn_
Khuyến cảo theo dõi các men gan ở những bệnh nhân được
điếu trị với các thuốc khác gây độc gan.
Các báo cáo sau lưu hảnh ghi nhận suy gan cũng xảy ra ở
những bệnh nhân không có bệnh gan trước đó hoặc các yếu tố
nguy cơ có thể nhận biêt khảc. Cần quan tâm theo dõi men gan
cho tất cả bệnh nhân không kể đến rôi loạn chức năng gan trước
đó hoặc các yếu tố nguy cơ khác.
Các triệu chứng tãm thần
Các tác dụng không mong muốn về tâm thần đã được ghi nhận
ở những bệnh nhân điếu tn_ với efavirenz. Bệnh nhân có tiền sử
rối loạn tâm thần trước đó có nguy cơ cao hơn đối với các tác
dựng không mong muốn nghiêm ưọng về tâm thần Đặc biệt,
trằm cảm nặng thường gặp hơn ớ những người có tiến sử trầm
cảm. Bệnh nhân nến được biết rắng nêu họ có những triệu
chứng như trầm cảm nặng, rổi loạn tâm thần hay có ý định tự
tứ, họ nên liên hệ ngay lập tức với bác sĩ để đánh giá khả năng
cảc triệu chứng nảy có thể liên quan đến việc sử dụng efavirenz,
và nếu là như vậy, để cân nhắc giữa nguy cơ cùa việc tiếp tục
điếu trị so với lợi ích
Các triệu chửng trên hệ thần kinh
Các triệu chứng bao gồm nhưng không chỉ giới hạn ở cảc ưiệu
chứng nảy chóng mặt, mât ngù, buốn ngù, giảm tập trung và
giâc mơ bất thường thường dược ghi nhận nhu cac tác dụng
không mong muôn ở những bệnh nhân uống 600 mg efavirenz
môi ngảy trong các nghiên cứu lâm sảng. Các triệu chứng ưên
hệ thần kinh liên quan với efavirenz thường bắt đẩu trong vòng
một hoặc hai ngảy điều trị đẩu tiến vả thường hồi phục sau 2— 4
tuần đầu tiên. Bệnh nhân nên được thông báo rằng nêu chúng
xảy ra. những niệu chứng thường gặp nảy thường cải thiện khi
tiếp tực điếu trị và chúng không phải là các triệu chứng báo
trước của sự khỏi phát bất kỳ triệu chứng tâm thần nảo ít gặp
hơn sau đó.
Động kinh
Co giật đã được ghi nhặn ở những bệnh nhân uống efavirenz,
thường xảy ra khi có tiến sứ động kinh đã biết. Những bệnh
nhân uống đổng thời thuốc chống co giật được chuyến hóa chủ
yếu ở gan, như phenytoin, carbamazepin vả lphenobarbital, có
thề cẩn theo dõi nông độ thuốc trong huyết tương định kỳ
Trong một nghiên cứu tương tác thuốc, nồng độ carbamazepin
trong huyết tương giảm khi được sử dụng cùng với efavirenz.
Cần thận trọng đối với bẩt kỷ bệnh nhân nảo có tiến sử động
kinh.
Suy thận
Không khuyến cáo dùng MAXXTRIPLE ch bệnh nhân suy
thận vùa hoặc nặng (độ thanh thải creatinin < 5
Nếu điều trị MAXXTRIPLE phối hợp với n áng viêm
không thuộc nhớm steroid (NSAID), cẩn th dõi đẩy đủ chức
năng thận.
Nên tính độ thanh thải creatinin của tắt cả các bệnh nhân trước
khi bắt đầu điều trị với MAXXTRIPLE và chức năng thận (độ
thanh thải creatinin vả phosphat huyết thanh) cũng nên được
theo đõi sau 2-4 tuần điều trị, sau 3 thảng điếu trị và mỗi 3—6
tháng sau đó ở nhũng bệnh nhân không có yếu tố nguy cơ trên
thận Ở những bệnh nhân có tiền sử rôi loạn chức năng thận
H
C'
;…
~1I
hoặc ở những bệnh nhân có nguy cơ bị rổi Ioạn chức năng thận.
cẩn theo dỏi chức năng thận thường xuyên hơn.
Nếu phosphat trong huyết thanh < 1,5 mg/di (0,48 mmol/1) hoặc
độ thanh thải creatinin giảm xuống < 50 ml/phủt ớ bắt kỳ bệnh
nhân nảo uống MAXXTRlPLE. chức năng thận phải được
đánh giá lại trong vòng một tuần, kể cả đo đường huyết, nổng
độ kali trong mảu vả nống dộ g1ucose trong nước tiếu (bệnh lý
ống thận gần). Phải tạm ngưng điều m“ với MAXXTRIPLE ở
những bệnh nhân có độ thanh thải creatinin xác nhận < 50
mVphủt hoặc giảm phosphat huyết thanh đến mức < 1.0 mgldl
(0.32 mmol/l). Nên xem xét tạm ngưng điếu trị với
MAXXTRIPLE trong trường hợp chức năng thận giảm liên tục
mả không xảc định được nguyên nhân khác.
Ẩnh hướng trên xuong
Giảm mật độ khoảng cùa xương chậu vả cột sống vả những
thay đối trong chi dắu sinh học cùa xương so với ban đầu
thường cao hơn đáng kể khi điếu trị với tenofovir disoproxil
tìtmarat. Tuy nhiên, không có sự gia tăng nguy cơ gãy xương
hay bầng chứng về những bắt thường của xương có liên quan
trên lâm sảng trong hơn 144 tuần
Bất thường về xương (khòng thường xuyên góp phấn lảm gãy
xương) có thể liên quan với bệnh lý ong thận gân. Nếu nghi ngờ
có bất thường xương. bệnh nhân cân được thăm khám thich
hợp.
Hoại tử xuong
Một số trường hợp hoại từ xương đă được ghi nhận, đặc biệt ở
những bệnh nhân nhiễm HIV tiến triến vảđtoặc điểu …; lâu dải
với liệu pháp điếu trị kháng retrovirus kết hợp (cART). Bệnh
nhân nên dến khám bệnh nếu họ cảm thấy đau và nhức khớp,
cứng khớp hoặc di chuyền khó khăn.
Phản ứng da
Khỏng khuyến cáo sử dụng MAXXTRIPLE cho các bệnh nhãn
có phản ứng da đe dọa tinh mạng (ví dụ, hội chứng Stevens-
Johnson) khi điếu trị với một chất ức chế enzym sao chép
ngược không có cấu trúc nucleosid (NNRTI).
Đã quan sát thấy tải phân bốl tích tự mở trong cơ thể ở những
bệnh nhân được điếu trị vởi thuốc kháng retrovirus.
Trọng lượng vả nhũng thông số chuyển hỏa
Tăng trọng lượng, nồng độ lỉpid vả glucose trong máu có thể
xảy ra trong thời gian điều trị kháng retrovirus. Nhũng thay đổi
nảy có thể một phần ảnh hướng tới việc kiếm soát bệnh và lối
sỏng. Đối với lipid, có một sô ttuờng hợp bằng chứng về hiệu
quả điếu trị, trong khi tăng cân không có bằng chứng vững chắc
nảo 1iến quan tới điếu trị. Đối với việc giám sát lipid vả glucose
máu nên được thực hiện theo hướng dẫn điểu trị HIV. Những
rối loạn lipid nên được xử lý thich hợp về mặt lâm sảng.
Rối Ioạn chức năng ty thể sau khi phoi nhiễm trong tử cung
Cảc chắt tương tự nucleos(t)id có thể ảnh hướng đến chức năng
ty thế ở mức độ khảc nhau, vả rõ rệt nhất 1ả với stavudin,
didanosin vả zidovudin. Đã có báo cáo về rối loạn chức nảng ty
thế ở trẻ sơ sinh có HIV âm tính đã tiếp xúc trong tử cung vả!
hoặc sau khi sinh với cảc chất tương tự nucleosid. Cảc phản
ứng có hại chính đã bảo cảo là rối loạn huyết học (thiếu máu,
giảm bạch cầu) và rối ioạn chuyển hóa (tăng lactat, mảu nhiễm
mỡ). Những tác dụng phụ nảy thường lả tạm thời Những rối
Ioạn thần kinh khởi phảt muộn đã được báo cáo hiếm gặp (tăng
trương lực cơ, co giật, hảnh vi bất thường). Dù những rôi loạn
thần kinh nảy xảy ra tạm thời hay vĩnh vỉễn thì hiện vẫn chưa
rõ. Những phảt hiện nảy nên được xem xét cho những đứa trẻ
tiếp xúc trong tử cung với các chất tương tự nucleos(t)id có
những biểu hiện lâm sảng nặng không rõ nguyên nhân, đặc biệt
là các phát hiện về thần kinh. Những phảt híện nảy không ánh
hướng tới cảc khuyến nghị quốc gia hiện tại về việc sử dụng
liệu phảp kháng retrovirus ớ phụ nữ mang thai để ngan ngừa 1ây
truyền HIV.
Hội chửng tải kích hoạt hệ miễn dịch
Những bệnh nhân nhiễm HIV có hệ miễn dịch suy giảm
nghiêm trọng vảo thời điểm khời đằu cùa CART. phản ứng
viêm với những tác nhân gây bệnh cơ hội còn lại hoặc những
tác nhân gây bệnh không có triệu chứng có thể phát sinh và gây
ra cảc tình trạng lâm sảng nghiêm trọng hoặc lảm các triệu
chứng nảy nặng thêm. Thông thường những phản ứng nây dược
thẳy trong vải tuần hoặc thảng đầu khi khời đầu CART. Những
ví dụ Iiên quan như lá viêm võng mạc do cytomegalovirus
nhiễm mycobacterial khu trú vả’ hoặc toản thân vả viêm phối
do Pneumocystisjirovecii Bất kỳ tn'ệu chứng viếm nảo cũng
nên đánh giá và bắt đầu điếu trị khi cần thiết.
Nhũng rổi loạn tự miễn (như Ibệnh Graves) dã được bảo cảo lả
xảy ra khi có tái kich hoạt miên dịch, tuy nhiên thời gian khới
phát được báo cáo có nhiều thay đối và những trường hợp nảy
có thể xảy ra nhiểu tháng sau khi bắt đầu điểu tn'
Bệnh nhân nhiễm HIV-l đột biến ẫn
Nên tránh sử Idụng MAXXTRIPLE ở những bệnh nhân nhiễm
HIV- 1 đột biến an 1465R M184V/1 hoặc K103N.
Ngum 1611 tuổi
Nên sử dụng MAXXTRIPLE thận trọng với người lớn tuổi.
Trẻ em
Độ an toản vả hiệu quả cùa MAXXTRIPLE đối với trẻ em dưới
18 tuôi chưa được xác định.
Phụ nữcỏ khả năng mang thai
Phụ nữ nên tránh mang thai khi sử dụng MAXXTRIPLE.
Những phụ nữ có khả năng mang thai nên được thử thai trước
khi băt đâu điêu m“ với MAXXTRIPLE.
Trảnh thai ở nam và nữ._x
Nén sữ dụng thường xuỵe
ngản kểt hợp với các phỵ ~
điếu trị với MAXXTRIP '
O \
ơng pháp ngửa thai bằng mảng
ời gian bận hùy cùa efavirenz
' dụng đây đủ cảc biện phảp
Không nên sử dung MAXXTRIPLE ưong thai kỳ, trừ khi tinh
trạng lâm sảng của người phụ nữ cân được điều trị với
efavirenz/emtticitabủtenofovir disoproxil fumarat.
9. Sử dung thuốc cho phu nữ cho con bu ’
Efavirenz, emtricitabin vả tenofovir đã được chứng minh bải
tiết qua sữa mẹ. Không có đủ thông tin về ảnh hưởng cùa
efavirenz, emtricitabin vả tenofovir ở trẻ sơ sinh/nhũ nhi
Không thế loại trừ nguy cơ dôi với trẻ nhũ nhi. Vì vậy không
nến sử dụng MAXXTRIPLE trong thời kỳ cho con bủ.
Như một quy luật chung, phụ nữ nhiễm HIV được khuyến cáo
không nên cho con bú đê tránh lây nhiễm HIV cho trẻ nhũ nhi.
10. Ẩnh hưởng tới khả năng lải xe và vân hânh mảỵ mỏc
Chưa có nghiên cứu về ảnh hướng lên khá nảngl '
hảnh máy móc được thực hiện. Tuy nhiên, chóng
ghi nhận trong quá trinh điếu tii với efavirenz, e
nến ưảnh các cổng việccó khả năng gây nguy hiếm như lái xe
và vận hânh máy móc nêu họ có những triệu chứng nảy.
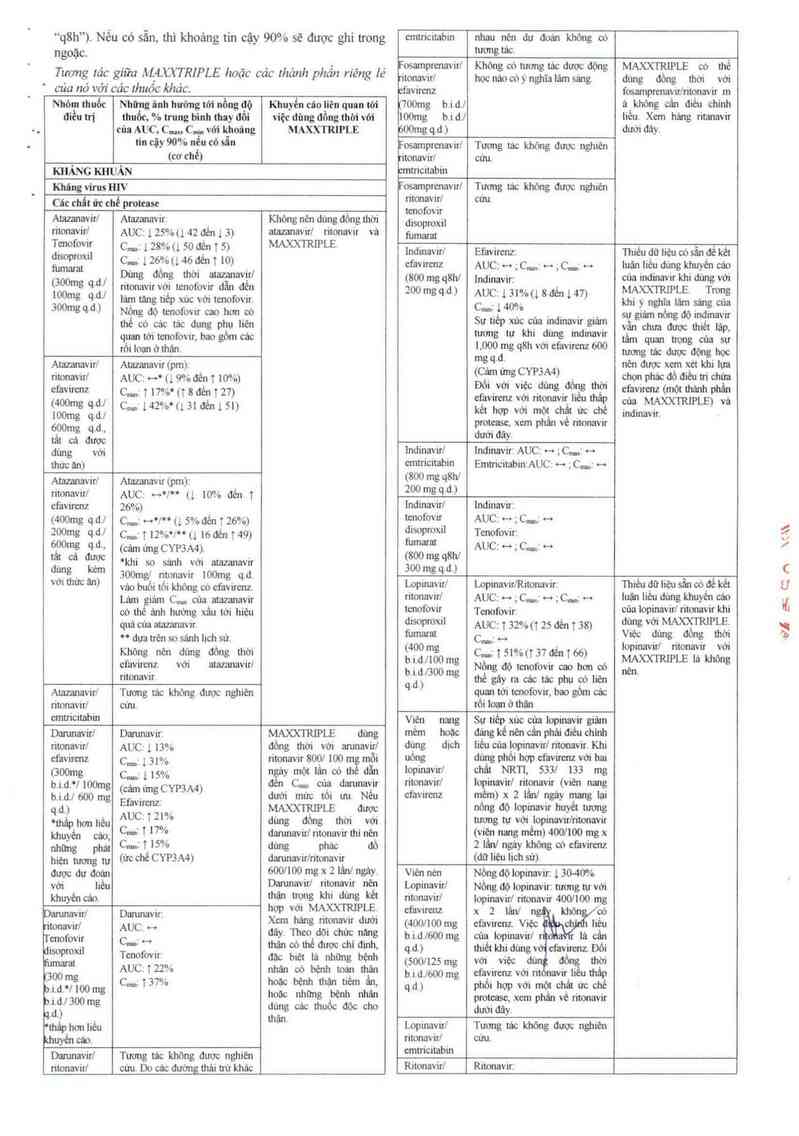
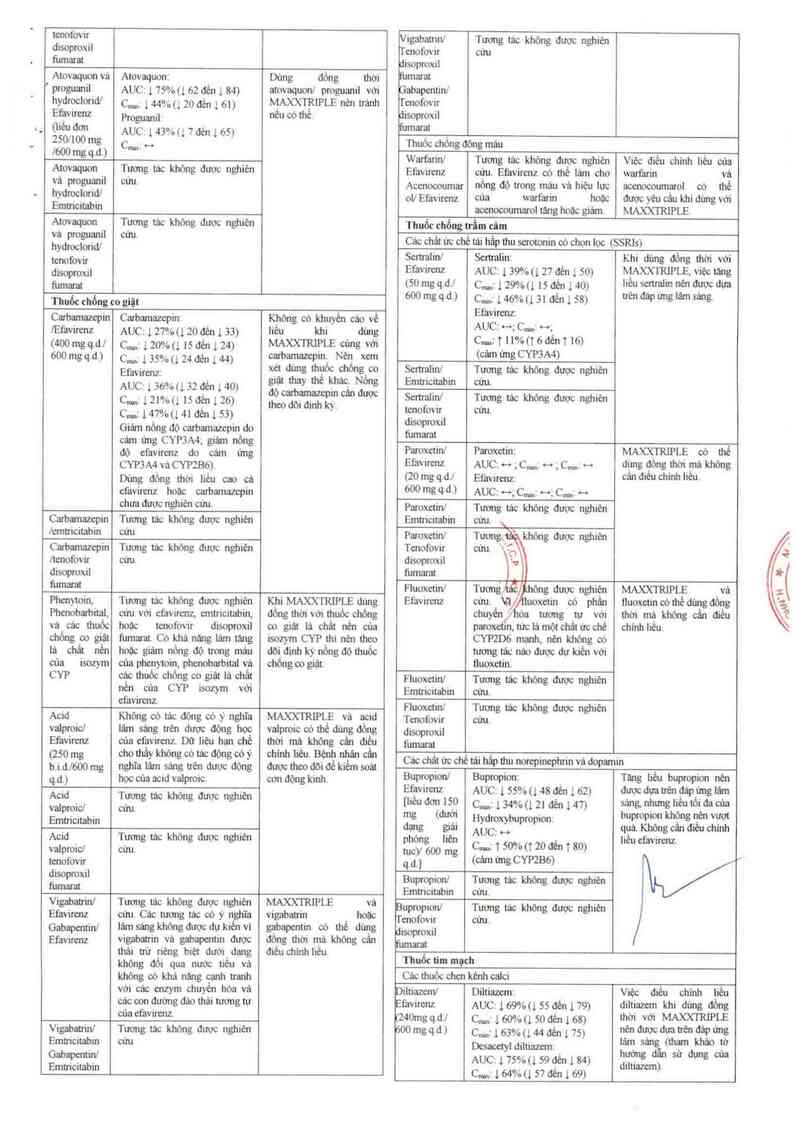
ll.Tươn tảc thuốc
Tương tảc giữa MẠXXTRIPLE hoặc các thảnh phần riếng [é
của nó với các thuôc khác được liệt kê trong_bảng sau (tảng
được ký hiệu là “1” ,giảm lả “1", không thay đội 1ả _++”, 2 lân/
ngảy lả “b.i.d.”, ] lân] ngảy lả “q.d.” vả ] lân môi 8 giờ là
“.q8h") Nếu có sẫn thi khoản tin cậ 90% sẽ được iưon emưicitabm nhau nên du đoán không có
g y 8
ngoặc. tucmgtảc.
, __ _ , _ . , ; … , osamprenavirl Không oó tương tác dược động MAXXTRIPLE có thề
_ Tuơng Ia_c giưa AêJLUTRIPLE hoạc cac thanh phan rieng le 'ionavirl học nàggóỷnghĩalám sang. dùng đồng thời với
cua no vơi cac lhuoc khac. favưenz fosamprenavir/ritọnavir …
Nhớm thuốc Những ình huờng tới nồng ao Khuyến cito liên quan tới 700mg b.id./ á_ khỏng cán điếu chinh
đỉếu tri thuỏc % trung bình thay đổi việc dùng đồng thời với 100mg bi.dJ Iiêư x… hhng ritanavir
. cũa AUC C.… Cụ với Ii_hoâng MAXXTRIPLE 600mg q.d ) dưới đảy.
“" Cậy 90% "ê“ °° săn Fosamprmavirl Tương tảc khòng đuợc nghiên
_ (W Chế) ritonavir/ cứu,
KHANG KHUẢN ớntncitabin
KhângvirusllIV Focamprenavirl Tương tảc không được nghiên
Cíc chẢt ửc chế protease ntonavưl CỬU—
. . . ! f "
Ạtaunnvư/ Amzanavưị Khỏng nến dùng đông thời dỉẳpỄíil
gtonafvưl AUC: 1 zs%u 42 đến 1 3) atazanav'ưl ritonavir và mm…
moovir ~ 2 o ; ² MAXXTRIPLE . . . › - … .
d,,opmxn Ê: _1 zễơý’ễ_l ẩẵẵẵỊ _Sỗ_ lnd1navưl Efavưenz Thiêu ớn liệu cớ sán ớe ket
fumamt , ' ° . _ cfawmz AUC: … ,c… … ,c...: … iuặn liẻu dùng khuyen cac
(300mg q_dj __PẸỄVJỄẸỆ _ẳị'ovẵlaẩẳnnaẵểfẩ (800 mg q8hl indinavir; cùa indinavir khi dùng với
lOOmg q.dJ lám tang tiếp xúc với tenofovir. 200 mgq.d) AUCZ 13l%(1 8 đén 147) MAXXTIẺIPLE - Trong
3ng q.d.) Nồng độ tcnofovir cao hơn có CmỈ .l 40% km ỉàằgu'a lâẵề ỉẩ~g cua
thể có càc tác dụng phụ liên Sự tiếp xúc của indinavir giảm Sẵng nỏng mavự
_ _ . . . .. , v chưađượcthiếtlặp,
quan tới tenofovư, bao gỏm các ẹfggằ W ỄỀ' dunfẫ …dmaVư tầm quan m của sự
… , m ới ' 600
_ ’Ô'IWẾ'hặn- mqu gq V ° W mmgtâcđuợcdộnshoc
Ạtamnnvư/ Atazanavư (pm): _ (Cám ,` CYP3 A 4 nẻn được xem x_et khi lưa
monavưl AUC: … (ị 9%đến t mv…) , ung ) . chọn phác ơộ điếu ni chủn
efavưenz c…: t 1m~ (`T8đến T 27) Đòi Với V*ệc dùng đôfẫ thời efavimnz (mộtthảnh phần
(400mg q.d.l C…J 142%'(131đến151) efavirenz với ritonavirl thấp của MA>OGRIPLE) vá
100mg q.dJ ka hw Vởi W. chẳl ức chế indinavir,
600mg qu protase xem phẵm vẻ monavir
'- " đười đả
tat cá được y'
đủng với Indinavirl lnđinavirt AUC: o-o ;C._z -—
thửc am emmcnabin EmưicitabmzAUC: … ; c...,
Ạtazanyavir/ Atazanavư (pm): (28()ẹtonTg qẫhi
ntonavưf AUC; …Ju (l mv… đến 1 gq- ~)
cfavirenz 26%) [nđinavir/ [ndinavírt
i4oomg q.dJ sz …vu 11 5% đền t 26%) tenofovư AUC; … ; C…: …
²00mg 441 c…: i 12%°l°° u lớđến 149) ỄiĨnon Tenofovir:
_mfZOO'cà'18 dqd› (cám imgCYPSA4). BOOM W AUC:~;C…:~
d“ Ể.Ợc °khi so sánh với atazanavir ắoo mg qd
uỂìẳl. em 300mg1 n'tonavir lOOmg q d mg q. ') _ , _ _ _
\Ởl ưc ần) vảo buối tối khỏng oó efavirenz. Lopmavưl bopmavirlRitonavir. Thiêu đữ liệu sử oớ đề kêt
Lảm giảm CtIIII của atazanavir ritonaviýrl AUCI **;Cmí H ;Cmii H luận Iiẽn dủ_ng khUYỞÌ ®°
cớ thể ảnh hướng xấu tới hiẹu te_mfovư_ Tenofovir: của loọu_Javưl ritomvử khi
quả của atamnavir. dlSOPTOXIỈ AUC: T 32% (T 25 đến T 38) dững với MA>OỂTRIPLẸ
“dưaưênsosảnhhchsủ. _fi4uỗloafaf sz.., ề'ệỹ fitlmg, dỏnẹ thả
Khỏng nên dùng dồng thời _ mg sz T 51% (T 37 đến 1 66) pmavự ntonavư v
et'avưenz với atazanavir/ gỉẵgẫ ỆỄ Nộng đo tenofovir cao hon có Ề’ễnfflpLE là khđng
ntonavư. qid- _’ me gây ra cảc m phụ có nen ’
Ạtamnạvirl Tương tác không được nghiên ` " quan tới tenofovir, bao gđm các
nton_avưl _ cưu. I'ÔI loạn ở thận
emtncnabm Viên nang Sự tiếp xùc của lopinavir giám
Darunavirl Damnavir: MAXXTRIPLE dùng mem hoặc dáng kẻ nencản phái diều chlnh
ritonavirl AUC: ) 13% đỏng thời với amnavirl dimg đich lièu cùal_opinavirl ritonavír Khi
ct'avirenz C… l 3 1% ritonavư 8001 100 mg mỗi uông dùng phỏi hợp efavixenz với hai
(3ng C…: 115% ngầy một lân cớ the dãn lopinavirl chất NRTI, 533/ m mg
b.i.d.'l lO(hng (cảm ứng CYP3A4) n Cml củạ darunavir ritonavirl | inavirl ritonavír (viên nang
b.i.df 600 mg Efavưenz dưới mủc tôi ưu. Nếu efaVitenz _ ) x 2 Iân/ ngây mang lại
qd.) AUC 21°' MAX)GTZIPLE được nông độ lopinavir huyết tương
omảp hơn ua, -T __ ’“ đùng đỏng thời với tương tự với _iopinavh/titmavit
khuyến cáo; C…² Ĩ l7f° darunavirl ritonavír thì nên (vìên nang mêm) 400l100 mg x
nhũng phát Cmầ T_ l>°/ồ dùng phác dò 2 lân/ ngảy không 00 efavinenz
hiện tương tự (ức chế CYP3A4) darunavirlritonavữ (dữliệu lịch sử).
được dự ớoi_in 6001 100 _mg>f ² lân_l ngay. Viớn nớn Nớng độ lopinavư. tao-4tm
VỚỈ , liêu Darunavư/ ntonavư nện LOPỈn²VỪJ Nồng độ lopinavir: tương tự với
khuyên cán. M" "% kh' dung kẻ' ritomvíri lopinavirl ritonavír 400/100 mg
Damnavir/ Damnavir: hợp VỚI MẠmIPLEI efavirenz X 2 lẩn] °Ỏ
ritonavirl AUC1 … X°m Mnẽ m_°naYlf dưỞl (400/100mg efavirenz. Việc iiệu
Tenofovir C… H đây' Th°o.dõ' Chưc nặng b.i.d.l600 mg của lopinavirl r 111 cân
W°XỈÌ Tenofovir ẵẵn ỄỀệtmỉảdưnĩicũncễi Ểầhh› q.d.) thiết khi dùng v cfavirenz. Đối
Ềmmam . ' . . . (soonzs mg vớt việc dủn thới
(300mg ÊUC. 13ị2/% Lthm bcgnhbenh toẩnèmtlẵn b_jÃdjôOO mg cfavirenz với rit ir_l' lhẩp
b.i.dfl lOOmg …… T 0 hẵ nhũn mặỂệnh nhẩl'i q.d,) phố! hợp Với một chál _ửc chế
b_i_dj 300 mg _ g , protcese, xem phán vé monavư
qđ) dung các ỨIUÔC dÔC cho dưới đảy
' . . th . .
'thâphợn liẻu ặn Lop…avư/ Tương tâc không được nghiến
khuyến cáo, ritonnvirl cứu.
Darunavirl Tương tác không được nghiên emtncnabm
ritonavir/ cửu. Do các đường thái trư khác Ritonavirl Ritonavir;
al s CA \…
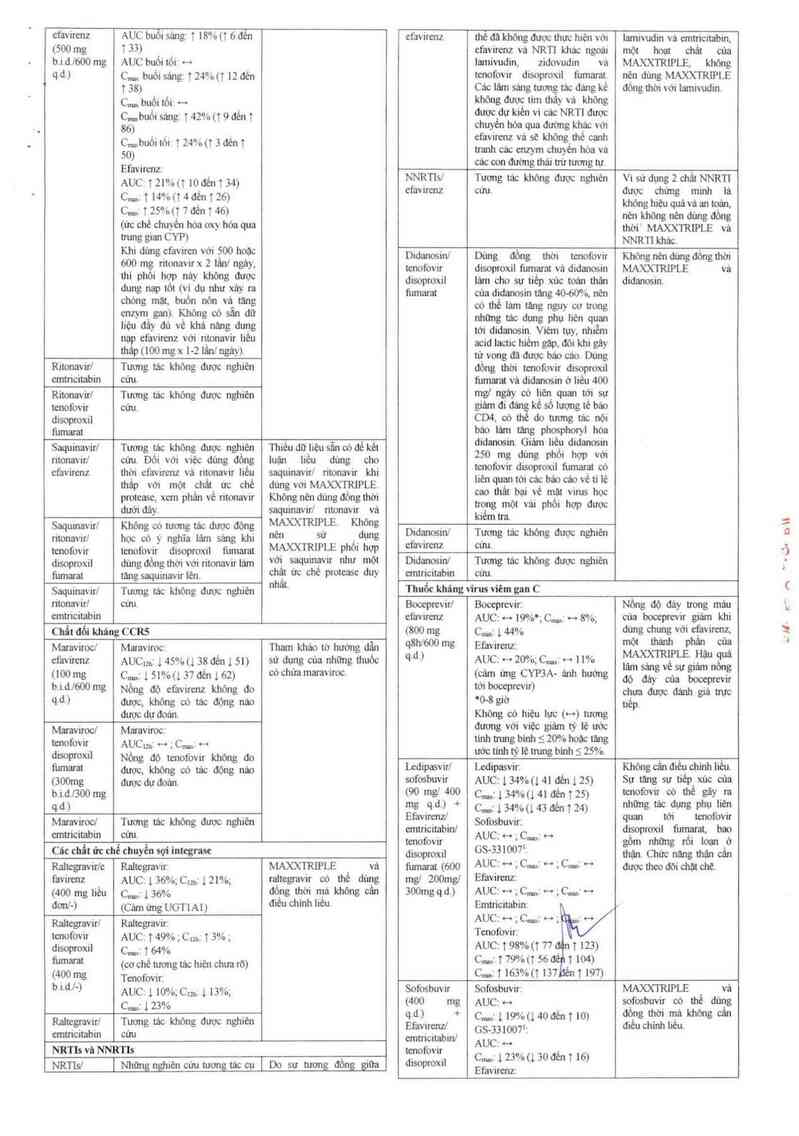
efavirenz AUC buôi sáng: ĩ 18%(1 6 đén efavirenz thế đã khỏng được thưc hiện với Iamivudin vả emưicitabin,
(500 mg ) 33) _ _ efavirenz vả NRTI khác ngoải một hoạt chẩt của
b.id.lóOO mg AUC buôi tới … lamivudin, zidovudin vả MAXXTRIPLE, khỏng
q.đ) C… buổi sảng: T 2.m,u 12 đến tenofovư đisoproxil ủmamt. nện đùng MAXXTRIPLE
T 38) Các lảm sang tương tác đáng kê đông thời với lamivudin.
C… buổi tối. ._, khỏng được tim tháy vả khòng
c..., buổi sáng: T 42% tt 9 đến T gg°°éẵưhầlaến VÌ ẵ°__ưRkThláẳưẫ
86) “Y °“² g ' . V
., ,, _ . favưenz vá sẽ không thế canh
Cmbuôllor t mm 3 đênT ° - ~ .
tranh các cnzym chuvén hớa va
q .
ễễwirm_ các oon đường thải tn“: tuong tự.
AUC: TZl%(T lOđến T 34) NNRTIsJ Tương tác không được nghiên Vi sủ dựng2 ohãt _NNRT]
C… 1 14%(t4đếnpỏ) efavưeuz cưu. được chưng mmh lả
" 75°" 7 đề 46 khỏng hiệu quả vá an tọản,
C,… T.~ "°Ư ,"T ), nẻnkhôngnếndủngđông
(ưc chế chuyên hoa oxy hoa qua thời“ MAXXTRIPLE và
*…{ìe Ẹ… CYP) __ NNRTI khác
Ả dung Ff²V“F“ Vf2“_ẫoo °°ac Didanosin/ Dùng đổng thời tenofovir Khóng nẻn đủng đống thời
_ …; mmavưx W "8²² tenofovir disoproxil fum_ami vả didanosin MAXXTRIPLE va
2“ Ph°' "g °?Yd 'dẵng °°°° disoproin lâm cho sự tiep xúc toán thân didanosin.
ung MP (VỊ " ° xảy … fumamt của didanosin tang 40…60%, nến
chớng mặt, buon nón Và. tang có thế lảm tảng nguy co trong
enzym gan) Khòng có săn dữ nhũn tảc d !"
Iiệu aâ dũvếkhánăn dun g “"gphu ”"quan
nạp efayvirenz với ri_tonaẵir _liếẫ tới didanosin. Viem tụy, nhiễm
acid Iactic hiem gặp, đội khi gảy
RitonaVưl Tương tác khỏng được nghiên đờng thời tenofovir disoproxil
emtricitabin cửu… fumarat vá didanosin ớ liếu 400
Ritonavirl Tường iảc khòng được nghiến mgl ngáy CỐ Iien_ quan tội SƯ
mfovừ cứu. giảm đi đáng kể sô lượng tế bảo
đisopmxil CD4,oóuiédommgtácnòi
fumarat báo Iám W18 PhO_SPhOM hớa
Saquinavirl Tương tác không được nghìên Thiếu dữ_hệu sẵncớđế kẻi ỂẸ_anosdeiiảm heằi didanosằ
ritonavirl cửu. Dòi với việc dùng đồng luận liếu dùng cho m~__ofmể d.““ẵ °“, ', °°° “có
et'avirenz thời efavirenz vả ritonavir liêu saquinavid ritonavir khi l'ên 0Vư tớliscếẵếoễláo . ; tH
thâp với môt _chât_ ưc chê dùng với MAXXTRIPLE. ' Ềẳ_"b è “’“ h é
protease, xem phân về ritonavír Khỏng nên dùng đòng thời Ế ai v hmốa ấ'msd oc
dưới đây. saquinavitl ritonavir vá kiẩẵtrĩột vai p ' Ợp ược
Saqumav'ưl Khỏng có nmng tác dược động MAXXTRIPLE Không , , ,
ritonavirl học cớ ý nghĩa lâm sảng khi nên sử đuns Ẹẻ°ề"°sw T."°“g ""“ kh°"ễ °“°° "Ế“Ổ“
tenofovir tenofovir đisoproxil fumarat MA~WLE Phố' hợp _th cuu. _
disoproxil dùng đòng thời với ritonavirlảm với saquinavir như môt Didanosuv Tương tác không được nghiên
fiimaral tang saquinavirlến. Châl ức CỦ proteese duy uutncitabm cứu.
Saquinavir/ Tượng tác không được nghiên nhấL Thuốc khlng virus viêm gan C
n'tonavirl cứu Booeprevirl Boceprevir Nồng độ đáy trong máu
ỆỂicẩỀbin efavirenz AUC: … 19%ỵcmgẹnga; ẳũa bo_ẹeprcv`g_ ỄẺT khi
t 'kháng ccns (800 mg C…1144% ung c U_ng v , …gl
vaich Mamviroc: Tham khảo tờ hướng dẫn °Wfflo mẽ Efavirenzz …,Ể’Ễề °“ẵ
cfavircnz Aucm: i4smi 38đến 1 51) Sử dung của nhũng thuóc “" AUC² "²0%ẻCv-v “’ "% lâm è "am" ẵẵ
(100 mg Cmt 1 51% U 31 đến 1 62) cóchửa mamviroc. (cảm ứng C_Y_P3A— ánh hướng đó ỉđTygềuẳự Ễloocpllìcvigr
b-i—d-l600 mg Nổng độ efavirenz không đo tới boc_eprevư› chư, m dủ giả …
qtd.) được, không cớ tbc động nao 'ữ8 glờ tiếp,
dược dự đoán. Không có hiệu lực (H) tương
Maraviroc! Mataviroc; đương Với việc giảm tỷ lệ ước
tenofovir AUC… … _ C…ỉ … tinh tmng_binh _<_ 20% hoac tảng
dỈ9°Pmxịl Nổng đỏ tenofovir không đo ước ttnhtylệtmngbinhs25% . . .
fumamt được, khòng có mc động náo deipasvirl Leđipmvìr: Khôngcánđiẻu chinh 1iếu.
(3ng dưth dựaoan sofosbuvir AUC: 134%(141 đếnl 25) Sư mng_ Sư_tiẻp xúc của
bimoo mg t90 meJ 400 c...:mmuu ớ_éni25) tenofovư_ 00 thể sây _…
Zinaẵằl'tfẫ’gn Ịẵuơng '“ khỏ“g đwc “gh'en emtricitabin/ SAOJỂỄỀỈLC -… disoproxil fiunamt, bao
' tenofovir ’ ’ l""’ gồm những rõi loạn ở
Cic chất ửc chế chuyền sợi integrase disoproxil GS-331007 ỉ man Chức năng man càn
Raltegmvirle Raltegravir: MAXXTRIPLE vả finnarat (600 ^UC_I H 2 C…J ** ; C… H được theo dõi chat che.
favirenz AUC; 136%-,cmz & 21%-, m_ltegravir cớ ihè dùng mgl 2an Efavưenzz
(400 mg liều c.,.,: 136% đổ_ng thời mã không cản 300mg q.d.) AUC: … ;c...,: .…. ~,c…~ -›
dơnl-> (Cám ủng UGTIAI) đtễu chỉnh liều Emtricitabin;
Raltegmvirl Raitegravir. AUC: -o_ ;C…1 H ;
tenofovir AUC: T 49% -_ cm T 3%; Tenofovnr.
disoproxil sz 164% AUC: T98%(1 77 _ T 123)
fumW (cơ chế tương tác hiệu chua rõ) C…² T 79% (T “’ T W)
(400mg Tenofovir Cm: T 163% (T 137 1 197)
b.i.d.l-) AUC: l 10%; cm 1 13%; Sofosbuvư Sofosbuvir: MAXXTRIPLE vả
Cqu 123% (400 mg AUC: … sofosbuvir có ổ dùng
. . qd) + C…tll9"/(Ị40đếnĩlO) đổnst scển
Wvựl Tương tác không được nghiến Efavirenz/ _ 0: điếuchinh liều
emtncnabm cưu emm'cntabin/ GS ễ31007,
NRTIs vã NNRTIs tenofovir ỀU jl`ẫ'3% U 30 dẻ__ 1 16)
NRTIsI [ Những nghiến cửu tươngtảc cu I Do sự tương đồng giữa disoproxil EỆỊirenz:
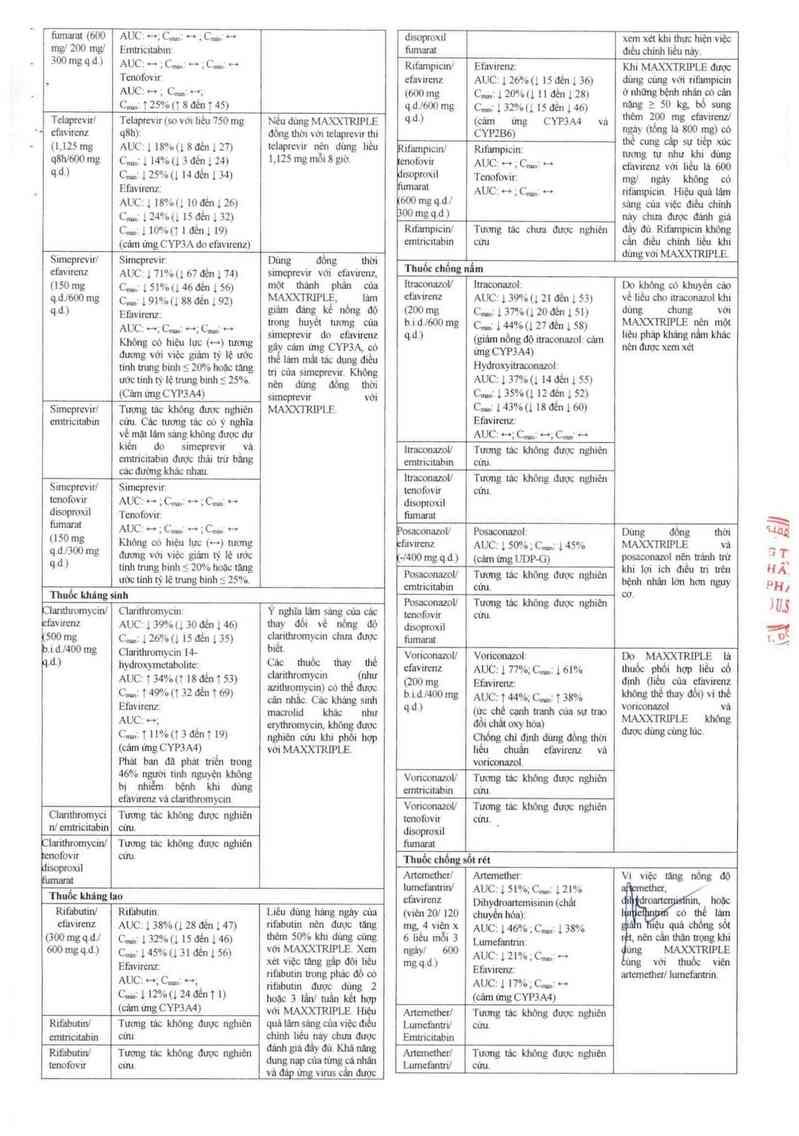
ch n\l
Ẹ"A`
.' It
fumamt (600 AUC: ~;C,…z … ;CÚ; H
mg] 200 mg] Emtricitabin:
300mqu> AUC: … ;c…ị … ;c,,.: …
_ Tenofovir
AUC: H ; C…t H;
C.… izsvm 8đến ị 45)
Tclapưvirl Tclaprevư (so với liếu 750 mg Nếu đủng MAXXTRIPLE
' 1 cfavirenz q8h): đổng thời với telaprevư thi
(1.125 mg AUC: l 18%(18đẻn127) telaprevir nén dùng Iiếu
q8W600 mg c…: 1 14%(13 đến 1 24) 111²5 mg mổi 8giờ-
c… c…: 125%(1 14 đển 1 34)
Efavirenz:
AUC:l 18%(1 10đếnịZb)
C…: 124%(1 15 ơảm ị32)
c… 1 10%(1 1 đến], t9)
(ơâm ửng CYP3A do efavirenz)
Simeprevirl Simeprevir: Dùng đổng thời
efavirenz AUC: 171%(167 đến 1 74) simeprevir với ct`avirenz,
tlSOmg c.…ziswbti4ớớệntsới mỏt thảnh phân cùa
qth600 mg c..., 191%u 886ển192) MAXXWPL—ỆJ . làm
q.d.) Efavirenz: giám đ__ang_ kê nỏng độ
, tmn u et mơn cua
ỔUCỊ H; C",“1 H; C"“"1 H simẵưcviry do efẵrirenz
đương với Việc giảm ty lệ ước [ảm mải tảc dụng điều
ước tinh tỷ lệ tnmg bmh S 25%. nè,, đủng đống mời
(Cảm ửng CYP3A4) simeprevir với
Simeprevirl Tương tác không đuợc nghiên MAXXTRIPLE.
emưicitabin cữu. Các tương tác có _v nghĩa
vè_mặt Iám sảng không được dự
kiến do simeprevir vít
cmtricitabin được thải trứ bảng
các đường khác nhau
Simeprevir/ Simeprevir:
tenofovir AUC; … ;Cm; … ;c…; H
dỈSOPfOXỈI T enofovir:
fumarat AUCtH;C…:H;C…:H
(150mg Không có hiệu lực (H) tương
quJ3mmg đương với việc giảm tỷ lệ ước
q-d ) tinh trung binh 5 20% hoAc inng
uớc itnh tỷ lệ u-ung binh 5 25%.
Thuốc khíng sinh
Clanthromycinl Claritlưomyctn Ý nghĩa_lâm _sảng_của các
efavirenz AUC: 139%11 30 đến 146) thay dỏi vê nỏng dó
500 mg c…: 126%(1 15 đến 135) cl_ệrithromwm chưa dược
b—i—dJ4OO mg Ciantiưomycin 14- b'a- ,
qđ.) hydroxymetabolite: Các thuỏc_ thay thế
AUC: ị 34%(1 18 đến 1 sai ẳ'ziaẵưúggẹăẵẫìm ___é ấ'_l_hơlcf
ỄỆJiJẵ/mnđênĩỏg) cânnh_ắc.Cáckhángsinh
AUC: …; T.…ỉẵ'ẳẻẳ ~ khẩcng i'ịềẳ
C....: T 11%(13 đẽnT 19) nghiến ểumm phối hợp
(cả… ửng CYP3A4) với MAXXTRIPLE.
Phát ban đã phát tn'ển trong
46% người tinh nguyện không
bị nhiễm bệnh khi dùng
efavirenz vá clasittưomycm.
C1a-ithromyci Tương tác không đuợc nghiên
nlemtricỉtabin cửu.
Claiithromycin/ Tương tác không được nghiến
fovir cữu.
Eisoptoxil
Thuốc …ng 1ao
Rifabutinl Rifabutin: Liều đủng hảng ngây cùa
efavircnz AUC: l 38%(1 28 đến 147) rifabutin nen đươc tăng
@… mg q.dJ C…Ắ 132%(1 15 đến 146) Mn 50% khi dùng cùng
600msq~dờ c… 1 45%u 31 đến l sc> “" fflffl _x_°!“
Efavirenz: x_ét v'ẹ.c tăng gâp đỏ' ~haỂ
AUC- «-r c —~- 'Ff²°“°° °°“Ể °°°°. dô °°
“"““ ’, nfabưtin đượcđung2
9… l l²°f°U ²°°ênT U hoạc 3 lần/ tuần kết hợp
(cảm ứng CYP3A4) với MAXXTRIPLE. Hiệu
Rifabutinl Tương tác không được nghiên quảlãm_sảngcủaviệc điếu
emtricitabin củu. chinh liẽudànảấ cthỂ_aàẵtẩnợc
- — › đánh giá y ủ. g
ảỂẳ'”h I:.ĩ’“ … *… … …… …………n
và đáp ửng virus câu được
disq›mxil xem xét khi thưc hièi việc
fumamt điều chính liều náy.
Rifampicm/ Efavirenz Khi MAXX1R1PLE được
efavircnz AUC: 126%(1 15 đến 1 36) dùng củng với rifampicin
«›oo mg c…: 120%(1 11 đến 1 28) ở nhũng bệnh nhán_oócân
q.dJớOO mg ij132%(1 lSđếnl4ớ) “ống ì 50 kể °°ể“"g
q-d-t (cám ửng CYP3A4 vá ““em .².00 mg ef²“W
CYP286) nEềt’ ®“8 .'² 800 _ng °,°
, _ _ , thê cung dp su nep xuc
Rifampicm/ Rifampicm: tương … như khi dùng
°“°f°V"_ AUC= ~ -,c…: ~ efavirenz với iiẻu la 600
|SOpmxll Tcnofovir: mg] ngày không có
_ ²“ AUC: … —,c....: .…. rifampicin. Hiệu quả lâm
600mg «1… sáng của việc điếu chính
300 mg q-d) nảy chưa được đánh giá
Rifampicinl Tuong tảc chưa được nghiên đặyđủ._Rifampicin_khòng
emtricitabin cưu cán điếu chinh lieu khi
dùng với MAXXTRIPLE.
Thuốc chống nấm
1traoonazoll lưaconazolz Do không có khuyến cáo
cfavitenz AUC: 1 39%( 1 21 ơéu ) 53) vé liều cho itmoonamt khi
tzoo mg c…:mmuzoaệnị 51) dùng chung _ vữi
bi d…1600 mg cm: 144%(127 đến158) M^ỀOỂTRIPLE 'F`" m°²
q.d.) (giảm nồng độ iưaoonazol- cám liệu phap khmg nèn khác
ứng CYP3A4) nèn được xem xét
Hydroxyiưaconazolr
AUC: 137%(1 14đến 1 55)
C…:135%(1 12đến152)
C…1143%(1186ến160)
Efavirenzz
AUC: M; C...,ị …;sz …
Inaconazol/ Tương tác khớng đuợc nghiên
emtn’citabin cứu.
lưaconazoll Tương tác khỏng được nghiên
tenofovir cứu.
disoproxil
fumarai
Posaoonazoll Posaconazol: Dùng đống thời
=favirenz AUC: 1 50% ; an 145% MAXXTRIPLE vả
4400 mg q.d-t (cảm ứng UDP-G) p___cỉsat_aona_zt_t_l t_t_Ề_ớớthutễit
Posaconazoll Tương tảc khớng đuợc ngtiến ' C” 'c ' m n
cmtricitabin củu. ễẳnh nhá" lớn hon nguy
Posaconazol/ Tuong tác khóng được nghiên '
tenofovir cứu.
dimproxil
thmam
Von'oonazoll Von'oonazol: Do MAXXTRIPLE lả
efavirenz AUC; ị 77%;C…1 161% thuốc phối hợp lỉếu cố
(200 mg Efavirenz: định ỮỈỒF °Ủa efan
b—i-df4OO mg AUC: 144%; c…: 1 38% WB °ìê Thay dổÙ vì lhỀ
…” (ưc chế cạnh ưanh uia sự trao "°“… V
đòichẩt oxy hớa) mẸEI. W’“g
Chổngchiđịnhtỉmgđổngthời ưọc g g"°'
iiếu chuẩn efavirenz vả
vorioonazol.
Vorimnazoll Tương tác không được nghiên
emtn'citabin ct'iu.
Voriconazol/ Tương tác khỏng được nghiên
tenofovir cửu.
disoproxil '
fumarat
Thuốc chống sốt rét
Anemetherl Anemether: Vì việc tớng nống độ
I…ncfmuirv AUC: ị sm;c..,: izm , —
=favimnz Dihyớroanmisinin (chât 0… ` ' _ h0ồc
(Viẽtl 20l 120 chuyền hóa); OỎ lhê lám
mc_4 viên x AUC: ias%;c…: 138% Ở quá Chống Sử
6 iieu mỗi 3 Lumefmửm, nến cân thận ưọng khi
"gáy’ 60° AUC: l 2… 4 c…: -› “"8 Ế`WOỮRIPLE
mg q.d) Ei'avirenz I VỚI thuốc -wen
~ ancmeùerllumeỉanmn
AUCIl 17%;C…1 ~
(cám ủng CYP3A4)
Artemether/ Tương tác không được nghiên
Lumcfanưil cửu.
Emtricitabin
Anunetherl Tuơng tác khỏng đuợc nghiên
Lumcfantri/ cửu.
"Ắ’ Éll
5~l
.…
F›
dã
__…
tcnofovir
disoproxil
fumamt
Atovaquon vá Atovaquon: Dùng đổng thời
" proguanil AUC ], 75%(162 đến 1 84) atovaquonl proguanil với
hydrocloridl cm 1440 ’GU 206ến161) MAXXTRIPLEnẺnIIÉnh
Efavirenz Proguanil nểu có thế
Giềuđm AUC 143%(1 7 đến 1 65)
2501100mg c [_ ' ’
f600mgq.dù “““"
Atovaquon Tương tác không được nghiến
vả pmguanil cứu.
hydrocloridl
Emm'citabin
Atovaquon Tan tác khỏng đuợc nghiên
vả proguanil cửu.
hyđtoclon'dl
tenofovir
disoproxil
lìimmat
Thuốc chống co giật
Catbmachin Carbamazepin: Không có khuyến cáo về
lEfavirmz AUC: l27%(120đến133) liêu khi dùng
(400 mgq.d.l C,… 120%(1 [saén 124) MAXXTRHẶLE củng với
6°O…sQ—d-> C:… … … 244en144) °²fbafĩtwmạ Nên, …
Efavirenz. x_ét dung thựỏc diông_co
AUC: 136%(132đến140) ẫỂ' "“, y mé kntiỄnrẵỀ
C…121%(t150611126) thoodõ1địnhkỷ
C.....1147%(141đẻ11153)
Giám nống độ cerbamazepin do
cảm ửng CYP3A4; giảm nông
độ cĩavirenz do cảm ứng
CYP3A4 vá CYPZBô).
Dùng động thời liếu cao cả
efavirenz hoac carbmnazepin
chua được nghiên củu.
Cmbamazepin Tương tác khỏng được nghiên
lcmưicitabin cứu
Carbamazepin Tương tác khỏng được nghiến
Itenofovir cữu.
disoproxil
fumamt
Phenytoin, Tương tảc không được nghiến Khi MA)O(TRJPLE dùng
Phenobathital, cửu với efavirenz, emtricitabin, đồng thòi với thuốc chổng
vả cảc thuốc hoặc tenofovir disoproxil co giật lả chẩt nến của
chống co giật fumarat. Có khá nãng lảm táng isozym CYP thi nên theo
lá chẩt nền hoặc giảm nờng độ trong máu dỏi định kỳ nồng độ thuốc
của isozym cùa phenytoin, phenobarbital vả chốngco giật.
CYP các thuốc chổng co giật lả chất
nến của CYP isozym với
efav'ươtz
Acid Không có tác động có ý nghĩa MA)O(TRIPLE vá acid
valproic] lâm sảng tiến dược động hợc valproic có thể dùng đồng
Efavirenz eủa efavirenz. Dữ liệu hạn chế thời mả khớng cẩn điều
(zsoing chothẩykhôngcótácđộngcớy' chinhiièu Bệnhnhâncần
b.i.dJóOO mg nghĩa 1âm sảng trến dược động được theo dõi để kiếm soát
q.d.) học của acid valproic. cơn động kinh.
Acid Tương tac khớng đuợc nghiến
valproic! cứu
Emtricitabin
Acid Tương tác không đuợc nghiên
valpmid cửu.
tenofovir
disoproxil
fumarat
Vigabaưin/ Tường tác không được nghiên MAXXTRIPLE vả
Efavirenz cứu. Các tương tác 06 ý nghĩa vigabatn'n hoặc
Gabapentin/ lâm sang không được dự kiến vi gabapcntin có thể dùng
Efavirenz vigabatrin vá gabapentm được đồng thời ma không cấn
thải tn: yiùig biệt dưới đạng điếu chinhliếu.
không đổi qua nước tiếu vả
không có khả nảng cạnh tranh
với các cnzym chuyến hóa vả
các con đường đảo thải tưtmgtự
của efavirenz
Vigabaninl Tương tải: không được nghiến
Emtricitabin cửu
Gabapentinl
Emưicitabin
Tương tảc khong được nghiên
củu
Thuốc chống đớng máu
Warfarin! Tường tác không được nghiến Việc điếu chinh liếu cùa
Efavirenz cứu. Efavirenz có thế lảm cho warfarin vậ
Acenocoumar nổng độ trong máu vả hiệu lực acenocoumạml có thẻ
oV Efavitenz của warftưin hoac được yéu cãi] khi dùng với
aoenocoumarol tăng hoặc giảm. MAXXTRIPLE.
Thuốc chống trÌm cảm
Các chầt ức chế tái hẩp thư serotonin có chọn loc (SSRIs)
Semaiin! Semnlin: Khi dùng đồng thời với
Efavirenz AUC: ) 3g%u 21 aén 1 so) MAXXTRIPLE, việc tảng
('50 mgq.d.l C…:129%(1 |_; đến 140) Iiểu semaiin nén được dưa
600mgqu) C…:l46%(lSlđếnlổB) Ưêndápfmg'ámSảnẽ
Efavirenz:
AUC: ~; C…: …_
c…:r 11%(16đến1 ló)
(câm ửng C YP3A4)
Semalin/ Tumg tải: khòng được nghiên
Emtricitabin củu.
Semalin/ Tường tảc khóng được nghiến
tcnofovir cứu.
disoproxil
fiunamt
Paroxctinl Paroxetin: MAXXTRIPLE có thể
Efavircnz AUC: -~ ;C…z -~ ;C…ị ~—o dimg ỢỒHS ỨÌỜl má khớng
(20 mg q.dJ Efavirẹnz cân điếu chinh liếư.
600 mẹ 4… AUC: …; c…: ~; c…; …
Paroxctin/ Tượng tác không được nghiên
Emtricitabin cửu. \
Paroxctin/ Tươngt khóng đuợc nghiên
Tutofovir "
disoproxil
fumarat
Fluoxetinl MAXXTRIPLE vả
Efavircnz tiuoxctin oó thể dùng đồng
' thời má khớng cần điểu
parox n, tức lả một chât ửc chẻ chinh Iiểu.
CYon6 mạnh, nến không có
tường tảc náo được dự kiến với
tluoxetin.
Fluoxetin! Tướng tác không được nghiến
Emtricitabin cửu.
Fluoxetin! Tượng tác khóng được nghiến
Tmofovir cửu.
disoproxil
fumarat
Các chẩt ức chế tái hẩp thu norepinephrin vá dopamin
Docacetyl diltiazem:
AUC: l 75%u 59 đến 1 84)
c…: 164%(1 sv đến 1 69)
Bupropionl Bupropion: Tìng liều bupropion nến
Etạvirenz AUC: 1 55% (1 48 ơén 1 62) đươc dụa trên ợápợt’mg lãm
[liếuđon 150 an134%(T Zlđếnl47) sáng,nhưngliếutôiđacùa
mg (dum Hydroxybupropion: bupropion không _nèn Vượt
đang giải AUC, _ quá… Khớng cấn ớieu chinh
ẵ_hcớỷigsoolẫtể C…1 T 50%(120đẻn T 80) ltều efavưenz.
q_d_l (tám i'mg CYP286)
Bupropionl Tương tác không được nghiên
Emtricitabin ct'm.
Bupropion/ Tương tác không được nghiên
Tenofovir cún.
disoproxil
Thuốc tim mọch
Các thuốc chẹn kènh calci
Diltiazem/ Diltiazem: Việc điếu chinh 1iều
Efavirenz AUC: 169%(1 ss đến 179) diltịazcnj khi dùng đông
240mg q,dj c…; ị 60%(1 SOđển 1 68) thời với MAXXTRIP_LE
600mgqđ) C…:lỏ3'VoU44đếnl7S) nẻnđượcđưaưùiđápưng
lâm Sảng (tham khử lờ
hướng dẫn sử dung của
diltiazem).
…vh“'“ " 4._
Việc điểu chinh liẻu của
các thuốc chen kếnh calci
với MAXXTRIPLE nên
duợc dụa trên đáp ứng lâm
sáng (tham khác tờ hướng
dẫn sữ dụng của các thuốc
chen kenh calci).
Nồng độ cholesterol nến
được theo dõi đinh kỳ.
Việc điêu chinh 1i_éu cùa
atorva_statin có thế được
yếu câu khi dùng chung
với MA)O(TRIPLE
m…… khảo tờ huớng dẫn
sử dụng của atorvastatin).
Nổng độ cholcsterol nèn
đuợc theo dõi định kỳ.
Việc điếu chinh Iiếu của
pmm_tatin có thế được
yếu câu 1dii dùng chung
với MAXXTRIPLE.
(Tham khảo tờ hướng dẫn
sử dụng cùa pmvastatin).
C.….z 162%(144 đẻn 175)
N—monodcsmethyl diltiazem.
AUC l37%(l17đếnlS2J
C…: 1 28%(1 7 đến 1 44)
c....z umu l7đến 1 52)
Efavirenz:
AUC:1 11%(1’ SđềnT 18)
c…:t 16%(T ớttệ'n T 26)
C… 1 13%(T lđến 1 26)
(cám ứng CYP3A4)
Việc tảng các thòng sớ dược
động hợc cùa efavirenz không
được xem lả oó ý nghĩa về mặt
lâm sâng
Diltiazeml Tumg tảc idiỏng được nghiên
Emtricitabin cửu
Diltiazun/ Tuong tác khỏng được nghiến
Tenofovir cưu
disoproxil
fumarat
Verapamii, Tương tảc không được nghiến
felodipin, oứư với faviren; emtricitabin,
nifedipin vả hoặc tenofovir disoproxil
nictưđipin fumarat. Khi efavirenz dùng
đỏng thời với calci chẹn kenh lè
mới cơ chát cùa enzym
CYP3A4, 00 thế lảm giám nỏng
độ ưong máu của cớc thuôc
chẹn kênh mlci.
Thuốc hạ lipid
Các chẩt ức chế HMG Co-A reductase
Atorvastatin/ Atorvastatin:
Efavirenz AUC: ) 43%(1 34 đến 1 50)
(10 mgq.dJ c…: 1 mm iớẻn ị 26)
600 mg Q—d-) 2-hydmxy atorvastatin:
AUC: l 35%(1 13 đển 1 40)
c…: ) 13%(100ến123)
4-hyđroxy atorvastatin:
AUC: 14%(lOđến 131)
c...,zi4mtịọớén 1 51)
Tổng các chẩt ửc chế HMG Co-
A reductme oc hoạt tinh
AUC; ) 34%(121 dến ) 41)
c…: & 20%u 2đến ) 26)
Atorvastatin/ Tương tâc không được nghiên
Emtricitabin cứu.
Atorvastan'n/ Tương tác không được nghiến
Tenofovir cứu.
disoproxil
ftưnarat
Pravatatin/ Pravastatm:
Efavirem AUC: 140%(“1260ển1 51)
(40mgq—dJ c...,z ) 18%(159đến1 12)
600 mg q.d.)
Pravastatùml Tương tác khỏng được nghiên
Fmưicitabin cún.
vaastatinl Tương tác khỏng đuợc nghiến
Tenofovir cứu.
đisoproxil
fumaxat
Simvastatin/ Simvastatin:
Efavirenz AUC: l 69%(1 62 đến ) 73)
Go mg q.dJ c…: 1 76%(1 63 đến 1 79)
600 mg qxi) Simvastatin aciớ
AUC: ) 58%(139 đến 168)
c…: 1 smuszơén ) 58)
Tống các chất i'm chế HMG
Co-A reductase có hoat tinh
AUC: 160%(152đé11168)
c…: 162%(1550ến178)
(cảm ứng CYP3A4)
Dùng đống thời favìrcnz với
atorvastatin, pravastatin hoac
simvastatin đã không ảnh hướng
tới giá trị AUC hoặc C… cùa
efavirenz
Sưnvastatin/ Tương tảc khỏng được nghiên
Nồng độ cholesterol nén
được theo dõi đinh kỳ.
Viec điếu chinh liễu cùa
simvastatin có thể được
yếu cáu khi dùng chung
Với MAXXTRIPLE.
(Tham khác tờ hướng dẫn
sử dưng của simvmtatin)
lềẻâảủ
Emtricitabin cứu
Simvastatin/ Tương tả: không được ngh1ẻn
Tenofovir cửu
disoproxil
fưmarat
Rosưvastatin Tuong tác không đuợc nghiến MAXXTRIPLE vả
[Efavirenz ct'm Rosuvastatinphảnlớn được msuvastatin có thể đt`tng
đảotháidướidangkhớngđối đốngthờimảkhòngcẩn
qua phản, do đó tương tác với điếu chinhliểu.
efavirenz không được dự kiến.
Rosưvastatin Tương tảc không được nghiến
lEmn-icitabin cứu.
Rosưvastntin Tương tác khỏng được nghiến
ỉTenofovir cứu
disoproxil
fưmamt
Phương pháp tránh thai bảng hormon
Đường uỏng; Ethinylocsnadnol.
Ethinyloesưa AUC: H; C…: …;
diol+ _ c,..nzisoxou 14đếnl25)
NOTBCSUW Norelgestromin (chẩt chuyến
Efavưenz hỏa):
(0v035 mg+ AUC: t 64%(1 62 đến 1 67)
0,25 mg q dl c…: l 46%(1 39 đến 1 52)
600mg °-°-) c…: 1 smu 79đến ) 85)
Levonorgcsưel (chả chuyến
hớa):
AUC: t 83%(1 79Ổn187)
c...; iso%u 77đến183)
cm: 1 86%(l80đến190)
(sự cám ưng chuyền hoa)
Efavirenz: không có tương tác có
ý ngtĩa lãm sâng.
Ý nghĩa lãm sâng của nhũng tác
động nảy khđng được biết
Ethinyloesưa Ethinylocsưadiol:
di0V AUC: …; C…ị …
Tenofovir Tenofovir.
đưoproxtl AUC: __,_ C…: __
fưmam
(J300 mg
q-d)
Noưgestimat/ Tượng tác khòng được nghiến
Ethinyloesưa cứu,
dioV
Emtricitabin
Dường tiêm: Trong nghiên củu tuong tâc Bời vi hạn chế các thỏng
Depomeđrox thuốc trong 3 thảng, khớng thẩy tin sẵn có, nớn dùng biện
yprogesteron CÓ sự khổ biet đáng kẽ Về cảc ph_ấp ưánh ll'lBí máng
acetat tliỏthốđượcđộnghợccủa chảnđảngơũythêmvảo
(DMPA)! MPA giữa các đói tượng dùng với tránh thai bảng
Efavirenz cfavirenz- cớ tmng liệu pháp hormon
(150 mg liếu kháng retrovitns vá đỏi tượng
đơn DMPA kbỏns dùng, hén pMp khảng
úử bắp) rdrovim_s. Két quả tang lụcũng
đượcthâyớcácnhánghiến cứu
khớc, mac dù nồng độ MPA
ttong máu oớ nhiếư biến đối ớ
nghiến cùu thứ hai. Trong cả hai
nghiến cửu, nòng dộ
progesterone trong máu của các
đối tượng dùng cfavirenz vù
DMPA vẫn thẩp phủ hợp với
việc ức chế sự rụng trừng
DMPA] Tượng tác khớng được nghiến
Tenofovir ct'm.
disoproxil
fưmara
DMPA] Tương tác khỏng được nghiến
Emtricitabin cửu.
Các chất ửc che’ miễn dịch /
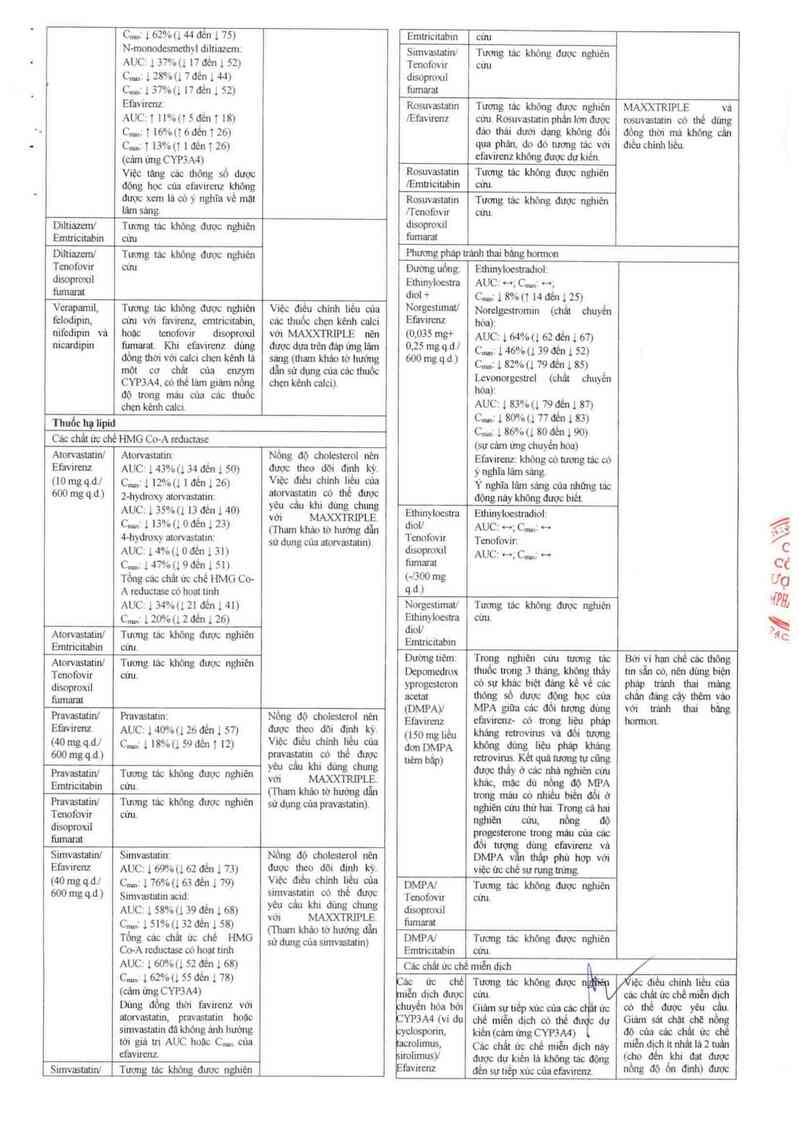
Các ửc chếTưongtáckhôngđượcn iẹcớièuchinhiiẻuuia
miễn dịch được cứu. câc chật ức chế miền dịch
chuyến hóa bới Giảm sự nép xúc củacáẹ ' ức 00 thế được yếu cấu.
CYP3A4 (ví dụ chẻ miên dịch «) ihẻ đ dự Giám sát chặt _chẽ nồng
cyclosọorin, kiến(cám ứngCYPZA4) do của các ch_đt ủc chế
_limus, Các chất ủc chế miễn dich nảy nằỄ' Ếễnh ftkẵhadẵ 2đnưỄcn
imimusy đượcdựkiếnlảkhỏngtácđòng ( . '_
ẵffflz đến sưtiếp xúc của eíăvirenz nồng độ Ồ" đlnh) được
:Ẩ`U
D.
Tacrolimusl Tacrolimus: khuyên cảo khi bat đâu
Emtricitabin/ AUC … ,Cm ~ ;Cunị … hoặc ngững điêu trị với
Tenofovir Emtricitabin MAXXTRIPLE
đtsoprox1l AUC H ._ C…, __ ;Cm.z __
tumarat Tenofovư đisoproxil fưmamt:
… "'g’kg AUC: …- c..., … c…. …
q.d.l 200 mg/ ’ '
300 mg q.d.)
Các thuốc opioid
Mcthadonl Methadon: Những bệnh nhân được
Efavirenz AUC; t 52%(1 33 đến ) 66) dùng memadon đồng thời
135-100mg C…: t45%u 25 đến 1 5.9) Với MAHTRIPLE cẩn
q.d.l 600 mg (cảm ưng CYP3A4) được theo dõi các dấu
qd.) Trong một nghiên cưu vế nhiễm h'ệu cai IhUỎC Và hề"
HIV do tiếm chich ma túy, dùng "’“lhadm °°° °° °“°°
đổng thời efavưenz với tang kh' Cẩn mua để giảm
. - . . bớt các triệu ch cai
methadon lam giám nỏng đo cua ưng
mcthađon trong máu vá câc đằu
hiệu của hội chửng cai thuốc
Liêu methadon được táng trung
binh la 22% để giảm bớt triệu
chủng cai.
Methađtm/ Meưtadon:
Tcnofovir AUC_ H ;ij o—› ;Cmm 4—4
dỈSOPTOXỈỈ Tenofovir.
111… AUC: …; c...,: …, c…. …
(40-1 10 mg
qđ.l 300 mg
q.d.)
Methadon/Em Tương tác khớng được nghiến
tricitabin cứu.
Buprenorpth Buprenorphin AUC 1 50% Mặc dù giảm tiểp xùc của
naloxonl Norbupnenorphin: AUC: 1 71% buprcnorphin, nhưng
Efavirenz Efavirenz. Không có tương tảc không, °Ồ _bệnhnhân nản
dược động hoc nảo cớ ý nghĩa có btẻta hlẻn mẻụ chứng
lâm sảng cni thuôc. Việc diêu chinh
Buprenorphinl Tương tảc không được nghiên ltiỂếu 1Ĩẵẳnịuẵìotirẹiiếinkffl
ẵoxofvmb. cm" dùng chung với
mc' ’" MAXXTRIPLE.
Buprenorphin/ Tưong tác không được nghiến
nalox~onl cứu.
tenofovir
disoproxil
fumarat
lChất chuyền hóa lưu thông trong tuần hoản chủ yếu của
sofosbuvir.
Các nghiên cún đuợc tiến hânh với nhũng thuốc khác.
Không oó tương tác dược động học nảo có ý nghĩa lâm sảng
khi efavirenz được dùng với azithromycin, cetirizin,
fosamprenavir/ rỉtonavir, lorazepam, nelfmavir, zidovudin, cảc
kháng acid chưa hydroxid nhôml magnesi, famotidin hoặc
fiuconazol. Khả nảng xảy ra tương tác giữa efavirenz và thuốc
khảng nấm nhóm azol, ví dụ như ketoconazol, chưa được
nghiên cứu.
Không có tương tác dược động học nảo có ý nghĩa lâm sảng
khi emtricitabin được dùng với stavudin, zidovudin hoặc
famciclovir. Không có tương tác dược động học nảo có ý nghĩa
lâm sảng khi tenofovir disoproxil fumarat được dùng với
emưicitabin, nelfinavir hoặc ribavirỉn.
12. Tảc dung không mong muốn (ADR)
Rất ớtướ›tg gặp, ADR > mo
Rối Ioạn chuyến hóa vả dinh duõng: giám phosphat máu.
Rối Ioạn tiêu hóa: tiêu chảy, nôn, buồn nôn.
Rối loạn da vả các mỏ duới da; phảt ban.
Rối loạn cơxuơng khóp vả mô Iiẻn kết: tảng creatin kinase.
Thường gặp, 1/100 S ADR < 1/10
Rối Ioạn máu vả hệ bợch huyết: giảm bạch cầu đa nhân trung
tính.
Rối loạn hệ miễn dich: phản ứng dị ứng.
Rối Ioạn chtợến hóa vả dinh dưỡng: tảng triglycerid mảu. tăng
đường huyết
Rối_loạn tâm thần: trầm cảm. lo âu, những giấc mơ bất thường,
mât ngù.
Rối !oạn thần kinh: rối loạn phối hợp vả cân bằng ở tiền nảo
buốn ngủ nhức đầu rối loạn chủ ỷ, chóng mặt
Rối Ioạn riêu hóa đau bụng, tảng amylase kể cả tăng amy1ase
tụy, tăng lipase huyết thanh khó tiêu, trướng bụng, đằ_v hoi.
Rối loạn gan mật. tảng gamma-glutamylnnnstferase (GGT),
tăng AST huyết thanh vá/hoậc tảng ALT huyết thanh, tăng
bilirubin mảu, tăng transaminase.
Rối Ioạn da vả mỏ _duới_ da: ngửa. phải. ban dạng mụn nước,
mụn mủ, dát sấn, nối mề đay. nảm da (tăng sảc tố)
Toản thân: mệt mói, suy nhược.
it gặp, m.ooo s ADR < moo
Rối Ioạn máu và hệ bạch hưvếl: thỉếu máu.
Rối Ioạn chwến hóa vả dinh dưỡng: tảng cholesterol trong
mảu, hạ kali mảu.
Rối Ioạn tăm lhắn. toan tinh tự từ, có ý định tự từ, Ioạn tâm
thần, hưng cảm, rối loạn nhân cảch, ảo giác, tâm trạng khoái
cảm, cảm xủc không on định, trạng thái lủ lẫn, hay gây hẩn.
Rối !oạn Ihẳn kinh: co giật, quến, suy nghĩ bất thường, mất
điếu hòa, phối hợp bẩt thường, kich động,run
Rối Ioạn mắt: nhin mờ.
Rối Ioạn tai vã mẻ đạo: ù tai, chóng mặt.
Rối Ioạn mạch máu: đỏ bửng mặt.
Rối loạn tiêu hóa: viêm tụy.
Rối Ioạn gan mật: viêm gan cấp tinh.
Rối Ioạn da vã mỏ dưới da: hội chứng Stevens-Johnson, hồng
ban đa dạng, phảt ban nặng, phù mạch.
Rối loạn cơxương vả mô liên kết: tiếu cơ vân, yểu cơ.
Rối Ioạn ihận vả tiết niệu: tăng creatinin, protein niệu.
Rối loạn hệ sinh dục vù ngực: chứng vú to ở nam giới.
Hiếm gặp, 1/10. 000 5 ADR <1/1.000
Rối Ioạn chuyển hóa vả dinh duỡng: nhiễm acid 1actic.
Rối Ioạn tảm thần: tự từ thảnh còng, hoang tướng, rối loạn thần
kinh chức năng.
Rối Ioạn gan mật: suy gan, gan nhiễm mỡ, viêm gan.
Rối Ioạn da vả căc mô dưởi da: viêm da dị ứng với ánh sáng.
Rối“ !oạn cơxương vả mô liên kết: nhuyễn xương bệnh lý cơ.
Rối Ioạn ihận và hệ tiết niệu: 5ưy thận (cấp tinh và mãn tinh),
hoại tử ống thận cắp, bệnh _“1ý ong thận gân bac gổm hội chúng
Fanconi, viêm thận (bao gôm viêm thặn kẽ cắp tinh), đải tháo
nhạt do thận.
13- QiLáltẬ
Một số bệnh nhân vô tình uống 600 mg efavirenz x 2 lẩn/ ngảy
bị_tảng cậc triệu chứng tiến hệ thân kinh. Một bệnh nhân bị co
thái cơ bảp không tự chù.
Nếu quá liều xảy ra bệnh nhân phải được theo t_iới các dẩu hiệu
ngộ độc, và điều tii nâng dỡ thông thường khi cân thiêt.
Sử dụng than hoạt tính có thể hỗ trợ ioại bò efavirenz chưa
dược hắp thu. Không có thuốc giậi ộc đặc hiệu cho quá liều
với efavirenz Vi efavirenz gắn kết ' '
không thế loại bỏ lượng efavirenz đ
tenofovir có thế được loại bỏ bằng thẩm phân phúc mạc hay
không.
14. Bảo_guãn: ớ nhiệt độ dưới 30°C. Tránh ánh sáng trực tiếp và
nơi âm ướt.
' 15_ Han dùng; 36 thảng kế từ ngảy sản XUất. MVR77. Non-Nucleostde Reverse Transcrụuase Inhibtlơr; PI: Protease lnhtbưor:
cART~ C ombmauon Anuretrơvmzl ĩ7iercựzv; HBV: Hepantu B l'trus; HCV:
16. Ngảỵ xem Xét sửa đổi, cân nhât Iai nội dung hướng dẫn Sử Hepanns C i’trus; NS4ID: Non StereldzlAnIt-InjlammaloợDmg
dựng thuốc:
' Sản xuất và Phân phối bởi:
CÔNG TY cò PHÀN DƯỢC PHAM AMPHARCO A
' Khu Cỏng Nghiệp Nhơn Trạch 3, Xã Hiệp Phước. Huyện Nhon Trạch Đổng Nai
' Điện thoại: 0613-566202 Fax: 0613-56620
tuc.cợc TRUÒNG
P.tRUÒNG PHÒNG
cỗớaM wa
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng