









xféSJụfM
BỘ Y TẾ
CUCfflưoe …...ffl,
Box of1 via]
Color: I Eẵ_…
I Bucỉco 1L “““““““““ --—~
El
ĐÃ PHÊ DUYỆT
sm²B1XSZSXOGM
8…m: lllum
BMD_DEMOI 1G06-2015 Conm ct Nl’ _
Lân đẩquEtl.ẢQ…/QffllíS
DẺMO S.A.
CEUTICAL INDU'F'WY
2W KM NATIONAL RỦÀD ATHENS-L ' .
145 68 ATHENS—GREECE.
' ² '~30 210 8i61802 -FAX: o30.210.811- . ..
e-maĩt: đ[email protected]
°ẵ'Ỉỉew V
1
!
²ỉ
Sa _
. iắẫ ' .
1 Ễẩẵẫỉ ẳỉị R“ ThUOC ban meo dơn
1 ỂẵấỄ ỄiỄỄ R" n…...ủ. °“9 IM
ifẵ i _ : M f f ẩ
JỄỂỂẺỂ:ỄịỂtỂ aX 800 g ẫ Maxf
ễỂịẫị Ếll Ceftrỉaxonel ị Ễ ece
ỄỂỄẫỂ ẾỂỄỊỊ Howwủc ị g ỂỄ Ce_ftriỳgaxonel
EỂỄ’ỂỂỂỄ ỉEẸ' ióngdu"ằ'"ềmumn Ễ Ịa ỂỂ tv… n…
²ỂẵfiỄE-tỂ am… . ,_ ²ả ỉẳ ~…ỉorv'e'ã”
ịịỉẵỉ ÉỆỄ i phatiem gm°' Ểẵ ẳẽ Ễ“ anuscuurm
naẻfị²n* ẫz i . ẩn ………
in . ] uj I; `Ễẫ s0lutlonfurinjmanm \
ẫẵặ²² ịịiẳẵl DEMO s A ỂỄ°ịỉễ Ễ=ễ
ẳảãeưẳtẳti "'”“"““““’²“ <“ễẫ
888 _ Q
\—
1
!
')
MAXFEOEF 1G (LDL)
Label in vínl
color: I ẸM…SỆ.°J…Ê_…… ..._….……
DEMO S.A. , g,…
HARMACE AL mnusTFẢ
ẵls1 KMNAT\ONALROAD ATHENS-LA… s……ze…
' ' us a ATRENS'GREỂỂỂmW W… u………
» TEL: .30 210 8ẫ6180²gủẵảcígr BMD_DEMOI 1e-oe—zms c…… m.:
e-ffllilt cm0
LOT: 22x15mm LOT: 22x15mm
lu Mun ……
MMCúnuole lg |M
… nb wma Mi In a M
E'IỀzỄIẸẸW " Ề '. … n u …
DEMO S.A. …lunm ĐUN~ DEMO S.A. M_g sun»
Ềằ'ắỉĩầẩf'““m *:a::…trmưr~……
Rx Thuóc bén theo đơn
MỀXfỂỂỂf Ceftriaxone lg | M
nem báp. Thuóc bot pha tiem. Mõi lo ohứa
Celtriaxone Sodium Triseequihydrate tương Mng
vơi 1g Ceftriaxone.
Intramuscular use. Powder foơ Solution for Injecb'on.
Each via! oontains Ceũriaxone Sodium Tn'sesquihydrate equivalent to 1g of Ceftriaxone. qV
Ê DEMO S.A. Phnmmuưcdlnơuưy semmm
21'MIWMAỦHELEIIÌ. 14568 Kliumi.Rhưu GrumlHyLw
Td: +30 210 816180² ' Fu +1] 210 6161587
ỈỦIÍ Ẹế' ụủ .
IAXFECEF 1G (I.I.ì
Lidooein HC! 1%
SbO:ỐOXSOMHI
WD: Illustrator
BMD_DEMOI 16-CB-2015 Contlđ lùn:
40… DEMO S.A.
PHARMACEUTICAL INDUSTRY
21SỈ KM NATIONALROAD ATHENS—LAMIA
145 68 ATHENS-GREECE
TEL.: o302108161802 — FAX: o30.210.8161587
e-mil: [email protected]
Lidocain HCl 1%
Lidocain
' Dung mũ I lùn 3.611!
…gzmt… .:;ưzwm
Suan bdm an:.
SI lb BX Ilm ui
usxuq em
30mm
DĐIEU dù
[]EMO … ›z ÍỸỰ
Rx Thuốc bán theo đơn
Hướng dẫn sử dung
Đọc kỹ hưóng dân sử dụng trước khi dùng
Nếu cẩn thông tin, xin hỏi ý kiến bác sỹ
MAXFECEF
Ceftriaxon 1 g, LM
DEMO S.A.
1' TÊN DƯỢC PHẨM PHARMACEUTICAL iNDUSTp_Y
Maxfecef lgllo, LM… 1151KMNATÌONALROADATHENS-LAmA
. 145 68 ATHENỉ-XGỄỂỄIỂỂIỐ m7
` ' ' ` . . F '_ + . .v
2. THANH PHAN CHAT VA LƯỢNG TEL'ẹỀẫho_sẩễễẫỉỉhar@otẹneụgr
Mỗi lọ thuốc bột có chứa:
Hoạt chất: Ceftriaxonhatri trisesquihydrat (Clng60stS;;Na23.5H20) 1193,0 mg tương đương với
1000,0 mg Ccftriaxon.
Không chứa tá dược.
Óng dung môi: 3,5 ml dung dịch tiêm Lidocain hydroclorid 1%.
3. IDẠNG DƯỢC LÝ ' ợ
Thuôc bột vả dung môi pha tiêm (tiêm băp).
4. ĐẶC ĐIỀM LÂM SÀNG
4.1 Các chỉ định điều trị _
Ceftriaxon được chỉ định để điều trị các nhỉễm trùng sau gây ra bời các chủng vi khuân nhạy cảm
với ceftriaxon:
— Nhiễm trùng huyết
- Viêm mảng năo
- Bệnh Lyme: được chứng minh ảnh hưởng nghiêm trọng đến thần kinh trung ương, tim và khớp.
- Nhiễm trùng ố bụng (viêm phủc mạc, nhiễm trùng đường mật và nhiễm trùng ống tiêu hóa).
- Nhiễm trùng xương,- khớp, nhỉễm trùng da và mô mềm vả nhiễm trùng vết thương.
- Nhiễm trùng ở bệnh nhân bị suy giảm miễn dịch (ức chế miễn dịch) dùng phối hợp với các nhóm
kháng sinh khác như aminoglycosid
- Nhiễm trùng thận và ống dẫn nước tiểu
- Nhiễm trùng đưòng hô hấp, đặc biệt là viêm phối, nhiễm trùng Tai Mũi Họng (ENT)
- Nhiễm trùng đường sinh dục bao gồm cả bệnh lậu
- Dự phòng nhiễm trùng trước phẫu thuật, trong trường hợp chủng vi khuẩn kháng với các
cephalosporin thế hệ thứ nhất và thứ hai đã được chứng mỉnh bằng thử nghiệm lâm sảng.
4.2 Liều lượng và cách sử dụng
Liều bình thường
Người Iởn vả trẻ em trên 12 tuổi: Liều thông thường là 1-2 g ceftriaxon dùng mỗi ngây một lần,
tức là một lần mỗi 24 giờ. Trong trường h nhiễm trùng nặng hoặc trong trường hợp nhiễm trùng
docác vi khuẩn nhạy cám vừa phải với thuoc, lỉều lượng có thể tăng lên đến 4g mỗi ngảy chia lảm
2 lân.
Thời gian đìều trị: khoảng thời gian điều trị tùy theo diễn tiến của bệnh hoặc tình trạng đau yểu.
Cũng như các kháng sinh khác, nên dùng tiếp tục ceftriaxon ít nhất 48-72 giờ sau khi hạ sốt hoặc
sau khi vi khuẩn bị loại trừ.
Điểu trị phổi họp: Tác dụng hiệp đồng giữa ceftriaxon vả aminogiycosid đă được chứng minh đối
với nhiều loại vi khuẩn Gram (-) trong điều kiện thí nghiệm. Tuy nhiên, tác dụng hiệp đồng của
những phối hợp trên không phải luôn luôn dự đoản trước được, chỉ nên áp dụng trong những
trường hợp nhiễm trùng nặng, đe dọa tính mạng. Do không tương thich về lý tinh, cả hai thuốc phải
được dùng riêng rẽ, với Iỉều được chỉ định.
Cảch dùng: nên sử dụng ngay dung dịch sau khi đã pha.
Độ ồn định lý hóa cùa dung dịch hoản nguyên duy trì trong 6 gíờ ở nhiệt độ phòng (hoặc 24 giờ ở
2-80C). Dung dịch có khoảng mảư dao động từ mảư vảng sáng đển mảu vảng đậm tùy. thuộc vảo
nổng độ vả thời gỉan bảo quản. Đặc tỉnh nây cùa hoạt chất ảnh hưởng không đáng kể đến hiệu lực
hoặc độ an toản cùa thuốc.
Tiêm bãp:
Đối với tiêm bắp, 1 g ceftriaxon được hòa tan trong 3,5 ml dung dịch lidocaìn hydroclorid 1%, sau
đó tiêm sâu vảo khối cơ tương đối lớn . 250 mg ceftriaxon được hòa tan trong 1 ml dung dịch
lidocaìn hydroclorid vả 500 mg ceftriaxon được hòa tan trong 2 ml dung dịch ]ỉdocaỉn hydroclorid.
Không khuyến cáo tiêm lượng lớn hơn 1 g vảo cùng vị tri.
Không dùng đường tĩnh mạch dung dịch chứa lidocain.
Liều đặc biệt:
Suy gan: vởì bệnh nhân bị suy chức năng gan, không cần giảm liều nếu chức năng thận bình
thường
Suy thận: với bệnh nhân suy thận, không cần giảm liều Maxfecef nếu chức năng gan binh thường
Giảm Íỉều chí trong trường hợp suy thận nặng (độ thanh thải creatinin < 10 mllphút), liều hảng
ngảy không được vượt quá 2 g. Trong trường hợp suy thận nặng kèm theo suy gan, cần theo dõi
nồng độ ceftriaxon trong huyết tương thưởng xuyên và điều chinh liều.
Ở bệnh nhân đang được thầm phân máu, không yêu cầu phải bổ sung liều sau khi thực hiện thẳm
phân máu. Tuy nhiên, để xác định xem có cần thiết phải điều chỉnh liều hay không, cần kiềm tra
nông độ huyểt thanh, do tốc độ thanh thải ceftriaxon ở những bệnh nhân nảy có thế giảm.
Người Iơn tuổi: không cần thiểt Phải điều chỉnh liễu cho bệnh nhân lão khoa.
Trẻ em: Trẻ sơ sinh vả trẻ em đen 12 tuổi: phảc đồ liều dùng sau đây được khuyến nghị dùng một
lần mỗi ngảy:
Trẻ sơ sinh đển 14 ngảy Iuỗi: liều hảng ngảy là 20- 50 mgl kg thể trọng, không được vượt quá 50
mg! kg Không cần thiết phải điều chĩnh lỉểu cho trẻ sơ sinh thiếu thảng.
Chống chỉ định dùng ceftriaxon ở trẻ sơ sinh (< 28 ngảy tuổi) nếu trẻ sơ sinh đang phải điểu trị với
dịch truyền chứa canxi, kể cả truyền liên tục dịch truyền có chửa canxi lả dung dịch dinh dưỡng
ngoải đưòng tiêu hóa do nguy cơ tạo tủa ccftrỉaxon-canxi (xem mục 4.3).
Trẻ sơ sính, trẻ em (15 ngảy tuổi đến 12 tuổi): liều hâng ngảy là 20-80 mg/kg thể trọng. @“
Vởi trẻ có trọng lượng cơ thể 50 kg hoặc hơn, nên dùng theo liều thông thưòng của người lởn. 1
Liều 50 mg/ kg thể trọng phải được truyền tĩnh mạch chậm trong ít nhất 30 phủt.
Viêm mãng não: việc điều trị viêm mảng não nhiễm khuẫn ở trẻ em được bắt đầu với liều 100
mg/kg thể trọng nhưng không quá 4 g mỗi ngảy Sau đó dùng tổng liều 100 mg] kg thể trọng (đển
tối đa 4 g mỗi ngảy chia lảm 2 lần). Ngay sau khi xác định được loại vi khuẳn là nguyên nhân gây
bệnh vả tính nhạy cảm cũa chúng Với ceftriaxon, liều lượng có thể được giảm xuống cho phù hợp.
Thời gian tối thiếu để điều trị có hiệu quả lâ:
Neisseria meningitidis: 4 ngảy
Haemophilus injluenzae: 6 ngảy
Streplococcus pneumoniae: 7 ngảy.
Tuy nhỉẽn thời gìan đíều trị thông thường là 7-14 ngảy tùy thuộc vảo vi khuẩn gây bệnh.
Bệnh LYME: liều dùng ở trẻ em và người lởn là 50 mglkg đển tối đa 2 g dùng một lẫn mỗi ngảy
trong 14 ngảy.
Bệnh lậu: (những chùng tạo penicillinase và những chùng không tạo penicillỉnasc), tiêm bắp một
liều duy nhất 250 mg Maxfeccf.
Dự phòng trước khi phẫu !huật: dùng một Iỉều duy nhẩt 1—2g Maxfecef 30-90 phút trước khi
phẫu thuật để phòng nguy cơ nhiễm trùng. Trong phẫu thuật đại trực trảng, việc dùng đồng thời
Maxfecef cùng với hoặc không với 5—nitroimidazol (ví dụ ornidazol), đã được chứng minh là có
hiệu quả.
4.3 Chống chỉ định
Ccftriaxon không được khuyến nghị vởí bệnh nhân được biểt dị ứng với khảng sinh nhóm
cephalosporin. Đối với bệnh nhân quả mẫn cảm vởi penicillin, nên đưa vảo nhóm có khả năng xây
ra phán ứng dị ứng chéo.
Ceftriaxon chống chỉ định ở những bệnh nhân trước đó đã có phản ứng quả mẫn với khảng sinh
nhóm beta-lactam.
Không nên sử dụng ceftriaxon ớ trẻ sơ sinh bị vảng da hoặc trẻ đẻ non Nghiên cứu in vitro cho
thấy ceftriaxon có thể thay thế bilirubin trong albumin huyết thanh và gây ra bệnh não do bỉlírubin
Ceftriaxon được chống chỉ định' 0:
~ trẻ sơ sinh thiếu tháng cho tới trẻ đủ 41 tuần (tuần tuối thai + tuần tuối),
… trẻ sinh đủ tháng (đến 28 ngảy tuổi).
- bị vảng da, hoặc thiếu albumin hoặc bị nhiễm toan hời vì đây là những điểu kiện khiến bilirubin
iiên hhợp có thể bị giảm.
- Nếu yêu cầu (hoặc dự kiến sẽ yêu cầu) phải điều trị bằng canxi tíêm tĩnh mạch, hoặc dịch truyền
có canxi vì nguy cơ tạo tùa ceftriaxon- -canxi (xem mục 4. 4 và 4.8).
4. 4 Cânh báo đặc bỉệt và thận trọng trong sử dụng
Như đối với các cephalosporin khác, trưởng hợp phản ửng phản vệ gây tử vong đã được bảo cảo
ngay cả ở những bệnh nhân không được bỉểt có tỉền sứ bị dị ưng.
Mỗi gam Maxfeccf chứa khoảng 3, 6 mmol natri. Cần cân nhắc đổi với bệnh nhân có chế độ ãn
kiểm soát muối.
Thiếu mảư tản huyết tự miễn đã được quan sảt thấy ở những bệnh nhân được dùng cephalosporin
bao gổm cả ceftriaxon. Trường hợp thỉêu máu tản huyết nặng, bao gồm cả trường hợp từ vong đă
được bảo cáo trong quá trình điều trị ở người lớn và trẻ em. Nếu trong quá trình điều trị với
ceftriaxon, bệnh nhân xảy ra tinh trạng thỉếu máu thì khả năng thiếu mảư gây ra do cephalosporin
phải được kiểm tra như một khả năng, và phải ngừng dùng ceftriaxon cho đến khi nguyên nhân
được xảc định. À Â
Bệnh tiêu chảy liên quan đến vi khuẩn Clostridium dijjìcile (CDAD) đã được bảo cáo ở gân như tât
cả các thuốc kháng sinh được dùng, bao gồrn Maxfecef, vả có thể xảy ra ở tất cả các mức độ tử
tiêu chảy nhẹ đến nặng rổi đến tử vong do viêm đại trảng. Việc điểu trị với các thuốc kháng sinh
lảm thay đối hệ vi khuẩn có lợi cùa ruột dẫn đến phảt triển quá mửc vi khuẩn C. dzfi` c;1e C.
dffl'ìciie sản xuất độc tố A vả B là những độc tố góp phẳn gây ra CDAD. Độc tố được tạo ra bởi
chủng C. dzfflcile lảm tăng tỷ lệ mắc bệnh vả tử vong, do các nhiễm trùng nảy có thể đề khảng với
kháng sinh đỉều trị và có thế phải yêu cầu cắt bỏ đại trảng. CDAD phải dược xét tới ở tất cả các
bệnh nhân có biền hỉện tỉêu chảy sau khi dùng kháng sinh. Cần phải quan tâm tới lịch sử điều trị vì
CDAD đã được báo cảo xảy ra hon hai tháng sau khi dùng các thuốc khảng khuẩn.
Nếu nghi ngờ hoặc đã xác nhận bị CDAD, việc tiếp tục dùng khảng sinh không trực tiếp khảng C
dịfflcile có thế cần phải ngừng lại. Bù nước và chất đỉện giải, bổ sung protein, dùng khảng sinh
đìều trị C. dịfflcile, và nên cân nhắc phẫu thuật khi có chỉ định lâm sảng.
Giống như trường hợp cùa các thuốc khảng sinh khác tái phảt nhíễm trùng do vi khuẩn đề khảng
thuốc có thể xảy ra.
Bóng cản đã được quan sảt thắy trong các nghiên cứu về sỉêu âm túi mật. Những bớng cản nảy đã
bị hiều nhầm là sòi mật. Những bóng cản nảy thường xuất hiện sau khi dùng liều cao hơn liều
khuyến cảo. Những bóng cản nảy là do sự lắng đọng các muối canxi hinh thảnh bởi ceftríaxon,
hiện tượng nảy sẽ biến mất sau khi kểt thúc hoặc ngửng điếu trị với ccftriaxon. Việc phảt hiện
những bóng cản nảy hiểm khi có liên quan với các triệu chứn. Trong trường hợp các triệu chứng
nảy xây ra, chỉ cần đỉều trị bảo tồn không cần các tác động phân thuật Trong trường hợp nảy, việc
nên ngừng hay không ngừng điều trị với ceftriaxon phải được quyết định bởi bảc sĩ điểu trị.
Tương tác với các sản phẩm có chứa canxi:
Các trường họp phản ứng gây chết người do tạo tủa canxi-ceftrìaxon trong phổi và thận đã được
mô tả ở trẻ sơ sinh dưới 1 thảng tuôi Ít nhất một trong số các trường hợp nảy đă được dùng
ccftrỉaxon vả canxi ở các thời điếm khảo nhau và thông qua đường truyền tĩnh mạch khảo nhau.
Trong các dữ liệu khoa học có sẵn, không có báo cáo xác nhận việc tạo tùa trong mạch máu ở
những bệnh nhân không phải trẻ sơ sinh, được điều trị với cảc dung dịch có chứa canxi hoặc bất kỳ
sản phấm nảo khác có chứa canxi khác. Trong nghiên cún in vitro đã chứng minh rằng trẻ sơ sính
có nguy cơ bị tủa ceftriaxon-canxỉ cao hơn so với các nhóm tuổi khác.
Với bệnh nhân ở bất kỳ độ tuối nâo cũng không được trộn lẫn hoặc dùng đồng thời ceftriaxon với
bắt kỳ dung dịch tiêm tĩnh mạch nảo có chứa canxi, thậm chí thông qua đuờng truyền khảo nhau
hoặc tại cảc vị trí truyền khác nhau. Tuy nhỉên, với những bệnh nhân iớn hơn 28 ngảy tuổi, có thể
3
dùng ceftriaxon vả cảc dung dịch có chứa canxi theo thứ tự lần lượt thuốc nọ sau thuốc kia nểu sử
dụng đường truyền tại oác vị trí khảo nhau hoặc nểu thay thế các đường truyền hoặc rửa thật kỹ
đường truyền băng nước muối bình thường để tránh tùa Đối với bệnh nhận cân truyền liên tục
dung dịch TPN có chứa canxi, bảc sỹ có thể xem xét dến việc dùng cảc thuốc khảng sinh thay thế
mã không có nguy cơ tạo tủa tương tự như ceftriaxon. Nếu việc dùng oefiriaxon được coi lả cần
thiết đối với bệnh nhân cần dinh dưỡng liên tục, dung dịch TPN vả ceftriaxon có thế được dùng
cùng một lủc, mặc dù qua đường truyền khác nhau tại oảc vị trí khảo nhau. Ngoài ra, việc truyền
dung dịch TPN có thế được dừng lại trong khi truyền ceftriaxon, chủ ý cần rửa đường truyền giữa
các dung dịch (xem mục 4 3, 4. 4, 4 8 5.2 và 6. 2).
Trường hợp viêm tụy; có thế là nguyên nhân gây tắc mật, hiếm gặp ở những bệnh nhân được điếu
trị bằng Maxfeccf. Hằu hết bệnh nhân được rnô tả với các yếu tố nguy oơ dẫn tới ứ mật và bùn
mặt, ví dụ như trưởc đó đã điểu trị một bệnh nặng, ốm nặng và có chế độ dinh đường hoản toản
ngoải đường tiêu hóa. Không thể Ioại trừ Maxfecef có vai trò kích hoạt hoặc lả đổng yếu tố liên
quan đến việc ứ mật.
Trường hợp suy thận và suy gan nặng, nên giảm liều theo khuyến nghị được đưa ra.
Độ an toản vả hiệu quả cùa ceftriaxon 0 trẻ sơ sinh và trẻ cm đă được ghi nhận và mô tả trong mục
"Liều lượng và Cảch sử dụng'. Các nghiên cứu liên quan đến ceftriaxon cho thấy, cũng như một số
ccphalosporỉn khảo ceftriaxon có thể thay thế billirubin trong ;;Ibumin huyết thanh.
Không sử dụng ccftriaxon ở trẻ sơ sinh, đặc biệt là trẻ sinh thiếu tháng có nguy cơ cao bị bệnh não
do bilirubin (xem mục 4. 3).
Trong trường hợp điều trị kéo dải, cần phải kiếm tra thường xuyên công thức máu.
Trong trường hợp dùng dung môi lidocaìn, dung dịch cefiriaxon chi được dùng đường tiêm bắp.
4.5 Tưong tác với các thuốc khác và các đạng tương tác khác
Cho đến nay không quan sát thấy việc suy giảm chức năng thận sau khi đùng đồng thời !ỉếu cao
Maxfcccf vả thuốc lợi tiếu mạnh (ví dụ như Furosemid). Không có bằng chứng cho thẳy ccftriaxon
lảm tăng độc tính trên thận oủa aminoglycosỉd. Ceftriaxon đã được chứng minh không có tác dụng
tương tự như cùa disulfĩram sau khi uống ruợu ngay sau thời điềm dùng ceftriaxon. Maxfcccf
không chứa N- -methylthiotetrazol lả tảo nhân có thề iiên quan đến khả năng dung nạp ethanol và
vân đề chảy máu của một số kháng sinh cephalosporin khảo. Việc thải trừ ceftriaxon không bị thay
đổi bởi probenecid. Trong một nghiên cứu in vitro, đã quan sát thẳy việc ceftrìaxon có hoạt tính
cạnh tranh khi dùng phối hợp chloramphcnicol vả ceftriaxon.
Dung dịch pha loãng có chứa canxi (ví dụ dung dịch Ringer hoặc dung dịch Hartmann) không
được dùng để hoản nguyên ocftriaxon.
Dựa trên cảc tải liệu bảo cáo, ccftriaxon không tương thích với amsacrin, vancomycin, fiuconazol
vả aminoglycosid vả không được dùng cùng đường truyền với cảc thuốc nảy.
Ceftriaxon có thế có ảnh hướng bất lợi đến hiệu quả của cảc thuốc trảnh thai nội tiết tố đuờng
uống. Do đó, nên sử dụng các biện pháp tránh thai thay thế (không có nội tiểt tố) trong khi điếu trị
vả trong tháng sau khi đỉếu trị.
4.6 Mang thai và cho con bú
Mang thai
Ceftrỉaxon đi qua hảng rảo nhau thai. Độ an toân đối với toản bộ thời kỳ mang thai chưa được ghi
nhận. Nghiên cứu vê độc tính sinh sản ở động vật không cho thấy bất kỳ dấu hiệu nảo về việc
ceftriaxon gây độc tính cho phôi thai, sinh quái thai hoặc bẩt kỳ ảnh hướng nâo khác đối vởi khả
nãng sinh sản cùa cả hai giới tính, việc sinh, hoặc trước vả sau khi sinh. Không quan sát thấy
ccftriaxon gây độc tính trên phôi thai hoặc sinh quái thai ở khi.
Cho con bú
Ceftriaxon đi vảo sữa mẹ với nồng độ nhò. Khuyến nghị cần thận trọng khi dùng Maxfccef cho phụ
nữ cho con bú.
4 7 Ẩnh hưởng trên khả năng lái xe và vận hảnh máy móc
Khả năng iái xe và vận hânh mây móc có thể bị giảm xuông vì đôi khi Maxfecef gây chóng mặt.
4. 8 Các tác dụng không mong muổn
Tảo dụng không mong muôn thường nhẹ và ngắn.
Trong quá trình dùng ccfiriaxon cảc tác dụng phụ sau đã được ghi nhận là có thế hổi phục tự phát
hoặc sau khi việc dùng ccftriaxon kết thúc:
Tác dụng không mong muốn cho mỗi hệ cơ quan:
Rẩi loạn dạ dây-ruột (khoảng 2%): đi ngoải phân lỏng hoặc tiêu chảy, buồn nôn, nôn, viếm miệng
và viêm luỡi
Thay đổi huyết học (khoảng 2%): tăng bạch oầu eosin, giảm bạoh cầu, giảm bạch oầu hạt, thiếju
máu tan máu, giảm tiếu câu. Trường hợp cá biệt, không rõ tần suất giảm bạch cẩu hạt (<500 mm )
đã được bảo cáo, hầu hết trong số đó xảy ra sau 10 ngây điều trị với tống liếu dùng 20g hoặc cao
hơn.
Phản ứng da (khoảng 1%): phát ban, viêm da dị úng, ngứa, nối mề đay, phù nế. Trường hợp cá
bíệt không rõ tần suất tác dụng phụ nghiêm trọng đã được báo cảo: ban đó đa hinh, hội chửng
Stevens- Johnson, hội chứng Lyell/ hoại từ thượng bì nhiễm độc.
Khác, tác dụng phụ hiểm gặp: đau đầu và chóng mặt, tăng mcn gan, bùn mật, thiếu niệu, tãng
creatinin huyết thanh, nấm đường sinh dục, sốt, run rẩy vả phản ứng quá mẫn hoặc phản ửng phản
vệ ví dụ như co thắt phế quả;;
Các trường hợp tác dụng phụ hiếm gặp nhưng nghỉêm trọng- một vải trường hợp gây từ vong đã
được bảo cảo ở các trẻ sinh thiếu tháng hoặc trẻ sinh đủ thảng (dưới 28 ngảy tuổi) được đìếu trị
bằng ccftríaxon vả canxi qua dường tĩnh mạch. Tùa ceftriaxon- -canxi được quan sảt thấy trong phổi
và thận khi khảm nghiệm từ thì. Ô trẻ sơ sinh, nguy cơ tạo tua cao hơn do lượng máu ít hơn và thời
gian bản thải ceftrỉaxon đâi hơn so với nguời lớn (xem mục 4 3, 4. 8 và 5.2).
Bội nhiễm gây ra bởi vi sinh vật không nhạy cảm vởi ccftriaxon (nắm candida, các nấm khác hoặc
vì khuấn đề kháng khác) có thế được quan sát thấy. Viêm đại trâng giả mạc do Closiridium difflcíle
là một tảo dụng không mong muốn hiếm gặp trong khí điếu trị bằng ccftrỉaxon. Do đó, khả năng bị
vỉêm đại trảng giả mạo do Clostridium dzfflcile phải dược xét tới ở tất cả cảc bệnh nhân có biếu
hiện tiếu chảy sau khi dùng khảng sinh. _-
Hiếm gặp trường hợp viêm tụy. iiìf
Rẳt hiếm gặp viếm ruột có mảng giá hoặc rối loạn đông rnáu. 1
Rất hiếm gặp trường hợp thuốc gây lắng đọng trong ống thận được báo cáo, chủ yếu lá ở trẻ em
hơn 3 tuổi, được điếu trị hảng ngảy với liều cao (2 80 mglkg/ngảy) hoặc tổng liếu quá 10g, và có
yếu tố nguy oơ khác (giảm dịch, hạn chế vận động). Tình trạng nảy có thế oớ triệu chửng hoặc
không có triệu chứng, nó có thể dẫn đến suy thận vả oớ thế hổi phục bằng cách ngừng dùng thuốc
Kết tùa muối oanxi-ocftriaxon trong túi mật đã được quan sát thẳy, chủ yếu là ở những bệnh nhân
được điếu trị với Iiếu cao hơn liều chuẩn được khuyến cảo. Ở trẻ em, nghiên cứu tiền cứu đã cho
thấy một tỷ lệ rất khảo nhau của lượng tùa với việc dùng đường tĩnh mạch, trong một số nghiên
cửu tỷ lệ nảy lên tới trên 30%. Tỷ lệ nảy có vẻ thẳp hơn khi truyên chậm (20- 30 phủt). Ành hưởng
nảy thường không có triệu chứng, nhưng trong các trường hợp hiếm gặp, việc tạo kết tùa nảy có đi
kèm với các triệu chứng lâm sảng như đau buồn nôn vả nôn. Khuyến nghị nên điếu trị triệu chứng
trong những trường hợp nảy. Việc tạo tủa trong túi mật thường hết khi ngừng dùng ccftriaxon.
Phản ửng tại chỗ: hiếm gặp viêm tĩnh mạch tại chỗ sau khi tiêm tĩnh mạch. Có thế phòng tránh
bằng cáoh tiêm chậm (2— 4 phút).
Kết quả xét nghiệm bị sai lệch
Ành hướng tới cảc xét nghỉệm trong` phòng thí nghiệm: Hiếm khi xét nghiệm Coombs cho kết quả
dương tính gỉả ở bệnh nhân được đíếu trị với Maxfeccf Như cảc khảng sỉnh khảo, Maxfcocf có thể
cho kết quả dương tính giả trong xét nghiệm galactose huyết. Tương tự như vậy, các phương pháp
không dùng enzym đế xảo định glucọsc trong nước tiếu có thế cho kết quả dương tính giả Do đó,
việc xác định glucose trong nước tiếu trong khi điều trị với ceftriaxon nên được thực hiện bằng
phương pháp enzym.
4. 9 Quá liều
Trong trường hơp quả liếu, buổn nôn, nôn, tiêu chảy có thể xảy ra. Không thể lảm giảm nổng độ
thuốc trong huyết tương bằng phương pháp chạy thận nhân tạo hoặc thẩm phân phúc mạc. Không
có thưốc giải độc đặc hiệu. Nên điếu trị triệu chứng.
5. CÁC ĐẶC ĐIỂM DƯỢC LÝ
5.1 Dược lực học
Tác dụng khẳng khuấn của ccftriaxon là do khả nãng ức chế sự tồng hợp thảnh tế bảo vi khuấn
Trong in vỉtro ccftriaxon có phố rộng ức chế sự phát triển của cả vi khuẩn Gram âm và Gram
dương. Ceftriaxon có độ bến vững cao với |3- lactamasc, pcnicillinase vả cephalosporinase của vi
khuẩn Gram dương vả Gram am. Trong … vitro và trong thực nghiệm lâm sảng, ceftriaxon có tác
dụng với các chùng vi khuẩn sau (xem mục "Chi định").
Vi k_huẫn hiếu _khi. Gram dư_g. Staphylococcus aureus (nhạy cám với methycillin),
Slaphylococci không sinh coagulasc, Strep;ococcus pyogenes (tan huyết B nhỏm A), Streptococcus
agalactz'ae (tan huyết B nhỏm A), Streptococcus tan hưyết B (không thuộc cảc nhóm A và B),
Streptococcus viridans, Streptococcus pneumomae. _
Chú ỷ: ioải tụ cầu khuẩn kháng methyciilin cũng khảng ccphalosporin, bao gôm ceftriaxon. Nói
chung, Enterococcusfaecalis, Enterococcus faecium vả Listeria monocylogenes khảng iại thuốc.
Vi khuẩn hiếu khí. Gram âm: Acinetobacter twoffl, Acinetobacter anirratus (chủ yếu là A
baumaniỉ) *, Aeromonas hydrophz'la, AIcaligenes fizecalis, Alcaligenes odorans, vi khuẩn
Alcaligenes, Borrelia burgdorferi, Capnocytophaga spp, Cztrobacter diversus (bao gổm C
amalonatícus), Citrobacler. freundii *, Escherichia coli, Enterobacler cloacae *, Enlerobacter
aerogenes *, Enterobacter spp. (khác) *, HaemOphỉlus ducreyi, Haemophilus influenzae,
Haemophilus parainfiuenzae, Hafitia alvei, Klebsiella oxytoca, KIebsiella pneumoniae **,
Moraxella catarrhalis (thuộc lởp Branhamella catarrhalis), Moraxella osloenis, Moraerla spp.
(khác), Morganella morganii, Neisseria gonorrhoeae, Neisseria meningitidis, Pasteurelia
multocida, Plesíomonas shigeiloides, Proteus mirabilis, Proteus penneri *, Proteus vulgaris,
Pseudomonas cepacia, Pseudomonas fiuorescens *, Pseudomonas spp. (khác) *, Providentia
rettgerí, Providentia spp. (khác), Salmonnela typhi, Salmonella spp. (không thương hản), Serratia
marcescens, Serratz'a spp. (khác), Shigella spp., Vibrio spp., Yersinia enterocolitica, YerỮ;ừzịa spp.
(khảo).
* Một số chủng vi khuấn cúa những loải nảy kháng ceftrỉaxon, do sinh B-lactamase - đượế mã hóa
bởi các gen trên nhiễm sắc thế.
** Một số chủng vi khuấn của những loải nảy kháng cefiriaxon, do sinh B-lactamase phố rộng
được mã hóa bởi các gon trên plasmid.
Chú ý: Nhiếu chúng vi khuẩn kế trên kháng với cảc khảng sinh khác ví dụ như amino- vả urcid-
penicillincs, cephalosporin thế hệ 1 và aminoglycosid, lại nhạy cảm với ceftriaxon. Treponema
pallidum nhạy cảm với ceftrỉaxon cả trong in vitro và trên động vật thí nghíệm. Nghiên cửu lâm
sảng oho thấy ccftriaxon có hiệu quả tốt đối với bệnh gìang mai ở giai đoạn 1 và giai đoạn 2. Trên
lâm sảng oảc chủng P aeruginosa khảng ceftriaxon, với một số ít trường hợp ngoại lệ.
Vi khuân kỵ khí: Bacleroz'des spp * Clostrz'dium spp. (.trừ nhóm C. peưi~ingens), Fusobacterium
nucIeatum, Fusobacterium spp., Gafjkia anaerobica, Pepiostrepíococcus spp
~ Một số chùng vi khuẳn của những loải nảy kháng ceftriaxon, do sản xuất 13- lactamasc
LƯU Ý: Nhiếu chủng của loâi Bacteroz'des spp (chủ yêu iả B ftagilis) sản xuất [3- -lactamase kháng
ccftriaxon Clostridium díjỹ'iciie kháng thuốc
Độ nhạy cảm với ccftriaxon có thế được xác định bằng cảoh sử dụng các phương phảp khuếch tán
trên đ” a thạch đế đảnh giá độ nhạy cảm hoặc cảc phương pháp pha loãng trong thạch hoặc canh
thang, theo các tiêu chuẩn kỹ thuật về thử độ nhạy cám cùa Ủy ban Quốc gia về chuẩn mực xét
nghiệm lâm sảng (NCCLS), trong đó có các tiêu chuẩn được diễn giải dưới đây:
Nhạy cảm Trung gian Để kháng
Phương pháp pha loãng MIC (mg/L) s 8 16 - 32 2 64
Phương pháp khuếch tán (30ụg Ceftriaxon 2 2; 20 - ;4 s ;;
lđỉa) _
Đường kính vòng võ khuân (mm)
Lưu ý: Khi dùng ceftriaxon phải xác định được mức độ nhạy cảm cùa cảc vi khuân, chỉ dùng
ceftriaxon khi nó đã được chứng minh tinh nhạy cảm trong … vitro. Trong trường hợp các tiêu
chuẩn để xảo định độ nhạy cảm nói trên không thế sử dụng được, có thế sử dụng cảc qui trinh
chuẩn mực và các tiêu chuẩn để xác định dộ nhạy cảm khác (ví dụ như các tiêu chuẩn DIN, ICS
VV)
5 2 Dược động học
Dược động học của Ceftriaxon không tuyến tính vả ;; oại trữ thời gian bán thải, tất cả các thông số
dược động học chủ yếu phụ thuộc vảo liều dùng neu các thông sô nảy được dựa trên tông Iiểu
dùng.
Hấp thụ: nổng độ huyết tương tối đa đạt được do tiêm bắp liếu 1 g là khoảng 81 mg] ! sau 2- 3 giờ.
Diện tích dưới đường cong phản ảnh nông độ trong huyết tương theo thời gian sau khi tiêm bắp và
tiêm tĩnh mạch giống nhau. Điếu nảy cho thấy sinh khả dụng của ceftriaxon sau khi tiêm bắp là
100%.
Phân bố: thể tích phân bố của ccftriaxon là 7- 12 L.
Ceftrỉaxon phân bố các mô vả dịch cùa cơ thể sau khi dùng một liếu 1-2 g. Nồng độ ceftrìaxon cao
hơn rất nhiêu so với nổng độ ức chế tối thiếu MIC, đã được phát hiện trong vòng 24 giờ trong hơn
60 mô và dịch cơ thề, bao ồm phổi, tim, ống gan mật, amidan, tai giữa và niêm mạc mủi, xương
và não, mảng phổi, tuyến tiên liệt và dịch ổ khớp đối với hầu hết cảc vi khuẩn lá nguyên nhân gây
nhiều bệnh nhiễm trùng.
Sau khi tiêm tĩnh mạch, cefiriaxon nhanh chóng đi vảo dịch nội bảo và nồng độ diệt khuấn chống
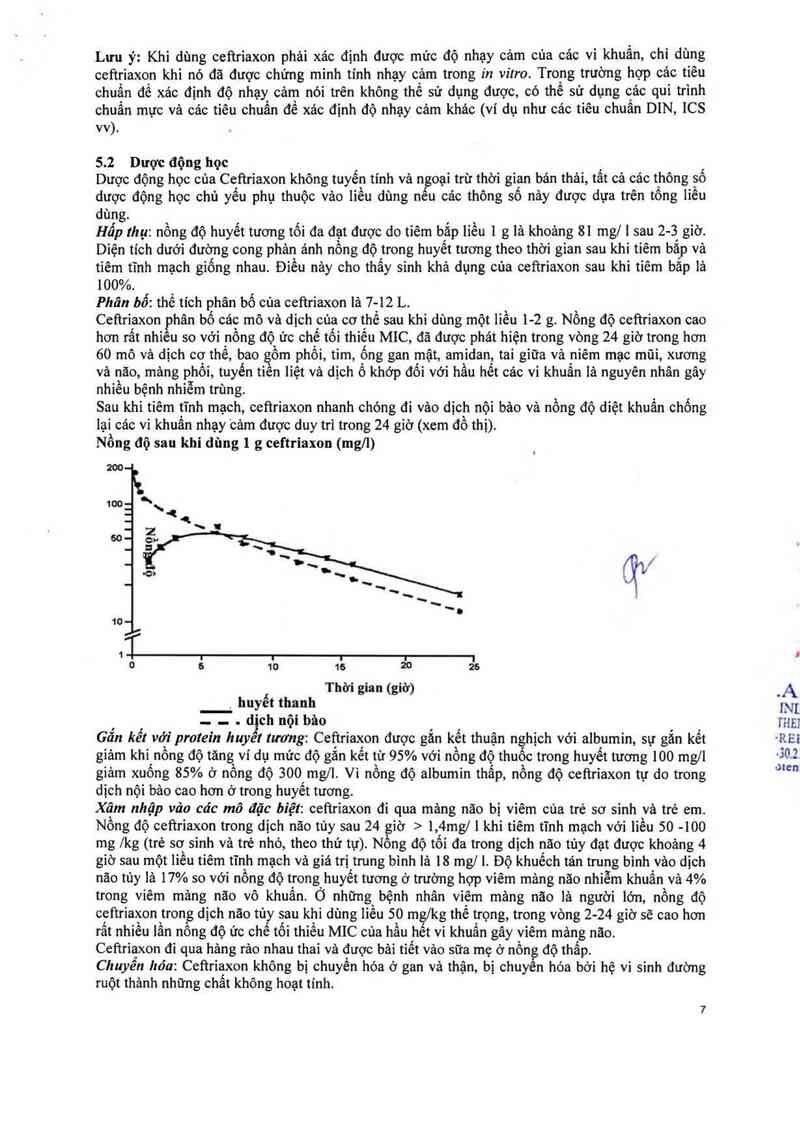
lại các vi khuấn nhạy cảm được duy tri trong 24 giờ (xem đồ thị).
Nồng độ sau khi dùng 1 g ceftriaxon (mgll)
²®
10 16 ²0 ²6
Thời gian (giờ)
_huyết thanh
- - . d'chnộibăo
Gắn kể; với protein huyet lương: Ceftriaxon được gắn kết thuận nghịch với albumin, sự gắn kết
giảm khi nổng độ tăng ví dụ mức độ gắn kểt từ 95% với nồng độ thuốc trong huyết tương 100 mg/i
giảm xuống 85% ở nồng độ 300 mg/l. Vì nồng độ albumin thấp, nồng độ ceftriaxon tự do trong
dịch nội bảo cao hơn ở trong huyết tương.
Xâm nhập vâo các mô đặc bỉệt: ceftriaxon đi qua mảng não bị viêm cùa trẻ sơ sinh vả trẻ em.
Nồng độ ceftriaxon trong dịch não tùy sau 24 iờ > 1 ,4mgl ] khi tiêm tĩnh mạch với liều 50 —100
mg /kg (trẻ sơ sinh và trẻ nhò, thoo thứ tự). Nong độ tối đa trong dịch não túy đạt được khoảng 4
giờ sau một Iiểu tiêm tĩnh mạch và giá trị trung bình lả 18 mgl !. Độ khuếch tán trung bình vảo dịch
não tùy lả 17% so với nổng độ trong huyết tương ở trường hợp viêm mảng não nhiễm khuẩnx và 4%
trong viêm mảng não vô khuẩn. Ở những bệnh nhân viêm mảng não là người lớn, nồng độ
ceftrìaxon trong dịch não tùy sau khi dùng iiếu 50 mglkg thể trọng, trong vòng 2— 24 giờ sẽ cao hơn
rất nhiều lần nông độ' ưc chế tối thiểu MIC của hầu hết vi khuẩn gây viêm mảng não.
Ceftriaxon đi qua hâng rảo nhau thai và được bải tiết vâo sữa mẹ ở non độ thấp.
Chuyển hóa: Ceftriaxon không bị chuyến hóa ở gan và thận, bị chuyển hóa bới hệ vi sinh đường
ruột thảnh những chất không hoạt tính.
1NI
fiiEi
~RE1
-30.2
ủlCn
Thảí trừ: tống độ thanh thải huyết tương lả 10- 22 mllphút. Độ thanh thải ở thận là 5 12 ml /phút.
50- 60% ccftriaxon được đảo thải qua nước tiếu dưới dạng không đổi, 40- 50% đảo thải ở dạng
không đối qua mật. '
Thời gian bản thải đôi với người lớn là khoảng 8 giờ.
Dược động học đối vói các nhóm bệnh nhân đặc bỉệl
Bệnh nhân suy thận hoặc suy gan
Bệnh nhân suy thận hoặc suy gan, dược động học cua ccftriaxon gần như không đồi và thời gian
bản thải tăng không đáng kế. Nếu chỉ suy thặn, tăng đảo thải ccftriaxon qua đưòng mật; nếu chỉ suy
gan, sự đảo thải ceftriaxon qua thận tãng lên.
Người giả
Người giả trên 75 tuổi, thời gỉan bán thải trung binh thường tăng gấp 2- 3 lần nhớm người lớn trẻ
T re em
Ở trẻ sơ sinh, gần 70% lỉếu dùng được phát hiện trong nước tiếu. Trong tuần đầu tiên, 80% liếu
dùng được bải tiết qua nước tiếu; trong tháng đầu tiên, giảm xuống mức tương tự như ở người lớn.
Ở trẻ sơ sinh dưới 8 ngảy tuổi, thời gian thải trừ trung bình tăng gấp 2-3 lẩn so với ở người lớn.
5.3 Số liệu an toản tiếu lâm sảng
Gây quái thai
Nghiên cứu về độc tinh sinh sản ở động vật không cho thấy bất kỳ dấu hiệu nảo vế độc tính trên
phôi thai, gây quải thai hoặc bất kỳ ảnh hưởng nảo khác đối với khả năng sỉnh sản của cả hai giởi
tính, việc sinh, hoặc trước và sau khi sinh. Ở khỉ, không quan sát thấy ceftrìaxon gây độc tính trên
phôi thai hoặc gây quái thai.
6. ĐẶC ĐIÊM DƯỢC PHẨM
6.1 Danh mục tá dược
Thuốc bột: không có tá dược
Dung môi (Dung dịch lidocaìn hydroclorid 1%): nước cất pha tiêm
6.2 Tương kỵ
Không pha trộn ceftriaxon với các dung dịch chứa canxi, như là dung dịch Hartmann và dung dịch
Ringcr.
Ceftriaxon tương kỵ với amsacrin, vancomycỉn, fluconazol vả aminoglycosid. W
Không được trộn lẫn hoặc thêm các dung dịch khác vảo dung dịch ceftriaxon
Dung dịch pha loãng có chứa canxi (ví dụ dung dịch Ringcr hoặc dung dịch Hartmann) không
được dùng để hoản nguyên ccftriaxon. Không được trộn lẫn hoặc dùng đổng thời ccftriaxon với bắt
kỳ dung dịch tiêm tĩnh mạch có chứa canxi nảo (xem mục 4. 2, 4. 3, 4. 4 vả 4. 8).
6 3 Hạn dùng
36 thảng kế từ ngảy sản xuất.
Không dùng thuốc hết hạn sử dụng.
6. 4 Thận trọng0 đặc biệt trong bảo quãn
Bảo quản dưới 300 C.
Dung dịch pha loãng ổnđịnh trong 6 giờ ở nhiệt độ dưới 25°C hoặc 24 giờ trong tủ lạnh (2—80C).
Bảo quản trong bao bì gôc.
6.5 Qui cách đóng gỏi
Hộp ] lọ 1g cciìriaxon + 1 ống dung môi.
6. 6 Hướng đẫn dùng và xử lý
Xem mục "Liều lượng và cách sử dụng", bột pha tiếm Maxfcccf phải được hoản nguyên trước khi
dùng
Xử lý bơm tiêm/ kim tiêm
Phải tuân thủ nghiêm ngặt việc sử dụng và xử lý bơm kim tiêm thuôo như sau:
JUST
;S LA
CE
-18161
J.gr
~ Bơm kim tiêm được sử dụng một lần duy nhất.
- Sau khi dùng, bỏ tất cả các kim đã được dùng trong bao bì chứa kim (bao bì chi an toản khi dùng
một lần).
' Đề xa tầm tay trẻ em.
' Không loại bỏ kỉm đã sử dụng vảo rác thải sinh hoạt.
' Loại bỏ bao bì theo qui định của địa phương hoặc hướng dẫn của bác sĩ.
Xử lý các thuốc không được sử dụng sau khi hết hạn sử dụng.
Hạn chế tối đa việc thải thuốc vảo môi trường. Không được ioại bỏ thuốc thông qua hệ thống thoát
nước hoặc rác thải sỉnh hoạt. Nếu có thế, sử dụng hệ thống thu gom cùa địa phương.
6.7 Tiêu chuẩn: BP 2015
Thông báo cho bảc sỹ về ca'c Iảc dụng không mong muốn gạp phải khi sử dụng thuốc
Đê xa tầm với trẻ em!
Nhà sản xuất: q7
DEMO S.A. Pharmaceutical Industry
21St km National Road Athens-Lamỉa
14568 Krioneri, Athens— Hy Lạp
TUQ. cục TRUỞNG
P.TRư'JNG PHÒNG
Jiỷuấễn Jẳly JẳìMý
.'!A
537
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng