










Bộ Y TẾ 360/gỹ/
cuc QUAN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
… ui….ttỉJát...…tảoư…
1
uumnmmananm. muumuuxmn…imx
ũlll.SỦM Mpiilciúllllhlmtftll’.
lưuvmu an.lngsmtm CE…
rumunumnnmnmm. hnủ — h…mhllụnnnnuubl
nansmrmntma. Sun Awluww/hhm
NInut ph Ibmk MTaSẸn IG.Smủm um
mua. … nu… !ImIR au khu: ầẵ/Jisig'g'ghl
I'rlbutnnnmln. lill. Sđum fimu
luumltfủmúdsifflluidttb
Muml uu
Yuthftllnnvlulủhmluulmls
Amunimt iètlỉlùl nmumm ouhwưn lnl núi: v…
ủnmn fflrlh ùIùbu; l-knhin. thl …
Snnnĩ't I'Nmmhuu) hnltlculiwtnb & inlein
m mm lnlwmi: muh… Inu
Emma: m…lu ibủA 41th t 1 nm…
fun… um HH'C [Inn Illlll
…dl …
A… mtn d'o-JI'Ctm erựltưl)
ldabmydllwiltlduhsniim
I III Mum muhimú 10 m
Ennưax c.u~iùln mm, Lhútlư WM
l-lulliurmmmununnumhnm
numnl. L- mmtum. uhwbm
… pur rua… mdliu
nưpb. 0mmull'smthmửu lnliũưứđthuhzmù
hiu ro-rc Iựmmn KMmI’J lSuutụ !aulmlz mu lrúimhìn
kMdni’nul Va Liilschm l—IUHW WM. NIIHỉn. mMsulnưll c ễ
Wquth :: Ế
' Iudưuúnnl'ẳi nulul pmiiMin
Iwilm u
'ồ Q M A swml ìuuưw mhut
?
.A . f~ .M\\
V
& °’ ’ usx … wo sx- ……mr -mv mm… … …
` ẺỀÌÚJỆN……ffl … …… …. . ..… ….. … …………… …. ………… ……
= | lb le f uupảnuana..m x…nu-l ….
MW… zu uilel ua…u nu…u su.… … nmflluullllu …«v sm- <.vmn-m
cninyn :… …; … cut …… um… ……g … … …. nảnlzvmmun :… ntznuc , … nt W
› - . S 1] ' ) VSVF li. nua ! K1`.N Vfl u ›! : :: Ilnu n
«2 70T H tzmnm ;" ~ “~ '~ …… *~ … …… .… … …~…= :……..zr…zzrzz… …
` /’ mlmu ullmu
’Ả’ — mmamm … ut
m-uw »… … ~'
1 …… mwmm mm: …… m
tau] mm n…… um~u ncm: /
mom WWW 1mm MIer ;
Imx-m …… mrzrmv … Im
«~ num-umvm
(
Imibủimù … mlnt
Fu…upiumự
Pmliihttpù…
Sdmhupinlsiilinlhmmu qullluu
SúủIllltilffll/ lllủl WIIIIQIIIWÌIIITUI
lni 10.23 vaìnuwíal
ỉmi xUBml/Ụnu
WIQIÌZẵIIVÌR 3ml ui Ilmn
] lìmhì…M 1115 dIIJ lu ụn BurcmnMc
®
IIIỊIIII .
01
\
\
LOUIS-GEORGES LASSONNERY
Chiet Representative
Tna Representative Oifice of
Novartis Phanna Sarvices AG ín HCMC
õ` `\`
~ Ộ '
VAN PHQ_NG è.
nq.l_ DH_ÌN _. fuỵ'.
JH PHÙ …
(u)
nu
gMA
. l“
qồ
%
(
:
Sduđh W
mm: Phun MM. …
.. .……… Hõ` HÍMINH ..
mu uozuu mnmm lz
_zosuave
utimfưỉlịdiffl/
NOVAR'I'l 5
0u/ld
LOUlS-GEORGES LASSONNERY
Chìef Representative
The Representative Office of
Novam's Pharma Services AG in HCMC
.`e
Ì Z! ÌLIH
Ổ› NOVARTIS
Rx - Thuốc bản theo dơn
Lucentis®
Thuốc chống sự hình thảnh tân mạch
THÀNH PHẨN VÀ DẠNG BÀO CHẾ
Mỗi mL chứa 10 mg ranibizumab. Mỗi lọ chứa 2.3 mg ranibỉzumab trong 0.23 m! dung dịch.
Ranìbìzumab lả m_ột đoạn kháng thể đơn dòng giống như ở ngưòi được sản xuất từ tế bảo của
lĩscherichia coli băng kỹ thuật DNA tái tỏ hợp.
Danh mục đầy dù các tả dược` xem phần TẢ DƯỢC .
Dung dịch tiêm vô khuẩn. trong suốt. không mảu đền mảu vâng nhạt, không có chất báo quán.
CHỈ ĐỊNH
Luccntìs _đu'ợc chí dịnh để diểu trị thoái hóa hoảng đĩềm liên quan đến tuồỉ gỉả (AMD) có tân
mạch (thê uót) (Xem phân DƯỢC LỰC HỌC).
LIÊU LƯỢNG vÀ CÁCH DÙNG Ễ/
Lọ sử dụng một lân chi dùng tiêm trong dịch kỉnh.
Lucentis phải dược bác sĩ chuyên khoa mắt có dù kinh nghiệm sử dụng tìêm trong dịch kính.
| iều l ucentis dược khuyến cáo lả 0 5 mg (0 05 ml)
Diều trị Lucentis đuợc khời đầu vởi một gĩai đoạn nạp bằng một mũi tìẽm mỗi tháng trong 3
tháng lỉên tỉếp sau đó lả giai đoạn duy trì trong đó bệnh nhân cần được theo dõi thị lực mỗi
thảng. Nếu bệnh nhân bị mất thị lực hơn 5 chữ (được dánh giá bằng thẻ đo thị lực ETDRS hoặc
tương đương với một dòng thị lực theo Snellen). thì nên dùng Lucentỉs. Khoảng cảch giữa 2 lìểu
không dược dưới l tháng.
Cũng như tất cả cảc thuốc dùng đường tỉẻm. phải kỉềm tra kỹ Lucentis bằng mắt về tiều phân
không hòa tan vả sự đôi mảu trước khi sử dụng
Kỹ thuật tỉêm phái đuợc thực hiện trong diển kìện vỏ khuần bao gồm vỉệc sử dụng cảc chẳt diệt
khuẩn bản tay dùng trong phẫu thuật. gãng vô khuẳn. vái phú vô khuắn vả banh mí mắt vô khuấn
(hoặc dụng cụ tuong đương) vả có săn dụng cụ chọc hút vô khuẩn (nếu cẩn) Cần đánh giá cẩn
thận tiền sử phản ửng quá mẫn cám cúa bệnh nhân trước khi thục hiện thủ thuật tiêm trong dịch
kính (xem phẩn ( HÓNG CHỈ DỊNH) Da quanh mắt mi mắt. bề mặt cua mắt phải duợc khư
khuấn. Cần gây tê đẳy đủ vả sủ“ dụng thuốc diệt khuẩn dùng tại chỗ phố rộng trước khi tiêm.
Bệnh nhân phải được hưởng dẫn tự nhủ thuốc kháng khuấn 4 lần mỗi ngảy trong 3 ngảy trước vả
sau mỗi lân tìêm.
Về cách chuẩn bị thuốc Lucentis. xem phần HƯỚNG DÀN SỬ DỤNG VÀ THAO TÁC.
Kìm tiêm nên được tiêm cắm sâu 3 5- 4 mm phía sau ria vảo trong khoang dịch kính trảnh kinh
tuyến ngang. và hưởng về trung tâm lnhãn cầu. Sau đó bơm vảo 0 05 ml. nẽn xoay quanh vị trí
cùng mạc mắt cho những mũi tỉẽm tiếp theo.
Thông tin thêm về cảc nhỏ… bệnh nhân đặc biệt
Suy gan
…JI
'ẽJ' \Ị.MỬV
\
Lucentis chưa đuợc nghiên cùu ở bệnh nhân suy gan. Tuy nhiên vì luợng hấp thu toản thân
không dáng kế. khỏng có phương pháp đặc bìệt nâo đuợc xem là cần thiết với nhóm bệnh nhân
nảy.
Suy thận
Không cẩn điều chính Iiếu ở bệnh nhân suy thận (Xem phần DƯỢC ĐỌNG HỌC)
Trẻ cm và thiểu niên (dưới 18 tuổi)
Khỏng khuyến cáo dùng Lucentis cho trẻ em và thiểu niên do thiếu dữ lìệu về độ an toản và hiệu
quả ở những nhóm bệnh nhân nảy.
Người cao tuổi (từ 65 tuổi trở lên)
Không cần dỉểu chỉnh liều Ở người cao tuốì.
CHỐNG CHỈ ĐỊNH
Quá mẫn cảm với hoạt chất hoặc vởi bất cứ thânh phần nảo của tả dược.
Bệnh nhân đang có hoặc nghi ngờ bị nhìễm trùng mắt hoặc quanh mắt.
Bệnh nhân đang có viêm lrong mắt.
CẨNH BÁO VÀ THẶN TRỌNG ĐẶC BIỆT KHI sử DỤNG
Dọc kỹ hướng dẫn sử dụng Iru'ớc khi dùng. Nếu cần Illẽm lhông rìn, xìn hỏi ý kiểu bác sĩ. ả
Thuốc nảy chỉ dùng Iheo sự kê đơn của bác sĩ. ,
Tìẽm trong dịch kính. kể cả tíêm Lucentỉs, có liên quan đễn viêm nội nhãn. viêm lrong mắt. bong
võng mạc do vết rách. rảch võng mạc. đục thúy tinh thể do chấn thương do dùng thuốc (Xem
phẩn 'I'ẢC DỤNG KIIÔNG MONG MUÔN). Phải luôn luôn ảp dụng kỹ thuật tiêm vỏ khuẩn
dùng khi sử dụng Lucentis. Ngoải ra. bệnh nhân phải đu-ọc theo dõi trong tuần sau khi tiêm đê
điều trị sở… nếu xảy ra nhiễm khuẳn. Cần hướng` dẫn bệnh nhãn bảo cáo ngay bất cứ triệu chừng
nảo nghi ngờ viêm nội nhãn hoặc bẳt cứ tinh trạng nảo được đề cập ở trẻn.
Dã ghi nhận tăng áp suất nội nhãn trong vòng 60 phút sau khi tiêm Lucqntìs (Xem phần TÁC
DỤNG KHONG MONG MUÔN). Vì vậy cả ảp suât nội nhãn và tiêm truyên vùng dâu thân kinh
thị phải được theo dõi và xử trí thích hợp.
Có nguy cơ tìềm tảng bị thuyên tắc động mạch sau khi tiêm trong dịch kính cảc thuốc ức chế
VF(iF (yếu tố phảt triến nội mô mạch máu). Trong các nghìên cúu pha lll về AMD thể ướt tẩn
suất bị thuyên tắc dộng mạch là như nhau giữa nhóm dùng ranibìzumab và nhóm chún.g Tỉ lệ bị
đột quỵ cao hon ò nhóm bệnh nhân dùng ranibìzumab 0.5 mg so vói nhóm dùng ranỉbizumab 0 3
mg hoặc nhóm chúng. tuy nhiên sự khảc biệt lá không có ý nghĩa thống ké. Sự khảo nhau về ti
lệ đột qu; có thề lởn hơn ở những bệnh nhân đuợc bìết lá có nhũng nyêu tố nguy co cùa dột quỵ
bao gồm cả tiền sử đã bị đột quỵ trước đó hoặc các cơn thiếu máu cục bộ thoáng qua. Do dó các
bệnh nhản nảy phải dược bảc sĩ đánh giá cấn thặn xem liệu việc diều trị với Luccntis có thích
hợp và lợi ích có lớn hơn nguy cơ tiểm tảng.
Cũng như tất cả các protein trị liệu, Lucentìs có khả năng sinh miễn dịch.
bộ an toản và hiệu quả cùa điều trị Lucentis đồng thời cho cả hai mắt chưa được nghiên cứu.
Lucentìs chưa được nghiên cứu trên cảc bệnh nhân đang bị nhiễm trùng hệ thống tiến triến hay
các bệnh nhán dang bị các bệnh khảc vé măt như bong võng mạc hay lỗ hoảng điêm.
TƯO'NG TÁC THUỐC
Chưa có nghiên cứu chính thức nảo về tương tảc thuốc dược thực hiện.
PHỤ NỮ có THAI VÀ CHO CON m':
Phụ nữ có thai
Không có dữ liệu lâm sảng về việc sử dụng ranibizumab ở phụ nữ có thai.
Các nghiên cứu trên khi cynomolgus không cho thẩy các tác động có hại gián tỉểp hay trục tiếp
đối vói khi mang thai hay sự phát triền của phôi thai (xem phần CẢC DỮ LIỆU AN TOÀN
TIÊN LÂM SÀNG).
Nguy cơ tiếm tảng đối vói con nguời chưa được biết dến.
Cần thận trọng khi dùng cho phụ nữ có thai.
Phụ nữ có khả nãng mang thai
Nhĩmg phụ nữ có khả nảng mang thai nên dùng phương phảp ngừa thai có hiệu quả trong khi
điêu trị.
Cho con bú
Chưa rõ có phải Lucentis được bảì tiết qua sữa mẹ hay không. Để dễ phòng, khuyến cảo không
cho con bú trong thời gian sử dụng Luccntìs.
TÁC ĐỌNG CỦA THUỐC KHI LÁ] XE VÀ VẬN HÀNH MÁY MÓC
Thủ thuật điều trị Lucentis có thể gây rối loạn thị lục tạm thời có thể ảnh hưòng đến khả năng
lái xe hoặc sử dụng mảy móc (Xem phần TÁC DỤNG KHONG MONG MUÔN). Bệnh nhân có
nhũng dấu hiệu nảy không được Iải xe hoặc sủ dụng mảy móc cho đến khi các rối loạn thị lực
tạm thời nảy giảm di.
TÁC DỤNG KHÔNG MONG MUÔN Ji
Af/j
Nhóm bệnh nhân bị AMD thể ướt
Dân số nghỉẻn cứu bao gồm tồng số ! 3.IS bệnh nhân trong ba nghiên củu pha III về AMD thề
ưót được đỉều trị với Lucentìs trong 24 thảng vả 440 bệnh nhân dã đuợc dìều trị với lìều khuyến
cáo 0 5 mg.
Những phản ủng phụ nghiêm trọng có liên quan đến thủ thuật tiêm bao gốm viêm nội nhăn bong
võng mạc do vêt rách rách võng mạc vả đục thủy tinh thể do chấn thương do dùng thuốc (Xem
phần CÁNH BÁO VÀ THẬN TRỌNG ĐÀC BIẸT KHI SU DỤNG)
Những phán ứng phụ về mắt nghiêm trọng khác quan sảt thấy ở những bệnh nhân điều trị
Lucentis bao gôm viêm trong mắt và tăng áp suất nội nhãn (Xem phần CÁNH BÁO VÀ iHẬN
TRỌNG ĐẶC BIẸT KHI SU DỤ NG).
Những phản ửng phụ đưọc liệt kê dưới đây chiếm một tỷ lệ cao hơn (ít nhắt z diềm phần trăm) ơ
nhũng bệnh nhân đang diếu trị bằng Lucentis () 5 mg so với nhũng nguời điều trị ở nhóm chứng
(tiêm giá dược (xem định nghĩa ở phần DUỌC ĐỘNG HỌC) hoặc trị liệu quang động học
(PDT) vởi vcrtcporfin) theo dữ liệu gộp cúa 3 nghiên cúu giai đoạn III về AMD thề uớt có kiêm
chứng FVF2598g (MARINA) FVF2SS7g (ANCHOR) vả FVF3I92g (PIER) Vì vặy những
phản ứng nảy duợc xem lả những phản ứng có hại cùa thuốc có thể có. Dữ liệu an toản dược mô
tả dưới đây cũng bao gồm tât cả phản ủng phụ đuợc nghi ngờ ít nhắt lá có khả nảng Iiẽn quan
dến thủ thuật tiêm hoặc do thuốc ở 440 bệnh nhãn bị AMD thể ướt trong nhóm diều trị phối hợp
0 5 mg.
Nhũng phản ủng phụ đuợc liệt kê theo nhóm cơ quan hệ thống vả theo tần suất sử dụng quy uóc
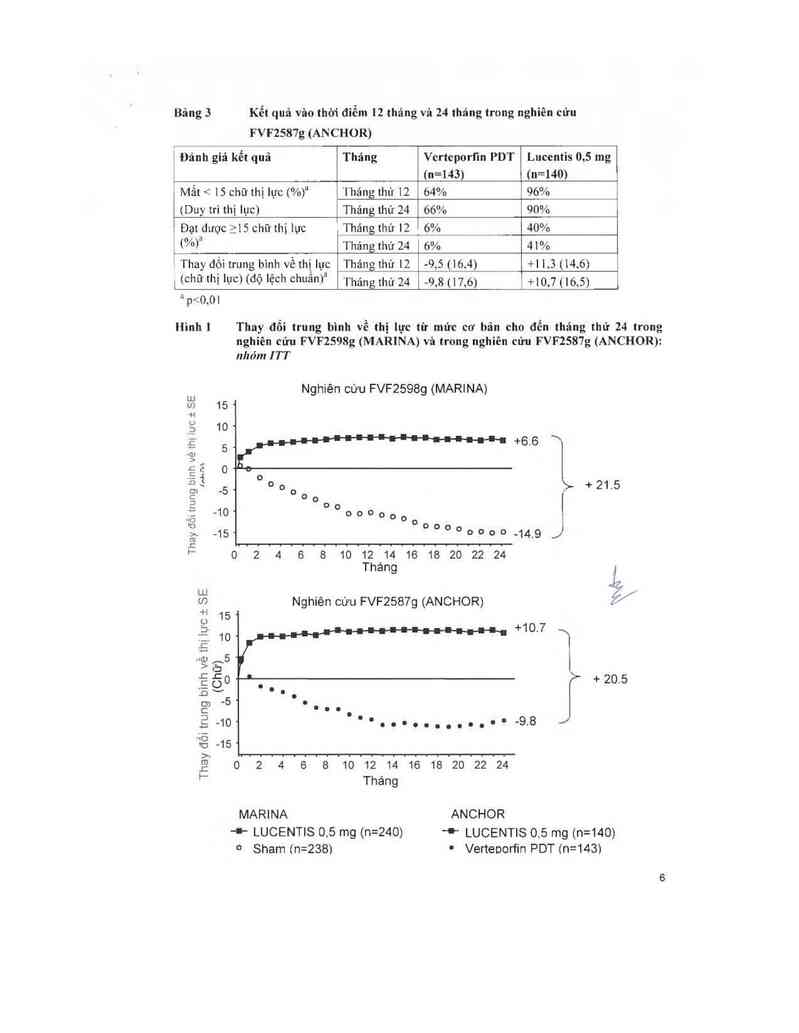
sau đây: rãt hay gặp(> 1/10) hay gặp (> 1 l00 đển < l/IO) ítgặp (> lfl .000 đến ° Thảng thứ 12 62% 95% __ _ __Ả
_l5 chữthị lực Tháng thứ l2 5% 34%
(%> Tháng thứ 24 4% 55%
'I`hay dối trung bình về thị lực ẤTháng thứ 12 -l0.5 (16.6) 47,2 [14.4)
_ tchũ' thì lực) (dộ lệ_ch chuânì“ Tháng thứ 24 —l4.9(18_7) +6,6 (16,5)
" p -5 0 o 0 0
Ễ —10 o o o o 0 o o 1
.,0 o 0
to 0 o o 0
ẫ -15 o 0 o 0 -14.9 J
C
*“ 024681012141618202224
Tháng
UJ .. . ỊỄ/
ƯJ Ngh1en cưu FVF2587g (ANCHOR) 1
| .
Ỉổ 15 +107
:J 10 - ` \l
5
«m As i
> Ô
C .C n \
E 00 . , * 20-5
.O V . .
Ê“) "5 O . . .
Ễ-1O .'oo°oog.oơo"'g-8 /
"ổ -15
>
Ễ 024681012141618202224
F—
MARINA
Tháng
+ LUCENTIS 06 mg (n=240)
° Sham ( n=238)
ANCHOR
* LUCENTIS 0.5 mg (n=140)
- Verteoorfin PDT (n=143ì
Ó nhóm bệnh nhân dược diếu trị bằng Lucentis nói chung, có sự tỉến triến của tốn thương tân
mạch hắc mạc có thế quan sảt đuợc ở mức tối thiều Vảo tháng thủ 12; thay đồi trung bình về
toản bộ vùng tồn thương tân mạch hắc mạc lả 0,1 đến 0 3 DA đối với Luccntìs so với 2 3- 2 6
DA ở nhỏm chứng.
Kết quả từ cả hai thứ nghìệm chỉ ra rằng việc tiếp tục đỉếu trị với ranibizumab có thể có lợi cho
cả những bệnh nhân mât 2 15 chủ theo kinh diêu chỉnh (BCVA) trong năm đâu đỉều trị.
Việc sử dụng Luccntis trên 24 tháng chưa được nghìên cứu.
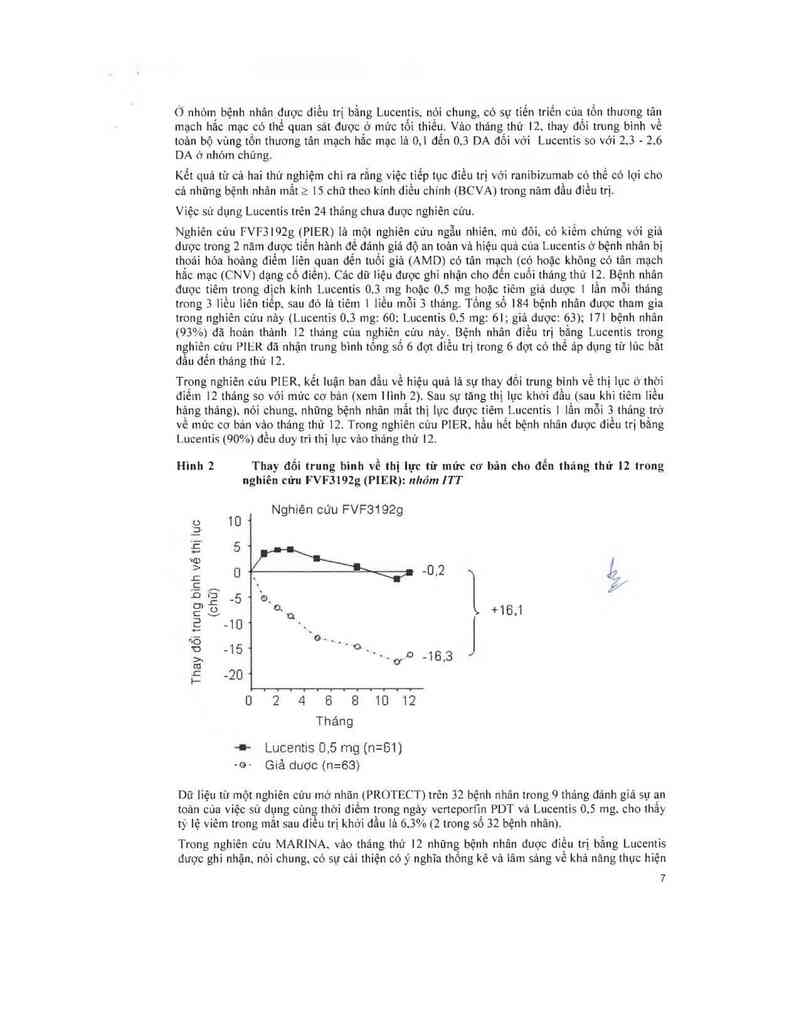
Nghiên cứu FVF3102g (PIER) là một nghiên cứu ngẫu nhỉên; mù đỏi; có kiềm chứng vởi giả
dược trong 2 năm được tiến hảnh đề đảnh giá độ an toản vả hiệu quả cùa Lucentis ở bệnh nhân bị
thoái hóa hoảng điểm liẽn quan đến tuối giả (AMD) có tân mạch (có hoặc không có tân mạch
hắc mạc (CNV) dạng có diền). Các dữ liệu được ghi nhận cho đến cuối tháng thứ 12. Bệnh nhân
đuợc tiêm trong dịch kính Lucentis 0.3 mg hoặc 0.5 mg hoặc tiêm giả dược 1 lần mỗi tháng
trong 3 lìều liên tìếp. sau đỏ là tiêm 1 liều mỗi 3 thảng. Tống số 184 bệnh nhân được tham gia
trong nghiến cứu nảy (Luccntis 013 mg: 60; Luccntis 05 mg: 61; giá dược: 63); 171 bệnh nhân
(93%) đã hoản thảnh 12 thảng cùa nghiên cứu nảy. Bệnh nhân diều trị bằng Luccntis trong
nghiên cứu PIER đã nhận trung bình tồng số 6 dọt diều trị trong 6 dợt có thể áp dụng từ lủc bất
dầu đến thảng thứ 12.
Trong nghiên cứu PIER. kết luận ban dầu về hiệu quả lả sự thay đối trung bình về thị 1ụ-c 6 thời
đìếm 12 tháng so vởi mức cơ bản (xem llình 2). Sau sự tăng thị lục khởi dầu (sau khi tiêm liều
hậng tháng)` nói chung; những bệnh nhân mắt thị lục đuợc tiêm Luccntis 1 lần mỗi 3 tháng trở
về mủc cơ bản vảo tháng thủ 12. Trong nghiên củu P1ER. hầu hết bệnh nhân được điều trị bằng
1 ucentis (90%) đều duy trì thị lục vảo thảng thứ 12.
Hình 2 Thay đổi trung hinh về thị lực từ mức cơ bản cho đến tháng thứ 12 trong
nghiên cứu FVFJI9Zg (PlER): nhóm ITT
Nghiên cứu FVF3192g
.o 10'
E.
ẻ s—
“*GJ
Ễ [] .ểv -o_2 \ nL,
E ,; -_ f,
.o 13 _5 . @
Ể’Ễ qQ [ +161
Ế ›… - .
°Ễõ 0.
2 '15 o -16,3
Ê 20
|_ -
Thảng
+ Lucentis 0.5 mg (n=61)
—G~ Giả dược (n=63)
Dũ liệu tư một nghiên củu mở nhãn (PROTECT) trên 32 bệnh nhân trong 9 thảng đánh gỉả sự an
toản của việc sử dụng cùng thời đìếm trong ngảy vcrteporfin PDT vá Lucentỉs 0. 5 mg cho thấy
tỷ lệ viêm trong mắt sau dỉêu trị khởi dầu là 6. 3% (2 trong SỐ 32 bệnh nhân).
Trong nghiên cứu MARINA. vảo tháng thứ 12 những bệnh nhân được diệu trị bằng Lucentis
được ghi nhặn; nói chung, có sự cải thiện có ý nghĩa thỏng kê và 1âm sảng vẻ khá nảng thực hiện
7
các hoạt động lìên quan đến nhìn gần. nhìn xa và cảc hoạt động phụ thuộc đặc biệt vảo thị giác.
được đánh giá bằng thang điếm NEI VFQ—2S; trong khi những bệnh nhân dùng giả dược cho
thẩy sự suy giảm khả năng trong việc thực hỉện những hoạt động nảy. Ở thang điềm đảnh giá
hoạt động nhin gần; bệnh nhân diếu trị bằng Luccntis báo cảo tãng +10;4 điếm; trong khi bệnh
nhân dùng giả dược giảm 26 điếm (p<0.01). Ở thang điếm đánh gỉá hoạt động nhin xa. bệnh
nhân điếu trị bằng Lucentis được ghi nhặn tăng +7 điềm. trong khi bệnh nhân dùng giả dược
giảm 5.9 đíềm (p<0,0I ). Ở thang điềm đánh giá hoạt động phụ thuộc đặc biệt vảo thị giảc. bệnh
nhân điểu trị bằng Lucentis được ghi nhận tăng +6.8 đìếm. trong khi bệnh nhân dùng giả dược
gìảm 4.7 điềm (p<0;01).
Sự gia tãng nảy so với mức cơ bản ở một trong 3 thang điếm phụ VFQ-25 nêu trên vảo thảng thứ
12 đã dược duy trì vảo thảng thứ 24 đối vói bệnh nhân điếu trị bằng Lucentis; trong khi ở nhóm
tiêm giả dược sự thay đối trung bình so với múc cơ bản giảm thêm từ tháng thứ 12 đến tháng thứ
24 trong từng thang điếm phụ. Vì vậy, lợi ich điều trị của Lucentis so với điếu trị giá duợc ở
tháng thứ 24 cao hơn so với ở tháng thứ 12.
Trong Inghiên củu ANCHOR. vảo thảng thứ 12 những bệnh nhân đuợc điếu trị bằng [ucentis
cho thẳy có sự cải thìện có ý nghĩa thống kê và lâm sảng về khả năng thực hiện các hoạt động
liên quan đến nhin gần. nhìn xa vả các hoạt động phụ thuộc dặc biệt vảo thị gìác so với bệnh
nhân_điếu trị bằng vcrteporf'tn PDT. Ô thang điềm đánh giá hoạt động nhìn gẩn bệnh nhân điểu
trị băng Lucentis 0. 5 mg đuợc ghi nhận tăng +9.1 điếm; trong khi bệnh nhân đìếu trị bằng
vertcporiìn PDT tăng +3; 7 điếm (p<0 01). Ô thang điếm đánh giá hoạt động nhìn xa, bệnh nhân
đìểu trị với Lucentis đuợc ghi nhận tãng +9 3 điếm trong khi bệnh nhân điếu trị bằng vertepori'm
PDT tăng 1; 7 đỉếm (p<0 01). Ở thang điếm đánh giá hoạt động phụ thuộc đặc biệt vảo thị giác;
bệnh nhân điếu trị bằng Lucentis được ghi nhận tăng +8.9 diếm trong khi bệnh nhân điếu trị
băng veneporfm PDT giảm 1;4 điềm (p<0.0I ). Trong nhóln dùng vcrteporf'm PDT, sự cải thìện
trung bình so vởi mức cơ bản theo thang điếm phụ đánh giá các hoạt động nhìn gần vả hoạt động
nhin xa vảo tháng thứ 12 đã bị mất vảo tháng thứ 24. trong khi sự gìảm trung bình so với mức cơ
bản theo thang điếm phụ đánh giá hoạt động phụ thuộc đặc biệt vảo thị giảc vảo tháng thứ 12 đã
dược duy tri vảo tháng thứ 24. Những thay đồi giữa thảng thứ 12 và thảng thứ 24 trong mỗi
nhóm điêu trị cho thẳy kết quả duy trì hay lợi ích diếu trị cao hơn cùa ranibizumab đối với
verteport'm PDT khi so sánh ở tháng thứ 12, trong khi lợi ích điều trị cùa ranibizumab theo thang
điếm phụ đánh giá hoạt động phụ thuộc đặc biệt vảo thị giảc lả kém hơn ở thảng thứ 24 so với
tháng thứ 12 (giá trị p trong khoảng từ o;0023 đển 0;0006).
Nghiên cứu FVF3689g (SAILOR) là một nghiên cứu pha lllb. mù đon; đa trung tâm trong một
năm trên những đối tượng không biết trước vẻ đã được điểu trị CNV do AMD trước đó. Mục
đích nghiên cứu chính lả đảnh giá ti lệ bị các tác dụng phụ nghiêm trọng với mắt vả ngoải mắt ở
nhũng đối tuợng được điều trị 12 tháng. Hai nghin ba trăm bảy mươi tám bệnh nhân được chọn
ngẫu nhiên theo tỉ lệ 1: 1 dế tiêm trong dịch kính ranibizumab 0; 3 mg hoặc 0. 5 mg 1 lần mỗi
thảng trong 3 thảng liên tiếp sau đó lả diếu trị lại nếu cẩn nhưng không quá 1 Iần/tháng
Nhìn chung. khỏng quan sảt thấy sự mất cân bằng giũa hai nhóm liều về tẩn suất cùa cảc tác
dụng phụ với mắt vả ngoải mắt Có xu hướng tăng cao không đảng kể về mặt thống kê về t1 lệ
đột quỵ ở nhóm dùng 0; 5 mg so vởi nhóm dùng 0 3 mg. Khoảng tin cậy (Cl) 95% đối với tỉ lệ
đột quỵ nhin chung 1ả rộng (0. 3% đến 1 ;3% ở nhóm dùng 0 3 mg so với 0. 7% đến 2 0% ở nhóm
dùng 0; 5 mg). Số lượng đột quỵ lá nhỏ ở cá hai nhóm liều vả không có đủ bằng chúng để kết
luận (hay bác bò) răng có một sự khảc nhau thực sự về tỉ 1ệ đột quỵ giữa các nhóm điếu trị. Sự
khảo nhau về tỉ lệ đột quỵ có thế lởn hơn ở những bệnh nhân được biêt lá có nhủng yếu tố nguy
cơ của đột quỵ; bao gồm cả tìền sư đã bị đột quỵ trưởc đó hoặc các cơn thiểu máu cục bộ thoáng
qua.
** Thu lhuậl liêm gia dược lién quan đến sự gây lẻ mắt theo cách giống như Iiẻm Lucentis trong
dịch kính Đầu czia óng liêm khóng kim ]ủc đó đè vảo kết mạc vả piston của ống tiêm khỏng kim
được đáy xuống
DƯỢC ĐỌNG HỌC
Sau khi tiêm 1 ucentis trong dịch kính hảng thảng cho bệnh nhân bị thoái hóa hoảng điểm 1iên
qụan đển tuối giả (AMD) cỏ tân mạch nồng dộ ranibizumab trong huyết thanh thường thấp với
nông độ cao nhất trong huyết thanh (C mat) thường thấp hơn nông độ ranibizumab cân thiết để ức
chế hoạt động sinh học cùa VEGF khoáng 50% [11 đến 27 nglmL đuợc đánh giá trong một thủ
nghiệm tăng sinh tế bảo in vilro) Nổng độ cao nhất trong huyết thanh (C,…) tỉ lệ thuận với liều
ờ liếu từ 0; 05 đếnl; 0 mg/1 mắt
Dựa trên phân tích dược động học ở nhóm nghìến cứu và sự biển mắt của ranibizumab khói
huyết thanh ớ bệnh nhân điếu trị với liều 05 mg; thời gian bán thải trung bình cùa ranibizumab
trong dịch kinh khoảng 9 ngảy. Khi tiêm 1 ucentis 0 5 mg/l mắt trong dịch kính hảng thảng
nồng độ cao nhất trong huyết thanh (C.…) của ranibizumab đạt được khoảng 1 ngảy sau khi
tiêm. được dụ đoán thường dao động ở mủc tư 0; 79 dến 2, 90 ng/mL vả nông độ thấp nhất trong
huyết thanh (C……) dược dụ doán thường dao dộng ở mức từ 0 07 đến 0 49 ng/mi Nồng độ tốn
lưu của Ranibìzumab trong huyết thanh được dự đoản thẳp hon khoảng 90.000 Iẳn so vói nồng
độ tồn lưu cùa ranibizumab trong dịch kính.
Bệnh nhân suy ihận: Chưa có nghìên cứu chinh thức nảo dược thực hiện để kiếm tra dược động
học cùa 1.ucentis ở bệnh nhân suy thận. 68% bệnh nhân (136 trong số 200) trong một phân tich
được dộng học ở nhóm bệnh nhân nghiến cứu bị suy thận (465% nhẹ [50-80 ml/phủtj; 20%
trung bình [30-50 milphút] vả I,5% nặng [< 30 mllphủtị). Độ thanh thải toản thân hơi thâp hớn.
nhưng điểu nảy không có ý nghĩa lâm sảng.
Sny gam Chưa có nghiên cứu chính thừc nảo thực hiện để kiểm tra dược động học của Lucentis
ở bệnh nhân sưy gan.
cÁc DỮ 1…1Ẹ11 AN TOÀN TIÊN LÂM SÀNG
Tiếm rạnibizymabtrong dịch kính cả 2 bên_cho khỉ cynomolgus với liếu 0.25 mg/1 mắt — 2 mg/l
măt 1 lân môi 2 tuân cho dên 26 tuân dẫn đên các tác dụng trên măt phụ thuộc liẽu.
Trong mắt. có sự tăng phụ thuộc liếu về đó tiến phòng vả các tế bâo cùa tiến phòng ở mức cao
nhất 2 ngảy sau khi tiêm. Độ trẳm trọng cùa đảp ứng viêm thường giảm ở cảc lần tiêm sau hoặc
trong thời gian hồi phục. Ó phẳn sau của mắt có sự thảm nhiễm tế bảo dịch kính và hiện tượng
ruồi bay. có khuynh hướng phụ thuộc lìếu và kéo dải đến cuối thời gìan điếu trị. Trong nghiên
cứu 26 tuấn; độ trầm trọng cùa viêm dịch kinh tăng lến theo số lẩn tiêm. Tuy nhiên đã quan sảt
thẳy dấu hiệu thuận nghịch trong thời gian hổi phục. Bản chắt và thời gian viêm phần sau mắt
gợi ý một đảp ứng tạo kháng thể qua trung gian miễn dịch, mã đáp ửng nảy cỏ [hề không biếu 1ộ
trên lâm sảng. Sự hình thảnh đục thưy tinh thể được quan sát ở một số động vật sau một thời gìan
viêm nặng tu'ong đối dải. gợi ý 1ả những thay đồi ớ thùy tinh thế là thứ phát sau quá trinh viếm
trầm trọng.` Tăng tạm thời ảp suất nội nhãn sau tiêm được quan sảt thấy sau khi tiêm trong dịch _
kính. bất kê liếu dùng
Những thay đối ở mắt qua kính hiền vi có liên quan đến viêm và không là dấu hiệu cùa tìến trinh
thoái hóa. NhCmg thay đôi vìêm dạng 11 hạt đã đuợc ghi nhận ở đĩa thị trong một số trường hợp.
Nhũng thay đổi nảy ở phần sau của mắt giảm vả ơ một số thời diềm mất đi; trong thời gian hổi
phục Saư khi tiêm trong dịch kinh không phát hiện dấu hiệu nảo về nh1ch đọc. toản thân. Cảc
khảng thê đôi với ranìbizumab trong huyết thanh và dịch kinh được tim thây ở một nhảnh cảc
động vặt được điếu trị.
Chưa có dữ liệu về tinh gây ung thư. gây dột biến.
Ó khi mang thai; việc điếu trị bằng ranibizumab tiêm trong dịch kính không gây ra dộc tính đối
với sự phảt triền của thai hoặc gây quải thai. vả không có ảnh huờng trên cân nặng hoặc cẳu trùc
cua nhau thai. mặc dù. dựa trên tác dụng dược ly cùa thuốc. ranibizumab đưọc xem lá có khả
năng gây quái thai vả gây độc đối vói phỏi—thai.
Tuy nhiên do hạn chế của liếu sủ dụng dùng tiêm trong dịch kinh; các liếu có thề thục hiện được
đã dùng trong nghiến cứu nảy khỏng dẫn đến độc tinh đối với vật mẹ mả chi lả một bội số đối
với Iiếu hẳp thu toản thân ở người. Việc không có tác dụng qua trung gian cùa ranibizumab trên
sự phát triền cùa phỏi— —thai chủ yêu iiên quan một cách hợp lý đến việc mânh Fab khong có khả
năng đi qua nhau thai.
Tuy vậy; một trướng hợp đã được mô tả là có nồng dộ remibizumab trong huyết thanh cao Ở vật
mẹ vả có ranibizumab trong huyết thanh cùa thai, gợi ý lả khảng thể kháng ranibizumab hoạt
dộng như lá một protein tải (chứa vùng Fc) dối với ranibizumab. do đó lảm giảm độ thanh thải
cùa chất nảy trong huyết thanh ở vật mẹ và lảm cho nó có khả năng truyền qua nhau thai. Do cảc
nghiên cứu về sự phát triến cùa phôi—thai dã dược tìến hảnh trên cảc động vật mang thai khờe
mạnh và bệnh tật (ví dụ đái tháo đường) có thế 121… thay đồi tính thấm của nhau thai đối với
mảnh 1²ab. cần thận trọng khi dùng ranibizumab ở phụ nữ có khả năng mang thai nói chung. vả
phụ nữ đang mang thai nói riêng.
TẢ DƯỢC
alpha; alpha-trchalose dihydrat
Histidine hydrochlorỉd; monohydrate
Histidine
Polysorbate 20
Nước pha tiếm.
'I`UỜNG KY
Trong khi chưa có cảc nghiến cứu về sự tượng hợp. không được pha trộn thuốc nảy với cảc
thuốc khác.
HẠN DÙNG
36 tháng kế từ ngảy sản xuất.
BẢO QUẦN
Bảo quản trong tủ lạnh 2°C đến 8°C.
Không lảm đông lạnh.
Xem trên vỏ hộp. jỷ/
Không dùng Lucentis quá hạn sử dụng được ghi “EXP" trên bao bì.
QUY CÁCH ĐÓNG GÓI
Dung dịch tiêm Lucentis chứa trong 1ọ thưy tinh (thủy tinh không mảư loại 1) vởi nút đặy bằng
cao su chlorobutyl.
Một hộp chứa _1 lọ 0;23 1111; 1 kim lọc để rút thuốc trong lọ; 1 kim tiêm trong dịch kinh. 1 ống
tiếm đê rủt thuôc trong lộ và tiêm trong dịch kính.
HƯỚNG DẨN SỬ DỤNG VÀ THAO TẢC
Lọ thuốc chỉ dùng một lần (xem phần LIÊU LƯỢNG VÀ CÁCH DÙNG).
Để chuẩn bị thuốc Lucentis cho tiêm trong dịch kính; xin tuân thủ các chỉ dẫn sau đây:
10
1. Tmớc khi rủt thuốc phẩn ngoải cùi nút cao su của lọ phái dược
diệt khuấn.
2. Lắp kim lọc 5 micrometcr (dược cung cẩp sẵn) vảo ống tiếm 1
mL (dược cung cấp sẵn) trong điều kiện vô khuấn. Ấn kim lọc vâo
giữa nút lộ cho đến khi kim chạm vảo dáy 1ọ.
3. Rút toân bõ lượng dịch trong lọ. giơ lộ ở vị tr1 thâng đứng, hơi
nÉiêng dể dễ rủt hết thuốc.
4. Phải dảm bảo rầng Pittông được kéo đủ 12 sau khi rủt thuốc
tmng lọ dể rủt hết thuốc trong kim lọc
5. Đề nguyên kim 1ọc lại trong lọ vả tháo ống tiếm ra khới kim
1ọc.Kim 1ọc phải dược vứt bỏ ngay sau khi v_/rũt thuốc Vả khỏng
ỂÍ
ẩl được dùng dễ tiêm trong địch kinh.
! ' ~ t . "…
, 11“
iici1p1 1'… .11:11'1411 ị
l".Lịjw /
6. Lắp kim tiếm (dược cung cẩp sẫn) chắc chắn trong diềư kiện võ
khuẩn vảo ổng tiêm. `\ ~
t 7. Cấn thận tháo nắp kim tiêm má không lảm tuột kim tiêm khỏi
ng tiếm
Lưu ý: Giữ chật trục mâu vảng của kim tiêm trong khi tháo nắp.
a. Cấn thận đuổi khí 1th61 ống t_iem vá chuẩn liều dến vạch o,os
mL trẻn ông tiêm. Ông tiếm dã săn sảng để tiếm.
Luu ý: Không Iau chùi kim tiêm. Không kẻo ngược pittông. 1
11,05 mL Ộ
Bất kỳ thuốc nâo không dùng hoặc chất thâi phải dược hủy bỏ theo quy dịnh của dịa phương.
Lưu ỷ: Thuốc Lucentis pllăi đễxtỉ tẩm Iny vả rẩm nhìn của trẻ em. ly
NHÀ SẢN XUÀT //
Novartis Pharma Stcin AG //
Schatthauscrstrassc, CH-4332 Stein ỷ_Ã
Switzerland " ~ " ;
qV>,i . ~_;
v11111111~1 '; _. \
1" 11… 1 11
"( TN 111›\1411
Từ hưởng dẫn sử dụng cho quốct
Ngảy phát hânh thông tin: Tháng 5, 2010
® = nhăn hiệu dã đăng ký
Novartis Pharma
Representahve Office of
The 11
Ụrtis Phar…a Services AG in HCMC
c…,ạ Pi 1Ỏ cục TRƯỞNG
…1_ẹw n 16% ẫỈẨan/ể
|
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng