













500mg 500mg
mlmlARlM unnmuulAmmun uu…umun
\ 5mfng 500mg 500mg 500mg
A KM U€IMMIAIA.IÍLEIIJI UGI IVIMỦIA ưth LIIWUILIIIũIW uu IWWIA
ml…naưusaun MWILILIEIII mlmmu,… umnmuưmun
AI
BỌYTE
A
o L°ẽ
mm—ử
Q>i ;
i>.D ²
~JQ s
Z,ffl `Ệ
<
:›5 _,
ỢQ-t ,ă
u…g ~==
ỗcn 'Ể
AA.HWIìDIhdU
Á) 1211 m in: 114
Ở
ÙHIiũlmnủdvl
mua
0 Eisijsmm
IMIỈIDIAL Ale
WNUM MDII.
IGM°
…lulun 500mg
DCI FM… | ! mm:
nnle
PINIICI' …I: Inu:
… l.
IOLI WIIQ 'llũuul
uminnusm nIt
IMPORTANT
GSK Mafkel is msponsible for this pmduct. its dcsign and comem.
Ensure the anvmrk ìs thomughly chedmd. all the text ptoof—read and approved.
Rsc GSK is responsible for site technkal requiremenu and pre-pmss suitability.
GSK Market is responsible tn advise RSC in case thanng required
impad the followings:
Formulation. Tablet embossing. Storage conditions. Shelf Life
This PDF has been verifỉed using PitStop 08 - PDF is PDFIX-1a compliant
(Flext'bles wnrkflow)
GluoSmlthlllm
AM Informllm
Pml
Item Number:
0A1376lA
Manuhcturlng sin:
GSI—Conlvlffllỳillv-Pd-hllhul-UCI n……
MarIm nr Fadt 0wner:
Vletnam-VNM
Mnoltet Trldn Nlme:
Komfi
Mo. of Cnloun: 1
uoumummnnuutnld
l.ist Oolouu:
… IQh …… hq
M lNI MVI mhnlun
Tuhnlcal luhlcnce Nots):
110 mm
n:uuùnum …dúhul-nủll
… W Ilh FFỦ lNh
G…h ỎUII d bum:
Ailnlpthn ruhn I …: u … lưmnud
ung! Qilmnnuuutlhll
Ibnìlvll lkỉẳ'fỉlllhllllũhỉllM'll
mdlmlhnẵm lndnd…lnhnucmhmt
u… ml
…iiiẵglunm. cs: uu m mpt … nnuẫm hnhu
nin… … m…i ựum g…
InbdeMhmunikcm
ulnmnnnmmmnhm luu
muiùmnimnunu s:
ATTENTiON ~ ›ẮTTENTION
h……lfmnuhhlhu
mm…tuummms
MnluillưủnAnủullniu. Slnillnlu
udmilhlúumĩl Wmm
mn ›. mtmd M nnuun nnmlhniu.
M
ph! ntủiị Iu Mị lmuln hut mlu.
Il_I~ẢRJOVlInI
Illinth
Ihmi…_mmựuùmnúú…hmh~tuúnlúdơilự… l
869L€LVD ' aP°J BZL
`ụqx_ ~..u
\J
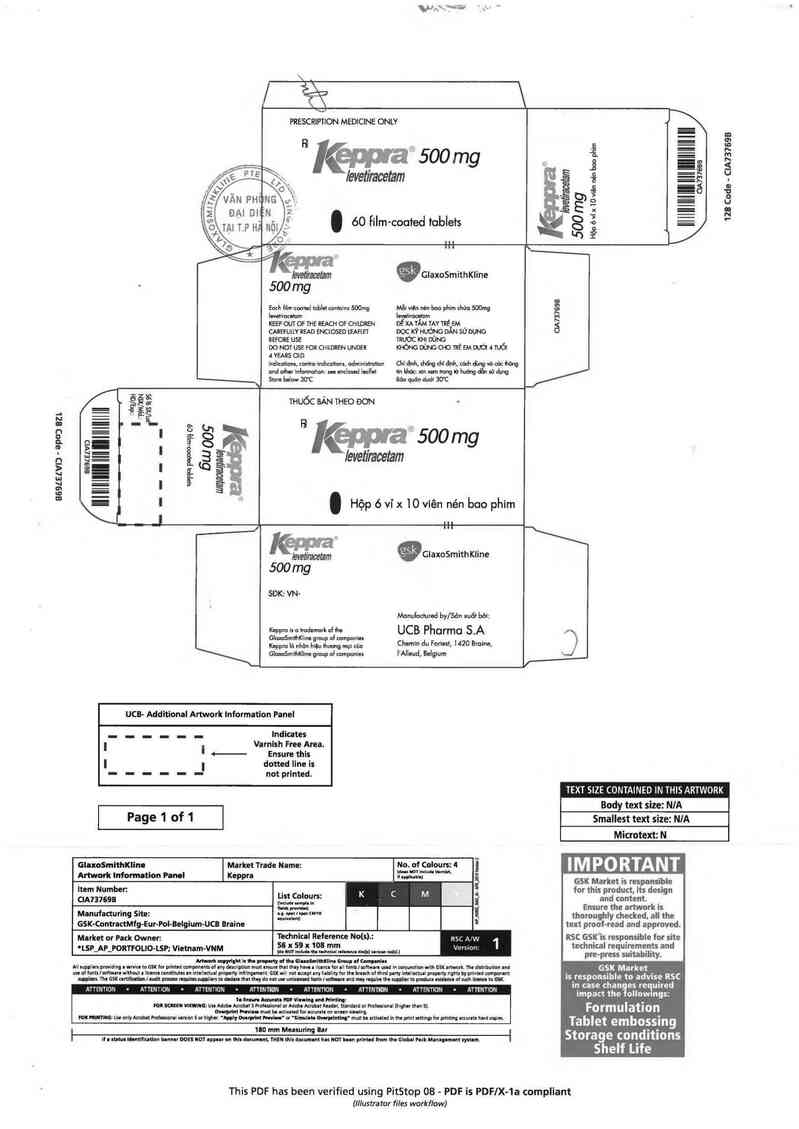
PRESCRIPTION MEDICINE ONLY
R J(eppra 500 mg
Ievetiracetam
\
<>\_ị`
Ế . 60 film-cooted toblets
q
a .
leveũ'raoebm
\
500 mg
III llllllllllll lllll illlllili III
128 Code - CIA737698
If
HộọóvixlOvtẽn nẻnbuophlm
`letet'metam ỦGIaxoSmithKline
@
Eoch Ítlm-cocicd tublet ccnkalm 500mg Mỗi len nẻn boc phim chỉ… 500mg 8
levdtrucdom lcvdlrocgtom iv`i
KEEP OUT OF THE REACH or cmtoasn ĐỂ XA TAM TAY TitỂ_EM 'ẩ
cmeruuv READ ENCLOSED ưAFtEt oọc KỸ HuớNG DAN sủ DỤNG
BEFORE usa muớc KHI DÙNG __
oo NOT use FOR cnunnen un… KHÓNG DÙNG cuc mẻ EM Duới 4 …
a YEARS om
indkciiom, contro—Indlcutlons, udminlltrutlon Gil đỊnh, diống chi địrù, củđi ỏlmg vủ oấc hẽng
und other tntorchon: see enclosed ieuiiui Hn Húc: xin xun Irung % huúng cỦ1 :ù dvng
Store bciow 30'C Bỏo quỏn duót 30'C
THUỐC BÁN THEO ĐON
R ,
Ễ 7\^ (eppra 500mg
CQ
levetiracetam
EG9LSLVD
_ _ _ _ _
uanm P~……iii cọ
. Hộp 6 ví x 10 viên nén boo phim
Kleveliraoeẫ gũlaxoSmithKline
500 mg
SĐK: VN-
Monufoctuređ bylSỏn xuẩt bởi:
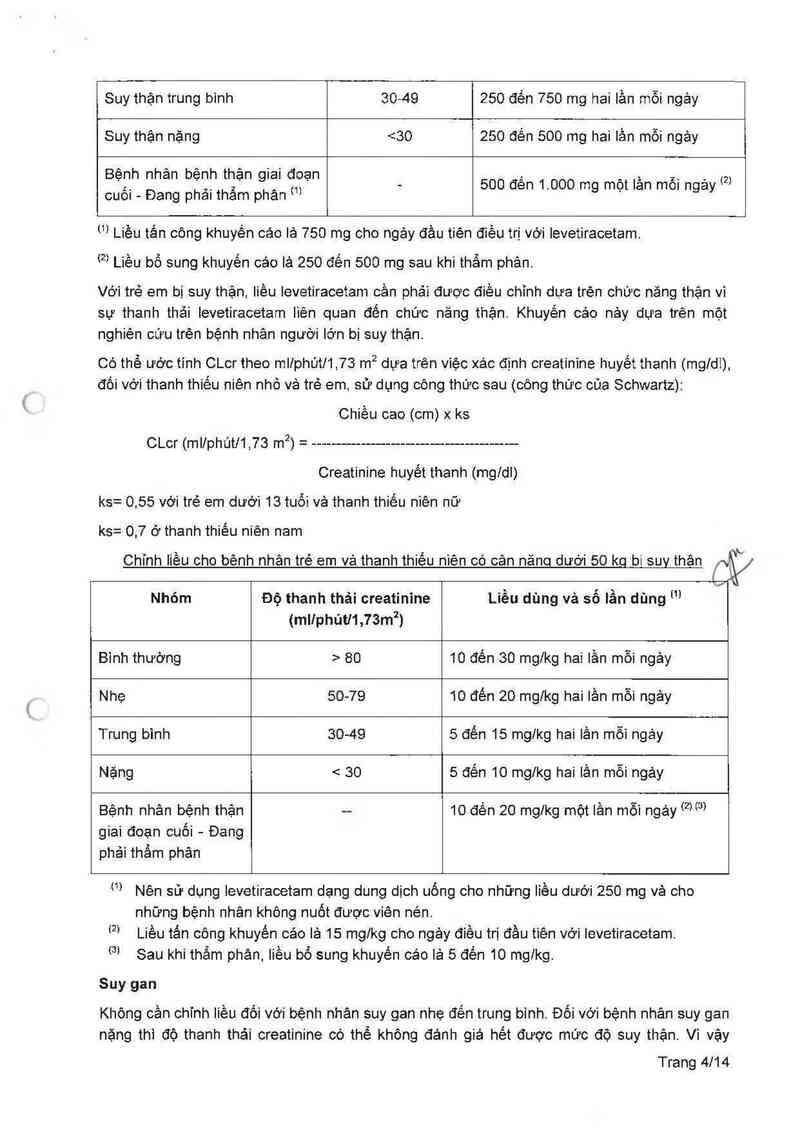
i 80 500 đến 1.500 mg hai lần mỗi ngảy
Suy thận nhẹ 50-79 500 đến 1.000 mg hai lần mỗi ngảy
Trang 3114
Suy thận trung bình 30-49 250 đến 750 mg hai lần mỗi ngảy
Suy thận nặng <30 250 đên 500 mg hai lần mỗi ngảy
Bệnh nhân bệnh thặn giai đoạn
cuối - Đang phải thẩm phản «; - 500 đến 1'000 mg một 'ần mỗi ngảY …
… Liều tấn công khuyến các là 750 mg cho ngảy đầu tiên điều trị vởi levetiracetam.
(²² Liều bổ sung khuyến cáo là 250 đến 500 mg sau khi thầm phản.
Vởi trẻ em bị suy thận, liếu levetiracetam cằn phải được điều chỉnh dựa trên chức năng thận vì
sự thanh thải levetiracetam liên quan đến chức nãng thận. Khuyến cáo nảy dựa trên một
nghiên cứu trên bệnh nhân người lớn bị suy thận.
Có thể ước tinh CLcr theo mllphútl1,73 m2 dựa trên vìệc xảo định creatinine huyết thanh (mgldl),
đối vởi thanh thiếu niên nhỏ vả trẻ em. sử dụng công thức sau (công thức của Schwartz):
Chiều cao (cm) x ks
CLcr (milphútl1,73 m²) ²
Creatinine huyết thanh (mgldl)
ks= 0,55 vởi trẻ em dưới 13 tuổi vả thanh thiếu nìên nữ
ks= 0,7 ở thanh thiếu niên nam
Chỉnh liều cho bênh nhân trẻ em và thanh thiếu nìên có cân năng dưới 50 kg bi suy thân p"
~J
Nhóm Độ thanh thải creatinine Liều dùng vả số lần dùng …
(mllphủtl1Jsz)
Bình thường > 80 10 đến 30 mg/kg hai lần mỗi ngảy
Nhẹ 50-79 10 đến 20 mg/kg hai lần mỗi ngảy
Trung bình 30-49 5 đến 15 mg/kg hai lần mỗi ngảy
Nặng < 30 5 đến 10 mglkg hai lần mỗi ngảy
Bệnh nhân bệnh thận —- 10 đến 20 mg/kg một lần mỗi ngảy ® (3)
giai đoạn cuối — Đang
phải thẩm phân
… Nên sử dụng levetiracetam dạng dung dịch uống cho những liều dưới 250 mg vả cho
những bệnh nhân không nuốt được viên nén.
Liều tấn cõng khuyến cảo lẻ 15 mglkg cho ngảy điều trị đầu tiên vởi levetiracetam.
Sau khi thẩm phân, liều bổ sung khuyên cáo là 5 đền 10 mg/kg.
…
…
Suy gan
Không cần chĩnh liều đối vởi bệnh nhân suy gan nhẹ đến trung bỉnh. Đối vởi bệnh nhân suy gan
nặng thì độ thanh thải creatinine có thế không đánh giá hết được mưc độ Suy thận. Vì vậy
Trang 4/14
khuyến cáo giảm 50% liều duy irì hảng ngảy khi độ thanh thải creatinine dưới 60
mllphútl1,73m².
CHỐNG CHỈĐỊNH
Chống chỉ định Ievetiracetam trong trường hợpz
- quá mẫn vởi hoạt chât hoặc các dẫn xuất khác của pyrrolidone hoặc vởi bất cứ tá dược nảo
của thuốc.
CẢNH BẤO VÀ THẬN TRỌNG
Ngừng thuốc
Theo thực hảnh lâm sảng hiện hảnh, nếu phải ngưng điều trị với levetiracetam thì khuyến cáo
nẻn giảm liều dần dần (ví dụ ở người Iởn vả thanh thiếu niên cân nặng trẻn 50 kg: giảm 500 mg
hai lần mỗi ngảy cho mỗi 2 đến 4 tuần; ở trẻ em vả thanh thiếu niên cân nặng dưới 50 kg:
không nên giảm liều quả 10 mglkg hai lần mỗi ngảy cho mỗi 2 tuần).
Suy thận hoặc suy gan
Có thể cần điều chinh liều khi sử dụng levetiracetam cho bệnh nhân suy thận. Vởi bệnh nhân
suy gan nặng, khuyên cáo đánh giá chức năng thận trước khi chọn liều dùng (xem phần "Líểu
lượng vả cách dùng").
Trầm cảm vảlhoặc ý định tự tử
Đã có báo cảo về việc tự tử, nỗ lực tự tử, có ý định vả hảnh vì tự tử ở bệnh nhân được điều trị
bằng các thuốc chống động kinh (kể cả levetiracetam). Một phân tích gộp (meta-analysis) từ
các thử nghiệm ngẫu nhiên, có đối chứng với giả dược trên các thuốc chống động kinh khảo đã
cho thấy tăng nhẹ nguy cơ có các ý nghĩ và hảnh vi tự tử. Chưa rõ cơ chế của nguy cơ nảy.
Do đó nên theo dõi cảc dắu hiệu trầm cảm vảlhoặc ý định và hảnh vi tự tử cùa bệnh nhân và
cân nhắc biện phảp fflều trị thích hợp. Khuyên bệnh nhân (vả người chăm sóc bệnh nhân) nên
gặp bác sĩ khi xuất hỉện các dấu hiệu trầm cảm vả/hoặc ý định vả hảnh vi tự tử.
Trẻ em
Dang viên nén không thích hợp để sử dụng ở trẻ em dưới 6 tuổi.
Dữ liệu sẳn có ở trẻ em không gợi ý tảc động của levetiracetam lên sự phát triến vả tuổi dậy thì.
Tuy nhiên, vẫn chưa rõ tác động lâu dải lên khả năng học tập, sự thông minh, phảt triển, chức
năng nội tiết, tuồi dậy thì và khả năng sinh sản trên trẻ em.
TƯỚNG TÁC THUỐC
Các thuốc chống động kinh
Dữ liệu trước khi lưu hảnh thuốc từ các nghiên cứu lâm sảng tiến hảnh trên người lởn cho thắy
Ievetiracetam không ảnh hưởng đến nồng độ trong huyêt thanh của các thuốc chống động kinh
hiện hảnh (phenytoin, carbamazepine. acid valproic, phenobarbitai, lamotrigine, gabapentin vả
primidone) vả các thuốc chống động kinh nảy không ảnh hưởng đến dược động học cùa
Ievetiracetam.
Cũng như đối vởi người lởn. không có bằng chững về tương tác thuốc có ý nghĩa lâm sảng trên
bệnh nhi dùng levetiracetam lên tởi 60 mg/kg/ngảy.
Trang 5/14
Một đảnh giá hồi cứu về tương tảo dược động học trên trẻ em và thanh thiều niên bị động kinh
(4 đến 17 tuổi) đã xảo nhặn điều trị kết hợp với levetiracetam uống không Iảm ảnh hưởng đến
nồng độ trong huyết thanh ở trạng thải ốn định của carbamazepine vả valproate dùng đồng thời.
Tuy nhiên, dữ liệu gợi ý rằng độ thanh thải levetiracetam cao hơn 20% ở trẻ em dùng thuốc
chống động kinh cảm ưng men gan. Không yêu cầu điều chỉnh liều.
Probenecid
Probenecid (liều 500 mg 4 lần mỗi ngảy), một chắt ức chế bải tiết tại ống thặn, cho thẳy ức chế
độ thanh thải qua thận của chắt chuyển hóa ban đầu nhưng không ức chế sự thanh thải qua
thận của levetiracetam. Tuy nhiên, nồng độ của chắt chuyển hóa nảy vẫn duy trì ở mức thấp.
Người ta cho rằng các thuốc khác được thải trừ nhờ bải tiết chủ động qua ống thận cũng có thế
Iảm giảm độ thanh thải của chầt chuyến hóa qua thặn. Tác động của levetiracetam lên
probenecid chưa được nghiên cứu và củng chưa biết tảc động của levetiracetam lên các thuốc
được bải tiềt chủ động khác, ví dụ như cảc thuốc chồng viêm không steroid (NSAIDS), các
sulfonamide vả methotrexate.
Cảc thuốc tránh thai đường uổng, digoxin vả wafarin
Levetiracetam lìều 1.000 mg mỗi ngảy không ảnh hướng đến dược động học của các thuốc
tránh thai đường uổng (ethinyl estradiol vả levonorgestrel) vả các thông số nội tiết (LH vả
progesterone) không bị thay đỗi. Levetiracetam liều 2.000 mg mỗi ngảy không ảnh hưởng đến
dược động học của digoxin vả warfarin; thời gian prothrombin khỏng bị biến đối. Việc dùng
đồng thời vởi các thuốc digoxin, thuốc tránh thai đường uống và warfarin không ảnh hưởng tới
dược động học của levetiracetam.
Cảc thuốc khảng acid
i , . . Ju
Chưa có dữ liệu vê ảnh hưởng của các thuôo kháng acid đôi với sự hâp thu Ievetiracetamrii /
Thức ăn và đồ uống có cồn \
Mức độ hắp thu của Ievetiracetam không bị ảnh hưởng bởi thức ăn nhưng tốc độ hắp thu bị
giảm nhẹ.
Chưa có sẫn dữ liệu về tương tảo thuốc giữa levetiracetam vả đồ uống có cồn (alcohol).
THAI KỸ vÀ CHO con BÚ
Khả năng sình sản
Không thẩy ảnh hưởng lên khả năng sinh sản trong các nghiên cứu trên động vật. Không có
sẳn dữ liệu lâm sảng, chưa rõ nguy cơ tiềm ần trên người.
Thai kỳ
Không khuyến cáo levetiracetam trong thai kỳ vả ở phụ nữ có khả nảng mang thai mả không
dùng biện pháp tránh thai trừ khi thật cần thiềt.
Chưa có đủ dữ tiệu về việc sử dụng levetiracetam ở phụ nữ có thai. Những nghiên cứu trên
động vật đã cho thắy độc tính đối với khả năng sinh sản. Nguy cơ tiềm ẩn đồi vởi con người
chưa được biết.
Giống như cảc thuốc chống động kinh khác, những thay đổi sinh iỷ trong thai kỳ có thể ảnh
hưởng đến nồng độ Ievetiracetam. Đã quan sát thẳy có giảm nồng độ Ievetiracetam huyết
Trang 6/14
tương trong thai kỳ. Sự giảm sút nảy thể hiện rõ hơn trong ba tháng cuối của thai kỳ (đến 60%
nồng độ ban đầu trưởc khi có thai). Nên đảm bảo kiếm soát lâm sảng phù hợp cho phụ nữ
mang thai điều trị bằng levetiracetam. Việc ngừng điều trị thuốc chống động kinh có thể dẫn
đến đợt kịch phảt của bệnh có thể gây hại cho người mẹ và thai nhi.
Cho con bú
Levetiracetam được bải tiêt qua sữa mẹ. Vì vậy, không khuyến cảo cho con bú khi đang dùng
thuốc. Tuy nhiên, néu cần cũèu trị với levetiracetam trong khi cho con bú, nên cân nhắc iợi ích]
nguy cơ của việc điều trị so vởi tầm quan trọng cùa việc cho con bú.
ÀNH HƯỞNG LÊN KHẢ NẢNG LÁI XE VÀ VẬN HÀNH MÁY Móc
Chưa tiến hảnh nghiên cứu tảo động của thuốc trên khả năng lải xe và vận hảnh máy móc.
Do tỉnh nhạy cảm của mỗi cá nhân có thể khác nhau, một số bệnh nhân có thể buổn ngủ hoặc
có các triệu chứng khác có liên quan đến hệ thần kinh trung ương, đặc biệt tại thời điểm bắt
đầu điều trị hoặc sau khi tảng Iièu. Vì vậy khuyên cảo nên thận trọng đối vởi những bệnh nhân
thực hiện những công việc đòi hỏi kỹ năng, ví dụ: lái xe hoặc vận hảnh máy móc. Khuyên bệnh
nhân không nên lái xe hoặc vận hảnh mảy móc cho đến khi xảc nhận được rằng khả năng thực
hiện những hoạt động nảy không bị ảnh hưởng.
TÁC DỤNG KHÔNG MONG MUỐN
Dữ liệu thử nghiệm lâm sảng vả Dữ liệu sau khi lưu hảnh thuốc
Tóm tắt hồ sơ an toản v
Dữ liệu biến cố bảt lợi được trinh bảy dưới đây dưa trên sự phân tích các thử nghiệm lâm sảgầ/
chung có đối chứng vời giả dược vởi tất cả cảc chỉ đinh. với tồng số 3.416 bệnh nhân được
điều trị bằng Ievetiracetam. Những dữ liệu nảy được bổ sung vởi việc sử dung Ievetiracetam
trong các nghiên cứu mở rộng nhăn mở tương ứng cũng như trong kinh nghiệm sau khi lưu
hảnh thuốc. Tảo dụng khõng mong muốn được báo cáo vởi tần suất nhiều nhắt lả viêm mủi-
họng, buồn ngù, đau đầu, mệt mỏi và choáng vảng. Hồ sơ an toản của levetiracetam thường lả
tương tự giữa các nhóm tuổi (bệnh nhân người lởn vả trẻ em) vả giữa các chỉ định động kinh
đã được phê duyệt.
Cảc tảo dụng không mong muốn được xếp Ioai theo loại tần suất sử dụng quy ước sau:
Rất phổ biến zmo
Phố bìến 21/100 đén <1l10
Không phổ biến z1l1000 đên <11100
Hiếm 21l10000 đên <1l1000
Rắt hiếm <1l10000
Không biết (không thể ước tinh từ dữ liệu sẵn có)
Cảc nhiễm khuẩn vả nhiễm ký sinh trùng
Rất phố biên: viêm mũi họng
Hiếm: nhiễm khuẩn
Rối loạn về máu vả hệ bạch huyết
Trang 7/14
Khỏng phổ biến: giảm tiều cầu, giảm bạch cằu
Hiếm: giảm toản bộ huyết cầuV giảm bạch cầu trung tĩnh, giảm bạch cầu hạt
Rối ioạn hệ miễn dịch
Hiếm: phản ứng thuốc có tảng eosinophi vả cảc triệu chứng toản thân (DRESS)
Rối loạn chuyển hóa vả dinh dưỡng
Phổ biến: chản ăn
Khỏng phố biền: sụt cân, tăng cân
Hiếm: giảm natri huyết
Rối ioạn tãm thẳn
Phổ biến: trầm cảm` chống đốilgây hần, lo lắng, mắt ngù, bồn chổn/kich thich
Không phổ bìến: nỗ lực tự tử, ý định tự tử, rối loạn tâm thần, hảnh vi bất thường, ảo giảc.
giận dữ. trạng thái lù lẫn, cơn hoảng sợ, không ồn định về cảm xúclthay
đối tâm trạng, lo âu
Hiềm: thực hiện hảnh vi tự tứ, rối loạn tinh cách, suy nghĩ bắt thường
Rối loạn hệ thẩn kinh
Rất phố biên: buồn ngủ, đau đầu
Phổ biến: co giật. rối loạn thăng bắng, choáng va'ng. ngũ lim, run
Không phổ bỉến: quên, suy giảm trí nhớ, mầt điều hòal đỉều phối vận động bắt thường, d` . \
cảm, rối Ioạn tập trung Òằ/
Hiếm: múa giật múa vờn` rối loạn vận động chứng tăng động
Rối !oạn về mắt
Khỏng phổ biến: song thị, nhìn mờ
Rối Ioạn tai vả mê đạo
Phổ biến: chóng mặt
Rối loạn hô hấp, lồng ngực vả trung thất
Phổ biến: ho
Rối loạn tíêu hóa
Phổ biến: đau bụng, tìèu chảy, khó tiêu. nôn, buồn nôn
Hiếm: viêm tụy
Rối ioạn gan mật
Không phổ biến: xét nghiệm chức năng gan bắt thường
Hiềm: suy gan, viêm gan
RỔỈ Ioạn da vả mõ dưới“ da
Phổ bỉền: phảt ban
Trang 8|14
Không phổ biến: rụng tóc. ohảm, ngứa
Hiếm: hoại tử biếu bi nhiễm độc, hội chứng Stevens-Johnson, hồng ban đa
dạng
Rối Ioạn cơ xương vả hệ mõ Iìên kết
Không phố biên: yếu cơ, đau cơ
Rối Ioạn toa`n thân vả tại chỗ
Phổ biên: suy nhược. mệt mỏi
Chấn thương, nhiễm độc vả biến chứng do thủ thuật
Không phổ biến: chản thương
Mô tả những tác dụng không mong muốn được lựa chọn
Nguy cơ chản ăn cao hơn khi dùng topiramate đồng thời với levetiracetam.
Trong vải trường hợp bị rụng tóc, quan sát thấy có hồi phục khi ngừng dùng levetiracetam.
Ừc chê túy xương được xảo định trong một số trường hợp giảm toản bộ huyêt cầu.
Đối tượng trẻ em
Trên những bệnh nhân 4-16 tuổi, tống số 645 bệnh nhân đã được điều trị vời levetiracetam
trong các nghiên cứu mở rộng nhãn mở vả có đối chứng vởi giả dược. Có 233 bệnh nhản trong
nhóm nảy được điều trị với Ievetiracetam trong cảc nghiên cứu có đôi chứng với giả dược.
Những dữ liệu nảy được bổ sung vảo kình nghiệm sử dụng levetiracetam sau khi lưu hảnh
thuốc. Dữ liệu về biên oố bất lợi của levetiracetam thường lả tương tự nhau giữa các nhóm tuồi
vả giữa các chỉ định động kinh được phê duyệt… Kết quả về tính an toản của levetiracetam trên
bệnh nhi trong các nghiên cứu lâm sảng có đối chứng với giả dược và trên người lớn iả nhất
quán, ngoại trừ cảc tác dụng không mong muốn về hảnh vi vả tâm thần thường xuất hiện trên
trẻ em hơn lá ở người lớn. Trên trẻ em vả thanh thiêu niên từ 4 đến 16 tuổi, nôn (rắt phổ biến.
11,2%), lo âu (phổ biến. 3,4%), thay đổi tâm trạng (phổ biến. 2.1%), cảm xúc không ốn định
(phổ biến, 1,7%), dễ gây hấn (phố biên, 8,2%), hảnh vi bắt thường (phổ biến, 5,6%) và ngủ lịm
(phổ biến, 3,9%) được báo cáo với tần suất nhiều hơn so vởi các nhóm tuỗi khảo hoặc trong hồ
sơ an toản nói chung.
Một nghiên cứu mù đôi, có đối chứng vởi giả dược về an toản trên bệnh nhi với thiêt kế khỏng-
kém-hơn (non-inferior) đả đảnh gìá tác động trên nhận thức vả tâm lý-thần kinh của
Ievetiracetam trên trẻ em 4 đên 16 tuối có các cơn co giật khời phảt cục bộ. Đã có kêt Iuận rằng
levetiracetam không khảo biệt (khỏng-kém-hơn) so vởi giả dược về sự thay đổi so với ban đầu
trên thang điếm tống hợp kiểm tra trí nhớ. khả năng chủ ý và trí nhớ Leiter-R, trong quần thể
nghiên cứu theo đề cương (per protocol). Kết quả liên quan đên chức năng cảm xúc vả hảnh vì
đã cho thắy điều trị bằng levetiracetam lảm xắu đi về hảnh vi gây hấn được xảo định bởi
phương phảp hệ thống vả tiêu chuẩn hóa sử dụng một thiết bị đã được thẳm định (bảng kiếm
về hảnh vi trẻ em Achenbach — CBCL). Tuy nhiên, những đối tượng dùng Ievetiracetam trong
nghiên cứu theo dõi, nhăn mở trong thời gian dải nhìn chung không cho thắy biểu hiện xảu đi
về chức năng cảm xúc và hảnh vi; đặc biệt cảc đảnh giá về hảnh vi gây hắn không xấu đi so vởì
ban đâu.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Trang 9/14
QUÁ LIỀU
Triệu chứng và dắu hiệu
Buồn ngủ, lo âu, gây hắn. suy giảm nhận thức. suy hô hấp vả hôn mẽ đã được quan sát thấy
khi dùng quá liều levetiracetam.
Xử trí quá liều
Sau khi quá liều cầp có thể Iảm rỗng dạ dảy bằng cảch gây nôn. Chưa có thuốc giải độc đặc
hiệu đối với levetiracetam. Xử trí quá liều chủ yếu lả điều trị triệu chứng và có thể bao gồm việc
thầm tách mảu. Hiệu suất mảy thầm tảch lả 60% đối với levetiracetam vả 74% đối vời ohât
ohuyến hóa chính.
ĐẶC TÍNH DƯỢC HỌC
Dược lực học
Nhóm dược điều trị
Thuốc chống động kinh; thuốc chống động kinh khác
Mã ATC
N03AX14.
Cơ chế tác dụng
Hoạt chắt levetiracetam lả dẫn xuất của pyrrolidone (đồng phân đối hình S của oc-ethyl-2-oxo-1-
pyrrolidine acetamide) vả không oó liên quan về mặt hóa học với các thuốc chống động kinh
hiện hảnh. /V'
, … . (
Cơ chê tác dụng của levetiracetam vân chưa được giải thich đây đủ nhưng oó vẻ khác vởi các
cơ chế tác dụng của những thuốc chống động kinh hiện hảnh. Các thử nghiệm in vitro và in
vivo gợi ý rằng levetiracetam không lảm thay đổi các đặc tinh cơ bản của tế bảo vả sự dẫn
truyền thần kinh binh thường.
Các nghiên cứu in vitro cho thầy Ievetiraoetam tác động lên nồng độ Ca²+ trong tế báo thần kinh
bằng oách ức chế một phần dòng Ca²* loại N và Iảm giảm phỏng thich Ca²+ từ oác nguồn dự
trữ trong tế bảo thần kinh. Ngoải ra thuốc còn lảm hồi phục một phần việc giảm sút những dòng
ion qua cống glycine vả GABA gây ra bởi kẻm vả các ị3-carboline. Hơn nữa, trong cảc nghiên
cứu in vitro, Ievetiracetam cho thắy có gắn kềt Với một vị trí đặc hiệu ở mỏ não của loảì gặm
nhắm. Vị trí gắn kết nảy lả protein 2A ở túi synap. được cho là có Iièn quan đến sự vở túi vả sự
phóng thích cảc chất dẫn truyền thần kinh ra khỏi tế bảo (exocytosis) . Levetiracetam vả các
chất đồng đẳng liên quan có ái lực nhắt định để gắn kết với protein 2A ở túi synap. điều nảy
tương ứng vời hoạt tinh bảo vệ chồng động kinh của thuốc trong nghiên cữu trên mô hình
chuột bị động kinh dưới kỉch thích âm thanh. Phát hiện nảy gợi ý rằng tương tảo giữa
levetiracetam vả protein 2A ở túi synap có thể góp phần vảo cơ chế tác dụng chống động kinh
của thuốc.
Tác dụng dược lực
Levetiracetam tăng cường bảo vệ chống cơn co giật trong nhiều mô hỉnh cơn co giặt cục bộ vả
toản thế tiên phảt trên động vật mà không có tảo đông gãy co giặt. Chẩt chuyền hóa chính
không có hoạt tính.
Trang 10114
Ở người, thuốc có tảo dụng trong oả động kinh cuc bộ vả toản thể (cơn phóng điện dạng động
kinh/ đảp ứng đối với kich thích ảnh sáng) đã khắng định đặc tính dược lý phố rộng của
Ievetiracetam.
Dược động học
Levetiracetam lả chắt có tính thắm và hòa tan cao. Đặc tính dược động học tuyến tinh vởi sự
biến đồi thấp trong vả giữa các cá thể. Độ thanh thải của thuốc không bị thay đối sau khi dùng
lặp lại. Chưa có bằng chứng về sự khác biệt giữa cảc cá thế có iiên quan đến giới tính. chủng
tộc hoặc thời gian trong ngảy. Đặc tính dược động học lả tương đương ở người tình nguyện
khỏe mạnh vả bệnh nhân động kinh.
Nồng độ thuốc trong huyêt tương có thể dự tính được dưa trên liều uống Ievetiracetam theo
mg/kg trọng lượng Cơ thể do thuốc hấp thu hoản toản vả tuyến tính. VÌ vậy, không cần thiết
phải theo dõi nồng độ thuốc trong huyết tương.
Cũng quan sát thắy mối liên quan đảng kể giữa nồng độ thuốc trong nước bọt vả trong huyết
tương ở người Iờn vả trẻ em (tỷ lệ nồng độ thuốc trong nước bọtlnồng độ thuốc trong huyết
tương lả khoảng từ 1 đên 1,7 đối với dang viên nèn dùng đường uống vả sau 4 giờ sau khi
dùng đổi với dung dịch uống).
Hấp thu
ÍV in 11
Levetiracetam được hảp thu nhanh sau khi uống. Sinh khả dung tuyệt đối đường uống đạt gẦ V
100%. @
lễ
Nồng độ đỉnh trong huyết tương (Cmax) đạt được 1,3 giờ sau khi uống. Trạng thái ốn đinh đạt -iÀ
được sau 2 ngảy với chế độ liều 2 lần mỗi ngảy. __
Cảo nồng độ đỉnh (Cmax) điển hỉnh tương ứng lả 31 vé 43 ụg/ml sau liều đơn 1.000 mg và sau ,…
liều lặp lại 1.000 mg hai lần mỗi ngảy.
Mức độ hầp thu không phụ thuộc vảo liều vả không bị ảnh hưởng bởi thức ăn.
Phân bố
Chưa có sẵn dữ liệu phân bố trong mỏ ở người.
Cả levetiracetam vả chảt chuyển hóa ohính của nó đều không gắn kẻt đáng kể với protein huyềt
tương (<10%).
Thể tích phân bố của Ievetiracetam là khoảng 0,5 đến 0.7 llkg, trị số nảy gần với thế tỉch nước
toản bộ cơ thể.
Chuyển hóa
Ở người, Ievetiracetam không được chuyền hóa rộng rải. Con đường chuyến hóa chủ yêu
(24% của liều) lả thủy phân nhóm acetamide bằng men. Cảo dạng đồng phân của men gan
cytochrome P450 không tham gia vảo quá trình tạo chắt chuyến hóa ohính, ucb L057. Đã đo
lường được sự thủy phân nhóm acetamide ở nhiều mô bao gồm cả các tế bảo máu. Chắt
chuyền hóa ucb L057 không có hoạt tính dược lý học.
Hai chất chuyển hóa phụ cũng đã được xác định. Một chất thu được bởi hydroxyl hóa vòng
pyrrolidone (1,6% của liều) vả ohât oòn lại thu được bời mở vòng pyrrolidone (0,9% oủa liều).
Các thảnh phần khác không xác đinh được ohỉ chiêm 0,6% của liều.
Trang 11/14
Không thấy có bằng chững về sự chuyển đỗi đối hình ín vivo của levetiracetam vả cả chắt
chuyển hóa chính cũa nó.
ln vitro. levetiracetam vả chắt chuyển hóa ohinh của nó được thấy là khỏng ửc chế hoạt động
của cảc dạng đồng phân chinh oùa men gan người cytochrome P450 (CYP3A4, 2A6, 2C9V
2019, 2D6, 2E1, vả 1A2), glucuronyl transferase (UGT1A1 vả UGT1A6) vả epoxide
hydroxylase. Ngoài ra, levetiracetam không ảnh hưởng đến glucuronyl hóa acid valproic in vitro.
Ở tế bảo gan người nuôi cắy, tevetiracetam ít hoặc không ảnh hưởng đến CYP1A2. SULT1E1
hoặc UGT1A1. Levetiracetam gây cảm ứng nhẹ CYPZBG vả CYP3A4. Dữ liệu in vitro vả dữ liệu
tương tác in vivo trên cảc thuốctránh thai đường uống, digoxin vả warfarin chi ra rằng không có
cảm ứng enzyme đáng kế in vivo. Do đó, không xảy ra tương tảo levetiracetam với các chắt
khác hoặc ngược lại.
Thải trừ
Thời gian bản hùy trong huyết tương ở người lớn lả 7i1 giờ vả không thay đối theo liều,
đường dùng, hoặc dùng liều lặp lại. Độ thanh thải toản thân trung binh là 0,96 mllphútlkg.
Đường thải trừ ohỉnh là qua đường tiểu. chiếm trung binh 95% của iiều (khoảng 93% cúa liều
được thải trừ trong vòng 48 giờ). Chỉ có 0,3% của liều thải trừ que phản.
Trong 48 giờ đầu, lượng thái trừ tích lũy qua đường tìếu của levetiracetam vả chắt chuyển hóa
chinh của nó tương ứng lả 66% và 24% của liều. J’V
Độ thanh thải thận của levetiracetam vả ucb L057 tương ứng lả 0.6 vả 4,2 mllphút/kg cho th y
rằng levetiracetam thải trừ qua lọc cầu thận với sự tải hầp thu kế đó ở ống thận vè cho thắy
chất chuyến hóa chỉnh cũng thải trừ qua bải tiết chủ động qua ống thặn cùng với lọc cầu thận.
Sự thải trừ Ievetiracetam có tương quan với độ thanh thải creatinine.
Nhóm bệnh nhân đặc biệt
Trẻ em
Trẻ em (4 đển 12 tuối)
Thời gian bán hủy của levetiracetam ở trẻ bị động kinh (6 đến 12 tuổi) là 6 giờ sau khi uống liều
đơn 20 mg/kg. Độ thanh thải biều kiến được điều chỉnh theo cân nặng cao hơn khoảng 30% so
Với độ thanh thải Ở người lỎ'l'ì bị động kinh.
Levetiracetam nhanh chóng được hầp thu sau khi uống liều lặp lại (20 đến 60 mglkglngảy) ở trẻ
bị động kinh (4-12 tuồi). Nồng độ đỉnh trong huyết tương được quan sát thấy sau khi uống
khoảng 0,5 - 1 giờ. Nồng độ đỉnh trong huyết tương vả diện tích dưới đường cong tăng tuyền
tinh vả tỷ lệ thuận với liều. Thời gian bán hủy lả khoảng 5 giờ. Độ thanh thải biếu kiến toản thân
của thuốc lá 1,1 mllphútlkg.
Người cao tuổi
Thời gian bán hủy tăng khoảng 40% (10 đến 11 giờ) ở người cao tuổi do suy giảm chức năng
thận.
Suv thân
Trang 12|14
\.
Độ thanh thải biểu kiên toản thân của oả levetiracetam vả chắt chuyển hóa ohính của nó tương
quan với độ thanh thải creatinine. Chinh vì vậy, đối vởi bệnh nhân suy thận mức độ trung binh
và nặng cần chinh liều duy trì hảng ngảy của levetiraoetam dựa trên độ thanh thải creatinine.
Ở bệnh nhân người lớn bệnh thận giai đoan cuối có vô niệu, thời gian bán hủy giữa cảc giai
đoạn thẩm tảch vả trong giai đoạn thẩm tảch tương ứng lả khoảng 25 và 3,1 giờ.
Tỷ suất loại Ievetiracetam lả 51% trong một chu kỳ thầm tảch fflền hình 4 giờ.
Suv cian
Không có sự thay đối về độ thanh thải của levetiracetam ở bệnh nhân suy gan mức độ nhẹ vả
trung bình.
Ở hầu hết những bệnh nhân suy gan nặng, độ thanh thải của levetiracetam giảm trẻn 50% do
suy thận đồng thời.
Dữ liệu an toản tiền lâm sảng
Các dữ liệu tiền lâm sảng oho thấy không có mối nguy hại đặc biệt đổi với người dưa trên các
nghiên cứu quy ước về an toản dược lý, độc tính gien và tính sinh ung thư.
Không quan sảt thấy Các tác dụng không mong muốn trong các thử nghiệm lâm sảng nhưng lại
quan sát thắy ở chuột cống và it thấy hơn ở chuột nhắt ở các mức phơi nhiễm tương tự mức
phơi nhiễm ở người vả có thể có liên quan đên việc sử dung trên lâm sảng lá các thay đối ở
gan, biều thị đáp ứng thỉch nghi như tảng cân và phi đại trung tâm tiều thùy, thâm nhiễm chắt
béo và tăng các men gan trong huyêt tương. Ẩ
Với các liều lên tởi 1.800 mglkg/ngảy (gắp 6 lần MRHD dựa trên mg/m2 hoặc trên phơi nhiễm)
không quan sát thắy các tảo dụng khỏng mong muốn trên khả năng sinh sản của chuột cồng
đực vả chuột cống cái thế hệ bố mẹ vả cả thế hệ F1.
Hai nghiên cứu về phát triến phôi thai … bảo thai (EFD) đã được thực hiện trên chuột cống ở cảc
liều 400, 1.200 vả 3.600 mglkg/ngảy. Ở liều 3.600 mglkg/ngảy, chỉ 1 trong 2 nghiên cứu EFD,
có sự giảm nhẹ trọng lượng bảo thai đi kèm với tảng rắt ít những thay đốilbắt thường nhẹ về
xương. Không có ảnh hưởng đên sự mất phôi và không tăng tỉ lệ dị tật. NOAEL (Mức liều
không quan sảt thắy tác dụng không mong muốn - No Observed Adverse Effect Level) lả 3.600
mglkglngảy cho chuột cống cải mang thai (gảp 12 lần MRHD dựa trên mglm²) vả 1.200
mg/kg/ngảy cho bảo thai.
Bốn nghiên cứu về phảt trìển phôi thai - bảo thai đă được thưc hiện trên thỏ ở cảc liều 200, 600,
800, 1.200 và 1.800 mglkglngảy. Mức liều 1.800 mg/kglngảy gây tăng đảng kế độc tinh cho mẹ
vả giảm trọng lượng bảo thai đi kèm vởi tăng tỉ lệ bảo thai có cảc bắt thường về tim
machlxương. NOEAL lả dưới 200 mg/kg/ngảy cho mẹ vả 200 mg/kglngảy cho bảo thai (tương
đương với MRHD dựa trên mglm²).
Một nghiên cứu về sự phảt triền chu sinh và sau sinh được thực hiện trên chuột cống ở các liều
levetiracetam 70, 350 và 1.800 mg/kglngảy. NOAEL lả z 1.800 mglkg/ngảy cho chuột oải FO vả
cho sự sống oòn, tảng trưởng vả phảt triền của toản bộ số chuột con F1 đến khi dứt sữa (gấp
6 lần MRHD dưa trên mglm²).
Cảo nghiên cứu trên động vật mởi sinh vả chưa trưởng thảnh ở chuột cống vả ohó chứng minh
rằng không quan sảt thắy tảo dụng không mong muốn được trong bất cứ tiêu chí chuẩn nảo về
Trang 13/14
phát triển hoặc trưởng thảnh ở các liều lên tởi 1.800 mg/kg/ngảy (gấp 6-17 lần MRHD dựa trẻn
mglm²).
HẠN DÙNG
36 thảng kể từ ngảy sản xuất.
BÀO QUẢN
Bảo quản dưới 30°C.
ĐỀ XA TẦM TAY TRẺ EM
ĐỌC KỸ HƯỞNG DĂN sữ DỤNG TRƯỚC KHI DÙNG
NÉU CẢN THÊM THÔNG TIN x… HỎI Ý KIỂM BÁC sĩ
SẢN XUẦT BỜ!
UCB Pharma S.A
Chemin du Foriest, 1420 Braine, I’Alleud, Belgium.
o
GlaxoSmithKline
KEPPRA là nhãn hiệu thương mai đã đăng ký của GlaxoSmithKline group of companies. ỔỸ
Dựa trên NCDS 05 ban hảnh ngảy 20|12|2013 (trữ dữ liệu liên quan đến mở rộng lữa tuổi ở
bệnh nhi)
KEPTABõOO 0214-05|201213
ỆJTỄUỜNG PHÒNG
CỤ C TRUỜNG
Trang 14/14
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng