















llllllll ` ' ,_Ỉ _\ {'
lv …. )
ỉJ.^.l LJ
u)',›Xì )) …
(qaeapu 091° ẩ²lWẳlv` .`
uonn|ogo )… oo'z ~
|… Jad S… OZ/ 8… 08
uneumm/nuugdm uxxmaom
1003009C10
uoụmos |EJO ỡenale>l :oooooecm
uu. -Qn-
Ụ" WA
Kaletra® Oral Solution ỆỆ
Lopinavir ] Ritonavir
80 mg/ZO mg por ml
CW
le mluiqlozưzệ~r mmg :!e omva e IOrrgee 'an'l
300m1đesolugão ỦN …
… 0 M… 0
(5 frascos com GOmlcada) mạ.umlm|o
Cì-umùxM)ulmựóumennrưxn
»… nlmạqcmnpiuanvlửclq ~)lucmdmưu ›…
lwon DnCuuruọu
(…: mkguÍưGỌ—E'L) xéwlocmtamooeme
Nhífeltssấmllhpuộq p…; m…… ưuzlcncpmoóo
LtllM(ủmmije n…ma anuưaựmunnim .
n-c Azmsdu—semưnruembaìagtmadaaưrqxc
nưúnnưmnýmmưqduhqn'fm lua upmỵnmzú:
mam Mưurícuúndu'ư eeđJnudascrqnụs
RX Only [ Í ’ ý ’ `Íỳ ý 1
Dnmn nnubuxh _
nựìlu v…
Kaletra® Oral Solution
Lopinavirlllitonavir
80 mg/20 mg per ml
300 ml of sohmon
(ỂEoỳttles of60 ml each)
R. M uu Iìn hu
uutumụmu m….m-nu x ….)
n…. uh .q uh ml u…. on co …— …ẹnnu um.Lnnu… X) m| ›loẹ .+m ỉd- … ..) u<
.) n» um… —.Jlmn hu)
)» Au-n …› … ưu % cL`n. ch «m. ưu …… «… m…. )… u… … u… … ug n hm
d'murbru s…nsx NSX …: :… 1… ' um -rxr nen…t.
Inq.Aumqm ).ư nnMan): rr) 1…nj … udị| :) lun mu n. : mm… Ju )… m…—
:… nA …— hu: :k` w … … .›.ạ .» .…
sz \\ uu»…
n… … ra… un rMn m Vm Nn uhH: ba…uunchu lnlM l\wa
mạp …)1
o
.
7
ơn
7 ".r
Ccvụù'm
Euhlwídmimtmunnủmỵbụuwuũìũullmn
Icủuíuu
kembwđpxkựnm
Suumbưdpxkụm'ơMu-ủvmw
sunplnnnh-
Sian mơ(rrc)ưdmọomcdmmpuq
Rủụmm )Mpatmunuưnwcdduưdmhr Um
(ủ…) uduuedbtbuìấx n……nectuuvumdued
… vavvuũmủưpr Avuctọuuưm
uniwưnn Kupuudủtrtuhndqhddúef
Nfflumuss
rme IANWIMA
I…lì IW]
M… IOTIImSH
Wnnùọn H
Nmùl OlmI INIÌỸ
Im… ›cmlr n|lm
Wan ! MM
Kuụ mu
Muufmđiinhdbr
Aun'meun—ahuđ
WougùKemell SEl UK
[ỨỀ
’ ,…L 3…
m -ỵC
^
`s
..
'ƯƯ.’ "VH' .
M) *“
Front Cover
LmNo 3956 .
Kaletra“ Otal Solutmn 3
anínavír / Rủonuir
80 mg/20mg per ml Ề
60 ml nì solution | 60ml de sduậo
Rmey _
Illlllll …
AL…eưtmlu-MUJỊIM IằJawwnnlenlu
nuadeuhguíưu …npecgna…umm mrlơndn
Ikmcl Iu nm
In…un: íu~ìu u
Audwmuznuunm m-nnfumnưrnnn
…
-uw
m…nucm n
NuDẦC M“
1… uumonpuuu “"“ mnnz
. mm Zlnhabun mllnllnn
Lu… Ễềmuĩn mb— lunpUunĩ
lom um;
Dumofduọnum
Ll5lNo 3956
; Kaletta' Oral Solution
chnnlvit] Ritcnavir
8 80 mg | 20 mg per ml
60 mlofsdutinn |GOmI đc soluqăo
R: nnly
obbvle
RPVzEf'.C ’ “ 'r …nl Luv…
ÍíiJĩ'lk.
zu…
CmWùnủnntmtmÚmịđmwnmtuưmgùmifaw
lnkụ-
vuvm dlmulmotuu
nhuth
Deauln zumamruẹùuulummcútơ Dmmừnmcụusmpnuwa
luầwlumtm ndulI
inqhnntnnmẹh
c…numhựknư n-c›u…lummaam …:
munủhrílfnợopeln …uuunúu 'opơuđơdldĩ am
(AMWJWWMAdnmAIST
m
lnhl ddnmnn zmum lũml …)er mmlmnuw
hủ—
su cm)…n: aadaụmm
ủ
Mn ủn…
NMbyynu mem keondoưí p…qumenơm M AM
Iuưụ mu…
suunmiụmuưlt)mưmụnndmơuạun
lúwnmbyùưp:mmmnuqụ vn Iwumlưm (Gin)
cndurM 511… 25 'C
Đọc kỹ hưởng dẫn sữ dụng rrước kh1dùng. Nếu cẩn ma… rhông tin, xin hỏiý kiểu bác sĩ.
Thuốc nây chỉ dùng theo đơn của bác sĩ.
KALETRA®
(Dung dich uống Iopinavir/ritonavir)
MO TA
Kaletra ( lopmavưlntonavư) là một công thức phối hợp cùa lopinavir vả ritonavir. Lopinavir là một chất ức chế HIV ] vả
HIV-2 protease. Khi dùng phối hợp trong Kaletra, ritonavir ức chế sự chuyền hóa qua trung gían CYP3A của iopinavir, từ
đó Iảm tăng nông độ lopỉnavir trong huyết tương.
Lopỉnavir có công thức hóa học lả [lS- [IR*, (R*), 3R*, 4R*]]—N—[4—[[(2,6-dimethylphenoxy) acetyl] amino] -3-hydroxy-S—
phenyl-l-(phenylmethyl)pentyl]telrahyđro-alpha-( I-methylethyl)-2—oxo—l(2H)—pyrimidineacetamide. Công thức phân từ
cùa lopinavir lả ngH,;sN4Os, vả phân tử lượng lả 628,80. Lopinavir có công thức cấu tạo như sau:
Ổ a
Ritonavir có công thủc hóa học là 10- -Hydroxy— —2- -methyl- 5-(l-methylethyl} l- --[2 (l --methylethyl) 4-thíazolyl]- -3, 6— dioxo-
8, ll—bis(phenylmethyl)- 2, 4, 7, l2-tetraazaửidecan-l3-oic acid, 5- -thiazoiylmethyl ester, [SS-(SR*, 8R*, 10R* ,HR”)]
Công thức phân tử là CpHASNÓOqu vã phân tử lượng lả 720,95 Ritonavir có công thức cắn tạo như sau:
H,C C))3
0 O
) ĨĨ) )oẮ
22— CH3 S
Ổ
THÀNH PHẨN
Dung dịch uống Kaletra chủa 80mg lopinavir vả 20mg ritonavir trong 1 ml với cảc tá dược sau đây: cồn, xi—rô ngô chứa
hảm lượng cao fiuctose, propylene glycol, nước tinh khiết, glycerin, povidone hương Magnasweet—l IO, hương vani, tinh
dầu thầu dầu, polyoxy] 40 hydro hóa, hương kẹo bông nhân tạo, kali acesulfame, natri saccharin, natri clorid, tinh dầu bạc
hả, natri citrat, acid cỉtric vả menthol.
Dung dịch uống Kaletra chứa 42, 4 % alcohol vù 15,3% propylene glycol.
CHÍ ĐỊNH
Kaletra được chỉ định phối hợp với các thuốc kháng retrovirus khác đỉểu trị cho bệnh nhân nhiễm virus gây suy giảm miễn
địch ở người (HIV-I ) trên cảc đối tượng người lớn, trẻ vị thảnh niên vả trẻ em từ )4 ngả) tuổi trở lên.
Lựa chọn Kaletra để điều trị cho bệnh nhân nhiễm HlV-l đã từng sử dụng thuốc ức chế protease nên dựa vảo xét nghiệm
đề kháng vỉrus vả tíền sứ điều trị của bệnh nhân (xem phần Cảnh báo vả thận trọng, Dược lực học)
uỀu DÙNG VÀ CÁCH DÙNG , _
Nên sử dụng Kaletra theo chỉ định của bảo sĩ đã có kỉnh nghiệm diêu trị nhiêm HIV.
LIÊU LƯONG
Sử dụng cho người !ón vã trẻ vị lhânh niên
Liều khuyến cảo của Kaletra là 5 ml dung dịch uống (400/100mg), 2 lần mỗi ngả), dùng cùng thức ăn.
Sử dụng cho bệnh nhân nhi (trẻ lừ 14 ngảy Iuổì Irở lên)
Sử dụng lỉều đung dịch uổng chính xảo nhất khi dựa trên diện tích bề mặt hoặc trỌng lượng cơ thế. Tuy nhiên, dạng viên
nén K2aletra ( 100/25 mg có thể được sử dụng cho trẻ em cân nặng ít hơn 40 kg hoặc có diện tích bề mặt cơ thể từ 20, 5 đến
1, 4 m2 và có thể nuốt cả viên nén Đối với trẻ cân nặng từ 40 kg trở lên hoặc diện tích bề mặt cơ thể lớn hơn 1,4 mz, có thế
sử dụng viên nén Kaletra (400/100 mg ngả) hai lẩn) dùng cho người lớn. Víên nén Kaletra dùng đường uống, phải nuốt cả
viên, không được nhai, bè hoặc nghiền nát viên thuốc.
Tổng lượng alcoho] vả propylene glycol từ tất cả cảc thuốc, bao gồm cả dung dich uống Kaletra sử dụng cho trẻ sơ sinh
nên được tính toản để tránh ngộ độc từ những tá dược nảy (xem phần Cảnh báo và Thận trọng).
Lỉểu khuyến cáo cho tre' em từ 14 tuối đến 6 tháng
Hướng dẫn liều cho trẻ em từ 2 tuần đến 6 tháng tuổi [
w®
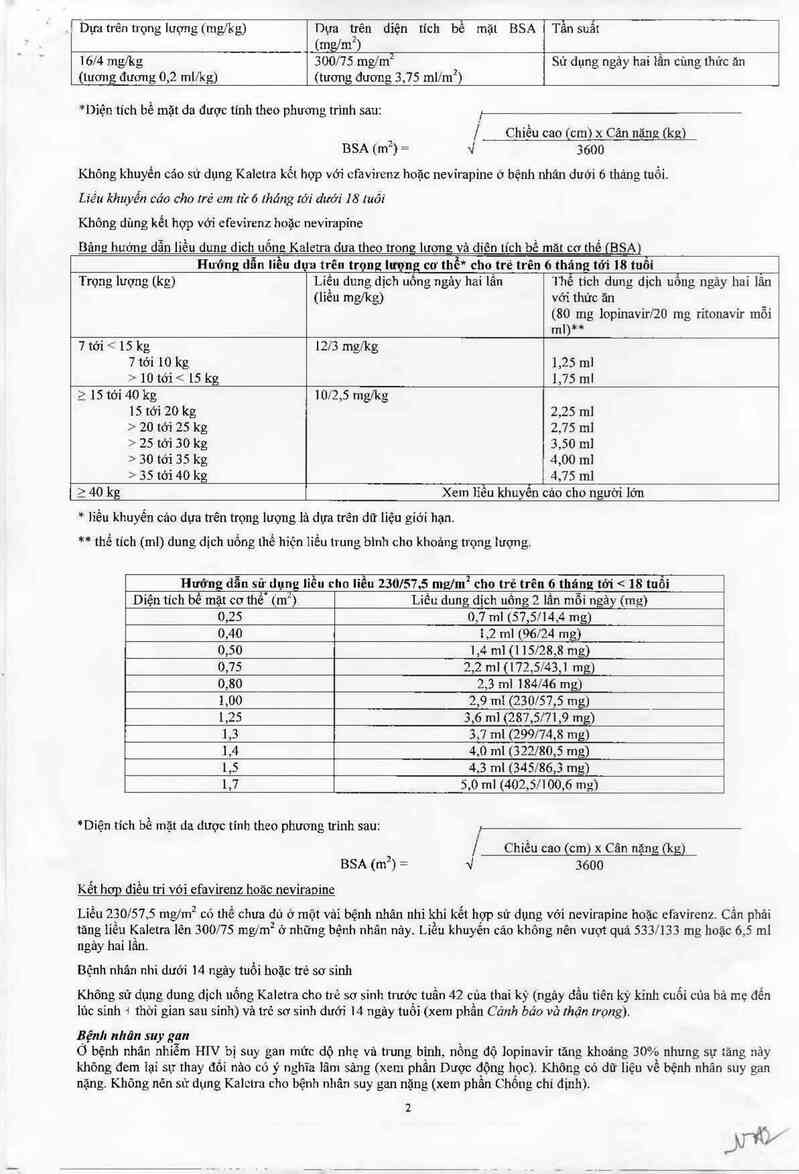
l_D)m trên trọng lượng (nngng Dựa trên diện tích bề mặt BSA Tần suất
(mg/m2) ,
16/4 mglkg 300/75 mg/m2 Sử dụng ngả) hai ìân cùng thức ăn
(lương đương 0,2 ml/kg) (tuong đuơng 3,75 ml1m²)
*Dỉện tích bề mặt da được tinh theo phương trình sau:
.J'
| Chiếu cao (cm) x Cân nặng (kg)
BSA (m²) = 4 3600
Không khuyến cáo sử dụng Kaletra kết hợp với cfavỉrenz hoặc nevirapine ở bệnh nhân dưới 6 tháng tuổi.
Liều khuyến cáo cho trẻ em từ 6 thóng xới dưới 18 luối
Không dùng kế) hợp với cfevirenz hoặc nevirapỉne
Bảng hướan dẫn liễu ):lun).I dich uống Kaletra dưa theo trong lưong vả díên tích bề măt cơ thể [BSAỵ
Hướng dẫn liều d va trên trọng luụnz cơ thễ* cho trẻ trên 6 tháng tởi 18 tuôi
Trọng lượng (kg) Líều dung dịch uống ngả) hai lẩn Thê tich dung dịch uông ngả) hai lẫn
(lỉều mg/kg) với thức ản
(80 mg lopinavir/2O mg rỉtonavỉr mỗi
ml)**
7 tới < )5 kg )213 mg1’kg
7 tới 10 kg 1,25 ml
>10tới 20 tởỉ 25 kg 2,75 ml
> 25 tởỉ 30 kg 3,50 m]
> 30 tởi 35 kg 4,00 ml
> 35 tởi 40 kg 4,75 ml
2 40 kg Xem lỉêu khuyên cảo cho ngưới lớn
* liều khuyến cảo đựa trên trọng lượng là dựa trên đữ liệu gíớỉ hạn.
** thề tich (ml) dung dịch uống thể hìện liều 1mng bình cho khoảng trọng )uợng.
Hướng dẫn sử dụng liễu cho liều 230157,5 mg/m² cho trẻ trên 6 thảnz tới < 18 tuổi
Diện tich bề mặt cơ thẻ“ (m²) Liều dung dịch uống 2 lần mỗi ngảy (mg)
0,25 0,7 ml (57,5114,4 mg)
0,40 ),2 ml (96/24 mg)
0,50 ),4 m] (115/28,8 mg)
0,75 2,2 ml (172,5143,1 mg)
0,80 2,3 ml 184146 mg)
1,00 2,9 mi (230/57,5 mg)
),25 3,6 ml (287,5/71,9 mg)
1,3 3,7 ml (299174,8 mg)
),4 4,0 ml (322/80,5 mg)
1,5 4,3 ml (345/86,3 mg)
1,7 5,0 ml (402,5/100,6 mg)
*Diện tích bề mặt da được tỉnh theo phương trình sau:
!
/ Chiều cao (cm) x Cân nặng (kg)
BSA (m²) = xi 3600
Kêt hơp điêu tri với efavirenz hoăc neviraoinc
Liều 250/57,5 mg/m2 có thế chưa dù ở một vải bệnh nhân nhi )ghi kết hợp sử dụng với nevirapine hoặc efavircnz. Cẩn phải
tăng lìẽu [ặaletra lên 300/75 mg/m2 ở những bệnh nhân nảy. Liêu khuyên cảo không nên vượt quá 533/133 mg hoặc 6,5 ml
ngây hai lân.
Bệnh nhân nhi dưới 14 ngả) tuối hoặc trẻ sơ sinh
Không sử dụng dung dịch uống Kaletra cho trẻ sơ sinh trước tuần 42 của thai kỳ (ngả) dầu tiên kỳ kinh cuối cùa bả mẹ đến
lủc sình ) thời gian sau sỉnh) và trẻ sơ sinh dưới 14 ngả) tuối (xem phần Cánh báo vã thận trọng).
Bệnh nhân suy gan
Ó bệnh nhân nhiễm HIV bị suy gan mức dộ nhẹ và trung bình, nồng độ lopinavir tăng khoảng 30% nhưng sự tảng nảy
không đem ìạỉ sự thay đổi nảo có ý nghĩa lân) sảng (xem phần Dược động học). Không có dữ liệu về bệnh nhân suy gan
nặng. Không nên sử dụng Kalctm cho bệnh nhân suy gan nặng (xem phần Chống chỉ định).
JJẤ/
Bệnh nhân suy thận
Đô lhanh thải tại thận của lopinavir vả ritonavir không đảng kế nên có it khả nảng nồng độ Lhuốc tmng huyết tương tăng ở
bệnh nhân suy thận Do lopinavir vả ritonavir găn mạnh với protein nên i) có khả năng thuốc có thế được ioại bỏ dảng kế
bằng thẳm tich mảu hoặc thẩm phân phủc mạc.
CẢCH DƯNG
D_ung dịch uống Kaletra phải dùng_ cùng vởỉ thức ăn (xem phần Dược động học) Liều dùng nên dược lấy bằng xy—lanh
uông cỏ chia vạch 2 m] hoặc 5 ml để có thể iẩy đúng liều được kê đơn
CHỐNG CHỈ ĐỊNH
Kalctra chống chỉ định với bệnh nhân có tiền sử mẫn cảm vởi iopinavỉr, ritonavir hay với bất kỳ thảnh phần nảo của thuốc.
Bệnh nhân suy gan nặng
Kaletra chứa iopinavir vả ritonavir, cả hai thảnh phần nảy là chắt ức chế isol`onn P450 cúa CY P3A Chống chỉ định dùng
Kaletra cùng iúc với các thuốc có độ thanh thải phụ thuộc nhiều vảo CYP3A vả những thuốc mả sự tăng nồng độ thuốc
trong huyết tương di kèm những tác dụng bắt lợi nghiêm trọng vả/hay đe đọa đến tính mạng. Cảo thuốc nảy ban gôm
Nhóm thuốc
[ Thuốc
Phân It'ch nguyên nhãn
Lám tăng nồng độ các thaổc sử dụng đồng thời
ngực
Cảo thuôo đối vận alpha Alfuzosin Nông độ aifuzosin huyết tương tăng có thể dẫn tới giảm
l—adrenoceptor huyết áp nghiêm trọng. Chống chỉ định dùng đồng thòi
Kaletra với alfuzosin (xem phẩn TươngT lảc thuốc).
Thuốc chống đau thẳt Ranolazin Nống dộ cùa. ranolazin trong huyết tương tăng lẽn, có
thề Iảrn tâng khả năng xảy ra cảc phản ứng nghiêm trọng
vả/hoặc đe dọa tinh mạng (xem phẩn T ương lác thuốc)
Các thuốc chống loạn
nhịp
Amỉodaron, droneđaron
Nồng độ amiodaron vả droncdaron huyết tương tăng. Do
đó, tăng nguy cơ loạn nhịp hoặc cảc tảc dụng bât lợi
nghiêm trọng khác.
Các thuốc kháng khuẩn Acid fusiđic Nống dộ acid fusidic huyết tương tảng. Chống chỉ định
dùng dồng thời Kaietra vả acid Fusidic trong điều trị
))hiễư) trùng da (xem phẩn T ương tác lhuốc).
Thuốc chống ungthư Vcnetoclax Nồng dộ trong huyết tương của venetoclax tăng. Dẫn
đến tăng nguy cơ cùa hội chứng tiêu khối )) ở líều khới
đầu và trong quá trình tăng iiều (xem phần Tan tác
thuốc]
Thuốc điếu trị gout Colchicin Tăng nổng độ của coichỉcin trong huyết tương. Nguy cơ
xảy ra phản ứng nghiêm trọng vả_/hoặc tử vong ở bệnh
nhân suy gan, suy thận (xern phân Cảnh báo vi: thận
trọng vả phần Tương lác lhuôc).
Các thuốc
histamin
khảng
Astemizoi, Terfcnadin
Nồng độ asĩemizol vả terfenadin huyết tương tãng. Do
đó, tăng nguy cơ ioạn nhịp nghiêm trọng do các thuốc
nảy
gan C tảo động trực tiếp
Cảo thuốc chống loạn Lurasidon Nộng độ của lurasidon trong huyết tương tăng lên, có
thần thế lảm tăng khả năng xảy ra các phản ứng nghìêm trọng
Cảo thuốc an thềm kinh vảfhoặc de dọa tinh mạng (xem phần Tương )a’c lhuốc)
Pimozid Nồng độ pimozid huyểt tương tăng. Do đó, tăng nguy co
cảc bắt thường về máu nghiêm trọng, hoặc các tảc dụng
bất lợi khảo của thuốc nảy.
Quetiapin Nống dộ quetiapin huyết tương tăng có thể dẫn tới hôn
mê. Chống chỉ định dùng đồng thời với quetiapine (xem
phần T ư
Không cân hiệu chỉnh liêu
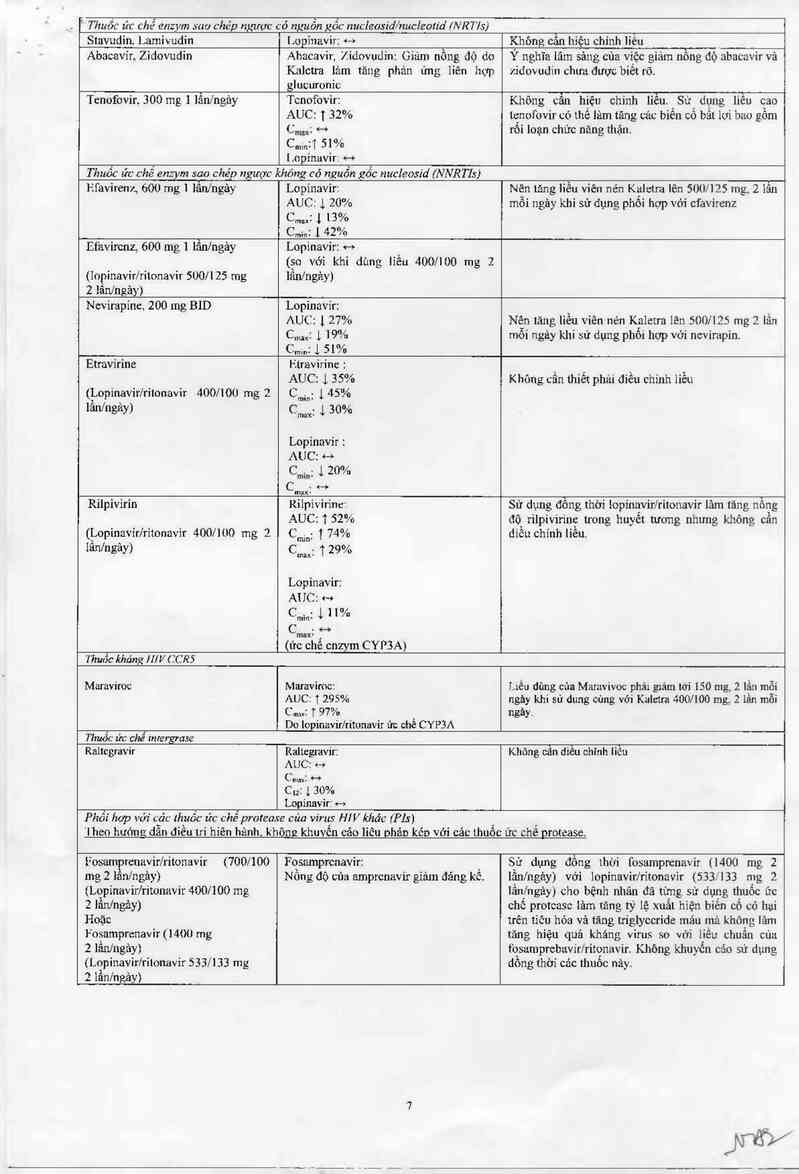
Abacavỉr, Zidovudin
Abacavir, Zidovudỉn: Giảm nồng độ do
Kalctra lảm tãng phản ứng liên hợp
Ý nghĩa lâm sảng của việc giảm nồng độ abacavir vả
zidovudin chưa được biêt rõ.
glucuronic
Tcnofovir, 300 mg 1 lân/ngảy Tcnofovir: Không cẫn hiệu chinh liêu. Sử dụng liên cao
AUC: T 32% le_nofovir có lhề lảm tăng các biến cố bất lợi bao gồm
C…: H rôi loạn chức năng thận.
Cminti 51%
[.opinavir: ->
Thuốc ức chế enzym sao chép ngược khónz có nguồn zốc nucleosid (NNRTIS)
Efavirenr, 600 mg 1 lầnlngảy
Lopínavir:
AUC: 1 20%
Cmax: 1 13%
C……: 1 42%
NỄn tảng liều viên nén Kạletra lên 500/125 mg, 2 lần
môi ngây khi sử dụng phôi hợp với cfavirenz
Efavircnz, 600 ing 1 lẩn/ngảy
(Inpinavir/rilonavir 500/125 mg
2 lân/ngây)
Lopinavir: +-›
(go vởì khi dùng lỉều 400/100 mg 2
lân/ngảy)
Nevirapinc, 200 mg BID
Lopinavir:
AUC: 1 27%
C.…1 1 19%
C…: 1 51%
Nê_n tăng lìều viên nén K_aleưa lẽn sonnzs mg 2 lần
môi ngùy khi sử dụng phôi hợp vởi ncvirapin.
Etravirine Htrzlvirine :
AUC 1 35% Không cân thiết phải điều chỉnh liêu
(Ị..opinavirỉrilonavir 400/100 mg 2 Ễmin_ 1 45%
lan/ngay) Cmax- .L30%
Lopinavỉr :
AUC: H
C…; 1 20%
Cmax: (%
Rilpivỉrin Rilpivirinct Sử dụng đông thời lopinavir/ritonavir lảm tăng nồng
AUC: 152% độ rilpivirinc trong huyết tương nhưng không cân
(Ị…opinavírlrỉtonavir 400/100 mg 2 n;ĩ 74% diễn chính liều.
Iunlngay) CIm 129%
Lopinavir:
AUC: …
Cmỉw ị 11%
C…: j-°
(ức chê cnzym CYP3A)
Y'huồc kháng mv ccns
Maraviroc Maraviroc: Liều dùng cùa Marzwivoc phải giãm tới 150 mg, 2 lằn mỗi
AUC: T 295%
Cm: T 97% ,
Do lopinavirfritonavir ức chê CYP3A
ngây khi sử dụng cùng với Kaletra 400/100 mg, 2 lần mỗi
ngây.
Thuốc ửc chế intergrase
Raltcgravir
Raltegnwir:
AUCI f—›
Cnmxễ °'°
Cu: J, 30%
Lopinavir: e-›
Không cân diêu ch1nh liêu
Phối họp với c_ảc fhyốc ức chế protease của viruts Hỉ V khác (Pls)
'I'heo hướng dân điêu lri hiên hânh. không khuyên cảo liêu DhảD kéo với cải: thuốc
ức chế protease,
Fosamprenavir/ritonavir {700/100
mg 2 lần/ngảy)
(Lopínavirlritonavir 400/100 mg
z Iần/ngây)
Hoặc
Fosamprenavir (1400 mg
2 lần/ngảy)
([.opinavir/rilmavír 533/133 mg
z lẩn/ngảy)
Fosamprcnavir:
Nôn g độ của amprenavir giảm đảng kê.
Sử dụng đồng lhời fosamprcnavir (1400 mg 2
lần/ngảy) với lopinavir/rỉtonavir (533J 133 mg 2
lẩnlngây) cho bệnh nhân đã từng sử dụng thuốc ức
chế protcasc lâm tãng tỷ lệ xuất hiện biến cố có hại
trên tỉêu hóa vả tăng triglyceride mảu mã không lảm
tăng hiệu quả kháng virus so với liều chuẩn của
quamprcbavirlritqnavir. Không khuyến cáo sử dụng
dông thời cảc thuôc nảy.
Indínavir, 601) mg 2 1ẩn/ngảy
indinavirz
AUC: <—›
m`,,, 1 3. 5 lấn
Cmax 1
(tương tư với liều đơn indinavìr 800 mg
TID)
Lopinavir : <—›
(so với nhóm chửng lịch sừ)
Chưa xác định được liếu thích hợp cho phôi họp nảy
dê dảm bảo hỉệu quả vả tỉnh an toân.
Saquinavir 1000 mg 2 lân/ngảy
Saquinavir : «—
Không cân híện chinh lỉều.
'Ijipranavír/rítonavír (500.1100 mg 2
lânlngảy)
Lopinavỉr :
AUC: 1 55%
(J,,,,,,: 1 70%
C.…: l 47%
Không khuyên cản sử dụng đồng 1hời cảc thuốc nảy.
Thuốc úc chế bdí tiết acid
Omcprazol (40 mg 1 1ẩn/ngảy)
Omeprazol : <-›
Lopinavir : <—>
Không cẩn hiệu chinh liều.
Ranitìdin (150mg liêu dơn)
Ranitidỉn : <~+
Khỏng cẫn hiệu chinh iiệu,
Thuốc đối vận alpha 1 —adrenoceptur
A1 íưzosín
Alfuzosin :
Dp ]opinavir/ritonavir ức chẽ CYP3A,
nông độ alfuzosin có nguy cơ tảng
Chống chỉ định sử dụng Kalctra cùng Alfuzosin
(xem phẩn Chống chỉ định) do có thể tăng biển cố
gây độc của alfuzosin kể cả giảm huyết ảR
Thuốc gíám dau
Fcntanyl
Fentzmyl :
Kaletra ức chế CYP3A4 lảm tãng nồng
độ fentanyl trong huyết tuong vì vậy 1ảm
tăng ngưy cơ xảy ra những tác dụng
không mong muôn (ức chế hô hắp,an
thấn)
Theo dõi cẳn thận cảc túc dụng không mọng muốn
(dặc biệt là suy hô hắp và cả lác dụng an thân) khi sử
dụng đông thời fcntanyi vả Kaletra.
Th uõc chống đau thăt ngực
Ranolazin
Do sự ửc chế CYP3A của
lopỉnavir/ritonavir, nông dộ
ranolazin có thô lăng lên
Việc sử dụng đổng thời `Kaletrạ với ranolazin lả
chông chỉ định (xem phân Chỏng chỉ định)
Thuốc chống loạn nhịp
Amiodaron, dmnedamn
Amiodamn, dronedaron : nồng độ có thể
tăng do Kaletra ức chê CYP3A4
Chống chỉ định két hợp Kaletra với amiodaron hoặc
droncdaron (xcm phần Chổng chỉ định) do tăng nguy
cơ loạn nhịp tim hoặc các tảo dụng bất lợi nghiêm
trọng khác.
Dig0xin
Digoxin :
Nồng dộ trong huyết tướng có lhế táng
do sự ức chế P-glycoprotcin gây ra bởi
Kaletra Sự tăng nông độ digoxin có thể
gíảm sau một thời gian do cảm ứng l’gp
Căn thận trọng, theo dõi chặt chẽ nông độ dígoxin
nểu lùm được xét nghiệm nảy lrong trường hợp phối
hợp Kaletra vả digoxin. Nên dưa ra cânh bảo dặc
biệt khi kê đơn Kaletra cho bệnh nhân đang sử dụng
digoxin v1 lác dụng ức chế tức thì 1’-glycoprolcin cùa
ritonavir lảm nông độ digoxin tãng lên đáng kế. Đối
với nhửng bệnh nhân bắt dẩn sử dụng digoxin khi
dang dược diều lrị bằng Kaletra thì nồng dộ dígoxin
có thể tăng thấp hơn.
Bepridil, Lidocain đường toản thân
vả Quinidin
Bepridil, Lidocain đường tnản thân và
Quinidin :
Nổng độ có thể tãng khi sử dụng phối
hợp với Kaietra,
Cẩn thận trọng vả khuyến cản lheo dõi nồng dộ
thuôo nêu lảm được xét nghiệm nảy.
Kháng .s'inh
C larithromycin
Clarỉthromycin:
AUC của clarithromycỉn tăng vừa phái
do sự ức chế CYP3A gây ra bời Kaletra
Bệnh nhân suy thận (CrCL < 30 mllphủl) nên giảm
liều cùa clarithromy cin (xem phẳn Cánh báo vờ Ihản
trọng). Cẩn thận trọng khi sử dụng clarithromycin
phối hợp với Kaletra cho bệnh nhân suy giảm chức
năng gan hoặc thận.
Thuốc chống ung Jhư
Afatinib Afatinib: Cẩn thận trọng khi dùng afatinìb với Kaletra Xem
(Ritonavir 200 mg, ngảy 2 lần) AUC 1 Tớm ư'n đặc tinh sản phẩm (SPC) afatinib để hiết các
Cimx T khuyến cảo về điều chính liều lượng. Theo dõi các
Mức độ tăng phụ thuộc vảo thời gỉan sư
dụng ritonavir
Do sự ức chế BCRP (protein kháng ung
thư vủ/ABCG2) vả ửc chê P—gp câp tính
bới lopinnvir/rilonavir
phản ứng phụ (ADR) liên quan dên afatinib.
Ccrỉtiníb
Nông dộ trong huyêt tưmtg có thẻ lăng
đo sự ức chê CYP3A vả P-gp bới
lopinavir/ritonavỉr
C ẩn thận lrọng khi dùng ceritinib với Kaletra. Xem
Tóm tất đặc tinh sản phắm (SPC) của ccritinib dễ
biết các khuyến cảo về díều chỉnh liều lượng 'l`hco
dõi cải: phản' ưng phụ (ADR) liên quan đến ccritinib.
J®f
`VJJ _
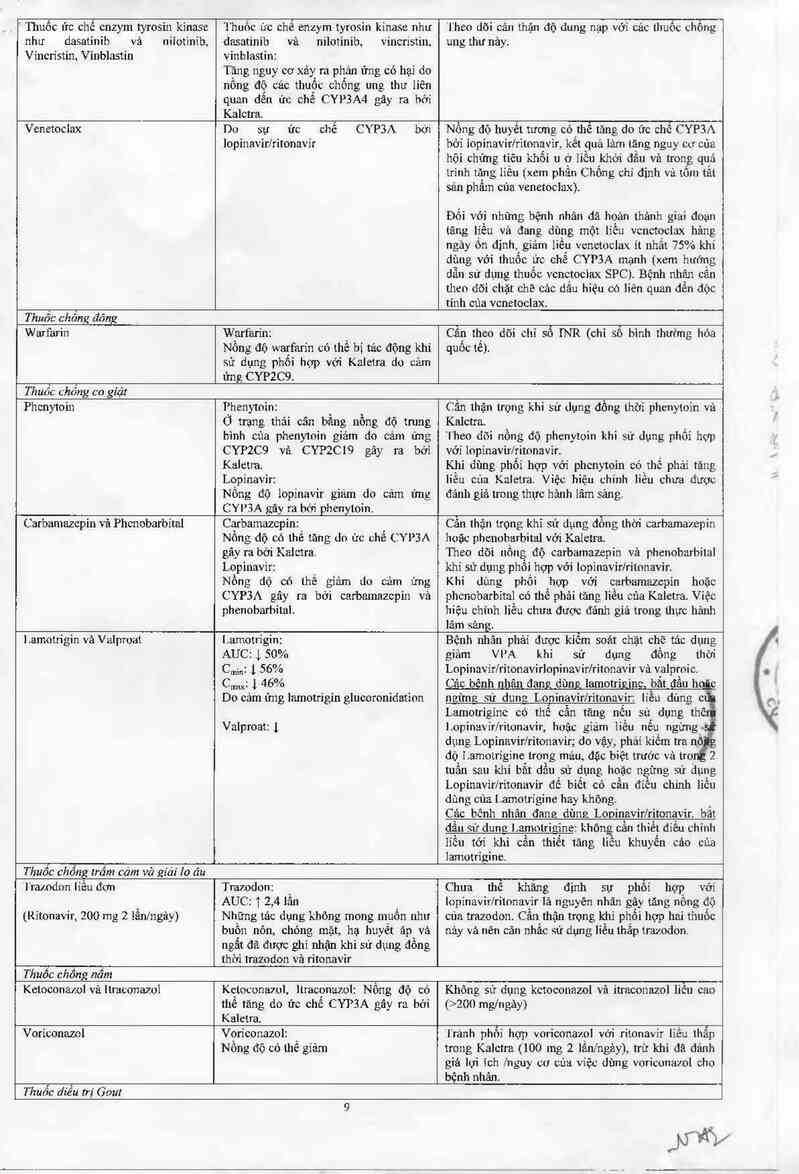
' Thuốc ức chế cnzym tyrosin kinase
như dasatinib vả niiotinib,
Víncrístin` Vinblastin
Thuốc ửc chê enzym tyrosin kínase như
dasatinib vả nilotinib. vincristin,
vinblastin:
Tăng nguy cơ xảy ra phản ứng có hại do
nông độ cúc thuốc chống ung thư liên
quan dển ửc chế CYP3A4 gây ra hớỉ
Kaletra.
i'heo dõi cắn thận dộ dung nạp với các thuốc chống
ung thư nảy.
Venetociax
Do sự ức chế CYP3A bởi
lopinavir/ritonavír
Nồng độ huyết tương có thể tăng do ức chế CYP3A
bởi iopinavirlritnnavir_ kết quả ]ảm tảng nguy cơ của
hội chứng tiêu khối u ớ liễu khởi đầu và trong quá
trinh tăng Iíều txem phần Chống chi dinh vả tốm tắt
sản phẩm của venetoclax)
Đối với nhửng bệnh nhân dã hoản thảnh giai doạn
tăng liều và đang dùng một iiều vcnctoclax hảng
ngây ốn dinh, giảm lỉều vcnctoclax ít nhất 75% khi
dùng với thuốc ức chế CYP3A mạnh (xem hướng
dẫn sử dụng thuốc vcnctociax SPC). Bệnh nhân cân
theo dõi chặt chẽ các đầu hiệu có liên quan dến dộc
tính cùa vcneloclax.
Thuốc chrĩing dông
Warfarỉn
Warfarỉn:
Nồng độ warfarin có thể bị tâc động khi
sử dụng phối hợp với Kaletra do cảm
ứng CYP2C9.
Cân theo dõi chỉ số INR (chỉ số bình thường hóa
quôc tê).
T huốc chồng co giật
Phcnytoin
I’henytnin:
Ở trạng thái cân bằng nồng độ trung
bình cùa phenymin giảm do cảm ửng
CYP2C9 vả CYP2CI9 gây ra bới
Kaletra.
Lopínavir:
Nồng độ lopinavir giảm do cảm ứng
CYP3A gây ra bới phenytoin.
Cần thặn trọng khi sử dụng đổng thời phenytoin vả
Kaletra.
'l`heo dõi nổng độ phenytoin khi sử dụng phối hợp
với lopinavìr/ritonavir.
Khi dùng phổi họp với phenytoin có thể phải tăng
liền của Kaletra. Việc hiệu chỉnh liều chưa được
đánh giá trong thực hảnh lãm sảng.
Carbamachin vả Phcn obarbital
Carbamachin:
Nồng dộ có thể tăng do ức chế CYP3A
gây ra bới Kaletra.
Lopinavir:
Nồng dộ có lhể gỉảm du cảm ứng
CYP3A gây ra bới carbamachin vả
phenoharhilal.
Cân thận trọng khi sử dụng dồng thời carbamazepin
hoặc phcnobarbital vởi Kaletra.
Theo dõi nồng độ carbamazepin vả phenobarbital
khi sử dụng phối hợp với lopinavirlritnnavir.
Khi dùng phối hợp vởi carbamazepỉn hoặc
phcnobarbital có thế phải tăng liều cúa Kaletra. Việc
hiệu chỉnh liếư chưa được đánh giá trong thực hảnh
lãm .~eảng.
l.arnotrigin vả Valproat
Lamotrigin:
AUC: 1 50%
C…;,,: L 56%
C…1 1 46%
Do cảm ứng lamotrigin glucoronidatinn
Valproat: 1
Bệnh nhân phải được kiêm soát chặt chẽ tảc dụng
giâm VI-’A khi sử dụng đồng thời
Lopinavir/ritonavirlopinavirfritonavir vả valproic.
Cải: bẽnh nhân đan dùn lamotri inc bắt đầu hoỉc
nzỉmsz sứ dum: Loninavir/ritonnvir: líều dùng c
Lamotrigínc có thề cấn tãng nếu sử dụng thẻ
lopinavỉr/ritonavir, hoặc giảm iiều nểu ngừng
dụng Lopinavirfritonavir; do vậy, phải kiếm tra nỗ g
dộ I amoirigine erng máu, đặc biệt trước và tro
tuần sau khi bắt dầu sử dụng hoặc ngừng sử dụng
Lopinavirlritonavir để biết có cần điểu chinh liều
dùng của 1.amotrỉgine hay không.
Cảc bênh nhân đang dùng Looinavir/ritonavir. bắt
dau sứ dum ] amotrigine không cần thiết díều chính
lỉcu tới khi cần thiểt tảng liêu khuyến cáo của
iamotrỉgine.
Thuốc chổng trầm cảm vờ ziảì lo âu
`l'ramdon lỉều đơn
(Ritonavir, 200 mg z iẩnfngảy)
Trazodon: `
AUC: 1 2,4 lân
Những tảc dụng không mong muốn như
buôn nôn, chóng mặt, hạ huyết áp và
ngất đã được ghi nhận khi sử dụng đồng
thời trazodon vả ritonavir
Chưa thể khăng định sự phối hợp với
lopinavir/ritonavir lá nguyên nhân gậy tâng nông độ
cùa trazodon. Cần thận trọng khi phối hợp hai thuốc
nảy vả nên cãn nhắc sử dụng liễu thấp trazodon.
Thuốc chống nốm
Ketnconazol vả ltraconazol
Kẹtoconawl, ltracpnazol: Nồng độ có
thẻ tăng do ức chê CYP3A gãy ra bới
Kaletra.
Không sử dụng ketoconazol vả itraconazol liêu cao
(>200 mgfngảy)
Voriconazol
Vọríconazol: `
Nông đô có thẻ giảm
'I'rảnh phối hợp voriconazol vởi ritonavir liếư lhấp
trong Kalctra (100 mg 2 lần/ngảy), trừ khi đã dánh
giả lợi ích /nguy cơ của việc dùng voricunazol cho
bệnh nhân.
Thuốc diều trị Gout
Colchicin Iíều đơn
(Ritonavir 200mg, 2 lần/ngảy)
Co1chicin:
AUC: ? 3 lần
C,…: 1 1.8 lẩn
I)o ritonavir ức chế P-gp vảỉhoặc
CYP3A4
Chông chi dịnh sử dụng Kaletra cùng colchicìn ớ`
bệnh nhân suy gan vù/hoặc suy thận do khả năng
tãng các tác dụng bẩt lợi nghiêm trọng vảfhoậc
ngt`mg hô hẳp liên quan đển colchicìn như dộc tính
thằn kinh cơ (kể cả tìẽu cu vân), (xem phần Chống
chỉ định vả phẩn Cánh bán vả lhận trong). Khuyến
cáo nên giảm liều hoặc ngừng sử dụng colchicìn khi
có yêu cẩu diều tri hằng Kaletra ở bệnh nhãn có chức
năng gan hoặc thặn binh thường. Xem thẻ… thông
tin kê đơn của colchicìn.
Thuốc kháng khuân
Acid Fusidic
Acid Fusidic: _
Nông độ có thẻ tãng do
lnpinavirlritonavir ức chế CYP3A
Không được sư dụng Kaletra cùng acid fusidic tmng
cảc chỉ định da liễu do nguy cơ tăng cảc tác dụng
không mong muốn của acid fusidic, dặc biệt liêu cơ
vãn (xem phẳn Chống chỉ định) Đổi với cảc bệnh
nhân đang điều trị bằng Kaletra mắc các nhiễm
khuẩn xương khớp, cân thiểt sử dụng phối hợp, phải
kiếm soát iâm sảng chật chẽ đổi với tác dụng không
mong muốn về cơ (xem phẩn Cảnh báo và thận
Irong)
Thuốc kháng mycobacterium
Bedaquilin (1i—ẽu dơn)
(lopinavir/ritonavir 400/100 mg 2
ngâyllấn, 1iểu phối hựp).
Bedaquilin:
AUC: 1 22°
Cnuxv H
Nổng độ bedaquilin huyết tương có thề hị tác
động rõ rệt khi sử dụng phối hợp với
Inpinavir/ritonavir trong thời gian dải.
Do lopinavit/tilonavir ức chế CYP3A4
Nên trânh dùng đồng thới bedaquilin vả lopinavit/ritonavir
do nguy cơ của các biến có bắt lợ] liên quan đền
heduquilin Có thể dùng phối hợp bedaquilin vả
lớpinavitltitnnavir một cảch thận trợng khí lợi ích của sự
phối hợp nảy dược dảnh giá cao hơn nguy cơ. Khuyến cản
theo dới điện tâm đồ thướng xuyên vả kiểm soát các enzym
transaminase (xem phẳn Tuơng !ác thuốc và tham khán
Tóm tắt đặc tính sán phấm cún bedaquilin).
Dclamanid (100 mg, 2 lẩiưngảy)
(Loinavirlritonavir 400 mg/IUO mg, 2
lãiưligảy)
Delamanid:
AUC: T 22%
DM—6705 (kich lhỉch chuyền hóa delamanid)
AUC: T 30%
Có thể thẩy rõ sự ânh huớng iên DM-6705
khi kéo dải việc sử dụng dổng thời với
iopinavit/ritonavir
Do nguy cơ của viêc kéo dải khoảng QT liẽn quan đền
DM— 6705, nên nếu việc sử dưng đồng lhời delamanid vả
lopinavitititonavir được đánh giá lả cần thiết, thì khuyến
cản cân theo dõi điện tãm đố (lit G) thưrmg xuyên trong
suốt quá trinh sư dụng dciamanid (xem mục Tương tác
rhuốc và tham khảo Tóm lắl đăc lính sán phấm của
delamaniđ).
Rifabutin, 150 mg 1 iần/ngảy
Rifabutín (chất mẹ và chât chuyên hỏa
25-0-dcsacetỵl):
AUC: 1 5,71ân
c…: T 3,5 lần
Khi sử dụng cùng Kaletra, khuyên cáo liên rifabutin
là 150 mg dùng cảch ngảy 3 lần mỗi tuần (ví dụ: thứ
hai— lhứ tư-thứ sản). Tăng kiềm soát các tác dụng
không mong muôn liên quan dến rifabntin kể cả
neutrnpenin vả uveitis do tăng nồng độ tifabutin.
Giảm liễu tiếp theo tới 150 mg, 2 lần mỗi tuần dùng
cách ngây cho các bệnh nhân không dung nạp liều
150 mg, 3 lẩn mỗi tuần. Phải luôn nhớ rằng liều 150
mg, 2 lần mỗi tuần có thể không dạt được nổng dộ
rifabutin tối ưu, dẫn tới nguy cơ kháng rifamycinc vả
thắt bại điều tri.
Không cần đỉều chinh liễu Kaletra.
Rifampicín
].opinavir:
Nồng độ cùa lopinavir giảm mạnh do tảc
dụng gây cảm ứng CYP3A của
rifampicin
Không sử dụng phối hợp Kaletra với rifampicin vì
lảm giảm nồng độ cún lopinavir dẫn đến lảm giảm
đảng kế tác dụng diều irị của iopinavir. Hỉệu chinh
liều cùa Kaletra thảnh 400 mg/4OO mg (ví dụ
Kaletra 400/100 mg + ritonavir 300 mg)" 2 lẩn mỗi
ngảy đã được chẩp nhận dề bù trừ lại tác động gây
cảm ửng CYP3A4 cùa rifampicin. Tuy nhiên, việc
híệu chỉnh liều có thể dẫn dến sư táng A1 TJAST vả
có thể lảm tăng các rồi loạn tiêu hỏa Do đớ, trảnh
phối hợp trừ khi thực sự cẩn thiểt Nếu sự phối hợp
không thể tránh được, tăng liễu cùa Kaletra lên mức
400 ng400 mg 2 lần mỗi ngảy có thể phối hợp với
rifampicin trong trường hợp theo dõi chặt chẽ tính an
tnãm vả giảm sải nông độ thuốc trong mảu. Liều
dùng của Knletra nẻn dược thăm dò chi sau khi dã
bắt đẳu sư dụng rifampỉcin (xem phần Cánh báo vả
[hận !rọng)
Thuốc chống !oạn Ihần
Lurasidon Nồng độ lumsidon CỘ Thê tăng do Việc sử dụng đống thời với lurasidon lả chổng
lopinavir/rilonavir ức chê CYP3A chỉ định (xem phần Chống chỉ định)
1~’imozide Nông độ pimozid có thẻ tăng do Chống chỉ định dùng đồng thời Kaletra vả pimozidc
ltipínavin'ritonavir ức chế CYP3A
vi có thể tăng khả nãng gây bắt thường về huyết học
nghíêm trọng hoặc cảc phản ửng phụ nghiêm trọng
khủc liẽn quan đến quctiapin (xem phấn Chống chi
dịnh)
Quctiapin Nông độ quetiapin có thể tăng do Chổng chỉ định dùng dồng thời Lopinavír/ritonavir
lopinavir/ritonavir ức chế CYP3A vả quctiapin vi có thề tãng độc tính 1ỉên quan đển
getiapine
Benzodiazepin
Midazolam Midazolam dường uống:
AUC: T 13 lẳn
Midazolam đường tiêm:
AUC: t 4 lẩn
Do ức chế CYP3A gây ra bời Kaletra
Không phối hỌẵ Kaletra với midazolam dường uống
(xem phần Ch ng chi dịnh), cẩn thận trọng khi sử
dụng phối hợp Kaletra vả midazolam dường tiêm.
Trường hợp phối hợp Kaletra với midazolam dường
tiêm nén chi dược tiến hảnh tại dơn vị chăm sóc tỉch
cực (ICU) hoặc các diễu kiện chăm sóc tương tự để
đảm bảo việc theo dõi chặt về lâm sảng vả xử trí
thích hợp trong tmờng hợp suy hô hẩp vả/hoặc an
thần kéo dải. Cần cân nhắc hiệu chinh liều của
midazolam, dặc biệt nểu sư dụng nhiều hơn một liều
đơn mídazolam.
Thuốc đối vận Betaz-adrenoceptor (tác dụng kéo dãi)
Salmetcrol Salmetcroi: Sử dụng salmeterol cùng Kaletra có thế lâm lăng
Nồng dộ tăng do lopinavir/ritonavir ức uy cơ xuất hiện cảc tảc dụng khỏng mong muốn
chế CYP3A vẳ tim mạch 1iẻn quan đến saltemerol như kéo dải
khoảng QT, nhịp xoang nhanh. Do vậy, khuyến cảo
khỏng sử dụng kaietra cùng salmeterol.
Thuốc chẹn kênh calci
Felodipin. Nifedipin vả Nicardipin
Felodỉpin, Nifedipin Nicardipin:
Nổng dộ tăng do ức chế CYP3A gây ra
bời Kaletra
Tth dõi hiệu quả diễu trị vả những tác dụng không
mong muốn của các thuốc nảy khi sử dụng dông thời
với Kaietra
Thuõc corticosteroid
Dcxamcthason Lopinavir: Theo dõi hiệu quả kháng virus cùa cảc thuốc nảy khi
Nồng độ giảm do dexamethason cảm sử dụng dồng thời với Kaletra,
ứng CYP3A.
Fluticason propionate, budesonidc, Fluticason propionate, SOụg xịt mũi 4 Có thế lảm tảng híệu quả diều trị của i1uticason
ưiamcinolonc dạng xông hít, dạng lằn mỗi ngây: propionat khi dùng qua dường xỏng hít. T ác dụng
dung dịch tiêm, dạng xịt mũi Nồng dộ trong huyết tươngĩ toản thân của corticosteroid bao gổm hội chứng
Nồng dộ cortisol 1 86% Cushing vá ửc chế tuyến thượng thặn dã dược ghi
nhận ở bệnh nhân sử dụng đồng thời ritonavir với
tiutícason propìonat dường xỏng hit h0ặc xịt; tác
dụng tương tự cũng có thể xảy ra với cảc
conicosteroid khác chuyền hỏa qua dường P450 3A
như budesonid vả triamcinolon. Vì vậy không
khuyến cáo sử dụng đồng thời Kaletra với các
glucocorticoid nảy trừ khi iợi ỉch diều ưi hơn hắn
nguy cơ tác dụng toản thân của conicosteroid (xem
phẩn Cánh báo vả thận trọng). Nên giảm 1iều
glucocortỉcoid đồng thời theo dõi chặt tảc dụng tại
chỗ và tác dụng toản thân của thuốc hoặc thay thế
bằng một glucocorticoid khác không phải là cơ chất
cùa CYP3A4 (ví dụ: beclomcthason). Ngoài ra khi
ngừng glucocorticoid, việc giảm liền từ từ cần dược
tiến hảnh trong một khoảng thời gian dải hơn.
Thuốc ửc chế phosphodiesterase (PDE5 )
Avanafil Avanafil: Chống chi đinh dùng avanafil vởi
(rỉtonavir 600 mg 2 lẩnlngảy) AUC: 1 13 lần Lopinavir/ritonavir (xem phẩn Chống chỉ định)
Do lopinavỉrlritonavir ửc chế CYP3A
Tadalafil Tadalafil: Điều tri tãng ảp lưc dông mach phổi:
AUC: T 2 lẩn Chống chỉ định dùng đồng thời Kaletra với sildenatil
Do ức chế CYP3A gây ra bởi (xem phần Chống chi đinh).Khuyến cảo không nên
lopinavir/ritonavir sử dụng Kaictra cùng với tadalafil
Sildenafil Sildenatil: Điểu tri rối loan cương dương:
AUC: t 11 lần Cần đặc biệt thận trọng khi kẻ dơn sildenafil hoặc
Do ức chế CYP3A gây ra bởi tadalafil cho bệnh nhân đang điểu trị bằng Kaletra.
lopinavir/ritonavir bao gồm việc tăng cường theo dõi những tảc dụng
không mong muốn như hạ huyết áp, ngất, rối loạn thị
giác vả cương cứng kéo dải (xem phần Cảnh báo và
thận trợng)
Khi sử dụng dồng thời vởi Kaletra, không sử dụng
1iểu sildenafil vượt quá 25 mg trong vòng 48 giờ vả
liếư tadalaf 1 vượt quá 10 mg trong vòng 72 giờ
Vardenafii Vardenaffl: Chỗng chỉ dịnh dùn d?…g thời vardenafl với
AUC: t 49 lần Kaietra (xem phần Ch ng chỉ định).
Do ức chế CYP3A gây ra bới Kaletra
Thuốc kháng HC V tác động trực tiép
' EIbasvir/grazoprevir
(50/200 mg QD)
Elbasvir: _
AUC: 12,71 lân
Cmax: 11,87 lân
cz4: 13,581ẩ11
Grazoprevir:
AUC: 111,86 1ần
Cmax: 16,311 lần
c24: t 20,70 lần
(kết hợp các cơ chế bao gổm ức chế
CYP3A)
Lopinavír: f-›
Kễt hợp sử dụng c1basvirlgraạoprcvir với Kaletra lả
chống chi dịnh (xem phân Chông chỉ định)
Ombitasvirlparitaprevir/ritonavir +
dasabuvir
(25/150/100mg QD + 400mg BID)
Lopinavir/ritonavir 400/100mg BID
Ombitasvir: 4—›
Pan'taprevir: `
AUC: T2,17 lân
Cmax: T2,04 lần`
Ctrough: 12,36 lân
m_c chế CYP3A/các chẩt vặn chuyền bâi
neo
Dasabuvir: <—›
Lopinavir: <-›
Ombitasvirlpmitaprevirl ritonavir
(251150/100mg QD)
Lopinavir/rỉtonavir
400/100mg BID
Ombitasvirz4-›
Paritaprevir:
AUC: T6.101ẩn
Cmax: T4. 76 lần
Ctrough: 112.33 lần
(ức chế CYP3AI cảc chất vận chuyền
bảỉ tiết)
Lopinavir: <-›
Sự kết hợp là chống chỉ định.
Lopinavir/ritonavir 800/200 mg QD dã dược tiêm
với ombitasvìr/paritaprevir ritonavir có hoặc không
có dasabuvir. Tảo dụng trên DAAs vả lopinavir cũng
tương tự như trường hợp đã thấy khi dùng
iidoconavir/ritonavir 400/100mg BID (xem phần
Chống chi đinh)
T huốc ửC chế HC V Protease
Boceprevir 800 mg. 3 lầnlngảy
Boceprcvir:
AUC: 1 45 %
C,…: 1 50 %
C…: 1 57 %
Lopinavir:
AUC: l 34 %
C…: 1 30 %
Cmủ: }, 43 %
Không khuyến cảo sử dụng đồng thời
Lopinavirlritonavir vả boceprevir
Simeprevỉr 200 mg dùng hảng ngảy
(ritonavir 100 mg 2 lằn/ngảy)
Simeprevir:
AUC: 1 7,21ần
Cmax: 1 4,7 lẩn
Cmin: 1 14,41ần
Không khuyến cáo sử dụng dồng thời Kaletra vả
simeprevir
Telaprevỉr 750mg, 3 lầnlngảy
Tealaprevir:
Không khuyến cáo sử dụng đồng thời
AUC: 1 54 % Lopinavir/ritonavir vả telaprevir
C…: 1 53 %
C……: 1 52 %
Lopinavir: H
Các chế phấm có nguồn gốc dược liệu
Cỏ St John wort Lopinavir: Không sử dụng đống thời các chế phầm nguồn gỗc
(Hypericum perforatum) Nồng độ có thế giảm do có St John’s dược liệu có chứa cò St John’s won với lopinavir vả
wort gây cảm ứng CYP3A ritonavir. Với những bệnh nhân dang sử dụng có St
John’s wort, ngừng ngay vỉệc dùng có St John’s wort
vả kiềm tra số phiên bán virus trong mảu nếu có thề.
Nồng độ liponavir vả ritonavir có thể tăng lên khi
ngừng sử dụng có St John’s wort. Vì vậy, cẩn hiệu
chinh liều cùa Kaletra. Tảc dụng cảm ứng cùa cớ St
John’s wort có thể kéo dâi trong ỉt nhẩt 2 tuần sau
khi ngùng sử dụng (xem phần Chống chỉ định). Do
ao, Kaletra bắt đẩu sử dụng an toản 2 tuần sau khi
ngimg dùng có St John’ wort.
Thuốc ức chê miên dịch
12
Lố'í .r. _ /~íỷl'zl_hỉl
tì,
ư
51
\“.ft
' Cyclosporin, Siroiimus (rapamycin) Cyciosporin, Sirolimus (rapamycin), Theo dõi thường xuyên nồng độ cùa các thuốc nảy
vả Tacrolimus Tacroiimus: trong huyết tương cho đến khi nồng độ dạt trạng thái
Nồng độ tăng do ức chế CYP3A gây ra ổn định.
bời Kaletra
Thuốc hạ Iípid máu
Lovastatin vả Simvastatin Lovastatin, Simvastatin: Nồng độ cùa các thuốc ức chế HMG—CoA reductase
Nồng độ tăng rõ rệt do ức chế CYP3A tăng lên có thể gây ra bệnh co bao gồm cả tiêu cơ
gây ra bới Kaletra vân. Vì vậy chống chi dịnh phối hợp các thuốc nảy
với Kaletra (xem phần Chống chỉ định).
Atorvastatin Atorvastatỉn: Không khuyên cáo sử dụng dỗng thời Kaletra với
AUC: T 5,91ần atorvastatin. Nẻu việc sử dụng atorvastatín lả thực sự
sz T 4,7 lẩn cần thiết thì phải dùng 1iều thấp nhắt có thể và kèm
Do ức chế CYP3A gây ra bới Kaletra theo sự theo dõi cẩn thặn tinh an toản (xem phần
Cảnh báo vả thặn trọng).
Rosuvastatin, 20 mg 1 lầnlngảy Rosuvastatin: Thân trọng và cân nhắc giảm liều khi sử dụng đồng
AUC: T 2 1ần thời Kaletra với rosuvastatin (xem phần Cảnh báo vả
sz T 5 lẩn thận trọng).
Trong khi rosuvastatin ít được chuyền
hớa qua CYP3A, sự tâng nồng độ tmng
máu của rosuvastatin đã được ghi nhận
Cơ chế cùa tương tảc nảy có thẻ lả do ức
chế protein vận chuyển
Fiuvastatin vả pravastatin Fluvastatin pravastatin: Nẻu cần điêu trị bằng thuôc ức chê HMG-CoA
Không xây ra tương tảc có ý nghĩa lâm reductase thì nên lựa chọn pravastatin vả 11uvastatin.
sảng.
vaastatin không chuyền hóa qua
CYP4SO
Fluvastatin ch1 chuyền hóa một phẩn
qua CYP2C9.
Thuốc giám đau opioia'
Buprenorphin 16 % 1Tân/ngảy Buprenorphin: <-› Không cân hiệu chinh liêu
Methadon Methadon: 1 Khuyến cáo nên theo dõi nồng dộ methadone trong
huyết tương
T huốc tránh thai đường uống
Ethinyl Oestradiol Ethinyi Oestradioi:l Trong trường hợp sử dụng đồng thời Kaletra với
thuốc trảnh thai có chứa ethinyl omtradio] (bất kỳ
cách thức trảnh thai nản: uống hay miếng dán 1ẽn da)
nên sử dụng thêm các biện phảỷ tránh thai khác.
Thuốc hô rrợ cai nghiện !huổc lá
Bupropion Buproprion vả chât chuyên hỏa có hoạt Trong tmờng hợp việc sử dụng đồng thời
tinh hydroxybupropion: lopinavirlritonavir với bupropion 1â không tránh
AUC vả C,… 1 ~50% được nên theo dõi hiệu quả diều trị của bupropion,
_ , không vượt quá liều khuyến cảo cho dù đã biệt đển
Tảc dụng nây có thẻ do cảm ứng chuyên hiện tượng cảm ứng thuốc ở trẻn.
hóa cùa bupropion
C ác thuốc giãn mạch
Bosentan Lopinavir— Ritonavir: , Cân trọng khi sử dụng Kaietra cùng với bosentan.
Nông độ lopinavirlritonavir huyêt tương Khi dùng Kaletra cùng bosentan, phải kiêm tra hiệu
có thẻ giảm do bosentan cảm ửng quả diều trị HIV, bệnh nhân phải được kiêm soát kỹ
CYP3A4. về độc tinh bosentan, đặc biệt trong tuần sử dụng
Bosentan: dẩn tiên.
AUC: T51ần
C……: T 61ần
Ban dầu. bosentan cmin 1 khoảng 48 lần,
do lopinavirlritonavir ức chê CYP3A4
Các thuốc khác
Dựa vâo thông tin hiện có về chuyên hóa của thuốc, tương tảc giữa Kaletra với dapson,trimethoprimIsulfamcthoxazol, azithromycin
hoặc t1uconazol không dược coi là có ý nghĩa lâm sảng.
PHỤ NỮ cớ THAI VÀ CHO CON BÚ
Phụ nữ có lhaỉ
Theo nguyên tắc, khi quyểt định sử dụng thuốc kháng retrovirus cho phụ nữ có thai bị nhiễm HIV do hạn chế nguy cơ lây
nhiễm HIV trực tiếp sang trẻ sơ sinh, các dữ lỉệu về sử dụng thuốc trên động vật cũng như kinh nghiệm lâm sảng trên phụ
nữ có thai cần được đưa vảo để mô tả tinh an toản cho thai nhi.
Lopinavirlritonavir đã được đánh giá trên bệnh nhân mang thai với số lượng lớn hơn 3000 người, trong đó có trên 1000
người ở giai đoạn ba tháng đâu thai kỳ.
Theo dõi hậu maketing thộng qua Dữ liệu đăng ký sử dụng thuốc kháng retrovirus ở phụ nữ có thai— được thảnh lập từ
thảng 01 năm 1989 cho thấy không có báo cảo nảo về sự tăng nguy cơ dị tật bấm sinh ở hơn 1000 phụ nữ sử dụng Kaletra
trong ba tháng đầu thai kỳ. Tỷ lệ dị tật bấm sinh sau khi sử dụng lopinavir ở bất kỳ giai đoạn thai kỳ nảo ngang bằng với
tỷ lệ dị tặt bẩm sinh quan sát được trong quần thể chung. Không có trường hợp dị tật bẳm sinh gợi ý nguyên nhân gây ra
bời thuốc. Nghiên cứu trên động vật cho thấy độc tinh trên sinh sản (xem phần Dữ Iíệu an toản tiền lâm sùng). Dựa vảo
.,ựÍ`
l
\,,1 .
những dữ liệu hạn chế đã mô tả ở trên, nguy cơ dị tặt không chắc chắn xảy ra trên người. Lopinavir có thế sử dụng cho phụ
nữ mang thai nếu cần thiết
Phụ nữ cho con bú
Nghiên cúu trên chuột cho thấy lopinavir được bải tiêt qua sữa. Hiện chưa rõ thuốc có bải tiết qua sữa mẹ hay không. Theo
nguyên tắc, người mẹ nhiễm HIV nên được khuyến táo không cho con bú dưới bất kỳ hình thức nảo để trảnh iây nhiễm
HIV.
Ảnh hưởng lên khá nảng sinh sản .
Nghiên cứu trên dộng vật cho thây thuôc không ảnh hướng đên khả năng sinh sản. Hiện không có dữ liệu nảo về ảnh
hướng của iopinavir/ritonavir trên khả năng sinh sản ở người.
ẨNH HƯỚNG LÊN KHẢ NĂNG LÁ] XE vÀ VẶN HÀNH MÁY MÓC
Chưa có nghiên cứu nảo về tác dụng đối với khả năng lải xe vả vận hảnh mảy móc được cõng bổ. Bộnh nhân nên được
thông báo về tảc dụng không mong muốn lả buồn nôn đã được báo cảo khi sử dụng Kaletra (xem phẩn Tác dụng không
mong muốn)
Dung dịch uống Kaletra chứa khoảng 42% alcohol.
TẢC DỤNG KHÔNG MONG MUÔN
Tỏm tắt hồ sơ về đó an toân
Tinh an toản cùa lopinavirlritonavia được đảnh giá trên hưn 2600 bệnh nhân trong cảc nghỉên cứu lâm sảng pha ll—1V,
trong đỏ có hớn 700 bệnh nhân sử dụng liều 800/200 mg ] lần mỗi ngảy (6 viên nang hoặc 4 viên nén). Cùng vợỉ cảc thuốc
ức chế enzym phiên mã ngược có nguôn gốc nucleosid (NRTIS), trong một số nghiên cửu lopinavirlritonavir được sư dụng
phối hợp với efavìrenz hoặc nevirapin.
Cảo phản ứng có hại thường gặp nhất liên quan đển liệu phảp lopinavir/ritonavir trong cảc thử nghiệm lâm sảng lả tỉẽu
chảy, buồn nôn, nôn, tăng triglycerid mảu vả tảng cholesterol mảu. Tiêu chảy, buồn nôn, nôn có thể xảy ra ở giai đoạn đầu
điều trị, trong khi tảng trig1yccrid máu vả tăng cholesterol máu có thể xảy ra muộn hơn. Có 7% số bệnh nhân đã phải
ngừng «… gia trước hạn cảc nghiên cứu pha 11-1v do xuất hiện các biến cố bất lợi cần phái điều trị.
Cần luu ý rằng một số trường hợp viêm tụy đã được báo cảo ở bệnh nhân đang sử dụng iopinavir/ritonavir, bao gồm cả
những bệnh nhân tăng ttiglycerid tiên triẽn. Hơn nữa, kéo dải khoảng PR cũng được báo cáo trong khi điêu trị với
lopinaviriritonavir (xem phân Cảnh báo và thận trọng).
Bảng nhân loai nhăn ứng có hai
Các phỏn ủng co' hại rừ thử nghiệm lâm sảng vả Iheo dõi hậu mãi ở bệnh nhân trưởng thảnh vả bệnh nhân nhi:
Nhũng biến có sau đây đã được xảo định là phản ứng có hại Tẩt cả cảc biến cổ từ múc độ trưng binh đến nặng đã được đưa
vảo đế tinh tần xuất, cho dù mối quan hệ nhân quả đã được đánh giá hay không. Các phản ứng có hại được trình bảy theo
nhớm cơ quan hệ thống. Trong mỗi nhóm, tác dụng không mong muốn được lỉệt kê theo thứ tự giảm dần của độ nghiêm
trọng: hay gặp (> 1/10), thường gặp (> 1/100 đến < 1/ 10), ít gặp (>111000 đến < 1’100) vả không rõ (không thể ước lượng
dược từ cảc dữ liệu sẵn có).
Các biến cố được ghi chú tần suất là “Không rõ” được xác định thông qua theo dõi hậu mãi.
Tác dụng không mong muốn ở nguời trướng thânh được ghi nhận trong cảc thử nghiệm lâm sâng và theo dõi hậu mãi
Nhỏm cơ quan hệ thổng Tẫn suất Phân ứng có hại
Nhiễm khuấn vả nhiễm ký sinh trùng Hay gặp Nhiễm khuẩn dường hô hẫp ua…
Thường gặp Nhiễm khuẩn đường hô hẳp dưới, nhiễm khuẩn da bao gổm viêm
mô tế bảo, viêm nang lõng vả nhọt
Rối loạn mảu vả hệ bạch huyễt Thướng gặp Thiếu mảu, giâm hạch cẫu, giảm bạch cầu trung tính, bệnh iympho
bạch huyết
Rối loạn hệ miễn dịch Thường gặp Phản ứng quá mẫn bẽO gổm mảy đay vả phù mạch
It gặp Hội chứng tải tạo miên dịch
Rối loạn nội tiẽt Ít gặp Giảm nảng tuyến sinh dục
Rôi loạn chưyên hớa vả dinh dưỡng Thường gặp Rối loạn đường huyết hao gồm cả đải thải đường, tăng triglycerid
_ máu, tảng cholcsterol ináu, giảm cân, gỉảm cám giảc ngon miệng
It gặp Tăng căn, tăng cảm giảc ngon miệng
Rối loạn tâm thân Thường gặp Lo ảu
Ít gặp Giấc mơ bất thường giảm ham muốn tình dục
Rôi loạn hệ thân kinh Thường gặp Đau đâu (bao gồm đau nứa đâu) bệnh thần kinh (bao gôm bệnh
. thần kinh ngoại vi), chớng mặt mất ngủ ,
lt gặp Tai biến mạch máu não, co giật loạn vị giản:, mât vị giải:, run
Rỗi loạn măt Ít gặp Giảm thị lực
Rối loạn tai và mê dạo Ít gặp Ủ tai. chớng mặt
Rối loạn tim Ỉt gặp Xơ vữa động mạch như nhôi mảu cơ tim, hlock nhĩ thắt, suy van ba
lá
Rối loạn mạch máu Thường gặp Tăng huyết ảp
Ít gặp Huvết khối tĩnh mạch sâu
14
’ Rôi ioạn đường iiêu hớa Hay gặp Tiêu chảy, buôn nôn
Thường gặp Viêm tụy, trảm ngược dạ dây thực quản viêm dạ đảv- ruột và viêm
đại trảng, nôn, đau bụng (trên vả dưới) căng phồng bụng khó tiêu,
Ít gặp bệnh trĩ, đầy hới
Xuất huyễt tiêu hớn bao gồm loét tiêu hóa, viêm tả tráng, viêm dạ
dảy vả xuất huyết trực trảng, viêm miệng và loét miệng, rối loạn đại
tiện, tảo bớn, khô miệng.
Rối loạn gan mật Ĩfhường gặp Viêm gan hao gôm tảng AST, ALT vả GGT
It gặp (Jan nhiễm mỡ, gan to, viêm đường mật, tảng bilirubin huyềt
Không rõ Vảng da
Rối loạn da và tổ chức dưới da Thường gặp Phải ban bao gồm ban sân, viêm da/ban bao gồm eczema và viêm
tíết bã nhờn, mồ hôi đêm, ngửa
Ỉt gặp Rụng tỏc, viêm mao mạch, viêm mạch
Không tỏ Hội chứng Stevens-Johnson, hồng ban đa dạng
Rối loạn cơ xương vả mô liẽn kêt Thường gặp Đau cot, đau bộ cơ xưưng bao gồm đau khớp vả đau lưng, rổi loạn
_ cơ như yểu cơ và co cứng cơ
It gặp Tiêu cơ vân, hoại từ xương
Rôi loạn thận vả dường tiết niệu ii gặp Giâm độ thanh thải creatinin, viêm thận, huyết niệu
Rôi loạn hệ sinh sản và tuyến vú Thường gặp Rôi loạn chức năng cương dương, rôi loạn kinh nguyệt — mẫt kinh,
rong kỉn g
Rôi loạn chung và tinh trạng của vị trí Thường gặp Mệt mỏi bao gồm suy nhược
đưa thuốc
' Xcm phân Cảnh báo và thận trọng: Viêm tụy và lipid
Mô tả môt số phản ứng có hai
Hội chứng Cushing đã được ghi nhận ở bệnh nhân sử dụng đồng thời ritonavir vả i1uticason pl’OpỉOtffltũ đường xông hit
hoặc xịt mũi; tác dụng mong tự cũng có thể xảy ra với cảc corticosteroid khác chuyển hóa qua con đường P450 3A như
budesonid (xem phần Cánh báo và thận trọng, Tương tác thuốc).
Tăng creatin phosphokinase (CPK), đau cơ, viêm cơ vả hiếm gặp hớn lả tiêu cơ vân đã được ghi nhận với các thuốc ức chế
protease, dậc biệt trong trường hợp sử dụng phối hợp với cảc thuốc ức chế enzym phiên mã ngược có nguồn gốc nucieosid.
Các thỏng sỏ chuyên hóa
Trọng lượng cơ thể vả nồng độ lipid vả glucose huyêt có thể tăng ttong quá trình điều trị thuốc kháng vius (xem phần Cánh
báo vả Thận irọng).
Bệnh nhân nhiễm HIV bị suy giảm miễn dịch nặng có thể tăng phẩm ứng viêm đối với cảc nhiễm trùng cơ hội không triệu
chửng hoặc các nhiễm trùng cìơ hội còn sót lại khi bắt đầu điều trị với liệu pháp phối hợp các thuốc 1gháng retrovirus
(CART). Cũng dã có bảo cảo vẽ các rôi loạn tự miễnđịch (như bệnh Graves) xảy ra, tuy nhiên, thời gian băt đầu khảo nhau,
và có thể xảy ra nhiễu thảng sau thời diềm bắt đầu điêu trị (xem phần Cảnh báo vã thận !rọng).
Một số trường hợp hoại từ xương đã được báo cáo, đậc biệt ở bệnh nhân có những yếu tố nguy cơ đã biểt, nhiễm HIV tiến
triền hoặc thời gian điều trị bằng liệu pháp phối hợp thuốc kháng retrovitus (CART) kéo dải. Tần suất của tảc dụng không
mong muốn nảy vẫn chưa được rõ (xem phần Cảnh báo vả thận trọng).
Trẻ em
Trẻ cm từ 14 ngảy tuổi trở lên, tính an toản tướng tự như dã quan sảt được trên người lớn (xem bảng trên).
Báo cáo tác dung không mong muỗn:
Việc báo cảo tác dụng không mong muốn sau khi thuốc được hiu hảnh là quan trọng, giúp tiếp tục theo dõi cán cân lợi
ích/nguy cơ khi sử dụng` thuốc Nhân viên y tế cần bảo cảo bắt kỳ tảc dụng không mong muôn nảo của thuốc theo hệ thống
bảo cảo của quốc gia.
QUÁ LIÊU
Cho đến nay, dữ liệu về quá liều Kaletra cắp tinh ở người còn hạn chế.
Đã có báo cảo về quá liều dung dịch uống Kaletra (kể cả bảo cảo tử vong). Cảo triệu chứng sau đây đã được báo cáo khi vô
tình sử dụng quá liều ở trẻ sinh non, biok nhĩ thất toản bộ, bệnh tim không rõ nguyên nhân, nhiễm acid lactic vả sny thận
câp
Những triệu chửng iâm sảng đã được ghi nhận trên chớ bao gồm tảng tiết nước bọt, nôn và tiêu chảy/phân bất thường. Các
dấu hiệu ngộ độc dã dược ghi nhận trên chuột nhắt chuột cống và chó bao gổm giảm hoạt động, mât điểu hòa, gây mòn,
mất nước và run
Không có thuốc giải dộc dặc hiệu cho trường hợp quá liều Kaietra. Nên xử trí quả 1iều Kaletra bằng cảc biện pháp hỗ trợ
chung bao gồm theo dõi dấu hiệu sinh tồn và tình trạng iâm sảng của hệnh nhân. Khi có chỉ định cần loại bỏ lượng thuốc
chưa hẫp thu qua niêm mạc ruột bằng cảch gây nôn hoặc rửa dạ dảy. Sử dụng than hoạt cũng có thể giúp loại bỏ phần
thuốc chưa dược hấp thu Kaietra găn mạnh với protein vì vậy thấm tích có thế không hiệu quả trong việc loại bỏ đáng kể
thảnh phần có hoạt tính.
Tuy nhiên, thắm tich có thể loại bỏ cả aicohol vả propylene glycol trong trường hợp dùng quá. liễu Kaletra dung dịch uống.
CÁC ĐẶC TÍNH DƯỢC LÝ
DƯỢC LỰC HỌC
Nhóm trị liệu: Thuốc kháng virus đường dùng toản thân, ức chế protcasc, điều trị nhìễm HIV, dạng thuốc phối hợp, mã
15
JM)“
ATC: JOSARIO
Cơ chế tác dung: Hoạt chất kháng virus cùa Kaletra lả lopinavir. Lopinavir là chất ức chế cnzym protease cùa virus HlV-1
vả HIV-2. Sự ức chế protease cùa HIV ngản cản thùy phân gag-po! polyprotein dẫn đểu hình thảnh ra các virus không hoản
chỉnh và không lây nhiễm.
Ảnh hướng trên điên tâm đồ: Ánh hướng của thuốc iên khoảng QTcF được đánh giá trong một nghiên cứu ngẫu nhỉên,
có kiểm soát, chéo đôi, dùng đối chứng placebo vả moxifioxacin 400 mg ] 1ẩn mỗi ngây, tiến hảnh trên 39 người tinh
nguyện khỏe mạnh với 10 lần ghi đíện tâm đồ trong vòng 12 gìờ vảo ngảy thứ 3. Giá trị tmng binh khảc biệt (khoảng tin
cậy 95%) cùa khoảng QTcF so với placebo là 3,6 (6,3) với liều 400/100 mg 2 lần mỗi ngảy vả 13,1 (15,8) với liều lớn hơn
liều điều trị 800/200 mg 2 lần mỗi ngảy. Liponavir/ritonavir liều cao (800/200 mg 2 lần mỗi ngảy) lảm kéo dải khoáng
QRS từ 6 milỉ giây lên 9,5 mili giây góp phần kéo dải khoảng QT. Giá trị khoảng QTcF ghi nhận được trong ngảy thứ 3
tương ứng với 2 chế độ liều trên cao hơn gấp khoảng 1,5 lần và 3 1ần so với liều khuyến cảo của liponavirlritonavir sử
dụng 1 1ần mỗi ngảy hoặc 2 lần mỗi ngảy ở trạng thải cân bằng. Không bệnh nhân nảo có mức tăng QTcF 2 60 mi1ì giây so
với giá trị nền hoặc khoảng QTcF vượt quá ngưỡng có thể gây biều hiện trên lâm sảng là 500 mili giây.
Cùng trong nghiên cứu nảy, sự tăng nhẹ khoảng PR cũng dược ghi nhận ở các bệnh nhân dùng Iiponavir/ritonavir vảo ngảy
thứ 3. Mức thay đổi tmng bình so với giá trị nền cùa khoảng PR nằm trong khoảng 1 1,6 đểu 24,4 mili giây được ghi nhận
trong vòng 12 giờ sau khi dùng thuốc. Khoảng PR tổi đa ghi nhận được là 286 mili giây và không ghi nhận được tmờng
hợp nảo có giá trị hâng giây trong hay block tim độ 2 hoặc độ 3 nảo (xem phần Cănh băo vả thận trọng).
Hoat tính khảng virus trên in vitro: Hoạt tính kháng virus trên ín vitro cùa lopinavir với chủng HIV phòng thí nghiệm và
phân 1ập từ lâm sảng đã được đánh giá tương ửng trên các dòng nguyên bảo lympho và các tế bảo lympho mảu ngoại biên
gây nhiễm. Trong trường hợp không có mặt huyết thanh người, ICso trung bình của lopinavir với 5 chủng HIV—l phòng thí
nghiệm là 19 nM. Trong trường hợp không có mặt và có 50% huyết thanh người thì giá trị leo trung bình của lopìnavir với
chủng HIV~lmB trên dòng tế bảo MT4 tương ứng lả 17 nM và 102 nM. ớ trường hợp không có mặt huyết thanh người, giá
trị ECso trung bình của liponavir với một số chủng HIV-l được phân lập từ lâm sảng lả 6,5 nM.
Khảnz thuốc
Chọn lọc khủng thuốc trên … vỉtro
Một sô chủng phân lập HIV- 1 giảm nhạy cảm với lopinavir đã được chọn lọc trên in vitro. HIV- 1 được nuôi cấy trong môi
trường có chứa lopinavir đơn độc và chứa liponavir kết hợp ritonavir ở các tỷ lệ nồng độ tương ứng với khoảng nồng độ
được ghi nhận trong quá trình đíều trị bằng Lopinavir/ritonavir. Phân tích kỉễu gen và kiểu hình các virus được chọn lọc
trong môi trường nảy cho thấy sự có mặt của ritonavir, với các nồng độ thù không ảnh hướng đến việc chọn lọc virus
kháng lopinavir. Nhìn chung, phân tích đặc điềm kiểu hình để khảng chèo trên in vitro giữa lopinavir và các thuốc ức chế
protease khảc cho thấy sự giảm nhạy cảm với lopinavir có mối tương quan chặt chẽ với sự giảm nhạy cảm với ritonavir vả
indinavir, nhưng không có mối tương quan chặt chẽ nảo với sự giảm nhạy cảm với amprenavir, saquinavir vả nelfinavir.
Phân tích kháng thuốc ở bệnh nhân chưa điều trị thuốc ARV
Trong các nghiên cứu lâm sảng với số lượng hạn chế chủng phân lập được lựa chọn để khảng lopinavir chưa được ghi
nhặn ở bệnh nhân mới không có kháng ức chế protease ở mức nên. Xem thêm thông tin chi tiết trong các thử nghíệm lâm
sâng.
Phân tlch kháng thuốc ở bệnh nhân đã đỉều trị thuốc ửc chế protease
Chọn lọc đề kháng với lopinavir ở bệnh nhân bị thất bại với phảc đồ điều trị bằng thuốc ức chế protease trước đó được mô
tả bằng phân tích dọc các chùng phân lập được từ 19 bệnh nhận đã điều trị với thuốc ức chế protease trong 2 nghỉên cửu
pha I] và một nghiên cứu pha III, đối tượng nghiên cứu bao gồm những bệnh nhân không ức chế được hoản toản sự phải
triển của virus hoặc có sự tăng số lượng virus bùng phát lại sau khi đã có đảp ứng ban đầu với thuốc và những bệnh nhân
có tăng kháng thuốc trên in vitro giữa mửc nen và mức xuất hiện lại (được định nghĩa là sự xuất hiện đột biến mới hoặc
thay đổi 2 lằn nhạy cảm kiều hình với iopinavir). Sự khảng thuốc tăng lên phổ biến nhất ở bệnh nhân mà chủng phân lập
nền đã có một số dột biến khác liên quan đến cảc thuốc ức chế protease, nhưng mức độ nhạy cảm với lopinavir < 40 lằn so
với mức nền. Những đột biến thường gặp nhất là V82A, 154V vả M461. Các đột biến L33F, 150V vả V321 phối hợp với
I47V/A cũng đã được ghi nhận. 19 chùng phân lập có le0 tăng 4,3 lần so vởi các chùng phân lập nến (từ 6,2 đến 43 lần so
với virus hoang dại).
Kiểu gen liên quan đến kiều hình giảm nhạy cảm với lolinavir ở những virus được chọn lọc bởi các thuốc ức chế protease
khảo. Hoạt tính kháng virus trên in vitro cùa lopìnavir trên đã được đánh giá trên ] 12 chủng phân lập từ cảc bệnh nhân đã
được đánh giá thất bại điều trị với một hoặc nhiều thuốc ức chế protease. Trong phạm vi các chùng nảy, cảc dột biến trên
HIV protease liên quan đến giảm nhạy cảm với lopinavir trên ín vitro lả: LlOF/I/R/V, K2OM/R, L241, M461/L, F53L,
IS4L/TIV, L63P, A711/L/T/V, V82AlF/T , 184V vả L9OM. Giá trị ECso trung bình của lopìnavir với cảc chủng phân lập đột
biến ở các vi tri acid amin 0—3, 4—5, 6-7, và 8—10 trên amino acid tuong ứng cao hơn gắp 0,8; 2,7; 13,5 vả 44,0 lần so với
ECso cùa chùng HIV hoang dại. Trên 16 virus có sự thay đổi lớn hơn 20 lần đều chứa các đột biển ở cảc vị trí 10, 54, 63
cộng 82 vảfhoặc 84. Ngoài ra, chủng còn chứa trung bỉnh khoáng 3 đột biến tại các vị trí acid amin số 20, 24, 46, 53, 71 vả
90. Ngoài các đột bỉến dược mô tả ở trên, đột biến V321 vả 147A đã dược ghi nhận ở cảc chủng xuất hiện lại có giảm nhạy
cảm với lopinavir ở bệnh nhân đã sử dụng thuốc ức chế protease đang sử dụng lopinavir/ritonavir. Cảc đột biến 147A,
L76V đã được ghi nhận ở cảc chùng xuất hiện lại giảm nhạy cảm với lopinavir ở bệnh nhân đang sử dụng
lopinavir/ritonavir.
Kết luận liên quan đến ý nghĩa cùa các đột biến riêng biệt hoặc các đột biến chung có thể thay đổi với các dữ liệu bổ sung
do đó nên tham khảo các hệ thống phân tích hiện tại kiểm tra kháng thuốc.
Hoạt tính khảng virus của !opinavỉr/ritonavir ở những bệnh nhân đã !lzẩ! bại điều trị với Ilmỗc ửc chế prolease
Ý nghĩa lâm sảng cùa sự giảm nhạy cảm với lopinavir trên in viiro được đánh giá thộng qua đảp ứng virus với liệu phảp
lopỉnavir/ritonavir so với giá trị nên kiểu gen và kiếu hình virus ở 56 bệnh nhân đã thất bại đỉều trị vởi nhiều thuốc ức chế
protease trước đó. Giá trị ECso của lopinavir với 56 chủng virus phân lập nền cao hơn từ 0, 6 đến 96 lần giá trị EC… với
16
chủng HĨV hoang dại Sau 48 tuần điêu trị với lopinavir/ritonavir, efavirenz vả cảc thuốc úc chế enzym phiên mã ngược có
nguôn gốc nucleosid, tải lưọng ARN cúa virus HIV < 400 phiên bánlml đã được ghi nhận 93% (25. 27) 73% (1 1'15) và
25% (218) số bệnh nhân có sự giảm nhạy cảm vởi lopinavir so với giá trị nền tương ứng < 10 lần, từ 10 đểu 40 lằn và 40
lần. Ngoài ra, đáp ứng vìrus đã được ghi nhận ở 91% (21123), 71% (15121) và 33% (2l6) bệnh nhân có 0- 5, 6—7 và 8- 10 đột
biến trôn HTV protease liên quan đến giảm nhạy cảm vởi lopinavir trên in vilro. Do những bệnh nhân không phơi nhiễm
với Kaletra hoặc efavirenz trước đó, một phần đáp ủng có thể do hoạt tinh kháng virus của cí'avircnz, đặc biệt ở bệnh nhân
mang virus có đề khảng cao với ỈOpỈHEIVỈI'. Nghiên cứu nảy không có nhóm bệnh nhân đối chửng không sử dụng
Iopinavirlritonavir.
Kháng chéo
Hoạt tính của cảc thuốc ức chế protcasc với cảc chùng phân lặp có sự tăng đề kháng với lopinavir sau khi điều trị
lt›pinavỉrlritonavir ở bệnh nhân đã từng sử dụng thuốc ức chế proteasc: Sự có mặt cúa hiện tượng kháng chéo với cảc thuốc
ức chế protease khác dã được phân tích trên 18 chùng phân lập xuất hiện 1ại cho thẳy có sự tiến triển của đề kháng
Iopinavir trong 3 nghiên cứu pha II và 1 nghiên cứu pha III của lopinavirfritonavir trên bệnh nhân đã từng sử dụng thuốc ửc
chế protcasc. Giá trị ICsn trung bình cùa lopinavir với 18 chùng phân lập nên vả xuất hiện 1ại tướng ứng gắp 6, 9 vả 63 lẳn
so với chủng HIV hoang dại. Nhìn chung, các chùng phân lặp xuất hiện lại đều lưu giữ được (nếu kháng chéo ớ mức nển)
hoặc phát triến khảng chéo đáng kể với indinavir, saquinavir vả atazanavir. Giảm nhẹ sinh hoạt tính cùa amprenavir giảm
nhẹ đã được ghi nhận với giá tri IC… trung bình tăng từ 3 ,7 đến 8 lần tương ứng vớ1 các chứng nền và chùng xuât hiện lại
Nhưng chùng phân Iập còn nhạy cảm với tipranavir tăng giá trị ICsn tmng bình lương ứng 1,9 và 1 ,8 lần với các chủng nền
và chủng xuất hiện lại so với chùng virus hoang dại. Nên tham khảo tóm tắt đặc tinh sản phấm cùa Aptivưs để bổ sung
thêm thông tin sử dụng tipranavir bao gồm các yếu tố kiều hình dự đoản đáp ứng trong điều trị HIV- 1 đã kháng lại
lopỉnavir.
Kết auả nehiên cứu lâm sản
'1ảc dụng của lopinavir/ritonavir (phối hợp với các thuốc kháng rctrovirus khác) lên cảc chẳt chỉ điềm sinh học (hảm lượng
ARN của virus HIV trong huyết tương và số lượng tế bảo T CD4+) đã được đảnh giả trong các nghiên cứu đối chứng có
kiểm soát có sử dụng Iopinavir/ritonavir trong khoảng thời gian từ 48 đến 360 tuần.
Sử dung thuốc cho ngu ời lớn
Vơi bệnh nhân chưa từng điều trị thuốc kháng virus
Nghiên cứu M98- 863 có phân nhóm ngẫu nhìên, mù đôi tiến hảnh trên 653 bệnh nhân chưa từng điều trị thuốc khang virus
được sử dụng lopinavir/rotỉnavir (4001 100 mg 2 tần mỗi ngảy) được so sảnh vởỉ nelfinavỉr (750 mg 3 lần môi ngảy),
stavudin vả 1amivudin Số lượng tế bảo T CD4+ trung, bình ở múc nến là 259 tế bảofmtn3 (dao động từ 2 dến 949 tể
bảofmm ) vả hảm lượng ARN của vưus HIV- ] ở mức nển lả 4, 9 log… phiên bảníml (dao dộng từ 2,6 đển 6, 8 lognJ phiên
bân/ml).
Bảng 1
Kết quả ở tuần thứ 48: Nghiên củu M98-863
Lofflnavir/ritonavir Nelfìnavir
(N=326) (N=327)
Hảm lượng ARN cùa HIV < 400 phiên bảnlml* 75% 63%
Hảm lượng ARN cùa HIV < 50 phiên bản/ml*i 67% 52%
Sô lượng tế bảo T CD44 tmng binh tăng so với nên (tê 207 195
bảo/mm’)
*Trong đó, nhũng bệnh nhân thiểu kẽt quả xét nghìệrn được coi là thât bại về mặt virus học.
†p<0,001
1 13 bệnh nhân điều trị bằng nelfinavir và 74 bệnh nhân điều trị bầng lopỉnavirlrítonavir có hảm lượng ARN của HIV trên
400 phiên bảnlml trong khoảng thời gían điều trị từ tuần 24 đến tuần 96. Trong số đó, các chủng phân lập từ 96 bệnh nhân
diếu ni vởi nelfinavir và 51 bệnh nhân điều trị lopinavir/ritonavir có mẻ được khuyếch đại để đánh giá khảng thuốc. Kháng
nelfinavìr dược định nghĩa bởi sự có mặt của gen đột biến D3ON hoặc L9OM đă được ghi nhận ở 41f96 bệnh nhân (43%).
Khảng lopinavir dược dịnh nghĩ bới sự có mặt của bất kỳ đột bỉến ở vị trí khới đầu hoặc ở vị trí hoạt động trên protease
(xcm phần trên) đã được ghi nhặn 01'50 bệnh nhân (0%). Sự vắng mặt cùa virus kháng lopinavir đã được xảc nhận qua phân
tích kiêu hình.
Sự duy trì đáp ứng virus với Iopinavir/ritobavir (phối hợp với thuốc ức chế enzym phiên mã ngược có nguồn gốc
nucleosid/nucleotid) cũng đã được ghi nhận trong ] nghiên cứu nhỏ 61 pha 11 (M97-720) tmng suốt 360 tuần điều trị.
Nghìên cứu gồm 100 bệnh nhân được bắt dầu diều trị với lopinavirlritonavir (bao gồm 51 bộnh nhăn sử dụng liều 400/100
mg 2 lần mỗi ngảy và 49 bệnh nhân sử dụng liều 200/100 mg 2 lần mỗi ngảy hoặc 400/200 mg 2 lần mỗi ngảy) Tất cả
bệnh nhân dược công khai đồi liều lopinavỉr/ritonavir ở mức iiều 400/100 mg 2 lần mỗi ngảy vảo khoảng giữa tuần 48 và
tuần 72 Có 39 bệnh nhân (39%) không tìếp tục nghiên cứu, trong đó 16 bệnh nhân (16%) đừng đỉều trị do gặp cảc biển cố
bất lợi, một bệnh nhân trong sô đó đã tử vong. 61 bệnh nhân hoản thảnh nghiên cứu (35 bệnh nhân sử dụng liều khuyến
cảo 400/100 mg 2 Iần môi ngùy trong suốt quá trình nghiên cứu).
Bâng 2
Kết quả ở tuẫn 360: Nghiên cứu M97-720
Lopinavir/rỉtonavir
(N=100)
Hảm lượng ARN của HIV < 400 phìẽn bản/ml 61%
Hảm lượng ARN cùa HIV < 50 phiên bản/ml 59%
Mức tăng tmng bình của số lượng tế bảo T CD4+ so với nền (tế bảo/mm3) 501
Sau 360 tuần phân tích kiêu gen cùa các chùng vìrus phân lập đã được tiên hảnh ở 19 trong 28 bệnh nhân được xác nhận
có hảm lượng ARN cùa H1V trên 400 phỉên bản/ml cho thẳy không có đột biến ở vị trí khởi đầu hay ở vị trí hoạt động trên
protease (amino acid ở các vị trí 8, 30, 32,46, 47,48, 50, 82, 84 và 90) hoặc sự khảng thế hiện trên kiểu hinh cùa thuốc ức
chế protease.
Bệnh nhũn đã đỉểu trị thuốc khảng retrovirus trước đó
Nghỉên cứu M97—765 là thử nghiệm ngẫu nhiên, mù đôi, đánh giá điều trị bằng Kaletra ở hai mức 1iều (400/100 mg 2
lần/ngảy vả 400/200 mg 2 lầnfngảy) + nevirapine (200 mg 2 1ần/ngảy) + 2 NRTIs ở 70 bệnh nhân đã dùng một ức chế
protcase và chưa dùng ức chế cnzym sao chép ngược non- -nucleosid (NNRTI) Số lượng CD4 trung bình trước điều trị lả
349 tế bảolmm3 (dao động từ 72— 807 tế bảo/mm3) và số lượng HIV- 1 RNA trong huyết tương trung bình trước điều trị lả
4.0 log… bản sao/mL (dao động từ 2 9- 5. 8 log… bản saolmL).
Báng 3
Kết quả ở tuần thứ 24: Nghiên cứu M97-765
Kaletra 400/100 mg
(N=36)
Hảm lượng ARN cùa HIV < 4110 phiên bản/ml (ITT)* 75%
Hảm lượng ARN cùa 111v < so phiên bản/ml (11~n* 58%
Sô lượng tê bảo T CD4+ trung bình tăng so với nền (tê bảo/mmĩ) 174
*Trong đó, những bệnh nhân thiếu kết quả xét nghiệm được coi lả thốt bại về mặt virus học.
Nghiên cứu M98- 957 lả nghiên cứu ngẫu nhiên, nhãn mớ, đảnh gỉá điểu trị bằng Kaletra ở hai mức liều (400/100mg, 2 lần/
ngảy vả 533/133mg, 2 lẩn/ngảy) + efavirenz (600mg, [ 1ần/ngảy) + NRTIs trên 57 bệnh nhân đã sử dụng nhiều ức chế
protease và chưa dùng ức chế enzym sao chép ngược non- nucleosid (NNRTI). Giữa tuần 24 và tuần 48, bệnh nhân đang
dùng liều 400/100mg được chuyền sang liều 533/133mg. Số lượng CD4 trung bình trước điểu trị là 220 tế bảo/mm3 (dao
động từ 13- 1030 tế bảo/mm3)
Bảng 4
Kết quả ở tuần thứ 48: Nghiên cửu M98-957
Kaletra 400/100 mg
(N=57)
Hậm lượng ARN cùa HIV < 400 phiến bản/ml * , 65%
Sô lượng tế bảo T CD4+ trung bình tăng so với nên (tê bảo/mm’) 94
*Trong đó, những bệnh nhân thiểu kết quả xét nghiệm được coi là thất bại về mặt virus học.
Sử dụng thuốc cho bệnh nhân nhi
Một nghiên cứu mở M98- 940 về dạng bảo chế lỏng của lopinavir/ritonavir tiến hảnh trên 100 bệnh nhi trong đó có 44%
bệnh nhi chưa điều trị với thuốc khảng retrovirus và 56% bệnh nhi đã diếu trị với thuốc kháng retrovirus. Tất cả cảc bênh
nhân đều chưa từng sử dụng thuốc ức chế enzym phiên mã ngược không có nguồn gốc nucleosid (NNRTIs) Bệnh nhân
được lựa chọn ngẫu nghiên vảo 1 trong 2 nhóm sử dụng liếư 230 mg lopinavir/ 57,5 mg ritonavir trên 1 m2 diện tich bề mặt
cơ thế và nhóm sử dụng liều 300 mg lopinavir/7S mg ritonavir trên 1 m2 diện tích bề mặt cơ thề. Những bệnh nhân chưa
điều trị với thuốc kháng retrovirus được sử dụng thuốc ức chế enzym phiên mã ngược nguồn gốc nucleosid (NRTIs). Còn
những bệnh nhân đã từng điều trị vởi thuốc kháng virus thì được sử dụng nevirapìn kểt hợp với 2 thuốc ức chế enzym
phiên mã ngược nguồn gốc nucleosid. Tỉnh an toản, hiệu quả vả các đặc tinh dược động học cùa hai chế độ liếư được đánh
giả sau 3 tuần điều trị ở mỗi bệnh nhân. Sau đó, tất cả các bệnh nhân được tiếp tục sử dụng liều 300/75 mg trên 1 m² diện
tích bề mặt cơ thề. Độ tuổi trung bình của bệnh nhân lả 5 tuổi (dao động từ 6 tháng đển 12 tuổi), trong đó 14 bệnh nhân
dưới 2 tuổi và 6 bệnh nhân nhỏ hơn hoặc bằng 1 tuổi. sớ lượng tế bảo T CD4+ trung bình ở mức nền là 838 tế bao/mm² vả
hảm lượng ARN cùa HIV-l trung bình ở mức nền là 4,7 log… phiên bản/ml.
Bảng 5
Kết quả nghiên cửu M98-940 ở tuần 48
Bệnh nhân chua từng điều trị với Bệnh nhân đã được điều trị
thuốc kháng retrovirus trưởc đó vói thuốc khảng retrovirus
(N=44) (N=56)
Hảm lượng ARN của HIV < 400 phiên 84% 75%
bản/ml , _
Mức tăng trung binh cùa sô lượng tê bảo T 404 284
CD4+ so với nên (tê bảo/mm²)
Nghiên cứu P1030 là một nghiên cứu nhãn mớ, dùng liếư để đánh giá chỉ số dược động học, khả năng dung nạp, tính an
toản và hiệu quả của đung dịch uống Kaletra ở liều 300 mg lopinvair/7S mg ritonavir mỗi m2 ngảy hai lần kèm 2 NRTIs ở
trẻ từ 14 ngảy đến dưới 6 tháng tuối bị nhiễm HIV-l. ò cảc đối tượng đầu vảo, ha… lượng ARN cùa HIV-l lả 6,0 (dao
động từ 4,7-7,2) log… bản sao/ml vả số lượng phần trăm tế bảo CD4+T lả 41 (dao động từ 16-59).
Báng 6
Kết quả ở tuân 24: nghiên cửu P 1030
18
Tuổi: 214 ngảy đến < 6 tuần Tuổi: 26 tuân đến < 6 tháng
(N=IO) (N=21)
Hảm lượng ARN cùa HIV < 400 bản 70% 48%
saolml*
Mức thay đổi của số lượng tế bảo T -1%(95% c1: -10, 18) +4%(95%C11—1,9)
CD4+ so với nến (tế bảo/mmz) (n=6) (n= 19)
* Ti 1ệ các đổi tượng có H1V—l < 400 bản sao/ml và vẫn tiễp tục nghiên cửu.
Nghiên cứu P1060 là một thử nghiệm đối chửng ngẫu nhiên với liệu pháp điều trị bằng nevirpine so với lopinvairlritonavir
ở những đối tượng từ 2 đến 36 tháng tuổi bị nhiễm HIV—l, đối tượng phơi nhỉễm với nevirapine (Nhóm » vả không (Nhóm
11) trong thời kỳ mang thai đề phòng ngừa lây từ mẹ sang con.
Lopinavir/ritonavir được dùng mỗi ngảy ở liều lượng 16/4 mg/kg đối với trẻ 2 đến < 6 thảng, 1273 mg/kg đối với trẻ > 6
tháng và < 15 kg, 10/2.5 mg/kg ở trẻ › 6 thảng vả › 15 kg đến ~: 40 kg hoặc 400/100 mg cho các đối tượng 2 40 kg. Phảc
đồ dựa trên nevirapine lả 160—200 ngm² mỗi ngây trong 14 ngảy, sau đó 160—200 mg/m² mỗi 12 giờ. Cả hai nhóm điều trị
bao gồm zidovudine 180 mg/m² mỗi 12 giờ vả lamivudine 4 mg/kg mỗi 12 giờ. Theo dõi 48 tuần ớ Nhóm 1 và 72 tuần ớ
Nhóm 11. Ở cảc đối tượng đầu vảo, độ tuối trung bình là 0,7 năm, lượng tế bảo CD4T là 1147 tổ bảo/mmẵ tương đương
19% và hảm lượng ARN của HIV-l lả > 750,000 bản saolml. Trong số 13 bệnh nhân bị suy giảm khả năng kháng virus,
không tìm thấy sự kháng lopinavir/ritonavir ương dữ liệu kháng thuốc.
Bảng 7
Kết quả tuần 24: Nghiên cứu P1060
Nhóm 1 Nhóm II
lopinavir/ritonavir nevirapine lopinavir/ritonavir nevirapine
(N=82) m=sz› (N=140) (N=147)
Thất bại về mặt vius 21,7% 39,6% 19,3% 40,8%
hợc*
* Xác định băng hảm lượng ARN cùzi HlV-l'trong huyết tương > 400 bặn sao/ml ở tuấn 24 hoặc sự hôi phục của virus >
4000 bản sao/ml sau__tuân 24, T1 lệ thât bại kêt hợp gíữa các liệu pháp điêu trị khảc nhau giữa các độ tuôi xác định bời đó
đúng ước tính với môi lửa tuôi, p=0,015 (Nhóm 1), p< 0,001 (Nhóm II).
Nghiên cứu CHER 18 một nghiến cứu ngẫu nhiên,, nhăn mớ, so sánh 3 chiến lược điều trị (điều trị muộn, đíều trị sớm trong
40 tuần, hoảc điều trị sớm trong 96 tuần) 6 trẻ bị nhiễm 111v-1 thời kỳ chu sinh. Liệu pháp điều trị là zidovudine -r
lamivudine + 300 mg lopinavir/7S mg ritonavir/m2 ngảy hai lần tới 6 tháng tuổi; sau đó 230 mg Iopinavir/S7,S mg
ritonavirlm2 ngảy hai lần. Không có báo cáo nảo về việc thẩt bại do liệu pháp điều n-ị hạn chế độc tính.
Báng 8
Tỷ lệ nguy hiếm đối với tử vong hoặc thắt bại điều trị của iiệu phảp đầu tiên liến quan đểu đíếu trị muộn ART: Nghiên cứu Ể
CHER
Tuần 40 (N=13) Tuần 96 (N=13)
Tỷ lệ nguy hiểm đổi với tử vong hoặc 0,139 0,332
thất bại điếu tnị*
* Thẩt bại điếu trị được xác định là thầt bại về lâm sảng, về tiến triến miến dịch học, vẽ virus học hoặc kềt quá hạn chế độc
tính ART. ` _
p=0,0005 (tuân 40); p<0,0008 (tuân 96)
DƯỢC ĐỘNG HỌC
Các đặc tính dược dộng học của lopinavir phối hợp với ritonavir được đánh giá trên người tình nguyện khóe mạnh và trên
bệnh nhân bị nhiễm HIV, không có sự khác biệt đảng kế dược ghi nhận giữa hai nhóm nây. Lopinavir được chuyền hóa
chủ yếu hoản toản qua CYP3A. Ritonavir ửc chế quá trình chuyến hóa của iopinavir, do đó lảm tăng nồng độ của lopínavir
trong huyết tương. Các nghiên cứu cho thấy, điều trị bảng Kaletra 400/100 mg 2 lần mỗi ngảy tạo nồng độ lopinavir ở
trạng thải cân bằng trong huyết tương cao hơn gắp 15 đến 20 lần nồng độ của ritonavir ở bệnh nhân bị nhiễm HIV. Nồng
độ ritonavir ít hơn 7% so với nông độ thu được sau khi dùng ritonavir liều 600 mg 2 lần mỗi ngảy Nghiên cứu kháng virus
trên in vitro cho thấy giá trị ECso của lopínavư thấp hơn gần 10 lần so với ritonavir. Do đó hoạt tính kháng virus cùa
Kaletra là do lopinavir
Hẩg 11…
Dùng đa liểu 400/100 mg lopinavỉr/ritonavir 2 lần mỗi ngảy trong 2 tuần với điều kiện không hạn chế về chế độ ăn cho
thẳy nồng độ đinh của lopinavir trong huyết tương (C.…) (giá trị tmng bình i SD) là 12,3 i 5,4 ụng, xuất hiện khoảng 4
giờ sau khi dùng thuốc. Nổng độ đáy ở trạng thải on định thu được trước khi sử dụng liều buối sảng là 8,1 i 5, 7 ụg/m1.Giả
trị AUC cùa lopinavir với khoảng cách liền là 12 giờ đạt trung bình là 113,2 :t 60,5 ụg'hlml. Sinh khả dụng tuyệt đối cùa
lopinavir khi phối hợp với ritonavir chưa được thiết lập trên người.
Ành hưởng của thửc ăn lên sự hấp thu khi dùng đường uống
Kaletra dạng viên nang mềm vả dung dịch uông có tính tương đương sinh học trong những điều kiện không ăn kiêng (thức
ăn có lượng chất béo vừa phải). Dùng Kaletra viên nang mêm liếư duy nhẳt 400/100 mg với chế độ ăn chắt béo vừa phải
(500- 682 kcal, 22 7-25. 1% từ chất béo) lảm tăng AUC vả Cmu của Iopinavir lên trung binh 48% vả 23% khi so sánh với
chế độ ăn kiêng. Đối với Kaletra dung dịch uống, tăng tương ứng AUC và C,… của lo inavir lả 80% và 54%. So sánh với
chế độ ăn kiêng, dùng Kaletra với chế độ ãn nhiều chất béo (872 kcal, 55.8% từ chât béo) lảm tăng AUC và C,… của
lopinavir lên khoảng 97% và 43% đối với viên nang mếm; 130% và 56% đối với dưng dịch uống. Đế lảm tăng sinh khả
dụng và giảm thiếu tính biến đổi về dược động học nên dùng Kaletra với thức ăn.
. Phân bố
0 trạng thái ốn định, tỷ lệ lopinavir gắn với protein trong huyết tương khoảng 98—99%. Lopinavir gắn với cả alpha—l-acid
glycoprotein (AAG) vả albumin, tuy nhiên lopinavir có ải lực cao hơn với AAG. Ở trạng thải ổn định, liên kết lopinavir với
protein vẫn hằng định trong khoảng nồng độ đã được ghi nhận sau khi sử dụng Kaletra lỉều 400/100 mg 2 lẩn mỗi ngảy và
tỷ lệ nảy là tương tư giữa nhóm người tình nguyện khỏe mạnh và nhóm bệnh nhân nhiễm HIV.
Chuvên hỏa
Thử nghiệm in vitro tiến hảnh trên microsom gan người cho thấy lopinavir chủ yếu được chuyền hóa bằng quả trinh oxy
hóa khứ. Lopinavir chuyển hóa chủ yếu bời hệ thống cytochrom P450 tại gan, phần 1ởn là do nhóm isozym CYP3A.
Ritonavir lả một thuốc ức chế mạnh CYP3A, ức chế quá trình chuyến hóa cùa lopinavir vì vậy lảm tăng nồng độ của
lopinavir trong huyết tương. Một nghiên cứu sử dụng liponavir gắn đổng vị phóng xạ MC—lopinavir tiến hảnh trên người
cho thấy 89% hoạt tính phóng xạ trong huyết tương sau khi dùng 1 liều Lopinavir/ritonavir 400/100 mg lả do chẩt mẹ. Có
ít nhất 13 dẫn chắt chuyến hòa chẩt oxy hóa từ liponavir được tìm thấy trên người. Cặp đồng phân epime của chất chuyền
hóa tại cảc vị trí 4—oxo vả 4-hydro lả chất chuyến hóa chính có hoạt tinh kháng virus nhưng hoạt tính phóng xạ trong huyết
tương rất thấp. Ritonavir có tác dụng cảm ứng enzym đẫn đến tự cảm ứng chuyển hóa của chính nó và có thể cảm ứng sự
chuyến hóa cùa Iopinavir. Nồng độ lopinavir tư liều dùng trước giảm trong suốt thời gian dùng da liều vả nồng độ nảy ôn
định sau khoáng 10 ngảy đến 2 tuần
Thải trừ
Sau khi sử dụng 14C-lopinavir/ritonavir liều 400/100 mg có khoảng 10,4 :t 2,3% và 82,6 :t 2,5% liều dùng cùa MC-lopinavir
được phát hiện trong nước tỉếu và phân. Lượng lopinavir không bị bỉến đổi chiếm khoảng 2,2% vả 19,8% iiều dùng xuất
hỉện tương ứng trong nước tiếu và phân. Sau khi sử dụng đa liều, có it hơn 3% lượng lopinavir bải tiết trong nước tiểu dưới
dạng không bị biến đổi. Thời gỉan bản thải của lopinavir với khoảng cách đưa liều 12 giờ trung bình khoảng 5-6 giờ, độ
thanh thải đường uống biểu kiến (CL/F) của lopinavir là 6 đểu 7 l/h.
Những đối tưrme đãc biêt
Bệnh nhân nhi
Dữ liệu về dược động học ở trẻ em dưới 2 tuổi còn hạn chế. Dược động học cùa dung dịch uống lopinavirlritonavir liều
300/75 ngm² 2 lần mỗi ngảy vả 230/57,5 ngm² 2 lần mỗi ngảy được nghiên cứu trên 53 bệnh nhân nhi, có tuổi dao động
từ 6 tháng đến 12 tuổi. ó trạng thái ổn dịnh giá trị các thông số AUC, c,… và cmm cùa Iopinavir tương ứng là 72,6 2 31,1
ụg-h/ml, 8,2 8 2,9 png và 3,4 4 2,1 11ng sau khi uống dung dịch lopinavirlritonavir liều 230/57,5 mgfm² 2 lần mỗi ngảy
không phối hợp ncvirapin (n=12); giá trị các thông số tương ửng là 85,8 i 36,9 ụg'hlml. 10,0 i 3,3 11ng và 3,6 zt 3,5
pglml sau khi uống 2dung dịch Iopinavir/ritonavir 1iều 300/75 mglm2 2 lần mỗi ngây có phối hợp nevirapin (n=12). Chế độ
liều 230/57, 5 mg/m2 2 lẩn mỗi ngáy không phối hợp nevirapin và chế độ liều 300/75 mg/m2 2 lần môi ngảy có phối hợp
nevirapin dền cho nồng độ lopinavir trong huyết tương tương tự như giá trị thu được ở bệnh nhân người lớn trướng thảnh
sử dụng liều 400/100 mg 2 lần mỗi ngảy không phối hợp nevirapin.
Giới tinh, chủng tộc vã tuổi
Dược động học cùa Kaletra chưa được nghiên cứu ở người cao tuổi Không có mối iiên quan giữa tuối, giới tính với sự
khác nhau về dược động học được ghi nhận ở bệnh nhân trướng thảnh Không nhận thắy có sự khảo nhau vê dược động
học do chủng tộc.
Suy giảm chức năng thận
Dược động học cùa Kaletra chưa được nghiên cứu trên bệnh nhân suy giâm chức năng thận; tuy nhiên do độ thanh thái
thận cùa lopinavir không đáng kể nên có ít khả năng độ thanh thải toản phần cùa cơ mề bị giảm ở bệnh nhân suy thận.
Suy giám chức nãng gan
Các thông số duợc động học ở trạng thải ổn định cùa lopinavir trên bệnh nhân nhiễm HIV có suy giảm chức nảng gan nhẹ
đến trung binh được so sánh với bệnh nhân bị nhiễm HIV có chức năng gan binh thường trong một nghiên cứu đa liều sử
dụng lopinavir/ritonavir 400/100 mg 2 lẩn mỗi ngảy. Nồng độ trong mảu cùa lopinavir tăng khoảng 30% đã dược ghi nhận
nhưng sự tăng nảy không được coi lá có ý nghĩa lâm sảng.
DỮ LIỆU AN TOÀN TIÊN LÃM SÀNG
Các nghiên cứu về độc tính cùa lỉều lặp lại tiến hảnh trên động vật gặm nhắm và chó đã xác định được những cơ quan dích
chính là gan, thận, tuyến giảp, lảch vả hổng cầu lưu hảnh trong máu. Sự thay đổi tại gan cho thấy có sự phồng lên cùa tế
bảo kèm theo thái hóa trung tâm. Mặc dù phơi nhiễm gây ra những thay đổi trên là tương đương hoặc thấp hơn nồng độ
trên lâm sảng ở người, nhưng liều dùng trên động vật cao hơn 6 lằn liều khuyến cáo trên lâm sảng. Thoải hóa nhẹ ống thận
đã quan sát được trên nồng chuột nhắt đã phơi nhiễm gấp ít nhất 2 lần so với nổng độ khuyến cáo trên người; trong khi đó
thận không bị ảnh hướng ở chuột cống vả chó. Nồng độ thyroxin trong huyết thanh giảm dẫn đến tãng giải phóng TSH lâm
phì đại các tế bảo nang tuyến dù được quan sảt ở chuột cống. Sự thay đổi nảy có tính chất thuận nghịch khi ngừng dùng
thuốc và không xuất hiện ở chuột nhắt vả chó. Xét nghiệm Coomb âm tính hồng cầu không đều và hồng cầu biến dạng
được quan sát thẩy ở chuột cống nhưng không thấy ở chuột nhắt và chó. Lách to kết hợp với chứng mô bảo huyết đã được
phát hiện ở chuột cống những không thấy ở cảc Ioải khác. Nồng độ cholesterol trong huyết thanh tăng lên ở động vật gặm
nhấm nhưng không tăng ở chó, trong khi dó nổng độ triglycerid lại chỉ tăng ở chuột nhắt.
Trên in vitro, kênh kali ở dòng tế bảo tim người (HERG) đã bị ức chế 30% với nổng độ cao nhất cùa lopinavir/ritonavir
được thừ tương ứng gấp 7 lần nổng độ trong huyết thanh toản phần và 15 lần nổng độ đinh cùa dạng tự do trong huyết
tương đạt được ở người với liếư khuyến cáo cao nhất. Ngược lại, nồng độ tương tự của lopinav'ư/ritonavir không lảm chậm
lại sự tải cực ở các sợi Purkinje của cơ tim Nổng độ thấp hơn Iopinavir/ritonavir không gây phong bế rõ rệt dòng kali
(HERG) Nghiên cửu phân bổ mô được tỉến hảnh trên chuột cống cho thấy khả năng lưu giữ cùa thuôc trong tim lả khộng
đảng kề Sau 72 giờ giá trị AUC trong tim đạt xấp xỉ 50% giá trị AUC đo được trong huyết tương Do đó, có thể cho rầng
nồng độ iopinavir trong tim cao hơn không đáng kể nồng độ trong huyết tương.
20
\Ou. . ..
_ Ó chó, các sóng lồi hình chữ U trên điện tâm đồ đã được xác nhận là có liên quan đến kéo dải khoảng PR vả 1ảm chặm
nhịp tim. Tác động nảy lả do khả năng ảnh hưởng đến nông độ các chất điện giải
Ý nghĩa lâm sảng cùa các dữ liệu tiển lâm sảng nói trên chưa được biết đến, tuy nhiên không thế loại trứ tác động trên tim
người của thuốc (xem phần Cảnh báo và thận trọng, Tác dụng không mong muốn)
Ó chuột cống gây độc tố trên bảo thai (hỏng thai, giảm khả nãng sống của bảo thai, giảm cân nặng bảo thai, tăng sự biến
đổi bộ xương) và độc tinh tăng trướng sau khi sinh (giảm khả nãng sống sót cùa chó con) đã được ghi nhận liếư gây độc
cho cá thế mẹ. Nồng độ toản thân của lopinavir/ritonavir ở cá thế mẹ và liếu gây độc ảnh hướng đến phát triển của cá thế
con thẩp hợn nồng độ diếu trị mong đợi ở người.
Nghiên cứu về khả năng sử dụng lâu dải gây ung thư của Iopilovir/ritonavir trên chuột nhắt cho thắy thuốc không độc hại
gen, không kích thích phân bảo khời tạo khối u gan, do đó được coi là không có nguy cơ trên người
Nghiên cứu khả nãng sinh ung thư trên chuột công không tim thắy khả năng sinh khổi u cùa thuốc. Lopinavirlritonavir
không gây đột biển gen trong cảc thử nghiệm in vitro và in vivo bao gổm thử nghiệm đảo ngược đột biến ttên vi khuấn
Ames, xét nghiệm u lympho ở chuột nhắt, xét nghiệm vi nhân trên chuột nhắt và xét nghiệm sự sai lệch nhiễm sắc thể ở tế
bảo lympho của người.
BÃO QUẢN
Bảo quản dung dịch uống Kaletra trong tủ lạnh, ở nhiệt độ (2- 8°C)
Trong khi sử dụng: nếu giữ thuốc ngoâi tủ lạnh, cẩn bảo quản ở nhiệt độ không quá 25°C và bỏ phần còn lại sau 42 ngảy (6
tuần)
Trảnh để gần nơi có nhiệt độ cao.
DẠNG ĐÓNG GÓI
Dung dịch uống Kaletra được đóng trong chai polyethylene terephthalate (PET) mảu hổ phách với dung tích 60 ml. Mỗi
hộp thuốc gồm 5 chai 60m1 và 5 xy-lanh Iẩy thuốc dung tỉch 5 ml, được chia đó tới 0.1 ml. Mỗi 5 mL dung dich thuốc chứa
400 mg lop1nav1r/lOO mg ritonavir.
HẠN DÙNG ,
24 thảng kể từ ngảy sản xuât
Kliõllg dùng Illuốc quá hạn sử dụng. Đế thuốc ngoảỉ tẩm với của mã em.
Thông báo với bác sĩ nếu gặp bẫt kỳ tác dạng không mong muốn nản khi dùng thuốc.
Dung dịch uống Kalen-a được sản xuất bới:
Aesica Queenborough Ltd., North road, Queenbourough, Kent, ME1 1 5EL, Anh
Kaletra 10-1 7-UK cpl-OOOI.V4J.O-UKÍ CCDSOJO809IÓ. 021 7.
wq.cục TRUỜNG
RTRIÙNG PHÒNG
%…ỉWùẽM
21
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng