












ả
ẵ
n
AI
YTE
__L.
ỤE-t
%…
Q>t
`>…íD
—²Q
z,LỉJ
Ịểz
c-e,
L,,j
Cĩ'
Đ
Lán đauấJéÙjllf ỗffl/
dXìlOH
l0VXS 0195
€ólLỉ ó
I~
M
…
N
"f
N
umw m 9H 141
’i uèno “²!ltỒN ttu uẹAnEN vz
: … nfu *… "IW » u mm
……
| XX'XXXX'XX “93M65
eịsau0pm 'imuu em
’uerunsed ’uupued gy wỵ uưpund lÁeự "
mu …de WW°O ỦlllS IN… '.l.d
.ịọq 6uụnx ipnx en pũ Suog|Aq paseap: pue pan>ed
mm …oọôuni pm…n 'nrt tzau
'pueuaqmnuuou 'uoxõuqumj 'aue1 uouoqs
'… …u=o ' đ…ls wm
m ›… uẹqu pa…ưmutw
sunu nm aomu nuno
os uyu amnn pi 300
W! ịll AVI Wyl. II 30
M 0²²1 “011 .JO'L '.'dXầ.
'…“9đW. max ²XS 91 95 'OH 'XSN
1a..esi J.ot uanp 09 …… o uenb m
uax qugp Bunpm uẹp 6uọnụ m …a UỊX
:Jựipị uu 6uọm Jen ụ 6uou uuu_ 'uuịp
N² õuọua 'õnnp um eA õưml nạn Ju…» …
~uuduũnls 6… os Buonp fiuom 'aưquoụd
uudqõeu; 6… gng em:: wmd oeq uau uạu iọw
~ua›puqa Jo qaea
]o mo saungpatu daaỵ
Sìồlq ²1. 8Z
tôm os uuơuõeusn
…ggnuor
osw ệ Ẹ“ ẵ-
Ó
In
_
=
Slaqu18Z _—
(6u1 os undnõeuS) E _—
ỔLUOS ….D HUD a —1
_ f ®ẵẻ
NDG oan-u wa aọmu Ềịl ả % ẳ_ /
á ã %
Jonụểĩẳw
(sltagliptin 50 mg)
28 Ta blets
Each tablet contains 64.25 mg
sitagliptin phosphate equiva ent
to 50 mg sitagliptin
Store below 30°C t86“F).
For Indications, Dosage
and Administration,
Conuaind ỉcations.
Precautions/Wamings.
see accompanying circular.
J,I,sỆ
3 LOT NO 2 LOT NO.
JANUVIA” JANUVIA“ JANUVIA“
50 mg mm 50 ml Tllilnl 50 mu TIth
mugum nunm mmlpm nmm mmuun mm…
IWWuI II 50 in nulqul In 50 Il ullulul tu 50 II|
tmllhllll nlulmlm tllnllunl
ộm Im 0 ơn
JANUVIA" JANUVIA“ JANUVIA“
50 m mm 50 mg Tlhlet 50 mu Tlhlet
tlillưMn mm… (dlqmln nusgluh tdtuldln llus III
:ululul II 50 no eutullnl II 5 lululul lu nu
Illulblh] lilluIlnlhl :ilnợlplnj
0 In 0 no 0 u.
JAN UVIA’“ JANUVIA“ JANUVIA“
50 ml leld 50 m mm 50 m Tlhlel
uuullul: mun… ldmlmtn mnsnhm uuullmm nlumm
uu1vlut II !0 n eululell In 50 m. lubalell II 50 no
dlulhlh) tllultulhl sllldlsll)
em 0 u 0 In
JANUVIA" JANUVIA“ JANUVIA"
50 mu mm 50 m Tum! 50 mg Tllilut
umuuih uamme ummm mm»: uumpln pmmie
uululcnt lu 50 III uulnlul II 50 m uulwlc Il II 50 Il
nmllụml sllulhlllị snmuinị
0 m 0 m o _
JANUVIA“ JANUVIA“ JANUVIA”
50 mu Tnblol 50 m Tlhlut 50 nm Tlhlcl
tsm IỤII m huu lnl: Ipln nu nm (tlll ltnln plusnhm
uu mun in | Il uu vllul n 5 m Iul le SI ne
muuuị summln o'suummm
0 m 0 … 0…
JANUVIA” JANUVIA" JANUVIA“
50 nm lelll 50 In Tim! 50 m Tllllel
umlmn nnnm: lu'lulpln nnanne (:|lullutln plnsịlll
mlulm Iu iu ml eululell h 50 mg en’mlell Iu u nc
euiunn mmlmln silựlplnị
0— 0 m 0 van
JANUVIA“ JANUVIA“ JANUVIA“
50 mu Tablet mTablel 50 mu ĩalllct
mughlh nnitgmu Iulẵlnln ỰIlẵhll uuuan III! …
ll0M Iul us lehll ln ne
dl n Mutl u] slmlmlnị smulunl
@ nu 0 In o II!
EXP DATE EXP DATE
1] L_..
Ẹ xxxxxxxxxx ỊỀ
.]
`
_ l _]
1 Lm NO
JANUVIA” SJANUVIA'" JANUVIA“
50 mg Tlhhl mhth 50 mg T0801
ullndhln mm… uIIJII no MI (dldiưll ỷn Ile
wman II 50 mg umm lo nulntnl I 5 nl
smmtm Msllqluln] shldlulhi
0 m 0 la 0 In
JANUVIA“ JANUVIA" JANUVIA“
50 mg mm 50 mg Talillt 50 m TIth
WIlựlpln muhau mtulịth nunm li Illn nluịn
numtul 1150 m uliuillt lu i0 :. uu llnl lo SI nu
stiỊtlolIn) dhưnlh] sllldlulnl
0 n. 0— o …
JANUVIA" JANUVIA“ JANUVIA"
50 mo Tath 50 mg Ĩllilll 50 mg “lìth
tsll: Ipln plẵMIl (iIulblll |tMltl mu lhlll umuhm
udcll ln5 oululul In 50 M :| mm In 50 m
ulllllihlhl dlulhlll) Hillllllì
III o-› o…
JANUVIA" JAN UVIA'“ JANUVIA"
50 mu Tith 50 nm Tnhlet 50 mg mm
(slllllpiu mẫmu utlalllluln noalm (lllldlịin Mun…
lụth 50m| en uilll Il nu iulivlltll II 50 Il
stluthlh) xmlan] :ltullnlh)
0 m 0 um
JANUVIA" JANUVIA“
50 mg T|0lll 50 TM
(silnlun nnsnlulu (:muwa Ịluhdll
nnqu In 50 ul uutulul In 50 m
tlllơlph] slquan
0 m 0 …
JANUVIA“ JANUVIA”
50 m Tlhlll 50 m TINH
mui: pin Jlus lư (ttlnlnla nuum
Illll lo um:qu In 50 nu
slllollưuln 51 I h
o un 0 …
JANUVIA“ JANUVIA"
50 mg Ỉlhlll 50 mu lelet me —-
(dhlllnln uumn (almlợth mm… mtulun nunm
oumnnt to 50 un uumlnl II u nu uthut II 50 ml
stnullnu) mm…) tíllơlnlnl
0 m 0 _ Ồ …
EXP? DATE
1 & f— ] I
xxxxxxxxxx Ẹ xxxxxxxxxx
043 ] -VNM-2013-007406
WPC-MKD43 1 —T—0220 1 4
JANUVIATM
Viên nén bao phim
(sỉtagliptin phosphate)
NHÓM TRỊ LIẸU
JANUVIA* (sitagliptin phosphate) lá thuốc ức chế mạnh, chọn lọc cao trên enzyme dipeptidyl
peptidase 4 (DPP-4), có hiệu lực ở dạng uông dùng đê diêu trị bệnh đái tháo đường tỷp 2. Cảc
thuốc ức chế DPP-4 là 1 nhóm thuốc có tảc dụng Iảm tăng nồng độ incretin. Bằng cảch ức chế
enzyme DPP-4, sitagliptin lảm tăng nồng độ của 2 hormone incretin hoạt động đã đuợc biết rõ,
là peptide giống glucagon l (giucagon—like peptide 1: GLP—l) vả polypeptide kich thích tiết
insulin vả phụ thuộc vảo glucose (glucose-depcndent insulinotropic polypeptide: GIP). Cảc
hormone incretin nảy lả thảnh phần của hệ thống nội sinh tham gia điếu hòa sinh lý tình trạng
cân bằng nội môi glucose. Khi nồng độ glucose trong mảu binh thường hoặc tăng cao, GLP-l vả
GIP lâm tăng tống hợp và phóng thich insulin tù cảc tế bảo beta tuyến tụy. GLP— 1 cũng lảm
giám tiết glucagon từ cảc tế bảo alpha tuyến tụy, dẫn đến giảm sản xuất glucose tại gan. Cơ chế
nảy không giông như cơ chế tác dụng cùa các sulfamid hạ đường huyết, cảc sulfamid hạ đường
huyết gây phóng thích insulin ngay cả khi nồng độ glucose thấp, điếu nảy có thể dẫn đến hạ
đường huyết do sulfamid hạ đường huyết ở bệnh nhân đái thảo đường týp 2 và ở người binh
thường. Sitagliptin lả một chất ức chế mạnh, rất chọn lọc enzyme DPP-4 và không ức chế các
enzyme liên quan gần lả DPP-8 hoặc DPP- 9 ở cảc nồng độ điều trị. Sitagliptin có cấu trúc hóa
học và tảc dụng dược lý khảc với các chắt tương tự GLP- l, insulin, sulfamide hạ đường huyết
hoặc nhóm meglitinidcs, biguanides, chất chủ vận thụ thể gamma được hoạt hớa bởi yếu tố tăng
trường peroxisome (peroxisome proiiferator-activated receptor gamma -PPARy), cảc chất ức chế
alpha-glucosidase vả các chất tương tự amylin.
THÀNH PHÀN ỸV
Mỗi viên nén bao phim JANUVIA chứa 32,13 mg, 64,25 mg hoặc 128,5 mg sitagliptin phosphat
monohydrat, tương đương với 25 mg, 50 mg hoặc 100 mg, theo thứ tự, dạng base tự do.
Tả dược
Hoạt chất
Mỗi viến nén bao phim JANUVIA chứa cảc tá dược sau đây: cellulose vi tinh thế, anhydrous
dibasic calci phosphat (calci hydrogen phosphat dạng khan), croscarmellose natri, magnesi
stearat vả natri stearyl fumarat. Ngoài ra, lớp bao phim chứa các tả dược sau đây: polyvinyl
alcol, poiyethylene giycol (macrogol), ta1c, titan dioxyd, sắt oxyd mảu đò vả sắt oxyd mảu vảng.
CHỈ ĐỊNH
Đơn trị liệu
JANUVIA được dùng như liệu phảp hỗ trợ cho chế độ ăn kiêng và vận động thế lực để cải thiện
kiếm soát đường huyết ở bệnh nhân đải thảo đường tỷp 2.
Kết hợp với Metformin
JANUVIA được chỉ định ở bệnh nhân đải thảo đường týp 2 đề cải thiện kiếm soát đường huyết
bằng cảch kết hợp với metformin như liệu phảp ban đầu hoặc khi metformin đơn trị lìệu cùng
chế độ ăn kiêng và vận động thể lực không kiếm soát được đường huyết thich đáng.
Kết hỌp với một sulfamid hạ đường huyết
JANUVIA được chỉ định ở bệnh nhân đái thảo đường tỷp 2 để cải thiện kiếm soát đường huyết
bằng cảch kết hợp với sulfamid hạ đườn huyết đơn trị liệu cùng chế độ ăn kiêng và vận động
thế lực không kiếm soát được đường huyet thích đáng.
Kế! hợp với chất chủ vận PPARy
JANUVIA được chỉ định ở bệnh nhân đái thảo đường týp 2 để cải thiện kiếm soát đường huyết
bằng cảch kết hợp với chất chủ vận PPARy (như nhóm thiazolidinediones) khi chẩt đồng vận
PPARv đơn trị liệu cùng chế độ ăn kiêng và vận động thế lực không kiếm soát được đường
huyết thích đảng.
Kết họp với Metformin và một sulfamide hạ đường huyết
JANUVIA được chỉ định ở bệnh nhân đái tháo đường tỷp 2 đề cải thiện kiếm soát đường huyết
bằng cách kết hợp với metformin và một sulfamide hạ đường huyết khi hai loại thuốc nảy cùng
chế độ ăn kiêng và vận động thế lực không kiếm soát được đường huyết thích đáng.
Kết họp với Metformin vả một chất chủ vận PPARy
JANUVIA được chỉ định ở bệnh nhân đải thảo đường týp 2 đề cải thiện kiếm soát đường huyết
bằng cảch kết hợp với metformin và một chắt chủ vận PPARy (như thiazolidinediones) khi hai
loại thuốc nảy cùng chế độ ăn kiêng và vận động thế lực không kiểm soát được đường huyết
thích đáng.
Kết họp với Insulin
JANUVIA được chỉ định ở bệnh nhân đái tháo đường tỷp 2 như một liệu phảp hỗ trợ cho chế độ
ăn kỉêng vả vận động thể lực để cải thiện kiếm soát đường huyết khi dùng kết hợp với insulin
(cùng hoặc không cùng metformin). Ọ/
LIÊU LƯỢNG vÀ CÁCH DÙNG
Liều JANUVIA khuyến cảo lả mo mg, ngảy 1 lần khi dùng như đơn trị liệu hoặc kết hợp với
metformin, sulfamide hạ đường huyết, insulin (cùng hoặc không cùng metformin), chất chủ vặn
PPARv (như thiazoiidincdiones), hoặc metformin cùng sulfamide hạ đường huyết hoặc có thể
dùng metformin cùng chất chủ vận PPARy. Có thế uông JANUVIA cùng hoặc không cùng với
thức ăn.
Khi dùng JANUVIA kết hợp với sulfamide hạ đường huyết hoặc insulin, có thể xem xét dùng
sulfamide hạ đường huyết hoặc insulin liếư thấp hơn nhằm giảm nguy cơ hạ đường huyết do
sulfamide hạ đường huyết (xem THẶN TRỌNG, Hạ đường huyết khi kểt họp với sulfamide hạ
đường huyết hoặc insulin).
Bệnh nhân suy thận
Đối với bệnh nhân suy thận nhẹ (hệ số thanh thải creatinine [CrCl]_ > 50 mL/ phút, gần tương
ứng với creatinine huyết thanh < 1,7 mg/dL ở nam và < 1,5 mgldL ở nữ), không cân chinh liếư
JANUVIA.
Đối với bệnh nhân suy thận trung binh (CrCl > 30 đến < 50 mL/phủt, gần tương ứng vởi
creatinine huyết thanh > 1,7 đến < 3,0 mgldL ở nam vả > 1 ,5 đến < 2 ,SmgldL ở nữ), liếư
JANUVIA là 50 mg ngây ! lần.
Đối với bệnh nhân suy thận nặng (CrCl <30 mL/phủt, tương ứng với creatinine huyết thanh
khoảng >3, O mg/dL ở nam vả >2, 5 mg/dL ở nữ) hoặc có bệnh thận giai đoạn cuối cần thấm tách
mảu hoặc thấm phân phức mạc, liếư JANUVIA là 25 mg ngảy ] lần. Có thể dùng JANUVIA bất
kỳ Iức nảo, không liên quan đến thời điếm thẩm tảch mảu.
Vì có sự chinh `liếư dựa vảo chứcnăng thận, theo khuyến cáo nến đảnh giả chức năng thận trước
khi khởi đâu điêu trị và sau đó kiêm tra định kỳ.
CHỐNG cni ĐỊNH
Chống chỉ định dùng JANUVIA ở bệnh nhân quả mẫn với bất kỳ thảnh phần nảo cùa thuốc
(xem THẶN TRỌNG, Phán ứng mẫn cám vả TÁC DỤNG PHỤ, Kinh nghiệm hậu mãi).
THẶN TRỌNG
Tổng quát
Không nên dùng JANUVIA ở bệnh nhân đải thảo đường týp 1 hoặc để điếu trị nhiễm acid
ceton ở bệnh nhân đái thảo đường.
Viêm tụy: Về kinh nghiệm hậu mãi, đã có cảc báo cảo về viêm tụy cẳp, bao gồm vìêm tụy xuất
huyết hoặc hoại tử gây tử vong vả không gây tử vong (xem TÁC DỤNG PHỤ, Kinh nghiệm
hậu mãi) ở bệnh nhân dùng sitagliptin. Vì cảc báo cảo nảy được thực hiện tự nguyện từ một
dân sô chưa rõ cỡ mẫu, nên thường không thể ước tính chắc chắn tần suất của tảo dụng phụ
hoặc thiết lập được quan hệ nhân-quả do sử dụng thuốc. Nên cho bệnh nhân biết triệu Àchứng
đặc trưng của viêm tụy cấp là đau bụng dữ dội vả liên tục. Viêm tụy được ghi nhận hồi phục
sau khi ngưng dùng sitagliptin. Nếu nghi ngờ viêm tụy, nên ngưng dùng JANUVIA và các
thuốc khảo có thế liến quan.
Sử dụng ở bệnh nhân suy thận: JANUVIA được đảo thải qua thận. Để đạt nồng độ JA VIA
trong huyết tương tương tự như ở bệnh nhân có chức năng thận binh thường, nên giảm liều
thuốc ở bệnh nhân suy thận trung bình và nặng, cũng như ở bệnh nhân có bệnh thận giai đoạn
cuối (ESRD) cần thấm phân mảu hoặc thẩm phân phức mạc (xem LIÊU LƯỢNG VÀ CÁCH
DÙNG, Bệnh nhân suy thặn.)
Hạ đường huyết khi dùng liệu pháp kết họp với sulfamide hạ đường huyết hoặc insulin. Trong
cảc thử nghiệm lâm sảng với JANUVIA theo đơn trị liệu và theo trị liệu kết hợp với các thuốc
được biết rõ không gây hạ đường huyết (như metformin hoặc chất chủ vận PPARy
(thiazolidinediones)), tỷ lệ cậc bảo cảo hạ đường huyết khi dùng JANUVIA tương tự như ở
bệnh nhân dùng placebo. Giông như các thuốc trị tảng đường huyết khác, đã quan sảt thấy hạ
đường huyết khi dùng JANUVIA kết hợp với insulin hoặc sulfamide hạ đường huyết (xem
TÁC DỤNG PHỤ). Do đó, để giảm nguy cơ hạ đường huyết do SU vả insulin, có thể xem xét
giảm liếư SU hoặc insulin (xem LIÊU LƯỢNG VÀ CÁCH DÙNG)
Phản ứng quả mẫn Đã có các báo cáo hậu mãi về những phản ứng quá mẫn nghiêm trọng ở
bệnh nhân dùng JANUVIA. Cảo phản ửng nảy bao gồm phản ứng phản vệ, phù mạch vả các
bệnh 1ý tróc da kể cả hội chứng Stevens-Johnson. Vi cảc phản ứng nảy được bảo cảo tự nguyện
từ dân số chưa biết rõ cỡ mẫu, nên thường không thể ước tính chắc chắn tần suất hoặc xảc lập
mối quan hệ nhân guả với việc sử dụng thuốc. Các phản ứng nảy bắt đầu xuất hiện trong 3
tháng đầu sau khi băt đầu điếu trị với JANUVIA, với vải báo cáo xảy ra sau liều đẫu tiến. Nếu
²“ấ/è/l
2
n
\\
nghi ngờ có phản ứng quả mẫn, phải ngưng dùng JANUVIA, đảnh giả cảc nguyên nhân tiếm
tảng khác và bắt đầu cảc trị liệu thay thể vẽ bệnh đái tháo đường. (xem CHỐNG CHỈ ĐỊNH
vả TÁC DỤNG PHỤ, Kinh nghiẹm hậu mãi).
PHỤ NỮ có THAI
Sitagliptin khộng có khả năng gây quải thai ở chuột cống khi dùng liếư đến 250 mg/kg hoặc ở
thò với liếư đến 125 mg/kg trong giai đoạn hình thảnh cảc cơ quan (tương ứng đến 32 lần vả 22
lần, lượng dung nạp ở người dựa theo liếư đề nghị hảng ngảy ở người lớn là 100 mglngảy). Ở
chuột công, tỷ lệ biến dạng xương sườn thai nhi (không có xương sườn, xương sườn giảm sản và
chuỗi hạt sườn) tăng nhẹ được ghi nhận khi chuột mẹ dùng liếư 1.000 mgfkg/ngảy (khoảng 100
lần lượng dung nạp ở người dựa theo liếư đề nghị hảng ngảy ở người lớn là 100 mg/ngảy). Khi
chuột công mẹ dùng liếư uống 1.000 mg/kg/ngảy, cân nặng trung binh cùa chuột con cả 2 giống
đực và cải trước khi thôi bú vả sự tăng cân của chuột đực con sau khi thôi bú đến gìảm nhẹ. Tuy
nhiên, những nghiên cứu về sự sinh sản ở động vật không phải lúc nảo cũng dự đoán được đảp
ứng ở người.
Vì không có những nghiên cứu đầy đủ và đối chứng tốt ở phụ nữ có thai, nên chưa biết rõ tính an
toản cùa JANUVIA ở phụ nữ có thai. Như cảc thuốc uông trị tăng đường huyết khảc, không
khuyến cảo sủ dụng JANUVIA trong thai kỳ
PHỤ NỮ CHO CON BỦ
Sitagliptin được bải tiết vảo sữa chuột cống mẹ. Vẫn chưa biết rõ sitagliptin có bải tiết vảo sữa
người hay không. Do đó, không nên dùng JANUVIA cho phụ nữ đang cho con bủ.
sử DỤNG ờ TRẺ EM
Chưa xác lập tính an toân và hiệu lực của JANUVIA ở bệnh nhi dưới 18 tuổi. C31/
sư DỤNG ở NGƯỜI CAO TUỔI
Trong các nghiến cứu lâm sảng, tinh an toản và hiệu lực của JANUVIA ở người cao tuổi (_ 65
tuổi) tương tự như ở bệnh nhân trẻ tuổi hơn (<65 tuổi). Không cần chinh 1iếu theo độ tuổi. Bệnh
nhân cao tuổi có nhiều khả năng suy thận hơn; như các bệnh nhân khảc, có thế cần chinh liều khi
có suy thận đảng kế (xem LIÊU LƯỢNG VÀ CÁCH DÙNG, Bệnh nhân suy thận).
TƯỚNG TÁC THUỐC
Trong các nghiên cứu tương tảo thuốc, sitagliptin không gây tác động có ý nghĩa lâm sảng lên
dược động học cùa các thuốc sau đây: metformin, rosiglitazone, glyburide, simvastatin, warfarin
và viên uông trảnh thai. Dựa vảo cảc dữ liệu nảy, sitagliptin không ức chế cảc isozyme CYP lả
CYP3A4, 2C8, hoặc 2C9. Dựa vảo dữ iiệu in vitro, người ta cho rằng sitagliptin cũng không có
tảo dụng ức chế CYP2D6, IA2, 2c19 hoặc 2B6, hoặc cảm ứng CYP3A4.
Dùng metformin 1iếu lặp lại ngảy 2 lần cùng với sitagliptin không lảm thay đổi có ý nghĩa dược
động học cùa sitagliptin ở bệnh nhân đải tháo đường týp 2.
Cảc phân tich dược động học theo dân số đã được tiến hảnh ở bệnh nhân đải tháo đường tỷp 2.
Những thuốc dùng đồng thời không gây tảc dụng có ý nghĩạ lâm sảng lên dược động học cùa
sitagliptin. Những thuốc được đánh giả là thuốc dùng phổ biến ở bệnh nhân đải thảo đường tỷp
2, bao gôm cảc thuốc trị tăng cholesterol mảu (như statins, fibrates, ezetimibe), thuốc khảng tiểu
cẩu (như clopidogrel), thuốc trị tăng huyết áp (như thuốc ức chế ACE, chẹn thụ thể angiotensin,
chẹn beta, ức chế kênh canxi, hydrochlorothiazide), thuốc giảm đau và khảng viếm không
steroid (như naproxen, dic]ofenac, celecoxib), thuốc trị trầm cảm (như bupropion, fluoxetine,
sertralỉne), kháng histamine (như cetirizine),’ ưc chế bơm proton (như omeprazole, lansoprazole),
4
,`
\
\?oX'Ĩ
và các thuốc trị rối loạn cương dương (như sildenatil).
Diện tich dưới đường cong và trung bình nồng độ đỉnh cùa digoxin tăng nhẹ (AUC, 11% vả
C,…, 18%) khi dùng cùng sitagliptin, mức độ tăng nảy khõng được xem là có ý nghĩa lâm sảng.
Nến giám sảt bệnh nhân đang dùng digoxin cho thích hợp Không khuyến Cảo điếu chinh liếư
digoxin hay JANUVIA.
Khi cho đối tuợng nảy uống một liều đơn JANUVIA 100 mg cùng vởi một liều đơn cyclosporin
600 mg, vốn là chẩt ức chế mạnh p-glycoprotein, AUC vả Cmax cùa sitagliptin tăng xấp xỉ 29%
và 68 %. Những thay đối nảy trong dược động học cùa sitagliptin được xem không có ý nghĩa
lâm sảng Không khuyến cáo điếu chỉnh liếư JANUVIA khi dùng chung với cyclosporine hoặc
các chất ức chế p-glycoprotein khác (như ketoconazole).
TÁC DỤNG PHỤ
JANUVIA thường được dung nạp tốt trong cảc thử nghiệm iâm sảng có đối chứng theo phảc đồ
đơn trị liệu và điếu trị kết hợp, vởỉ tỷ lệ đối tượng ngưng điều trị do cảc tác dụng bất lợi trên lâm
sảng thì tương tự như nhỏm dùng placebo.
Trong 4 nghiên cứu lâm sảng đối chứng placebo, dùng thuốc theo phảc đồ đơn trị liệu (một
nghiên cửu kéo dải 18 tuần vả một nghiến cửu kéo dải 24 tuẩn) và phác đồ kết hợp vởi
metformin hoặc pioglitazone (cả hai nghiên cứu kẻo dải 24 tuần), có 1.082 bệnh nhân dùng
JANUVIA 100 mg, ngảy ] lần và 778 bệnh nhân dùng placebo (trong đó có hai nghiên cứu bao
gồm 456 bệnh nhân dùng JANUVIA 200 mg mỗi ngảy, gâp 2 lần liếư khuyến cáo dùng mỗi
ngảy). Không có bảo cảo vế cảc phản ứng bất lợi do thưốc xảy ra với tần suất > 1% ơ bệnh nhân
dùng JANUVIA 100 mg. Nói chung, hồ sơ an toân của liếư 200 mg mỗi ngảy cũng giống như
1iều 100 mg mỗi ngảy.
Trong một phân tích đã định trước tồng hợp từ các nghiến cửu trên, tần suất chung về tảc dụng
bất iợi hạ đường huyết ở bệnh nhân điều trị với JANUVIA 100 mg tương tự như nhóm dùng
placebo (1,2% so với 0 ,9%) Tác dụng bất lợi về hạ đường huyết dựa vảo tất cả cảc báo cáo vê
hạ đường huyết, không cân đo đường huyết lủc xảy ra sự kiện Tần suất các tảc dụng bẩt lợi
chọn lọc ở đường tiêu hóa ở bệnh nhân dùng JANUVIA hoặc placebo: đau bụng (JANUVIA,
2,3%; placebo, 2,1%), buồn nôn (] ,4%;0 ,,6%) nôn (O, 8%;0 ,9%) và tiếu chảy (3, 0%;2 ,3%)
Trong tất cả các nghiên cím, phản ứng bẩt lợi về hạ đường huyết được dựa trên tất cả báo cảo về
hạ đường huyết có triệu chứng; không yêu cầu đo glucose cùng thời điếm xảy ra phản ứng.
Bổ sung váo liệu pháp kết họp với Suifamid hạ đường huyếl: Trong một nghiên cứu đối chứng
placebo, kéo dải 24 tuân với JANUVIA 100 mg kết hợp với glimepiride hoặc với Iglimepiride vả
metformin (JANUVIA, N= 222; placebo, N= 2—19), hạ đường huyết là phản ứng bẫt lợi liến quan
đến thuốc được ghi nhận_ > 1% bệnh nhân dùng JANUVIA vả xảy ra phổ biến hơn so vởi bệnh
nhân dùng placebo (JANUVIA, 9,5%; placebo, 0 9,%)
Bổ sung vảo liệu phảp kết hợp vởi metformin và một chất chủ vận PPARy. Trong một nghiên
cứu đối chứng placebo, dùng chung JANUVIA 100 mg với metformin vả rosiglitazone
(JANUVIA, N=170; Placebo, N= —92), phản ứng bẳt lợi iiên quan đến thuốc được ghi nhận tại
thời điếm đầu tiến vảo tuần thứ 18 > 1% ở bệnh nhân được điếu trị vởi JANUVIA vả vởi tần
suất xảy ra phổ biến hon 50 với bệnh nhân dùng placebo lả nhức đầu (JANUVIA, 2,4%; placebo:
00,°/,o) tiêu chảy (1,8%; 1.1%), buồn nôn (1,2%; 1,,1%) hạ đường huyết (1,2%; 0 ,0%) và nôn
(1, 2%;0 ,0%) Qua tuần 54, phản ứng bắt lợi liẽn quan đến thuốc được ghi nhận > 1% ở bệnh
nhân dùng JANUVIA vả xây ra phố biển hơn bệnh nhân dùng placebo lả nhức đầu (,2 4%, 0 ,,0%)
hạ đường huyết (2,4%; 0 ,0%), nhiễm trùng đường hô hắp trên (1, 8 %; 0 ,0,%) buồn nôn (1,2%;
1,1%), ho (1,2%;0,0%),v1êm da do nâm (1, 2%;0 ,,0%) phủ ngoại bìên (1 ,2%;0 ,0%) và nôn
(1,2%; 0,0%).
5
Khới đầu liệu phảp kết hợp với Metformin. Trong 1 nghiên cứu đa biến số, đối chứng placebo,
kéo dải 24 tuần với khởi đầu điếu trị với sitagliptin 100 mg kết hợp với metformin lỉếu 1000 mg
hoặc 2000 mg/ngảy (dùng sitagliptin 50 mg/metformin 500 mg hoặc 1. 000 mg ngảy 2 lần), cảc
phản ứng bẫt lợi 1iên quan đến thuốc được báo cảo ở > 1% bệnh nhân dùng sitagliptin cùng
metformin (N= 372) vả xảy ra phổ biến hơn so với bệnh nhân dùng metformin đơn trị liệu
(N=364) lả: tiêu chảy (sitagliptin cùng metformin, 3,5%; metformin, 3,3%), khó tiêu (1, 3%;
1,1/o), đầy hơi (1, 3%;0 5,%), nôn (1,1%; 0 ,3%) và nhức đầu (1,3%;1,1%). Tẩn suất hạ đường
huyết là 1,1% ờ bệnh nhân dùng sitagliptin kết hợp với metformin và 0,5% ở bệnh nhân chỉ
dùng metformin.
Khởi đấu liệu pháp kết hợp với chất chủ vận PPARv: trong ] nghiên cửu kéo dải 24 tuần khởi
đầu trị liệu với JANUVIA liều 100 mg/ngảy kết hợp pỉoglitazone liếư 30 mg/ngảy, chi có 1 phản
ứng bất lợi liên quan đến thuốc được báo cảo ở > 1% bệnh nhân dùng JANUVIA cùng
pioglitazone (N= 261) và xảy ra phố biển hơn so với bệnh nhân dùng pioglitazone đơn thuần
(N=259) là hạ đường huyết không có triệu chứng (1,1% khi JANUVIA kết hợp pioglitazone vả
0% khi dùng pioglitazone). Tần suất hạ đường huyết có triệu chứng là 0,4% ở bệnh nhân dùng
J ANUVIA kết hợp với pioglitazone và 0,8 % ơ bệnh nhân dùng pỉoglitazonc
Bổ sung vòo Iiệupháp kểz hợp với Insulin trong ] nghiên cứu đối chứng piacebo kéo dải 24 tuần
với JANUVIA 100 mg kết hợp vói liếu insulin cố định (cùng hoặc không cùng metformin), các
phản ứng bất lợi liên quan đến thuốc được bảo cáo & > 1% bệnh nhân dùng JANUVIA (N=322)
vả xảy ra phổ biến hơn ở bệnh nhân dùng placebo (N=319) lả: hạ đường huyết (JANUVIA,
9 ,6%; placebo, 5 ,,3%) bệnh cúm(l ,2%; 0 ,3%) vả nhức đầu (1,2%; 0 ,.0%) Trong ] nghiên cứu
kéo dải 24 tuẫn khác, bệnh nhân được thêm JANUVIA vâo iiệu phảp insulin tích cực (cùng hoặc
không cùng mctformin), cảc phản ứng bẩt lợi khôn liên quan đến thuốc được bảo cảo ở >l%
bệnh nhân dùng JANUVIA 100 mg vả xảy ra phổ bien hơn ở bệnh nhân dùng placebo. M J
Viêm tụy. Trong một phân tích tống hợp từ 19 thử nghiệm lâm sảng thiết kế mù đôi với tiữ liệu
cùa 10.246 bệnh nhân dùng ngâu nhiên sitagliptin 100 mg/ngảy (N= —5. 429) hoặc thuốc so sánh
tương ứng (thuốc có hoạt tính hoặc placebo) (N=4. 817), tần suất viêm tụy cấp là 0,1/100 bệnh
nhân- năm ở mỗi nhóm (4 bệnh nhân có 1 tảc dụng bắt lợi trong số 4. 708 bệnh nhân-năm đối với
sitagliptin vả 4 bệnh nhân có 1 tác dụng bất lợi trong số 3 942 bệnh nhân-năm đối với thuốc so
sánh). (xem THẬN TRỌNG, Viêm tụy).
Không tìm thẫy bắt kỳ thay đổi có ý nghĩa lâm sâng về dẩu hiệu sinh tồn hoặc điện tâm đồ (bao
gôm khoảng QTc) ở bệnh nhân dùng JANUVIA.
Kinh nghiệm hậu mãi:
Các phản ứng bất lợi bổ sung sau đây được nhận biết trong quá trình sử dụng JANUVIA theo
phác đồ đơn trị lìệư vâfhoặc kết hợp vởỉ cảc thuốc hạ đường huyết khảc trên thị trường. Vì cảc
phản ứng nảy được bảo các tự nguyện từ dân số chưa biết rõ cỡ mâu, nên thương không thể ước
tính chắc chắn tần suất hoặc xác lập mối quan hệ nhãn quả vởi việc sử dụng thuốc.
Các phản ứng quá mẫn gồm phản ứng phản vệ, phù mạch, phát ban, mề đay, viêm mao mạch
và các bệnh lý gây tróc da kể cả hội chứng Stevens-Johnson (xem CHỐNG CHỈ ĐỊNH vả
THẶN TRỌNG, Phán ửng quá mẫn); viêm tụy cấp, bao gồm viêm tụy xuất hưyết vả hoại tử
gây từ vong và khỏng gây tử vong (xem THẶN TRỌNG, Viêm tụy); giảm chức năng thận bao
gồm suy thận câp (đôi khi cần thầm phân); viêm đường hô hắp trên; viêm mũi-họng; táo bón;
nôn; nhức đầu; đau khớp; đau cơ; đan tứ chi; đau lưng.
TỤÔNG BẢO cno BÁC SỸ NHỮNG TẢC DỤNG KHỎNG MONG MUỐN GẶP PHÀI KHI
SƯ DỤNG THUOC.
Các phát hiện vê xét nghiệm
Tần suất các tảc dụng bất lợi về kết quả xét nghiệm ở bệnh nhân dùng JANUVIA 100 mg tương
tự ở bệnh nhân dùng placebo. Trong cảc nghiên cứu iâm sảng chéo (across clinical studies),
lượng bạch cầu tăng nhẹ (khảc biệt xấp xỉ 200 tế bảo bạch câu /microL so với placebo; lượng
bạch cầu trung bình ban đầu xâp xi 6.600 tế bảo/microL) do tảng bạch cầu trung tính. Điếu nảy
được phát hiện ở hầu hết nhưng không phải ở tất cả cảc nghiên cứu. Sự thay đổi cảc thông số xét
nghiệm nảy được xem không liên quan đến lâm sảng
TÁC ĐỌNG CỦA THUỐC LÊN KHẢ NĂNG LÁ] XE VÀ VẬN HÀNH MÁY MÓC
Chưa thực hiện cảc nghiên cứu về tác động của JANUVIA lên khả năng lải xe và vận hânh máy
móc. Tuy nhiên, người ta cho rằng JANUVIA không ảnh hướng đến khả năng lái xe và vận hảnh
máy móc.
DƯỢC LỰC HỌC ẨV
Cơ chế tác động
JANUVIA thuộc nhóm thuốc uống trị tăng đường huyết, gọi lả chẩt ức chế dipeptidyl peptidase
4 (DPP-4) có tảo dụng cải thiện đường huyết ở bệnh nhân đải thảo đường týp 2 bằng cảch lảm
tăng nồng độ cảc hormone incretin thể hoạt động. Cảo hormone ỉncretin bao gồm peptide giống
glucagon 1 (giucagon- -like peptide-l: GLP-l) vả polypeptide kích thích tiết ỉnsulin vả phụ thuộc
vảo glucose (glucose- -dependent insulinotropic polypeptide: GIP), được phóng thích từ một suốt
ngảy, vả tãng nồng độ đảp ứng với bữa ăn. Cảc hormone incretin nảy lả thảnh phần cùa hệ thống
nội sinh tham gia vảo sự điều hòa sinh lý tình trạng cân bằng nội môi glucose. Khi nổng độ
glucose bình thường hoặc tăng cao, GLP—l and GIP lâm tăng sự tổng hợp và phóng thích insulin
từ các tế bảo beta tuyến tụy qua cảc đường truyền tín hiệu nội bảo liên kết với AMP vòng.
Người ta đã chứng minh việc điếu trị với cảc chất ức chế GLP- ] hoặc với DPP—4 các mô hình
động vật bị đải thảo đường týp 2 đã lảm cải thiện đảp ứng của tế bảo beta đối với glucose vả
kich thích sinh tổng hợp và phóng thích insulin. Sự hâp thu vả sử dụng glucose tại mỏ gia tăng
khi nồng độ insulin cao hơn. Ngoâi ra, GLP- 1 lảm giảm tiết glucagon từ tế bảo alpha tuyến tụy.
Nồng độ glucagon giảm cùng với nồng độ insulin cao hơn dẫn đến giảm sản xuất glucose tại
gan, gây giảm nông độ glucose trong máu. Cảc tác dụng nảy của GLP- ] vả GIP phụ thuộc vảo
glucose, vì vậy khi nồng độ glucose trong máu thấp, sự kích thỉch phóng thích insulin vả ức chế
tiết glucagon do GLP- ] không xảy ra Đối với cả hai GLP- 1 và GIP, khi nồng độ glucose cao
hơn mức bình thường thì sự kích thich phóng thích insulin gia tăng. Hơn nữa, GLP—l không lảm
suy giảm đảp ứng binh thường của glucagon đối với tình trạng đường huyết thẩp. Hoạt tinh của
GLP— ] vả GIP bị hạn chế bởi enzyme DPP- 4, đây 1ả enzyme nhanh chóng thủy phân các
hormone incretin thảnh cảc chất không hoạt tính. Sitagliptin ngăn ngùa DPP-4 thủy phân các
hormone incretin, do đó ]ảm tảng nồng độ cảc dạng hoạt tính cùa GLP- ] vả GIP trong huyết
tương Bằng cảch tảng nồng độ incretin dạng hoạt động, sitagliptin lảm tăng phóng thích insulin
và giảm nông độ glucagon theo cách thức phụ thuộc vảo glucose. Ở bệnh nhân đái tháo đường
typ 2 có tình trạng tăng đường huyết, sự thay đổi nồng độ insulin vả glucagon nảy dẫn đến gỉảm
nông độ hemoglobin A1c (HbAlc) và nông độ glucose lủc đói và sau khi ăn. Cơ chế phụ thuộc
vảo glucose nảy khác biệt với cơ chế tác dụng cùa cảc Sulfamid hạ đường huyết; các sulfamid hạ
đường huyết lảm tăng tiết insulin ngay cả khi nồng độ glucose thấp và có thể dẫn đến hạ đường
huyết ở bệnh nhân đái tháo đường týp 2 và ở đối tượng bình thường. Sitagliptin lả ] chất ức chế
mạnh, chọn lọc cao trên enzyme DPP—4 và không ức chế cảc enzyme liên quan gần lả DPP- 8
hoặc DPP-9 ở cảc nồng độ điểu trị.
Dược lực học
“Ă
//n* ’
Tổng quát
Ô bệnh nhân đái thảo đường týp 2, cảc liếư đơn JANUVIA dẫn đến ức chế hoạt tính của DPP- 4
trong 24 gỉờ, gây tăng nông độ GLP- ] vả GIP thể hoạt động trong máu đến 2- 3 lần, tăng nồng độ
insulin và C- peptide trong huyết tương, giảm nồng độ glucagon, giảm glucose lúc đói, và giảm
dung nạp glucose sau khi uống glucose hoặc sau bữa ăn.
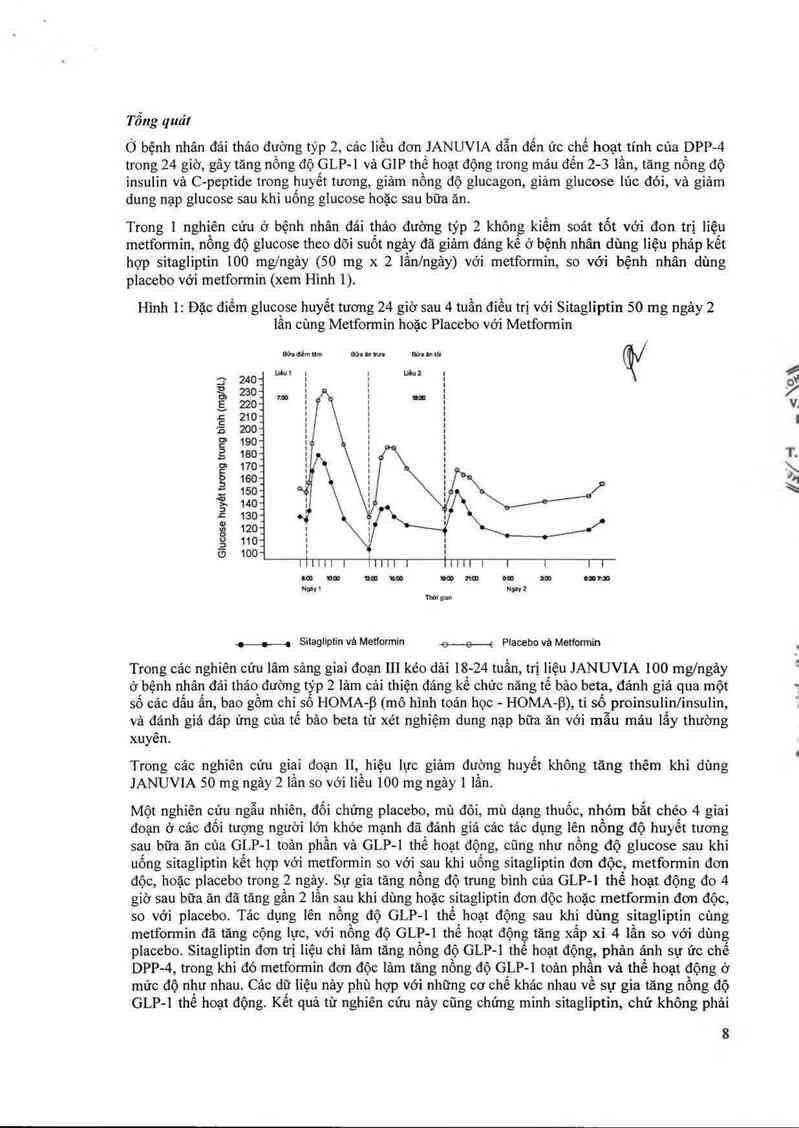
Trong 1 nghiên cứu ở bệnh nhân đái tháo đường týp 2 không kiếm soát tốt với đon trị liệu
metformin, nông độ glucose theo đõi suốt ngảy đã giảm đáng kể ở bệnh nhân dùng iiệu pháp kết
hợp sitagliptin 100 mg/ngảy (50 mg x 2 lầnlngảy) với metformin, so với bệnh nhân dùng
placebo với metformin (xem Hình 1).
Hình 1: Đặc điếm glucose huyết tương 24 giờ sau 4 tuần điếu trị với Sitagliptin 50 mg ngảy 2
lân cùng Metformin hoặc Placebo với Metformin
Đức Gẻm M… 90: in… Bỉnhlđ (W
Uử Uếu
240 : ' 2 “
l
ẫẵ; ; …
210: 1
200: i
190: E
180: |
170-_ ',
160: :
150; l
140; 1
130: .
120: {
110: ’
100~
I
I
I
|
|
I
I
I
I
|
I
I
I
|
I
|
I
I
Glucose huyêt tương trung bình (mg/dL)
!
I
I
|
I
I
I
I
I
I
I
|
I
|
I
I
I
I
I
|
I
|
|
I
I
|
o
1
|
I I
|
I
|
E ,
III] | llllll
] |
… W W % W m M m mm
Ngìyl Ngảy z
Thcn' gln
-O—O-C Sìtagliptin vả Metformin e—e—e Placebo vả Metfonnin
Trong các nghiên cứu lâm sảng giai đoạn 111 kéo dải 18-24 tuần, trị liệu JANUVIA 100 mg/ngảy
ở bệnh nhân đải thảo đường tỷp 2 lảm cải thiện đảng kế chức năng tế bảo beta, đảnh giả qua một
số các dấu ấn, bao gồm chỉ số HOMA-B (mô hình toán học - HOMA—B), tỉ số proinsulin/insulin,
vả đánh giá đảp ứng của tế bâo beta từ xét nghiệm dung nạp bữa ăn với mẫu mảu lẩy thường
xuyen.
Trong cảc nghiên cứu giại đoạn II,`hiệu lực giảm đường huyết không tăng thêm khi dùng
JANUVIA 50 mg ngảy 2 lân so với liêu 100 mg ngảy l lân.
Một nghiên cứu ngẫu nhiên, đối chứng placebo, mù đôi, mù dạng thuốc, nhóm bắt chéo 4 giai
đoạn ở cảc đối tượng người lớn khỏe mạnh đã đánh giá các tác dụng lên nồng độ huyết tương
sau bữa ăn của GLP- ] toản phần và GLP- ] thể hoạt động, cũng như nồng độ glucose sau khi
uống sitagliptin kết hợp với metformin so với sau khi uông sitagliptin đơn độc, metformin đơn
độc, hoặc placebo trong 2 ngảy. Sự gia tăng nồng độ trung bình của GLP- ] thể hoạt động đo 4
giờ sau bữa an đã tăng gần 2 iần sau khi dùng hoặc sitagliptin đơn độc hoặc metformin đơn độc,
so với placebo. Tảc dụng lên nồng độ GLP- ! thể hoạt động sau khi dùng sitagliptin cùng
metformin đã tăng cộng lực, với nông độ GLP-l thể hoạt động tăng xấp xỉ 4 lần so với dùng
placebo. Sitagliptin đơn trị liệu chỉ lảm tăng nồng độ GLP- ] thể hoạt động, phản ánh sự ức chế
DPP-4, trong khi đó metformin đơn độc lảm tăng nổng độ GLP- 1 toản phẩm vả thể hoạt động ở
mức độ như nhau. Các dữ 1iệu nảy phù hợp vởi những cơ chế khảo nhau vê sự gia tăng nồng độ
GLP-l thể hoạt động. Kết quả từ nghiên cứu nảy cũng chứng minh sitagliptin, chứ không phải
8
- .<\°A
lf.í°Í -“Ì
metformin, Iảm tăng nồng độ GIP thể hoạt động.
Trong các nghiên cứu ở đối tượng khóe mạnh, JANUVIA không lảm giảm thấp đường huyết
hơn mức độ binh thường hoặc gây hạ đương huyết, điếu nảy gợi ý các tác động kích thích tiết
insulin vả ức chế glucagon của thuốc nảy hoản toản phụ thuộc vảo glucose.
Tác dụng lên huyết áp
Trong một nghiên cứu ngẫu nhiên, đối chứng placebo, nhóm bắt chéo ở bệnh nhân tăng huyết ảp
đang đùng một hoặc nhiếư thuốc trị tăng huyết ảp (bao gồm cảc cảc thuốc ức chế men chu ến
angiotensỉn, thuốc đối khảng angiotensin-II, ức chế kênh canxin, chẹn beta và lợi tieu),
JANUVIA dùng chung vởi cảc thuốc nảy thường dung nạp tốt. Ở các bệnh nhân nảy, JANUVIA
có tảo dụng giảm huyết ảp vừa phải; JANUVIA liếư 100 mg/ngảy lảm giảm mức huyết ảp tâm
thu trung binh đo di động suốt 24 giờ đến gần 2 mmHg, khi so với placebo. Tảo dụng giảm
huyết' ap nảy không xảy ra ở đối tượng có huyết ảp bình thường.
Điện tim W
Trong một nghiên cứu ngẫu nhiên, đối chứng placebo, nhóm bắt chéo trên 79 đối tượng khỏe
mạnh dùng một liếư đơn JANUVIA 100 mg, JANUVIA 800 mg (8 lần liếư khuyến cảo) vã
placebo. Ở liếư khuyến cáo 100 mg, không xảy ra tác động lên khoảng QTc khi thuốc đạt nông
độ đỉnh trong huyết tương, hoặc vảo bất kỳ thời điếm khác trong nghiến cứu. Sau khi dùng liếư
800 mg, mức độ tăng tối đa về sự thay đổi trung bình khoảng QTc hỉệu chỉnh theo placebo so
với mức ban đầu sau 3 giờ uống thuốc là 8, 0 msec. Sự gia tăng nhờ nây không được xem có ý
nghĩa lâm sảng. Ở liếư 800 mg, nồng độ đỉnh cứa sitagliptin huyết tương cao hơn gân 11 lần so
với nông độ đinh của liều 100 mg.
Ở bệnh nhân đái thảo đường tỷp 2 dùng JANUVIA 100 mg (N=81) hoặc JANUVIA 200 mg
(N=63) mỗi ngảy, khoảng QTc thay đội không có ý nghĩa dựa theo dữ liệu ECG tại thời điếm
đạt nồng độ đỉnh thường gặp trong huyết tương.
nUợc ĐỘNG HỌC
Dược động học của sitagliptin được nghiên cứu sâu rộng ở đối tượng khỏe mạnh và ở bệnh nhân
đải tháo đường tỷp 2. Ở đôi tượng khóe mạnh uống dùng ] liều 100 mg, sitagliptin được hấp thu
nhanh chóng đạt nồng độ đinh trong huyết tương (trung vị T,…) 1-4 giờ sau khi uống thuốc.
AUC cùa sitagliptin trong huyết tương gia tăng tương ứng theo liếu dùng. Ở người tình nguyện
khỏe mạnh sau khi ưông 1 liếư đơn 100 mg, AUC trung binh cùa sitagliptin trong huyết tương là
8, 52 ụM~giờ, Cmax lả 950 nM, vả nứa đời thải trừ cuôi cùng biếu kiến (tưz) lả 12,4 giờ AUC
cùa sitagliptin huyết tương tăng xấp xỉ 14% sau khi dùng các lỉếu 100 mg ở trạng thái bến vững
so với dùng liếư đầu tiên. Hệ sô tương quan về AUC của sitagliptin ờ tùng dối tượng và giữa cảc
đối tượng đếu nhỏ (5, 8% so với 15 ,1.%) Dược động học của sitagliptin nói chung đếu giống
nhau ở đối tượng khỏe mạnh vả ở bệnh nhân đải tháo đường týp 2.
Hấp thu
Sinh khả dụng tuyệt đối cùa sitagliptin khoảng 87%. Do uống thuốc trong bữa ăn nhiếư chất béo
không ảnh hưởng đên tảc động lên dược động học của JANUVIA dùng cùng lủc, nên có thể
dùng JANUVIA cùng hoặc không cùng với thức ăn (1ủc bụng no hoặc bụng đói).
Phân phổi
Thể tích phân phối trưng bình ở trạng thải bến vững sau khi dùng ] liều đơn sỉtagliptin 100 mg
đường tĩnh mạch ở đối tượng khỏe mạnh thì khoảng 198 lít. Tỷ lệ sitagliptin gắn kết thuận
nghịch với các protein huyết tương thì thấp (38%).
'z' \ầ\\
— _J'ầ
III
Chuyển hóa
Sitagliptin được đảo thải chủ yếu trong nước tiếu ở dạng không thay đồi và một phần nhỏ qua
đường chuyền hóa Gần 79% sitagliptin được thải trong nước tiếu ở dạng không thay đối.
Sau khi uống 1 liếư sitagliptin có đảnh dắu [ C], khoảng 16% chất có tính phóng xạ là các chất
chuyến hóa của sitagliptin. Sáu chất chuyến hóa nảy được phảt hiện ở nồng độ vết vả đuợc cho
là không liên quan đến hoạt tính ức chế DPP-4 huyêt tương của sitagliptin. Những nghiên cứu in
vitro đã chứng minh enzyme chủ yếu chịu trảch nhiệm cho sự chuyến hóa hạn chế cùa sitagliptin
lả CYP3A4, với sự góp phần cứa CYP2CS.
Thảitrừ ẨƯ
Sau khi cảc đối tượng khỏe mạnh uống 1 liếư sitagliptin [ 4C], khoảng 100% chất có tinh phóng
xạ được thải trong phân (13%) hoặc nước tiếu (87%) trong 1 tuần dùng thuốc. Nửa đời thải trừ
cuối cùng biếu kiến sau khi uông 1 liếư sitagliptin 100 mg thì xẩp xi 12,4 giờ và sự thạnh thải
qua thận khoảng 350 mL/phứt.
Sitagligtin được đảo thải ehủ yếu qua thận với sự bải tiết chủ động qua ống thận. Sitagliptin là 1
chất n n đối với chất chuyên chở anion hữu cơ 3 ở người (human organic anion transportcr-3:
hOAT- 3), vốn là chất có thể tham gia vảo sự thải trừ sitagliptin qua thặn. Vẫn chưa xác định
được sự liên quan lâm sảng cùa hOAT-3 trong vận chuyến sitagliptin. Sitagliptin cũng lả ] chất
nên của p-glycoprotein, mà chất nảy cũng có thể tham gia vâo quá trinh đảo thải sitagliptin qua
thận. Tuy nhiên, cyclosmrine, một chẩt ức chế p- glycoprotein không lảm giảm sự thanh thải
sitagliptin qua thận.
Các đặc tinh ở bệnh nhân
Suy thận: Một nghiên cứu mở liểu đơn, nghiên cứu mở được tiến hảnh đế đảnh giá dược động
học của JANUVIA (liếư 50 mg) ở các bệnh nhân suy thận mãn tính với cảc mức độ khác nhau so
với đối tượng khỏe mạnh, chức năng thận bình thường ở nhóm chứng. Nghiên cứu nảy gồm các
bệnh nhân phân loại suy thận phân theo dụa vảo hệ số thanh thải creatinine: nhẹ (50 - <80
mL/phứt), trung bình (30— <50 mL/phủt) và nặng (<30 mL/phút), cũng như cảc bệnh nhân có
bệnh thận giai đoạn cuôi đang được thẩm phân máu. Hệ sô thanh thải creatinine được đo qua sự
thanh thải creatinine trong nước tiếu 24 giờ hoặc được tính từ nồng độ creatinine huyết thanh
theo công thức Cockcroft-Gault:
cic1 [140 - tuổi (năm)] x thể trọng (kg) {x 0,85 đối với bệnh nhân nữ}
[72 x creatinine huyết thanh (mg/dL)]
Bệnh nhân suy thận nhẹ không tăng nổng độ sitagliptin huyết tương có ý nghĩa lâm sảng, so với
đối tượng khỏe mạnh, bình thường ở nhóm chứng. AUC của sitag1iptin huyết tương đã tăng
khoảng 2 lần ở bệnh nhân suy thận trung bình, và tăng khoảng 4 1ần ở bệnh nhân suy thận nặng
và ở bệnh nhân có bệnh thận giai đoạn cuối đang được thấm phân mảu, khi so với đối tượng
khỏe mạnh, bình thường ở nhóm chứng. Sitagliptin được loại bỏ vừa phải qua thấm phân mảu
(13,5% sau 3— 4 giờ thẩm phân mảu, bắt đầu thẩm phân sau khi uống thuốc được 4 giờ). Để đạt
nồng độ sitagliptin trong huyết tương tương tự như ở bệnh nhân có chức năng thận bình thường,
nên dùng liếư thấp hơn ở benh nhân suy thận trung binh và nặng, cũng như ở các bệnh nhân có
bệnh thận giai đoạn cuối cân thấm phân máu. (xem LIÊU LƯỢNG VÀ CÁCH DÙNG, Bệnh
nhản suy thận).
Suy gan: Ở bệnh nhân suy gan trung binh (điếm số Chi1d—Pugh 7- 9), giá trị trung bình AUC
vả Cm max của sitagliptin tăng, lẫn lượt, khoảng 21% và 13%, so với các nhóm chứng tương ứng
khóe mạnh sau khi dùng 1 liều đơn JANUVIA 100mg. Các khác biệt nảy được xem không có ý
nghĩa lâm sảng Không cần chỉnh liếư JANUVIA đối với bệnh nhân suy gan nhẹ hoặc trung
10
binh.
Không có kinh nghiệm lâm sảng ở bệnh nhân bị suy gan nặng (điểm số Child- -Pugh > 9). Tuy
nhiên, vì sitagliptin chủ yếu dược đảo thải qua thận, nên theo dự đoán suy gan nặng không tảc
động lên dược động học cùa sitagliptin.
Người cao tuổi: Không cần chỉnh liếư theo tuổi. Tuổi tảc không gây tác động có ý nghĩa iâm
sảng lên dược động học của sitagliptin dựa theo 1 phân tich dược độn học theo dân sô từ dữ
liệu giai đoạn 1 và giai đoạn II. Đoi tượng cao tuổi (65- -80 tuối) có nong độ sitagliptin huyết
tương cao hơn 19% so với đối tượng trẻ tuối hơn.
Trẻ em: Chưa có nghiên cứu JANUVIA tiến hảnh ở trẻ em. ửV
Giới tính: Không cẩn chinh liều theo giới tính. Giới tính không gây tảc động có ý nghĩa lâm
sảng lên dược động học của sitagliptin dựa theo 1 phân tích tổng hợp từ các dữ liệu dược động
học giai đoạn I vả theo 1 phân tích dược động học dân số từ dữ liệu lâm sâng giai đoạn I và II.
Chủng tộc: Không cần chỉnh liếư theo chủng tộc. Chúng tộc không gây tác động có ý nghĩa
lâm sảng lến dược động học của sitagliptin dựa theo 1 phân tích tổng hợp từ các dữ liệu dược
động học giai đoạn I và theo 1 phân tích dược động học dân số từ dữ liệu lâm sảng giại đoạn I
vả 11, bao gôm cảc đối tượng người da trắng, Tây Ban Nha, da đen, da vảng Châu Á và các
nhóm chủng tộc khảo.
Chỉ so khổi cơ thể (BMI): Không cần chỉnh liếư theo BMI. Chỉ số khối cơ thể không gây tảo
động có ý nghĩa lâm sảng lên dược động học của sitagliptin dựa theo 1 phân tích tống hợp tử
cảc dữ liệu dược động học giai đoạn I và theo 1 phân tỉch dược động học dân số từ dữ liệu lâm
sảng giai đoạn ] và 11.
Đải thảo đường týp 2: Dược động học của sitagliptin ở bệnh nhân đải thảo đường tỷp 2 thường
tương tự như ở đối tượng khỏe mạnh.
SỬ DỤNG QUÁ LIÊU
Trong những thử nghiệm lâm sảng có đối chứng người khóc mạnh, JANUVIA liếư đơn đến 800
mg được dung nạp tốt. Trong một nghiên cứu dùng liều 800 mg JANUVIA, khoảng QTc tăng rất
ít và không liẽn quan đến lâm sảng (xem DƯỢC LÂM SÀNG, Dược lực học, Điện tim). Chưa
có kinh nghiệm sử dụng cảc liếư cao hơn 800 mg ở người. Trong các nghiến cứu giai đoạn 1 về
chế độ nhiếư liều trong ngảy, người ta không tìm thấy các phản ứng bất lợi trên lâm sảng iiên
quan đến liếư khi dùng JANUVIA đến iiều 600 mg/ngảy trong 10 ngảy và 400 mg/ngảy đến 28
ngay
Trong trường hợp quá liếu, nến áp dụng cảc biện pháp hỗ trợ thường dùng, như loại bỏ chất chưa
kịp hấp thu khỏi đường tiêu hóa, theo dõi trên lâm sảng (bao gồm lảm điện tâm đồ) vả trị liệu
nâng đỡ, nểu cần.
Sitagliptin có thể được thấm tảch vừa phải. Trong nghiên cửu lâm sảng, khoảng 13,5% liếư dùng
được loại bỏ sau 3-4 giờ thẩm phân mảu. Có thế xem xét thẩm phân mảu kéo dải nếu phù họp
trên lâm sâng. Vẫn chưa biết rõ thẩm phân phủc mạc có thế thầm tảch được sitagliptin hay
không.
BÁO QUÁN
Bảo quản ở nhiệt độ dưới 30°C (86°F).
]]
IM!
~m. ụ,
\\ n\
HẠN DÙNG
36 thảng kế từ ngảy sản xuất.
DẠNG TRÌNH BÀY
JANUVIA 25 mg: Hộp 2 vi x 14 viến nén bao phim.
JANUVIA 50 mg: Hộp 2 ví x 14 viên nén bao phim.
JANUVIA 100 mg: Hộp 2 ví x 14 viên nén bao phim.
THUỐC NÀY cụi DÙNG THEO ĐơN CỦA BÁC sỹ. ĐỌC KỸ HƯỚNG DĂN sứ DỤNG
TRỤớC_ Kffl DUNG, NGAY_CÁ KHI BẠN ĐÃ DUNG THUỐC NÀY THEO ĐơN CỦA
BAC sv TRƯỚC ĐỎ. NÊU CAN THÊM THONG TIN, XIN HỎI Ý KIÊN BÁC SỸ.
XIN LƯU Ý RĂNG THUỐC NÀY ĐƯỢC CHỈ ỳĐỊNH CHO cÁ NHÂN BẠN. KHÔN
ĐƯỢC ĐƯA THUỐC NÀY CHO NGƯỜI KHAC SƯ DỤNG. ĐỂ XA TẨM TAY TRẺ EM.
Sân xuất bởi: W
Merck Sharp & Dohme Limited
Shotton Lane, Cramlington, Northumberland, NE23 3JU, United Kingdom (Anh)
Đóng gỏi và xuất xưởng bởi:
PT. Merck Sharp & Dohme Pharma Tbk
JI. Raya Pandaan Km. 48 Pandaan, Pasuruan, Jawa Timur, Indonesia
12
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng