











omth— %
lO'VXS 01 95
0151
1l-JIl-lS-ú1
Ế
L'ỌYT
—1
1“
!
(TỤC QUẢN LÝ DƯỢC
DUYỆT
Lăn đauôjẮo/Ấ ạ/
E
ĐA PH
xx.ẵ.Ễ .uẳ
Ế: .6 9. .B
.… ẵớ.nãz Ế iẵz %
«Ễẫẵsẵồbẫ
ẵzo
……N … mơn_F_ o
n.…ocouc. ...ỄF …ẫ—
.:ễầuu .:3vcể nv .Ex ẫẵẵa Ễ .:.
Ể Ễẵ sẵ8 E.ẫ Ểo:.ỉ
Ế …ễ... .…3 @ Ê mãoỀ vẵẫ uc… EỂ.…
ìẵ ẫầẵ EỄ. ,:R …ũz
ỂỂBEESz .ẵỉ.ễu .uẵ ãẻã
ẫỄẵỀozẳ
Q…Ễuỗbzỉuẵ
lqu›ểẵpẫẵ
...a 03 :wă LbH ....mỎ.
....0uẵ. wa …xm 9 0… d: .me
.Fề Ế… cầ ou ẽ€ e ễỡ %…
.ễ. .ẫ. …:...ẫ Ế aẵ... e Ê.. s….
…xẵ :: 9.9: …0 a› 89. ãE .:ẵ
z… ….Ễu Ểẳ 58 ….> ?ẵ :! .Ễẹ …6
ẵằaoẵ m.: 8… aỄẵ 23132ẫ
.ỄỀỄu …o sụn!
..ẵ !.Ỉ. : ẫ ỏi:
…Ễ Ế… .ỄỀ vẫưẽẵ: sẫỄ…… mE ….mE đ.ỗ E..â cẵ 5: ẵ› Ễ
cẳâ %
ae 8… sẽ.….ẵ
nnauzaăag.
…o :6 8cẫqu oẵx
8: Ồ ….
…ụUENFMN
( ồE oầ cẵ:mGẽ …
ơEOOp .zpủaco—n Ớo ….
M B
zbo o….ẫ zn3ẳềầỡ?
nẵ.ũ…ẫưẵczư
ẩmẵoaễuẫ.ẳv
%… on:…ễwmẫ
…mn unnnẳbẵíổ QRcỂ.
_ ' 2 .…— l 1 l [ |
11 1.01 NO, 2 l.UT NO 1 1.01 ND.
JANUVIA" JANU VIA'“ JANUVIA“ JANUVIA“ JANUVIN'“ JINUVIA“
100 mg 11111111! 111] mg Tablet 100 mg Tablet 100 mg Tablet 1110 m Tlhlet 1110 mu lelct
{IIIuIlulll úunlull (III: lllplln nlmulm (dlullnllu uhnmhail (li1ullplln nomluln Islhnllulln pmspmln lslllollplln nhosnhllc
euưnllnl In 1110 mu luiulznl 1l 1011 ra; llulule 01 In 100 nm luulullnl II 100 mg luulullnl In 100 mg :quhtllcltl tn 1110 mu
:l1lullụlln) lilqllulln] lltl|llplln} illlululu] :lunlInlln] sllullmln]
Ồ _ 0 … 0 1- 0 m 0 m 0 im
.IANUVIA'" JINUVIA'“ .IANUVII'“ JANUVIẦ'" JANUVIA" .IINU1IWu
100 mu Taulet 100 mg Tablet 100 m Talilct 100 mg lelet 100 m 15111111 100 nm Tablet
lilllỊlllllll ul0ụllln [Il1llllulln ụlll:uhlll lilIlnllplll plmplllla {sllullulln n1luulutl lslllgllnlln uhl:nhlll lllllqliulln uhnanll
lqllullnt tu 100 mg nuululunl In 1110 m lqululllnl 1: 11111 mu uuluiunl II 100 mg 001110 nlut 111 1011 m lqulnlnnl 111 1011 m
sllưlptlnl sllllllplln] :lllnliulllị im11ụlln] tlhnllplln] :lllallpllil
0 … o … 0— 0 lu m …
JANUVIA“ JANUVIA“ JANUVIA“ JANUVII’" JANUVIA“ JANUVIA“
100 mg le1111 101] m Blilet 11… ml ĩalilet 100 mg T:blet 100 ml Tahlet 100 mu Table1
ullullulh phunlulu tslllnllnlln uilsuhlll ltlllglln1tli muamlu tsllllllnlll nhlwhzll |slugllnlln uhosnMn 1sllanlluln pluphm
00111111in II 1110 m| lqululcnl 111 101) mg luulưlllnt In 100 m| uululclll II 100 mg lnuhllcnl II 1110 m lnuMllnl In 1110 nu
sltullulnl lltlnllplll1] sllullutln] :11u11111111] :Hullallll] ll1ulipliul
0 m 9 un Ồ uu: o … o un 0 m
JANUVIA“l JANUVIA“ JANUVIA" JANUVIA“ JANUVIA“ JANUVIA“
100 mg ĩahlll 101] mu Tahlel …! mu hhlel 100 mg ĩlblet 1011 1111 Ĩlblli 100 mg Ialtlcl
(:lunllmln nunuln (summn nmsnhnlu Isllullnlln uluulllc (:ltnllnlln IIIIIIIIMI [slhnllplln nncuth (sl1anllplln nlnpluh
euuMllnl In 100 nm lullullnt 111 1011 ml uqnlulenl … 1110 III uulualut ll 1011 mu lquuln1 ll 1110 uu unulutcnl ll 1011 uu
:lilull 011 11] :lIlnllulln) :lllg 11111111] dtullullll] :l1ul lullnl mullu1m]
e m 0 m 0 nm o . 0 …: o …
JANUVIA” JANU VW" JANUVIA“ JANUVIA“ .IANUVIA'“ JANUVII"
100 mu Talilul 100 m Taulet 100 nm Tuhlel 100 mg lelet 100 mg Tnblel 100 nm T:hlel
[:lllqliplll otncnlllo l:ỉqllplln allomllh |dllullnlln phamlluo |sllullulln dlllnhlh lzlllnllnlln uhnxuh'h ml:ulhlln nhnsnhllu
mllvlllnl In 1110 1111; ullulcnl II 1011 nu uuluIlnl 10 100 nu laulullơll Il 100 mg lqulnlul In 1011 In oqululul II 101] ml
sluqunn1 smlimlnt mullpllnz :11lullalln] sncmiplmị sllllllpllnl
0 n 0 m 0 . @ mo 0 mo 0 m
JANUVIA“ JINUVIA'“ JANUVIA“ JANUVIA” JANUVIA“ JANUVII’“ ,
100 mg Tablet 100 mu Tablet 100 mg Tihlct 100 mg Tahlet 100 mg Tahlel 100 m
(mulldln Molle: isllulluliu nhu:nhuln 1:111n11u011 Mun… 1slllqlipln dìusnlml l:llnnllntlli mm… 1dlullplll
Olululul In 1110 mu eqululunl la 100 III] I011111 llutl II 1110 mu lơịlNltưnl In 1110 m lnulnlul In 100 mg
slllll lull I) 1111 ullplln] :ltlnllnlh] 11 Iull alln) :lunl lụll:J
o … e … 0 m e _ 0 m
JANUVIN" .111110111I"Il .IANUVII'” JRNUVIA“ JANUVIA“
100 mg Tahlel 100 mg ĩiblet 100 mg Tlhlet 100 mg 1101111 1110 mu Tllllel
(llhlllpllll msmn (111qu1u11n mum III (slllnlinln Mnsnhlll ltlllullnln mm… lzlủnllnlln l11omllh
Iullưllllli In 1110 m euululul lu 100 mi nqulullnl In 1110 m luululnnl 111 100 mi lnululnl m 1110 na
sl1lnllullnl slllnllpllnl :lllnllullu] slllnllplln] lltlnl lu1lnl
0 no 0 m @ @ un 0 …
EXP. DAĩE EXP. DAÌE ỂXP DATE _ vỳ
] , 1 1 | ” `
Ẻ xxxxxxxxxx E xxxxxxxxxx Ẹ xxxxxxxxxx
0431-VNM-2013-007406
WPC-MKO43l-T-MZỦ] 4
J ANUVIATM
Viên nén bao phim
(sitagliptin phosphate)
NHÓM TRỊ LIỆU
JANUVIA* (sitagliptin phosphate) lả thuốc ức chế mạnh, chọn lọc cao trên enzyme dipeptidyl
peptidase 4 (DPP- 4), có hiệu lực ở dạng uống dùng để diều trị bệnh đải thảo đường týp 2. Các
thuốc ức chế DPP—4 là 1 nhóm thuốc có tác dụng lảm tăng nổng độ incretin. Bằng cách ức chế
enzyme DPP-4, sitagliptin lảm tăng nồng độ cùa 2 hormone incretin hoạt động đã được biết rõ,
là peptide giống glucagon ] (glucagon- -like peptide l: GLP-l) vả polypeptide kích thích tiểt
insulin vả phụ thuộc vảo glucose (glucose-dependent insulinotropic polypeptide: GIP). Các
hormone incretin nảy lả thảnh phần của hệ thống nội sinh tham gia điều hòa sinh lý tình trạng
cân bằng nội mội glucose. Khi nồng độ glucose trong mảu bình thường hoặc tăng cao, GLP-l vả
GIP ]ảm tăng tống hợp và phóng thỉch insulin tù cảc tế bảo beta tuyến tụy. GLP-l cũng lảm
giảm tiết glucagon tù cảc tế bảo alpha tuyến tụy, dẫn dển giảm sản xuất glucose tại gan. Cơ chế
nảy không giống như cơ chế tác dụng của cảc sulfamid hạ đường huyết, các sulfamid hạ đường
huyết gây phóng thích insulin ngay cả khi nồng độ glucose thấp, điều nảy có thể dẫn đến hạ
đường huyết do sulfamid hạ dường huyết ở bệnh nhân đái tháo đường týp 2 và ở người bình
thường. Sitagliptin là một chất ức chế mạnh, rất chọn lọc enzyme DPP—4 và không ức chế các
enzyme liên quan gần lả DPP-8 hoặc DPP-9 ở cảc nồng độ điếu trị. Sitagliptin có cấu trúc hóa
học và tác dụng dược lý khác với các chất tương tự GLP- 1, insulin, sulfamide hạ đường huyết
hoặc nhóm meglitinides, bỉguanỉdes, chất chủ vận thụ thể gamma được hoạt hóa bởi yếu tố tăng
trường peroxisome (peroxỉsome proliferator-activated receptor gamma -PPARy), các chất ức chế
alpha-glucosidase và các chất tương tự amyiin.
THÀNH PHẨN Cf7
Mỗi viên nén bao phim JANUVIA chứa 32,13 mg, 64,25 mg hoặc 128,5 mg sitagliptin phosphat
monohydrat, tương đương với 25 mg, 50 mg hoặc 100 mg, theo thứ tự, dạng base tự do.
Tá dược
Hoạt chẩt
Mỗi viên nén bao phim JANUVIA chứa các tá dược sau đây: cellulose vi tỉnh thề, anhydrous
dibasic calci phosphat (calci hydrogen phosphat dạng khan), croscarmellose natri, magnesi
stearat vả natri steary] fumarat. Ngoài ra, lớp bao phim chứa cảc tả dược sau đây: polyvinyl
alcol, polycthylene glycol (macrogol), talc, titan dioxyd, sắt oxyd mảu đỏ và sắt oxyd mảu vảng.
CHỈ ĐỊNH
Đơn lr_í liệu
JANUVIA được dùng như 1iệu pháp hỗ trợ cho chế độ ăn kiêng và vận động thế lực để cải thiện
kiếm soát đường huyết ở bệnh nhân đái tháo đường týp 2.
Kết hợp với Metformin
JANUVIA được chỉ định ở bệnh nhân đải tháo đường týp 2 đề cải thiện kiếm soát đường huyết
bằng cảch kết hợp với metformin như liệu pháp ban đầu hoặc khi metformin đơn trị liệu cùng
chế độ ăn kiêng và vận động thể lục không kiếm soát được đường huyết thích đảng.
Kết họp với một suỊfamid hạ đường huyết
JANUVIA được chỉ định ở bệnh nhân đải tháo đường týp 2 đề cải thiện kiểm soát đường huyết
bằng cách kết hợp với sulfamid hạ đường huyết đơn trị liệu cùng chế độ ăn kiêng và vận động
thế lực không kiếm soát được đường huyêt thích đảng.
Kết hợp với chất chủ vận PPARy
JANUVIA được chỉ định ở bệnh nhân đái thảo đường týp 2 để cải thiện kiểm soát đường huyết
bằng cách kết hợp với chất chủ vận PPARy (như nhóm thiazolidinediones) khi chất đồng vận
PPARy đơn trị liệu cùng chế độ ăn kiêng và vận động thế lực không kiếm soát được đường
huyết thích đảng.
Kết họp vởi Megjbrmin và một sulfamide hạ đường huyết
JANUVIA được chỉ định ở bệnh nhân đải thảo đường týp 2 để cải thiện kiểm soát đường huyết
bằng cảch kết hợp với metformin và một sulfamide hạ đường huyết khi hai loại thuốc nây cùng
chế dộ ăn kiêng và vận động thế lực không kiếm soát được đường huyết thích đáng.
Kểt hạp với Metformin và một chất chủ vận PPARy
JANUVIA được chỉ định ở bệnh nhân đải tháo đường tỷp 2 đề cải thiện kiếm soát đường huyết
bằng cách kết hợp với metformin vả một chất chủ vận PPARy (như thiazolidinediones) khi hai
loại thuốc nảy cùng chế độ ăn kiêng và vận động thể lực không kiếm soát được dường huyết
thích đảng.
Kết họp với Insulin
JANUVIA được chỉ định ở bệnh nhân đải thảo đường tỷp 2 như một liệu phảp hỗ trợ cho chế độ
ãn kiêng vả vận động thể lực để cải thiện kiềm soát đường huyết khi dùng kết hợp với insulin
(cùng hoặc không cùng metformin).
LIÊU LƯỢNG VÀ CÁCH DÙNG
Liều JANUVIA khuyến cảo là 100 mg, ngảy ] lần khi dùng như đơn trị liệu hoặc kết hợp với
metformin, sulfamide hạ đường huyết, insulin (cùng hoặc không cùng metformin), chất chủ vận
PPARy (như thiazolidinediones), hoặc metformin cùng sulfamide hạ đường huyết hoặc có thể
dùng metformin cùng chất chủ vận PPARy. Có thế uông JANUVIA cùng hoặc không cùng với
thức an.
Khi dùng JANUVIA kết hợp với sulfamide hạ đường huyết hoặc insulin, có thể xem xét dùng
sulfamide hạ đường huyết hoặc insulin liều thấp hơn nhằm giảm nguy cơ hạ đường huyết do
sulfamide hạ đường huyết (xem THẶN TRỌNG, Hạ đường huyết khi kết họp với sulfamide hạ
đường huyết hoặc insulin).
Bệnh nhăn suy thận
Đối với bệnh nhân suy thận nhẹ (hệ số thanh thải creatinine [CrCl]_ > 50 mL/ phủt, gần tương
ứng với creatinine huyết thanh < 1,7 mg/dL ở nam và < 1,5 mg/dL ở nữ), không cần chỉnh liều
JANUVIA.
~ x'-JÌ\ m`
Đối với bệnh nhân suy thận trung bình (CrCl > 30 đến < 50 mL/phút, gần tương ứng với
creatinine huyết thanh > 1,7 đến < 3,0 mg/dL ở nam và > 1,5 đến _<_ 2 ,5mg/dL ở nữ), iiều
JANUVIA lả 50 mg ngảy ] lần.
Đối với bệnh nhân suy thận nặng (CrCl <30 mL/phủt, tương ứng với creatinine huyết thanh
khoảng >3, 0 mg/dL ở nam vả >2, 5 m gldL ở nữ) hoặc có bệnh thận giai đoạn cuối cần thẳm tảch
máu hoặc thẩm phân phúc mạc, liếư JANUVIA là 25 mg ngảy ] lằn. Có thể dùng JANUVIA bẩt
kỳ lủc nảo, không lỉên quan đến thời điếm thẩm tảch mảu.
Vì có sự chinh liều dựa vảo chức`năng thận, theo khuyến cảo nên đánh giá chức nảng thận trưởc
khi khởi đầu điêu trị và sau đó kiêm tra định kỳ.
CHỐNG CHỈ ĐỊNH
Chống chỉ định dùng JANUVIA ở bệnh nhân quả mẫn với bất kỳ thảnh phần nảo của thuốc
(xem THẶN TRỌNG, Phản' ưng mẫn cảm vả TAC DỤNG PHỤ, Kinh nghiệm hậu mãi)
THẶN TRỌNG
T ống quát ọ/
Không nến dùng JANUVIA ở bệnh nhân dái thảo đường týp 1 hoặc để điều trị nhiễm acid
ceton ở bệnh nhân đái thảo dường.
Viêm tụy: Về kinh nghiệm hậu mãi, đã có cảc báo cáo về viêm tụy cấp, bao gồm viêm tụy xuất
huyết hoặc hoại tử gây tử vong và không gây tử vong (xem TÁC DỤNG PHỤ, Kinh nghiệm
hậu mãi) ở bệnh nhân dùng sitagliptin. Vì cảc báo cáo nảy được thực hìện tự nguyện từ một
dân sô chưa rõ cỡ mẫu, nên thường không thể ước tính chẳc chắn tần suất của tác dụng phụ
hoặc thiết lập được quan hệ nhân—quả do sử dụng thuốc. Nên cho bệnh nhân biết trỉệu chứng
đặc trưng của viêm tụy cấp là đau bụng dữ dội và liên tục. Viêm tụy được ghi nhận hồi phục
sau khi ngưng dùng sỉtagliptìn. Nếu nghi ngờ viêm tụy, nến ngưng dùng JANUVIA và các
thuốc khảc có thế liên quan.
Sử dụng ở bệnh nhân suy thận: JANUVIA được đảo thải qua thận. Để đạt nồng độ JANUVIA
trong huyết tương tương tự như ở bệnh nhân có chức năng thận bình thường, nến giảm liếư
thuốc ở bệnh nhân suy thận trung bình vả nặng, cũng như ở bệnh nhân có bệnh thận giai đoạn
cuối (ESRD) cẩn thầm phân máu hoặc thẩm phân phúc mạc (xem LIÊU LƯỢNG VÀ CÁCH
DÙNG, Bệnh nhăn suy thận. )
Hạ đường huyết khi dùng liệu pháp kết họp với sulfamide hạ đường huyết hoặc insulin Trong
các thử nghiệm lâm sảng với JANUVIA theo đơn trị liệu vả theo trị liệu kết hợp với cảc thuốc
được biết rõ không gây hạ đường huyết (như metformin hoặc chất chủ vận PPARy
(thiazolidinediones)), tỷ lệ cảc báo cảo hạ đường huyết khi dùng JANUVIA tương tự như ở
bệnh nhân dùng placebo. Giống như các thuốc trị tăng đường huyết khảc, đã quan sát thấy hạ
đường huyết khi dùng JANUVIA kết hợp với insulin hoặc sulfamide hạ đường huyết (xem
TÁC DỤNG PHỤ). Do đó, để giảm nguy cơ hạ đương huyết do SU vả insulin, có thể xem xét
giảm liều SU hoặc insulin (xem LIÊU LƯỢNG VÀ CÁCH DÙNG).
Phản ứng quá mẫn. Đã có các bảo cảo hậu mải về những phản ứng quá mẫn nghiếm trọng ở
bệnh nhân dùng JANUVIA. Các phản ứng nảy bao gổm phản ứng phản vệ, phù mạch và các
bệnh lý tróc da kể cả hội chứng Stevens-Johnson. Vì cảc phản ứng nảy được báo cảo tự nguyện
từ dân số chưa biết rõ cỡ mẫu, nên thường không thể ước tính chắc chắn tần suất hoặc xảc lập
mối quan hệ nhân uả với việc sử dụng thuốc Cảo phản ứng nảy bắt đầu xuất hiện trong 3
thảng đẳu sau khi băt đầu điếu trị với JANUVIA, với vải bảo cảo xảy ra sau liếư đầu tiên. Nếu
nghi ngờ có phản ứng quá mẫn, phải ngưng dùng JANUVIA, đảnh giả cảc nguyên nhân tiếm
tảng khác và bắt đầu cảc trị liệu thay thể vẽ bệnh đái thảo đường. (xem CHỐNG CHỈ ĐỊNH
vả TÁC DỰNG PHỤ, Kinh nghiệm hậu mãi).
PHỤ NỮ có THAI
Sitagliptin khộng có khả năng gây quải thai ở chuột cống khi dùng liều đến 250 mg/kg hoặc ở
thỏ với liều đến 125 mg/kg trong giai đoạn hình thảnh cảc cơ quan (tương ứng đến 32 iần và 22
lần, lượng dung nạp ở người dựa theo liếư đề nghị hâng ngảy ở người iởn là 100 mg/ngảy). Ờ
chuột công, tỷ lệ biến dạng xương sườn thai nhi (không có xương sườn, xương sườn giảm sản và
chưỗi hạt sườn) tăng nhẹ được ghi nhận khi chuột mẹ dùng liếu 1.000 mg/kg/ngảy (khoảng 100
lần lượng dung nạp ở người dựa theo liếư đề nghị hảng ngảy ở người lớn lả 100 mg/ngây). Khi
chuột cống mẹ dùng liều uống 1.000 mg/kglngảy, cân nặng trung bình cùa chuột con cả 2 giống
đực và cải trước khi thôi bú và sự tăng cân cùa chuột đực con sau khi thôi bú đến giảm nhẹ. Tuy
nhiên, những nghiên cứu về sự sinh sản ở động vật không phải lúc nảo cũng dự đoán được đảp
ưng ở người.
Vì không có những nghiên cứu đầy đủ vả đối chứng tốt ở phụ nữ có thai, nên chưa biết rõ tính an
toản của JANUVIA ở phụ nữ có thai Như cảc thuốc uống trị tăng đường hưyết khác, không
khuyến cảo sử dụng JANUVIA trong thai kỳ.
PHỤ NỮ CHO CON BÚ
Sitagliptin được bải tiết vảo sữa chuột cống mẹ. Vẫn chưa biết rõ sitagliptin có bải tiết vảo sữa
người hay không. Do đó, không nên dùng JANUVIA cho phụ nữ đang cho con bủ.
sử DỤNG ở TRẺ EM
Chưa xác lập tính an toản và hiệu lực của JANUVIA ở bệnh nhi dưới 18 tuổi.
SỬ DỤNG ờ NGƯỜI CAO TUỔI
Trong các nghiến cứu lâm sâng, tính an toản và hiệu lực của JANUVIA ở người cao tuổi (_ 65
tuổi) tương tự như ở bệnh nhân trẻ tuổi hơn (<65 tuổi). Không cần chinh liếư theo độ tuối. Bệnh
nhân cao tuổi có nhiếư khả nãng suy thận hơn; như các bệnh nhân khác, có thế cần chinh liều khi
có suy thận đảng kể (xem LlẾU LƯỢNG VÀ CÁCH DÙNG, Bệnh nhản suy thận).
TƯỢNG TÁC THUỐC
Trong cảc nghiên cứu tương tảo thuốc, sitagliptin không gây tảc động có ý nghĩa lâm sảng lên
dược động học cùa cảc thuốc sau đây: metformin, rosiglitazone, giyburide, simvastatỉn, warfarin
và viên uông trảnh thai. Dựa vâo cảc dữ liệu nảy, sitagliptin không ức chế các isozyme CYP lả
CYP3A4, 2C8,_hoặc 2C9. Dựa vảo dữ liệu in vitro, người ta cho rằng sỉtagliptin cũng không có
tảo dụng ức chế CYP2D6, IA2, 2C 19 hoặc 2B6, hoặc cảm ứng CYP3A4.
Dùng metformin liều lặp lại ngảy 2 lần cùng với sitagliptin không lảm thay đổi có ý nghĩa dược
động học của sitagliptin ở bệnh nhân đải tháo đường týp 2.
Cảo phân tích dược động học theo dân số đã được tiến hảnh ở bệnh nhân đái thảo đường tỷp 2.
Những thuốc dùng đổng thời không gây tảc dụng có ý nghĩa lâm sảng lên dược động học của
sítagliptin. Những thuốc được đảnh giả lả thuốc dùng phổ biến ở bệnh nhân đái tháo đường tỷp
2, bao gôm cảc thuốc trị tăng cholesterol máu (như statins, fibrates, ezetimibe), thuốc khảng tiếu
cầu (như cloffldogrel), thuốc trị tăng huyết ảp (như thuốc ức chế ACE, chẹn thụ thể angiotensin,
chẹn beta, ức chế kênh canxi, hydrochlorothiazide), thuốc giảm đau và khảng viêm không
steroid (như naproxen, diclofenac, celecoxib), thuốc trị trầm cảm (như bupropion, fluoxetine,
sertraline), kháng histamine (như cetirizine), ức chế bơm proton (như omeprazole, lansoprazole),
4
vả các thuốc trị rối loạn cương dương (như sildenafil).
Diện tích dưới đường cong vả trung bình nồng độ đinh cùa digoxin tăng nhẹ (AUC, 11% và
Cmax 18%) khi dùng cùng sitagliptin, mức độ tăng nảy không được xem là có ý nghĩa lâm sảng.
Nên giám sảt bệnh nhân đang dùng digoxin cho thích hợp. Không khuyến cảo điếu chinh liếư
digoxin hay JANUVIA.
Khi cho đối tượng nảy uống một liếư đơn JANUVIA 100 mg cùng với một 1ỉều đơn cyclosporin
600 mg, vốn là chất ức chế mạnh p- glyc0protein, AUC vả Cmax của sitagliptin tăng xấp xỉ 29%
vả 68 %. Những thay đổi nảy trong dược động học của sitagliptin được xem không có ý nghĩa
lâm sảng. Không khuyến cáo điều chinh liều JANUVIA khi dùng chung vởi cyclosporine hoặc
các chất ưc chế p— —glycoprotein khảo (như ketoconazole).
TÁC DỤNG PHỤ fi»
JANUVIA thường được dung nạp tốt trong cảc thử nghiệm lâm sảng có đối chứng the phác đồ
đơn trị liệu và điếu trị kết hợp, với tỷ lệ dối tượng ngưng điếu trị do các tảc dụng bẩt lợi trên lâm
sảng thì tương tự như nhóm dùng placebo.
Trong 4 nghiên cứu iâm sảng đối chứng placebo, dùng thuốc theo phác đồ dơn trị liệu (một
nghiên cứu kéo dải 18 tuần và một nghiên cứu kéo dải 24 tuần) vả phảc đồ ket hợp với
metformin hoặc pioglitazone (cả hai nghiên cứu kéo dải 24 tuẫn), có 1.082 bệnh nhân dùng
JANUVIA 100 mg, ngảy ] iần vả 778 bệnh nhân dùng placebo (trong đó có hai nghiên cứu bao
gồm 456 bệnh nhân dùng JANUVIA 200 mg mỗi ngảy, gâp 2 lần lỉều khuyến cảo dùng mỗi
ngảy). Không có báo cảo về cảc phản ứng bẩt lợi do thuốc `xảy ra với tần suất > 1% ở bệnh nhân
dùng JANUVIA 100 mg. Nói chung, hồ sơ an toản của liễu 200 mg mỗi ngảy cũng giống như
liếư 100 mg mỗi ngảy.
Trong một phân tích đã định trước tổng hợp từ cảc nghiến cứu trên, tần suất chung về tác dụng
bất lợi hạ đường huyết ở bệnh nhân điếu trị với JANUVIA 100 mg tương tự như nhóm dùng
placebo (1,2% so với 0 ,9%). Tác dụng bất lợi về hạ đường huyết dựa vảo tất cả cảc báo cáo về
hạ đường huyết, không cân đo đường huyết 1ủc xảy ra sự kiện. Tần suất cảc tác dụng bất lợi
chọn lọc ở đường tiêu hóa ở bệnh nhân dùng JANUVIA hoặc placebo: đau bụng (JANUVIA,
2,3%; placebo, 2 ,,1%) buồn nôn (1 ,4%; 0,6%), nôn (0,8%; 0 ,9%) và tiêu chảy (3,0%; 2 ,.3%)
Trong tất cả cậc nghiên cứu, phản ứng bẩt lợi về hạ đường huyết được_dựa trên tất cả bảo cảo về
hạ đường huyết có triệu chứng; không yêu cần đo glucose cùng thời điêm xảy ra phản ứng.
Bổ sung vâo liệu pháp kểt hợp với Sulfamid hạ đường huyết. Trong một nghiên cứu đối chứng
placebo, kéo dải 24 tuần với JANUVIA 100 mg kết hợp với glimepiride hoặc với glimepiride vả
metformin (JANUVIA, N= 222, placebo, N= 21,9) hạ đường huyết là phản ứng bất lợi liên quan
đến thuốc được ghi nhận > 1% bệnh nhân dùng JANUVIA vả xảy ra phố biển hơn so với bệnh
nhân dùng placebo (JANUVIA, 9,5%; placebo, 0 ,.9%)
Bổ sung vảo liệu phảp kết hợp với metformin vả một chất chủ vận PPARy. Trong một nghiên
cứu đối chứng placebo, dùng chung JANUVIA 100 mg với metformin vả rosiglitazone
(JANUVIA, N= 170; Placebo,N =92), phản ứng bẩt lợi liên quan đến thuốc được ghi nhận tại
thời điếm đầu tiên vâo tuần thứ 18 > 1% ở bệnh nhân được điều trị với JANUVIA và với tần
suất xảy ra phổ biến hơn so vởì bệnh nhân dùng placebo lả nhức đầu (JANUVIA, 2,4%; placebo:
0 ,,0%) tiêu chảy (1, 8%; l. 1%), buồn nôn (1,2%; 1,,1%) hạ đường huyết (1 ,2%; 0 ,0%) và nôn
(1, 2%; 0 ,.0%) Qua tuần 54, phản ứng bất lợi liên quan đến thưốc được ghi nhận > 1% ở bệnh
nhân dùng JANUVIA vả xảy ra phổ biến hơn bệnh nhân dùng placebo lả nhức đầu (2, 4%;0 ,0%),
hạ đường huyết (2,4%; 0 ,0%), nhiễm trùng đường hô hấp trên (1,8 %; 0 ,0%), bưồn nôn (1,2%;
1 ,,1%) ho (1,2%; 0 ,0%), viêm da do nâm (1,2%; 0 ,0%), phủ ngoại biên (1,2%; 0 ,0%) và nôn
(1,2%;0,0%).
5
² êỉ Áả`ll
\\®.\ -—
Khới đẩu liệu pháp kết hợp với Metformin: Trong 1 nghiên cứu đa biến số, đối chứng placebo,
kéo dải 24 tuẫn với khởi đâu điếu trị với sitagliptin 100 mg kết hợp với mctformin liều 1000 mg
hoặc 2000 mg/ngảy (dùng sitagliptin 50 mg/metformìn 500 mg hoặc 1 000 mg ngảy 2 lần), các
phản ứng bẩt lợi liên quan đến thuốc được bảo cáo ở > 1% bệnh nhân dùng sitagliptin cùng
metformin (N=372) vả xảy ra phổ biến hơn so với bệnh nhân dùng metformin đơn trị liệu
(N=364) lả: tiêu chảy (sitagliptin cùng metformin, 3,5%; metformin, 3 3%), khó tiêu (1,3%;
1,1%), đầy hơi (1,3%;0,5%), nôn (1,1%; 0,3%) vả nhức đầu (1, 3%; 1,1%) Tần suất hạ đường
huyết lả 1,1% ở bệnh nhân dùng sitagliptin kết hợp với metformin vả 0,5% ở bệnh nhân chỉ
dùng metformin
Khới đồn liệu phảp kết họp với chất chủ vận PPARy. trong ] nghiến cứu kéo dải 24 tuần khởi
đầu trị 1iệu với JANUVIA liếư 100 mg/ngăy kết hợp pioglitazone iiều 30 mg/ngảy, chỉ có 1 phản
ứng bẩt lợi lỉên quan đến thuốc được bảo cảo ờ > 1% bệnh nhân dùng JANUVIA cùng
pioglìtazone fN= 261) và xảy ra phổ biến hơn so với bệnh nhân dùng pioglitazone đơn thuần
(N=259) là hạ đường huyết không có triệu chứng (1,1% khi JANUVIA kết hợp pioglitazone và
0% khi dùng pioglitazone). Tần suất hạ đưòng huyết có triệu chứng là 0,4% ở bệnh nhân dùng
JANUVIA kết hợp vởi pioglitazone và 0, 8%' 0 bệnh nhân dùng pioglỉtazone. |
Bổ sung vảo liệupháp kết hợp với Insulin: trong 1 nghiên cứu đối chứng placebo kéo tỉải 24 tuần
với JANUVIA 100 mg kết hợp với liều insulin cố định (cùng hoặc không cùng metformin), cảc
phản ứng bất lợi liên quan đến thuốc được bảo cáo ở > 1% bệnh nhân dùng JANUVIA (N=322)
vả xảy ra phổ biến hơn ở bệnh nhân dùng placebo (N=319) lâ: hạ đường huyết (JANUVIA,
9 ,6%; placebo, 5 3,°/,o) bệnh cúm(l, 2%, 0 ,3%) và nhức đầu (1, 2%; 0 ,0%). Trong 1 nghiên cứu
kẻo dải 24 tuần khảo, bệnh nhân được thếm JANUVIA vảo lỉệu phảp insulin tích cực (cùng hoặc
không cùng metformin), cảc phản ứng bắt lợi không liến quan đến thuốc được báo cáo ở _>.l%
bệnh nhân dùng JANUVIA 100 mg vả xảy ra phố bìến hơn ở bệnh nhân dùng placebo.
Viêm zụy: Trong một phân tich tổng hợp từ 19 thử nghiệm lâm sảng thiết kế mù đôi vởi dữ lỉệu
của 10. 246 bệnh nhân dùng ngẫu nhiên sitagliptin 100 mg/ngảy (N=5. 429) hoặc thuốc so sảnh
tương ứng (thuốc có hoạt tính hoặc placebo) (N=4. 817), tần suất viếm tụy cấp lả 0,11100 bệnh
nhân- năm ở mỗi nhóm (4 bệnh nhân có 1 tác dụng bất lợi trong số 4 708 bệnh nhân-năm đối với
sitagliptin vả 4 bệnh nhân có 1 tác dụng bất lợi trong số 3. 942 bệnh nhân-nărn đối với thuốc so
sánh). (xem THẶN TRỌNG, Vỉêm tụy).
Không tim thấy bất ký thay đối có ý nghĩa lâm sảng về dẳu hiện sinh tồn hOặc điện tâm đồ (bao
gồm khoảng QTc) ở bệnh nhân dùng JANUVIA.
Kinh nghiệm hậu mãi:
Cảc phản ứng bẩt lợi bổ sung sau đây được nhận biết trong quả trinh sử dụng JANUVIA theo
phảc đồ đon trị liệu vả/hoặc kết hợp với các thuốc hạ đường huyết khảo trên thị trường Vì các
phản ưng nảy được bảo cáo tự nguyện từ dân số chưa biết rõ cỡ mâu, nến thường không thể ước
tính chẳc chắn tần suất hoặc xảo lập mối quan hệ nhân quả vởi việc sử dụng thuốc.
Cảo phản ứng quá mẫn gồm phản ứng phản vệ, phù mạch, phát ban, mề đay, viêm mao mạch
và cảc bệnh lý gây tróc da kể cả hội chứng Stevens-Johnson (xem CHỐNG CHỈ ĐỊNH vả
THẬN TRỌNG, Phản ứng quá mẫn); viêm tụy cấp, bao gồm viêm tụy xuất huyết và hoại tử
gậy tử vong và không gây từ vong (xem THẶN TRỌNG, Viêm tựy); giảm chức năng thận bao
gôm suy thận cấp (đôi khi cần thẩm phân); viêm đường hô hẩp trên; viêm mũi—họng; tảo bón;
nôn; nhức đầu; đau khơp; đau cơ; đau tứ chi; đau lưng
TIỤ—IÔNG BÁO CIjO BẢC SỸ NHỮNG TÁC DỤNG KHÔNG MONG MUÔN GẶP PHÁ] KHI
SƯ DỤNG THUOC.
\\ a\ Z'\ I
Các phát hiện về xét nghiệm
Tần suất các tác dụng bất lợi về kết quả xét nghiệm ở bệnh nhân dùng JANUVIA 100 mg tương
tự ở bệnh nhân dùng placebo. Trong cảc nghiên cứu lâm sảng chéo (across clinical studies),
lượng bạch cầu tăng nhẹ (khác biệt xấp xỉ 200 tế bảo bạch câu /microL so với placebo; lượng
bạch cầu trung binh ban đầu xâp xi 6.600 tế bảo/microL) do tăng bạch cầu trung tính. Điếu nây
dược phảt hiện ở hầu hết nhưng không phải ở tất cả cảc nghiên cứu. Sự thay đối các thông số xét
nghiệm nảy được xem không liên quan đến lâm sảng.
TẢC ĐỌNG CÙA THUỐC LÊN lfflẢ NĂNG LÁ] XE VÀ VẬN HÀNH MÁY MÓC
Chưa thực hiện các nghiên cứu về tác động của JANUVIA lên khả năng lái xe và vận hảnh máy
móc. Tuy nhiên, người ta cho rằng JANUVIA không ảnh hưởng đển khả năng lái xe vả vận hảnh
máy mỏc.
DƯỢC LỰC HỌC Ọ/
Cơ chế tác động
JANUVIA thuộc nhỏm thuốc uống trị tảng đường huyết, gọi là chất ức chế dipeptidyl peptidase
4 (DPP— 4) có tác dụng cải thiện đường huyễt ở bệnh nhân đái tháo đường týp 2 bằng cảch 1ảm
tăng nổng độ các hormone incretin thể hoạt động. Các hormone incretin bao gồm peptide giống
glucagon l (glucagon-like peptide—l: GLP- -1) và polypeptide kích thích tiết insulin và phụ thuộc
vâo glucose (glucose- -dependent insulinotropic polypeptide: GIP), được phóng thích từ ruột suốt
ngảy, và tăng nồng độ đảp ưng với bữa ăn. Cảo hormone incretin nảy 1â thảnh phần của hệ thống
nội sỉnh tham gia vảo sự điếu hòa sinh lý tình trạng cân bằng nội môi glucose. Khi nông độ
glucose bình thường hoặc tăng cao, GLP- ] and GIP lảm tăng sự tống hợp và phóng thích insulin
từ các tế bảo beta tuyến tụy qua các đường truyền tín hiệu nội bảo liến kết với AMP vòng.
Người ta đã chứng minh việc điếu trị với cảc chất ức chế GLP—l hoặc với DPP-4 các mô hinh
động vật bị đái tháo đường týp 2 đã lảm cải thiện đã ứng của tế bảo beta đối với glucose và
kích thích sinh tồng hợp và phóng thích insulin. Sự haếjp thu vả sử dụng giucose tại mỏ gia tảng
khi nồng độ inSulin cao hơn. Ngoài ra, GLP-l lảm giảm tiết glucagon từ tế bảo alpha tuyến tụy.
Nồng độ glucagon giảm cùng với nồng độ insulin cao hơn dẫn đến giảm sản xuất glucose tại
gan, gây giảm nông độ glucose trong mảu. Các tảc dụng nảy của GLP— ] vả GiP phụ thuộc vảo
glucose, vì vậy khi nồng độ glucose trong mảu thấp, sự kích thích phóng thích insulin vả ức chế
tiết glucagon do GLP- 1 không xảy ra. Đối với cả hai GLP- ] vả GIP, khi nồng độ glucose cao
hơn mức bình thường thì sự kích thích phóng thích insulin gia tăng. Hơn nữa, GLP- 1 không lảm
suy giảm đáp ứng bình thường của glucagon đối với tinh trạng đường huyết thẩp. Hoạt tính của
GLP- 1 vả GIP bị hạn chế bởi enzyme DPP- 4, đây là enzyme nhanh chóng thùy phân các
hormone incretin thảnh các chất khộng hoạt tính. Sitagliptin ngăn ngửa DPP—4 thủy phân các
hormone incretin, do đó lảm tăng nông độ cảc dạng hoạt tính của GLP- 1 và GIP trong huyết
tương. Bằng cảch tăng nồng độ incretin dạng hoạt động, sitagliptin lâm tãng phóng thích insulin
và giảm nông độ glucagon theo cách thửc phụ thuộc vảo glucose. Ở bệnh nhân dái thảo đường
tỷp 2 có tình trạng tăng đường huyết, sự thay đổi nồng độ insulin vả glucagon nảy dẫn đến giảm
nông độ hemoglobin Alo (HbAlc) vả nông độ glucose lúc đói và sau khi ăn. Cơ chế phụ thuộc
vảo glucose nảy khảc biệt vởi cơ chế tảc dụng của các Sulfamid hạ đường huyết; cảc sulfamid hạ
đường huyết Iảm tăng tiết insulin ngay cả khi nồng độ glucose thấp và có thể dẫn đến hạ đường
huyết ở bệnh nhân đái tháo đường týp 2 và ở đối tượng bình thường. Sitagliptin lả ] chất ức chế
mạnh, chọn lọc cao trên enzyme DPP-4 và không ức chế các enzyme liên quan gần lả DPP- 8
hoặc DPP- 9 ở các nồng độ điếu trị.
Dược lực học
..
Tổng quát
Ó bệnh nhân đải tháo đường týp 2, các liếư đơn JANUVIA dẫn đến ức chế hoạt tính của DPP- 4
trong 24 giờ, gây tăng nông dộ GLP- 1 vả GIP thể hoạt động trong mảu đến 2- 3 lần, tăng nổng độ
insulin và C— —peptide trong huyểt tương, giảm nồng độ glucagon, giảm glucose lúc đói, và giảm
dung nạp giucose sau khi uông glucose hoặc sau bũa ăn.
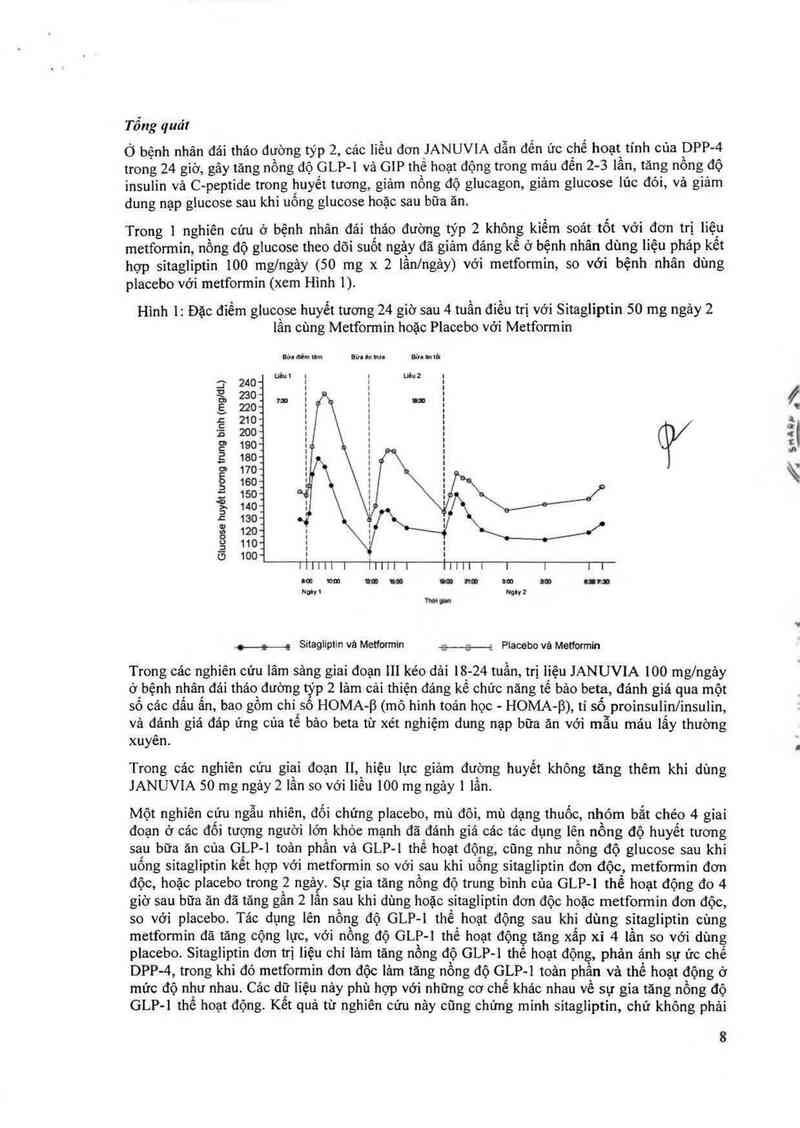
Trong 1 nghiên cứu ở bệnh nhân đải tháo đường týp 2 không kiềm soát tốt vởi đơn trị liệu
metformin, nông độ glucose theo dõi suốt ngả_y đã giảm đảng kế ở bệnh nhân dùng liệu pháp kết
hợp sitagliptin 100 mglngảy (50 mg x 2 lần/ngảy) vởi metformin, so với bệnh nhân dùng
placebo với metformin (xem Hinh 1).
Hình 1: Đặc điếm giucose huyết tương 24 giờ sau 4 tuần điều trị với Sitagliptin 50 mg ngảy 2
lần cùng Metformin hoặc Placebo vởỉ Metformin
lủl dn tâm Bừl In lun Bín In lù
uủt uủ2
zao {
230 j
220 :
2101
2001
190:
180:
1701
160:
150:
140j
1301
120: :
110: ;
100“ '
|
I
|
1
I
l
1
:
I
I
|
I
|
I
I
|
I
«
M
lillll ] [ 1111 1 | Ĩ [ |
I I
um nm tu tu ou no mm un :ltn
nm | Ngiv ›
nmpm
Glucose huyêt tương trung blnh (mg/dL)
H._g Sitagliptin vả Metformin +s—z Placebo vá Metformin
Trong các nghiến cứu lâm sảng giai đoạn 111 kéo dải I8- 24 tuần, trị iiệu JANUVIA 100 mg/ngảy
ở bệnh nhân đải thảo đường týp 2 lảm cải thiện đảng kể chức năng tế bảo beta, đánh giả qua một
số cảc dấu ản, bao gốm chỉ sô HOMA- B(mô hinh toán học- HOMA- 13), tỉ số proinsulin/insulin,
và đánh giá đáp ứng của tế bảo beta từ xét nghiệm dung nạp bữa ăn với mẫu máu lấy thường
xuyên
Trong các nghiên cứu giai đoạn 11, hiệu lực giảm đường huyết không tăng thêm khi dùng
JANUVIA 50 mg ngảy 2 lần so với liếư 100 mg ngảy 1 lằn.
Một nghiên cứu ngẫu nhiên, đối chửng placebo, mù đôi, mù dạng thuốc, nhóm bắt chéo 4 giai
đoạn ở cảc đối tượng người lón khỏe mạnh đã đánh giá các tảc dụng lên nống độ huyết tương
sau bữa ăn của GLP-l toản phần và GLP- ] thể hoạt động, cũng như nổng độ glucose sau khi
uống sitagliptin kết hợp với metformin so với sau khi uông sitagliptin đon độc, metformin đơn
độc, hoặc placebo trong 2 ngả. Sự gia tãng nồng độ trung binh của GLP-l thể hoạt động đo 4
giờ sau bữa ăn đã tăng gẩn 2 1an sau khi dùng hoặc sitagliptin đơn độc hoặc metformin đơn độc,
so với placebo. Tảc dụng lên nồng độ GLP- 1 thể hoạt động sau khi dùng sitagliptin cùng
metformin đã tăng cộng lực, với nồng độ GLP-l thể hoạt độn tăng xẩp xỉ 4 lần so với dùng
placebo. Sitagliptin đơn trị liệu chỉ lảm tăng nỗng độ GLP- 1 thế hoạt động, phản ảnh sự ức chế
DPP- 4, trong khi đó metformin đơn độc Iảm tăng nồng độ GLP-1 toản phần và thể hoạt động ở
mức độ như nhau. Các dữ liệu nảy phù hợp với những cơ chế khác nhau vê sự gia tăng nông dộ
GLP-l thế hoạt động. Kết quả từ nghiên cửu nảy cũng chứng minh sitagliptin, chứ không phải
8
Ả *"ếi" a\
mctformin, lảm tăng nồng độ GIP thể hoạt động.
Trong cảc nghiên cứu ở đối tượng khóe mạnh, JANUVIA không lảm giảm thắp đường huyết
hơn mức độ bình thường hoặc gãy hạ đường huyết, điếu nảy gợi ý cảc tảc động kích thích tiết
insulin vả ức chế glucagon cùa thuốc nảy hoản toản phụ thuộc vảo glucose.
Tác dụng lên huyết áp
Trong một nghiên cứu ngẫu nhiến, đối chứng placebo, nhóm bắt chéo 0 bệnh nhân tăng huyết’ ạp
đang dùng một hoặc nhiếư thuốc trị tăng huyết ảp (bao gồm cảc các thuốc ức chế men chuyến
angiotcnsin, thuốc đối kháng angiotcnsin- I-l, ức chế kênh canxin, chẹn beta và lợi tiếu),
JANUVIA dùng chung với cảc thuốc nảy thường dung nạp tốt Ở các bệnh nhân nảy, JANUVIA
có tác dụng giảm huyết ảp vừa phải; JANUVIA lìếu 100 mg/ngảy lảm giảm mức huyết áp tâm
thu trung binh đo di động suốt 24 giờ đến gần 2 mmHg, khi so vởi placebo. Tảo dụng giảm
hưyết ảp nảy không xảy ra ở đối tượng có huyết ảp bình thường.
Điện tim
Trong một nghiên cứu ngẫu nhiên, đối chứng placebo, nhóm bắt chéo trên 79 đối fượng khỏe
mạnh đùng một liều đơn JANUVIA 100 mg, JANUVIA 800 mg (8 lần liều khuyến cảo) vả
placebo. Ở liếư khuyến cáo 100 mg, không xảy ra tác động lên khoảng QTc khỉ thuốc đạt nông
độ đinh trong huyết tương, hoặc vảo bất kỳ thời điểm khảo trong nghiên cứn. Sau khi dùng liếư
800 mg, mức độ tăng tối đa về sự thay đối trung bình khoảng QTc hiệu chỉnh theo piaccbo so
với mức ban đầu sau 3 giờ uống thuốc là 8, 0 msec. Sự gia tăng nhỏ nảy không được xem có ý
nghĩa lâm sảng Ở liều 800 mg, nồng độ đỉnh của sitagliptin huyết tương cao hơn gần 11 lần so
với nông độ đinh của liếư 100 mg
Ở bệnh nhân đái thảo đường týp 2 dùng JANUVIA 100 mg (N=81) hoặc JANUVIA 200 mg
(N=63) mỗi ngây, khoảng QTc thay đối không có ý nghĩa dựa theo dữ liệu ECG tại thời điếm
đạt nông độ đinh thường gặp trong huyết tương.
DƯỢC ĐỌNG HỌC
Dược động học cùa sitạgliptin được nghiên cứu sâu rộng ở đối tượng khỏe mạnh và ở bệnh nhân
đảí tháo đường týp 2 0 đôi tượng khỏe mạnh uống dùng ] liếư 100 mg, sitagliptin được hấp thu
nhanh chóng đạt nồng độ đỉnh trong huyết tương (trung vị Tmax) 1-4 giờ sau khi uống thuốc
AUC cùa sitagliptin trong huyết tương gia tảng tương ứng theo liếư dùng. Ở người tình nguyện
khóe mạnh sau khi ưông 1 liếư đơn 100 mg, AUC trung bình cùa sitagliptin trong huyết tương là
8, 52 ụM—giờ, Crnax lả 950 nM, vả nứa đời thải trù cuôi cùng biếu kiến (tin) lả 12,4 giờ. AUC
của sitagliptin huyết tương tãng xấp xỉ 14% sạn khi dùng các liếư 100 mg ở trạng thải bến vững
so vởi dùng liều đầu tiên Hệ sô tương quan về AUC của sitagliptin ơ từng đối tượng và giũa các
đối tượng đều nhỏ (5, 8% so với 15,1%) Dược động học cùa sitagliptin nói chung đếu giống
nhau ở đối tượng khóc mạnh vả ở bệnh nhân đái tháo đường tỷp 2.
Hẩp thu
Sinh khả dụng tuyệt đối của sitagliptin khoảng 87%. Do uống thuốc trong bữa an nhìếu chẩt béo
không ảnh hưởng đến tác động lên dược động học cùa JANUVIA dùng cùng lúc, nên có thể
dùng JANUVIA cùng hoặc không cùng vởi thức an (Iủc bụng no hoặc bỤng đói).
Phân phối
Thế tich phân phổi trung bình ở trạng thải bến vững sạu khi dùng 1 liếư đơn sitagliptin 100 mg
đường tĩnh mạch ở đối tượng khỏe mạnh thì khoảng 198 lít. Tỷ lệ sitagliptin găn kết thuận
nghịch với các protein huyết tương thì thẳp (38%).
\OA
//ớ`/..
Chuyển hóa
Sitagliptin được đảo thải chủ yếu trong nước tiếu ở dạng không thay đối và một phần nhỏ qua
đường chuyến hóa Gần 79% sitagliptin được thải trong nước tiến ở dạng không thay đối
Sau khi ưống l liếư sitagliptin cớ đảnh dấu [ 4C], khoảng 16% chẳt có tinh phóng xạ là các chắt
chuyển hóa cùa sitagliptin. Sáu chẩt chuyến hóa nảy được phát hiện ở nồng độ vết vả được cho
là không liên quan đến hoạt tính ức chế DPP-4 huyết tương cùa sitagliptin Những nghiên cứu in
vilro đã chứng minh cnzyme chủ yếu chịu trách nhiệm cho sự chuyến hỏa hạn chế của sitagliptin
lả CYP3A4, với sự góp phần của CYP2CS
Thải trừ
Sau khi cảc đối tượng khỏe mạnh uống ] liếư sitagliptin [ C], khoảng 100% chất có tính phóng
xạ được thải trong phân (13%) hoặc nước tiếu (87%) trong 1 tuần dùng thuốc. Nửa đời thải trừ
cưối cùng biếu kiến sau khi uông l liếư sitagliptin 100 mg thì xấp xỉ 12,4 giờ vả sự thanh thải
qua thận khoảng 350 mL/phút.
Sitạgli tin dược đảo thải chủ yếu qua thận với sự bải tiểt chủ động qua ống thận. Sitagliptin là 1
chẩt nên đối với chất chuyên chở anion hữu cơ 3 ở người (human organic anion tran5porter-3:
hOAT- -3), vốn 1ả chất có thể tham gia vảo sự thải trừ sitagliptin qua thận. Vẫn chưa xảo định
được sự lỉến quan lâm sảng của hOAT-3 trong vận chuyến sitagliptin. Sitagliptin cũng lả 1 chất
nến cùa p-glycoprotein, mả chẳt nảy cũng có thể tham gia vảo quá trình đảo thải sitagliptin qua
thận Tuy nhiên, cyclosporine, một chẩt ức chế p- glycoprotein không lảm giảm sự thanh thải
sitagliptin qua thận. CÝV
Các đặc mm ở bệnh nhân
Suy thận: Một nghiên cứu mở liếư đơn, nghiên cứu mở được tỉến hảnh đế đảnh giả dược động
học của JANUVIA (liều 50 mg) ở các bệnh nhân suy thận mãn tính với cảc mức độ khảo nhau so
với đối tượng khỏe mạnh, chức năng thận bình thuờng ở nhỏm chứng. Nghiên cứu nảy gồm cảc
bệnh nhân phân loại suy thận phân theo dựa vảo hệ số thanh thải creatinine: nhẹ (50 - <80
mL/phủt), trung bình (30- <50 mL/phút) và nặng (<30 mprhứt), cũng như các bệnh nhân có
bệnh thận giai đoạn cuôi đang được thẩm phân máu. Hệ sô thanh thải creatinine được đo qua sự
thanh thải creatinỉnc trong nước tiếu 24 giờ hoặc được tính từ nồng độ creatinìnc huyết thanh
theo công thức Cockcroft-Gault:
1 [140 - tuối (năm)] x thể trọng (kg) {x 0,85 đối với bệnh nhân nữ}
CrC =
W x creatinine huyết thanh (mg/dL)]
Bệnh nhân suy thận nhẹ không tãng nồng độ sitagliptin huyết tương có ý nghĩa lâm sảng, so với
đối tượng khỏe mạnh, bình thường ở nhóm chứng. AUC của sitagliptin huyết tương đã tăng
khoảng 2 lần 0 bệnh nhân suy thận trung bình, và tăng khoảng 4 lần ở bệnh nhân suy thặn nặng
và ở bệnh nhân có bệnh thận giai đoạn cuối đang được thẩm phân mảu, khi so với đối tượng
khỏe mạnh, bình thường ở nhóm chứng Sitagliptin được loại bỏ vùa phải qua thẩm phân máu
(13,5% sạn 3- 4 giờ thẩm phân mảu, bắt đầu thẩm phân sau khi uống thuốc được 4 giờ). Để đạt
nông độ sitagliptin trong huyết tương tương tự như ở bệnh nhân có chức năng thận bình thường,
nên dùng liếư thấp hơn ở bệnh nhân suy thận trung binh và nặng, cũng như ở các bệnh nhân có
bệnh thận giai đoạn cuối cần thẩm phân máu. (xem LIÊU LƯỢNG VÀ CÁCH DÙNG, Bệnh
nhân suy thận).
Suy gan: Ở bệnh nhân suy gan trung bình (điếm số Child-Pugh 7- 9), giá trị trung binh AUC
vả Cmax của sitagliptin tãng, lần lượt, khoảng 21% và 13%, so với các nhỏm chứng tương ứng
khóe mạnh sau khi dùng 1 lìếu đơn JANUVIA lOOmg Các khác biệt nảy được xem không có ý
nghĩa lâm sảng. Không cần chỉnh liếư JANUVIA đối với bệnh nhân suy gan nhẹ hoặc trung
10
" \ỉ\\
U`
'>w
;,
//7
bình.
Không có kinh nghỉệm lâm sảng ở bệnh nhân bị suy gan nặng (điếm số Child- -Pugh > 9). Tuy
nhiên, vì sitagliptin chủ yếu được đảo thải qua thận, nên theo dự đoán suy gan nặng không tác
động lên dược động học của sitagliptin.
Người cao tuổi: Không cần chỉnh liều theo tuổi. Tuổi tảc không gây tảo động có ý nghĩa lâm
sảng lên dược động học của sitagliptin dựa theo 1 phân tích dược động học theo dân số từ dữ
liệu giai đoạn I vả giai đoạn II. Đoi tượng cao tuổi (65 80 tuổi) có nông độ sitagliptin huyết
tương cao hơn 19% so với đối tượng trẻ tuổi hơn
Trẻ em: Chưa có nghiên cứu JANUVIA tiến hảnh ở trẻ em. qi/
Giới tính: Không cần chinh liều theo giới tính. Giới tính khộng gây tác động có ý nghĩa lâm
sảng lên dược động học của sitagliptin dựa theo 1 phân tích tông hợp từ cảc dữ liệu dược động
học giai đoạn I và theo 1 phân tích dược động học dân số tù dữ liệu lâm sâng giai đoạn I và II.
Chủng tộc: Không cẳn chinh lìếu theo chủng tộc. Chủng tộc không gây tảc động có ý nghĩa
lâm sảng lên dược dộng học của sitagliptin dựa theo 1 phân tich tồng hợp từ các dữ liệu dược
động học giai đoạn 1 vả theo 1 phân tích dược động học dân số tù dữ liệu lâm sảng giai đoạn I
vả 11, bao gổm cảc đối tượng người da trắng, Tây Ban Nha, da đen, da vảng Châu Á vả các
nhóm chủng tộc khảo.
Chỉ số khối cơ thể (BMI): Không cần chinh liều theo BMI. Chỉ số khối cơ thể không gây tác
động có ý nghĩa lâm sảng lến dược động học của sitagliptin dụa theo 1 phân tich tống hợp từ
cảc dữ liệu dược động học giai đoạn ] vả theo 1 phân tích dược động học dân số từ dữ liệu lâm
sâng giai đoạn I và II.
Đái tháo đường týp 2: Dược động học của sitagliptin ở bệnh nhân đái thảo đường tỷp 2 thường
tương tự như ở đối tượng khỏe mạnh.
SỬ DỤNG QUÁ LIÊU
Trong những thử nghiệm lâm sảng có đối chứng người khỏe mạnh, JANUVIA liếư đơn đến 800
mg được dung nạp tốt. Trong một nghiên cứu dùng liếư 800 mg JANUV1A, khoảng QTc tăng rất
it và không liên quan đến lâm sảng (xem DƯỢC LÂM SÀNG, Dược lực học, Điện tim). Chưa
có kinh nghiệm sử dụng các liếư cao hơn 800 mg ở người. Trong cảc n hiên cứu giai đoạn 1 về
chế độ nhỉếu liếư trong ngây, người ta không tìm thấy cảc phản ứng bât lợi trên lâm sảng liên
quan đển lỉếu khi dùng JANUVIA đến liếư 600 mg/ngảy trong 10 ngảy vả 400 mg/ngảy đen 28
ngảy.
Trong trường hợp quá iiếu, nên ảp dụng cảc biện pháp hỗ trợ thường dùng, như loại bỏ chất chưa
kịp hấp thu khỏi đường tiêu hóa, theo dõi trên lâm sảng (bao gôm lảm điện tâm đồ) và trị liệu
nâng đỡ, nếu cần
Sitagliptin có thế được thẩm tách vừa phải. Trong nghiên cứu lâm sảng, khoảng 13 ,5% liều dùng
được loại bỏ sau 3—4 giờ thẩm phân mảu Có thể xem xét thấm phân mảu kéo dải nếu phù hợp
trên lâm sảng. Vẫn chưa biết rõ thấm phân phủc mạc có thế thấm tách được sitagliptin hay
không.
BẢO QUẢN
Bảo quản ở nhiệt độ dưới 30°C (86°F).
11
HẠN DÙNG
36 tháng kế từ ngảy sản xuất.
DẠNG TRÌNH BÀY
JANUVIA 25 mg: Hộp 2 ví x 14 viên nén bao phim.
JANUVIA so mg: Hộp 2 ví x 14 viên nén bao phim. q/
JANUVIA 100 mg: Hộp 2 ví x 14 viên nén bao phim.
THUỐC NÀY cni DÙNG THEQ ĐON CỦA BẶC sỹ. ĐỌC KỸ HƯỘNG DÃN SỬ DỤNG
TigƯớC KHI pUNợ, N_GAY_CA KIjI BẠN ĐA DUNG THUỐC NAY THEO ĐON CỦA
BAC SỸ TRƯOC ĐO. NEU CAN THEM THÔNG TIN, XIN HỎI Ý KIẾN BÁC SỸ.
XIN LƯU Ý RẤNG TẸUÒC NÀY ĐƯỢC cui _ĐỊNH CHO CÁ NHÂN BẠN. KHÔNG
ĐƯỢC ĐƯA THUOC NAY CHO NGƯỜI KHAC SƯ DỤNG. ĐỂ XA TÀM TAY TRẺ EM.
Sản xuất bởi:
Merck Sharp & Dohme Limited
Shotton Lane, Cramlỉngton, Northumberland, NE23 3JU, United Kingdom (Anh)
Đóng gỏi và xuất xưởng bới:
PT. Merck Sharp & Dohme Pharma Tbk
Ji. Raya Pandaan Km. 48 Pandaan, Pasuruan, Jawa Timur, Indonesia
TUQ. CUC Tp, u"o NG
P.TRUÙNG PHÒNG
Jiỷuyẻn quy eĩffỵânỹ
12
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng