


















Ruxolmmb
...—ơ“
Ê1l5lffl.UllMd \
ny IM om. Đo:
Ruxolitinib
tablets | comprimủs | comprimidos
ỂìJAMU»JF
14 tablets | comprimés |comprimidos
/ ²~Ễ gJAKAvr
“C. Store … the origmal package.
_ ch and sight of chndren
' ct subject to med»cal prescription
For oral use | voie orale / via oral
BỘ Y TẾ
CL'C Ql'ẢN' LÝ DLÌ’O'C
14 tablets | comprlmés | comprim1dos
kỷ hưònn ein … aụnq u…u … dùng
-v . HD. 50 … SX … 'MFD'. 'EXP', 'LOT` lríu Inn bl
Nguy MI hun u nqùy 01 cún lhlnn Mí nan In lrIn bn hl
Bln nuln nm ma …: molnn mm. ớ nmi oc unonq uul su'c em muée Irunq mo hi oôc
Sln :uửl tu Nova; Phlrml Smin AG. Scrnlfnnuuuluue 4112 Slein, Thuy Sĩ.
…: uth nqu:
cbcmũnq tin thư n'n dọc ưunq lơ huơnq dln sử dung kèm 1… Hot thíc min về sử mAm IM vui ìùnq
u0l1l00555541
@
…: 15 mg mnllmib (Quửl uong ruwlillmb phosưm] HOp1 vi ~ 14 vl0n nén
-xx cm dư…. …… dùng ehónq eni dlnh; xin doc uong lờ mom dln sứ uvnu
i
(nguỵ dẸqu ỊLM nes u
Manufactuer by Nova…s Pharma Stein AG, Slem Switzerland Im Novams Pharma AG, Bas|e Swttzerland i
Fabnquệ par Nova…s Pharma Sư.… AG, Stem` Sursse pour Nuvams Phavma AG. Eale, S…sse
Fabriudo pơr Novams Pharma Siem AG, Stem Sun1a nau Nơvams Pharma AG_ Basnlea, S…za
ẹp anp)
ĐĂPHỆDỤỸẸT
ýlLân dí…:..Z9...r’.…QZẮJ…ZOAỈ.…
mld UẺHN
an… ư issizzai
TVT mpnlbh
ya ne
fflEl
FS_SMIIìJSII1IÌSI
Ilourtll Ph
Fonlsize
techmcal
Used Font
’rodun
Ailenil No.
kplaced No.
',euntly
Tode No.
)imensnon
anlng No.
Foldan INJẦKAVIJAIJSMG 1X14,012
21154I0_U12
²112501111]
U12
2115400
75 I 11 | 132 mm
10000101049I0
m.a.tonno
ìec. Edge Marks 1154I0
chutll
Order Flle
64I661_50|
connm manufmurer
5qu
Png 1 c! 1
Typophuma a 103307
Colnurs
additionil
umn Suln AG
nu… pclmtm
5 m
Tudo Gothic
IlItk
(yul | Mngcnu/
hntonc 4!1 (
Fun!an 1665 (
hmuno 7447
Vunish Fưu
(utltng | Guides
1 . pmof
2. proof 30.01.2013 Im
3. prool
4. pm!
5. proof
é. pm!
11.01.2013 kh
Ủ Fơeiglbelreleue
Ionektur nutwendig/
Ủ coutan nequừed
Bemnkung/temuk
Dawm/dale: Unlmdưlh/signnlurt
Appmvll Iu cnly le bo fillod In tuc AWF ỉl nm used
M`ng ngljni: mmuưnpt
ocecrdlng le 50P-0022667.
To lu mg… by AwOpn.
Tochnlnl mfvnl.
To be dgned by Mnnuhciurlnq SIIo.
Fì_F—\ _Ì
fì
| n
SỒIOMỊW
Aepseum
) » Ọip……) bỌ
lb raovuns
:pmw
sauưw
Azpsanl
@
Ểẵ
:E'
2 ẵ ›°ẵ
~_ :»
ỂỂg o ẵES
aaa ả ẹeẹ
-…= …, …a-e
ỉ
Ế
15.02.12 13:31:12
Approval Bon only to be fillod In uu AWF is not used
Checking against manuscript
according to SOP-0022667.
To be signed by AwOps.
Technical approval.
To be signed by Manufacturing Site,
— / _
I 1. _\. O ffl f ,“x. ị "'
i ' ` i claẮìẵri- )
Anpumỉị ’
ẻ°
DAI D lẸ _ ă - _. Ộ
TAI THỹxNH PHO .— ẫ "Ê
- .,e , o _ ~ ~ -. ỉ o _
Hoghimmu,…,_ ư , ỀỄỄ
_, G u. ’›
S …
, @ ú
ả L
- ẵ fNr ẮỀ
. t'› uovums
“ả ẽỉ'Ễ' ễễề
n 3 3
,ả m …
m ›
E Ê ' Ữ Ơý V
9 u… ạ _
T“ 01 †“
.. _ g . S
; Ê A ~ ~.s.z * ' Ọ
“9 E F Pỉ ẵ t gẵ
u.. :. ; 0 v 5 :
'3 a = a ẵ g ra về
" 8 3 0 8 6
1 .
' saoms_mzmou 1
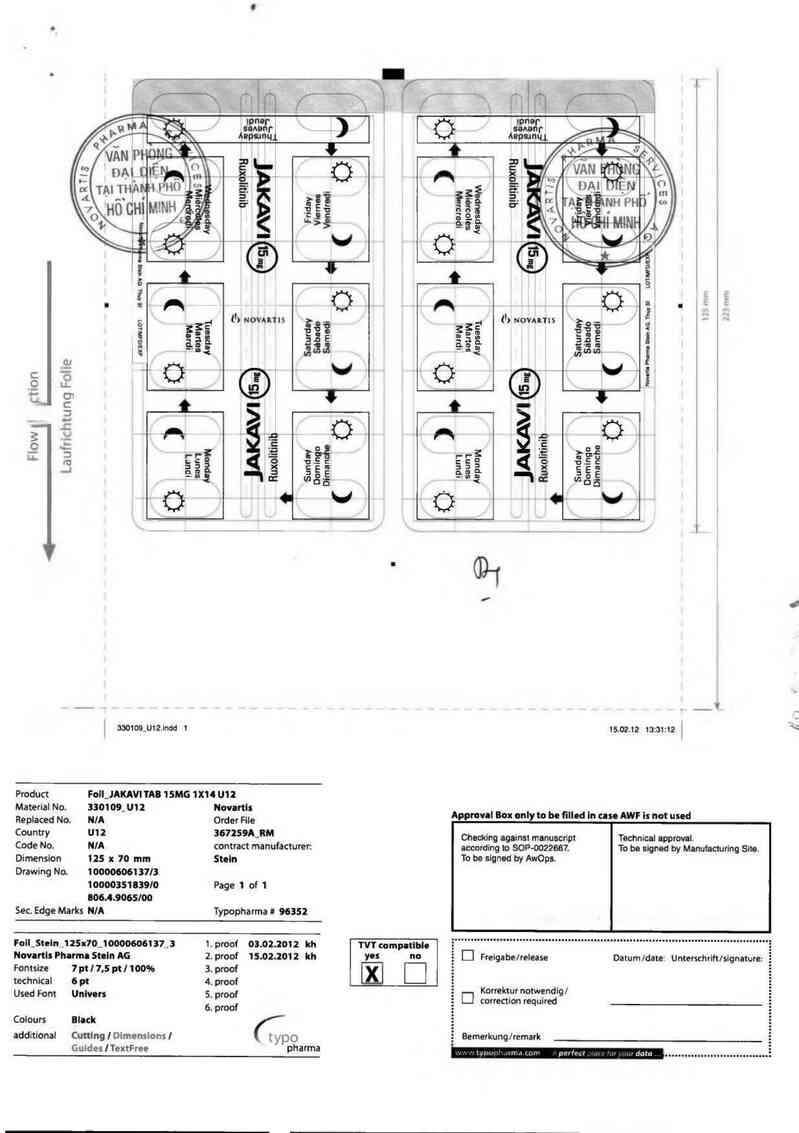
Product Foll_JAKAVI TAB 15MG 1X14 U] ²
Maierial No. 330109_ 01 2 Novnnls
Replaced No. NIA Order File
Cou nưy U12 367259A_RM
Code No. NIA contract manufacturer.
Dimenslon 125 x 70 mm Stoln
Drawíng No. 1 00000061 37/3
1000035103910 Page 1 of 1
006.48065l00
Sec. Edge Mark; NIA Typopharma # 9635²
Foll_Stelnjl 25x70_100006061 37_ 3 1. proof 03.02.2012 kh TVT compatlbh
Novartls Phlrml Stnln AG 2. proof 15.0².2012 kh ycs no
Fontsize
technlcal
Used Font
Colours
additional
7ptl7.5 pt/10096
6 M
Unlvors
Black
Cuning | Dimensions/
Guldes ITextFree
3. proof
4. proof
5. proof
6. proof
G…
pharma
ffll]
El Freigabe/release Datum/date: Unterschriftlsignalure:
Korrektur notwendig/
conection required
El
Bemerkung/remark
perf…
uuuuuuuunun ...... uuu
A"…
©JAKAVl
Ruxolitinib
tablets | comprimés | comprimidos
56 tablets | comprimés | comprlmtdos
For oral use | voie orate / via oral
9_JAKAVI
RumủhrMh
tablets | comprimủs | comprimidos
comprimélcomprimido =
xolitinib
› …mm
lvl'15 mg
N :: Ilm uy Irt om. 0q: tỷ hưởng dÌn la dung mrủc ùhi dùng
NSX, MD, 50 lô SX :… 'IAFD'. 'EXP' “\.0T` lrQn blu bi
Nqu hải nui u nqty 01 cdl mmg nh hon In ưen mo …
Nhu nhơp …
cm; thúng hn h
Manuíacturm by Nova…s Pharma Ste… AG. Swutzefland lor
Nova…s Pharma AG. Basle. Swulzerland
Fabnqué par Novartrs Pharma Stem AG. Stem. Sulsse Dour
Novartxs Pharma AG. Bale, Suisse
Fabncado oor Novams Pharma Stein AG. Suưa para
Novams Pharma AG. Bas:iea. Sua
56 tablets | comprimés | compfimidos
Mũi vlln Mn chửi 15 mg ruxdilinib ldưòi ucng ruxollmnh mesohall Hop | vi ' N len nOn
SĐK VNXJOOKXX Ch! ơmh … dùng dlónq chỉd'lnh :ln dọc Ironq tù nwng uln sử dung
Bln quln nơ! kM …, lhobuq mũ. ở nmỌt do khong quá :o’c Giữ thuóc uong mo hi qdc
Sln xuh ll ml: FthI Sĩeln AG SchIPfhluserstrule. 433² Slam. Thuy 51
n uoc uunq lơ huơnu dln sờdunq kèm mon. Mẹ- lhÀc mlc vê :in phỒm nín vui lòng
ị txmowm
(nẹun dqu … … uẹp ……
nud uẹtm
1 2110… Ulìhdd 1
@
ondud Mỏlni IGI_JAKAVI TAI_15MGJXÌI_U1I
MaerinI No. 20l5406_1111
Replaced No. NIA
Couan U12
Code ND. 2005440
Dnmemion 75 : I] I 152 mm
aning Ne. “IONMĐMGQII
000,4.le10
I00.4.0141I1
Set Edge erks 005440
Nonnl:
Ovdev File
nuqucu
conlvan minufacturert
Suin
Page 1 o! 1
Typopharma # ma
FS Shln 75142111]
NIWIHII Phnmu Sttìn AG
Fonmze l,5ptllptl1…
techmal 6 pt
Used Font Tudo Gothic
Colours Ilnt
Cylu lMlgcnhl
Flnlonn 7147 CIPlntonl1MS C
Fontan III c
VunlshFru
nddltaonal Cumng lo …. ,: u
1.proof oc.anmz Im
2. pmof 20.01.2012 kh
3.nroof
4.pmof
5. prod
G.pvoođ
pharma
²002 n i!rũ l5
TVT mmpnibln
yn no
fflffl
El noigmneiou om…mm Umevschdftlsõenaturo
Kcnekxur mmemlnl
conecuon 5 ’
.. _ _ , "
Lmul la only n M fillul In nu … ll … usd
Cnmng ale mmuscriơl Tơchmcd wpmvd
octhq lo 501²—0022807 To be slgnod Dy MuMưmring She.
Te M sởgned by AmOọl.
A C? …A Ủ-z
' t'› NOVARTIS .- s` ’ "
ư _, h NOVARTIS g.- -1 -
ã ẽễị ễẵ² ẻễặ ỂỂỀ ²
ịẹ aị % ẫ aẫ— =*a
—~ ; m 13 m " < ơn “
= @ * * * * V Q . V ổ
C ° @ — \ ,
O LL
c ơ1 # F \
- , * s *- s
_ _ Ò-í
“ e A . _- Je — Ô A ~ ~ ….n Ộ
ẫ Ế 'Ễ ;; o -ẳ o ° ị i
10— ' , _ > &—
E ² "E'Ể % ầề'ẽ EEỄ a a.ễz
3 ẳ= ã ả s ẽ ; ảẳ ả ả s e ;
- 8 _g ;; ca 8 5 .-~ 2 n: «n 8 ổ
11:1— *~*…~~ị … …o 1 v
_ ` ; _ _Í , _” __ ”_5. 1
v I ffl*r '
|
\
__ _ V
aeomo_uư.mo 1 1s.oe.1z 13:31:12
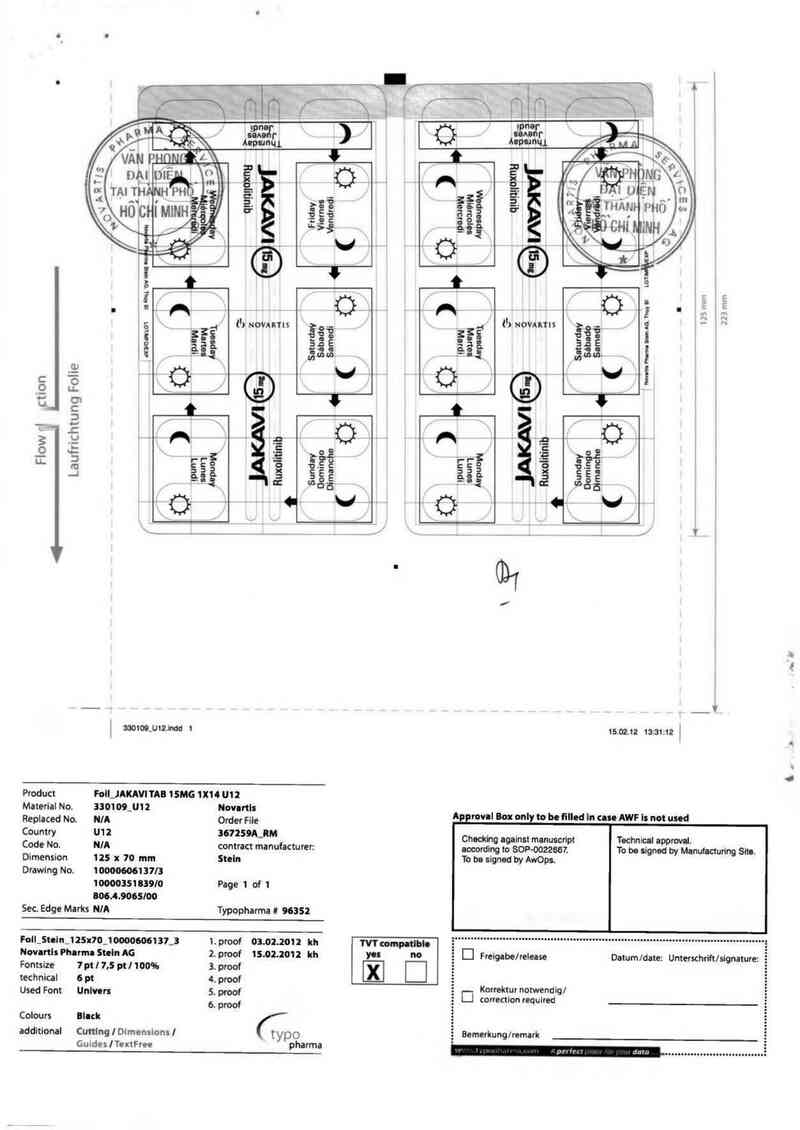
Product Foll_JAKAVITAB 1SMG 1X14 012
Material No. 330109_012 Novnrtls
Replaced No. N] A Order File A role Box only to bơ filled In cuc AWF Is not used
Cou ntry U12 367259A—RM Chodthg against manuscrỉpt Technical approval.
Code No. N/A contract manufacturer: ueoording to SOP—oozzesl To be signed by Manufacturing Sbto.
Dimension 125 x 70 mm Steln To be signed by AwOn
Drawing No. 10000606137/3
10000351039/0 Page 1 of 1
806.43005/00
See Edge Marks NIA Typopharma ! 9635²
Foll_Steln_ 125x70_100006061 37_3 1. proof 03.02.201 2 kh TVT eomeh
Novanls Phormn SteinAG 2.proof 15.02.2012 1111 M 00 El Freigabe/release Datum/date: Unterschrift/stgnaturec
Fontsize 1th 1.5 pt/10096 a. proof Ê El
1echnìcal 6 pt 4. proof Ko 'ffl Me d“ 7
1 ur no n lg
Used Font Unlvors 5. proof Ủ mneđion Íeqwed
6. proof
Colours lllck
additional Cuttlng ! Dlmenslons/ typo Bemerkunglremnrk
Guldes |TextFree pharma ___
Thuốc ức chế protein kìnase
MÔ TẢ VÀ THÀNH PHẦN
Dạng bảo chế
Viên nén 5 mg, hình tròn, mảu trắng.
Viên nén 15 mg, hình bầu dục, mảu trắng.
Viên nén 20 mg, hỉnh viên nang, mảu trắng.
Hoạt chẩt
Ruxolitinib phosphat
Ruxolitinib 5 mg/viên nén
Ruxolitinib 15 mg/viên nén OJ’]
Ruxolitinib 20 mglviên nén ,
Thảnh phẳn có hoạt tinh
Ruxolitinib.
Một số hảm lượng có thể không có sẵn ở tắt cả cảc nước.
Tá dược
Cellulose vi tinh thể
Magnesi stearat
Silica dạng keo khan
Natri starch glycolat (Loại A)
Hydroxypropylcellulose
Povidon
Mỗi viên nén 5 mg chứa 71,45 mg Iactose monohydrat.
Mỗi viên nén 15 mg chứa 214,35 mg Iactose monohydrat.
Mỗi viên nén 20 mg chứa 285,80 mg lactose monohydrat.
CHỈ ĐỊNH
Jakavi được chỉ định để điều trị bệnh nhân bị xơ tủy xương, bao gồm xơ tủy nguyên
phát, xơ tùy sau khi bị tảng hồng cầu vô căn hoặc xơ tủy sau khi bi tảng tiêu cầu vô
cản.
1 |2 1
Jakavi_OS.ZOI5_clinDL_ABC
LIEU LƯỢNG VÀ CÁCH DÙNG
Điều trị với Jakavi chỉ nên được tiến hảnh bởi bác sĩ có kinh nghiệm sử dụng thuốc
điều trị ung thư.
Hướng dẫn theo dõi
Công thức máu toản phần: Phải xét nghiệm công thức mảu toản phần trước khi
khởi đầu điêu trị băng Jakavi.
Cần theo dõi công thức máu toản phần mỗi 2 - 4 tuần cho đên khi iiều dùng ổn định
và sau đó được chỉ định theo lâm sảng (xem phần CẢNH BÁO VÀ THẬN TRỌNG).
Liều khởi đầu
Liều khởi đầu khuyên cáo của Jakavi là 15 mg, dùng đường uống 2 lầnlngảy đối vởi
những bệnh nhân có số lượng tiểu cầu từ 100.000 — 200.000]…m3 vả 20 mg, 2
Iần/ngảy đối với những bệnh nhân có số lượng tiếu cầu > 200.000/mm3. Thông tin
còn hạn chế về việc khuyên cáo liều khởi đằu cho những bệnh nhân có số lượng
tiếu cầu từ 50.000/mm3 - 100.000/mm3. Liều khởi đầu tối đa được khuyên cáo ở
những bệnh nhân nảy là 5 mg, 2 Iần/ngảy vả cảc bệnh nhân nảy nèn được chỉnh
liều một cách thận trọng.
Điều chinh liều ,
Liêu dùng nên được điều chỉnh dựa trên độ an toản vả hiệu quả. Nên tạm ngưng
điều trị khi số lượng tiều cầu dưới 50.000lmm3 hoặc số lượng bạch cầu trung tính
tuyệt đối dưới 500/mm3. Sau khi số lượng huyêt cầu phục hồi lên cao hơn những
mức nảy, có thề bảt đầu dùng thuốc trở Iai với liều 5 mg, 2 Iần/ngảy vả tăng dần dựa
trên việc theo dõi cần thặn công thức máu toản phần.
Nên xem xét giảm Iièu nếu số lượng tiếu cầu giảm dưới 100.000/mm3 với mục đich
trảnh phải gián đoạn liều dùng vì giảm tiểu cằu.
Nêu hiệu quả được xem là chưa đạt và số lượng huyêt cầu đầy đủ thì có thể tăng
liều lên tối đa thêm 5 mg, 2 lầnlngảy; lên đén liều tối đa 25 mg, 2 lầnlngảy.
Không nên tảng liều khởi đầu trong vòng 4 tuần điều trị đầu tiên và sau đó nêu cần
tảng thi phải chờ ỉt nhât môi 2 tuần mới tăng một iần.
Hướng dẫn sử dụng
Liều tối đa của Jakavi lả 25 mg, 2 Iần/ngảy.
Nêu quên một liều, bệnh nhân không nên uống một Iièu bổ sung mả nên dùng liều
kê tiêp theo thường lệ được kê đơn.
Có thể tiếp tục điều trị chừng nảo lợi ích vẫn còn nhiều hơn nguy cơ.
Điều chinh liều khi dùng đồng thời vởi thuốc ức chế mạnh CYP3A4 hoặc
fluconazol:
Khi Jakavi được dùng với thuốc ức chế mạnh CYP3A4 hoặc thuốc ức chế kép
CYẨP2C9 vá CYP3A4 (ví dụ: fluconazol), nên giảm tống Iièu hảng ngảy của Jakavi
xuong khoảng 50% bằng cách giảm liều dùng 2 Iần/ngảy hoặc giảm số lần dùng
2 | 2 1
Jakavi_OS .20 [ 5_clinDL_ABC
thuốc xuống còn 1 lầnlngảy với Iièu tương ứng khi liệu dùng 2 Iần/ngảy khộng khả
thi. Tránh dùng đồng thời Jakavi vả fluconazol với liêu lớn hơn 200 mg/ngay (xem
phần TƯỚNG TAC).
Khuyến cáo theo dõi thường xuyên hơn các thông số huyét học vả cáòc dệu hiệu,
triệu chứng lâm sảng của các phản ứng phụ liên quan với Jakavi khi bat đau dung
một thuốc ức chế mạnh CYP3A4 hoặc thuôc ức chế kép CYP2C9 vả CYP3A4.
Các nhóm bệnh nhân đặc biệt (D7
Suy thận
Không cần điều chỉnh liều đặc biệt ở bệnh nhân suy thận nhẹ hoặc trung binh.
Ở bệnh nhân bị suy thận nặng (độ thanh thải creatinin dưới 30 mI/phút), liều khởi đầu
khuyên các dựa trên số lượng tiểu cầu đối với bệnh nhản bi xơ tùy xương (MF) nên
được giảm xuống khoảng 50%, dùng 2 lầnlngảy. Cần theo dỏi bệnh nhân cần thận
về độ an toản vả hiệu quả trong khi điều trị bằng Jakavi.
Dữ liệu còn hạn chế trong việc xác đinh các lựa chọn liều dùng tốt nhât cho bệnh
nhân bị bệnh thận giai đoạn cuối (ESRD) đang được lọc thận. Các mô phỏng về
dược động họcldược lực học dựa trên dữ liệu hiện có ở nhóm bệnh nhân nảy cho
thảy liêu khởi đầu đối với bệnh nhân bị xơ tủy xương (MF) có bệnh thặn giai đoạn
cuối đang được lọc thặn là một liều đơn 15-20 mg hoặc 2 liêu 10 mg dùn cách nhau
12 giờ, được dùng sau khi lọc thận và chỉ dùng vảo ngảy lọc thận. Khuyen cáo dùng
một Iièu đơn 15 mg đối với bệnh nhân bị xơ tủy xương có số lượng tiểu cầu từ
100.000/mm3 - 200.000/mm3. Khuyến cáo dùng một liều đơn 20 mg hoặc 2 liều 10
mg cách nhau 12 giờ đối với bệnh nhân bị xơ tủy xương có số lượng tiểu cầu ›
200.000/mm3. Các liều kê tiêp (liều đơn hoặc 2 liều 10 mg dùng cách nhau 12 giờ)
chỉ nên dùng vảo những ngảy lọc thận sau mỗi lần loc thận (xem phần DƯỢC LÝ
LÂM SÀNG).
Suy gan
Ở bệnh nhân có bảt kỳ mức đó suy gan nảo, liều khởi đầu khuyến cáo dựa trên số
lượn tiếu cầu nèn được giảm xuống khoảng 50%. dùng 2 lầnlngảy. Cần fflều chinh
các lieu kê tiêp dựa trên việc theo dõi cẩn thận về độ an toản vả hiệu quả. Những bệnh
nhân được chẩn đoán suy gan trong khi điều trị bằng Jakavi cần được xét nghiệm
côn thức mảu toản bộ, bao gồm cả tỷ lệ bạch cầu, theo dõi ít nhât mỗi 12 tuần trong
6 tu n đầu tiên sau khi bắt đầu điều trị bằng Jakavi vả sau đó khi được chỉ định trên
lâm sảng một khi chức năng gan và số lượng huyêt cằu đã Ổn định. Liêu Jakavi có thế
được điều chỉnh để Iảm hạ thấp nguy cơ giảm huyết cầu.
Bệnh nhi
Độ an toản và hiệu quả của Jakavi ở bệnh nhi chưa được xác định.
Bệnh nhân cao tuổi
KiỊÔng có sự điêu chỉnh liều bổ sung nảo được khuyến cáo đối với bệnh nhản cao
tuoi.
Ngừng điều trị
3 | 2 1
Jakavi_OS .201 5_clinDL_ABC
Có thế tiêp tục điêu trị chừng nảo lợi ich vẫn lớn hơn nguy cơ. Tuy nhiên, nên
ngừng thuốc sau 6 tháng nếu không có sự giảm kích thước lách hoặc không có
cải thiện triệu chứng kê từ khi bảt đầu điều trị.
Đối với những bệnh nhân cho thậy có một số cải thiện nhắt định trên lâm sảng,
khuyến cáo nên ngừng điều trị bằng ruxolitinib nêu họ vẫn bị tăng chiều dải lảch
40% so với kich thước ban đầu (gần tương đương với một mức tăng 25% về thể
tich lách) vả không có sự cải thiện rõ rệt các triệu chứng liên quan đến bệnh.
Cách dùng
Jakavi được dùng đường uống và có thể dùng cùng hoặc không cùng với thức ăn.
CHỐNG CHỈ ĐỊNH
Quá mẫn với hoạt chât hoặc với bất kỳ tá dược nảo của thuốc. CD'J
;
Phụ nữ có thai vả cho con bủ.
CẢNH BÁO VÀ THẬN TRỌNG
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hỏi ý
kiến bác sĩ.
Thuốc nảy chi dùng theo sự kê đơn của bảc sĩ.
Giảm số lượng tế bảo máu
Điêu trị bằng Jakavi có thể gây ra các phản ứng phụ về huyêt học, bao gòm giảm
tiếu cầu thiêu máu và giảm bạch cầu trung tính Phải xét nghiệm công thức máu
toản phần trước khi bắt đầu điều trị bằng Jakavi. Ngừng điều trị ở các bệnh nhân có
số lượng tiêu3 cầu dưới 50 OOOlmm3 hoặc số lượng bạch cầu trung tính tuyệt đối
dưới 500/mm3 (về tần suất theo dõi xem phần LIEU LƯỢNG VÀ CÁCH DÙNG).
Người ta đả3 quan sát thấy rằng những bệnh nhân có số lượng tiểu cầu thắp (<
200 OOOlmm3 ) vảo lúc bắt đâu điều trị dễ bị giảm tiểu cầu hơn trong thời gian điều trị
Giảm tiểu cầu thường hồi phục được và thường được xử trí bằng cảch giảm liều
hoặc tam ngừng sử dụng Jakavi. Tuy nhiên, có thể cần phải truyền tiểu cầu khi
được chỉ định trên lâm sảng (xem phần LIEU LƯỢNG VÀ CÁCH DÙNG và phần
PHẢN ỪNG PHỤ CỦA THUỐC).
Những bệnh nhân phát sinh thiêu máu có thể cần phải truyền máu. Củng có thể cần
phải xem xét điều chinh liều đối với bệnh nhân bị thiếu máu.
Những bệnh nhân có lượng hemoglobin dưới 10 0 gldl lúc bắt đầu điều trị có nguy
cơ cao hơn bị giảm hemoglobin dưới 8, O gldl trong khi điều tri so với những bệnh
nhân có hemoglobin lúc ban đầu cao hơn (79 3% so với 30,1%) Khuyên cáo nẻn
theo dõi thường xuyên hơn về các thỏng số huyêt học, các dâu hiệu và triệu chứng
lâm sảng của những phản ứng bảt lợi Nên quan đên Jakavi đối với những bệnh nhân
có hemoglobin ban đầu dưới 10,0 gldl.
4 | 2 1
Jakavi_OS.20l 5_clinDL_ABC
Giảm bạch cầu trung tỉnh (Số lượng bạch cầu trung tính tuyệt đối (ANCỆ) < SOOImmỔ
thường hồi phục được Vả thường được xửtrí băng cách tạm ngừng sư dụng Jakạvn
(xem phần LIÊU LƯỢNG VA CACH DUNG vả phần PHẢN ƯNG PHỤ CUA
THUỐC)
Cần theo dõi công thức máu toán phần khi được chỉ định trện Iảm sảng và điều
chỉnh liều khiÌcần thiết (xem phần LIEU LƯỢNG VÀ CACH DUNG vả phan PHẢN
ƯNG PHỤ CUA THUỐC).
Nhiễm trùng —
Cần đánh giá bệnh nhân về nguy cơ phát sinh nhiễm khuẩn, nhiễm mycobacterium
vả nhiễm virus nghiêm trọng. Mắc bệnh Iao đă được báo cảo ở bệnh nhân đang
dùng Jakavi để điều trị xơ tủy. Cần lưu ý về khả năng bị bệnh Iao tiềm ần hoặc dạng
hoạt động. Không nên bắt đầu điều trị bằng Jakavi cho đên khi các nhiêm trùng
nghiêm trọng dạng hoạt động đã được giải quyết. Bác sĩ nên theo dõi cẩn thận
những bệnh nhân đang được điều trị bằng Jakavi về các dâu hiệu và triệu chứng
cùa nhiễm trùng vả bắt đầu điều trị thỉch hợp ngay lập tức (xem phần PHẢN ƯNG
PHỤ CÙA THUỐC),
Đã có báo cáo về tải lượng virus viêm gan B (nồng độ HBV-DNA) tăng lên, có và
không có tăng kèm theo alanin aminotransferase vả aspartat aminotransferase ở
những bệnh nhân bị nhiễm HBV mạn tính đang dùng Jakavi. Chưa rõ ảnh hưởng
cùa Jakavi đối với sự tăng sinh virus ở bệnh nhân bị nhiễm HBV mạn tỉnh. Bệnh
nhân bị nhiễm HBV mạn tính cần được điều trị và theo dõi theo các hướng dẫn lâm
sảng.
Bệnh zona (Herpes Zoster)
Bác sĩ nên giáo dục cho bệnh nhân về các dảu hiệu vả triệu chứng sớm của bệnh
zona (herpes zoster) và khuyên họ nên đi điêu trị cảng sớm cảng tốt.
Bệnh chất trắng não đa ổ tiến triến
Bệnh chầt trắng nảo đa 6 tiên triển (PML) đă được báo cáo với việc điều trị xơ tùy
băng ruxolitinib. Bác sĩ nên cảnh giảc với các triệu chứng thần kinh-tâm thần gợi ý
bệnh chắt trăng nảo đa ổ tiên triền.
Ung thư da không phải u hắc tố
Ung thư da không phải u hắc tố (NMSC), bao gồm ung thư tế bảo đáy, ung thư tế
bảo vảy vá ung thư biểu mô tế bảo Merkel đã được bảo cảo ở những bệnh nhân
điêu trị bằng Jakavi. Hầu hêt những bệnh nhân nảy có tiền sử điều trị kéo dải bằng
hydroxyurea và bị NMSC trước đó hoặc có tốn thương da tiền ác tính. Mối quan hệ
nhân quả với ruxolitinib chưa được xảc định. Khuyến cáo nên khám da định kỳ cho
những bệnh nhân có nguy cơ cao về ung thư da.
5 | 2 1
Jakavi_os2m5_ciinDL_ABC
Các nhóm bệnh nhân đặc biệt
Suy thận
Nên giảm liều khởi đầu của Jakavi ở bệnh nhân suy thận nặng. Đối với bệnh nhân bị
bệnh thặn giai đoạn cuối đang được thầm phân, liều khởi đầu nên dựa trên sô lượng
tiểu cầu. Chỉ nên dùng các liêu kê tiêp đối với bệnh nhân vảo những ngảy lọc thận
sau mỗi lần lọc thặn Việc điều chỉnh Iièu thêm nên dưa vảo độ an toản và hiệu quả
của thuốc (xem phần LIEU LƯỢNG VÀ CÁCH DUNG và phần DƯỢC LY LAM
SÀNG, Các nhóm bệnh nhân đặc biệt).
Suy gan
Nên giảm liêu khởi đầu của Jakavi ở bệnh nhân suy gan. Việc điều chỉnh liều thêm
nên dựa trèn độ an toản yả hiệu quả của thuốc (xem phần LIEU LƯỢNG VÀ CÁCH
DÙNG vả phần DƯỢC LY LAM SANG, Cảc nhóm bệnh nhân đặc biệt).
Tương tảo thuốc (Đi
Néu Jakavi được dùng đồng thời với thuốc ức chế mạnh CYP3A4 hoặc thuốc ức
chế kép trung binh CYP209 vả CYP3A4 (ví dụ: fluconzol), nên giảm liều khoảng
50% (về tần suất theo dõi, xem phần LIEU LƯỢNG VÀ CÁCH DÙNG và phần
TƯỚNG TÁC THUỐC).
Cảc tác dụng do ngừng thuốc
Sau khi ngừng điều trị, các triệu chứng liên quan với xơ hóa tủy xương có khả năng
quay trở lại.
PHẦN ỨNG PHỤ CỦA THUỐC
Thông báo cho bác sỹ những tác dụng không mong muốn gặp phải khi sử
dụng thuốc.
Tóm tắt về đặc tinh an toản
Đánh giá về độ an toản được dưa trên tổng số 855 bệnh nhán (bị xơ tủy xương
hoặc một chỉ định khác trên thực nghiệm) được điều trị băng Jakavi trong các
nghiên cứu pha 2 và pha 3.
Trong thời gian chọn điều trị ngẫu nhiên của hai nghiên cứu then chốt COMFORT—I
vả COMFORT-ll, các bệnh nhân đã có thời gian sử dụng Jakavi trung bình lả 10,8
thảng (trong khoảng 0,3-23,5 thảng). Đa số bệnh nhân (68,4%) đã được điều trị
trong it nhất 9 tháng. Trong số 301 bệnh nhân, 111 bệnh nhân (36,9%) có số lượng
tiều cầu Iủc ban đầu từ 100.000/mm3 - 200.0001mm3 vả 190 bệnh nhân (63,1%) có
số lượng tiểu cầu lúc ban đầu › 200.000/mm3.
Trong các nghiên cứu lâm sảng nảy, ngừng thuốc do cảc phản ứng bắt lợi bất kể
quan hệ nhân quả đã được quan sát thây ở 11,3% bệnh nhân.
6 | 2 1
Jakavi_os.zoi 5_clinDL_ABC
Các phản ứng bất lợi của thuốc được bảo cáo thường gặp nhầt lả giảm tiếu cầu vả
thiều máu.
Cảo phản ứng bất lợi về huyềt học (bảt kỳ cắp độ nảo theo Tiêu chuẩn thuật ngữ
chung vẽ các phản ứng bất lợi (CTCAE)) bao gồm thiếu máu (82 4%) giảm tiều câu
(69, 8%) vả giảm bạch cằu trung tính (16, 6%)
Thiếu máu, giảm tiều cầu vả giảm bạch cầu trung tinh là các tác dụng bât lợi Iiẻn
quan với liêu dùng.
Ba phản ứng bắt lợi không phải huyết học thường gặp nhắt lả bầm tím (21,6%), xây
xấm(15,3%) vả nhức đầu <14,0%).
Ba bât thường về xét nghiệm không phải huyêt học thường gặp nhất lả tảng alanin
aminotransferase (27,2%). tăng aspartat aminotransferase (19,9%) và táng
cholesterol mảu (16,9%). 07
Độ an toán lâu dải: Như được dự kiến với thời gian theo dõi kéo dải, tần suất tich Iủy
cùa một số phản ứng bất lợi tăng lên trong đánh giá cùa dữ liệu an toản theo dõi 3
nảm (thời gian sử dụng thuốc trung vị lả 33,4 tháng trong nghiên cứu COMFORT-I
vả COMFORT- Il đối với những bệnh nhản được chon ngẫu nhiên ban đầu để điều
trị bằng ruxolitinib) từ 457 bệnh nhân bị xơ tủy xương được điều trị bằng ruxolitinib
trong thời gian chọn ngẫu nhiên vả giai đoạn điều trị mở rộng của 2 nghiên cứu pha
3 then chốt. Việc đánh giá nảy bao gồm dữ liệu từ những bệnh nhân được chọn
ngẫu nhiên ban đầu để điều trị bằng ruxolitinib (n = 301) và những bệnh nhân đã
được điều trị bằng ruxolitinib sau khi chuyền nhóm từ các nhóm điều trị đối chứng (n
= 156). Với những dữ liệu cặp nhật nảy, ngừng điều trị do các phản ứng bất lợi đã
được quan sát thấy ở 21,4% bệnh nhân điêu trị bằng ruxolitinib.
Bảng tóm tắt các phản ứng bất lợi của thuốc từ cảc thử nghiệm lâm sảng
Phản ứng bất lợi của thuốc từ cảc thử nghiệm lảm sảng (Bảng 1) được liệt kê theo
nhóm hệ cơ quan của MedDRA Trong môi nhóm hệ cơ quan, các phản ứng bât lợi
của thuốc được sắp xêp theo tần suất đầu tiên lá các phản ứng thường gặp nhât.
Ngoải ra loại tần suất tương ứng đối với mỗi phản ứng bất lợi được dựa trèn quy
ước sau đảy (CIOMS III): rât thường gặp (2 1110); thường gặp (2 1l100 đên < 1110);
ít gặp (2 1/1. 000 đến < 1l100); hiếm gặp (2 1110 000 đến < 1/1. 000); rất hiếm gặp (<
1/10.000)
Trong các chương trinh nghiên cứu lâm sảng mức độ nặng cùa các phản ứng bât
lợi của thuốc được đảnh giá dựa trện Tiêu chuẩn thuật ngữ chung về các phản ứng
bầt lợi (CTCAE) xác định độ 1 = nhẹ, độ 2— - trung binh, độ 3 = nặng vả độ 4= đe
dọa tinh mạng hoặc gãy tản tật.
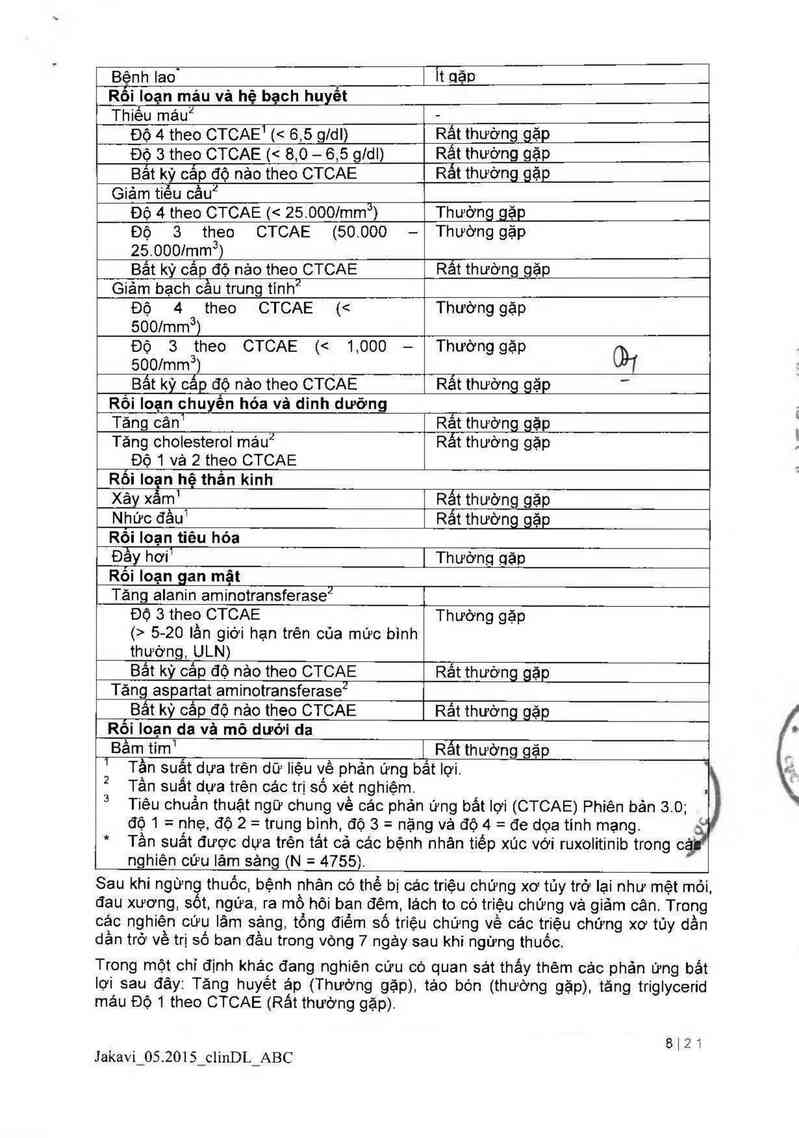
Bảng 1. Báo cáo nhóm tần suất của các phản ứng bắt lợi của thuốc được bảo
cáo trong cảc nghiên cứu pha 3 (COMFORT-I, COMFORT-ll)
Phản ứng bẩt lợi của thuốc và độ Nhóm tân suât đôi với bệnh nhân
CTCAE ² bị xơ hóa tùy xương (MF)
Nhiễm trùng và nhiễm ký sinh trùng
Nhiẻm trùng đường tiêt niệu1 Rắt thường gặp
Bệnh zona (Herpes zoster)1 Thường gặp
7 | 2 1
Jakavi_OS.2O 1 5_clinDL_ABC
25.0001mm3)
Bệnh Iao` Ít qặD
Rối loạn mảu vả hệ bạch huyềt
Thiêu máu2 -
Độ 4 theo CTCAE1 (< 65 gldl) Rât thướng_gặp
Độ 3 theo CTCAE ị< 8,0 - 6,5 gldl) Rât thường gặp
Bắt kỳ cắp độ nảo theo CTCAE Rất thường gặp
Giảm tiếu cầu2
Độ 4 theo CTCAE i< 25.0001mm3) Thường gặp
Độ 3 theo CTCAE (50.000 - Thường gặp
Bất kỳ cắp độ nảo theo CTCAE
Rất thường gặp
Giảm bạch cầu trung tinh2
Độ 4 theo CTCAE (< Thường gặp
500/mm3)
Độ 3 theo CTCAE (< 1,000 — Thường gặp
5001mm3)
Bất kỳ oắp độ nảo theo CTCAE
Rất thường gặp
Rối Ioạn chuyến hóa và dinh dưỡng
Tăng cân1
Rắt thường gặp
Tăng cholesterol máu2
ĐỘ 1 và 2 theo CTCAE
Rất thường gặp
Rối loạn hệ thẩn kinh
(› 520 lần giới hạn trên của mức bình
thường, ULN)
Xây xảm1 Rất thường gặp
Nhức đả…1 Rắt thường gặp
Rối Ioạn tiêu hóa
Đầy hơi1 Thường gặp
Rối Ioạn gan mật
Tảng alanin aminotransferase2
Độ 3 theo CTCAE Thường gặp
Bắt kỳ cắp độ nảo theo CTCAE
Rắt thường gặp
Tăng aspartat aminotransferase2
Bât kỳ câp độ nảo theo CTCAE
Rât thường gặp
Rối Ioạn da vả mô dưới da
Bâm tim
i Rất thường gặp
Tằn suất dựa trên các trị số xét nghiệm.
Tần suất dưa trên dữ liệu về phản ứng bất lợi
Tiêu chuẩn thuật ngữ chung về các phản ứng bắt lợi (CTCAE) Phiên bản 3 0;
độ 1 = nhẹ độ 2 — trung binh độ 3 - nặng vả độ 4= đe dọa tinh mạng
Tần suất được dựa trẻn tảt cả các bệnh nhân tiếp xúc với ruxolitinib trong °ế.
nghiên cứu lâm sảng (N= 4755)
Sau khi ngừng thuốc bệnh nhân có thể bị cảc triệu chứng xơ tủy trở lại như mệt mỏi
đau xương, sốt ngứa ra mồ hôi ban đêm lách to có triệu chứng và giảm cân. Trong
các nghiên cứu lâm sảng, tổng điêm số triệu chứng về các triệu chứng xơ tủy dần
dần trở về trị số ban đầu trong vòng 7 ngảy sau khi ngừng thuốc.
Trong một chỉ định khảc đang nghiện cứu có quan sảt thây thệm các phản ứng bât
lợi sau đây: Tăng huyết ảp (Thường gặp), táo bón (thường gặp), tăng triglycerid
mảu Độ 1 theo CTCAE (Rất thường gặp)
8 | 2 1
Jakavi_05 .201 5_clinDL_ABC
Mô tả cảc phản ứng phụ của thuốc chọn lọc
Thiếu máu
Trong các nghiên cứu lâm sảng pha 3, thời gian trung vị dẫn đên khới phát thiêu
máu lần đầu tiên đó 2 trở lên theo CTCAE iả 1,5 tháng. Một bệnh nhan (0,3%) đa
ngừng điều trị do thiêu máu.
Ở những bệnh nhân đang điều trị bằng Jakavi, mức giảm trung binh về hetnoglobin
đạt đến mức thấp nhắt khoảng 15-20 gll dưới mức ban đầu sau 8-12 tuần đieu trị và
sau đó phục hồi dần dần đề đạt được một trạng thái Ổn định mới khoảng 10 g/l dưới
mức ban đầu. Hiện tượng nảy được quan sát thấy ở bệnh nhân bất kể họ có được
truyền máu trong khi điều trị hay không.
Trong một nghiên cứu ngẫu nhiên, có đối chứng với giả dược (COMFORT-I), 59.4%
bệnh nhân được điều trị bằng Jakavi và 37,1% bệnh nhân được điêu trị bằng giá
dược được truyền hồng cầu trong khi điều trị. Trong nghiên cứu COMFORT-il, tỷ lệ
truyền hòng cầu lắng là 51,4% ở nhóm dùng Jakavi vả 38,4% ở nhóm dùng trị liệu
tốt nhất hiện có.
Giảm tiểu cầu ’
Trong các nghiên cứu lâm sảng pha 3, ở những bệnh nhân phát sinh giảm tiểu cầu
độ 3 hoặc 4, thời gian trung vị dẫn đến khởi phát khoảng 8 tuần. Giảm tiểu cầu
thường có hồi phục khi giảm liều hoặc tạm ngừng dùng thuốc. Thời gian trung vị đên
khi phục hồi số lượng tiếu cầu trên 50.000/mm3 là 14 ngảy. Truyền tiểu cầu đã được
sử dụng trong suốt giai đoạn ngẫu nhiện đối với 4,5% bệnh nhân đang dùng Jakavi
vả 5,8% bệnh nhân được điêu trị đối chứng. Ngừng điều trị do giảm tiểu cầu xảy ra
ở 0,7% bệnh nhân đang dùng Jakavi và 0,9% bệnh nhân điều trị đối chứng. Những
bệnh nhân có số lượng tiểu cầu 100.0001mm3 - 200.0007mm3 trưởc khi bắt đầu
dùng Jakavi có tần suất giảm tiếu cầu độ 3 hoặc 4 cao hơn so với những bệnh nhân
có sò lượng tiểu cầu › 200.000/mm3 (64,2% so với 35,4%).
Giảm bạch cầu trung tỉnh
Trong các nghiên cứu lâm sảng pha 3, ở những bệnh nhân phát sinh giảm bạch cầu
trung tính đó 3 hoặc 4, thời gian trung vị dẫn đên khởi phát là 12 tuần. Tạm ngưng
hoặc giảm lièu do giảm bạch cầu trung tính trong suốt giai đoạn ngẫu nhiên của
nghiên cứu đã được báo cáo ở 1,3% bệnh nhân vả 0,3% bệnh nhân đã ngừng hắn
điều trị do giảm bạch cầu trung tính.
Nhiễm trùng đường tiểt niệu
Trong các nghiên cứu lâm sảng pha 3, nhiễm trùng đường tiét niệu độ 3 hoặc 4 đã
được báo cáo ở 1,0% bệnh nhân, Nhiễm khuẩn huyết có nguồn gốc tiết niệu được
báo cáo ở 1,0% bệnh nhân và nhiẻm trùng thặn ở 1 bệnh nhân.
Bệnh zona (Herpes zoster)
9 | 2 1
Jakavi_OS.20l5_clinDL_ABC
Trong các nghiên cứu lâm sảng pha 3, bệnh zona (herpes zoster) độ 3 hoặc 4 đã
được báo cảo ở 1 bệnh nhân.
TƯỚNG TÁC THUỐC
Các tác nhân lảm thay đổi nồng độ ruxolitinib trong huyết tương
Thuốc ức chế manh CYP3A4
Các thuốc ức chế mạnh CYP3A4 (bao gồm nhưng không giới hạn ở: boceprevir,
clarithromycin, indinavir, itraconazol, ketoconazol, Iopinavir/ritonavir, ritonavir,
mibefradil, nefazodon, nelfinavir, posaconazol, saquinavir, teiaprevir, telithromycin,
vohconazoD.
Ở các đối tượng khỏe mạnh đang dùng ketoconazole iả thuốc ức chế mạnh
CYP3A4, với liều 200 mg 2 lần/ngảy trong 4 ngảy, diện tich dưới đường cong (AUC)
cùa Jakavi tăng 91 % và thời gian bán thải kéo dải từ 3,7 — 6,0 giờ.
Khi dùng Jakavi cùng với thuốc ức chế mạnh CYP3A4, tống iièu hảng ngảy của
Jakavi nên được giảm khoảng 50%.
Cần theo dõi chặt chẽ bệnh nhân để phát hiện giảm tế bảo máu và nên chỉnh iiêu
dựa trên độ an toản và hiệu quả (xem phần LIỆU LƯỢNG VÀ CÁCH DÙNG).
®1
Thuốc ức chế nhe hoăc trung bình CYP3A4 ,
Cảc thuốc ức chế nhe hoặc trung bình (bao gòm nhưng không giới hạn ở:
ciprofloxacin, erythromycin, amprenavir, atazanavir. diitiazem, cimetidin).
Ở các đối tượng khỏe mạnh đang dùng erythromycin lá thuốc ức chế trung bình
CYP3A4, với liều 500 mg 2 lần/ngảy trong 4 ngảy, có sư tãng 27% về AUC cùa
Jakavi.
Không khuyên cáo điều chỉnh iiều khi Jakavi được dùng đồng thời với thuốc ức chế
nhẹ hoặc trung bình CYP3A4 (ví dụ erythromycin). Cần theo dõi chặt chẽ bệnh nhân
để phát hiện giảm tế bảo máu khi bắt đầu điều trị với một thuốc ức chế trung bình
CYP3A4
Thuốc ức chế kép trung bình 0309 về CYP3A4 (vỉ du fluconazole): Dựa trên
mô hình trên máy tỉnh, AUC (diện tích dưới đường cong) của ruxolitinib được dự
đoán tăng 2,9 lần và 4,3 iần khi điều trị đồng thời với fluconazol 200 mg hoặc 400
mg, theo thứ tự tương ứng Nên xem xét giảm liều 50% khi sử dụng các thuốc ức
chế kép các enzym CYP209 vả CYP3A4 Tránh sử dụng đồng thời Jakavi với
fluconazol ở liêu lớn hơn 200 mglngảy
Thuốc gâỵ cảm ứng CYP3A4
Thuốc gây cảm ứng CYP3A4 (bao gồm nhưng không giới hạn ớ: avasimibe,
carbamazepin, phenobarbital, phenytoin, rifabutin, rifampin (rifampicin), St. John's
wort (Hypen'cum perforatum)
Khi bắt đầu dùng một thuốc gây cảm ứng CYP3A4 không khuyên cáo điều chỉnh
liều. Có thể xem xét tăng dần dần liều Jakavi nều hiệu quả trị liệu bị giảm trong khi
điều trị bằng thuốc gây cảm ứng CYP3A4
Ở cảc đối tượng khỏe mạnh đang dùng rifampin lá thuốc gây cảm ứng mạnh
CYP3A4, với Iièu 600 mg 1 Iần/ngảy trong 10 ngảy, AUC của Jakavi sau khi dùng
10 | 2 1
Jakavi_OS.ZOI5_clinDL_ABC
. \\
-f3
một liều đơn giảm 71% và thời gian bản thải giảm từ 3, 3 1,7 giờ Số lượng tương
đối của cảc chât chuyển hóa có hoạt tính tảng liên quan đên hợp chắt ban đầu
Ảnh ủởng của rụxolitinib đến các thuốc khác
Các chất đươc vãn chuvển gởi P-glvcoprotein hoaịc cg'c chất vân chuỵển khảo
Ruxolitinib có thể ức chế P- g-choprotein vá protein kháng ung thư vú (BCRP) ở ruột.
Điêu nảy có thể dẫn đến tăng nông độ toản thân của cảc cơ chắt của những chất
vận chuyến nảy như dabigatran etexilat, ciclosporin, rosuvastatin vả có khả năng là
digoxin. Nên theo dõi nồng độ thuốc trong mảu hoặc theo dõi lâm sảng của chất bị
ảnh hưởng.
Có thể lả khả nảng ức chế P- -gp vả protein kháng ung thư vú (BCRP) ở ruột có thể
được giảm thiểu nêu thời gian giữa các lần sử dụng được cách xa nhau cảng lâu
cảng tot.
(Di
Các ỵếu tố tăng trưởng tao máu ,
Việc sử dụng đồng thời các yếu tố tảng trưởng tạo máu vả Jakavi chưa được nghiên
cứu. Chưa rõ liệu sự ức chế Janus Associated Kinase (JAK) bới Jakavi có lảm giảm
hiệu quả của các yếu tố tảng trướng tạo mảu hay khỏng hoặc liệu các yếu tố tảng
trưởng tạo máu có ảnh hưởng đến hiệu quả của Jakavi hay không
Điều tri hóa chất lảm giảm tế bảo
Việc sử dụng đồng thời các phương pháp điêu trị giảm tế bảo vả Jakavi chưa được
nghiên cứu. Chưa rõ độ an toản vả hiệu quả cùa việc sử dụng đồng thời.
Cơ chất của CYP3A4
Một nghiên cứu ở các đối tượng khỏe mạnh cho thắyl ruxolitinib không ức chế sự
chuyển hóa của midazolam dùng đường uống lả cơ chắt cùa CYP3A4. Do đó không
có sự tăng nổng độ các cơ chất của CYP3A4 được dùng kết hợp với Jakavi.
Thuốc trảnh thai dùng đường uống
Một nghiên cứu ở các đối tượng khỏe mạnh cho thấy Jakavi không ảnh hưởng đên
dược động học của thuốc tránh thai dùng đường uống có chứa ethinyiestradiol vả
levonorgestrel Do đó không có dự kiên là hiệu quả tránh thai cùa dạng kêt hợp nảy
sẽ bị ảnh hưởng do việc dùng đồng thời với ruxolitinib
ẢNH HƯỞNG ĐÓ! Với KHẢ NÀNG LÁ! xe VÀ VẬN HÀNH MÁY MÓC
Chưa có nghiên cứu được thực hiện.
11 |2 1
Jakavi_OS.20l 5_clinDL_ABC
PHỤ NỮ có KHẢ NĂNG MANG THAI, PHỤ Nữ có THAI, CHO CON BÚ VÀ KHẢ
NẢNG SINH SẢN
Phụ nữ có khả năng mang thai
Những phụ nữ có khả nản mang thai phải có biện pháp phòng ngừa thich hợp để
tránh mang thai trong khi đieu trị.
Trong trường hợp mang thai xảy ra, phải thực hiện đánh giỀ nguy cợ/Iợi ích tiênềcơ
sở từng bệnh nhân với sự tư vấn cân thận về nguy cơ tiem ấn đoi với thai bang
cách sử dụng các dữ liệu cập nhặt nhất.
Phụ nữ có thai ,
Chưa có các nghiên cứu đầy đủ và đối chứng chặt chẽ về Jakavi ở phụ nữ có thai.
Các nghiên cứu về sự phát triến của phôi—thai với ruxolitinib ở chuột cống và chuột
nhắt không cho thấy tinh gây quái thai. Ruxolitinib có độc tinh đối với phôi vả độc
tinh đối với thai ở chuột cống (tãng mất phôi sau khi lảm tổ và giảm cân nặng của
thai) (xem phần cAc DỮ LIẸU AN TOÀN PHI LÀM SÀNG).
Chưa rõ nguy cơ tiềm ẩn đối với người. Không khuyên cảo sử dụng Jakavi trong khi
mang thai.
Phụ nữ cho con bú
Phụ nữ đang dùng Jakavi không nên cho con bủ.
Ở chuột cống cho con bú, ruxolitinib vảlhoặc các chắt chuyến hóa cùa nó được bải
tiêt vảo sữa với nồng độ cao hơn 13 lần so với nồng độ trong huyêt tương ở chuột
mẹ. Chưa rõ liệu Jakavi có bải tiêt vảo sữa mẹ hay không.
Khả năng sinh sản
Chưa có dữ liệu ở người về tác dụng của ruxolitinib trên khả náng sinh sản. Trong
các nghiên cứu ở độn vật, không quan sát thắy các tác dụng có hại trên khả năng
sinh sản hoặc hiệu suat sinh sản ở chuột cống đực hoặc cải. Trong một nghiên cứu
trước sinh và sau sinh ở chuột cống, khả năng sinh sản ở chuột oon thế hệ đầu tiên
cũng không bị ảnh hưởng (xem phần CÁC DỮ LIẸU AN TOÀN PHI LÀM SÀNG).
QUÁ LIEU
Chưa có thuốc giải độc đối với trường hợp quá liều Jakavi. Các liều đơn lên đến 200
mg đã được dùng với khả năng dung nạp cấp châp nhận được. Các liều lặp lại cao
hơn so với liều được khuyên cáo có liên quan với tăng ức chế tủy xương bao gồm
giảm bạch cầu, thiêu máu và giảm tiểu cầu. Cần tiến hảnh điêu tri hỗ trợ thỉch hợp.
Thẩm phân máu khó có thể Iảm tăng thải trừ Jakavi.
12 | 2 1
J akavì_OS.20l 5_clinDL_ABC
DƯỢC LÝ LÂM SÀNG
Cơ chế tác dụng (MOA)
Ruxolitinib là một thuốc ức chế chọn lọc Janus Associated Kinase (JAK) JAK1 vả
JAK2 (trị số le0 iả 3, 3 nM đối vởi enzym JAK1 và 2, 8 nM đối với enzym JAK2). Các
enzym nảy Iảm trung gian truyền tín hiệu cùa một số cytokin vả hormon tăng trưởng
quan trọng đối với chức nảng tạo máu và miễn dịch Sự truyền tin hiệu qua con
đường JAK Iiên quan đến sự huy động STAT (yêu tố chuyển đối tỉn hiệu và yêu tố
hoạt hóa sự phiên mả) cho các thụ thể cytokine, sự hoạt hỏa vả sự phân bố khu trú
sau đó của STAT ở nhân dẫn đên điều hòa biêu hiện gen. Rối Ioạn điều hòa con
đường JAK- STAT có liẻn quan với một số ung thư, gia tăng sự tăng sinh vả sự sống
sót của các tế bảo ác tính.
Xơ tủy xương (MF) là một rối Ioạn tảng sinh tùy xương (MPN) đã biết có liên quan
với sự rối Ioạn điều hòa việc truyền tín hiệu qua con đường JAK1 vả JAK2. Cơ sở
về rối Ioạn điều hòa được cho là bao gồm nồng độ cao của cytokine trong tuần hoản
hoạt hóa con đường JAK-STAT, các đột biến tăng chức năng như JAK2V617F vả
ức chế các cơ chế điều hòa âm tinh. Những bệnh nhân bị xơ hóa tủy xương biểu
hiện rối loạn điều hòa dẫn truyền tỉn hiệu qua con đường JAK bát kê tình trạng đột
biến JAK2V617F.
Ruxolitinib ức chế sự truyền tín hiệu qua con đường JAK-STAT và sự tảng sinh tế
bảo trong cảc mô hỉnh tế bảo của các u ác tinh về huyêt học phụ thuộc cytokine,
cũng như của tế bảo BalF3 Iảm cho chủng không phụ thuộc cytokine bằng cách biều
hiện protein đột biến JAK2V617F, với trị số ICso trong khoảng từ 80- 320 nM. Trong
một mô hinh u tăng sinh tủy xương với JAK2V617F dương tính, sử dụng ruxolitinib
đường uống đã ngăn ngừa lách to, ưu tiên lảm giảm cảc tế bảo đột biên JAK2V617F
ở iách, lảm giảm cảc cytokine gây viêm trong tuần hoản (ví dụ TNF- -oc, iL- -6) và dẫn
đên kéo dải sự sống còn đáng kể ở chuột nhăt ở các liều không gây tác dụng ức chế
tủy xương.
®1
Dược lực học (PD) ,
Ruxolitinib ức chế sự phosphoryl hóa STAT3 gây ra bởi cytokine trong mảu toản
phần ở các đối tượng khỏe mạnh vả bệnh nhân bị xơ tủy xương. Ruxolitinib dẫn đên
ức chế tối đa sự phosphoryl hóa STAT3 sau khi dùng thuốc 2 giờ, trở về gần mức
ban đầu lúc 8 giờ ở cả đối tượng khóe mạnh vả bệnh nhân bị xơ tủy xương, điều
nảy cho thấy không có sự tich lũy thuốc ban đầu hoặc các chắt chuyển hóa có hoạt
tinh.
Sư tảng ban đầu về các yêu tố chỉ điểm viêm có liên quan với các triệu chứng toản
thản như TNFalpha, iL 6 vả CRP ở các đối tượng bị xơ tùy xương giảm xuống sau
khi điều trị bằng ruxolitinib Bệnh nhân bị xơ tủy xương không bị đề khảng với các
tác dụng dược lực học cùa việc điều trị bằng ruxolitinib theo thời gian.
Tronẵ một nghiên cứu kỹ lưỡng về khoảng QT ở các đối tượng khỏe mạnh, không
co d u hiệu về tác dụng kéo dải khoảng QT/QTc do ruxolitinib ở các liều đơn lên đên
Iièu 200 mg cao vượt liều điều trị, điều nảy cho thắy ruxolitinib không có ảnh hưởng
đén sự tái cực của tim.
13 | 2 1
Jakavi_OS.201S_ciinDL_ABC
Dược động học (PK)
Hẳp thu
Ruxolitinib là một phân tử Loại 1 theo Hệ thống Phân loại Dược phẫm sinh học, có
tinh thắm cao, độ hòa tan cao vả đặc tỉnh hòa tan nhanh. Trong cảc nghiên Cứu, lâm
sảng, ruxolitinib được hấp thu nhanh sau khi dùng đường uống với nong độ toi đa
trong huyết tượng (Cmax) đạt được khoảng 1 giờ sau khi dùng thuoc. Dựa txrên
nghiên cứu về cân bằng khối lượng ở người, sự hấp thu ruxolitinib qua đường uong
là 95% hoặc cao hơn. Cmaxtrung bình của ruxolitinib và nồng độ tống cộng (diện tích
dưới đường cong, AUC) tăng tỉ lệ thuận trong phạm vi liêu đơn từ 5-200 mg. Không
có sự thay đối nảo có ý nghĩa lâm sảng về dược động học của ruxolitinib khi dùng
với bữa ản nhiều chảt béo. Cmax trung bình giảm vứa phải (24%) trong khi AUC trung
bình gần như không thay đổi (tăng 4%) khi dùng thuốc với bữa ản nhiêu chất béo.
Phân bố
Thể tichẵhân bố trung binh ở trạng thái Ổn định khoảng 75 lít ở bệnh nhản bị xơ tùy
xương. các nồng độ của ruxolitinib có ý nghĩa iâm sảng, sự găn kêt với protein
huyết tương in vitro khoảng 97%, chủ yếu lá với albumin. Một nghiên cứu chụp xạ
hình toản cơ thể ở chuột cống đá cho thảy ruxolitinib không thấm qua hảng rảo máu—
nảo.
Biến đối sinh họclchuyển hóa (DT
-
Các nghiên cứu in vitro cho thấy CYP3A4 lả một enzym chinh chịu trách nhiệm về
sự chuyền hóa ruxolitinib. Hợp chât ban đầu lả thực thể chủ yếu ở người, chiêm
khoảng 60% của chắt liên quan đên thuốc trong tuần hoản. Hai chât chuyến hóa
chính và có hoạt tinh được xác định trong huyết tương của các đối tượng khỏe
mạnh, đại diện 25% vả 11% về AUC của thuốc ban đầu. Những chắt chuyển hóa
nảy có một nứa đên 1/5 hoạt tinh dược lý liên quan vói JAK của thuốc ban đầu.
Tổng tầt cả các chất chuyển hóa có hoạt tinh đóng góp 18% vảo dược iực học cùa
ruxolitinib về tồng thế. Ở các nồng độ có ý nghĩa lâm sảng, ruxolitinib không ức chế
CYP1A2, CYP2BG, CYP2C8, CYP2C9, CYP2C19, CYPZDG hoặc CYP3A4 Và không
phải lá thuốc gây cảm ứng mạnh CYP1A2, CYPZBG hoặc CYP3A4 dựa trên các
nghiện cứu in vítro.
Thải trừ
Sau khi cho cảc đối tượng người lớn khỏe mạnh uống một liều đơn ruxolitinib có
đánh dầu phóng xạ [MC], sự thải trừ chủ yêu thông qua chuyền hòa với 74% hoạt
tính phóng xạ được bải tiết trong nước tiểu vả 22% thải trừ qua phân. Lượng thuốc
dạng không biến đồi chiêm dưới 1% tổng hoạt tinh phóng xạ được bải tiết. Thời gian
bán thải trung binh của ruxolitinib khoảng 3 giờ.
Sự tuyến tinh/không tuyến tinh
Sự t’ lệ thuận với iiều dùng đã được chứng minh trong các nghiên cứu đơn liều về
đa iieu. 1
c
Các nhóm đối tượng đặc biệt
14 | 2 1
Jakavi_OS .201 5_clinDL_ABC
Ảnh hưởng cùa tuổi, giởi tỉnh hoặc chủng tộc
Dựa trên cảc nghiên cứu ở các đối tượng khỏe mạnh, không quan sátthấy sự khác
biệt có ý nghĩa về dược động học của ruxolitinib về mặt giới tinhávả chung tọc.aTrong
một đảnh giá dược động học quần thể trên bệnh nhỊân bị xơxtiuy xương, khong co
mối quan hệ nảo rõ rảng giữa độ thanh thải đường uong vả tuOi hoặc chung tọc cuẹ
bệnh nhân. Độ thanh thải lả 17,7 Iit/giờ ở phụ nữ và 22,1 litlgiờ ơ nam giơi, với đo
biến thiên 39% giữa cảc đối tượng nghiên cứu.
Bệnh nhi
Độ an toản và hiệu quả cùa Jakavi ở bệnh nhi chưa được xác định.
Suy thặn
Sau khi dùng một liều đơn ruxolitinib 25 mg, dược động học tương tự nhau ở các
đối tượng có các mức đó suy thận khảo nhau và ở những người có chức nảng thặn
binh thường. Tuy nhiên, các trị số AUC của các chảt chuyển hóa của ruxolitinib
trong huyêt tương có xu hướng tăng theo mức độ nặn của suy thận tăng lên vả rõ
rệt nhắt ở cảc đối tượng bị bệnh thận giai đoạn cuoi cần phải thầm phân mảu.
Ruxolitinib không bị Ioại bỏ bằng thầm phản. Khuyến cáo điều chỉnh liêu đối với
bệnh nhân bị suy thận nặng (độ thanh thải creatinin (Clcr) dưới 30 mllphủt). Đối với
những bệnh nhân bị bệnh thặn giai đoạn cuối, khuyên cảo điều chỉnh phác đồ dùng
thuốc (xem phần LIEU LƯỢNG VÀ CÁCH DÙNG).
Suy gan (DT
Sau khi dùng một lièu đơn ruxolitinib 25 mg cho những bệnh nhân ổó các mức đó
suy gan khác nhau, dược động học vả dược lực học của ruxolitinib đã được đánh
giả. AUC trung binh của ruxolitinib tảng ở bệnh nhân suy gan nhẹ là 87%, ở bệnh
nhân suy gan trung binh lả 28% và ở bệnh nhân suy gan nặng lả 65%, so với bệnh
nhân có chức năng gan binh thường và cho thảy không có mối quan hệ rõ rảng với
mức đó suy gan dựa trèn điểm số ChiId-Pugh. Thời gian bán thải cuối cùng kéo dải
ở bệnh nhân suy gan so với nhóm đối chứng khỏe mạnh (4,1—5,0 giờ so với 2,8 giờ).
Khuyên cáo giảm liêu đối vởi bệnh nhân suy gan (xem phần LIỆU LƯỢNG VÀ
CÁCH DÙNG).
cÁc NGHIÊN cứu LÂM SÀNG
Hai nghiên cứu lâm sảng ngẫu nhiên pha 3 (COMFORT-I vả COMFORT-Il) đă được
tiến hảnh trên bệnh nhân bị xơ tùy xương (xơ tùy nguyên phát, xơ tủy sau đa hồng
câu vô căn hoặc xơ tủy sau tăng tiều cầu vô căn). Trong cả hai nghiên cứu, bệnh
nhân có lách to sờ thẳy được ỉt nhất lả 5 cm dưới bờ sườn vả thuộc nhóm nguy cơ
trung binh 2 (có 2 yếu tố tiện lượng) hoặc nguy cơ cao (có 3 yêu tố tiện lượn trở
lên) dựa trẻn Tiêu chỉ Đồng thuận của Nhóm Nghiên cứu Quốc tế (IWG). Các yẵu tổ
tiên lượng bao gồm các tiệu chỉ theo IWG gồm tuổi > 65, có các triệu chứng toản
thân (giảm cân, sốt, ra mồ hôi đêm), thiếu máu (hemoglobin <1o gldl), tăng bạch cầu
(tiền sử có số lượng bạch cầu (WBC) > 25 x 1ogll) vả nguyên bảo trong máu 21%.
Liêu khởi đầu của Jakavi được dựa trên số lượng tiểu cầu. Những bệnh nhân có số
lượng tiểu cầu từ 100.000 — 200.000|mm3 được điều trị khởi đầu bằng Jakavi 15 mg,
2 lản/ngảy vả những bệnh nhân có số lượng tiêu cầu > 200.000/mm được điều trị
khởi đầu bầng Jakavi 20 mg, 2 lần/ngảy. Sau đó các liêu được điêu chinh theo từng
bệnh nhân dựa trên khả náng dung nạp vả hiệu quả với liều tối đa lả 20 mg, 2
lânlngảy đối với những bệnh nhân có số lượng tiêu cầu từ 100.000 đến 5
125.000/mm3, liều 10 mg, 2 lần/ngáy đối với những bệnh nhân có số lượng tiếu cầu
15 | 2 1
Jakavi_OS.2O 1 5_clinDL_ABC
tư 75 000 đến 5 100. OOO/mmẫ vả liều 5 mg, 23 Iần/ngảy đối với những bệnh nhân có
số lượng tiếu cầu từ 50 000 đển s 75. OOO/mmẵ
COMFORT- | lá một nghiên cữu mù đội, ngẫu nhiên, có đối chứng với giả dược ở
309 bệnh nhân kháng trị hoặc không phải là đối tượng cho trị liệu hiện có. Các bệnh
nhản được cho dùng Jakavi hoặc giả dược đôi chứng. Tiêu chí đánh giá chính lả tỷ
lệ các đối tượng đạt được mức giảm 2 35% so với lúc ban đầu về thể tích cũa lảch
ở tuần thứ 24 khi được đánh giá bằng chụp còng hưởng từ (MRI) hoặc chụp cắt lớp
điện toản (CT)
Các tiêu chỉ phụ bao gồm thời gian duy trì mức giảm 2 35% so với iúc ban đầu về
thế tich của Iảch, tỷ lệ bệnh nhân có mức giảm 2 50% về tổng điểm số triệu chứng
từ lúc ban đầu đến tuần thứ 24 khi được đánh giá bằng nhật ký triệu chứng phiên
bản 2 0 theo Mẫu đảnh giá Triệu chứng Xơ Tủy xương (MFSAF) sứa đổi, thay đối
về tồng điểm số triệu chứng từ lúc ban đầu đên tuần thứ 24 khi được đảnh giá bằng
nhật ký triệu chứng phiên bản 2 0 theo MFSAF vả sổng còn toản bộ
COMFORT- II là một nghiên cứu nhăn mở, ngẫu nhiện ở 219 bệnh nhân. Các bệnh
nhân được chọn ngẫu nhiên 2: 1 điều trị bằng Jakavi so với trị liệu tốt nhât hiện có.
Trị liệu tốt nhắt hiện có được Iựa chọn bởi nhá nghiên cứu trên từng bệnh nhân. Ở
nhóm dùng trị liệu tốt nhắt hiện có, 47% bệnh nhân được điều trị bằng hydroxyurea
vệ 16% bệnh nhân được điều trị bằng glucocorticoid Tiêu chí đảnh giả chinh lá tỷ iệ
bệnh nhân đạt được mức giảm 2 35% so với lúc ban đầu về thể tích của lách ở tuần
thứ 48 khi được đánh giá bằng chụp MRI hoặc CT.
Một tiêu chỉ phụ trong nghiên cứu COMFORT-II lả tỷ lệ bệnh nhân đạt được mức
giảm 2 35% về thể tích của lách khi được đánh giá bằng chụp MRI hoặc CT từ lúc
ban đầu đên tuần thứ 24. Thời gian duy trì mức giảm 2 35% so với lúc ban đầu ở
bệnh nhân đáp ứng cũng lá một tỉêu chỉ phụ.
Trong nghiên cứu COMFORT—I, đặc điếm bệnh nhân lúc ban đầu vả đặc điểm về
bệnh ở bệnh nhản tương tư giữa 2 nhóm điều trị. Tuổi trung vị là 68 với 61% bệnh
nhân trện 65 tuối vả 54% nam. 50% bệnh nhân bị xơ tủy xương nguyên phảt, 31% bị
xơ tủy sau đa hồng cầu vô căn và 18% bị xơ tủy sau tăng tiểu cầu vô căn. 21% bệnh
nhản có các đợt truyền hồng cầu trong vòng 8 tuần tham gia vảo nghiên cứu. Số
lượng tiếu cầu trung vị lá 251. OOOlmm3. 76% bệnh nhân có đột biến mã hóa thay thế
V617F có trong protein JAK. Các bệnh nhân có chiêu dái lách trung vị sờ thấy được
là 16 cm Lúc ban đầu, 37,4% bệnh nhân ở nhòm Jakavi bị thiếu máu đỏ 1; 31,6%
độ 2 vả 4, 5% độ 3, trong khi ở nhóm giả dược 35 8% bị thiếu máu độ 1; 35,1% độ 2;
4,6% độ 3 và o,7% độ 4. Giảm tiếu cầu đó 1 được tim thấy ở 12,9% bệnh nhân
trong nhóm Jakavi và 13,2% ở nhóm giả dược.
Trong nghiên cứu COMFORT-ll, đặc điêm bệnh nhán lúc ban đầu và đặc điềm về
bệnh ở bệnh nhân tương tư giữa 2 nhóm điều trị. Tuổi trung vị là 66 với 52% bệnh
nhân trên 65 tuồi vả 57% nam. 53% bệnh nhản bị xơ tủy nguyên phảt, 31% bị xơ tủy
sau đa hồng cằu vô căn vả 16% bị xơ tủy sau tăng tiểu câu vô căn 19% bệnh nhân
được xem là phụ thuộc vác truyền máu lúc ban đầu Các bệnh nhảm có chiều dải
lảch trung vị sờ thắy được lẻ 15 cm.
Lúc ban đầu, 34,2% bệnh nhân ở nhóm Jakavi bị thiếu máu độ 1; 28,8% độ 2 vả
7,5% độ 3, trong khi ở nhóm dùng trị iiệu tốt nhất hiện có thi 37% bị thiếu mảu độ 1;
27,4% độ 2, 13,7% độ 3 và 1,4% độ 4. Giảm tiểu cầu độ 1 được phát hiện ở 8,2%
bệnh nhân ở nhóm Jakavi vả 9,6% ở nhóm dùng trị liệu tốt nhắt hiện cỏ. Phân tích
hiệu quả theo tiêu chí đánh giá chính trong các nghiên cứu COMFORT-l vả
COMFORT-ll được trinh bảy ở Bảng 2 dưới đảy. Một tỳ iệ bệnh nhản cao hơn đáng
16 | 2 1
Jakavi_OS.2t)i 5_clinDL_ABC
®1
.,
kể ở nhóm Jakavi đạt được mức giảm 2 35% về thể tich cùa lách so vởi lũc ban đặt:
ở cả hai nghiên cứu so với nhóm giả dược trong nghiện cứu COMFORT-I va trị liệu
tốt nhắt hiện có trong nghiên cứu COMFORT— Il
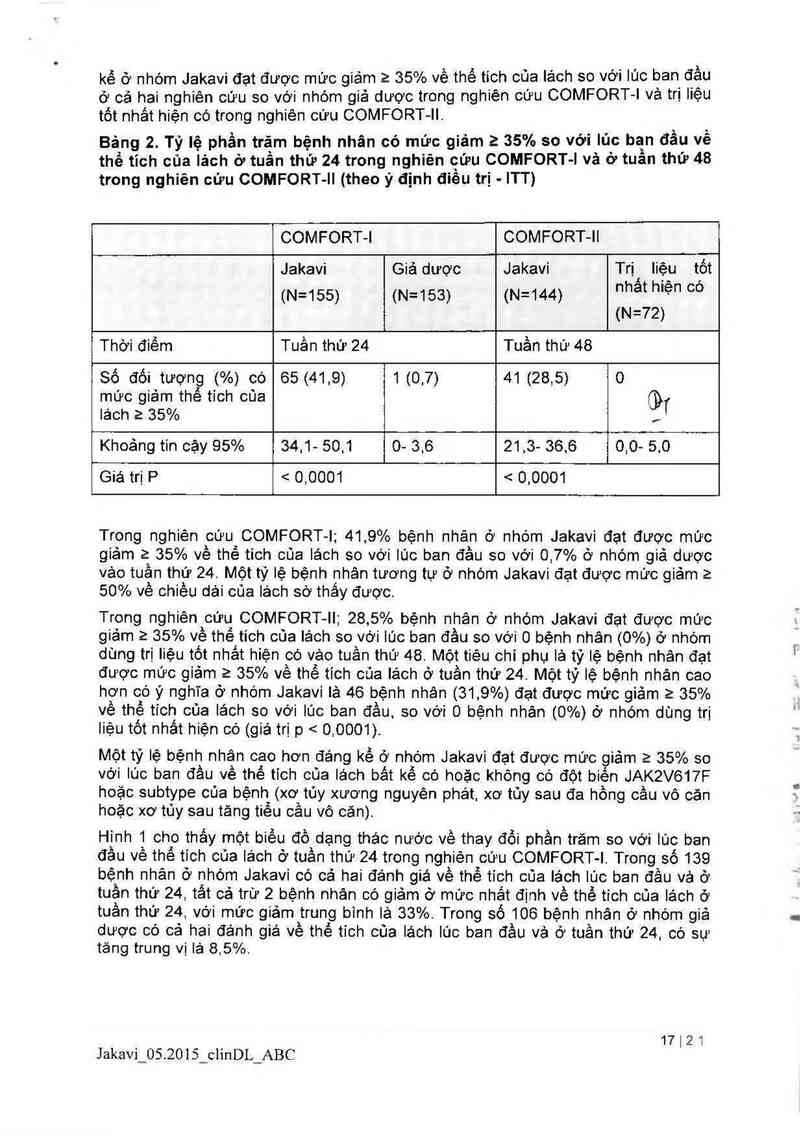
Bảng 2. Tỷ lệ phần trăm bệnh nhân có mức giảm 2 35% so với Iủc ban đầu về
thể tĩch của lách ở tuần thứ 24 trong nghiên cưu COMFORT- | vả ở tuần thứ 48
trong nghiên cứu COMFORT- Il (theo ý định điều trị ITT)
COMFORT-l COMFORT-Il
Jakavi Giả dược Jakavi TrịỊ liệu tốt
(N=155) (N=153) (N=144) “hat h'ẹ" °°
(N=72)
Thời điểm Tuần thứ 24 Tuần thứ 48
86 đối tượng (%) có 65 (41 ,9) 1 (0,7) 41 (28,5) 0
mức giảm thề tich cùa CDĩ
lách a 35% ,
Khoảng tin cậy 95% 34,1- 50,1 0. 3,6 21 ,3- 36,6 0,0- 5,0
Giá trị P < 0,0001 < 0,0001
Trong nghiên cứu COMFORT-l; 41 9% bệnh nhảm ở nhóm Jakavi đạt được mức
giảm 2 35% về thể tich cùa lách so với lúc ban đầu so vởi 0 ,7% ở nhóm giả dược
vảo tuần thứ 24. Một tỷ lệ bệnh nhân tương tự ở nhớm Jakavi đạt được mức giảm 2
50% về chiều dái của lách sờ thắy được
Trong nghiên cứu COMFORT-Il; 28,5% bệnh nhân ở nhóm Jakavi đạt được mức
giảm 2 35% về thể tích cũa lách so với lúc ban đầu so Với 0 bệnh nhân (0%) ở nhóm
dùng trị liệu tốt nhảt hiện có váo tuần thứ 48 Một tiêu chỉ phụ lả tỷ lệ bệnh nhân đại
được mức giảm 2 35% về thế tich oủa lách ở tuần thứ 24. Một tỷ lệ bệnh nhản cao
hơn có ý nghĩa ở nhóm Jakavi là 46 bệnh nhân (31, 9%) đạt được mức giảm 2 35%
về thể tích cùa lách so với iúc ban đầu so với 0 bệnh nhân (0%) ở nhóm dùng trị
liệu tốt nhầt hiện có (giá trị p < 0 ,.0001)
Một tỷ lệ bệnh nhân cao hơn đảng kể ở nhòm Jakavi đạt được mức giảm 2 35% so
với Iũc ban đầu về thế tich của lách bảt kể có hoặc không có đột biến JAK2V617F
hoặc subtype của bệnh (xơ túy xương nguyên phảt, xơ tùy sau đa hồng cầu vô căn
hoặc xơ tủy sau tăng tiễu câu vô cán).
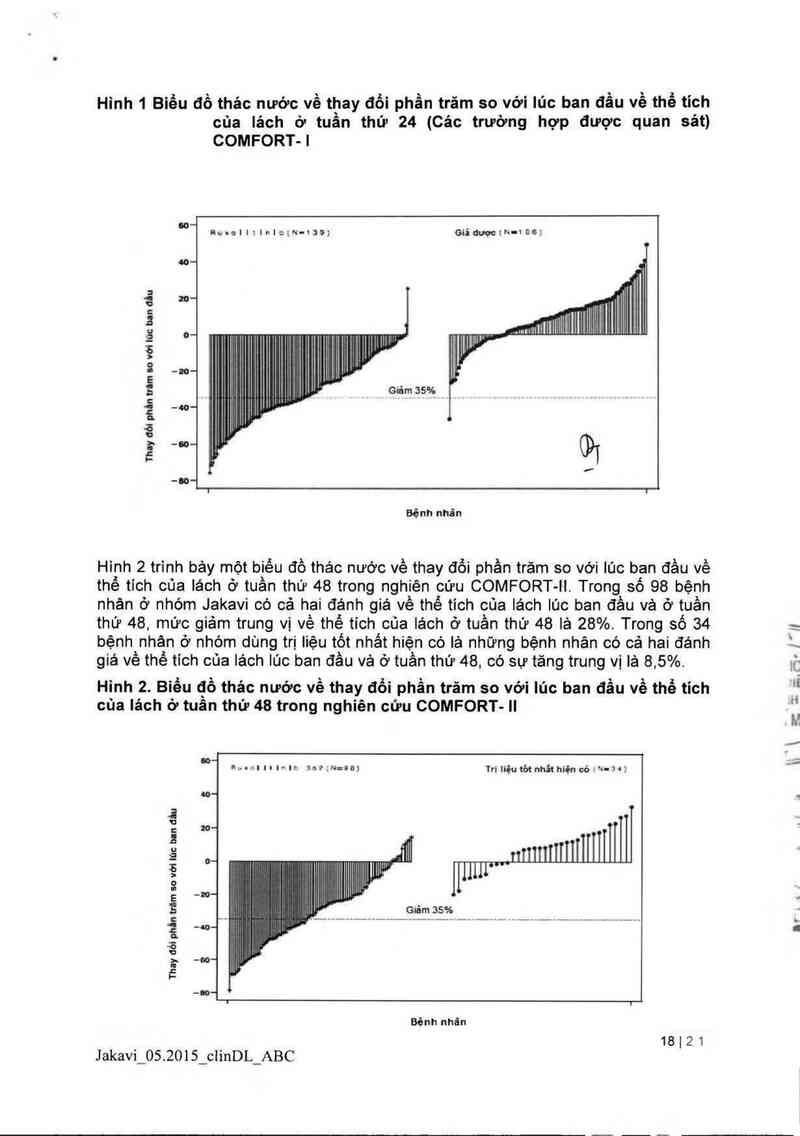
Hinh 1 cho thầy một biều đồ dạng thác nước về thay đồi phần trăm so với lúc ban
đầu về thể tích của lách ở tuần thứ 24 trong nghiện cứu COMFORT- I. Trong số 139
bệnh nhân ở nhóm Jakavi có cả hai đánh giá về thế tich cùa lách lúc ban đầu và ở
tuần thứ 24, tât cả trừ 2 bệnh nhân có giảm ở mữc nhất định về thế tich cùa lảch ở
tuần thứ 24, với mức giảm trung binh lả 33% Trong số 106 bệnh nhân ở nhóm giả
dược có cả hai đánh giá về thế tich của lách iúc ban đầu vả ở tuần thứ 24, có sự
tăng trung vị iả 8, 5%
17 | 2 1
Jakavi_OS.ZO l 5_clinDL_ABC
Hinh 1 Biểu đồ thác nước về thay đối phần trăm so với lủc ban đầu về thể tích
của lách ở tuần thứ 24 (Các trường hợp được quan sát)
COMFORT-I
m— nu-ulizlnlsịN-taoị GiảduợciN-tooz
lo—
_i
&—
...……ntiiiiiỉllliilliễmiHi
ii
Giâm 35%
Thoy dỏt phủ …… co với lủc bln …
Bệnh nhân
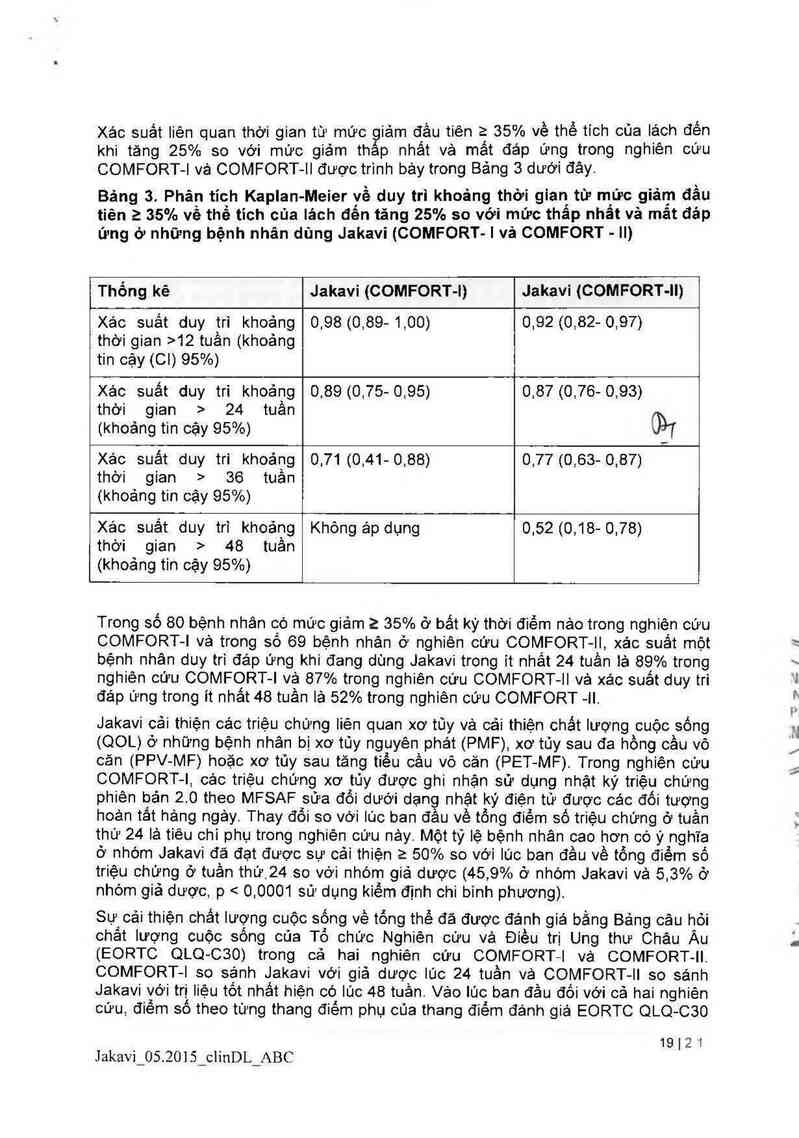
Hinh 2 trinh bảy một biểu đồ thảc nước về thay đổi phân trảm so với lúc ban đầu về
thể tich cùa iách ở tuần thứ 48 trong nghiên cứu COMFORT— II. Trong số 98 bệnh
nhân ở nhóm Jakavi có cả hai đánh giá về thể tich của lách lũc ban đầu và ở tuần
thứ 48, mức giảm trung vị về thế tich cùa lách ở tuần thứ 48 iả 28% Trong số 34
bệnh nhán ở nhóm dùng trị iiệu tốt nhất hiện có lá những bệnh nhân có cả hai đánh
giá về thế tich cùa lách lúc ban đâu vả ở tuần thứ 48. có sự tăng trung vị là 8, 5%
Hinh 2. Bỉều đồ thác nước về thay đổi phần trăm so với lủc ban đầu về thể tỉch
của lách ở tuần thứ 48 trong nghiên cứu COMFORT- Il
»—
n …lluh-ln 1Q?,NIilũj Trịliệutòtnhẩthiệnẹóxhuũộ)
WWiiiiiliiiuv ?
Thay dỏi phấn trlm so với lủc bnn đẩu
Bộnh nhán
18 | 2 1
J akavi_OS.ZOI 5_clinDL_ABC
I'.v
Xảc suất liên quan thời gian từ mức giảm đầu tiên 2 35% về thể tích của IỀch đện
khi tăng 25% so với mức giảm thấp nhât và mất đáp ứng trong nghien cưu
COMFORT-l vả COMFORT-il được trinh bảy trong Bảng 3 dưới đây.
Bảng 3. Phân tích Kaplan- -Meier về duy trì khoảng thời gian từ mức giảm đầu
tiên 2 35% về thể tỉch của lách đến tăng 25% so vởi mức thắp nhất vả mắt đáp
ứng ở những bệnh nhân dùng Jakavi (COMFORT- I vả COMFORT - Il)
Thổng kê Jakavi (COMFORT-l) Jakavi (COMFORT-Il)
Xác SUất duy Ìrỉ khoảng 0,98 (0,89- 1,00) 0,92 (0,82- 0,97)
thới gian >12 tuần (khoảng
tin cậy (CI) 05%)
Xác suất duy tri khoảng 0,89 (0,750,95) 0,87 (0,76— 0,93)
thời gian > 24 tuần
(khoảng tin cậy 95%) 021
Xác suất duy tri khoảng 0,71(0,41-0,88) 0,77 (0,63— 0,87)
thời gian > 36 tuân
(khoảng tin cậy 95%)
Xác suất duy tri khoảng Khỏng áp dụng 0,52 (0,18- 0,78)
thời gian > 48 tuân
(khoảng tin cặy 95%)
Trong số 80 bệnh nhân có mức giảm 2 35% ở bắt kỳ thời điểm nảo trong nghiên cữu
COMFORT-l vả trong số 69 bệnh nhân ở nghiên cứu COMFORT-ll, xảo suất một
bệnh nhân duy tri đảp ứng khi đang dùng Jakavi trong it nhất 24 tuần iả 89% trong
nghiên cứu COMFORT-l vả 87% trong nghiên cứu COMFORT- Il vả xác suất duy tri
đáp ứng trong ít nhắt 48 tuần lả 52% trong nghiên cứu COMFORT i-I.
Jakavi cải thiện cảc triệu chứng liện quan xơ tủy và cải thiện chắt lượng cuộc sống
(QOL) ở những bệnh nhân bị xơ tủy nguyên phảt (PMF), xơ tủy sau đa hồng cầu vô
căn (PPV- MF) hoặc xơ tủy sau tăng tiều câu vô căn (PET-MF). Trong nghiên cưu
COMFORT-I, các triệu chứng xơ tủy được ghi nhặn sữ dụng nhặt ký triệu chứng
phiên bản 2. 0 theo MFSAF sứa đối dưới dạng nhật ký điện tử được cảc đối tượng
hoản tắt hảng ngảy. Thay đổi so với lúc ban đầu về tồng điếm số triệu chứng ở tuần
thứ 24 là tiêu chỉ phụ trong nghiên cứu nảy Một tỷ lệ bệnh nhân cao hơn có ý nghĩa
ở nhòm Jakavi đã đạt được sự cải thiện 2 50% so với lúc ban đầu về tổng điếm số
triệu chứng ở tuần thứ 24 so với nhóm giả dược (45, 9% ở nhóm Jakavi và 5, 3% ở
nhóm giả dược, p < 0, 0001 sử dụng kiềm định chi binh phương).
Sự cải thiện chắt lượng cuộc sống về tồng thể đã được đánh giá bằng Bảng câu hòi
chầt lượng cuộc sống của Tổ chức Nghiện cứu và Điều trị Ung thư Châu Âu
(EORTC QLQ- -030) trong cả hai nghiên cứu COM-FORTI vả COMFORT- Il.
COMFORT-I so sánh Jakavi với giả dược lúc 24 tuần và COMFORT-il so sánh
Jakavi với trị liệu tốt nhắt hiện có lúc 48 tuần. Vảo lúc ban đầu đối với cả hai nghiên
cứu, điếm số theo tứng thang điếm phụ của thang điềm đánh giá EORTC QLQ- C30
19 | 2 1
Jakavì_OS.ZOI5_clinDL_ABC
đối với nhộm Jakavi và nhóm dùng thuốc so sảnh iả tương tự nhau. Vảo tuần thứ 24
ở nghiên cứu COMFORT-l, nhóm Jakavi cho thắy sự cải thiện có ý nghĩa về tinh
trạng sức khỏe chung/chất lượng cuộc sống theo thang điếm đánh giá EORTC
QLQ-C3O so với nhóm giả dược (thay đổi trung bình +12,3 đối với nhóm Jakavi vả -
3,4 đối với nhỏm giả dược, p < 0,0001). Ở tuần thứ 24 vả tu_ân thứ 48. nhóm Jakavi
ở nghiên cứu COMFORT—Ii cho thấy xu hướng cải thiện nhiêu hơn về tiêu chỉ thăm
dò iả tình trạng sức khỏe chunglchắt iượng cuộc sống so với tri iiệu tốt nhảt hiện có
vá điều nảy phù hợp với cảc kêt quả trong nghiên cứu COMFORT-I.
Trong nghiên cứu COMFORT-I, sau một thời gian theo dõi trung vị lả 34,3 thảng, ty
lệ tử vong ở bệnh nhân đươc phân ngẫu nhiên dùng ruxolitinib là 27,1% (42 trong so
155 bệnh nhân) so với 35,1% (54 trong số 154 bệnh nhân) thuộc nhóm dùng giả
dược. Ruxolitinib Iảm giảm nguy cơ tử vong 31,3% so với giả dược (HR 0,687; KTC
95% 0,459 — 1,029; p=0,0668)
Trong nghiện cứu COMFORT-il, sau một thời gian theo dõi trung vị iả 34,7 tháng, t”
lệ tử vong ở bệnh nhân đươc phân ngẫu nhiên dùng ruxolitinib là 19,9% (29 trong so
146 bệnh nhân) so với 30,1% (22 trong số 73 bệnh nhân) thuộc nhóm được điều trị
với liệu pháp tốt nhắt có được (BAT: best available therapy). Ruxolitinib Iảm giảm
nguy cơ tử vong 52% so với nhóm BAT (HR 0,48; KTC 95% 0,28 — 0,85; p=0,009).
cÁc Dữ LIẸU AN TOÀN PHI LÀM SÀNG %
Ruxolitinib đã được đánh giá trong các nghiên cứu về dược lý an toản, độc tính iiều
lặp lại, độc tỉnh gen, độc tinh đối với sinh sản vả một nghiên cứu về khả năng gây
ung thư. Các cơ quan đich liên quan với tác dụng dược lý của ruxolitinib trong cảc
nghiên gứu liều lặp lại bao gồm tùy xương, máu ngoại vi và mô dạng bạch huyết.
Các nhiêm trùng thường liện quan với sự ức chế miễn dịch đã được ghi nhặn ở chó.
Tinh trạng giảm huyết áp bất lợi cùng với tăng nhịp tim đã được ghi nhận trong một
nghiên cứu đo từ xa ở chó vả tình trạng giảm bât lợi thế tich theo phút đã được ghi
nhận trong một nghiên oứu vè hô hảp ở chuột cống. Cảo giới hạn về nồng độ (dựa
trẻn C…)( không găn kêt) ở mức không có tác dụng bất lợi trong cảc nghiên cứu trên
chó cao gấp 15,7 lần và trên chuột cống cao gâp 10,4 iần so với iiều tối đa khuyên
cáo cho người lả 25 mg, 2 lần/ngảy. Không có tảo dụng phụ nảo được ghi nhận
trong một đánh giá về tảc dụng dược lý trên thần kinh cùa ruxolitinib.
Ruxolitinib không gảy quái thai nhưng có liên quan với tảng mất phôi sau khi iâm tổ
vả giảm cân nặng của thai. Không có ảnh hưởng nảo được ghi nhận trên khả năng
sinh sản. _Trong một nghiên cứu về sự phát triển trước sinh vả sau sinh, không có
két quả bât lợi nảo đối với cảc chỉ số về khả nảng sinh sản, sự sống còn của mẹ vả
phôi-thai, sự tăng trưởng, vả các thông số về sự phát triển. Ruxolitinib không gây
đột biên hoặc đứt đoạn nhiễm sắc thế. Ruxolitinib không gây ung thư trong mô hinh
biên đổi gen Tg.rasH2 ở chuột nhắt.
TƯỚNG KY
Chưa được ghi nhận.
HẠN DÙNG
24 tháng kể từ ngảy sản xuất.
20 | 2 1
Jakavi_OS.20l5_clinDL_ABC
\o
BẢO QUÁN
Bảo quản nơi khô ráo, thoáng mát, ở nhiệt độ không quá 30°C. Giữ thuốc trong bao
bì gốc.
Không dùng Jakavi quá hạn sử dụng được ghi “EXP" trện bao bi.
Phải để Jakavi xa tầm tay vả tầm nhìn của trẻ em.
QUY CÁCH ĐÓNG GÓI
Hộp 1 ví >< 14 viên nén.
Hộp 4 ví >< 14 viên nén.
NHÀ SẢN XUÁT %
Novartis Pharma Stein AG ,
Schaffhauserstrasse, 4332 Stein, Thụy Sĩ.
Cho Novartis Pharma AG, Basle, Thụy Sĩ.
Tờ hướng dẫn sử dụng cho quốc tế
Ngảy phát hảnh thông tin: Tháng 5, 2015.
Phiên bản VN: tháng 06l2015.
® = nhản hiệu đã đảng ký
TUQ. cục: TRUỘNG
P.TRUỞNG PHONG
~'Ảỷaắẫn Ílfinf Jfễìng
21 ị2 1
J akavi_OS.ZOl 5_clinDL_ABC
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng