

















Store at or below 30'C iBG'FL
Protect from moisture and light.
Each tablet contains 434.4 mg
raltegraviư potassium equivalent
to 400 mg niteguvir fưe phencl
lnactive ingredients: Lactose
Monohyđiate, Mìcrocrystnlline
Cellulose, Calcium Phosphate Dibasic
anhydlous. Hypromellose 2208,
Poioxamet 407. Sodium Stearyl
Fumatate and Magnesium Stearate.
Film coating contains polyvinyl
alcohd. titan…m dioxide. polyethylene
glycol 3350,t216. and black iron onide
Monufactured by/Sán xuất bới:
MSD Illlnmlliđll ìl GMBM
iSIngapnrc ln nch)
21 Tuas South Avenue 6
Singapore 63 7766, Singa porn.
Packed byIĐớng gớl bớiz
Muù sharp & Dnh Inc B.V
Waarderweg 39. 2031 BN Hariem.
The Netherlanđs/Ha Lan
Ộ MSD
v
ISENTRESS'
(raltegravir, MSD)
For Oral Use
60 Tablets
Mmg
v
ISENTRESS'
twitegravir, MSD)
For Orai Use
60Tablets 400
usx Vu Dơi:
54 MA Ne
Moh
FOIW
. i
/ l°llỂư:llll \
l
Rx - THUỐC BAN THEO DON
Chl dinh, Chõng ch1 dinh. Cảch đùng
vả các thớng tin khác: xin xem tờ
hướng đản sủ dụng đinh kèm
Bảo quản nơi khô, thoáng mảt,
tránh ánh sáng, ở nhiệt đò khòng
quá 30'C (86'F).
DNNK: Cớng ty có phản Dược liệu
TW 2
24 Nguyên Thị Nghia. Q.l,
Tp. H6 … Minh
SĐK: xx-mx-xx
Mời vnèn nén chủa 434,4 mg
Rahegnvir potassium. tương dưong
400 mg Raltegravu.
ĐỂ XA TẦM TAY mt EM. Doc KÝ
HƯONG DĂN sờ DỤNG mu0c KHI
DÙNG.
°) 9IIỈLL 6
I Á-
ộ MSD
v
lSENTRESS'
(raltegravir. MSD)
For Orai Use
…...n. EM
Lọ 60 viên nén bao phim
For lndications, Dosage and
Administration. Contraindications,
Precautions/Wamings,
<.ee product clrcuiat
E
5 Ở Ê
c: ²“ O
C
Ế ’Ễ …
Ễ m› Ê`JO)
s` c 4 <
1 l"
’ Ể ẫ ẻ—Ei.
Ề“ .m, C.
i
3
©
«Q
n—0LV— ²~^
{: MSD
V
iii ISENTRESS"
(raltegravir, MSD)
ForOralUse
_..; ẵ 60Tablets 400mg
ổ ẫ o
è .. d
2 3 n lllll
M
N …Ểoìuễẫễẵẫễẫ
mE ọ.ẵ. ….Ễ:S …ẵs gun…
.ỄuỄụ
3 E!… uẵ Ê 053 50 …ucỉvoE 008.
.ỄẫỀ m:ỉcẵEơụục mo…
.ầcỄaẳcẵznumỉ .…coỄụỉEẵẵụ
.cẵaẵỄEu< uc: umuềD .ềoỄụẳS ồ…
ISENTRESS 400 MG MKOSIS-VNM—20lZ-OO49Z4
S-W PC-M K051 8-MF—0820] 4
* .- ~ Dểxa tẩm tay trẻ em.
. , _’ trưởc khi dùng.
5 JM . '
ẩn themãth
T p " A ' hóiý kỉến bácsỹ
ISENTRESS 400 mg
(Raltegravir)
Viên nén bao phim
THÀNH PHÀN
Hoạt chất: mỗi viên nén bao phim ISENTRESS chứa 434,4 mg muối Raltegravir tương
đương 400 mg Raltegravir.
Tá dược: Cellulose vi tinh thề, Lactose monohydrat, Canxi monohydrogen phosphat,
Hypromellose 2208, Poloxamer 407 (chứa 0,01% Hydroxytoluen butyl hóa iảm chất chống
oxy hóa), Natri stearyl fumarat, magiê stearate.
Mảng bao film OPADRY® II Gray 85F97553 (polyvinyl alcohol, tỉtan díoxĩđc, poiyethyiene
glycol 3350, talc, sẳt oxide).
CHỈ ĐỊNH
Điều trị phối hợp với cảc thuốc khảng retrovirus khảc trong điều trị nhiễm virus suy giảm
miễn dịch ở người (HIV-l).
LIÊU LƯỢNG VÀ CÁCH DÙNG
Viên nén 400 mg:
Điều trị cho bệnh nhân bị nhiễm HlV—l : người lớn 400mg x 2 lầnlngảy, uống cùng hoặc
không cùng vởi thức ăn. Dùng phối hợp ISENTRESS vởi các thuốc khảng retrovirus khảc.
CHỐNG CHỈ ĐỊNH
Quả mẫn với bất cứ thảnh phần nảo của thuốc. ( /
DƯỢC ĐỘNG HỌC
Hấp thu ở người lớn
Raltegravir đuợc hắp thu nhanh với Tmax đạt khoảng 3 gìờ sau khi uống thuốc lúc đói. AUC
vả Cmax của Raltegravir tăng tương ứng vởi liều dùng trong khoảng 100 mg đến 1600 mg.
Raltegravir Cizm tăng tuơng ứng vởi liều trong khoảng 100 đến 800 mg và tăng 1101 ít hơn so
với dùng liều trong khoảng 100 mg đến 1600 mg. Với liều sử dụng 2 lần một ngảy, trạng thải
bền vững dược động học đạt được nhanh chóng, trong khoảng 2 ngảy đầu tiên sau khi dùng
thuốc. Có rất ít hoặc không có tích lũy ở AUC vả Cmax và có sự tích lũy nhẹ ở Ciziư. Chưa xảc
định được sinh khả dụng tuyệt đối cùa raltegravir.
Đối với bệnh nhân dùng đơn trị liệu liều 400 mg hai lần mỗi ngảy, mức độ tiếp xúc vởỉ thuốc
Trang I/22
ISENTRESS 400 MG MKOS] 8-VNM—2012-004924
S-WPC-MKOSl8-MF -082014
raltegravir được đặc trưng bởi số trung bình nhân AUCO_1211r iả 14,3 ụMohr vả C,2h, lả 142
nm.
Ảnh hướng của thửc ăn đến sự hâịu thu theo đường uống
Có thể dùng ISENTRESS cùng hoặc không cùng vói thức ăn. Raltcgravir đă được sử dụng
bất kể đói hoặc no trong cảc nghiên cửu chính về hiệu lực vả độ an toản thuốc ở các bệnh
nhân nhiễm HIV. Ảnh hưỏng của bữa ản có chắt béo ở mức độ cao, trung bình, thấp đến
dược động học cùa raltcgravir ở trạng thải ổn định đã được đánh giá ở cảc tinh nguyện Viên
khỏe mạnh. Sử dụng raltcgravir theo chế độ liều nhiều lần sau bữa ăn có chất béo vừa phải
không lảm ảnh hưởng tởi AUC cùa raltegravir ở mức độ có ý nghĩa trên lâm sảng vói mức độ
gia tăng lả 13% so vởi lúc nhịn ăn, Raltegravir C12hr tăng hơn 66% và Cmax tăng hơn 5% sau
bữa ăn có chất béo vừa phải khi so sảnh với iúc đói. Sử dụng raltegravir sau bữa ăn nhiều
chất béo lảm tăng AUC vả Cmax khoảng 2 lần và lảm tãng Cmư khoảng 4,1 lẩn. Dùng
raitcgravir sau bữa ăn ít béo lảm giảm 46% AUC và 52% C…...; nhưng về cơ bản cm,, không
thay đổi. Thức ăn dường như lảm tăng sự biến thíên dược động học hơn so với lúc đói.
Phân bố ở người iớn
Raltegravir gắn kết khoảng 83% với protein huyết tương người trong giởi hạn nồng độ 2 - 10
ụM.
Raltcgravir qua nhau thai chuột một cảch dễ dảng nhưng không thấm vảo não ở mức độ đáng
kế.
Trong 2 nghiên cứu ở các đối tượng bị nhiễm HIV-l được điều trị bằng raltegravir 400 mg, 2
Iần/ngảy, dễ dảng phát hiện được raltegravir trong dịch não tủy. Trong nghiên cửu đầu tíẽn
(n=18), nồng độ trung bình trong dịch năo tủy lả 5,8% (khoảng giao động từ 1—53,5%) nồng
độ tương ứng trong huyết tương. Trong nghiên cứu thứ hai (n=]6), nồng độ trung binh trong
dịch não tùy là 3% (khoảng giao động từ 1-61%) nồng độ tương ứng trong huyết tương.
Những tỷ lệ trung bình nảy thắp hơn khoảng 3-6 lần so với phân đoạn tự do của raltegravir
trong huyết tương.
Chưyễn hóa và thải trừ & người lớn
Thời gian bản hùy biễu kiến cuối cùng cùa raltegravir là khoảng 9 giờ, với thời gian bán hủy
phasc 0i ngắn hơn (khoảng 1 giờ) giải thích cho độ lởn của AUC. Sau khi uống 1 liều
raltegravir gắn phóng xạ, khoảng 51% liều được bải tiết qua phân và 32% qua nước tiểu.
Trong phân, chi có raltcgravir hiện diện, đa Số có thể từ sự thủy phân raltegravir — glucuronid
được tiết vảo mật khi quan sải tiền lâm sảng ở một số loải. Hai chất raltegravỉr vả raltegravir
—glucuronid phải hiện trong nước tiểu chiếm khoảng 9% và 23% liều. Phần tử lưu hảnh chủ
Trang 2/22
\0`
lSENTRESS 400 MG MKOS] 8-VNM-2Dl 2-004924
S~WPC-MKOSIS-MF-OS2O 14
yếu trong mảu lả raltegravir, chiếm khoảng 70% tống lượng có hoạt tinh phóng xạ, lượng có
hoạt tính phóng xạ còn lại ở huyết tương được cho là raltcgravir — glucuronid. Các nghiên
cứu dùng những chắt ức chế hóa hợc isoform có chọn lọc vả cảc UDP-
glucuronosyltransferasc biểu hiện trên cDNA (UGT) cho thấy UGTiAI lả enzym chính có
vai trò trong việc hình thảnh raltegravir —glucoronid. Do vậy dữ liệu chỉ ra rằng cơ chế chính
giúp thanh thải raltegravir ở người lả quá trình glucuronyl hóa qua trung gian UGTIA] .
DƯỢC LỰC HỌC
Cơ chế tác dụng:
Raltegravir ức chế hoạt tính xúc tác cùa HIV integrase, enzym mã hỏa cần thiết cho sự nhân
lên của virus HIV. Ức chế integrase ngăn chặn việc chèn liên kết cộng hóa trị, hoặc sự liên
hợp genome HIV vởi genome tế bảo chủ trong giai đoạn đầu nhiễm bệnh. Cảo geome HIV
không liên hợp được dẫn đến việc không thể trực tiếp sản sinh cảc phần tử virus gây bệnh
mởi, vì vậy ức chế sự liên hợp giúp ngăn chặn lây nhiễm virus. Raltergravir không có tác
dụng ức chế đáng kể đối với các phosphoryltransferase người bao gồm ADN polymcrasc 0.,
B, và 1.
Vi sinh học
Nồng độ raltegravir 31 :E 20 nm có tác động ức chế 95% (1c95) sự lây lan virus (so sảnh vởi
môi trường cấy nhiễm virus không có thuốc) trong các môi truờng cấy tế bảo lympho T
ngưòi đã bị gây nhiễm với dòng tế bảo đã thích nghi vởi biến thể H9IIIB của HIV-l. Ngoài
ra, nồng độ raltegravir từ 6 tới 50 nM gây ức chế 95% sự lây lan virus trong môi trường nuôi
cấy tế bảo đơn nhân mảu ngoại vi người đã nhiễm với kỹ thuật phân lập lâm sảng chủ yếu
cùa HCV-l, bao gồm phân lập từ 5 tỷp phụ không thuộc B vả cảc thể phân lập đế khảng vởi
các chất ức chế enzym sao chép ngược và ức chế protease. Trong một thí nghiệm về chu kỳ
đơn nhiễm, raltcgravir ngăn cản quá trình nhiễm 23 thể phân lập HIV tiêu biểu lả 5 týp phụ
không thuộc B và 5 dạng tải hợp đang lưu hảnh với giá trị 1ng trong khoảng từ 5 đễn 12 nm.
Raltcgravir cũng ức chế sự nhân lên của một thể phân lặp HIV-2 khi thử nghiệm trong
những tế bảo CEMxI74 (1ch = 6 nm). Hoạt tỉnh đồng vận chống virus thêm vảo được quan
sảt thấy khi những tế bảo lympho T người nhiễm biến thế 14911113 của HIV-l được tỉ vởi
raltegravir kết hợp với những thuốc ức chế enzym sao chép ngược tương tự nucleoside
(NRTI) (zidovudine, zalcitabine, stavudinc, abacavir, tcnofovỉr, didanosine, hoặc
lamivudine); thuốc ức chế enzym sao chép ngược không thuộc nucleoside (NNRTI)
(efavircnz, ncvirapine, hoặc dclavirdỉne); chẳt ức chế protease (indinavir, saquinavir,
ritonavir, amprcnavir, lopinavir, nelfinavir, hoặc atazanavir); hoặc enfuvirtide, chât ức chê
Trang 3/22
ISENTRESS 400 MG MK051 8-VNM—2012-004924
S-WPC-MKOSIS-MF-O8ZOM
quả trinh xâm nhập.
Để kháng thuốc
Cảc đột biển quan sảt được ở HIV-l integrase cho thấy việc khảng raltegravir (tiến triến tù
nghiên cứu in vitro hoặc ở bệnh nhân điều trị với raltegravir) thường bao gồm việc thay thế
tại vị tn’ Y143 (thay đổi thảnh C, H hoặc R) hoặc Q148 (thay đổi thảnh H, K, hoặc R) hoặc
N155 (đổi thảnh H) cộng thêm một hoặc nhiều đột biến bổ sung (như lá L74I/M, 13920,
El38A/K, Gl4OA/S, hoặc V1511).
Những virus tái tổ họp có chứa một đột biển quan trọng (Q148H, K hoặc R, hoặc NISSH)
biểu hiện khả năng sao chẻp giảm và độ nhạy cảm với raitegravir giảm ín vitro. Những đột
biến thứ yếu lảm giảm thêm độ nhạy cảm với raltegravir vả đôi khi tảo động như những đột
biến bất thường về khả năng sao chép virus.
Đột biến đưa đến việc khảng raltergravir nhìn chung cũng đưa đến việc kháng elvitegravir
ửc chế sự vận chuyển sợi integrase. Cảc đột biến ở amino axít 143 đưa đến việc khảng
raltegravir nhiều hơn so với elvitegravir, và đột biến E92Q mang iại việc kháng elvitegravir
nhiều hơn raltegravir. Các virus chứa một đột biến ở amino axit 148, cùng với một hoặc hơn
một đột biến khảng raltegravir khảc, có thể cũng kháng dolutegravir có ý nghĩa lâm sảng
Sinh lý đỉện tim
Trong một nghiên cứu ngẫu nhiên, đối chứng vởi placebo, vả hoản đối, thực hiện trên 31 đối
tượng khỏe mạnh được cho uống liều đơn raltegravir 1600 mg cao hơn iiều trị liệu và
placebo. Không phát hiện thấy ảnh hướng đến khoảng cảch QTc. Nồng độ đinh raltegravir
huyết tương cao hơn xấp xỉ 4 lần nồng độ đỉnh của liều 400 mg.
THẬN TRỌNG , /
Phản ứng trên da trâm trọng và phản ứng quá mân
Các phản ứng da trầm trọng, có khả năng đe dọa tính mạng và gây tử vong đã được báo cảo ở
những bệnh nhân dùng ISENTRESS đồng thời với các thuốc khảc liên quan với những phản
ứng nảy, bao gồm các trường hợp hội chứng Stevens-Johnson vả hoại từ biểu bì nhiễm độc.
Phản ứng quá mẫn cũng đã được bảo cảo và đặc trưng bới phát ban, cảc dấu hiệu về thể chất
và đôi khi rối loạn chức năng cơ quan, bao gồm cả suy gan. Phải ngùng dùng ISENTRESS vả
cảc thuốc nghi ngờ khảo ngay lập tức nếu có các dấu hiệu hoặc triệu chứng về phản ứng da
nặng hoặc phản ứng quả mẫn (bao gồm, nhưng không giới hạn, phát ban nặng hoặc ban kèm
theo sốt, khó chịu toản thân, mệt mỏi, đau cơ hoặc đau khớp, bóng nước, tốn thương miệng,
viêm kết mạc, phù mặt, viêm gan, tăng bạch cầu ưa eosin, phù mạch). Cần theo dõi tinh trạng
lâm sảng, kể cả trị số aminotransferase của gan và bắt đầu điều trị thích hợp. Chậm trễ trong
Trang 4/22
ISENTRESS 400 MG MKOSIS-VNM-ZOI2-OIM924
S—WPC-M K0518-MF-082014
việc ngừng điều trị bằng ISENTRESS hoặc cảc thuốc nghi ngờ khác sau khi khởi phát nổi
ban nặng có thể dẫn đển phản ửng đe dọa tính mạng.
Tương tác thuốc
Dùng đồng thời ISENTRESS với thuốc khảng acid chứa nhôm và magiê dẫn đến giảm nồng
độ raltegravir trong huyết tương. Không khuyến cảo dùng đồng thời ISENTRESS với thuốc
khảng acid chứa nhôm vả/hoặc magiê (xem phần TƯONG TÁC VỚI CÁC THUỐC KHÁC
VÀ CÁC DẠNG TƯỚNG TÁC KHÁC).
Cần thận trọng khi dùng đồng thời ISENTRESS với cảc thuốc gây cảm ứng mạnh uridine
diphosphatc glucuronosyltransferase (UGT) 1Al (ví dụ rifampin) do giảm nồng độ
raltegravir trong huyết tương (xem phần TƯỢNG TÁC VỚI CÁC THUỐC KHÁC VÀ CÁC
DẠNG TƯONG TÁC KHÁC).
Hội chứngphục hồi miễn dịch
Trong giai đoạn đầu điều trị, bệnh nhân đảp ứng liệu phảp kháng retrovírus có thế có phân
ứng viêm do nhiễm trùng không đau hoặc nhiễm trùng cơ hội tồn dư (như phức hợp
Mycobacterium avium, cytomegalovirus, viêm phối do Pneumocystisjirovecỉ, và lao, hoặc tải
hoạt hóa virus varicella zoster), những đối tượng nảy cần được đánh giả và điều trị thêm.
Cảc rối loạn tự miễn (như bệnh Graves) cũng đã được báo cáo xảy ra trong bối cảnh phục hồi
miễn dịch, tuy nhiên, thời gian khới phải được bảo cảo biến thiên nhỉều và những phản ứng
nảy có thể xảy ra nhiều tháng sau khi bắt đầu đỉều trị.
PHỤ NỮ có THAI
Cảo nghiên cứu độc tính tiến triển được thực hiện trên thỏ (liều đến 1000 mg/kg/ngảy) và
chuột (liều đến 600 mglkg/ngảy). Những liều tối đa trong cảc nghiên cửu nảy tạo ra mức phơi
nhiễm toản thân ở thô và chuột gấp 34 lần dùng liều khuyến cáo ớ người. ó thỏ, không có
những thay đối bên ngoải, nội tạng hoặc hệ xương của cơ thể liên quan đến điều trị. Ớ chuột
dùng liều 600 mg/kg/ngảy, có sự gia tăng tỷ lệ xương sườn phảt triển thừa được ghi nhận có
liên quan đến điều ni khi so với nhóm chứng (mức độ phơi nhiễm cao hơn 4,4 lần so với liều
khuyến cảo dùng ở người). Không ghi nhận bất kỳ tảo động nảo liên quan đến điều trị ớ cả
thò và chuột đối với sự sống sót của phôi/thai nhi hoặc trọng lượng thai nhi.
Ở chuột cống mẹ khi áp dụng liều 600 mg/kg/ngảy, nồng độ thuốc trung bình trong huyết
tương bảo thai cao hơn khoảng 1,5 — 2,5 lần nồng độ thuốc trong huyết tương chuột mẹ sau
khi dùng thuốc 1 giờ và 24 gìờ. Đối với thỏ mẹ, khi dùng liều 1000 mg/kg/ngảy, nồng độ
thuốc trung bình ở huyết tương bảo thai vảo khoảng 2% nồng độ thuốc trung bình ở thỏ mẹ
sau khi dùng thuốc 1 gỉờ và 24 giờ. Cảo nghiên cứu độc lực học đã chứng minh thuốc đi qua
Trang 5/22
\\'
ISENTRESS 400 MG MKOSIS-VNM-ZOIZ-OCM9Z4
S-WPC-MKÙSIS-MF—082OI4
nhau thai ở cả hai loải trên.
Hiện vẫn chưa có những nghiên cứu thích đáng và kiếm chứng tốt ở phụ nữ mang thai; do đó,
độ an toản của ISENTRESS đối với phụ nữ mang thai vẫn chưa được biết. Tương tự như
những thuốc kháng retrovirus khác, không khuyến cáo dùng ISENTRESS cho phụ nữ mang
thai.
PHỤ NỮ CHO CON BỦ
Vẫn chưa biết rõ raltegravir có tiết vảo sữa mẹ hay không. Tưy nhiên, raitegravir được bải tiết
qua sữa mẹ ở loải chuột cống. Khi sử dụng liều 600 mg/kg/ngảy ở chuột cống mẹ, nồng độ
thuốc trung bình trong sữa cao hơn khoảng 3 iần so với nồng độ thuốc ở hưyết tương chuột
mẹ. Không khuyến cảo nuôi con bằng sữa mẹ trong thời gian người mẹ dùng ISENTRESS.
Ngoài ra, các bà mẹ nhiễm HIV được khuyến cảo không cho con bú mẹ để tránh nguy cơ lây
nhiễm HIV sau khi sinh.
TÁC ĐỘNG ĐỎI VÓ] KHẢ NĂNG LÁ] XE VÀ VẶN HÀNH MÁY MÓC
Có một số tảo dụng phụ của ISENTRESS được báo cáo là có thể ảnh hướng đến khả năng lái
xe và vận hảnh máy. Đáp ứng với ISENTRESS có thể khảc nhau ở mỗi người.
(xem phần TÁC DỤNG KHÔNG MONG MUÔN)
SỬ DỤNG CHO NGƯỜI CAO TUỔI
Cảo nghiên cửu lâm sảng cùa ISENTRESS không có đủ số lượng bệnh nhân từ 65 tuồi trở lên
để xảc định sự khảc biệt trong đáp ửng ở lứa tuổi nảy so với cảc bệnh nhân trẻ tuổi. Kinh
nghiệm lâm sảng khảo được báo cáo không xác định thấy sự khác biệt trong đảp ứng ở người
giả vả bệnh nhân trẻ tuổi. Nói chung, nên thận trọng trong việc chọn liều cho bệnh nhân cao
tuồi nhằm tránh tần suất cao gây giảm chức năng gan, thận hoặc tim mạch, bệnh đi kèm hoặc /
liệu pháp điều trị bằng thuốc khác.
QUÁ LIÊU
Không có thông tin chuyên biệt về việc xử lý quá liều với ISENTRESS. Nghiên cứu Giai
đoạn I không thấy dắu hiệu độc tính khi dùng chế độ liều đơn cao đến 1600 mg và đa liều
800 mg, ngảy dùng 2 lần (b.ỉ.d). Trong các nghiên cửu Gíai đoạn 111111, không thấy có dấu
hiệu độc tính khi ngẫu nhiên dùng cảc liều 1800 mg/ ngảy. Căn cứ vả.o cơ sở dữ liệu sẵn cớ,
raltcgravir dường như dung nạp tốt ở liều lên đến 800 mg x 2 lần/ngảy và khi dùng với cảc
thuốc lảm tăng nồng độ tiếp xúc 50-70% (như tcnofovitt vá ataz.anavir). Raltegravir có biên
điều trị rộng; do đó khả năng gây độc tinh do quá 1iều củng bị hạn chế.
Trong trường hợp bị quá 1iều, cẩn phải thực hiện những biện phảp hỗ trợ thường dùng, như
loại bỏ chẳt chưa được hắp thu ra khỏi đưòng dạ dảy-ruột, theo dõi lâm sảng (kể cả lảm điện
Tran g 6/22
ISENTRESS 400 MG MK0518—VNM-2012—004924
S-WPC—MKOS 18—M F-082014
tâm đồ), và điều trị hỗ trợ nếu cần thiết. Hiện chưa rõ có thể thẩm tách ISENTRESS đển mức
độ nảo.
TƯONG TÁC vót CÁC THUỐC KHÁC VÀ CÁC DẠNG TƯỜNG TÁC KHÁC
Raltegravir không phải là chất nền cùa enzym cytochrome P450 (CYP) và không ức chế in
vitro (le0>100 ựm) CYP1A2, CYPZBó, CYP2C8, CYP2C9, CYP2CI9, CYP2D6 hoặc
CYP3A. Thêm vảo đó, raltcgravir không gây cảm ửng CYP3A4 in vitro. Một nghiên cứu Về
tương tác với thuốc midazolam khẳng định raltegravir ít có khưynh hướng 1ảm thay đồi dược
động học cùa các chất bị chuyến hóa bởi CYP3A4 in vivo, bằng chứng là raltcgravir không
có tảc động có ý nghĩa lên dược động học cùa midazol'am, một chất nền CYP3A4 nhạy cảm.
Tương tự, raltegravir không phải là chẩt ức chế (ICSO>SO ụm) các UDP-
glucuronosyltransfcrase (UGTS) đã thử nghiệm (UGTIAI, UGT2B7), vả raltcgravir không
ức chế sự vận chuyển qua trung gian P—glycoprotcin. Dựa trên cảc dữ liệu nảy, ISENTRESS
không được cho là có ảnh hưởng đến dược động học cùa những thuốc lá chắt nền cũa những
cnzym nảy hoặc P-glycoprotein (như các chất ức chế protease, NNRTIs, methadone, thuốc
giảm đau opioid, statins, thuốc kháng nấm loại azole, cảc chất ức chế bơm proton và những
chất chống rối loạn cương dương).
Căn cứ vảo những kết quả nghiên cứu in vivo và in vitro, raltcgravir được đảo thải chủ yếu
do chuyển hóa glucuronyl hóa qua trung gian UGTIAI.
Sử dụng ISENTRESS đồng thời với nhũng chẳt gây cảm ứng mạnh UGTIAI, chẳng hạn
như rifampin (một chất gây cảm ứng rất nhiều enzym chuyến hóa thuốc) sẽ lảm giảm nồng
độ ISENTRESS trong huyết tương. Cần thận trọng khi dùng cùng lúc ISENTRESS với
rifampìn hoặc nhũng chẳt cảm ứng mạnh UGTIAI khác (xem THẬN TRỌNG).Tảc động
cùa những chất cảm ứng mạnh enzym chuyến hóa thuốc khác, như phenytoin vả
phenobarbita], lên UGTIA] vẫn chưa biết rõ. Những chất cảm ứng yếu hơn (ví dụ cfavircnz,
nevirapinc, rifabutin, các glucocorticoid, thảo dược St. John, pioglitazone) có thể được dùng
cùng vởi liều ISENTRESS khuyến cáo.
Sử dụng đồng thời ISENTRESS với nhũng thuốc được xem là chất ức chế mạnh UGTIA]
(như atazanavir) lảm tăng nồng độ ISENTRESS trong huyết tương. Tuy nhiên, cảc nghiên
cứu lâm sảng cho thắy mức độ gia tăng vừa phải và liệu phảp phối hợp cảc chất ức chế nảy
được dung nạp tốt do đó không cần điều chinh liều điều trị.
Dùng đồng thời ISENTRESS với thuốc kháng acid chứa cảc catíon kim loại hóa trị hai có thế
lảm giảm sự hấp thu raltegravir do sự chelat hóa, dẫn đến giảm nồng độ raltcgravir trong
huyết tương. Sử dụng thuốc khảng acid chứa nhôm và magiê trong vòng 2 giờ sau khi dùng
Trang 7122
ẨV
ISENTRESS 400 MG MK0518—VNM-2012-004924
S-WPC-MKOSIS-MF-D8ZOM
ISENTRESS lảm giảm đáng kể nồng độ raltcgravir trong huyết tương. Vì vậy, không khuyến
cáo dùng đồng thời ISENTRESS với thuốc kháng acid chứa nhôm vảfhoặc magiê. Dùng
đồng thời ISENTRESS với thuốc kháng acid chứa canxi carbonat iảm giảm nồng độ
raitegravir trong huyết tương, tuy nhiên tương tác nảy không được xem là có ý nghĩa lâm
sảng. Vì vậy, khi dùng đồng thời ISENTRESS với thuốc khảng acid chứa canxi carbonat,
không khuyến cảo điều chinh liều.
Sử dụng đồng thời ISENTRESS với những thuốc được biết 12 iảm tãng pH dạ dảy (như
ớmeprnzoic) có thế lảm tăng nồng độ ISENTRESS huyết tương do tăng hòa tan ISENTRESS
trong môi trường pH cao hơn. Với các đối tượng đã đùng ISENTRESS kết hợp vởì các chắt
ức chế bơm proton hoặc chất chẹn H2 trong đề cương nghiên cứu 018 và 019, hồ sơ nn toản
được ghi nhận tương đương ở phân nhóm đối tượng nảy so với nhóm đối tượng không dùng
cảc chất ức chế bơm proton hoặc chất chẹn H2. Dục trên cơ sở nảy, có thế sử dụng cảc chất
ức chế bơm proton vả chẹn 112 đổng thời với ISENTRESS mả khõng cằn điều chĩnh liều.
Ảnh hưởng của Raltegravir lên dược động học của cảc chẩt khảo
Các nghiên cứu về tương tảc thuốc cho thấy raltegravir không gây ảnh hưởng có ý nghĩa trên
lâm sảng đến dược động học của cảc chất sau: thuốc ngùa thai chứa hormon, methadone,
tenofovir, midazolam, lamuvidinc, ctravirine, darunavirlritonavir vả boccprevir. Trong một
nghíên cứu tương tảo thuốc dùng liễu nhiến lần, trị số AUC cùa ethinyl cstradiol là 98% và
cùa norelgcstromin lả 114% khi được sử dụng đồng thời với raltegravir so sảnh với không
dùng cùng lủc với raltegravir. Trong một nghiên cứu tương tảc thuốc dùng liều nhiều iần,
AUC vả cảc nồng độ tối thiếu của tcnofovir khi dùng cùng raltegravir có trị số bằng 90% vả
87% giá trị thu được khi dùng tenofovir đơn trị. Trong một nghiên cứu khảo về tương tác
thuốc, trị số AUC midazolam khi dùng kết hợp bằng 92% giá trị thu được khi dùng
midazolam đơn thuần. Trong một nghiên cứu giai đoạn II, dược động học của lamivudine
dùng kết hợp với raltegravir cũng tương tự như dùng kết hợp với cfavircnz.
Ảnh hưởng của những thuốc khác lên dược động học của Raltegravir
Các nghiên cứu về tưong tảo thuốc cho thấy atazanavỉr, cfavirenz, ritonavir, tcnofovir, vả
tipranavirlrítonavir không có ảnh hưởng có ý nghĩa về mặt lâm sảng lên. dược động học của.
raltegravir. Rifarnpin, một chắt cảm ứng mạnh các enzym chuyển hóa thuốc, lảm giảm nồng
độ tối thiểu của raltegravir.
Thuốc kháng acid chứa nhôm và magiê lảm giảm đảng kể nồng độ raltcgravir trong huyết
tương. Không khuyến cáo dùng đồng thời ISENTRESS với thuốc kháng acid chửa nhôm
vảlhoặc magiê.
Trưng 8/22
ISENTRESS 400 MG MK0518-VNM-2012-004924
S-WPC—MKOS] 8-MF-082014
Tất cả cảc nghiên cứu về tương tảo được tiến hảnh ở người lởn. Sự tương tác thuốc được mô
tả chi tiết hơn trong Bảng 1 sau đây.
Trang 9/22
ISENTRESS 400 MG
MK051 8-VNM-2012-004 924
S-WPC-MKOS 1 8-MF-082014
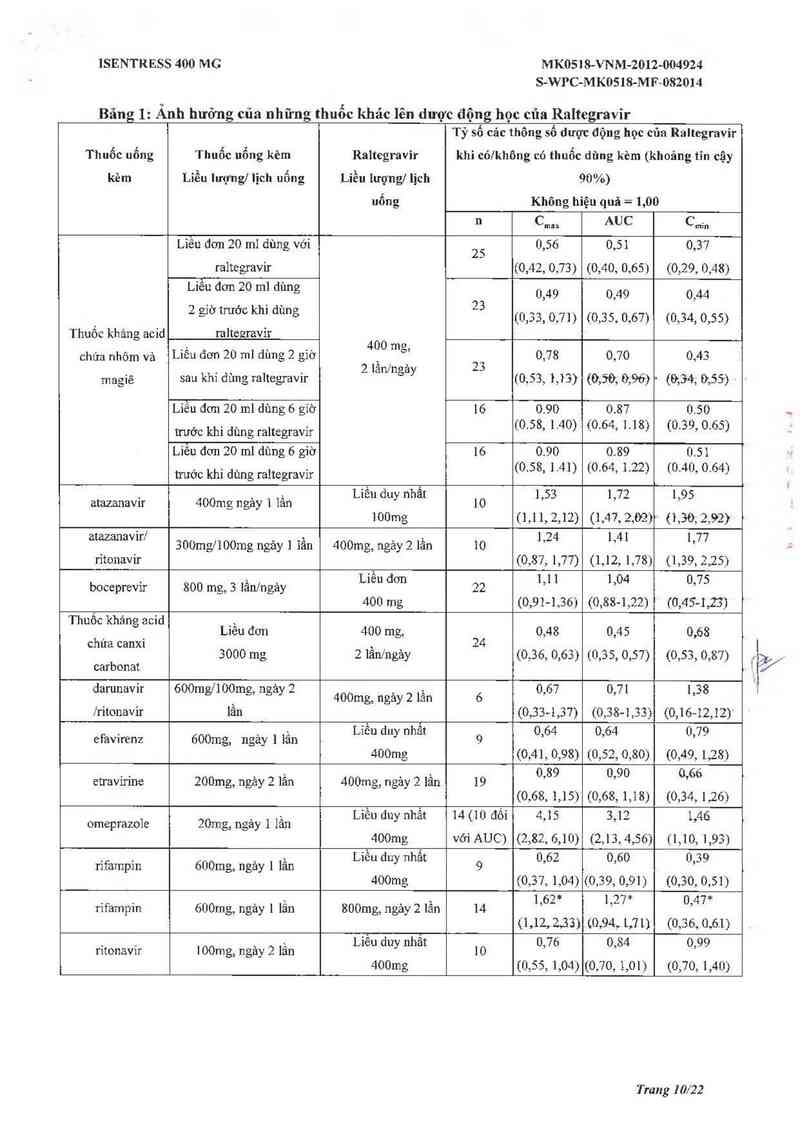
Bảng 1: Ẩnh hưởng của những thuốc khác lên dược động học của Raltegravỉr
Tỷ số cảc thông số dược động học cũa Raltegravir
Thuốc uổng Thuốc uổng kèm Raltegravir khi cólkhông có thuốc dùng kèm (khoảng tin cậy
kèm Liều lượng] lịch uống Liều lượng] lịch 90%)
nổng Không hiệu quả = 1,00
n Cmax AUC Cmin
Liêu đơn 20 ml dùng với 25 0,56 0,51 0,37
raltegravir (0,42, 0,73) (0,40, 0,65) (0,29, 0,48)
Liêu đơn 20 m] dùng 23 0’49 0’49 0’44
² g” Ĩfướ° kh' dung (0,33, 0,71) (0,35, 0,67) (0,34, 0,55)
Thuốc kháng acid ra]tczravir
_. , _, 400 mg,
chứa nhôm Vả Ltẽu đơn 20 ml dung 2 giơ ` 23 0,78 0,70 0,43
2 I“ | ả
magic sau khi đùng raltegravir a“ ng y (0,53, 1,13) (0,50, 0,96) - (t›,34, 0,551
Liều đơn 20 ml dùng 6 giờ 16 0.90 0.87 0.50
trước khi dùng raltegravir (0.58, 1.40) (0.64, 1.18) (0.39, 0.65)
Liêu đơn 20 ml dùng 6 gìờ 16 0.90 0.89 0.51
trưởc khi dùng rahegravir (0.58, 1.41) (0.64, 1.22) (0.40, 0.64)
. . L'ề đ hất 1,53 1,72 1,
atazanavư 400mg ngảy 1 lân 1 11 uy n 10 95
100mg (1,11, 2,12) (1,47, 2,02) (1,30, 2,92)
' . . 1 41
atmnaVưj 300mg/100mg ngảy 1 1ân 400mg, ngảy 2 16“… 10 1’24 ’ 1’77
ritonavir (0,87, 1,77) (1,12, 1,78) (1,39, 2,25)
. 'i 1 11 1 4
boccprevir 800 mg, 3 lân/ngảy L1cu đớn 22 ’ ’0 0’75
400 mg (0,91-1,36) (0,88-1,22) (0,45-1,231
Thuốc kháng acid _.
Liêu đơn 400 mg, 0,48 0,45 0,68
chứa canxi , ` 24
3000 mg 2 lân/ngay (0,36, 0,63) (0,35, 0,57) (0,53, 0,87)
carbonat
darunavư 600mg/100mg, ngay 2 400mg, ngầy 2 lần 6 0,67 0,71 1,38
/ritonavir lân (0,33-1,37) (0,38-1,33) (0,16—12,12)
efavirenz 600mg, ngảy 1 iần L1cu duy nhat 9 0’64 0’64 0’79
400mg (0,41, 0,98) (0,52, 0,80) (0,49, 1,28)
— . . ; 0,89 0,90 ,
cưavinne 200mg, ngảy 2 lân 400mg, ngay 2 lan 19 0 66
(0,68, 1,15) (0,68, 1,18) (0,34, 1,26)
. “~ ~'i 14 1 *“ 4 3 12
omeprazole 20mg, ngảy 1 lân Licu duy nha ( 0 đ… ,]5 , 1,46
400mg với AUC) (2,82, 6,10) (2,13, 4,56) (1,10, 1,93)
. L"` d h' 0 62 0 60
rifampin 600mg, ngảy 1 lân 1cu uyn ât 9 ’ ’ 0’39
400mg (0,37, 1,04) (0,39, 0,91) (0,30, 0,51)
. . 1,62* 1,2 * 0,47*
rifampin 600mg, ngảy 1 lân 800mg, ngảy 2 iân 14 7
(1,12, 2,33) (0,94- 1,71) (0,36, 0,61)
. '“ ” 0 76 4 99
ritonavir lOOrng, ngảy 2 lân Lleu duy nhat 10 ’ 0’8 0’
400mg (0,55, 1,04) (0,70, 1,01) (0,70, 1,40)
Tran g 10/22
ISENTRESS 400 MG MKOSIS-VNM-ZOH-OM924
S-WPC-MKOSIS-MF-OSNM
, , 1,64 1,49 ,0
tenofovir 300mg,ngảy 1 lân 400111g, ngảy 2 lân 9 I 3
(1,16, 2,32) (1,15, 1,94) (0,73, 1,45)
. - , , , ^" 0 82
npfflnavm 500mg/200mg, ngảy 2 lân 400111g,11gảy 2 lân 15 … đO' ’ 0’76 0’45
ritonavỉr với cmin) (0,46, 1,46) (0,49, 1,19) (0,31, 0,66)
* So với dùng đơn độc liều 400mg, 2 lần mỗi ngảy
TÁC DỤNG KHÔNG MONG MUỐN
N gười lớn
Phản ửng bẩt lọi ở bệnh nhân đã qua điều trị
Việc đảnh giá tính an toản cùa ISENTRESS ở cảc bộnh nhân đã qua điếu trị dựa vảo dữ liệu
an toả.n tống hợp từ những nghiên cứu lâm sảng phân nhóm ngẫu nhiên bao gồm nghiên cứu
1101 8 và P019, với lỉều khuyến cảo ISENTRESS 400 mg dùng 2 lần mỗi ngảy kết hợp với
liệu pháp cơ bản lỉều tối ưu (optimized background therapy-OBT) & 462 bệnh nhân, so sảnh
vởi 237 bệnh nhân dùng placebo kết hợp vởi OBT. Trong giai đoạn điểu trị mù đôi, tổng số
bệnh nhân đuợc theo dõi lả 1051 bệnh nhân trong nhóm điều 111 bằng ISENTRESS 400 mg2.
lần mỗi ngây vả 322 bệnh nhân nhóm placebo.
Đối vởi các bệnh nhân thuộc nhóm nhận ISENTRESS 400 mg hai lần mỗi ngảy cùng OBT
(trung bình 118,7 tuấn theo dõi) và nhóm placebo dùng OBT (trung bình 71,0 tuần theo dõi)
trong phân tích tổng hợp từ các nghiên cửu P018 vả 13019, các phản ứng bất 161 được bảo cáo
nhiều nhất (>10% trong cả hai nhóm) gồm tất cả cường độ và không kể nguyên nhân lần lượt
lả: tiêu chảy 26,6% vả 24,9%, buồn nôn 13,6% và 16%, nhức đầu 12,1% vả 13,5%, vìêm mũi
họng 14,3% và 8,9%, mệt mỏi 12,1% vả 5,9%, nhiễm trùng đuờng hô hấp trên 15,8% vả
10,1%, viêm phế quản 12,1% vả 6,8%, sốt 9,7% và 13,9%, nôn mừa 8,9% và 11,0% bệnh
nhân. Trong phân tích tổng hợp nảy, tỷ lệ bệnh nhân ngưng điều trị do tác dụng bất lợi là
4,5% ở nhóm dùng ISENTRESS+OBT và 5,5% ở nhóm dùng placebo+OBT.
Phản úng bất lơi liên auan đển thuốc
Những phản ứng bất lợi trên lâm sảng liệt kê dưới đây được các nhà nghíên cứu @ nhận có
cường độ trung bình đển nặng có nguyên nhân liên quan đến ISENTRESS hoặc placebo dùng
đơn độc hoặc dùng kết hợp với OBT.
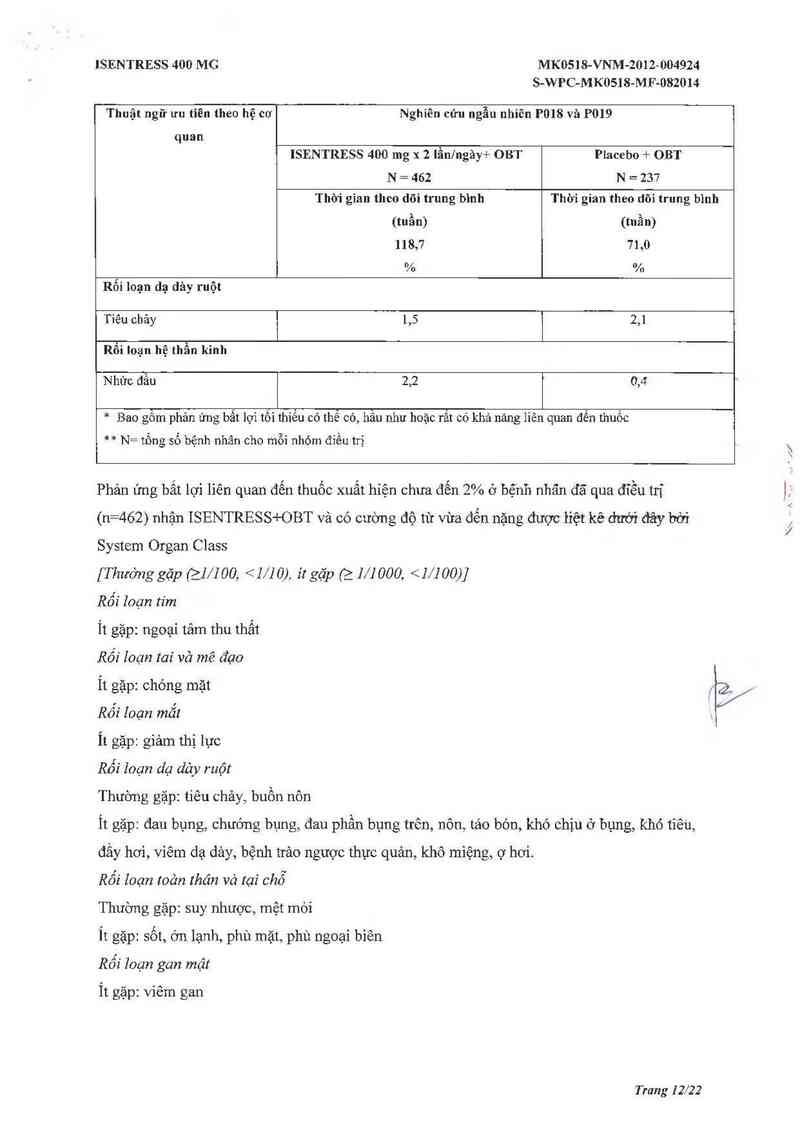
Bảng 2 trình bảy những phản ủng bất lọi trên lâm sảng liên quan đến thuốc có mức độ vừa
đến nặng xảy ra ở 2 2% bệnh nhân nguời lởn đã qua điều trị trong cả hai nhóm
Bảng 2: Tỷ lệ bệnh nhân có phản ứng bất lọi liên quan đến thuốc* vởi cường độ từ vừa
đẽn nặng xuất hiện ở 2 2% bệnh nhân người lớn đã qua điêu trị ở cả hai nhóm**
Trang ] 1f22
ISENTRESS 400 MG MK051 8-VNM-2012—004924
S-WPC-MKOSIS-MF-OSZOM
Thuật ngữ ưu tỉên theo hệ cơ Nghiên cứu ngẫu nhiên P018 vả P019
quan
ISENTRESS 400 mg x 2 Iân/ngảy+ OBT Placebo + OBT
N = 462 N = 237
Thôi gian theo dõi trung bình Thời gian theo dõi trung bình
(tuần) (tnần)
118,7 71,0
% %
Rối Ioạn dạ dảy ruột
Tiêu chảy 1,5 2,1
Rồi loạn hệ thần kinh
Nhức đầu 2,2 0,4
* Bao gỗĨn phản ứng bất lợi tồi thiểu có thẻ có, hâu như hoặc rãt có khả năng liên quan đến Lhuốc
** N= tồng số bệnh nhân cho mỗi nhóm đíều trị
.'x7
Phản ứng bất lợi liên quan đến thuốc xuất hiện chưa đến 2% ở bệnh nhãn đã qua đĩễu trị
(n=462) nhận ISENTRESS+OBT và có cường độ từ vừa đến nặng được liệt kê dưới đây bời
System Organ Class
[Thường gặp (21/100, <1/10), ít gặp (_>_ mooo, <1/100)]
Rôz' loạn tim
\\
Ỉt gặp: ngoại tâm thu thất
Rối loạn tai và mê đạo
Ít gặp: chóng mật
Rối loạn mắt
Ít gặp: giảm thị lực
Rối loạn dạ dảy ruột
Thường gặp: tiêu chảy, buồn nôn
Ít gặp: đau bụng, chướng bụng, đau phần bụng trên, nôn, táo bón, khó chịu ở bụng, khó tiêu,
đầy hơi, viêm dạ dảy, bệnh trảo ngược thực quản, khô miệng, ợ hơi.
Rối loạn toản lhán và tại chỗ
Thường gặp: suy nhược, mệt mòi
Ít gặp: sốt, ởn lạnh, phù mặt, phù ngoại bìên
Rối loạn gan mật
Ĩt gặp: viêm gan
Trang 12122
ỈSENTRESS 400 MG MK0518-VNM—2012-004924
S-WPC-MKDSl8-M F-082014
Rối loạn hệ thống miễn dịch
Ít gặp: mẫn cảm với thuốc
Bệnh nhiễm trùng vả ký sinh trùng
Ỉt gặp: herpes simplex, herpes sinh dục, viêm dạ dảy-ruột
Khám, xét nghiệm
Ít gặp: tăng cân, giảm cân
Rối Zoợn dính dưỡng và chuyển hóa
Ít gặp: đảí thảo đường, rối loạn1ipid mảu, tăng thèm ản, giảm ngon miệng
Rối loạn cơ xương và mô liên kểt
Ỉt gặp: đau khớp, đau cơ, đau lưng, đau cơ và xương, loãng xương, viêm đa khởp
Rối loạn hệ thần kinh
Ít gặp: choáng váng, bệnh thần kinh ngoại bíên, dị cảm, ngủ gả, nhức đầu căng cơ, rung giật
Rối loạn tâm lhần
Ít gặp: trầm cảm, mất ngủ, lo âu
Rối loạn thận và tiễt niệu
Ít gặp: viêm thặn, sỏi thận, tiễu đêm, suy thận, viêm ống - thận kẽ
Rối loạn tuyến vú vờ hệ sinh sán
Ỉt gặp: vú to ở đản ông
Rối loạn hô hấp, ngực và trung thất
Ỉt gặp: chảy máu mũi
Rối loạn da vả mô dưới da
Ít gặp: chứng rối loạn mô mỡ mắc phải, phảt ban, tãng tiểt mồ hôi, viêm da dạng trứng cá 1 /
(acneiform), ban đò, phì đại mô mỡ, đổ mồ hôi đêm, ban vết, ban dạng sẩn, phảt ban ngứa,
khô da, ngửa sần, teo mô mỡ, ngửa.
Phản ứm,T bẩi lơi thz'ẽm trongr
Những phản ứng bất lợi liên quan đến thuốc sau đây đuợc báo cáo trong cảc thử nghiệm lâm
sảng: viêm dạ dảy, viêm gan, suy thận, herpes sinh dục, quá liều ngẫu nhìên
Phản ửng bẩt 1ợi 6 bệnh nhân chua đỉều trị
Đánh giá độ an toản cùa ISENTRESS đối với bệnh nhân chưa điều trị dựa vảo nghiên cứu mù
đôi ngẫu nhiên có đối chứng, protocol 021 (STARMRK), với ISENTRESS 400 mg dùng mỗi
ngảy 2 lằn kết hợp vởi liều cố định emtrỉcitabine 200 mg (+) tenofovir 245 mg (N=281) so
với dùng efavìrenz (EFV) 600 mg lúc đi ngủ kểt hợp vởi emtricitabine (+) tenofovir (N=282).
Trong giai đoạn điều trị mù đôi, tổng số bệnh nhân đuợc theo dõi ở nhóm ISENTRESS 400
Trang 13/22
ỈSENTRESS 400 MG MK0518-VNM-2012-004924
S-WPC-MKDSIS-MF—OSZOI4
mg hai lẫn mỗi ngảy + emtrícitabine (+) tenofovir là 1104 bệnh nhân và 1036 bệnh nhân ở
nhóm efavirenz 600 mg uống lúc đi ngủ + emtricitabine (+) tenofovir.
Tỷ lệ (%) bệnh nhân có phản ứng bất lợi và có phản ứng bất lợi liên quan đến thuốc trong
nhóm sử dụng ISENTRESS ít hơn so với nhóm sử dụng efavirenz, dựa theo trị số p rất thấp
(0,325 vả <0,001 , tương ứng). Trong nghiên cứu nảy, tỷ lệ ngưng điều trị do phản ứng bất lợi
là 5,0% đối với bệnh nhân sử dụng ISENTRESS + emtricitabỉne (+) tenofovir và 10,0% đối
với bệnh nhân sử dụng efavirenz + emtricítabine (+) tenofovir.
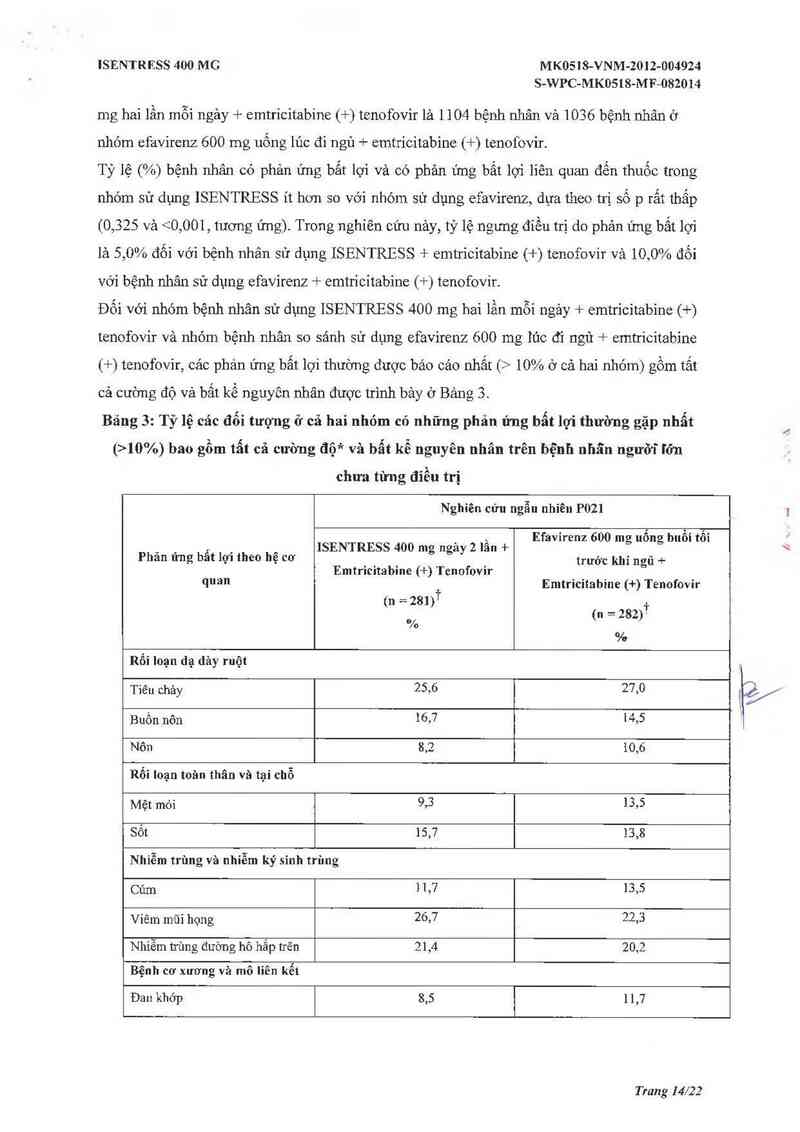
Đối vởi nhóm bệnh nhân sử dụng ISENTRESS 400 mg hai lần mỗi ngảy + emtricitabìne (+)
tenofovir và nhóm bệnh nhân so sảnh sử dụng efavirenz 600 mg 1ủc đi ngủ + emtricitabine
(+) tenofovir, các phản ứng bẩt lợi thường được báo cáo nhất (> 10% ở cả hai nhóm) gồm tắt
cả cường độ và bất kể nguyên nhân được trình bảy ở Bảng 3.
Bảng 31 Tỷ lệ cảc đối tượng ở cả hai nhỏm có những phản ửng bẫt lợi thường gặp nhẩt
(>10%) bao gồm tẩt cả cường flộả vả bẩt kể nguyên nhân trên bệnh nhấn ngưỡĩ I’ớn
chưa từng điều trị
Nghỉên cứu ngẫu nhiên P021
_ , Efavirenz 600 mg uống buổi tổi
ISENTRESS 400 mg ngay 2 lân +
Phản ửng bẩt lợi theo hệ cơ trước khi ngủ .).
Emtricitabine (+) Tenofovỉr
quan Emtricitabine (+) Tenofovir
(n = 2131)’r ,
(n = 282)
°/o
%
Rối loạn dạ dảy ruột
Tìêu chảy 25,6 27,0
Buồn nôn ÌỔJ 1415
Nôn 8,2 10,6
Rối loạn toân thân vã tại chỗ
Mệt mỏi 9,3 13,5
Sốt 15,7 13,8
Nhiễm trùng vả nhỉễm ký sỉnh trùng
Củm 1 1,7 13,5
Viêm mũi họng 26,7 22,3
Nhiễm trùng đường hô hắp trên 21,4 20,2
Bệnh cơ xương và mô liên kểt
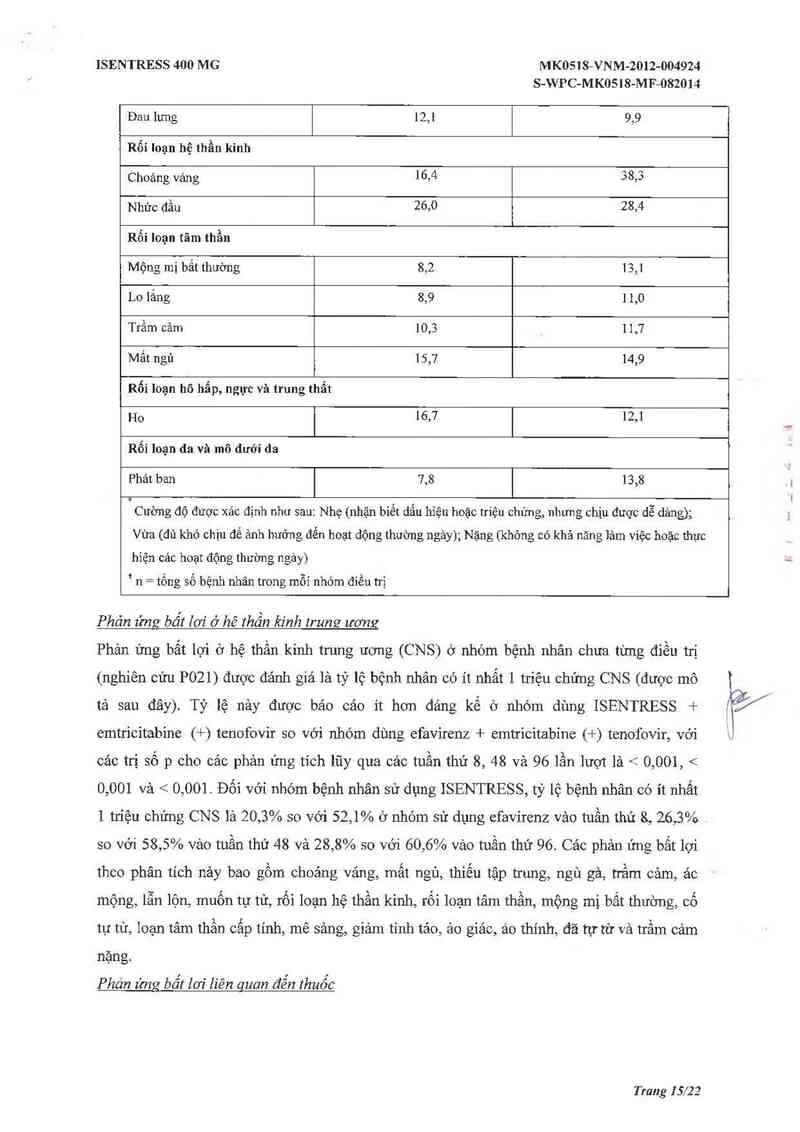
Đau khớp 8,5 1 1,7
Trang I4/22
ISENTRESS 400 MG MK0518-VNM-2012-004924
S—WPC-MKOSIS-MF-OS2OM
Đau lưng 12,1 9,9
Rối loạn hệ thần kinh
Choáng váng 16,4 38,3
Nhức đầu 26,0 28,4
Rối Ioạn tãm thần
Mộng mị bất thường 8,2 13,1
Lo lắng 8,9 1 1,0
Trầm cảm 10,3 11,7
Mất ngủ 15,7 14,9
Rối loạn hô hẳp, ngực và trung thẩt
Ho 16,7 12,1
Rối loạn da và mô đưới da
Phảt ban 7,8 13,8
' Cường độ được xác định như sau: Nhẹ (nhận biết dắu hiệu hoặc triệu chứng, nhưng chịu được dễ dảng);
Vừa (đủ khó chịu để ảnh hưởng đển hoạt động thuờng ngảy); Nặng (không có khả năng lảm việc hoặc thực
hiện các hoạt động thường ngảy)
' n = tống số bệnh nhân trong mỗi nhóm điều trị
Phán ửmz bẩt lơi ở hê thần kinh lrunQ ươmz
Phản ứng bất lợi 6 hệ thần kinh trung ương (CNS) ở nhóm bệnh nhân chưa từng điều trị
(nghiên cứu P021) được đảnh giả là tỷ lệ bệnh nhân có ít nhất 1 triệu chứng CNS (được mô
tả sau đây). Tỷ lệ nảy được báo cáo ít hơn đảng kế ở nhóm dùng ISENTRESS +
emtricitabine (+) tenofovir so vởi nhóm dùng efavirenz + emtricitabíne (+) tenofovir, vởi
các trị số p cho cảc phản ứng t1'ch lũy qua các tuần thứ 8, 48 và 96 lần lượt lả < 0,001, <
0,001 vả < 0,001. Đối với nhóm bệnh nhân sử dụng ISENTRESS, tỷ 16 bệnh nhân có ít nhất
1 triệu chứng CNS là 20,3% so vởi 52,1% ở nhóm sử dụng efavirenz vảo tuần thứ 8, 26,3%
so vởi 58,5% vảo tuần thứ 48 và 28,8% so vởi 60,6% vảo tuần thứ 96, Cảc phản ửng bất lợi
theo phân tích nảy bao gồm choáng váng, mất ngù, thiếu tập trung, ngủ gả, trầm cảm, ảo
mộng, lẫn lộn, muốn tự tứ, rối loạn hệ thần kinh, rối loạn tâm thằn, mộng mị bắt thường, cổ
tự tứ, Ioạn tâm thần cấp tính, mê sảng, giảm tỉnh tảo, ảo giác, ảo thính, đã tựtừ và trầm cảm
nặng.
Phản ửng bất lơi liên quan đển thuốc
Trang I5/22
TỆ…
ISENTRESS 400 MG
MKOSIS-VNM—ZOIZ-OÙ4924
S-WPC-MKOS! S—MF—0820 ] 4
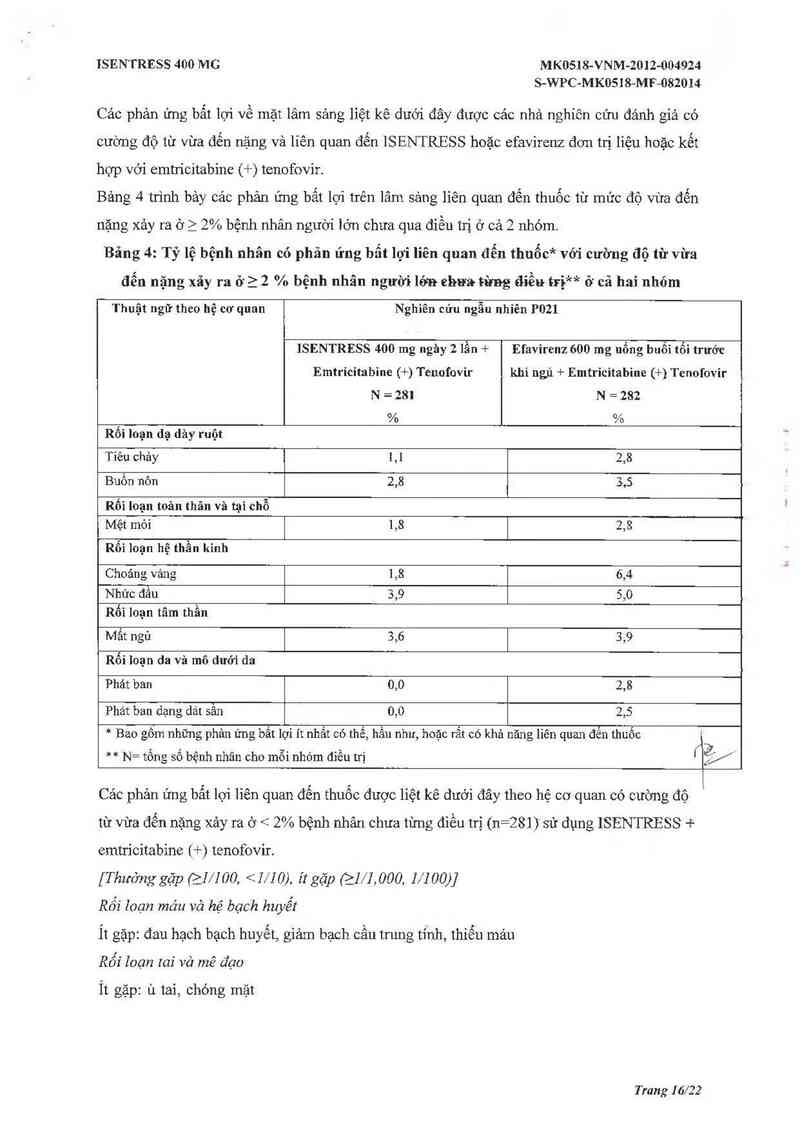
Các phản ứng bất lợi về mặt lâm sảng liệt kê dưới đây được các nhà nghiên cứu đảnh giả có
cường độ từ vùa đến nặng và liên quan đến ISENTRESS hoặc efavirenz đơn trị Iỉệu hoặc kết
hợp vói emtứcitabine (+) tenofovir.
Bảng 4 trình bảy cảc phản ứng bắt lợi trên lâm sảng liên quan đến thuốc từ mức độ vùa đến
nặng xảy ra ở 2 2% bệnh nhân người lớn chưa qua đỉều trị ở cả 2 nhóm.
Bãng 4: Tỷ lệ bệnh nhân có phân ứng bẩt lọi lỉên quan đến thuốc* với cường độ từ vừa
đến nặng xãy ra ở 2 2 % bệnh nhân người lớn ehưa từng đíều trị** ở cả hai nhóm
Thuật ngữ theo hệ cơ quan
Nghiên cứu ngẫu nhiên 18021
ISENTRESS 400 mg ngầy 2 lần +
Emtricitabine (+) Teuofovir
Efavirenz 600 mg uổng buổi tối trước
khi ngủ + Emtricitabìne (+) Tenofovir
N = 28] N = 282
, % %
Rôỉ loạn dạ dảy ruột
Tiêu chảy 1,1 2,8
Buổn nôn 2,8 3,5
Rối loạn toản thân vã tại chỗ
Mệt mói 1,8 2,8
Rối loạn hệ thần kinh
Choáng vảng ],8 6,4
Nhức đâu 3,9 5,0
Rối loạn tâm thần
Mất ngủ 3,6 3,9
Rối loạn da và mô dưới da
Phát ban 0,0 2,8
Phát ban dạng dát sân 0,0 2,5
* Bao gồm những phản ứng bất lợi ít nhất có thề, hầu như, hoặc rất có khả nãng liên quan đến thuốc `
** N= tống Số bệnh nhân cho mỗi nhóm điều trị 111Ể”/
Các phản ứng bất lợi liên quan đến thuốc được liệt kê đưới đây theo hệ cơ quan có cường độ
từ vừa đến nặng xảy ra ở < 2% bệnh nhân chưa từng điều trị (n=281) sử dụng ISENTRESS +
emtricitabỉne (+) tenofovir.
[Thuỏng gặp (21/100, <1/10), ít gặp em, 000, 1/100)]
Rối Ioạn máu và hệ bạch huyết
1t gặp: đau hạch bạch huyết, giảm bạch cầu trung tính, thiếu mảu
Rôi loạn lai vả mê đạo
Ít gặp: ù tai, chóng mặt
Tran g 16/22
ISENTRESS 400 MG MK051 8-VNM-2012-004924
S-WPC-MKOSIS-M F-08201 4
Rối loạn dạ dảy ruột
Thường gặp: tiêu chảy, đau bụng
Ỉt gặp: nôn ói, đau phần bụng trên, khó tiêu, viêm loét tả trảng, trảo ngược dạ dảy thực quản
Rối loạn toản thân và tại chỗ
Thường gặp: mệt mỏi, suy nhược
Ít gặp: sưng dưới hảm dưới
Rối loạn hệ miễn dịch
Ít gặp: hội chứng phục hồi miễn dịch
Bệnh nhỉễm trùng vả ký sính trùng
Ít gặp: herpes zoster, viêm dạ dảy ruột, viêm nang lông, ảp xe hạch bạch huyết
Rối Ioạn dinh dưỡng và chuyến hóa
Ỉt gặp: chản ăn, giảm ngon miệng, béo phì
Rối loạn cơ xương và mô liên kết
Ít gặp: viêm khớp, dau vùng cổ
Rối loạn hệ thần kinh
Thường gặp: choáng váng
Ỉt gặp: ngủ lịm, ngủ gả, giảm trí nhớ
Rối Ioạn tâm thần
Thường gặp: mộng mị bất thường, ảc mộng, trầm cảm
Ít gặp: lo âu, rối loạn tâm thần, lẫn lộn, trầm cảm nặng, cổ tự tử
Rối loạn thận và tiết niệu
Ít gặp: sỏi thận
Rối loạn tuyến vú vả hệ sinh sán
Ỉt gặp: rối loạn cương dương
Rối Ioạn da và mô dưới da
Ỉt gặp: viêm nang bã, rụng lông tóc, tổn thương da, teo mô mở
Những phán ứng nzhiêm trong
Những phản ứng bất lợi nghiêm trọng có liên quan đến thuốc ở bệnh nhân chưa từng đỉều trị
trước đây theo bảo cảo của nghiên cứu lâm sảng P0218ừ dụng ISENTRESS + emtricitabine
(+) tenofovir bao gồm: thiếu máu, hội chửng phục hồi miễn dịch. rối loạn tâm thần, cổ tự tử,
trầm cảm.
Phản ứng bẩt lợi chọn lọc — đổi tượng người lớn
Đã ghi nhận ung thư xảy ra trên bệnh nhân khởi đầu điều trị với ISENTRESS hoặc placebo,
Trang ! 7/22
ISENTRESS 400 MG MK051 8-VNM-201 2—004924
S-WPC-MKOSI 8-MF-082014
cả hai cùng vởi OBT, vả trên bệnh nhân chua từng qua điều trị được dùng khởi đầu vởi
ISENTRESS hoặc efavirenz, cả hai cùng vởi emtricitabine (+) tenofovir, Vải trường hợp
xuất hiện ung thư tải phát. Một số loại và tỷ lệ cảc ung thư đặc trưng thuờng hiện diện ớ
nhóm bệnh nhân bị suy giảm miễn dịch cao (nhiều người có số lượng CD4+ thấp dưới 50 tế
bảo/mm² và đa số đã được chẩn đoản bị AIDS từ trước). Nguy 00 phát triển ung thư ở
những nghiên cửu nảy đều giống nhau ở nhóm dùng ÌSENTRESS và nhóm so sánh.
Cảo bất thường xét nghỉệm creatine kinase mức độ 2-4 đã đuợc quan sải ở cảc đối tượng
điều trị với ISENTRESS (xem bảng 5). Đã có cảc báo cảo về bệnh cơ và tiêu cơ vân. Do đó
cẩn phải thận trọng khi dùng ISENTRESS ở cảc bệnh nhân có nguy cơ gia tăng bệnh cơ
hoặc tiêu cơ vân, như lá ở bệnh nhân dùng cảc thuốc đồng thời được biết rõ gây ra cảc bệnh
lý nảy.
Phát ban thuờng gặp hơn ở bệnh nhân đã từng điều trị nhận phảc đồ gồm ISENTRESS +
darunavir so vởí nhóm bệnh nhân dùng ISENTRESS không kèm damnavỉr hoặc đamnavir
không kèm ISENTRESS. Tuy nhiên, tỷ lệ phảt ban đuợc xem là liên quan đến thuốc đều
gỉống nhau ở cả ba nhóm. Phải ban thuò’ng trong mức độ từ nhẹ đến vừa và không gây hạn
chế việc điều trị; do đó không có trường hợp ngưng dùng thuốc do phát ban. Phảt ban thường
ít gặp hơn ở bệnh nhân chưa điều trị trưởo đây ở nhóm dùng ISENTRESS SO với nhóm dùng
efavirenz, khi cả hai đuợc dùng kết hợp vởi emtricitabine (+) tenofovir.
Bệnh nhân có bệnh đồng nhiễm
Bệnh nhân đổng nhiễm viêm gan B vả/hoặc viêm gan C
Trong cảc nghiên cứu Giai đoạn 111, các bệnh nhân đã trải qua đìều trị (N=114/699 hoặc
16%) và bệnh nhân chua qua điều trị HIV (N=34/563 hoặc 6% đang bị nhiễm viêm gan B
mạn tính vảfhoặc nhỉễm viêm gan C mạn tính hoạt động [không cấp tính) thì được phép tuyến
vảo nghiên cứu nếu các xét nghiệm chức năng gan ban đằu không vượt quá 5 lần mức tối đa
cùa gỉởi hạn bình thuờng. Nhìn chung, mức độ an toản của ISENTRESS đối vói bệnh nhân
HIV đồng nhiễm viêm gan B vả/hoặc viêm gan C giống vói bệnh nhân không bị đồng nhiễm
viêm gan B vả/hoặc viêm gan C, mặc dù tỷ lệ bệnh nhân có AST vả ALT bắt thường có phần
cao hơn ở phân nhóm đồng nhiễm viêm gan B vả/hoặc viêm gan c đối với cảhai nhóm điều
trị.
Phán ứng bẩt lợi gặp ở bệnh nhi
Trẻ em rừ 2 đến 18 tuổi
ISENTRESS duợc nghiên cửu trên 126 trẻ em và thiếu niên từ 2—18 tuổi mắc HIV-l đã qua
đíều trị bằng thuốc khảng retrovirus, kểt hợp với các thuốc khảng retrovirus khác trong
Trang 181’22
ISENTRESS 400 MG MK051 8-VNM-2012-004924
S-WPC-MKOSIS-MF—DSZOH
nghiên cứu IMPAACT P1066. Trong số 126 bệnh nhân, 96 đuợc nhận IS ENTRESS liều
khuyến nghị.
Trong số 96 trẻ nảy, tẩn suất, loại và mức độ nặng của các phản ứng bất lợi lỉên quan đến
thuốc qua tuần thứ 24 có thể so sảnh với cảc phản ứng ở người lởn.
Một bệnh nhân có phản ứng bất lợi liên quan tới thuốc gồm tăng tâm thần vận dộng độ 3, có
hảnh vì bất thường vả mắt ngủ; một bệnh nhân ban dị ứng độ 2. Một bệnh nhân có bất thường
về xét nghiệm, AST độ 4 vả ALT độ 3, dược cho là nghiêm trọng.
Trẻ từ 4 tuần tuổi đển 2 mổi
ISENTRESS cũng đuợc nghìên cứu trên 26 trẻ nhỏ và trẻ mởi biết đi từ 4 mần tuồi đển 2 tuối
nhiễm HIV-l, kểt hợp với các thuốc khảng retrovirus khảo trong nghỉên cứu IMPAACT
P1066.
Trong số 26 trẻ nảy, tần suất, Ioại vả mức độ phản ứng liên quan tới thuốc tới tuần thứ 48
tương đương với những quan sảt thu đuợc ở người lởn.
Có một bệnh nhân có phản ứng phảt ban dị ứng mức độ 3 liên quan tới thuốc phải buộc
ngưng điều trị.
Báo cáo sau bán hảng
Nhũng phản ứng bất 166 sau đây bất kể nguyên nhân được bổ sung từ bảo cảo sau bán hảng:
Rối loạn máu và hệ bạch huyết
Giảm tiễu cằu
Rối Ioạn cơ xương vả mô liên kết
Tiêu cơ vãn
Rối loạn tâm thẳn
Trầm cảm (đặc biệt đối với bệnh nhân có tiền sử bệnh tâm thần), kể cả có tư tưởng và hảnh
vi tự từ ( /
Rối loạn da vả mô dưới da 1
Hội chứng Stevens-Johnson
Các phát hiện về xẻt nghiệm
Các bất thường về xét nghiệm
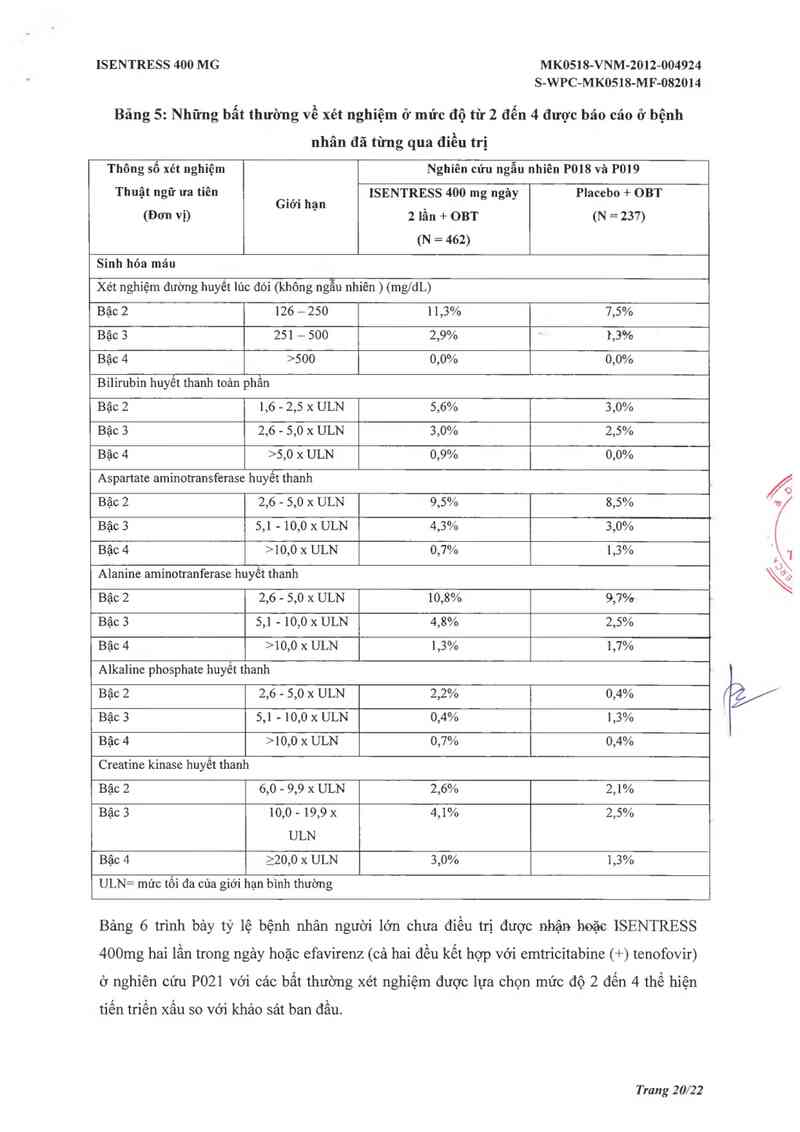
Bảng 5 trình bảy tỷ lệ bệnh nhân người 1ởn từng điều trị trưởo đây đã sử dụng hoặc
ISENTRESS 400 mg hai lần trong ngảy hoặc placebo (cả hai đều dùng cùng với OBT) txong
nghiên cứu P018 và 019 với các bất thường xét nghiệm được 1ụa chọn mức độ 2 đến 4 thể
hiện mức độ xâu đi so vởi khảo sảt ban đâu.
Trang 19/22
ISENTRESS 400 MG MK0518-VNM-2012-004924
S-WPC-MKOS] 8-MF-082014
Bâng 5: Những bẫt thường về xét nghiệm ở mức độ từ 2 đển 4 được bảo cáo ở bệnh
nhân đã từng qua điều trị
Thông số xét nghiệm Nghiên cứu ngẫu nhiên P018 vè P019
Thuật ngữ ưa tiên Giới han ISENTRESS 400 mg ngây Placebo + OBT
(Đơn vị) ' 2 lần + OBT (N = 237)
(N = 462)
Sinh hóa máu
Xét nghiệm đường huyềt lủc đói (không ngẫu nhiên ) (mg/dL)
Bậc 2 126 — 250 11,3% 7,5%
Bậc 3 251 — 500 2,9% 1,3%
Bậc 4 >500 0,0% 0,0%
Bilirubỉn huyết thanh toản phần
Bậc 2 1,6 - 2,5 X ULN 5,6% 3,0%
Bậc 3 2,6 - 5,0 X ULN 3,0% 2,5%
Bậc 4 >5,0 X ULN 0,9% 0,0%
Aspartate aminotransferase huyết thanh
Bậc 2 2,6 - 5,0 x ULN 9,5% 8,5% Ổ
Bậc 3 5,1 - 10,0 x ULN 4,3% 3,0%
Bậc 4 >10,0 X ULN 0,7% 1,3%
».
-7
Alanine aminotranferase huyết thanh
/f
.`V
«Ý
,.
Bậc 2 2,6 - 5,0 x ULN 10,8% 9,7%
Bậc 3 5,1 - 10,0 x ULN 4,8% 2,5%
Bậc 4 >10,0 x ULN 1,3% 1,7%
Alkaline phosphate huyết thanh
Bậc 2 2,6 - 5,0 x ULN 2,2% 0,4% ` /
Bậc 3 5,1 - 10,0 x ULN 0,4% 1,3%
Bậc 4 >10,0 x ULN 0,7% 0,4%
Creatỉne kinase huyêt thanh
Bậc 2 6,0 - 9,9 x ULN 2,6% 2,1%
Bậc 3 10,0 — 19,9 x 4,1% 2,5%
ULN
Bậc 4 220,0 x ULN 3,0% 1,3%
ULN= mức tối đa của giới hạn bình thường
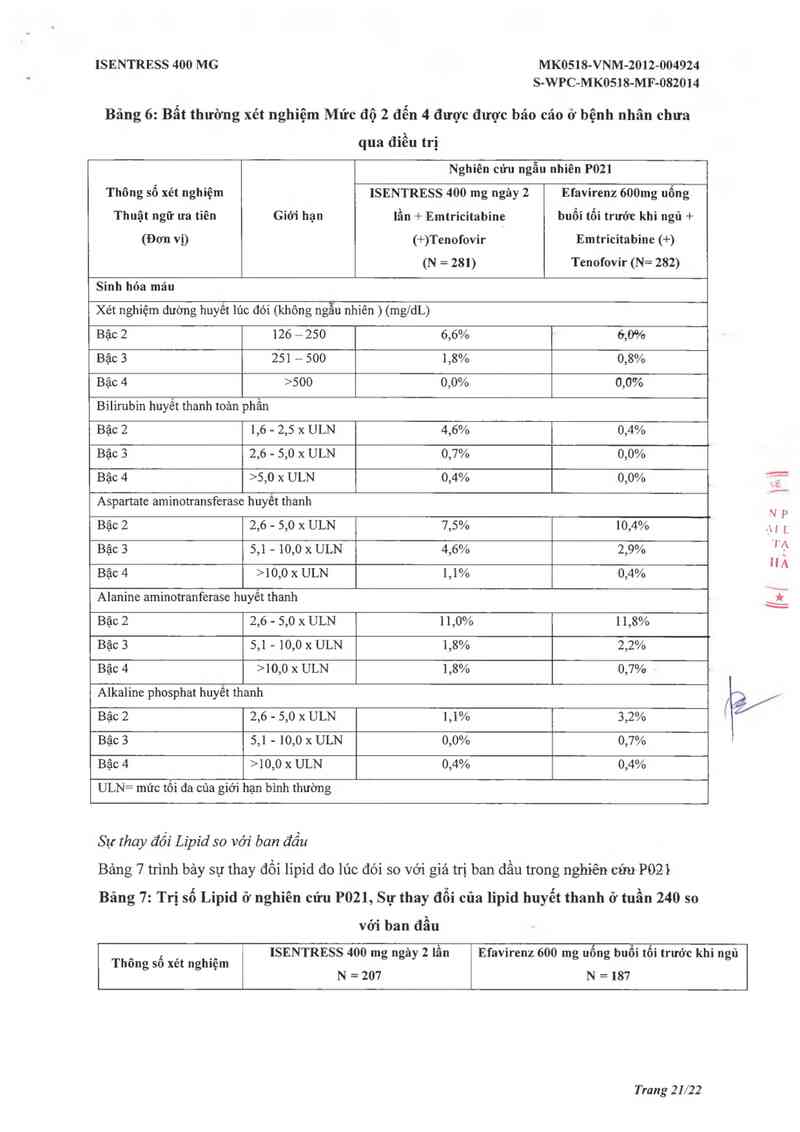
Bảng 6 trình bảy tỷ lệ bệnh nhân người lớn chưa điều trị được nhận hoặc ISENTRESS
400mg hai lần trong ngảy hoặc efavirenz (cả hai đều kết hợp vởi emtricitabine (+) tenofovir)
ở nghiên cứu P021 với cảc bất thường xét nghiệm được lựa chọn mức độ 2 đến 4 thể hiện
tiên triên xâu so với khảo sát ban đâu.
Trang 20/22
ISENTRESS 400 MG
MKOSIS-VNM-ZOIZ-OM924
S-WPC-MKOSIS-MF-OS2OM
Bãng 6: Bẩt thường xét nghiệm Mức độ 2 đễn 4 được được báo cáo ở bệnh nhân chưa
qua điều trị
Nghiên cứu ngẫu nhiên P021
Thông số xẻt nghiệm ISENTRESS 400 mg ngảy 2 Efavirenz 600mg uống
Thuật ngữ ưa tiên Giới hạn lần + Emtricitabỉne buổi tối trưót khi ngủ +
(Đơn vị) (+)Tenofovir Emtricitabine (+)
(N = 281) Tenofovir (N= 282)
Sinh hóa máu
Xét nghiệm đường huyềt 1ủc đói (không ngẫu nhiên ) (mg/dL)
Bậc 2 126 — 250 6,6% 6,0%
Bậc 3 25] — 500 1,8% 0,8%
Bậc 4 >500 0,0% 0,0%
Bilirubin huyết thanh toản phần
Bậc 2 1,6 — 2,5 x ULN 4,6% 0,4%
Bậc 3 2,6 - 5,0 x ULN 0,7% 0,0%
Bậc 4 >5,0 x ULN 0,4% 0,0%
Aspartate aminotransferase huyêt thanh
Bậc 2 2,6 - 5,0 x ULN 7,5% 10,4%
Bậc 3 5,1 — 10,0 x ULN 4,6% 2,9%
Bậc 4 >10,0 x ULN 1,1% 0,4%
Alanine aminotranferase huyết thanh
Bậc 2 2,6 - 5,0 x ULN 11,0% 11,8%
Bậc 3 5,1 - 10,0 x ULN 1,8% 2,2%
Bậc 4 >10,0 x ULN 1,8% 0,7%
Alkaline phosphat huyết thanh
Bậc 2 2,6 - 5,0 x ULN 1,1% 3,2%
Bậc 3 5,1 - 10,0 x ULN 0,0% 0,7%
Bậc 4 >10,0 x ULN 0,4% 0,4%
ULN= mức tối đa cùa giói hạn bình thường
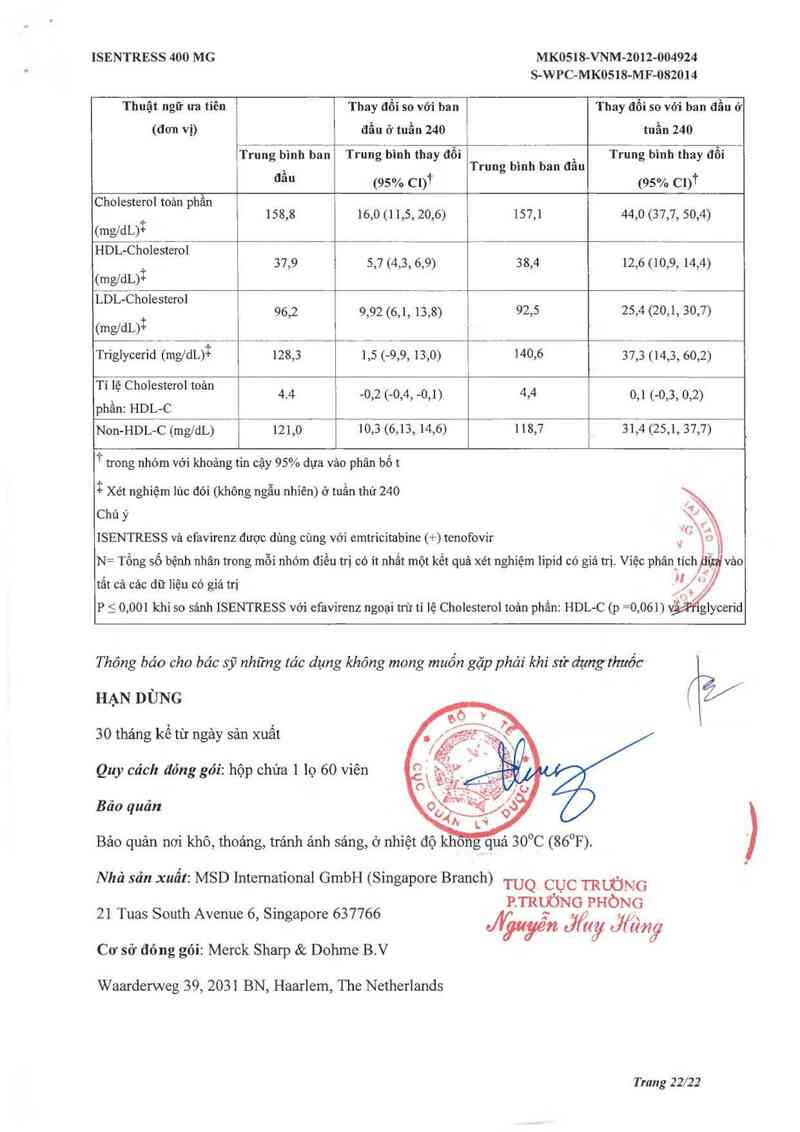
Sự thay đối Lipid so với ban đẳu
Bảng 7 trình bảy sự thay đổi lipid đo lúc đói so với giá trị ban đầu trong nghỉên cứu 12021
Bảng 7: Trị số Lipid ở nghiên cứu P021, Sự thay đổi của lipid huyết thanh ở tuần 240 so
với ban đầu
Thông số xét nghiệm
ISENTRESS 400 mg ngảy 2 lần
N = 207
Efavirenz 600 mg uống buổi tối trước khi ngủ
N=187
Trang 21/22
ISENTRESS 400 MG
MK0518-VNM-2012—004924
S-W PC-MKOSI8-M F-082014
Thuật ngữ ưa tiên Thay đỗi so với ban Thay đổi so với ban đầu ớ
(đơn vị) đẫu ở tuần 240 tuần 240
Trung bình ban Trung bình thay đồi Ầ Trung bình thay đổi
, Trung bình ban đau
da“ (95% Ci)ff (95% CN
Cholesterol toản phẫn
+ 158,8 16,0 (1 1,5, 20,6) 157,1 44,0 (37,7, 50,4)
(mgldL)+
HDL-Cholesterol
_ 37,9 5,7 (4,3, 6,9) 38,4 12,6 (10,9, 14,4)
imgdLfi
LDL—Cholesterol
+ 96,2 9,92 (6,1, 13,8) 92,5 25,4 (20,1, 30,7)
(mgldL1’f
Triglycerid (mg/dLỷể 128,3 1,5 (…9,9, 13,0) 140,6 37,3 (14,3, 60,2)
T' ,lệ Chmesmo' toan 4.4 02 (0,4, 0,1) 4,4 0,1 (-0,3, 0,2)
phân: HDL-C
Non-HDL—C (mgldL) 121,0 10,3 (6,13, 14,6) 118,7 31,4 (25,1, 37,7)
†
Chú ý
tất cả các dữ liệu có giá trị
trong nhóm với khoảng tỉn cậy 95% dựa vảo phân bố t
1² Xét nghỉệm lúc đói (không ngẫu nhíên) ở tuần thứ 240
ISENTRESS vả efavirenz được dùng cùng với emtricitabine (+) tenofovir
N= Tổng số bệnh nhân trong mỗi nhóm điều trị có ít nhất một kểt quả xét nghiệm lipid có gỉá ưị. Việc phân_tich “
P 5 0,001 khi so sảnh ISENTRESS với efavirenz ngoại trừ tỉ lệ Cholesterol toản phẩn: HDL-C (p =0,061) vt
H /
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng