















44 {đi?
Irinotel 40 mg/2 ml - Carton - Vietnam
Baddi - II
BATCi-i
MFC:
EXP:
Overpi mted Her
Unvarnish Area *
(40 x 40 mm) `
for over codinq
ZD code
40 mq/2 ml
Thinh phấn: Mới lo cnưa 40 mg
lrinnlecan hydmclorld tvthymat.
Ghi định. chỏng chỉ định. eách
dùng vi của thong tin khâc X…
60; tờ tỉuớng đẫn sử dung.
Dường dùng: nđm lruvẻn tĩnh mach
Sau khi pha
Báo quìn: ở nhiệt dộ dưul 30'C.
Không dong lạnh .Trảnh ánh eoểng.
SOIO SX NSX HD: xem 'BATCH
MFG, EXP“ tran bsc bt
Đủ thuỏc n M… vởícủn tri om. Đọc
kỹ han dản sử dung lmóc khi
dùng.
SĐKz
Săn xuắlta1An Dò bỞl
Fruonius Kebi Oncoloqy Ltd
vn…ge-Kmhanpure. Bedm.
Tehsn-Naiagnrh` D1stỏct Solan.
Himachal Pradesh lN-174101
DNNKt
Ễ Thuốc bán theo dơn
Irinotel
Irinotecan hydroctorid
trihydrat 40 qu2 ml
Dung dịch tiêm truyền
Hộp 1 lọ 2 ml
ỌẸCt i`ẢN LÝ 1›
ĐÁ Pi~iÊ DUYL
Cautmnz It is canqerous to iaue this
preparatten except under Med1cal
FRIINIUS Supervismn
KABI
e,… i
BỘYTỂ
“'?
'ứ
IIIXIXIKIK
i 40.40.10
/ VNM
40 mq/2 ml
Each vial containsz
40 mg lrinetecan nydrochloride
trihydraie
R Prescription det} lndlutlon, centralndlcltlen. uuqe
IMI other Intermahons: read
accompanyinq packaọe msert.
FDI l.v tniusion atter dtlutien
Storage: Store at a temperature
beiow 30°C… Protect trom liqht Do
not íreeze.
Irinoiel”
irinotecan hyđrochloride
trihyđrate 40 mq/2 m|
warning: Cytotoxic aqent. To be
supplied aqamst 0emanc lrom
Cancer Hospitals, lnsniutton no
aqainst prescliplion ot a Ca cer
Specialistonw
Solution for infusion
Miq. Lic. No.:
Manutaciured |
Fresemus Kabi 0
v:llaqe-Knshanpura, '
1ehst:Nalaqarh.Distr Soian,
Himachai Praoesh. 1N-174101
Box 011 vial 2 ml
FRBINIUS
Ễ 2 ml % KIABI
Mfg. & Exp. format: ddlmmlyyyy
Ìrinotel 40 mg/2 ml — Label - Vietnam
Baddi — II
~n…u mu-
Iiiriiĩitizi ’
..…. .…— ..
……-uw…
~ …-i…… .
:… onuợnnựunuuuur
munmơU*ulmmuo
v…;—
'ih3’“
200%
Eli:hvnlcontaluxz
40 mg lrinotenn hyđrochloride trlhyđnte.
Donqe: As directed by the Physiclnn. Read
accemplnqu plclthe Insert Im đetlilơd
deane. nlrectmns ÍQV vse and preuullens
Stnruu: Store al a tomperaturl bnlow 30°C.
Protect llom Ilth. Do nnl truu.
2 Prescrlptmn drch
Irinotel '”
Mlq. Lic. No.: MBIO7IS'IĐ
Nanutarhưnd … mm w
Fresenlus Kent Oncolnqy Ltd.
vltlnqulshmnura.
Badđi. Tehsỉi-Naiaọarh.
District Soiln.
Unvarntzh Art—n
'20 1 B mini
60x18mm
XXXXXIIIXK
Hỉmachal Pradesh.
lr'notecan h rochloride -
Cnunon: It is đcnoerous te in… this nve~ irinvnrata rỗ qu2 m| … 174101
pnnllen except underMemculSupervision. (
Soiutiơn ior in usncn gncgị -
Wunlnq: Cytotule lum. Te he vlal2ml MFG UI'WBI’I'IISh
wonllcđ oqninnt demanđ lmm Chncer '
Hespitais. Institutieni and aqainsl EXP:
pructlotten olacuncu Soccinlist eniv. ffla ỄÌỄEmUS (2 0 X 8 m m)
Mfg. & Exp. format: ddlmmlyyyy
Thuốc bán theo đơn
Để xa tầm tay trẻ em
Đọc kỹ hướng dẫn sử dụng trước khi dùng
Nếu cần thêm thông tin xin hỏi ý kiến bác sĩ
Thông báo ngay cho bảc sĩ hoặc dược sĩ những tác dụng không mong muốn gạ
t/môc
zai khi dùng
IRINOTELTM
CÀNH BÁO
Irinotecan chi được sử dụng dưới sự giám sát cùa cảc bác sĩ có kinh nghiệm trong việc sử
dụng các thuốc điều trị ung thư. Việc kiểm soát cảc biến chứng xảy ra chi có thể được đảm
bảo khi có đủ phương tiện chẩn đoán và điều trị. Irinotecan có thể gây tiêu chảy khời phảt
sớm và tiều chảy khới phảt chậm qua những cơ chế khác nhau. Cả hai dạng tiêu chảy đều có
thế nghiêm trọng. Tiêu chảy khởi phát sớm (xảy ra khi đang truyền hoặc sau khi truyền
irinotecan, có thể kèm theo cảc triệu chứng cường hệ thần kinh phó giao cảm như viêm mũi,
tăng tiết nước bọt, co đồng tứ, chảy nước mắt, chảy mồ hôi, đò bùng mặt, tăng như động ruột
gây đau thẳt bụng). Tiêu chảy khời phảt sớm và cảc triệu chứng cường phó giao cảm có thế
được ngăn ngừa hoặc giảm bót bởi atropin. Tiêu chảy khỏi phảt muộn (thường xảy ra sau 24
gìờ truyền irinotecan) có thể gây nguy hiềm tính mạng do tình trạng tiêu chảy kéo dải, có thể
gây mất nước, rối loạn điện giải hoặc nhiễm trùng. Tiêu chảy khới phát muộn qần phải/ được
điều trị kịp thời bằng loperamid. Cần theo dõi bệnh nhân bị tiều chảy vả chiỡm u ich và
chất điện giải nều bệnh nhân bị mất nước hoặc chỉ định sử dụng khảng sinh nếuìien Ềiiỉhân bị
tắc ruột, sốt hoặc tinh trạng tiêu chảy nặng. Cần ngung sử dụng irinotecan và giảm liều sau
đó nếu có tiêu chảy nặng. Thuốc có thể gây suy tủy nặng.
TIIÀNH PHÀN
Mỗi ml dung dịch chứa 20 mg irinotecan hydroclorid trihydrat
IRINOTEL 40 mg/2 ml:
Mỗi lọ 2 ml dung dịch chứa 40 mg irinotecan hydroclorid trihydrat
IRINOTEL 100 mg/5 ml:
Mỗi 1ọ 5 ml dung dịch chửa 100 mg irinotecan hydroclorid trihydrat
Tá dược: Sorbitol, acid lactic, acid hydrocloric, natri hydroxid, nước cất pha tiêm vừa đủ.
MO TA
Irinotecan 1ả dẫn chất bán tổng hợp của một aikaloid thực vật là camptothecin chiết xuất từ
Camptotheca accuminata. Irinotecan lá thuốc trị ung thư đầy tiềm nãng do có hoạt tính kháng
nhiều loại ung thư khảo nhau trên cảc mô hình ung thư thực nghiệm. Thuốc ức chế chức năng cùa
topoisomerase 1 bằng cách gắn với phức họp topoisomerase I/ADN. Dung dịch irinotecan
hydroclorid trihydrat là dung dịch có mảu vảng nhạt và không chứa các tiếu phân có thể nhìn thấy
đươc.
1115
CẤU TRÚC HÓA HỌC
13143
1 uNCl
Oc , ~= ,
u 1
° N 6
HO CHchJ
lrtnotecan Hydtochtođde
Irinotccan hydroclorid có dạng bột kết tinh mảu vảng nhạt, có hoạt tinh khảng ung thư mạnh. Về
mặt hóa học, thuốc có cấu trúc 1â: (8)—4, 11—diethyl-4-hydroxy-9-[(4-piperi-dinopiperidino)
carbonyioxy]-l H-pyrano [3’,4':6,7] indolizino [1,2-b] quinoiine-3,14(4H,121—1)d10n0 hydroclorid.
Thuốc tan ít trong nước và đung môi hữu cơ. Thuốc có công thức hóa học tổng quát 1ả
ngH;gNiO6.HCL3H2O vả trợng lượng phân tử là 677,19.
DẠNG BÀO CHẾ
Dung dịch tiêm truyền.
QUY CÁCH DÒNG GÓI
IRINOTEL 40 111ng ml: Hộp 1 lọ 21111
iRINOTEL 100 mg/S ml: Hộp 1 lọ 51111
ĐẶC TỈNH DƯỢC LỰC HỌC
lrinotecan 1ả một dẫn chất của camptothecin. Các camptothecin tương tác đặc hiệu với Fenzym
topoisomerase 1, một cnzym giúp mở chuỗi xoắn kép ADN để tạo các chuỗi xo" 1 . 11'ii'iotecan
và chất chuyền hóa có hoạt tính của nó SN-38 gắn vảo phức hợp topoisomerasề \ỊJả ngản
chặn sự tạo thảnh chuỗi xoắn kép ADN. Các nghiên cứu gần đây cho thẩy rằng tầ'c di, háng tế
bảo ung thư của irinotecan là đo tác dụng gây tổn thương chuỗi xoắn kép ADN trong quá trình
tồng hợp AND, khi enzym sao chép tương tảo với phức hợp của 3 phân tứ: topoisomerase [ —ADN
và irinotecan hoặc chất chuyến hóa SN-38. Các tế bảo cùa động vật có vú không có khả năng sửa
chữa hữu hiệu những tổn thương nảy.
irinotecan đóng vai trò là tiền chất tan được trong nước cho dạng chưyền hóa SN-38 tan trong
dầu. SN-38 được tạo thảnh từ irinotecan nhờ tác dụng cùa enzym carboxylesterasc cắt đửt iiên kết
carbamat giữa khung camptothecin và chuỗi dipiperidino. SN-38 có tác dụng ức chế
topoisomerase I được tinh chế từ các dòng tế bâo ung thư của người hoặc loải gặm nhấm mạnh
gấp khoảng 1000 iần so với irinotecan. Tác dụng diệt tế bảo ung thư in vilro cùa SN-38 mạnh gắp
2 — 2000 lần so với irinotecan. Tuy nhiên, nồng độ SN-38 trong huyết tương (AUC) chi bằng
khoảng 2-8% so với irinotecan và 95% SN-38 gắn với protein huyết tương, so với irinotecan
khoảng 50%. Vì thế, không xác định được chính xác có bao nhiều phần hoạt tính cùa sn…3s đóng
góp vảo hoạt tính của irinotecan. Cả irinotecan vả SN-38 đều có vòng Iacton có hoạt tính và một
anion đạng hydroxy acid không có hoạt tinh. Giữa 2 dạng nảy có một sự cân bằng lệ thuộc vảo pH
và môi trường pH acid giúp tăng cường dạng lacton trong khi đó môi trường kiềm giúp tạo dạng
anion hydroxy acid.
Irinotecan có tảo dụng kháng ung thư ở chuột nhắt dược gây ung thu bởi các dòng tế bảo ung thư
của loải gặm nhấm và trên mô ung thư ghép có nguồn gốc từ người ở nhiều dạng khác nhau về
mặt mô học.
2115
ĐẶC TÍNH DƯỢC ĐỌNG HỌC
Sau khi truyền tĩnh mạch irinotecan ở người, nồng độ irinotecan trong huyết tương giảm theo cấp
số nhân vả có Tia trung binh sau cùng 18) 6-12 giờ. Ti); trưng bình sau cùng cùa đạng chuyền hóa
có hoạt tính SN-38 là khoảng từ 10-20 giờ. Tin của dạng lacton (có hoạt tính) cùa irinotecan vả
SN—38 tương tự với T… của tồng lượng irinotecan vả SN-38, khi dạng lacton vả hydroxy] acid
cãn bằng nhau. Với iiều khuyến cảo từ 50 đến 350 mglm², AUC cùa irinotecan tăng tuyến tinh
theo iiềư; AUC của SN-38 ít tăng theo tỷ 1ệ vởi liều lượng hơn. Nồng độ tối đa cùa chắt chuyển
hóa có hoạt tính SN-38 thường dạt được trong khoảng 1 giờ sau kết thúc 90 phủt truyền irinotecan
với mửc liếư 125 và 340 mg1m².
Phân bố:
irinotecan gắn kết nhẹ với protcin huyết tương (30% đến 68%). SN-38 gắn mạnh vảo protein
huyết tương (khoảng 95%). Albưmin lả protein huyết tương chủ yếu được gắn kết VỚỈ ỉi~ỉiioteciin
vả SN-38
Chuyển hóa:
Sự chuyền hóa irinotecan thảnh chất chuyến hóa có hoạt tinh SN-38 được xúc tảo bời enzym
carboxylcstcrase Vả chủ yếu xảy ra ở gan. SN-38 sau đó liên hợp với glucuronid đưới tác dụng
của enzym UDP-giucuronosyl transferase 1A1 (UGTiA1). Hoạt tính cùa UGTIAI bị giảm ở
những đối tượng có đặc tính đa dạng di truyền gây giảm hoạt tính enzym, ví dụ như kiểu di truyền
UGTIAI *28. Có khoảng 10% dãn số Bắc Mỹ có kiều di ttuyèn đồng hợp tử UGT1Ai *28. Trong
một nghiên cứu tiền cứu, irinotecan được sử dụng ở dạng đơn trị theo phảc đổ một iiều cách mỗi
3 tuần, ở những bộnh nhân có kiến di truyền dồng hợp từ UGTIAI*28, nồng độ SN—38 cao hơn
so với bệnh nhân có kiều đi truyền UGTiAI bình thường. Dạng liên hợp SN-38 với giưcuronid
chi có hoạt tinh bằng 1150-11100 so với SN-3S khi thử nghiệm trên 2 đòng tế bảo ưng thư in virro.
Đảo lhải':
Chưa xác định rõ sự phân bố của irinotecan trong co' thể người lrinotecan được bải tiết quanước
tiếu khoảng 11—20%, SN-38 khoảng duới 1% vả SN 38 dạng liên hợp glucuronid k_koẫỆg 3% Sư
bải tiết qua mật và nước tìều cùa hinotecan vả SN- 38, SN- 38- g-lucuroniđ tiong 48 giờọ
dụng 11 inotecan ở 2 bệnh nhân là khoảng 25% (100 mg1m2 ) đen 50% (300 mg1m².)
11 khi su
Dược động học trong nhỏm dân số đặc biệt
Người cao luổi: 'i`rong những nghiên cứu sử dụng liều hảng tuần, Tin sau cùng của irinotecan lả
6,0 giờ ở các bệnh nhân từ 65 tưổỉ trờ iên, trong khi cảc bệnh nhân dưới 55 tuối là 5,5 giờ.
Aưco.ngg qui binh thường theo lỉều cùa SN-38 ở những bệnh nhân có độ tuồi tối thiếu n 65, cao
hơn khoảng 1 1% so với nhóm bệnh nhân dưới 65 tuối. Không có khuyến các thay đối liều khoi
đầu đối với bệnh nhân cao tuối sử dụng irinotecan liều hảng tuần. Dược dộng hợc của irinotecan
khi sử dụng liều một iẩn mỗi 3 tuần chưa được nghiên cứu ở nhóm cao tuồi; iiều khởi đầu dược
khuyến cảo cho bệnh nhân từ 70 tuổi trở lền là thấp hơn dựa trên kinh nghiệm độc tính lâm sảng
theo iiều nảy.
Gỉóz' tinh; Dược động học cùa irinotecan không bị ảnh hưởng bời giới tính.
Chủng tộc: Ảnh hướng cùa chùng tộc lên dược động học cùa irinotecan chưa được đánh giả.
Suy giám chức năng gan: Sự thanh thải irinotecan bị giảm ở bệnh nhân có rối loạn chức năng gan
do nồng độ cùa SN-38 tăng so với bệnh nhân có chức năng gan binh thường. Phạm vì tác động
cùa những ảnh hướng nảy tỷ lệ với mức độ tổn thương gan qua việc đo iưò'ng nồng độ bilirubin
toản phần và cảc transaminase. Tuy nhiên, sự đung nạp của irinotecan ớ cảc bệnh nhân có rối loạn
3115
chức năng gan (bilirubin lớn hơn 2 mgldl) vẫn chưa được đánh giá đầy đủ, và không có khuyến
cảo nảo về iiều lượng được đưa ra.
Suy giảm chức năng thận: Ảnh hướng của suy giảm chức năng thận trên dược dộng học cùa
irinotecan vẫn chưa được đánh gỉá. Vì thế cần thận trọng đối với bệnh nhân suy giảm chức năng
thận. Irinotecan không khuyến cáo sử dụng ở bệnh nhân thẩm phân.
CHỈ ĐỊNH
o irinotecan được chỉ định trong điếu trị cho bệnh nhân ung thư đại trực trảng tiến triến.
- Kết hợp với S-fluorouracii (5—FU) và axit folinic (FA) ở những bệnh nhân ung thư tiến triền
chưa được hóa trị trước đó.
- Sử dụng đon độc ở những bệnh nhân chưa thảnh công với phảc đồ điều trị có chứa 5-FU.
ơ Irinotecan kết hợp với cetuximab được chỉ định trong điều trị cho bệnh nhân với sự xuất hiện
thụ thể của yếu tố tăng trướng biền bì (EGFR) bị ung thư đại trực trảng di căn (gen KRAS
tuýp tự nhiên) mà chưa được điều trị trước khi di căn hoặc sau khi thất bại với liệu trình gây
độc tế bảo có chứa irinotecan.
o Irinotecan kết họp với S-FU, FA vả bevacizưmab được chỉ định là iựa chọn đầu tay trong điều
trị cho bệnh nhân ung thư biếu mô đại trảng hoặc trực trảng.
o Irinotecan kết hợp với capccitabin, có hoặc không có bevacizumab được chỉ định là lựa chọn
đầu tay trong điều trị cho bệnh nhân ung thư đại trực trảng di căn.
LIÊU DÙNG VÀ CÁCH DÙNG
Thuốc chỉ dùng cho người lớn. Dung dịch irinotecan sau khi dược pha đề truyền nên được truyền
vảo tĩnh mạch trung tâm hoặc tĩnh mạch ngoại vi.
Liều dùng khuyến cáo
Trong đơn tri liêu (ở bênh nhân đã điều tri trước đó):
Liều khuyến cảo cùa irinotecan là 350 mg/m2 dưới dạng truyền tĩnh mạch trong thời gian từ 30
đến 90 phủt, cứ mỗi ba tuần một lần.
Trong iiệu pháo nhối hop (ở bênh nhân chưa điều tri trước đó):
Sự an toản vả hiệu quả của irinotecan kết hợp với 5-fiuorouracil (5—FU) vả folinic a 1 được
đánh giá theo lịch trình sau:
— Irinotecan kết hợp với 5-FU/ FA, cứ mỗi 2 tuần.
Liều khuyến cáo cùa irinotecan lả 180 mglm2 mỗi tuần một lần, dưới dạng truyền iĩnh mạch,
trong khoảng thời gian 30 đến 90 phút, sau đó truyền FA vả 5-FU.
Khi dùng đồng thời với cetuximab, liều iượng vả cách dùng xem hướng dẫn sử dụng dảnh cho sản
phẩm nảy. Thông thường, liều irinotecan tuong đương sẽ được sử dụng như 111 đã được sử dụng
trong các chu kỳ cuối cùng cùa chế độ trưởo đó chứa irinotecan. Không nên dùng irinotecan trong
vòng 1 giờ sau khi truyền cetuximab.
Khi dùng đồng thời với bevacizumab, iiều lượng và cảch dùng xem hưởng dẫn sử dụng dảnh cho
sản phẩm nây.
Khi dùng đồng thời với capecitabin, iiều iượng vả cảch dùng xem hưởng dẽ… sử dụng ciảnh cho
sản phấm nảy.
4/15
Hiệu chỉnh liều lượng
Irinotecan nên được dùng sau khi các tác dụng phụ đã được phục hồi về mức 0 hoặc 1 theo NCI —
CTC (Viện ung thư quốc gia Mỹ — Tiêu chuẩn độc tinh chung) và triệu ohứng tiêu chảy liền quan
đến việc điều trị đã được giải quyết triệt đế.
Khi bắt đằu iiệu trinh điều trị tiếp theo, có thế giảm liều irinotecan vả 5-FU theo từng cá thề, nên
giảm liều tùy theo mức độ nghiêm trọng nhất của các tảo dụng phụ đã quan sải được trước đó.
Việc điều trị nên được trì hoãn trong 1-2 tuần để người bệnh phục hồi các tác dụng phụ liên quan
đến điều trị.
Nên gỉảm iiều từ 15 đến 20% so với irinotecan vả1 hoặc 5-FU khi có các tác dụng phụ sau đãy:
- Độc tính về huyết học như giảm bạch cầu trung tinh độ 4, sốt giảm bạch cầu (giảm bạoh cầu
trung tinh độ 3-4 và sốt độ 2-4), giảm tiếu cầu và giảm bạch cẳu độ 4.
. Độc tính không phải huyết học (độ 3-4).
Khi phối hợp với cctuximab, cần hiệu chinh liều theo hướng dẫn sử dụng cùa cctuximab.
Khi phối hợp bcvacizumab vởi irinotecan/ 5-FU1 FA, cần hiệu chinh liều theo hướng dẫn sử đụng
cùa bcvacizumab.
Nếu dùng phối hợp với capecitabin trên bệnh nhân từ 65 tuổi trở lên, khuyến cảo nên giảm liều
khỏi đằu oủa capecitabin xướng 800 mg/m2 mỗi ngảy 2 lần, theo hướng dẫn sử dụng của
capecitabin. Xem thêm các khuyến cáo về hiệu chinh liều trong phác đồ phối hợp trong hướng
dẫn sử đụng cũa oapecitabin.
Thời ginn điều trị
Việc điều trị bằng irinotecan nên được tiếp tục cho đến khi có hiệu quả điếu trị hoặc dến ngưỡng
độc tinh cho phép.
Sử dụng ở cảc đổi tượng đặc biệt
Bệnh nhân suy giảm chức nãng gan
Đơn lri liêu: Mức bilirubin (tối đa 3 lần giới hạn trên của binh thường [ULN]) 6 bệnh nhân có chỉ
số toản trạng theo WHO S 2 nên xác định liều khỏi đẩu cùa irinotecan. Ở những bệnh nhân tăng
bilirubin máu vả thời gian prothrombin trên 50%, độ thanh thải của irinotecan giảm và do đó ngưy
cơ độc tính về huyết học tăng lên. Do đó, cần thco dõi công thức máu hảng tuần ở Qtịằri thể/bệnh
nhân nảy. ọ, Ji 1
' Ở bệnh nhân có nổng độ bilirubin gắp 1,5 iẩn so với ULN, iiếư khuyến cáo của irincgeỹrn iả 350
mgl'm2
— 15 bệnh nhân có nồng độ bilirubin từ 1,5 đển 3 iần so với ULN, iiều khuyến cáo cùa irinotecan lả
200 mg1m²
— Bệnh nhân có nổng độ bilirubin trên 3 lần so với ULN, không nên điếu trị với irinotecan.
Liêu pháp phối hop: Không có dữ liệu cho bệnh nhân suy gìảm chức năng gan được điều ti-i_ bằng
irinotecan trong liệu pháp phối hợp.
Bệnh nhân suy giảm chửc nãng thận
Irinotccan không được khuyến cảo sử dụng ở bệnh nhân bị suy giảm chức năng thận, vì sản phẩm
chưa được nghiên cứu trong nhóm bệnh nhân nảy.
Người cao tuối
Không có nghiên cứu dược động học cụ thể nảo được thưc hiện ở người cao tuối. Tuy nhiên, liều
đùng nên được lựa chọn cẳn thận trong 11hóm bệnh nhân nảy do gỉảm chủ'c nãng sinh học cùa cơ
thể. Nhóm dân số nảy cần được giám sảt chặt chẽ hơn.
Câch pha dung dịch tiêm truyền
Cần pha ìoãng dung dịch irinotecan trưởo khỉ tìêm truyền. Pha loãng irinotecan trong dung dịch
NaC! 0,9% hoặc Glucose 5% thảnh dung dịch có nồng độ từ (),12-2,8 mg/ml.
CHỐNG CHỈ ĐỊNH
- Bệnh nhân mẫn cảm vởi irinotecan hoặc cảc thảnh phẩn khác cùa thưốc.
- Bệnh viêm ruột mạn tĩnh vả/hoặc lắc ruột (xem mục Cảe trường họp thận trọng khi dùng thuốc)
- Phụ nữ cho con bú (xem mục Cảo trường hợp thận trc_mg khi dùng thuốc)
- Bilirubin > 3 lần ULN (giới hạn trên cùa phạm vi bình thưởng) (xem mục Các trường hợp thận
trọng khi dùng thuốc)
- Suy tủy xương nặng
- Chỉ số toản trạng theo WIIO > 2
- Sử dụng đồng thời với St. John’s Wort (xem mục Tương tảc thưốc)
cÁc TRƯỜNG HỢP THẬN TRỌNG KIII DÙNG THUỐC
Irinotccan chỉ được sử dụng dưới sự giám sảt của các bác sĩ có kinh nghiệm trOng việc sử dụng
các thuốc điều trị ung thư.
Triệu chứng tỉêu chảy và cường phó giao câm
Tiêu chảy khởi phát sởm (xảy ra trong hoặc ngay sau khi truyền irinotecan) thường lả thoáng qua
và chỉ thinh thoảng mởỉ gây tiêu chảy nặng. Tiêu chảy có thể kèm theo các triệu chứng cường phó
gìao cảm như viêm mũi, tăng tiết nước bọt, chảy nước mắt, co đồng từ, chảy mồ hỏi, đỏ bừng mặt
và tăng như động ruột gây co thắt bụng. Chứng nhịp lỉm chậm củng có thể xảy ra. Tiêu chảy lchởi
phát sớm vả các triệu chửng cường phó giao eảm khác eó thể được ngăn ngừa hoặc giảm bớt bằng
atropin. Dự phòng hoặc diều trị bằng cách tiêm tĩnh mạch hoặc tiêm dưới da 0,25 - i mg aưopin
(trừ khi chống chỉ định trên lâm sảng). Nhũng triệu chưng nảy xảy ra với tằn suất cao hơn khi sử
dụng liều irinotecan cao hơn.
Tỉêu chảy khởi phát muộn [thường xảy ra sau 24 giờ sử dụng irinotecan) có thể gây nguy hiểm
tính mạng, do tiêu chảy kéo dải gây mất nước, mất cãn bằng điện giải hoặc nhiễm trùng huyết.
Tìêu chuẩn khởi phảt muộn mức 3-4 xảy ra ở 23-31% bệnh nhân dùng liều hảng tuần.
Trong các nghỉên cứu lâm sảng, thời gỉan trung binh xảy ra tỉêu chảy muộn là 5 ngảy với liều
dùng 3 tưần và 1] ngảy vởi lỉễu hảng tuần Tỉêu chảy muộn có thế nghiêm trọng do viêm đại
trảng, loét, chảy mảu, tắc ruột, nhiễm trùng. Tiêu chảy khỏi phảt muộn cần được đỉều trị kịp thời
bằng lopcxamid. Bắt đầu sử dụng Ioperamid ò giai đoạn đầu của phân lóng hoãc vnSẫLhiên như
động ruột thuờng xuyên hon. Liều lopetamid là 4 mg vảo lủc bắt đầu xuất hleZultểthnyÁchou
phát muộn và sau đó là 2 mg mỗi 2 gỉò cho đến khi bệnh nhân không còn tiêu ehảy trongÁt nhất
12 giờ. Lopetamid không được khuyến cáo sử dụng trOng hon 48 giờ liên tục ờnhững liễu nảy, vì
nguy cơ bị Iỉệt ruột thừa. Vảo ban đêm, bệnh nhân có thể sử dụng 4 mg loperamĩd 4 giờ một lần.
Cần theo dõi cảc bệnh nhân tỉêu ehảy, truyền dịch và chẳt diện giải để phòng bệnh nhân bị mắt
nước, sử dụng khảng sinh nếu bệnh nhân có tắc ruột, sốt hoặc giảm bạch cầu trưng tính nghiêm
trỌng. Sau tuần trị liệu đẳu tiên, cần hoãn các tuần hóa trị tỉếp thoo cho đến khi chúc năng ruột trở
về tình trạng ban đầu trong tối thỉểu 24 gỉờ mã không cẩn phải sử dụng thuốc trị tiêu chảy. Nếu
tỉêu chảy khởi phảt muộn độ 2, 3 hoặc 4 xảy ra, cẩn phải giảm liều irinotecan trong chu kỳ tìểp
theo.
Tránh dùng thuốc lợi tỉếu hoặc thuốc nhuận trảng ở những bệnh nhân bị tỉêư chảy.
6/15
Huyết học
Tử vong do nhiễm trùng sau khi giảm bạch cầu trung tính cũng đã đưọc ghi nhận ở các bệnh nhân
được điều trị bằng irinotecan. Trong những nghiên cứu lâm sảng sử dụng liều hảng tuần, sốt giảm
bạch cầu (giảm bạch cầu trung tính độ 4 theo NCI và sốt mức 2 hoặc hơn xuất hiện đồng thòi) xảy
ra trong 3% bệnh nhân; 6% bệnh nhân được chi dịnh G-CSF dễ điều trị giảm bạch cầu trung tính.
Có thể kiểm soát sốt giảm bạch cầu nhanh chóng với sự hỗ trợ kháng sinh. Cần tạm thòi bỏ qua trị
liệu với irinotecan trong chu kỳ nếu có sốt giảm bạch cầu hoặc nếu số lượng bạch cầu trung tính
giảm < lOOO/mmẵ Sau khi bệnh nhân phục hồi số lượng bạch cầu trung tính 2 lOOOlmmẵ cần
giảm liều irinotecan cho các lần trị iiệu tiếp theo.
Khi đánh giá cảc thử nghiệm sử dụng chế độ liều hảng tuần, tằn suất giảm bạch cầu trung tính độ
3 hoặc 4 thường cao hơn ở các bệnh nhân trước đó được xạ trị vùng chậu/ố bụng so với bệnh nhân
không xạ trị (48% [13/27] so với 24% [67/277]; p = 0,04). Những bệnh nhân trước đó đã được xạ
trị vùng chậu và ổ bụng có nguy cơ cao suy tùy sau khi dùng irinotecan. Dựa vảo các số liệu sơ
sải có sẵn, việc sử dụng đổng thời irinotecan cùng với xạ trị không được khuyến cảo.
Bệnh nhân có hảm lượng bilirubin toản phần trong huyết thanh từ 1,0 mg/dL trở lên có khả năng
xuất hiện giảm bạch cầu trung tính độ 3 hoặc 4 sau chu kỳ 1 tăng so vởi bệnh nhân có hảm lượng
bilirubin toản phần trong huyết thanh dưới 1,0 mg/dL (50% [19/38] so với 18% [47/266]; p <
0,001). Bệnh nhân thiếu glucuronidation bilirubin, ví dụ như người có hội chứng Gilbert. có thể
có nguy cơ cao bị suy tủy khi điều trị với ỉrỉnotecan.
Bệnh nhân suy gan
Xét nghiệm chức năng gan phải được thực hiện ở thời điểm đầu và trước mỗi chu kỳ đìều trị.
Cần theo dõi công thức máu ở bệnh nhân có bilirubin từ |,5 đến 3 lần ULN (giới hạn trên của
phạm Vì bình thường), do lảm giảm độ thanh thải của irinotecan vả do dó lảm tăng nguy cơ độc
tính tuyến trùng trong quần thể nảy. Không dùng irinotecan ở những bệnh nhân có bilirubin > 3
lân ULN.
Độc tính trên hô hẫp
Bệnh phồi mô kẽ bìều hiện dưới dạng thâm nhiễm phồi lá không phổ biến trong điều trị
irinotecan. Bệnh phồi mô kẻ có thể gây từ vong. Cảo yếu tố nguy cơ có thể liên quan dến sự phát
triền của bệnh phổi mô kẽ bao gổm: sử dụng các thuốc gây khó thở, xạ trị vả cảc yếu tố kích thích
vì khuấn phảt triển. Bệnh nhân có các yếu tố nguy cơ cần được theo dõi chặt chẽ các triệu chứng
hô hấp trước và trong khi điều trị bằng irinotecan.
Rối loạn trên tim mạch
Thiếu mảu cơ tim cục bộ đã được quan sát thẫy sau khi điều trị irinotecan chủ yếu ở nh n _nh
nhân có bệnh tim tiềm ấn, các yếu tố nguy cơ khác gây hại cho tim, hoặc hóa trị liệu gâỳ"độc tê
bảo trước đó. Do đó, bệnh nhân có các yếu tố nguy cơ đã biết phải được theo dõi chặt chẽ và cằn
phải có hảnh động để giảm thiếu tất cả các yểu tố nguy cơ có thề điểu chỉnh (ví dụ như hút thuốc
lá, cao huyết áp và tăng lipid máu)
Ức chế miễn dịch
Tiêm vắc xỉn sống hoặc vắc xin sống đã giảm hoạt lực ở những bệnh nhân suy giảm miễn dịch
bởi các chất hoá trị lỉệu như irinotecan, có thể dẫn đến nhiễm trùng nghiêm trọng hoặc tử vong.
7/15
Cân tránh tiêm văc xỉn sống ở bệnh nhân dùng irinotecan. Cảo vắc xin dã bất hoạt có thể được
tiêm, tuy nhiên đáp ửng với những vẳc-xìn nảy có thể bị gỉảm đi.
Độc tính của phác đồ 5 ngây
Ngoài những nghiên cứu lâm sảng được thiết kế chặt chẽ, không nên sử dụng phối hợp irinotecan
với phảc đồ S-FU/ LV ]ỉên tục trong 4-5 ngảy mỗi 4 tuần do độc tính gia tăng vả có thể gây tử
vong. Irinotecan phải được sử đụng theo đủng khuyến cảo.
Tăng độc tỉnh ở bệnh nhân chỉ số toân trạng theo WHO = 2
Trong các thử nghiệm lâm sảng sử dụng phảc đồ irinotecan/S-FU/LV hoặc 5-FU/LV, những bệnh
nhân nảo có chỉ số toản trạng theo WHO ở mức 2 có tỷ iệ nhập vỉện, sốt gìảm bạch cầu trung tính,
huyết khối tắc mạch, ngưng trị liệu sau chu kỳ ] và tử vong sớm cao hơn nhũng bệnh nhân có chỉ
số toản trạng theo WHO ở mức 0 hoặc 1.
Rối loạn chức năng thận/suy thận
Tăng creatinin huyết thanh hoặc urê huyết đã được quan sát thẳy. Một số hiếm ca gây rối loạn
chức nãng thận và suy thận cấp đã được xảc định, thường xảy ra ở bệnh nhân nôn mửa vảlhoặc
tiêu chảy nặng. Các trường hợp hiếm hoi rối loạn chức năng thận do hội chứng phân tách khối u
cũng đã được bảo cáo.
Rối Ioạn mạch máu
Huyết khối tắc mạch cũng đã xảy ra ở những bệnh nhân được điều trị bằng phảc đồ có chứa
irinotecan; nguyên nhân cùa những trường hợp nảy chưa được xảo định.
Bệnh viêm ruột mãn tính vâl hoặc tắc ruột
Bệnh nhân không được đìễu trị bằng irinotecan cho đến khi giải quyết xong tắc ruột.
Buồn nôn vã nôn
Đỉều trị dự phòng bằng thuốc chống nôn đã được khuyến cáo trước mỗi lần điều trị với irinotecan.
Buồn nôn vả nôn thường xuyên được bảo cảo. Bệnh nhân bị nôn liên quan đến tiêu chảy khới
phát muộn nên được nhập viện cảng sớm cảng tốt để điều trị.
Bệnh nhân suy giảm hoạt tính UGTIAl
Ở những bệnh nhân có chứa kiến di truyền dồng hợp tử UGTIAI *28 thấy có sự gia tăng ngưy cơ
giảm bạch cằu trưng tính sau khi Ichới đẩu trị liệu bằng irinotecan.
Trong một nghiên cứu trên 66 bệnh nhân dùng irinotecan đơn trị liệu (350 mg/m2 một lần/ tllậđì
mỗi 3 tuần), tỷ lệ giảm bạch cằu trung tính độ 4 ở bệnh nhân đồng hợp tử với UC/`TlWảxĩ 28'Illả
50% và tỷ iệ mắc ở bệnh nhân dị hợp từ alen (kiêu gen UGTIAI 617) là 12,5%. Khôngờsả ýhủng
giảm bạch cầu độ 4 được tìm thấy ở những bệnh nhân đồng hợp từ với alcn hoang đã Úđễu gen
UGTIAI 6/6).
Trong một nghiên cứu tiến cứu (n = 250) dể khảo sảt vai trò cùa đa hình UGTlAI* 28 trong sự
phát triển độc tính ở bệnh nhân điều trị với ỉrinotecan kết hợp với tiêm S-FU/ LV, tỉ
lệ giảm bạch cầu trung tính độ 4 ở bệnh nhân đồng hợp tử với alen UGTlA] * 28 là 4,5%, và tỷ
lệ mắc ở bệnh nhân đị hợp tù~ vởi aien nây là 5,3%. Giảm bạch cầu hạt độ 4 được ghi nhận ở 1,8%
bệnh nhân đồng hợp hợp tử với aìen hoang dã.
8/15
Trong một nghiên cứu khác, trong đó 109 bệnh nhân được điều trị vó'i ìrinotecan (100-125
mg/m2) kết hợp với tiêm bolus 5-FU/ LV, tỷ lệ giảm bạch cầu trung tính dộ 4 ở những bệnh nhân
đồng hợp tử với alen UGTIAI* 28 là 18,2%, vả tỷ lệ bệnh nhân dị hợp tử với alen nảy lả il,ì%.
Giảm bạch cẩu hạt độ 4 đã được quan sảt thấy ở 6,8% bệnh nhân đồng hợp với alen hoang dã.
Khi dùng dơn độc hoặc kết hợp với các thuốc khác, cần cân nhắc giảm liều khởi đẩu irinotecan ít
nhất một độ ở những bệnh nhân được cho là đồng hợp hợp với alcn UGTIAI* 28. Tuy nhiên,
việc gỉảm liều chỉnh xác trong quần thể bệnh nhân nảy không được xác định và những điều chĩnh
lĩều tiếp theo nên dược xem xét đựa trên khả năng chịu đựng của bệnh nhân đối vởi đìều trị.
Quá mẫn
Phán ưng quả mẫn bao gôm phản ứng phản vệ nghiêm trọug cũng đã được ghi nhận. Cần ngưn g
sử dụng irinotecan khi xảy ra phản ứng phản vệ.
Tá dược sorbitol
Thuốc có chửa scrbitol, do đó thuốc không thich hợp với những bệnh nhân không dung nạp
fructose di truyền.
Các xét nghiệm
Cân theo dõi kỳ công thức bạch cầu, hemoglobin và số lượng tiếu cằu trước mỗi liều irinoitecan.
Sử dụng ở trẻ cm
Hiệu quả của irinotecan trên bệnh nhi chưa được xảc định. Cảo kết quả từ 2 nghiên cứu mớ, chỉ sử
dụng 1 nhóm nghiên cửu đã được đảnh gìả. 170 trẻ có bưởu rắn, ít nhạy cảm với thuốc được đưa
vảo một nghìên cứu pha 2, sử dụng irinotecan liều 50 mglm2 truyền 5 ngảy liên tục trong mỗi 3
tuần. Gìảm bạch cầu trung tính độ 3-4 xảy ra ở 54 bệnh nhân (31,8%). Giảm bạch cầu trung tính
kèm theo sốt được thẳy ở 15 bệnh nhân (8,8%). Tiêu chảy độ 3-4 cũng được ghi nhận ở 35 bệnh
nhân (20,6%). Những tác dụng bất lợi nảy là tương tự so với ở người lớn. Tron g một nghiên cớu
pha 2 khảo gổm 21 trẻ em bị sarcoma cơ, chưa được điều trị trước đó, irinotecan được truyền liều
20 mg/m2 trong 5 ngảy liên tục vảo cảc tuần 0, l, 3 vả 4. Chế độ đớn trị lỉệu nảy sau đó được tĩếp
tục bằng đa hóa trị. Số lượng lìều irinotecan ở pha đơn trị tạm dừng lại do tỷ lệ bệnh tỉến triến cao
(28,6%) và tử vong sớm (14%). Cảo phản ứng bắt lợi quan sảt được trong nghĩên cửu nảy khác
với cảc phản úng bẩt lợi xảy ra ở người lớn; tác dụng bẳt lợi độ 3 hcặc độ 4 thường xuất hiện nhắt
là mất nước ở 28,6% bệnh nhân, kèm theo giảm lCr nặng trong 5 bệnh nhân (23,8%) vả giảm Na'
ở 3 bệnh nhân (14,3%); Ngoài ra nhiễm trùng độ 3—4 cũng được bảo cáo ở 5 bệnh nhân (23,8%)
(qua tẩt cả cảc đợt trị liệu vả không liên quan đến nguyên nhân). Các thông số dược động học đối
với irinotecan vả SN-38 cũng được xảo định trong 2 thử nghiệm trên bướu rắn ở trẻ em với liều
50 mg/m2 (trưyền 60 phút, n = 48) vá 125 mgfm2 (truyền 90 phút, n = 6). Sự thanh thải `ưinotecan
là 17,3 f 6,7 L/giờim² đối với liếư SOmg/m² và 16,2 1: 4,6 LJgiờ/m² đối với liều 12 uig/ i tuchg
tự so với người lớn. AUC của SN-38 bỉnh thường hớa theo iiều lả tương tự nhauỉiữh ngườ'yiởn
vả trẻ em. Sự tích tụ irinotecan vả SN-38 quan sảt dược ở trẻ em theo chế độ liều hảng ngảýiffl1ảng
ngảy x 5 mỗi 3 tuần hoặc (hảng ngảy x 5) x 2 tuần cách mỗi 3 mần] là thấp.
Sử dụng ở bệnh nhãn cao tuổi
Cẩn theo dõi chặt chẽ cảc bệnh nhân trên 65 tuồi về nguy cơ xảy ra tiêu chảy khỏi phảt mưộn.
Liều khời đầu cùa ìrỉnotccan ở các bệnh nhân từ 70 tuổi trở lên theo chế độ Iiều [ lần mỗi 3 tuần
là 300 mg/m².
9/15
Khả nãng sỉnh sản, sử dụng ở phụ nữ có thai vã cho con bú
Khả năn g sinh sản
Không có dữ liệu về ảnh hưởng cùa ỉrỉnotecan đối vởi khả nãng sỉnh sản ở người. Ở động vật, cảc
tảo động bất lợi cùa ỉrinotecan đối với khả năng sinh sản đã được ghi nhận.
Cảo biện pháp tránh thai cần được thưc hỉện ở phụ nữ trcng tuồi sinh sản và bệnh nhân nam giới
trong thời gian điều trị và 3 thảng sau khi điều trị.
Phụ n »? có thai
Không có đủ nghiên cứu trong việc sử đụng irinotecan ở phụ nữ mang thai. Irinotecan dã được
chứng minh lả có độc tố trên phôi thai và gây quải thai ở thờ và chuột. Do đó, không nên sử đụng
thuốc nảy trong thời kỳ mang thai.
Nốu bệnh nhân có thai trong khi dùng thuốc nảy, cần thông báo n gay cho bảo sĩ diều tri.
Phụ nữ cho con bú
Chất phóng xạ iiên quan đến 14C-irinotecan xuất hiện trong sữa chuột. Không bỉết liệu thuốc nảy
cò bải tiết trong sữa mẹ hay không. Do nhỉều thuốc bải tiết qua sữa mẹ và do irinotecan có nguy
cơ gây những phản ứng bất iợi nghiêm trọng trên trẻ bú sữa, vì thế cần ngưng cho c0n bú khi
được đỉều trị bằng irinotecan.
Ảnh hưởng cũa thuốc đến khả năng lái xe hoặc vận hânh máy
Bệnh nhân cẩn được cảnh báo về nguy cơ hoa mắt, rối loạn thị lục có thể xảy ra trong vòng 24 giờ
sau khi truyền irinotecan và khuyến cảo không nên lái xe, vận hảnh mảy móc nếu những triệu
chứng nảy xảy ra.
TƯỚNG TÁC THUỐC
5-fluorouracỉl (5—FU) vả leucovorin (L V):
Trong một nghiên cứu iảm sảng pha 1, bao gồm irinotecan, S-fiuorouracil (_S-FU) vả leucovorin
(LV) ở 26 bệnh nhân có bướu rắn, sự phân bố irinotecan không bị thay đồi khi sử dụng đồng thời
các thuốc trên. Mặc dù Cmax vả AUCo.24 giờ của SN-38 có gỉảm (khoảng 14% vả 8%) khi S-FU vả
LV được truyền sau khi truyền ỉrinotecan so với khi chỉ sử dụng một mình irinotecan, thứ tự
truyền dịch nảy được sử dụng trong cảc thử nghiệm phối hợp và đã được khuyến cáo. Các nghiên
cửu tương lảc thuốc chính thửc in vivo và in vitro đề đảnh giá ảnh hướng của ìrinotecan trên sự
phân bố cùa 5-FU vả LV vẫn chưa được tiến hảnh.
Các thuốc cảm ứng mạnh CYP3A 4:
Ở người lớn và trẻ cm, nồng độ ìrinotecan hoặc chất chuyển hoá có hoạt tính SN—38 gỉảm 'ng kể
khi sử dụng đồng thời vởi thuốc chống co giật cảm ứng enzym CYP3A4 nht ah \ toigi,
phenobarbitai, carbamazepỉn, hoặc St. John’s Wort. Liều khởi đằu thich hợp cho bộ ihxiih | ợ`(ng
các thuốc cảm ứng mạnh như rifampin vả rifabutin chưa dược xảo định chính thức. V
Cần cân nhắc việc thay thế phương phảp điều trị bằng thuốc không gãy cảm ứng enzym it nhắt 2
tuần trưởo khi bắt đằu điều trị bằng irinotecan. Không đùng thuốc cảm ứng CYP3A4 mạnh với
irinotecan trừ khi không có phương pháp điều trị thay thế.
Cảc llmổc ửc chế mạnh C YP3A4 hoặc UGTJA 1:
Irinotecan vả chắt chưyến hóa có hoạt tỉnh SN-38 được chnyến hóa qua isoenzym cytocrom P450
3A4 (CYP3A4) vả uriđin diphosphat-giucuroncsy1 transferase IA] (UGTIAI) tương ứng. Khi
10115
dùng đồng thời ketoconazoi (một thuốc ức chế CYP3A4 vả UGTIAI) sẽ lảm tăng nồng độ
ỉrinotecan vả chẩt chuyển hoá có hoạt tính SN-38.
Việc dùng chung irinotecan với các chắt ức chế CYP3A4 khác (ví đụ ciarithromycin, indinavỉr,
itraconazol, Iopinavir, nefazodon, nelfinavir, rỉtonavir, saquinavir, tclaprevir, voriconazol) hoặc
UGT1AI (ví dụ atazanavir, gemf'xbrozil, ỉndinavir) có thể iảm tăng nồng độ toản phẩn cùa
irinotecan hoặc SN-38. Ngừng cảc chất ửc chế CYP3A4 mạnh ít nhẳt 1 tuần trước khi bắt đằư
điều trị bằng irinotecan. Không dùng đồng thời cảc thuốc ức chế mạnh CYP3A4 hoặc UGTIA]
với irinotecan trừ khi không có phương phảp đỉềư trị thay thế.
Thuốc chẹn thồn kinh—co':
Không thể Ioại trừ sự tương tảo gỉữa irinotecan vả thuốc chẹn thần kinh cơ. Irinotccan có hoạt tĩnh
ức chế cholinesterase và có thể kéo dải tảo dụng chẹn thần kinh-co' cùa suxamethonium vả có thế
đối kháng với các thưốc chẹn thần kinh cơ nhóm không khítr cực.
Cetuximub:
Không có bằng chửng về tính an toản cùa irinotecan bị ảnh hướng bới cctưximab hoặc ngược lại.
Bevacizumab:
Trong một nghiên cứu, nồng độ irinotecan là tương tư ở bệnh nhân dùng irinotecan! 5-FU/ i~`A
hoặc kết hợp với bevacizumab. Nồng độ chất chuyển hóa có hoạt tính của irinotecan (SN-38),
được phân tích trong một nghiên cửu (khoảng 30 bệnh nhân mỗi nhánh điều trị). Nồng dộ SN-38
trung bình ở bệnh nhân đùng irinotecan/ 5-FU/ FA kết hợp với bevacizumab cao hơn 33% so với
những người chỉ đùng irinotecan/ S—FU/ FA. Do có sự biến đổi giữa các bộnh nhân và gióì hạn số
lượng mẫu, nên không chắc chắn rằng SN-38 tăng lên do bevacizumab. Có một sự tăng nhẹ hiện
tượng tiêu chảy và giảm các triệu chứng bắt lợi bạch cầu. Giảm liều irinotecan dược bảo cáo ở
những bệnh nhân dùng irinotecan/ S-FU/ FA kểt hợp với bevacizumab.
Những bệnh nhân bị tiêu chảy nặng, giảm bạch cầu hoặc gỉảm bạch cầu trung tính khi kết hợp
bevacizumab vả irinotecan cần được điều chinh liều irinotecan.
Thuốc chổng dõng:
Việc sử dụng thuốc chống đông lả phố biển do bệnh khối u lảm tăng nguy cơ cảc hiện tượng
huyết khối. Nếu chỉ định thuốc chống đông máu kháng vitamin K, cần phải tăng tằn suất theo dõi
INR (chỉ số chuẩn quốc tế) do chỉ số diều trị hẹp, sự bỉến đối cơ địa bệnh nhân về huyết khối và
khả năng tương tác giữa thuốc chống đông đường uống và hóa trị ììệu chống ung thư.
Vẳc xin:
Không dược sư dụng dồng thời vắc xin sốt vảng với irinotecan vi có nguy cơ dẫn đếr'i"tư g 0
phản ưng với vắc xin. \
Không sử dụng đồng thời vắc xin sống giảm độc lực (trừ sốt vảng) với irinotecan vì nguyxỗợ mắc
bệnh hoặc tử vong (như do nhiễm trùng) có thể xảy ra. Nguy cơ nảy tăng lên ở nhũng người đã bị
ức chế miễn dịch đo bệnh tiềm ẩn cùa họ.
Có thể sử đụng vẳc xin bất hoạt trong những trường hợp nảy (ví dụ như vắc xin bại Iìệt).
Phenytoín:
Có nguy cơ co giật trầm trọng do sự giảm hắp thư đường tiêu hóa cùa phenytoin khi sử đụng
thuốc gây độc tế bảo hoặc tãng ngưy cơ nhiễm độc do tăng chuyến hóa phenytoin tại gan.
lh'lS
Ciclosporin, tacrolimus:
Cân cân nhăc khi sử dụng đông thời irinotecan vói ciclosporin hoặc tacrolimus do ưc chế miễn
dịch quá mức có thẻ dẫn đên nguy cơ tăng sinh hạch bạch hưyêt.
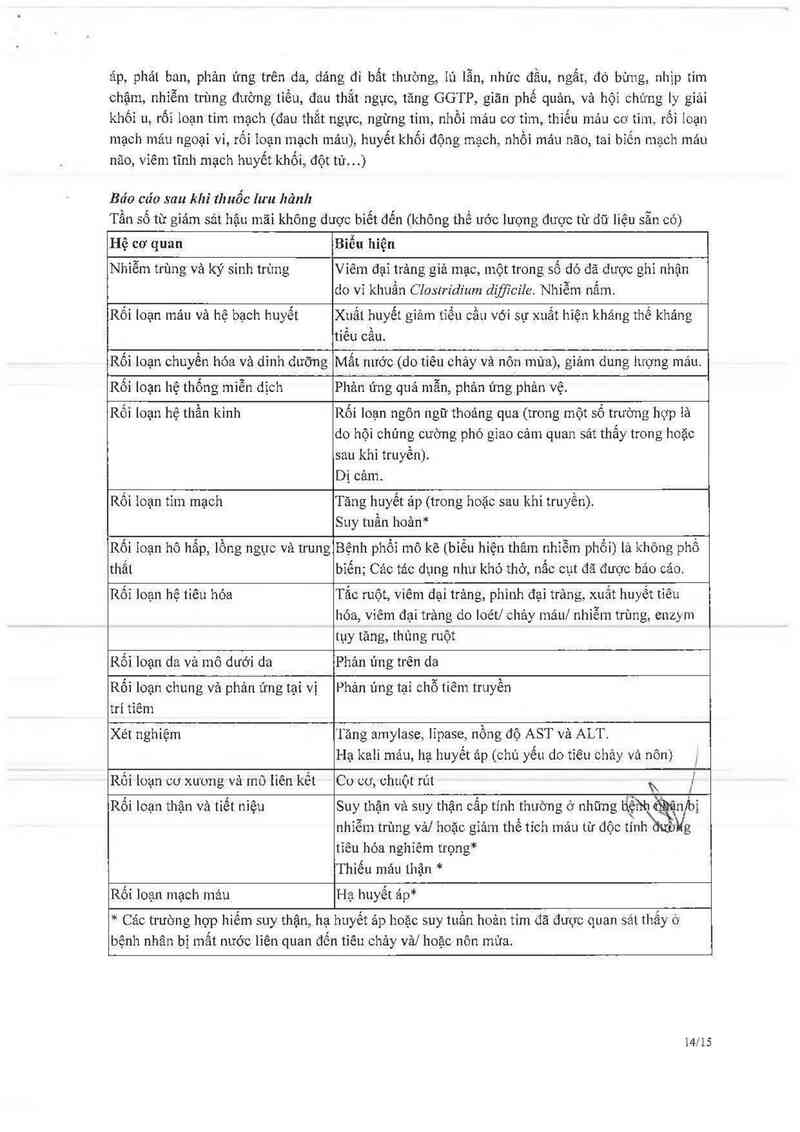
TÁC DỤNG KHÔNG MONG MUỐN
Các dữ liệu về tảo dụng không mong muốn được thu thập từ nghiên cứu trên bệnh nhân ung thư
đại trực trảng di căn. Cảc tác dụng không mong muốn cho cảc chỉ định khảc đụ' kiến sẽ tương tự
như với ung thư đại trực trảng.
Tác dụng không mong muốn thường gặp nhẫt (a …0) ia tỉêu chảy khớì phát muộn (24 giờ sau
khi đùng thuốc) và rối ioạn máu bao gồm giảm bạch cằn, thỉếu máu vả giảm tiểu cẳu.
Giảm bạch cầu trung tính là một tảo dụng độc có giới hạn liềư. Giảm bạch cằn trưng tính có thể
đảo ngược và không tích lũy; Thời gỉan xưẳt hiện triệu chứng trung bình là 8 ngảy dù sử dụng đơn
trị hoặc iiệu pháp phối hợp.
Hội chứng cường phó giao cảm cẳp tính nghiêm trọng rắt thường gặp đã được quan sát. Các triệu
chứng chính là tiêu chảy khỏi phát sớm vả các triệu chứng khác như đau bụng, dỗ mồ hôi, ho và
tăng tĩết nước bọt xảy ra trong lúc truyền hoặc trong 24 giờ đầu sau khi trưyền irinotecan. Các
triệu chửng nảy bìến mất sau khi dùng atropin (xem phần Cảo trường hợp thận trọng khi dùng
thuốc)
Đơn trị liệu
Cảo tảo dụng không mong muốn sau đây được xem là có hoặc có thế iiên quan đến việc dùng
irinotecan đã được báo cảo từ 765 bệnh nhân ở iiều khưyến cáo 350 mg/m2 trong đo'n trị liệu.
Trong mỗi nhóm tần số, tác dụng không mong m uốn được trình bảy theo thứ tự giảm dần. Cảo tần
số được định nghĩa ư: rất phố biển (a moi, phổ biến (; …oo đển < moi, ít gặp
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng