















45.111
Irinotel 100 mg/S ml - Carton - Vietnam
Baddi - II
(40 x 40 mm)
tor over coding
Ì Unvarnish Area
ị ZD code
|
ffl Thuỏc bán theo đơn
Irỉnotel”
lrinotecan hydroclorid
trihydrat 100 mgl5 ml
Dung dịch tlém truyền
HộpllọSml
ổ… '1h n…
iiif…Bộ Y TẾ
C_ỄỄỄỄQb'ẢN' L_Ý DƯỢC
i ,———,——k—— ,
ịJA PHE DUYỆT
Lân dauẮ9/ỂI0ẨQÁ'Ĩ’
Thủnh phìn: Mòt le chửa 100 mg
lrinetecan hyđrodond trihydrat
Chi đinh, ehđng em định. eieh
dùng vì eie lhỡnq !… khie: xin
đoc tờ huởng dăn sử dụng
Đường đủllg: tiem truyắn tinh madx
sau khi pha
Bia quin: ở nhtèt dò duới 30'C
Khỏng đũng ianh Trinh ánh sang
sóm sx Nsx. HD: xem "BAici-i`
MFG. EXP' tren bao bx
Đớthuỏcnủmvỏicủưdombọc
kỷ h…g dln sử dụng mm khi
dùng.
SĐK
Sán xuất tei An Dò bởi:
Frululuu Klbi Onenlogy le.
Wlege-Kìsnonpum. Baddu
Tehul-Nalaũarh. Disulcl Solan.
Himachal Fradech. lN-174101
DNNK
Cautlou: it Is dangernus lo lake lhis
preparation except onder Mecka1
Sunervxsmn.
Ễ…
tOO mo/5 ml
R“ Prescription diug
lrỉnoiel
trìnotecan hydrochloride
trihydrate 100 mg/5 ml
Solution for infuszon
Box of 1 via! 5 ml
&
VẤN PHÒNG
/n' có ĐẬI DIỆN
~1' No 11 CỔPHẤ
z FREsemus kaai
t BỈDIP_HAR
_ TẬỈ HÀ NỘI
unnan
40.40.70
VNN
Each vial contains~
100 mg Irinolecan hydrochloride
trihydmte. `
lnđicatlon, conlraimticitien. usaqe
and other inlormatlcns: read
accompanqu packaqe inseri.
Fer … inlusien iíterdlluhon
Storage: Store at a lemperature
bemw 30°C. Pfơteci lrem lith Do
not treeze
Warninq: cytotoxic aqent. To ue
supplied aqainst tiemand trom
Cancet Hospitals, Institutỉon and
aqamsl presttiptien ot a Canter
SpectaiisLoniy
Mtq. Lic. lũ .: TIỆ9/
" ’ ndi
y.
Fresenìus H E uqv LM. '
V1llaqe-Kishbhpura. Bandc.
ĩehsil~Nalaqarh, District Solan.
mmacnal Pradesh. IN~174101
111111I11I111111 `
Mfg. & Exp. format: ddlmmlyyyy
~
Irinotel 100 mg/S ml - Label - Vietnam
Baddỉ - II
200%
Eun vialcontc1ns:
`»u letuI'I
lnrư›tr~l “
›…«nvfnơmc
t…... c……
……1……
……
n...…—
Fnessmus KABI
stoip_itAn
_ Tu HA NỘI
LJnvgrlliẵh Area
'èĩi.“ ' Ê mm«
60x18 mm
Mfg. Lic. Ne.: 14131011519
100 mg lrinolenn hydrocmorlde trlhydute. Manufactured [n md, ỉ
0ouu: A1 đinclcd by the Physlcian. Read , Freunius Kúl :
cccomplnvlnq plcknqe insm fer detaileđ "'Prescnehon druq villlqe-Klghlnpu , E
eoane. dlrectìons ioruse nnn preccutlons. _ l __ B.nail Tehsil—Nll
Sfouọo: stem lt I temperalurl below 30°C. |n nO'ị'el District sọlgn,
Protect Irem llth Donot |rneze, Hlmlchal Pudesh,
_ , lrinotecan hydrochlouce iN-t14101
Cauliun: It is dinqerous to take this pre- trlhvđrate 100 111ng mi
uaratinn except under MedicalSuuervisicn. S | ! ' _ 1 1
o u on 01 … us on BATCH: '
wunmq: Cvtotoxlc nqent. ĩo be Viai5mị MĩG* Unvarnl5h Area
supolleđ lqninst dnmlnd ftom Clnocf EXPÌ 20 8 ,
Hosmtals Institutlons and aqunst :
preseriutioh olaCincer Spenalỉst only. % ã'ẳzmw ` X m m '
Mfg. & Exp. format:
ddlmmlyyyy
zi \
,. ,I_c \
`JJAJ'
ỂI4,Ô \
/ -, ’ifẽNpiiòNG ~`
( _`… U£_11 DIỆN
CÔNG TY có PHẢN
\
Thuốc bán theo đơn
Đê xa tãm tay trẻ em ~_- 1 FRESENIus KABt '
- , ;— , , , , ,_\_ BtDIPHAR /i
Đọc ky huv’ng dan sư dụng trươc khi dung tị__ tgcini HÀ Nội / ,_
Nêu cân thêm lhông tín xin hỏi ý kíến băc sĩ \\Ử
Thông báo ngay cho bác sĩ hoặc dược sĩ những tác dụng không mong muốn gặp p`lĩ ' ni dùng
thuốc
iRINOTELTM
CẢNH BÁO
Irinotecan chi được sử dụng dưới sự giám sát cùa các bảo sĩ có kỉnh nghiệm trong việc sử
dụng cảc thuốc diễu trị ung thu'. Việc kiểm soát các biến chứng xảy ra chỉ có thể dược đảm
bảo khi có đủ phương tiện chẳn đoán và điều trị. Irỉnotecan có thể gây tiêu chảy khởi phảt
sớm và tiêu chảy khới phải chậm qua những cơ chế khác nhau. Cả hai dạng tiêu chảy đều có
thể nghiêm ti'ợhg. Tiên chây khởi phát sớm (xảy ra khi đang truyền hoặc sau khi truyền
irìnotecan, có thể kèm theo các triệu chứng cường hệ thần kinh phó giao cảm như viêm mũi,
tăng tiết nước bọt, co đỗng tứ, chảy nước mắt, chảy mồ hôi, đỏ bừng mặt, tăn g như động ruột
gây đau thắt bụng). Tiêu chảy khởi phảt sởm và các triệu chứng cường phó giao cảm có thế
được ngăn ngừa hoặc giảm bót bới atropin. Tiêu chảy khỏi phảt muộn (thuờng xảy ra sau 24
giờ truyền iiinotecan) có thể gây nguy hiếm tính mạng do tình trạng tiêu chảy kéo dải, có thế
guy mắt nuớc, rối Ioạn điện giải hoặc nhiễm trùng. Tiêu chảy khỏi phát muộn cần phải được
điều trị kịp thời bằng lopemmid. Cần theo dõi bênh nhân bị tiêu chảy/hả địnlybù dịch và
chất diện gìải nếu bệnh nhân bị mẩt nuớc hoặc chỉ định sử dụng kháng smn ếuẤaộnh nhân bị
tắc ruột, sốt hoặc tình trạng tiêu chảy nặng. Cần ngưng sử dụng irinotecaử giảm liỗu sau
đó nếu có tiếu chảy nặng. Thuốc có thể gây suy tùy nặng.
THÀNH PHÂN
Mỗi 1111 dung dịch chửa 20 mg ìrinotccan hydroclorid trihydrat
IRINOTEL 40 mgl2 ml:
Mỗi lộ 2 ml dung dịch chứa 40 mg irìnotecan hydroclorid trihydrat
IRINOTEL 100 mng mi:
Mỗi lo 5 ml dung dịch chứa 100 mg irinotecan hydroclorid trihydrat
Tá dược: Sorbitol, acid lactic, acid hydrocloric, natri hydroxid, nước cất pha tiêm vừa đủ.
MÔ TẢ
Irinotecan lả dẫn chất bán tồng hợp cùa một alkaloid thực vật 1ả camptothccin chiết xuất từ
Campiolheca accuminata. lrinotecan lá thuốc trị ung thư đầy tiềm năng do có hoạt tinh khảng
nhiều Ioại ung thư khảo nhau trên cảc mô hình ung thu' thực nghiệm. 'l`huốc ức chế chức năng oùa
topoisomerase 1 bằng cảch gắn với phức hợp topoisomerase i/ADN. Dung dịch irinotecan
hydroclorid trihydrat là dung dịch có mảu vâng nhạt vả không chứa các tiến phân có thể nhìn thấy
đươc.
CẢU TRÚC HÓA HỌC
CH3
| 1; HC)
©O ,
\c/
Il
° o
cn;cm
lrlnotecan Nvdrochloride
Irinotccan hydroclorid có dạng bột kết tinh mảu vảng nhạt, có hoạt tính kháng ung thu mạnh. Về
mặt hóa học, thuốc có cấu trúc lả: (S)—4, 11-diethyl-4-hydroxy-9-[(4-pỉperi-dìnopiperidìno)
carbonyloxy]-l H-pyrano [3’,4’:6,7] indoiizino [1,2-b] quỉnoiine-3,14(411,12H)di0n0 hydroclorid.
Thuốc tan ít trong nước và dung môi hữu cơ. Thuốc có công thức hóa học tổng quải lả
C33HggNioó.HCi.3Hzo và trọng lượng phân từ là 677,19.
DẠNG BÀO CHẾ
Dung dịch tiêm truyền.
QUY CÁCH ĐÓNG GÓI
IRINOTEL 40 mg/2 ml: Hộp 1 lọ 2 ml
IRINOTEL 100111g/5 ml: Hộp ] lọ 5 ml
DẶC TÍNH DƯỢC LỰC HỌC
Irinotecan kì một dẫn chất của camptothecin. Các camptothccin tương tác đặc hiệu vởi enzym
topoisomerase 1, một cnzym giúp mở chuỗi xoắn kép ADN để tạo các chuỗi xoắn dơn. lrinotecan
và chất chuyển hóa có hoạt tính của nó SN-38 gắn vảo phức hợp topoisomerase I-ADN và ngăn
chặn sự tạo thảnh chuỗi xoắn kép ADN. Các nghiên cứu gần đây cho thấy rằng tác đụng khảng tế
bảo ung thư của irinotecan là do tác dụng gây tổn thương chuỗi xoắ1i`kốè ADN/Ểrong quá trình
tổng hợp AND, khi cnzym sao chép tương tác với phức họp của 3 phâr`htiiỵ: \ oiễomerase 1 -ADN
và irinotccan hoặc chất chuyển hóa SN-38. Cảo tế bảo của động vật có vú ng có khả nảng sứa
chữa hữu hiệu những tồn thương nảy.
lrinotecan đóng vai trò là tiền chất tan được trong nước cho dạng chuyến hóa SN—38 tan trong
dầu. SN-38 được tạo thảnh từ irinotecan nhờ tác dụng cùa enzym carboxylesterasc cắt dứt liên kết
carbamat giũa khung camptothccin và chuỗi dipiperidino. SN-38 có tảo dụng ức chế
topoisomerase I được tinh chế từ các dòng tế bảo ung thư cùa người hoặc loải gặm nhấm mạnh
gấp khoảng 1000 lần so với irinotccan. Tác dụng diệt tế bảo ung thư in vitro cùa SN-38 mạnh gấp
2 — 2000 lần so vởi irinotecan. Tuy nhiên, nồng độ SN-38 trong huyết tương (AUC) chi bằng
khoảng 2-8% so vởi irinotecan và 95% SN-38 gắn với protein huyết tương, so với irìnotccan
khoảng 50%. Vì thế, không xác định được chinh xác có bao nhiều phần hoạt tính cùa SN-38 đóng
góp vảo hoạt tính của irinotecan. Cả irinotecan vả SN-3S đều có vòng lacton có hoạt tính và một
anion dạng hydroxy acid không có hoạt tinh. Giữa 2 dạng nảy có một sự cân bằng lệ thuộc vảo pH
vả môi trường pH acid gỉúp tãng cưòng dạng lacton trong khi dó môi trường kiềm giúp tạo dạng
anion hydroxy acid.
Irinotecan có tác dụng khảng ung thư ở chuột nhắt được gây ung thu' bởi cảc dòng tế bảo ung thu'
của loải gặm nhấm vả trên mô ung thư ghép có nguồn gốc từ người ở nhiều dạng khảc nhau về
mặt mô học.
2/15
ĐẶC TÍNH DƯỢC ĐỘNG HỌC
Sau khi truyền tĩnh mạch irinotecan ở người, nồng độ irinotecan trong huyết tương giảm theo cắp
số nhân và có T1); trung bình sau cùng 1ả 6-12 giờ. Tu; trung bình sau cùng cùa dạng chuyền hóa
có hoạt tính SN-38 iả khoảng từ 10-20 giờ. Tin cửa dạng lacton (có hoạt tinh) của irinotccan vả
' SN-38 tướng tư với Tiiz cùa tồng lượng irinotecan vả SN-38, khi dạng lacton vả hydroxyi 'dCid
cân bằng nhau. Với liếư khuyến cảo từ 50 đến 350 mglm², AUC cùa irinotecan tăng tưyến tinh
theo iiều; AUC cùa SN-38 it tăng theo tỷ lệ với liều iượng hon. Nồng độ tối đa cùa chẳt chuyến
hóa có hoạt tính SN-38 thường đạt được trong khoảng 1 giờ sau kết thủc 90 phút truyền irinotecan
với mửc iiều 125 và 340 mg/m².
Phân bố:
Irỉnotecan gắn kết nhẹ vói protein huyết tương (30% đến 68%). SN-38 gắn mạnh vảo protein
huyết tương (khoảng 95%). Albumin lả protein huyết tương chủ yếu được gắn kết với irinotecan
vả SN—38.
Chuyển hỏa:
Sự chuyến hóa irinotecan thảnh chất chuyển hóa có hoạt tinh SN-38 được xúc tảo bới enzym
carboxyiesterasc và chủ yếu xảy ra ở gan. SN-38 sau đó iiên hợp vởi glucurmưd dưới tác dụng
của enzym UDP-giucuronosyi transferase IA] (UGTIAi). Hoạt tinh của UGTiAi bị giảm ở
những đối tượng có đặc tính đa dạng di truyền gây giảm hoạt tính cnzym, ví dụ như kiểu đi truyền
UGTiAi *28. Có khoảng 10% dân số Bắc Mỹ có kiến di truyền đồng hợp tử UGTIAI*28. 'i'rong
một nghiên cứu tiền cứu, irinotecan được sử dụng ở dạng đơn trị theo phảc đổ một iiều cách mỗi
3 tuần, ở những bệnh nhân có kiến di truyền đồng hợp từ UGTIAI*28, nồng độ SN-38 cao hon
so với bệnh nhân có kiều di truyền UGTIAI binh thưòng. Dạng liên hợp SN…38 với giucuronid
chỉ có hoạt tính bằng 1150-11100 so với SN-38 khi thử nghiệm lrên 2 dòng tế bảo ung thư in víer.
Đảo rhải:
Chưa xác định rõ sự phân bố của irinotecan trong cơ thế người. Irinotccan được bải tiết qua nước
tiều khoảng 11-20%, SN-38 khoảng dưới 1% và SN-38 dạng liên hợp glucuronid khoảng 3%. Sự
bải tiết qua mật vả nước tiếu của irinotecan vả SN-38, SN-38-giucuronid trong 48 giờ sau khi sử
dụng irinotecan ở 2 bệnh nhân iả khoảng 25% (100 mglm²) đến 50% (300 mg/mz).
Dược động học trong nhóm dân số đặc biệt
Người cao tuổi: Trong nhũng nghiên cứu sử dụng liều hảng tuần, TW sau cùng của irinotecan là
6,0 gỉờ ở các bệnh nhãn từ 65 tuồi trở lên, trong khi cảc bệnh nhân dưới 55 tnốí`iệt 5,5 gib.
AUCo.g4 g,ử qui bình thường theo liều của SN—38 ở nhũng bệnh nhân có độ ịluặl\\cxt thìổift iả 65, cao
hơn khoảng 1 1% so vởi nhóm bệnh nhân dưới 65 tuối. Không có khuyến cáoưhìg/dối liều khói
đâu đối với bệnh nhân cao tuối sử dụng irinotecan liều hảng tuần. Dược động học của irinotecan
khi sử dụng Iiều một iần mỗi 3 tưần chưa được nghiên cứu ở nhóm cao luồi; liều khói đầu được
khuyến cáo cho bệnh nhân từ 70 tuối trở lẽn là thấp hơn dựa trên kinh nghiệm độc tinh iảm sảng
theo iiều nảy.
Giới iỉnh: Dược động học của irinotecan không bị ảnh hưởng bởi giói tinh.
Chủng tộc: Ành hưởng cùa chủng tộc iên dược dộng học cùa irinotecan chưa được đánh giả.
Suy giảm chức năng gan: Sự thanh thải irinotecan bị giảm ở bệnh nhân có rối loạn chức nảng gan
do nồng độ cùa SN-38 tảng so với bệnh nhân có chức năng gan binh thường. Phạm vì tác động
của những ánh hưởng nảy tỷ lệ với mức độ tổn thương gan qua việc do iường nồng dộ bilirubin
toản phần vả các transaminase. Tuy nhiên, sự dung nạp của irinotecan o cảc bệnh nhăn có rối ioạn
31'15
chức năng gan (bilirubin iớn hơn 2 mglđl) vẫn chưa được đảnh giá đầy đù, và không có khuyến
cáo nảo Về liều lương được dưa ra.
Suy giám chức năng thận: Ảnh hưởng cùa suy giảm chúc năng thận trên dược động học cùa
itinotecan vẫn chưa được đảnh giả. Vì thế cẩn thận trọng đối với bệnh nhân sưy giảm chức năng
thận. Irinotecan không khuyến cáo sử dụng ở bệnh nhân thẩm phân.
CHỈ ĐỊNH
o Irinotecan được chỉ định trong điều trị cho bệnh nhân ung thư đại trực trảng tiến trĩển.
— Kết họp vởi 5-fluorouracìl (S—FU) vả axit folinic (FA) ở những bệnh nhân Ung thư tiến triến
chưa được hóa trị trước đó.
- Sử dụng đơn độc ở nhũng bệnh nhân chưa thảnh công vói phảc dỗ diếu trị có chửa 5-FU.
o Irinotecan kết hợp vởi cetuxỉmab dược chỉ định trong điếu trị cho bệnh nhân với sự xuất hiện
thụ thể của yếu tố tăng trưởng biếu bi (EGFR) bị ung thư đại trực trảng di căn (gen KRAS
tuýp tự nhiên) mà chưa được điều trị trước khi di căn hoặc sau khi thất bại với liệu trinh gây
độc tế bảo có chứa irinotecan.
o Irinotecan kết hợp với 5-FU, FA vả bevacizumab được chỉ định lả lựa chọn đầu tay trong điều
trị cho bệnh nhân ung thư biều mỏ đại trảng hoặc trực trảng.
» Irinotecan kết hợp với capecitabin, có hoặc không có bevacizumab được chỉ dịnh lả iựa chọn
đẩu tay trong điếu trị cho bệnh nhân ưng thư đại trực trâng di căn.
LIÊU DÙNG VÀ CÁCH DÙNG
Thuốc chi dùng cho ngưòi lớn. Dung dịch irinotecan sau khi được pha để truyền nên được truyền
vảo tĩnh mạch trung tâm hoặc tĩnh mạch ngoại vi.
Liều dùng khuyến cáo
Trong đơn tri liêu (ở bếnh nhân đã đỉếu tri trước đói:
Liều khuyến cảo cùa irinotecan là 350 mg/m2 dưới dạng truyền tĩnh mạch trong thòi gian từ 30
đến 90 phút, oứ mỗi ba tuần một lần.
Trong liêu oháp phếi hop ro bênh nhân chưa điều tri trước đó):
Sự an toản và hiệu quả của irinotecan kết hợp với 5-fiuorouracil (5-FU) vả folinic acid (FA) được
đánh gỉá theo lịch trình sau:
— Irinotecan kết hợp Với 5-FU/ FA, cứ mỗi 2 tuần.
Liều khuyến cảo của irinotecan là 180 mg(…2 mỗi tuần một iần, dưới dạng truyền tĩnh lmạch,
trong khoảng thời gian 30 đến 90 phút, sau đó truyền FA và 5- F U i\
Khi dùng đồng thời với cetuximab, liếư lượng và cách dùng xem huởng dẫn sử dt_ingi 11 cho sản
phẳm nảy. Thông thuờng, liều irinotccan tuong dương sẽ được sử dụng như lá đã ổưọi sủ dụng
trong các chu kỳ cuối cùng của chế độ truớc đó chúa irìnotecan. Không nên dùng irinotecan trong
vòng 1 giờ sau khi truyền cetuximab.
Khi dùng đồng thời với bevacizumab, liếư lượng và cảch dùng xem hướng dẫn sử dụng dảnh cho
sản phẳm nảy.
Khi dùng đồng thời vói capecitabin, liếư lượng vả cảch dùng xem hướng dẫn sử dụng dảnh cho
sản phầm nảy.
4.115
Hiệu chỉnh liều lượng
Irinotecan nên dược dùng sau khi các tác dụng phụ đã được phục hổi về lnủ'c 0 hoặc 1 theo NC1—
CTC (Viện ung thư quốc gia Mỹ — Tiêu chuẩn độc tính chung) vả triệu chứng tiếu chảy liên quan
đến việc điều trị đã được giải quyểt triệt đế.
Khi bắt đầu liệu ttình điều trị tiếp theo, có thế giảm iiều irinotccan vả 5-F U theo từng cá thề, nên
giảm iiều tùy theo mức độ nghiêm trọng nhắt của các tảo dụng phụ đã quan sải được trước đó.
Việc điều trị nên được trì hoãn trong 1-2 tuần để người bệnh phục hồi cảc tác đụng phụ liên quan
đến điếu trị.
Nên giảm iiều từ 15 đến 20% so với irinotecan vả/ hoặc S-FU khi có các tảo dụng phụ sau đây:
' Độc tinh về huyết học như giảm bạch cằu trung tính độ 4, sốt giảm bạch cầu (giảm bạch cẳu
trung tinh độ 3-4 và sốt độ 2-4), giảm tiều cẩu và giảm bạch cẩu độ 4.
. Độc tính không phải huyết học (độ 34).
Khi phối hợp với cetuximab, cần hiệu chinh iiếu theo hướng dẫn sử dụng cùa cctưximab.
Khi phối hợp bevacizumab với irinotccan/ 5-FU/ FA, cần hiệu chinh lỉều tth hướng dẫn sử dụng
của bevacizumab.
Nếu dùng phối hợp Vởi capecitabỉn trên bệnh nhân từ 65 tuổi trở lên, khuyến cáo nến giảm liều
khỏi đầu của capccitabỉn xuống 800 mg/m2 mỗi ngảy 2 lần, theo hướng dẫn sử dụng cùa
capecitabỉn. Xem thếm cảc khuyến cảo về hiệu chinh liền trong phảc đồ phối hợp trong hướng
dẫn sử dụng của capecỉtabin.
Thời gian điều trị
Việc điếu trị bằng irinotecan nên được tiếp tục cho đến khi có hiệu quả diếu trị hoặc đến ngưỡng
độc tính cho phép.
Sử dụng ở các đối tượng đặc bìệt
Bệnh nhãn suy gíăm chức năng gan
Đơn tri Iiêư: Mức bilirubin (tối đa 3 lần giói hạn trên của bình thường {ULND ở bệnh nhân có chỉ
số toản trạng theo WHO S 2 nên xác định iiếu khới đầu của irinotecan. Ở những bệnh nhân tăng
bilirubin máu vả thời gian prothrombin trên 50%, độ thanh thải cùa irinotccan giảm vả do đó nguy
cơ độc tính về huyễt học tăng iên. Do đó, cần theo dõi công thủ'c máu hảng tuần ở quần thể bệnh
nhân nảy.
— Ở bệnh nhân có nồng độ bỉlirubin gắp 1,5 lần so với ULN, liều khuyến cảo của irinotecan lả 350
mg/m2
~ 0 bệnh nhận 91 nồng độ bilirubin từ 1.5 đến 3 lằn so với ULN, iiều khưyến cảo của itinotccan 13
200 mg/m2
~ Bệnh nhân có nồng độ bilirubin trên 3 lần so với ULN, không nến đỉều trị với irỀ
Liêu phản phối hơp: Không có dữ iiệu cho bệnh nhân sưy giảm chức năng gan được
irinotecan trong liệu pháp phối hợp.
… ạiy'"
ii trị bằng
Bệnh nhân suy giăm chức nãng thận
irinotecan không được khuyến cảo sử dụng ở bệnh nhân bị suy giảm chửc năng thận, vì sản phẩm
chưa được nghiên cứu trong nhóm bệnh nhân nây.
Người cao tuổi
Không có nghiên cưu dược động học cụ thể nảo được thực hiện ở ngưòi cao tuôi. Tuy nhiên, iiồu
đùng nên được iựa chọn cẩn thận trong nhóm bệnh nhân nảy do giảm chức năng sinh học cùa cơ
thế. Nhóm dân số nảy cần được giảm sát chặt chẽ hơn.
51 1 5
Cách pha dung dịch tiêm truyền
Cần pha ioãng dung dịch irìnotecan trước khi tìêm truyền. Pha loãng irinotccan trong dung địch
NaCl 0,9% hoặc Giucose 5% thânh dung dịch có nồng độ từ 0,12-2,8 mg/mi.
CHỐNG CHỈ ĐỊNH
- Bệnh nhân mẫn cảm với irinotecan hoặc cảc thảnh phần khảo của thuốc.
- Bệnh viêm ruột mạn tinh vả/hoặc tắc ruột (xem mục Cảo trường họp thận trọng khi dùng thuốc)
- Phụ nữ cho con bú (xem mục Cảo trường hợp thận trọcg khi dùng thuốc)
- Bilirubin > 3 lần ULN (giới hạn trên của phạm vi binh thường) (xem mục Cảo trường họp thận
trọng khi đùng thuốc)
- Suy tủy xương nặng
… Chỉ số toản trạng theo WHO > 2
- Sử dụng đổng thời với St. John’s Wort (xem mục Tương tác thuốc)
CÁC TRƯỜNG HỢP THẬN TRỌNG KHI DÙNG THUỐC
Irinotccan chi được sử dụng dưới sự giảm sảt của các bác sĩ có kinh nghìệm trong việc sử dụng
các thuốc diều trị ung thư.
Triệu chứng tiêu chãy vả cường phó giao cãm
Tiêu chảy khới phát sớm (xảy ra trong hoặc ngay sau khi truyền irinotecan) thường 1ẩl thoáng qua
và chi thinh thoảng mới gây tiêu chảy nặng. Tiêu chảy có thể kèm theo cảc triệu chứng cường phó
giao cảm như viêm mũi, tăng tiết nước bọt, chảy nước mắt, co đồng tử, chảy mồ hôi, đỏ bừng mặt
vả tăng như động ruột gây co thắt bụng. Chứng nhịp tim chậm cũng có thế xáy ra. 'i`iêu chảy khới
phảt sớm và cảc trỉệu chứng cường phó giao cảm khác có thể được ngản ngừa hoặc giảm bớt bằng
atropin. Dự phòng hoặc điếu trị bằng cách tiếm tĩnh mạch hoặc tiêm dưới da 0,25 - 1 mg atr0pin
(trừ khi chống chỉ định trên iâm sảng). Những triệu chứng nảy xảy ra với tần suất cao hơn khi sử
dụng Iiều irinotecan cao hơn.
Tiêu chảy khởi phảt muộn (thường xảy ra sau 24 giờ sử dụng irinotecan) có thể gây ngưy hiếm
tinh mạng, đo tiếu chảy kéo dải gây mất nước, mất cân bằng điện giải hoặc nhỉễm trùng huyết.
Tiêu chưẩn khớỉ phải muộn mức 34 xảy ra ờ 23-31 % bệnh nhân dùng liều hảng tuần.
Trong cảc nghiên cứu lâm sảng, thời gian trung binh xảy ra tiêu chảy muộn lả 5 ngảy với liều
dùng 3 tuần và 11 ngảy với liếư hảng tuần. Tiếu chảy muộn có thể nghiêm trọng do viêm đại
trảng, loét, chảy máu, tắc ruột, nhiễm trùng. Tiêu chảy khởi phát muộn cằn được điều trị kịp thời
bằng ioperamid. Bắt đầu sử dụng ioperamid ở giai đoạn đầu của phân lóng hoặc sự xuất hiện như
động ruột thường xuyên hơn. Liều loperamìd lả 4 mg vảo iúc bắt đầu xuất hiện\t' ụ C-1’1ẫily khởi
phảt muộn và sau đó là 2 mg mỗi 2 giờ cho đến khi bệnh nhân không còn tiêu chả Ềầọng'íi nhẩt
ẺJịếh nảy, vì
nguy cơ bị liệt ruột thừa. Vảo ban đêm, bệnh nhân có thế sử dụng 4 mg ioperamiđ 4 giờ một lần!
Cần theo dõi cảc bệnh nhân tiêu chảy, truyền dịch và chất điện giải để phòng bệnh nhân bị mật
nước, sử dụng kháng sinh nêu bệnh nhân có tăc rưột, sôt hoặc giảm bạch câu trung tính nghiêi
trọng. Sau tuần trị Iiệu đẩu tiến, cằn hoãn các tuần hóa trị tiếp theo cho đến khi chức năng ruột trở
về tinh trạng ban đầu trong tối thìếu 24 giờ mà không cần phải sử dụng thuốc trị tiêu chảy. Nếu
tiêu chảy khởi phảt muộn dộ 2, 3 hoặc 4 xảy ra, cần phải giảm liếư irinotecan trong chu kỳ tiếp
thco.
12 giờ. Loperamid không được khuyến cảo sử dụng trong hon 48 giờ liên tục ở nhữn
Tránh dùng thưốc iợi tiểu hoặc thuốc nhuận trâng ở những bộnh nhân bị tìêư chảy.
6115
Huyễt học
Tử vong do nhiễm trùng sau khi giảm bạch cầu trung tinh cũng đã được ghi nhận ở các bệnh nhãn
được điếu trị bằng irinotecan. Trong những nghiên cứu lâm sảng sử dụng iiếu hảng tuần, sốt giám
bạch cầu (gỉảm bạch cầu trung tinh độ 4 theo NCI và sốt mức 2 hoặc hợn xuất hiện đồng thời) xảy
ra trong 3% bệnh nhân; 6% bệnh nhân được chỉ định G-CSF đề đìều trị giảm bạch cầu trung tính.
Có thể kiểm soát sốt giảm bạch cần nhanh chóng với sự hỗ trợ kháng sinh. Cần tạm thời bỏ qua trị
iiệu với irinotecan trong chu kỳ nếu có sốt giảm bạch cầu hoặc nếu số lượng bạch cầu trung tinh
giảm < 1000/111m3. Sau khi bệnh nhân phục hồi số iượng bạch cằu trung tính 2 1000/1111113, cần
giảm iiều irinotccan cho các lằn trị liệu tiếp theo.
Khi đánh giá các thử nghiệm sử dụng chế độ liều hảng tuần, tần suất giảm bạch cầu trung tinh độ
3 hoặc 4 thường cao hơn ở các bệnh nhân trước đó được xạ trị vùng chậu/ố bụng so với bệnh nhân
không xạ trị (48% [13127] so với 24% [67/277]; p = 0,04). Những bệnh nhân trước đó đã được xạ
trị vùng chậu vả ồ bụng có nguy cơ cao suy tùy sau khi dùng irinotecan. Dựa vầo cảc số iiệu sơ
sải có sẵn, vìệc sử dụng đồng thời irinotecan cùng với xạ trị không được khuyến cáo.
Bệnh nhân có hảm lượng bilirubin toản phần trong huyết thanh từ 1,0 mgỉdL trở 1ến có khả năng
xuất hỉện giảm bạch cầu trung tinh độ 3 hoặc 4 sau chu kỳ 1 tăng so với bệnh nhân có hảm iượng
bilirubin toản phần trong huyết thanh dưới 1,0 mg/dL (50% [19Í38] so vói 18% [47/266]; p <
0,001). Bệnh nhân thiếu giucuronidation bilirubin, ví dụ như người có hội chứng Gilbert, có thể
có nguy cơ cao bị sưy tùy khi điếu trị với irinotccan.
Bệnh nhân suy gan
Xét nghiệm chức năng gan phải được thực hiện ở thời điểm đầu và trước mỗi chu kỳ điếu trị.
Cần theo dỏi công thức mảu ở bệnh nhân có bilirubin từ 1,5 đến 3 iần ULN (giới hạn trên của
phạm vi bình thường), do lâm giảm độ thanh thải cùa irinotccan và do đó lảm tăng nguy cơ độc
tinh tuyến trùng trong quằn thể nảy. Không dùng irinotecan ở những bệnh nhân có bilirubin > 3
iân ULN.
Dộc tính trên hô liẫp
Bệnh phồi mô kẽ biền hiện dưới đạng thâm nhiễm phổi iả không phổ biến trong điều trị
irinotecan Bệnh phối mô kê có thể gây tử vong. Các yếu tố nguy cơ có thế iiên q 11 đến sự phát
triền của bệnh phối mô kể bao gồm: sữ dụng cảc thuốc gây khó thớ, xạ trị vả cảồv tố ngch thích
vi khuẩn phảt triển. Bệnh nhân có các yếu tố nguy co cần được theo dõi chặt chẽkgj/ triệu chúng
hô hấp truớc và trong khi điều trị bằng irinotecan.
Rối loạn trên tim mạch
Thỉếu mảu cơ tim cục bộ đã được quan sảt thẳy sau khi điếu trị irinotecan chủ yếu ở những bệnh
nhân có bệnh tim tiếm ẩn, cảc yểu tố nguy cơ khác gây hại cho tim, hoặc hóa trị liệu gây độc tế
bảo trước đó. Do đó, bệnh nhân có các yếu tố nguy cơ đã biết phải được theo dỏi chặt chẽ và cần
phải có hảnh động đề gíảm thiểu tất cả cảc yếu tố nguy cơ có thể điều chinh (vi dụ như hi'it thuốc
lả, cao huyết ảp và tăng iipìd máu)
Ức chế miễn dịch
Tiêm vảc xin sông hoặc vắc xin sống đã giảm hoạt lực ở những bệnh nhân suy giảm miễn dịch
bới cảc chất hoá trị liệu như irinotecan, có thể dẫn đến nhiễm trùng nghiêm trọng h0ặc tử vong.
71'15
Cân tránh tiêm vắc xin sống ở bệnh nhân đùng irinotccan. Cảo vắc xin đã bất hoạt có thế được
tiêm, tuy nhiên đáp ưng với những vắc-xin nảy có thể bị giảm đi.
Độc tinh cũa phác đồ 5 ngây
Ngoải những nghiên cứu lâm sảng được thiết kế chặt chẽ, không nên sử dụng phối hợp irinotecan
với phác đồ 5-FUJ' LV liên tục trong 4-5 ngảy mỗi 4 tuần do độc tinh gia tăng và có thể gây tử
vong. irinotecan phải được sử dụng theo đúng khuyến cáo.
Tăng độc tính ở bệnh nhân chỉ số toân trạng theo WHO = 2
Trong cảc thử nghiệm lâm sảng sử dụng phảc dồ irinotecan/S—FU/LV hoặc S…FU/LV, nhũng bệnh
nhân nảo có chỉ số toản trạng thco WHO ở mức 2 có tỷ iệ nhập viện, sốt giảm bạch cẩu trưng tính,
huyết khối tắc mạch, ngưng trị liệu sau chu kỳ 1 và tử vong sớm cao hơn nhũng bệnh nhân có chi
số toản trạng theo WHO ở mức 0 hoặc 1.
Rối loạn chức năng thậnlsuy thận
Tăng creatinin huyết thanh hoặc urê huyết đă được quan sảt thấy. Một số hiếm ca gãy rối ioạn
chức năng thận và suy thận cẳp đã được xác định, thường xảy ra ở bệnh nhân nôn mửa vả/hoặc
tiêu chảy nặng. Các trường hợp hiếm hoi rối Ioạn chức năng thận đo hội chứng phân tách khối 11
cũng dã được báo cáo.
Rối Ioạn mạch máu
Huyết khối tắc mạch cũng đã xảy ra ở nhũng bệnh nhân được điếu trị bằng phảc đồ có chứa
irinotecan; nguyên nhân của nhũng trường hợp nảy chưa được xác định.
Bệnh viêm ruột mãn tính vả] hoặc tắc ruột
Bệnh nhân không được điều trị bằng irinotecan cho đến khi giải quyết xong tắc ruột.
Buổn nôn vả nôn
Điều trị dự phòng bầng thuốc chống nôn đã được khuyến cảo trước mỗi iần điều trị với irinotccan.
Buồn nôn vả nôn thường xuyến được bảo cáo. Bệnh nhân bị nôn lìên quan đến tiêu chảy khói
phát muộn nên được nhập viện cảng sớm cảng tốt để điều trị.
Bệnh nhân suy giảm hoạt tinh UGTIAI
Ở những bệnh nhân có chứa kiến di truyền đồng hợp từ UGTiAI *28 thấy có sự gia tăng nguy cơ
giảm bạch cầu trung tinh sau khi khới đầu trị iiệu bằng irinotecan.
Tiong một nghiên cứu trên 66 bệnh nhân dùng irinotecan đơn tii liệu (350 mgfm2 một iầnt tuần
mỗi 3 tuẳn), tỷ lệ giảm bạch cầu trung tinh độ 4 ở bệnh nhân đổng họp tử với U lAl'7 28 lá
50% và tỷ 1ệ mắc ở bệnh nhân đi hợp tử alcn (kiến gen UGT1AI 6/7) lả 12,5%. {ủ ne co chúng
giảm bạch cầu độ 4 được tim thắy ở nhũng bệnh nhân đồng hợp tủ vói alen hoangkiỀ iếu gen
UGTIAI 6l6).
Trong một nghiên cứu tiến cứu (11 = 250) để khảo sát vai trò của đa hình UGTÌAI* 28 trong sự
phát triển độc tính ở bệnh nhân điều trị với irinotecan (180 mg/mz) kểt hợp với tiếm 5—FU/ LV, tỉ
lệ giảm bạch cầu trung tính độ 4 ở bệnh nhân đồng hợp tủ~ với alen UGTIAI * 28 1ả 4,5%, và tỷ
lệ mắc ở bệnh nhân dị họp tử với aien nảy lả 5,3%. Giảm bạch cẩu hạt độ 4 được ghi nhận ở 1,8%
bệnh nhân đồng hợp hợp từ với alen hoang dă.
8115
Trong một nghỉên cứu khảo, trong đó 109 bệnh nhân được điều trị với irinotecan (100-125
mglm²) kết hợp với tiêm bolus 5—FU/ LV, tỳ iệ giảm bạch cầu trung tính độ 4 ở những bệnh nhân
đồng hợp tử vói alen UGTIAI* 28 lá 18,2%, và tỷ iệ bệnh nhân dị hợp tử vói aicn nảy là 1 1,1%.
Gỉảm bạch cầu hạt độ 4 đã được quan sát thấy ở 6,8% bệnh nhân đồng hợp với alcn hoang dã.
Khi dùng đơn độc hoặc kết hợp vởi cảc thuốc khảo, cẩn cân nhắc giảm Iiều khỏi đẩu irỉnotecan ít
nhất một độ ở những bệnh nhân được cho là đồng hợp hợp với alen UGTIAI* 28. Tuy nhiên,
việc gỉảm liếư chỉnh xác trong quần thể bệnh nhân nảy không được xác định và những điều chinh
liều tỉếp theo nên được xem xét dựa trên khả năng chịu đựng của bệnh nhân đối với điều trị.
Quá mẫn
Phản ứng quả mẫn bao gổm phản ứng phản vệ nghìêm trỌng cũng đã được ghi nhận. Cần ngưng
sử dụng irinotecan khi xảy ra phản ứng phản vệ.
Tá dược sorbitol
Thuốc có chứa sorbitol, do đó thuốc không thich họp với những bệnh nhân không dưng nạp
fructose đi truyền.
Các xét nghiệm
Cần theo dõi kỳ công thức bạch cẩu, hemoglobin và số lượng tiến cằn trước mỗi liều irinoitccan.
Sử dụng ở trẻ em
Hiệu quả cùa irỉnotecan trên bệnh nhi chưa được xảo định. Cảo kết quả từ 2 nghiên cứu mở, chỉ sử
đụng 1 nhóm nghiên cứu đã được đánh giả. 170 trẻ có bướu rắn, ít nhạy cảm với thuốc được đưa
vảo một nghiên cứu pha 2, sử dụng irinotecan iiều 50 mglm2 truyền 5 ngảy liên tục trong mỗi 3
tuần. Giảm bạch cầu trung tinh độ 3-4 xảy ra ở 54 bệnh nhân (31,8%). Giảm bạch cẩu trung tinh
kèm theo sốt được thấy ở 15 bệnh nhân (8,8%).“1`1ô11011ảy độ 34 cũng được ghi nhận ở 35 bệnh
nhân (20,6%). Những tác dụng bất lợi nảy là tương tự so với ở người iớn. Trong một nghiên cứu
pha 2 khác gồm 21 trẻ em bị sarcoma co, chưa được điếu trị trước đó, irinotccan được truyền liếư
20 mg/m2 trong 5 ngảy ]ỉên tục vảo cảc tuần 0, 1, 3 vả 4. Chế độ đơn trị iiệu nảy sau đó được tiếp
tục bằng đa hóa trị. Số iượng liếư irinotecan ở pha đơn trị tạm dừng lại do tỷ iệ bệnh tiến triến cao
(28,6%) và tử vong sớm (14%). Cải: phản ứng bất iợi quan sát được trong nghiên cứu nảy khác
với cảc phản ứng bất lợi xảy ra ở người lớn ; tác dụng bất iợi độ 3 hoặc độ 4 thường xuất hiện nhất
lả mắt nước ở 28,6% bệnh nhân, kèm theo giảm K+ nặng trong 5 bệnh nhân (23,8%) vả giảm Nai
ở 3 bệnh nhân (14,3%); Ngoài ra nhiễm trùng độ 3-4 cũng được bảo cảo ở 5 bệnh nhân (23,8%)
(qua tất cả cảc dọt trị iiệu và không lỉên quan đến nguyên nhân). Các thông số dượcrđộng họẻ đối
với irinotccan vả SN-38 cũng được xác định trong 2 thử nghiệm trên bướu rắn ớ\r th1 v 'i liều
50 mg/m2 (truyền 60 phút, 11 = 48) vả 125 mg/m2 (truyền 90 phủt, n = 6). Sự thzinh ihá i1-itiotecan
lả 11,3 zi: 6,7 ngiờlm² đối với liều 50mg/m² và 16,2 3 4,6 L/giờ/m² đối với iiều 125 mỀ,nẵỉ tương
tự so với người iớn. AUC của SN-38 bình thường hóa theo liều lả tương tự nhau giữa ngưởi iớn
vả trẻ em. Sự tich tụ irinotccan Vả SN-38 quan sát được ở trẻ em theo chế độ liếư hảng ngảy [hảng
ngảy x 5 mỗi 3 tuần hoặc (hảng ngảy x 5) x 2 tuần cách mỗi 3 tuần] lả thấp.
Sử dụng ở bệnh nhân cao tuổi
Cần theo dõi chặt chẽ cảc bệnh 11hân trên 65 tuồi về nguy cơ xảy ra tiêu chảy khỏi phát muộn.
Liều khói dẫu của irinotccan ở các bệnh nhân từ 70 tuối trở lên theo chế độ liều ] iần mỗi 3 tuần
là 300 mglm².
9115
Khả năng sinh sản, sử dụng ở phụ nữ có thai và cho con bú
Khả năng sinh sản
Không có dữ iiệu về ảnh hưởng cùa irinotecan đối với khả năng sinh sản ở người. Ô động vật, các
tác động bất iợi cùa irinotecan đối với khả năng sinh sản đã được ghi nhận.
Các biện pháp tránh thai cẩn được thực hiện ở phụ nữ trong tuối sinh sản và bệnh nhân nam giới
trong thời gian điều trị và 3 thảng sau khi diều trị.
Phụ nữ có thai
Không có đủ nghiên cứu trong việc sử dụng irinotecan ở phụ nữ mang thai. Irinotecan đã được
chứng minh 1ả có độc tố trên phôi thai và gây quái thai ở thô và chuột. Do đó, không nên sử dụng
thuốc nảy trong thời kỳ mang thai.
Nếu bệnh nhân có thai trong khi dùng thuốc nây, cần thông báo ngay cho bảo sĩ điều trị.
Phụ nữ cho con bú
Chất phóng xạ liên quan đến MC—irinotecan xuất hiện trong sữa chuột. Không biết iiệu thuốc nảy
có bải tiết trong sữa mẹ hay không. Do nhiều thuốc bải tiết qua sữa mẹ và do irinotecan có nguy
cơ gây những phản ứng bất lợi nghiêm trọng trên trẻ bú sữa, vì thế cần ngưng cho con bú khi
được đỉều trị bằng irinotecan.
Ảnh hưởng của thuốc đến khả nãng 1311 xe hoặc vận hânh mảy
Bệnh nhân cần được cảnh báo về nguy cơ hoa mắt, rối ioạn thị lực có thể xảy ra trong vòng 24 giờ
sau khi truyền irinotecan và khuyến cảo không nên 1ải xe, vận hảnh máy móc nếu những triệu
chứng nảy xảy ra.
TƯONG TÁC THUỐC
5-jluoroumcil (5-FU) vả !eucovorin (L V):
Trong một nghiên cứu iâm sảng pha 1, bao gồm irinotecan, 5—i`iuorouracii (S—FU) vả leucovorin
(LV) ở 26 bệnh nhân có bướu rắn, sự phân bố irinotecan không bị thay đổi khi sử dụng đồng thời
các thuốc trên. Mặc dù Cmax vả AUCo-24 g.ờ của SN-38 có giảm (khoảng 14% và 8%) khi 5-FU vả
LV được truyền sau khi truyền irinotecan so với khi chỉ sử dụng một mình irinotecan, thứ tự
truyền dịch nảy được sử dụng trong cảc thử nghiệm phối hợp và đã được khuyến cảo. Các nghiên
cứu tương tác thuốc chính thức in vivo vả ín vitro để đánh giá ảnh hưởng của irinotecan trên sự
phân bố cùa 5-FU vả LV vẫn chưa được tiến hảnh.
Các lhuổc cảm ứng mạnh CYP3A4: /
Ở ngưòi lớn và trẻ em, nồng độ irinotecan hoặc chất chuyến hoá có hoạt tinh SN—38 ’ ản kể
khi sử dụng đồng thời với thuốc chống co giật cảm ứng enzym CYP3A4 như 11 toin,
phenobarbital, carbamazepin, hoặc St. John’s Wort. Liều khời đầu thích hợp cho bệnh 11 dùng
cảc thuốc cảm ứng mạnh như rifampin vả rifabutin chưa được xác định chinh thức.
Cần cân nhắc việc thay thế phương pháp điều trị bằng thuốc không gây cảm ứng enzym it nhất 2
tuần trưởc khi bắt đẫu điều trị bằng irinotecan. Không dùng thuốc cảm ứng CYP3A4 mạnh với
irinotecan trừ khi không có phương pháp điển trị thay thế.
Các thuốc ức chế mạnh CYP3A4 hoặc UGTIA 1 :
irinotecan và chất chuyển hóa có hoạt tính SN-38 được chuyển hóa qua isoenzym cytocrom P450
3A4 (CYP3A4) vả uridin diphosphat-glucuronosyi transferase IAI (UGTIAI) tương ứng. Khi
10/15
dùng đồng thời ketoconazoi (một thuốc ửc chế CYP3A4 vả UGTIAI) sẽ lảm tăng nồng độ
irinotecan và chất chuyến hoá có hoạt tinh SN-3S.
Việc dùng chưng irinotecan vởi cảc chẩt ức chế CYP3A4 khảo (ví dụ ciarithromycin, indinavir,
iti'aconazol, iopinavir, nefazodon, neifmavir, ritonavir, saquinavir, telaprcvir, voriconazoi) hoặc
UGTIA] (ví dụ atazanavir, gemfibrozỉl, indinavir) có thế iảm tăng nồng độ toản phẩn của
irinotecan hoặc SN—38. Ngừng các chất ửc chế CYP3A4 mạnh ít nhất 1 tưẳn trước khi bắt đằu
điều trị bằng irinotecan. Không đùng đồng thời cảc thuốc ức chế mạnh CYP3A4 hoặc UGTIAi
với irinotecan trừ khi không có phương pháp điều trị thay thế.
Thuốc chẹn lliẩii kinlt-cơ:
Không thể loại trừ sự tương tảo giữa irinotecan và thuốc chợn thần kinh cơ. Irinotccan có hoạt tính
ức chế cholỉnesterase vả có thể kéo dải tảo dụng ohẹn thần kinh—cơ của suxamethonium và có thế
đối khảng với các thuốc chẹn thần kinh cơ nhóm không khư cục.
Cetuximab:
Không có bằng chửng về tinh an toản của irinotecan bị ảnh hưởng bời cctuximab hoặc ngược lại.
Bevacizumab:
Trong một nghiên cứu, nồng độ irinotecan 181 tương tự ở bệnh nhãn dùng irinotecan/ 5-FU/ FA
hoặc kết hợp với bevacizumab. Nồng độ chất chuyển hóa có hoạt tinh cùa irinotecan (SN-38),
được phân tích trong một nghìên cứu (khoảng 30 bệnh nhân mỗi nhảnh điều trị). Nồng độ SN-38
trung bình ở bệnh nhân dùng irinotecan/ 5-FU1 FA kết hợp với bevacizumab cao hon 33% so với
những người chỉ dùng irinotecan/ 5—FU1 FA. Do có sự biến đổi giữa cảc bệnh nhân và giới hạn số
lượng mẫu, nên không chẳc chắn rằng SN-38 tăng lên do bevacizumab. Có một sự tăng nhẹ hiện
tượng tiêu chảy và giảm cảc trìệu chứng bất iợi bạch cầu. Giảm Iiều irinotecan được bảo cảo ớ
11hũng bệnh nhân dùng irinotecan/ 5-FU/ FA kết hợp với bevacizưmab.
Nhũng bệnh nhân bị tiêu chảy nặng, giảm bạch cầu hoặc giảm bạch cầu trung tinh khi kết hợp
bevacizumab vả irinotecan cần được điếu chinh liều irinotecan.
Thuốc chổng dông:
Việc sử dụng thuốc chống đông lả phổ biến do bệnh khối u lảm tăng nguy cơ các hiện tượng
huyết khối Nếu chỉ định thuốc chống đông mảu khảng vitamin K, cần phải t n n sưất theo dõi
iNR (chỉ số chuẩn quốc tế) do chí số điều t1ị hcp, sự biến đồi co dịa bệnh niiâhxnỵiiuyết khối vả
khả năng tuong tảo giữa thuốc chống đông đuờng uống và hóa trị liệu chống ưng
Vẳc xin:
Không được sử dụng đồng thời vắc xin sốt vảng với irinotecan vì có nguy cơ dẫn đến từ vong do
phản ứng vói vắc xin.
Không sử dụng đồng thời vẳc xin sống giảm độc lực (trừ sốt vảng) với irinotecan vi ngưy cơ mắc
bệnh hoặc tử vong (như do nhiễm trùng) có thể xảy ra. Nguy cơ nảy tăng lên ở những người đã bị
ức chế miễn dịch đo bệnh tiềm ẩn của hợ.
Có thế sử đụng vắc xin bắt hoạt trong những trường hợp nảy (ví dụ như vắc xin bại iiệt).
Pkenytoin:
Có nguy co co giật trầm trọng do sự giảm hấp thu đường tiêu hóa cùa phenytoin khi sử dụng
thuốc gây độc tế bâo hoặc tăng nguy cơ nhiễm độc do tăng chuyến hóa phenytoin tại gan.
11115
Ciclosporin, tacroiimus:
Cẩn cân nhắc khi sử dụng đồng thời irinotecan với oiclosporin hoặc tacrolimus đo ức chế miễn
dịch quá mức có thế dẫn đên nguy cơ tăng sinh hạch bạch huyết.
TÁC DỤNG KHÔNG MONG MUÔN
Các dữ liệu về tảo dụng không mong mưốn được thu thập từ nghiên cứu trên bệnh nhân ưng thu'
đại trục trảng di căn. Các tác dụng không mong muốn cho oác chỉ định khảo đự kiến sẽ tương tự
như với ung thư đại trực trảng.
Tác dụng không mong muốn thường gặp nhất (2 1/10) 1ả tiêu chảy khởi phát muộn (24 giờ sau
khi dùng thuốc) vả rối loạn máu bao gồm giảm bạch cẩu, thiếu máu vả giảm tiếu cầu.
Giảm bạch cầu trung tính là một tác dụng độc có giới hạn Iiều. Giảm bạch cầu trung tinh có thể
đảo ngược và không tích lũy; Thời gian xuất hỉện triệu chứng trung binh là 8 ngảy dù sử dụng dơn
trị hoặc iiệu phảp phối hợp.
Hội chứng cường phó giao cảm cấp tính nghiêm trỌng rẳt thường gặp dã được quan sảt. Các triệu
ohửng chính là tiêu chảy khới phát sớm và các triệu chứng khảo như đau bụng, đổ mồ hôi, ho vả
tăng tiết nước bọt xảy ra trong lúc truyền hoặc trong 24 giờ dần sau khi truyền irinotecan. Các
triệu chứng nây bìến mất sau khi dùng atropin (xem phần Cảo trường hợp thận trợng khi dùng
thuốc)
Đơn trị liệu
Các tảo đụng không mong muốn sau đây được xem là có hoặc có thề iiên quan đến việc dùng
irinotecan đã được báo cáo từ 765 bệnh nhân ở iiều khuyến cảo 350 mg/m2 trOng đơn trị iiệu.
Trong mỗi nhóm tần số, tảo dụng không mong muốn được trình bảy theo thứ tự giảm dẫn. Cảo tần
số được định nghĩa iả: rất phổ biến (2 1110), phổ biến (2 mon đến < 1110), ít gặp ta 111.000 đến
< 1/100), hiếm gặp (2 1110.000 đến < 1/1.000) vả rắt hiếm (< 1/10.000)
Tảo dụng không mong muốn khi sử dụng irinotecan đơn trị liệu (350 mg/mz cứ mỗi 3 tuần)
Hệ cơ quan Tần số Biểu hiện
Nhiễm trùng và ký sinh trùng Phổ biến Nhiễm trùng
Rối ioạn máu vả hệ bạch huyết Rắt phố bỉến Giảm bạch cầu trung tinh, thiếu mé…
Phổ biến Giảm tiều cầu, sốt giảm bạch cằn
Rối Ioạn chuyển hóa vả dinh dưỡng Rẩt phổ biến Chán ăn
Rối loạn hệ thần kinh Rất phổ biến Hội ohứng cường phó giao cảm
Rối loạn hệ tiêu hóa Rất phổ bỉển Tiêu chảy, buồn nôn vả nôn,` đau bụng
Phổ biến Táo bón \n\ )Ối Í...
Rối loạn da và mô đưới da Rất phổ biến Rụng tóc \ \' ỉịi/
Rối loạn chung và phản ứng tại vị trí Rất phố bìến Viếm niêm mạc, tăng thân in'iiột, suy
tỉêm nhược
Xét nghiệm Phổ biến Tăng creatinin máu, transaminase
(SGPT vả SGOT), bilirubin máu,
alkalin phOSphat máu
Liệu pháp phối hợp
Cảo tác dụng không mong muốn được nêu trong phần nảy liên quan đến irinotecan.
12115
Không có bằng chứng nảo về tinh an toản của irinotecan bị ảnh hưởng bởi cetuximab hoặc ngược
lại. Khi phối hợp với cetuximab, cảc tác dụng không mong muốn được bảo các thêm iả nhũng
phản ứng với cetuxìmab (như 88% xuất hiện mụn trứng oá). Để bìết thông tin về tác dụng không
mong muốn của irinotecan kết hợp với cetưximab, cũng có thể tham khác tóm tắt đặc tinh sản
phẩm của cetuximab.
Khi phối hợp vởi capccitabin, các tác dụng không mong muốn được bảo các thêm hoặc có mức
tẩn số cao hơn so với đơn trị iiệu oapecitabin bao gồm: tắc mạchlhuyết khối (rất phổ biến); phản
ứng quả mẫn, thiếu máu cục bộ] nhồi mảu cơ tim, sốt giảm bạoh cầu độ 3 và 4 (phổ biến)
Cảc tác dụng không mong muốn độ 3 và 4 ở nhũng bệnh nhân điều trị với capccitabin kết hợp với
irinotecan vả bevacizưmab so với khi dùng đơn trị iiệu capecitabin hoặc có tẩn số cao hon bao
gồm: giảm bạch cầu, tắc mạch/huyết khối, tăng huyết ảp, thiếu máu cục bộ/ nhồi máu cơ tim (phổ
biến). Tham khảo tóm tắt đặc tính sản phẫm cùa capecitabin đề có đẩy đủ thông tin về tác dụng
không mong muốn của oapecitabin vả bevacizumab.
Cao huyết áp cấp 3 lá nguy cơ đáng kể liên quan đến việc bổ sung bevacizumab vảo liệu pháp
phối hợp irinotecan/ 5-FU/ FA. Ngoài ra, tiêu chảy vả gỉảm bạch cầu cũng tăng iên mửc 3 hoặc 4
ở những bệnh nhãn nảy so với những bệnh nhân dùng iiệu pháp irinotecan1 5-FU/ FA.
irinotecan đã được nghiến cứu kết hợp với 5—F U và FA cho ung thư đại trực trảng di căn.
Các đũ' liệu về an toản khi nghiên cứu liệu phản phối hợp irinotecan với 5—FU/FA ở bệnh nhân
ung thư đại trực trảng di cãn cho thấy các phản ứng bất iợi độ 3 hoặc 4 rất phổ biến iả rối ioạn
mảu vả hệ bạch huyết, rỗi ioạn tiêu hóa, rối loạn mô dưới da.
Các tảo dụng không mong muốn sau dây được xem là có hoặc oó thể liên quan đến việc dùng
irinotecan trong liệu pháp phối họp với 5-FU/FA với liếư khuyến oáo 180 mglm2 cứ mỗi 2 tuần
được báo cáo từ 145 bệnh nhân.
Tác dụng không mong muốn khi sử dụng irinotecan trong liệu pháp phối hợp (180
mg]…2 cứ mỗi 2 tuẩn)
I-Iệ cơ quan Tẫn số Biến hiện
Nhiễm trùng vảkỷ sinh trùng Phổ biến Nhiễm trùng
Rối loạn mảu và hệ bạoh huyết Rất phổ biến Giảm bạch cầu trung tính, giảm tiếu
câu, thiêu mảu
Phổ biến Sốt giảm bạch cẩu
Rối ioạn chuyển hóa và dinh dưỡng Rất phổ biến Chản ăn
Rối loạn hệ thần kinh Rẩt phổ bỉến Hội chứng cường phó giao cảm
Rối loạn hệ tiêu hờa Rất phổ biến Tiêu chảy, buồn nôn vả nộn /
Phổ biến Đau bụng, táo bón C\\Kì /
Rối loạn da Vả mô dưới da Rẫt phổ biến Rụng tớc \,V
Rối loạn chung và phản ứng tại vị trí Rẳt phổ biến Viêm niêm mạc, sưy nhược
tỉêm Phổ biến Tăng thân nhiệt
Xét nghiệm Rất phổ biến Tăng transaminase (SGPT vả SGOT),
bilirubin máu, alkaiin phosphat máu
Các nghiên cứu khác
Cảo tảo dụng không mong muốn liên quan đến thuốc đã được báo cảo trong cảc nghiên cứu lâm
sảng khảo của irinotecan như: đau, nhiễm khuẩn hưyết, rối loạn trực trảng, viêm ãm đạo, hạ huyết
13115
áp, phát bnn, phản ứng trên da, dảng đi bắt thường, lù 1ẫn, nhức đẩu, ngắt, đỏ bừng, nhịp tim
chậm, nhiễm trùng đường tiếu, đau
thẳt ngực, tăng GGTP, giẫm phế quản, vả hội chứng 1y giải
khôi u, rôi loạn tim mạch (đau thắt ngực, ngừng tim, nhồi máu cơ tim, thiếu máu cơ tim, rối Ioạn
mạch mảu ngoại vi, rối loạn mạch máu), huyết khối động mạch, nhồi máu não, tai biến mạch máu
não, viêm tinh mạch huyết khối, đột từ. . .)
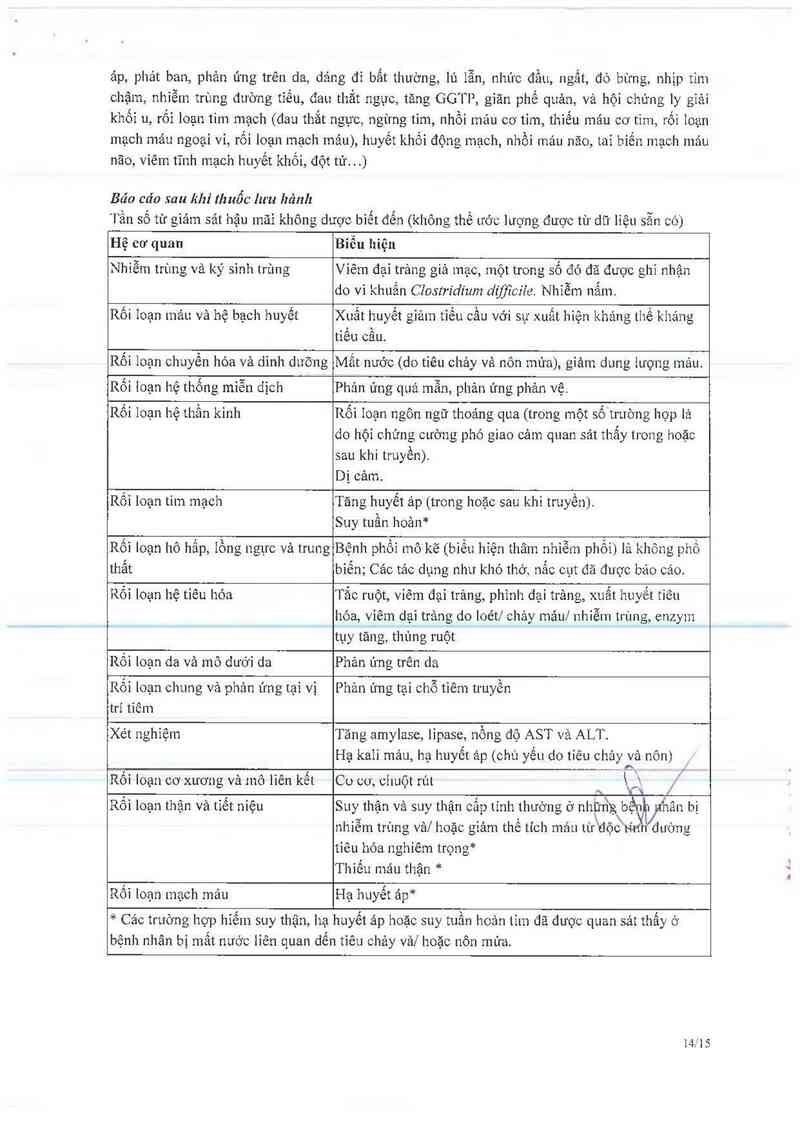
Báo cáo sau khi thuốc lưu hảnh
Tần số từ gỉảm sảt hậu măi không dược biết đến (không thể ước lượng được tư dữ liệu sẵn có)
Hệ cơ quan
Biêu hiện
Nhiễm trùng và ký sinh trùng
Viêm đại trảng giả mạc, một trong số đó đã được ghi nhận
do vi khuấn Clostríđium d1fflcile. Nhiễm nắm.
Rối Ioạn máu và hệ bạch huyết
Xuât huyết giảm tiêu câu với sự xuât hiện kháng thể kháng
tiếu câu.
Rôi lcạn chuyến hóa và dinh dưỡng
Mât nước (do tiêu chảy và nôn mùn), giảm dung 1ượng máu.
Rối ioạn hệ thống miễn dịch
Phản ứng quá mẫn, phản ửng phản vệ.
Rối loạn hệ thẩn kinh
Rối ioạn ngôn ngữ thoáng qua (trong một số trường hợp lả
do hội chứng cường phó giao cảm quan sảt thẩy trOng hoặc
sau khi trưyền).
Dị cảm.
Rối loạn tim mạch
Tãng huyết ảp (trong hoặc sau khi truyền).
Suy tuần hoản*
Rối loạn hô hấp, iồng ngực vả trung
thẳt
Bệnh phồi mô kẽ (biền hiện thâm nhiễm phồi) 16 không phổ
biến; Ca’c tác dụng như khó thớ, nấc oụt đă được báo cáo.
Rối loạn hệ tiêu hóa
Tắc ruột, viêm đại trảng, phình đại trảng, xuất huyết tiêu
hóa, viêm đại trâng do loét1 chảy mául nhiễm trùng, enzym
tụy tăng, thủng ruột
Rối Ioạn da và mô dưới da
Phản ứng trên da
Rôi loạn chưng và phản ửng tại vị
trí tỉêm
Phản ửng tại chỗ tiêm truyền
Xét nghiệm
Tăng amylase, lipase, nổng độ AST vả ALT.
Hạ kali mảu, hạ huyết ảp (chủ yếu do tiêu chảy và nôn)
Rối loạn cơ xương và mô liếư kết
3
Co co' chuôt rút .
’ ' \ VÌ Í
Rối loạn thận và tiết niệu
Suy thận vả suy thận cấp tinh thường ở nhữrig bềnh nhân bị
nhiễm trùng vảl hoặc giảm thế tich máu từ đỘàtitđ 'đường
tiêu hóa nghiêm trọng*
Thiếu mảu thận *
Rôi Ioạn mạch máu
Hạ huyết áp*
* Các trường họp hiếm suy thận, hạ huyết áp hoặc suy tuần hoản tim đã được quan sảt thắy ở
bệnh nhân bị mất nước iiên quan dến tiếu chảy vả/ hoặc nôn mừa.
14115
4.
QUÁ LIÊU VÀ CÁCH XỬ TRÍ
Đã có bảo các của quá liều ờ iiều khoảng gấp đôi liều điểu trị được khuyến cáo, có thể gây tử
vong. Cảo tảo dụng bất iợi quan trọng nhất được báo cáo 1ả giảm bạch cầu nặng và tiêu chảy nặng.
Không có thưốc giải độc đặc hiệu khi quá liều. Điều trị hỗ trợ cần phải được thực hiện nhằm
phòng ngừa mất nước do tiêu chảy và trị liệu các biến chứng nhiễm trùng.
xử LÝ vÀ LOẠI BÒ SAU KHI SỬ DỤNG
Irỉnotecan iả một thuốc kháng ung thư mạnh. Cần phải tuân theo các qui trình thao tảo chuẩn cho
các ioại thuốc trị ung thư.
0 Chi những đối tượng thảnh thạo trong xử 1ý và loại bỏ sau sử dụng mới được thao tác trên
Irinotecan. Cần mang găng tay khi thao tác.
0 Trong trường hợp irinotecan tiếp xúc với da, niêm mạc, phải rửa vùng da hoặc niêm mạc đó
bằng xả phòng và nước.
0 Sử dụng dung dịch NaOH 10% đề trung hòa nếu thuốc bị đổ ra ngoải.
BẢO QUÁN
Bảo quản ở nhỉệt độ dưới 30°C. Tránh ánh sáng. Không đông lạnh.
Cần giữ lọ thuốc trong hộp cho đến khi sử dụng. Độ ổn định về lý hóa có thể duy tri trong 24 giờ
ở nhiệt độ phòng và dưới ánh sáng huỳnh quang sau khi hoản nguyên. Dung dịch thuốc đã pha
trong Glucose 5% nếu bảo quản trong tủ lạnh (2- 8°C), trảnh ảnh sảng có thể ổn định trong 48 giờ
Có thế sử dụng dung dịch IRINOTEL trong vòng 6 giờ sau khi pha chế nếlư bảo quản ỏ_mhiệt độ
phòng Trảnh đông đã IRINOTEL hoặc dung dịch đã pha vì có thể gây kếtịtiịa hông bảo
quản thuốc đã pha chế bằng dung dịch NaCl 0,9% trong tủ lạnh. Không khuyếnNzu o ộn thuốc vởi
các thuốc khảo. Cần quan sát để phát hiện thuốc đồi mảu hoặc cặn nếu có trước khi sử dụng.
HẠN DÙNG
24 thảng kế từ ngảy sản xuất.
Nhà sản xuất: FRESENIUS KABI ONCOLOGY LIMITED
Địa chi: Village Kishanpura, Baddi, Tehsii Nalagarh, District Solan, Hỉmachal Pradesh, iN-
114101, Án Độ
TUQ.CỤc TRUỚNG
RTRLỦNG PHÒNG
ẩõẩũ’m % lVaễ'n ấfĩaxnÁ 15/15
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng