


















LtJf/ưo —
BỘ Y TẾ
cth QUẦN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
Lẩn đauoíéig/Jfgl
l*…mùurm veovmmom
’bH M
' ""ộ …… Pharmacodezõõ llllll
m.mou
Bmìlle: NO
736085
le IM… 0NKOVIS IM Embassing: NO
5MI. VIA'I VN
Materla/ quality: GQ
35x37x85m
Colours: Block 2
Pantone 3 75C MMGI WPlght 270 9lm
Pantone 7 536C
Gmss welght ofthe box:
vamìsh free Dlspersion vamish
ỉ Irinotecan
? onkovus
20 mg/ml
lrinote_can
onkovus
100mg
w…aử…
35137l85
WVNI
onkovis
20 mglml
Dung dich đậm đặc để
Pha dich truyền tĩnh mạch
Conoentrateforsdution
forinfusion ..
1ml ohứa 20 mg lrinotemn 8'
hydrodũoưide 3H20
100 mg! 5 ml
lbựFllllưủlhnffl-Hc
WilGưlpùủffl—Ul
SóiôSX/Batch
NSX/ Mfg. date.
HD | Exp. date:
| , L'ỊỊ
Q“ . 7*
ĩ mcnumtnnử m *
°, BIN
_
T CỎNG TY
Irinotecan onkovis 20 mg/ml
Thuốc nâyh dùng theo đơn thuốc
Để xa lầm tay trẻ em
Đọc kỹ hướng dẫn sử dụng trưởc khi dùng
Nếu cần Ihêm thông tin, xin hõiý kiến bảc sỹ
Thông báo cho bác sỹ về các tảc dụng không mong muốn gặp phải khi sử dụng thuốc
, c S.DJ..
TÊN THUỐC
Irinotecan onkovis 20 mng
THÀNH PHÂN CÔNG THỬC THUỐC
Một lọ 5 ml có chứa:
Thảnh phần hoạt chất: 100 mg Irinotecan hydrochloride trihydrate tương đương 86,65 mg Irinotecan
Thảnh phần tả dược: vừa đủ 5 ml (xem thêm mục Danh mục tá dược)
DẠNG BÀO CHẾ
Dung dịch đậm đặc để pha dich truyền tĩnh mạch.
Dung dịch trong suốt, mảu vảng nhạt có pH 3,5 và ảp suất thẩm thấu 305 mOsmol/kg.
cui ĐỊNH ~
Irinotecan onkovis được chỉ định điều trị cho cảc bệnh nhân ung thư đại trực trảng tiển triển:
— Dùng phối hợp vởi S-Fluorouracil vả acid folinic cho cảc bệnh nhân ung thư đại trực trâng tiến
triển chưa được hóa trị liệu trước đó.
- Dùng đơn dộc cho cảc bệnh nhân ung thư đại trực trảng tiểu triến diều trị với 5-Fluorouracil bị
thất bại.
Irinotecan onkovis phối hợp với cetuximab được chỉ định điều trị ung thư đại trực trảng di căn với gen
Kras wild-typc, có biếu hiện cùa thụ thế yếu tố tãng sinh biền bì (EGFR) chưa được điều trị g thư di
căn trước đó hoặc sau khi thất bại với liệu pháp thuốc gây độc tế bảo chứa Irinotech
Irinotecan onkovis phối hợp với 5—Fluorouracil, acid folinic vả bevacizumab được chỉ ịnh điều trị
đầu tay cho cảc bệnh nhân ung thư biểu mô đại trực trảng di căn.
Irinotecan onkovis phối hợp với capccitacin, có hoặc không có bevacizumab để điều trị đầu tay cho
bệnh nhân ung thư biếu mô đại trực trâng di căn.
cÁcư DÙNG, LIÊU DÙNG
Chỉ dùng cho người lớn.
Irinotecan onkovis nên pha loãng và truyền tĩnh mạch ngoại vi hoặc tĩnh mạch trung tâm.
Liều khuỵến cáo
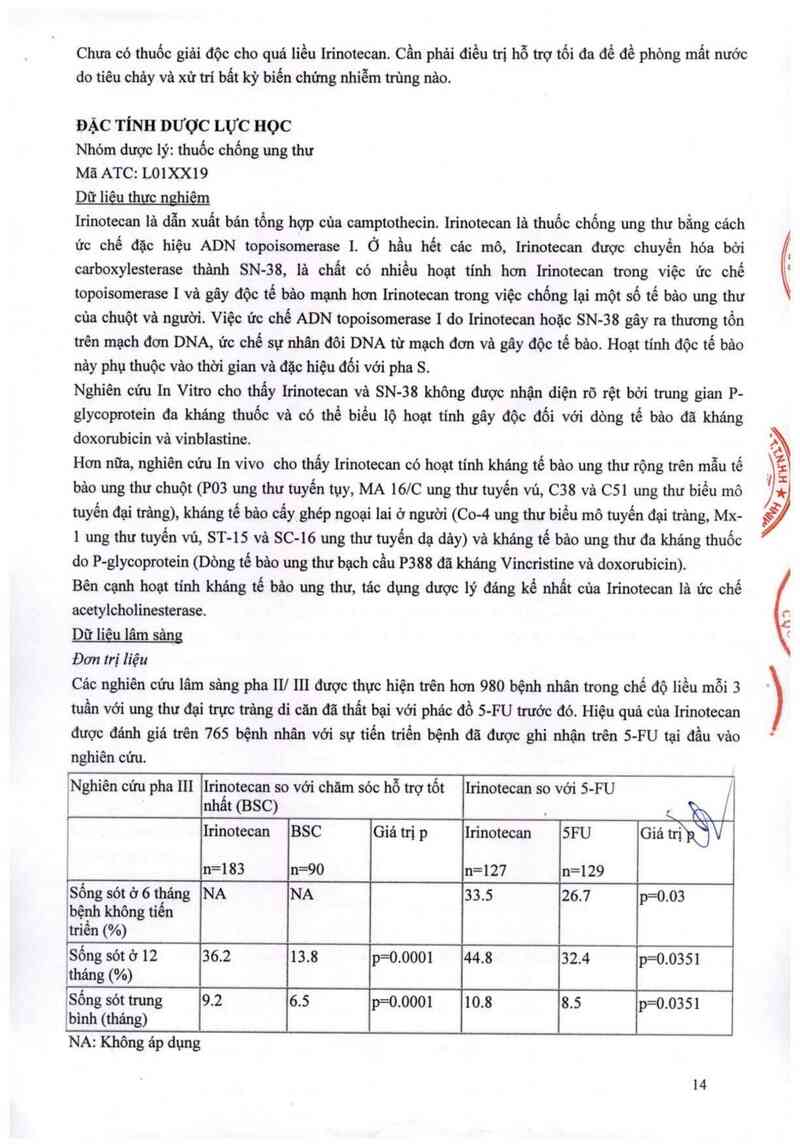
Liệu pháp đơn Irị liều (đối với bệnh nhân đã điều trị Irước đó):
Liều khuyến cáo của Irinotecan onkovis 350 mg/m2 tiêm truyền tĩnh mạch trong 30-90 phủt mỗi 3
tuần (xem mục Cănh báo vã thận trọng khi dùng thuốc và Thận !rọng đăc biệt khi Ioại bo' vả xử lý
ihuốc).
Liệu pháp dùngphối họp (đối vởi bệnh nhân chưa điều trị trước đó):
- Irinotecan onkovis phối hợp với 5-fiuorouracil vả acid folinic
Irinotecan onkovis phối hợp với S-fiuorouracil (S-FU) vả acid folinic đã được chứng minh an toản
và hiệu quả khi dùng theo thời gian biểu (mục Đăc tính dược lực học): Irinotecan phối hợp với
SFU/FA thời gian biếu mỗi 2 tuầh. Liều khuyến cảo của Irinotecan onkovis là 180 ngm² truyền
tĩnh mạch trong khoảng 30-90 phủt mỗi 2 tuần, sau đó truyền acid folinic vả 5-fiuorouracil.
- Irinotccan onkovis phối hợp với cetuximab
Liều lượng và cảch dùng cùng với cetuximab: tham khảo thông tin sản phẩm của cetuximab.
Thông thường, với cùng một liều như Irinotecan, cetuximab được dùng vảo hai đợt điều trị cuối
cùng cùa phảc đồ Irinotecan trước đó. Không truyền Irinotecan onkovis sởm hơn 1 giờ sau khi kết
thủc truyền cetuximab.
- Irinotecan onkovis phối hợp với bevacizumab
Liều lượng và cách dùng của bevacizumab theo tóm tắt đặc tính sản phẩm cùa bevacizumab.
- Irinotecan onkovis phối hợp với capecitabin
Liều lượng và cách dùng của capecitabin theo tóm tắt đặc tính sản phấm cùa capecitabin.
Điều chỉnh liều
Irinotecan onkovis chỉ nên dùng sau khi hầu hết các tác dụng bất lợi được giải quyết tới độ 0 hoặc 1
NCI—CTC (căn cứ theo tiêu chuẩn độc tính chung của viện ung thư quốc gia) và khi việc tiêu chảy
liên quan đển điều trị dã được giải quyết hoản toản.
Nên giảm liều kể tiếp của Irinotecan onkovis vả 5-FU nếu đợt điều trị trước đó xuất hiện các tảc dụng
không mong muốn độ nặng. Nên ngừng điều trị 1-2 tuần để giải quyết các tảc dụng phụ do dùng
thuốc.
Nếu cảc tảc dụng không mong muốn sau xuất hiện, cần giảm 15-20% lìều Irinotecan onkovis vả/hoặc
5-FU:
- Độc tính huyết học (giảm bạch cầu trung tính dộ 4, sốt giảm bạch cầu trung tỉnh (giảm bạch cầu
trung tính aộ 34 và sốt độ 2—4), giảm tiểu cầu và bạch cầu (dộ 4).
- Độc tính không thuộc hệ máu (độ 3-4)
Liều đề nghị hiệu chinh của Cetuximab khi phối hợp với Irinotecan onkovis được tuân thềềtếng tin
sản phấm cùa Cetuximab.
Liều dề nghị hỉệu chỉnh cùa bevacizumab khi phối hợp với Irinotecan/S-FU/FA theo tóm tắt đặc tính
sản phấm của bevacizumab.
Liều đề nghi hiệu chỉnh của capecitabin khi phối hợp với Irinotecan theo tóm tắt đặc tính sản phẩm
của capecitabin.
Thời gian điều trị
Điều trị với Irinotecan onkovis được tiếp tục cho đến khi bệnh tiến triền khách quan hoặc không chịu
nổi dộc tinh thuốc.
Cảc trường hgp đăc biệt
Bệnh nhân suy giám chức năng gan
P* n\ Ổ.\
J
|»)…
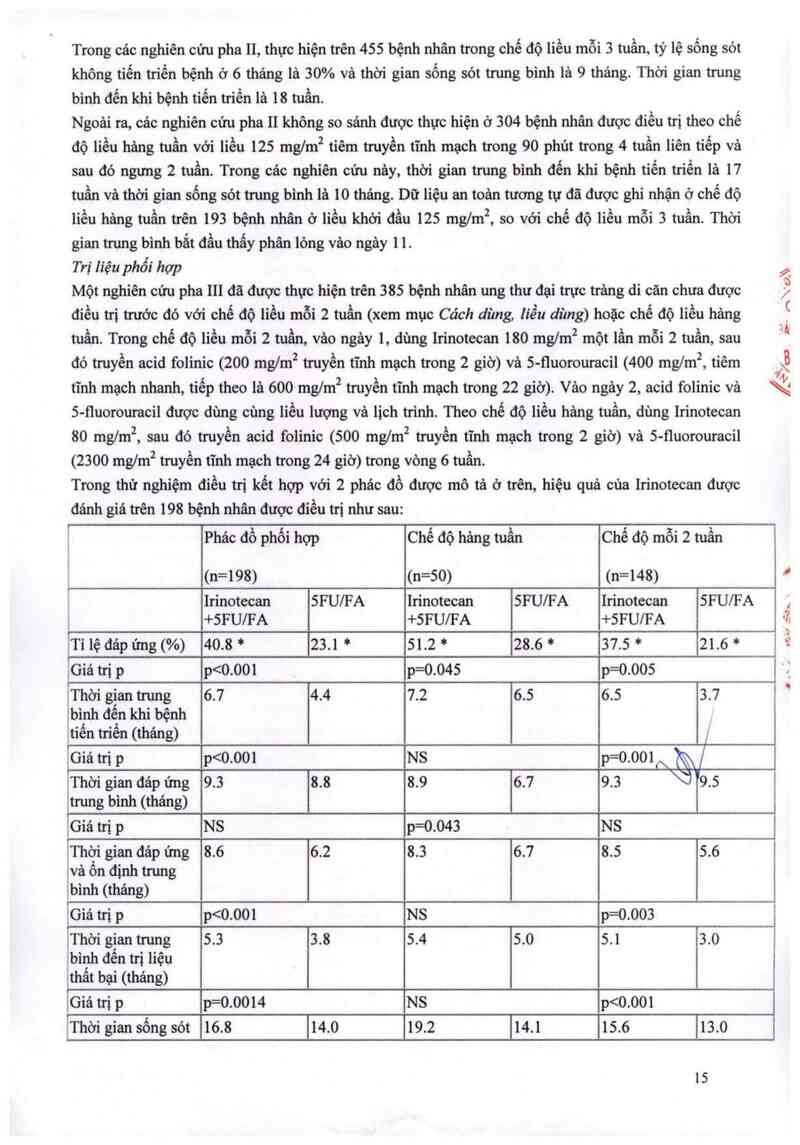
Đơn tri
Với cảc bệnh nhân có chỉ số toản trạng theo WHO 52, mức bỉlirubin mảu tối đa gấp 3 lần giởi hạn
trên của mửc bình thường (UNL) cần xảc định liều khời đầu của Irinotecan. Ở những bệnh nhân nảy,
chứng tăng bilirubin huyết và thời gian protiưombin lớn hơn 50%, độ thanh thải của Irinotecan giảm
(xem mục Đăc lính dược động học) và sẽ gây tăng nguy cơ dộc tính huyết học. Do đó, nên kiếm tra
công thức máu của các bệnh nhân nảy hảng tuần.
- Cảc bệnh nhân có mức bilirubin đển 1,5 lần giới hạn trên cùa mức bình thường (ULm, liều đề
nghị cùa Itinotecan onkovis là 350 ngm².
- Cảc bệnh nhân có mức bilirubin nằm trong khoảng 1,5 đến 3 lần giới hạn trên của mức bình
thường, liều đề nghị của Irinotecan onkovis là 200 mglm².
- Các bệnh nhân có mức bilirubin cao hơn 3 lần giới hạn trên cùa mức bình thường không nên diều
trị với Irinotecan onkovis (xem mục Chống chi đinh và Cánh báo vả thận trọng khi dùng thuốc).
Chưa có thông tin nghiên cứu trên cảc bệnh nhân suy gan điều trị vởi Irinotecan onkovis theo liệu
pháp phối hợp.
Bệnh nhăn suy giám chức năng rhận
Irinotecan onkovis không được khuyên dùng cho các bệnh nhân bị suy thận vì chưa có nghỉên cứu
chính thức dược tiến hảnh (xem mục Cánh băo vả Ihận trọng khi dùng thuốc và Đặc tính dược động
học).
Trẻ em
Irinotccan onkovis không nên dùng cho trẻ em.
Người cao tuổi
Chưa có nghiên cửu dược động học cụ thể được tiến hânh trên người cao tuổi. Tuy nhiên nên lựa
chọn liều cẩn thận do nhóm bệnh nhân nảy thường có chức năng sinh lý bị suy giảm. Nhóm bệnh
nhân nảy nên được giảm sát một cảch chặt chẽ.
CHỐNG CHỈ ĐỊNH
— Bệnh nhân có tiền sử phản ứng quả mẫn nghiêm trọng với Irinotecan hydrochloride trihydrate
hoặc một trong cảc thảnh phần của thuốc.
- Viêm ruột mạn tính vả/hoặc tắc ruột (xem mục C ánh báo vờ thận trọng khi dùng !huốc).
- Cho con bú (mục Sử dụng thuốc cho phụ nữ có thai vã cho con bú). '
- Bilirubin cao hơn 3 lần giới hạn trên của mức bình thường (xem mục Cách dùng, Iiếẳế va
Cánh báo và thận trọng khi dùng thuốc)
- Suy tùy nặng
- Chỉ số toản trạng theo WHO ›2
- Phối hợp với St John’s Wort (xem mục Tương tác với các thuốc khác vã các dạng tương tác khác)
Chống chỉ dịnh khi phối hợp với Cetuximab hoặc bevacizumab hoặc capecitabin theo thông tin sản
phẩm cùa các thuốc nảy.
CẢNH BÁO VÀ THẬN TRỌNG KHI DÙNG THUỐC
Chỉ được sử dụng Irinotecan tại cảc cơ sở chuyên về hóa tri liệu bằng thuốc gây độc tế bâo và
dưới sự giám sát của các thầy thuốc hoá trị liệu ung thư có kinh nghiệm.
Do bản chất và tần suất cùa các tảc dụng không mong muốn, chỉ nên kê đơn Irinotecan onkovis sau
khi cân nhắc cẩn thận lợi ích và nguy co khi điều trị những trường hợp sau:
- Bệnh nhân có yếu tố nguy cơ, đặc biệt là bệnh nhân có chỉ số toản trạng theo wno=z.
- Trong một số trường hợp hiếm gặp, khi thấy bệnh nhân không tuân thủ cảc khuyến cảo liên quan
đến kiềm soát tác dụng không mong muốn (cần điều trị chổng tiêu chảy tức thời và kéo dải kết
hợp với uống nhiều nước khi bắt đầu tiêu chảy muộn), những bệnh nhân nảy cần phải giảm sảt
chặt chẽ tại bệnh viện.
Khi sử dụng đơn trị Irinotecan onkovis phải luôn kê đơn theo phảc dỗ mỗi 3 tuần. Tuy nhiên có thể
xem xét phảc đồ mỗi tuần (xem mục Đăc tính dược lực học) cho những bệnh nhân cẩn theo dõi cấn
thận hoặc bệnh nhân có nguy cơ giảm bạch cầu trung tính thể nặng.
Tiêu chảỵ muộn
Bệnh nhân cẩn nhận thức nguy cơ tiêu chảy muộn xuất hiện sau 24 giờ truyền Irinotecan onkovis và
bất kỳ thời điểm nảo trước đợt điều tti kế tiếp.
Trong liệu phảp đơn trị liều, thời gian trung bình xuất hiện phân lòng đầu tiên vảo ngảy thứ 5 sau khi
truyền Irinotecan onkovis. Bệnh nhân cần báo ngay cho thầy thuốc và cần được diều trị kịp thời.
Những bệnh nhân có nguy cơ tiêu chảy cao là những bệnh nhân trước đó đã điều trị tia xạ vùng bụng,
xương chậu, bệnh nhân có chứng tăng bạch cầu, bệnh nhân có chỉ số toản trạng theo WHO 22 và phụ
nữ. Nếu không được xử trí thich hợp, tiêu chảy có thể đe dọa tính mạng, đặc biệt với những bệnh
nhân đồng thời bị giảm bạch cầu trung tinh.
Ngay khi bị tiêu chảy phân iớng đầu tiên, bệnh nhân cần uống thật nhiều nước có chất điện giải và kịp
thời sử dụng phương phảp điều trị tiêu chảy thích hợp. Cần điểu trị tiêu chảy ngay tại nơi sử dụng
Irinotecan onkovis. Sau khi ra viện, bệnh nhân cần được kê đơn thuốc để có thể điều trị ngay nếu bị
tiêu chảy. Bệnh nhân cần thông báo cho thầy thuốc hoặc nơi sử dụng Irinotecan onkovis nếu xuất hiện
tiêu chảy.
Phác đồ điều trị tiêu chảy hiện nay hay dùng có chứa loperamide liều cao (4 mg liều khởi đầu, sau đó
2 mg mỗi 2 giờ). Cần duy trì điều trị cho tới 12 giờ sau khi bị tiêu chảy lần cuối và không được điều
chỉnh liều. Không được sử dụng liều loperamide như trên kéo dải trên 48 giờ liên tiếp do nguy cơ liệt
ruột, và không được dưới 12 giờ.
Ngoài điều tử tiêu chảy cần phải điều tn dự phòng bằng khảng sinh phố rộng khi tiêu chảy có kèm
theo giảm bạch cầu trung tính thể nặng (số lượng bạch cầu trung tính dưới 500 tế bảolmm3 )
Ngoài việc điều m“ kháng sinh, cần cho bệnh nhân nhập viện để kiểm soát tiêu chảy tron g
trường hợp sau:
- Tiêu chảy kèm sốt
- Tiêu chảy nặng (cần phải truyền nước)
- Tiêu chảy trên 48 giờ sau khi khời đầu điều trị bằng loperamide liều cao.
Không nên điều trị dự phòng với loperamide, ngay cả với những bệnh nhân đã bị tiêu chảy muộn sau
đợt diều tti trước.
Đối với những bệnh nhân bị tiêu chảy nặng cần giảm liều ớ đợt điểu tti kế tiếp (xem mục Cách dùng,
Iiều dùng).
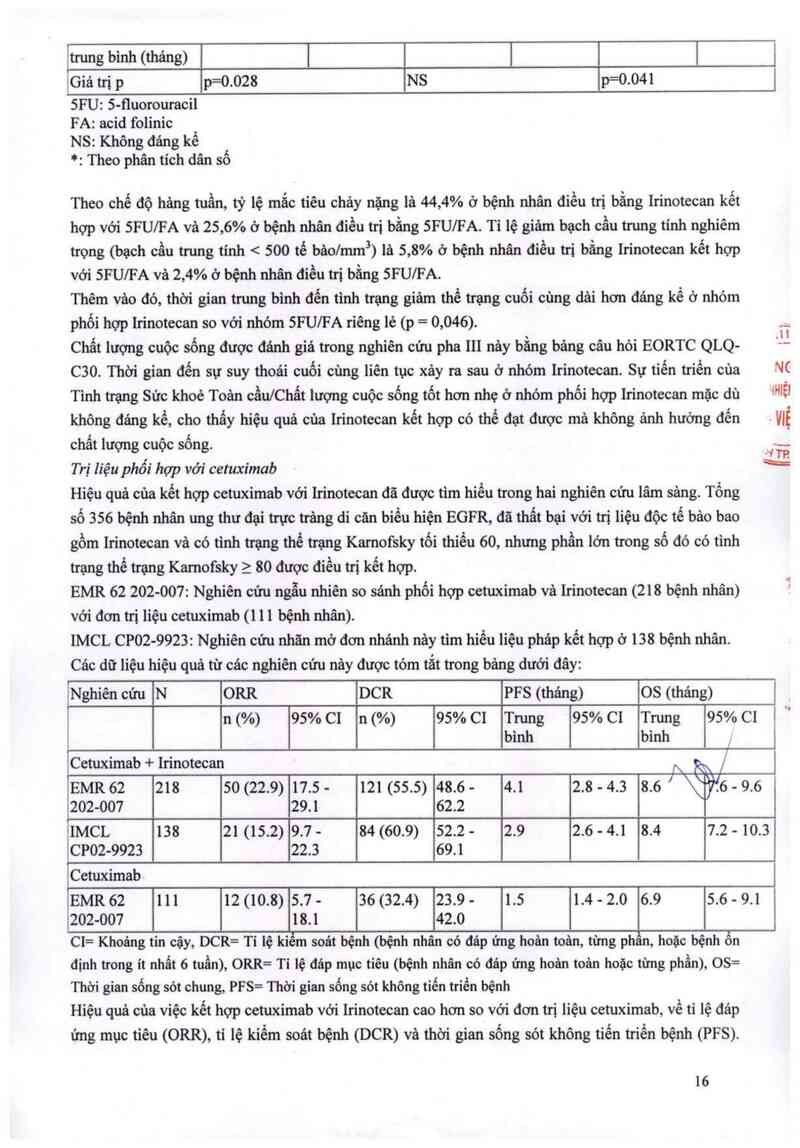
Huỵết hgc
..
| _
Iẫi £ả…:i
Trong khi điều trị với Irinotecan onkovis cần theo dõi công thức máu hảng tuần. Bệnh nhân cần nhận
thức nguy cơ giảm bạch cầu trung tính và tẩm quan trọng của sốt. Sốt do giảm bạch cầu trung tính
(nhiệt độ trên 38°C và số lượng bạch cầu trung tính là 1000 Jmm² và thấp hơn) cần được điều trị khẩn
cấp tại bệnh viện bằng cảch tiêm truyền tĩnh mạch với kháng sinh phố rộng.
Đối với bệnh nhân xảy ra độc tính huyết học thể nặng, cần phải giảm liều trong lần điều trị kế tiếp
(xem mục Cách dùng, liều dùng).
Nguy cơ nhiễm trùng và độc tính huyết học gỉa tăng ở những bệnh nhân bị tiêu chảy nặng. Những
bệnh nhân nây cần được theo dõi công thức máu.
Phản ứng thoát mgch
Trong khi Irinotecan không được biết gây sưng tấy, cần chăm sóc đế trảnh thoảt mạch và vị trí truyền
nên được theo dõi cảc dấu hiệu viêm. Khi thoảt mạch xảy ra, nên rửa vả chườm đá tại chỗ.
ẶLt.rj
Bệnh nhân trước đó đã được xạ trị vùng chậu/ bụng bị tăng nguy cơ suy tủy sau khi tiêm Irinotecan.
Các bác sĩ nên sử dụng thận trọng khi điều trị cho bệnh nhân đã có xạ trị phạm vi rộng (ví dụ > 25%
cùa tùy xương đã được chiếu xạ và trong vòng 6 tuần trước khi bắt đầu điểu trị với Irinotecan). Có thể
điều chỉnh liều cho nhóm đối tượng nảy (xem phần Cách dùng, Iíều dùng).
Rối loan trên tim
Thiếu máu cục bộ cơ tim đã được quan sảt thấy sau khi điều trị với Irỉnotecan chủ yếu ở những bệnh
nhân đã có bệnh tim, những yếu tố nguy cơ khảc của bệnh tim, hay hóa trị liệu độc tế bảo trước đó.
Do đó, những bệnh nhân có các yểu tố nguy cơ đã biết cần được theo dõi chặt chẽ, và cần có biện
phảp để cố gắng giảm thiểu tất cả cảc yểu tố nguy cơ có thể điều chinh (ví dụ như hút thuốc lá, tăng
huyết ảp, và tăng lipid huyết).
Rối log mạch
Irỉnotecan hiểm khi liên quan đến các sự cố huyết khối tắc mạch (thuyên tắc phổi, huyết khối tĩnh
mạch vả huyết khối thuyên tắc động mạch) ở những bệnh nhân có nhiều yếu tố nguy cơ, thêm vâo các
khối u sẵn có.
Tảc dgng ức chế miễn dịch[ tăng nhạỵ cảm với nhiễm trùng
Sử dụng vacxin sống hay vacxin sống giảm độc lực ở những bệnh nhân suy giảm miễn dịch do các tảc
nhân hóa trị bao gồm Irinotecan, có thể dẫn đến nhiễm trùng nghiêm trọng hoặc tử vong. " t '
tiêm chùng với vacxin sống ở bệnh nhân sử dụng Irinotecan. Vacxin đã chết hoặc bất hoạt 0 ược
sử dụng; tuy nhiên, đảp ứng với những vacxin nảy có thể bị giảm bớt.
Quá mẫn
Phản ứng quả mẫn bao gồm phản ímg phản vệ hoặc phản ứng giống phản vệ nặng đã được quan sát
thấy. Ngưng thuốc nếu phản ứng phản vệ xây ra.
nộc tính cùa phảc đồ 5 ngảỵ
Nằm ngoải phạm vi nghiên cứu lâm sảng được thiết kế tốt, Irinotecan không nên được sư dụng kết
hợp với một phảc oộ S-FU/FA dùng trong 4-5 ngảy liên tục mỗi 4 tuần bới vì cảc bảo cảo về tăng độc
tính bao gồm độc tính gây tử vong. Nên sử dụng theo khuyến cáo trong phần điều chinh liều, mục
C ách dùng, liều dùng.
Tăng ớộc tính trên bẹnh nhân ở thể trang mức dộ z
Ở những bệnh nhân sử dụng IrinotecanlS-FU/FA hoặc 5-FU/FA trong cảc thử nghiệm lâm sảng, tỉ iệ
cao hơn về nhập viện, sốt do giảm bạch cầu, huyết khối tắc mạch, ngưng điều trị ở chu kỳ đầu tiên, và
tử vong sớm được quan sảt thấy ở bệnh nhân có thể trạng mức độ 2 so với bệnh nhân có thể trạng
mức độ 0 hoặc 1.
Suỵ gan
Các xét nghiệm chức năng gan cơ bản cần được thực hiện trước và khi khời đầu mỗi kỳ điều tn.
Cần kiếm tra công thức máu hảng tuần ớ bệnh nhân suy giảm chức năng gan có mức bilirubin nằm
trong khoảng từ 1,5 đến 3 lần so với giới hạn trên cùa mức binh thường (ULN) do giảm độ thanh thải
Irinotecan (xem mục Đăc tính dược động học) và do đó lảm tãng ngưy cơ độc tính huyết học ở những
bệnh nhân nảy. Bệnh nhân có mức bilirubin vượt quá 3 lần so với ULN không nên điều trị với
Irinotecan (xem mục Chống chi đinh).
Bệnh nhân gịảm hoạt tính uridine dighosphate glucuronosỵltransferase ịUGTị
Enzyme uridine diphosphate glucuronosylưansferase IA] (UGTIAI) bất hoạt chất chuyển hóa có
hoạt tính cùa Irinotecan SN-38 thảnh SN-3 8-glucuronide (SN-38G) không hoạt tính bằng con đường
glucuronyl hóa. Hoạt tính cùa UGTIAI bị giảm trên cả thể có kiều đa hình UGTIAI *28 hoặc thiếu
hụt bấm sinh UGTIAI (hội chứng Crigler—Najjar dạng ] và dạng 2).
Dữ liệu từ phân tích Meta (Meta analysis) cho thấy cảc cả thế có đồng hợp tử với alen UGTIAI *28
có nguy cơ cao về độc tính huyết học (độ III—IV) khi dùng Irinotccan onkovis liều trung bình hoặc liều
cao (>150 mg/m2). Không thể loại trừ mối quan hệ giữa kiểu gen UGTIAI và tiêu chảy xảy ra do
dùng Irinotecan onkovis.
Nếu dùng Irinotecan onkovis trên cảc bệnh nhân được biết có đồng hợp từ kiếu đa hình UGTIAI *28
nên áp dụng liều bắt đầu thông thường. Tuy nhiên, căn cứ vảo mối liên quan giữa kiếu gen và độc tính
huyết học, nên giảm sát chặt chẽ độc tinh huyết học ở cảc cá thế có đồng hợp từ UGTIAI *28. Trường
hợp độc tính huyết học trầm trọng xảy ra sớm hơn trong quá tn`nh điều trị, nên xem xét việc giảm liều
ớ các bệnh nhân nảy. Liều giảm chính xác cùa cảc bệnh nhân thuộc nhóm nảy chưa được biết và liều)
hiệu chinh sẽ được cân nhắc dựa trên sức chịu đựng việc điều trị cùa timg bệnh nhân.
Nôn và buồn nôn
Điều trị dự phòng với thuốc chống nôn được khuyến cảo trước mỗi đợt điều trị với Irinotecan
onkovis. Nôn và buồn nôn được báo cảo thường xuyên. Bệnh nhân bị nôn kèm theo tiêu chây muộn
cần được sớm nhập viện đề đỉều trị.
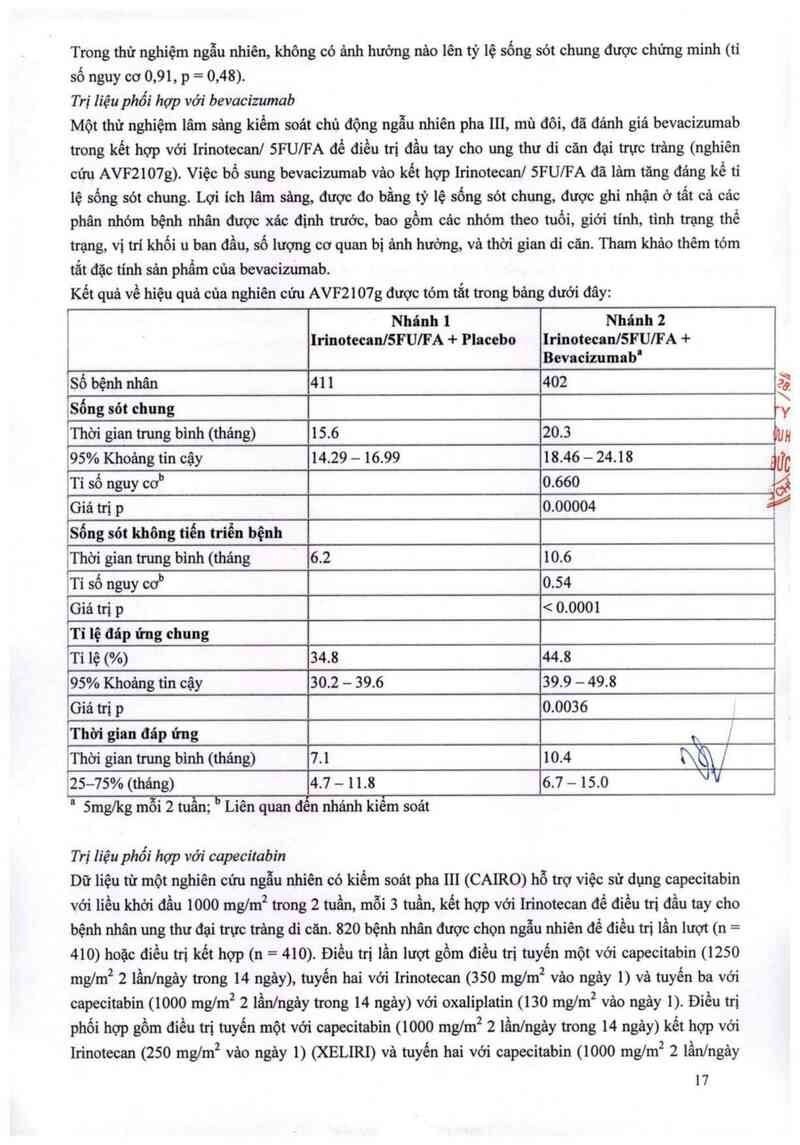
Hội chứng cholinergic cấp tính ,
?
ĩì
?
VI
*
ị
sn
Nếu xuất hiện hội chứng cholinergic cấp tính (các triệu chứng điền hinh là tiêu chảy s c triệu
chứng khác như ra mồ hôi, đau quặn bụng, chảy nước mắt, co đồng tử và tăng tiết nước bọ , cần tiêm
dưới da atropine sulphate (0,25 mg) trừ khi có chống chỉ định iâm sảng (xem mục Tác dụng không
mong muốn cúa thuốc).
Cần thận trọng đối với bệnh nhân bị hen phế quản. Đối với bệnh nhân đã xảy ra hội chứng cholinergic
cấp tính thể nặng cần sử dụng atropine sulphate để dự phòng trước liều Irinotecan onkovis kế tiếp.
Rối ioạn hô hấp
Bệnh viêm phổi kê có biếu hiện là thâm nhiễm phổi ít gặp trong khi dùng Irinotecan, nhưng có thể
gây tử vong. Yếu tố nguy cơ có thể liên quan tới sự phát triển bệnh viêm phổi kẽ gồm sử dụng cảc
thuốc gây độc hô hấp, xạ trị và các yếu tố kích thích tạo mảu. Cảc bệnh nhân có yếu tố nguy cơ cao
cần giám sát chặt chẽ cảc dấu hiệu hô hấp trước và trong khi dùng Irinotccan.
Người cao tuổi
Do các bệnh nhân cao tuổi thường bị suy giảm chức năng sinh lý, đặc biệt là chức nãng gan nên cần
phải lựa chọn liều Irinotecan onkovis cẩn thận (xem mục Cách dùng, liều dùng).
Bệnh nhân bị tắc một
Những bệnh nhân nảy không nên điều trị với Irinotecan onkovis cho tới khi hết tắc ruột (xem mục
Tác dụng không mong muốn của thuốc)
Bệnh nhân suỵ giảm chức nãng thg“
Chưa có nghiên cứu tiểu hảnh trên nhóm bệnh nhân nảy (xem mục Cách dùng, liều dùng và Đặc lính
dược động học).
Bệnh nhân khảc
Do thuốc có thảnh phần Sorbitol nên không thích hợp cho các bệnh nhân không dung nạp Fructose do
di truyền.
Đôi khi xảy ra các trường hợp giảm chức năng thận, hạ huyết áp và suy tuần hoản ở những bệnh nhân
bị mất nước do tiêu chảy vả/hoặc nôn, hoặc nhiễm khuấn.
Dùng phối hợp Irinotccan với thuốc ức chế mạnh (như ketoconazole) hoặc gây cảm ứng CYP3A4
(như rifampicin, carbamazepin, phenobarbital, phenytoin, St. John’s wort) có thề lảm thay đổi sự
chuyến hóa Irinotecan và nên trảnh các phối hợp nảy (xem mục Tương tác vởi các thuốc khác vả các
dạng tương tác khác)
Cần có biện pháp ngừa thai trong và ít nhất là 3 thảng sau khi ngừng điều trị (xem mục Sử dụng thuốc
cho phụ nữ có thai vả cho con bú).
sử DỤNG THUỐC CHO PHỤ NỮ có THAI VÀ CHO CON BỦ
Phu nữ có thai
Chưa có thông tin về việc dùng Irinotecan cho phụ nữ có thai.
Irinotecan gây độc phôi và gây quái thai ở động vật (xem mục Số liệu an toản tiền lâm sảng). Dựa
trên kểt quả nghiên cứu ở động vật thí nghiệm và cơ chế tảc dụng cùa Irinotecan, không nên dùng
Irinotecan trong lúc mang thai nhất n ba tháng dầu tiên của thai kỳ trừ khi thật cần thiết. Nên cân
nhắc lợi ích của việc điều trị và nguy cơ có thể xảy ra đối với thai nhi trong từng nường hợp.
Phịị nữ trong độ tuổi sinh sản l…
Phụ nữ vả nam giới trong độ tuổi sinh sản phải sử dụng biện phảp tránh thai hiệu quả trotịgử ít
nhất 3 tháng sau khi điều trị. .
Khả năng sinh sản
Chưa có dữ liệu về ảnh hưởng cùa Irỉnotecan lên khả năng sinh sản ở người. Đã có tải liệu về tảc
dụng bất lợi của Irinotecan lên khả năng sinh sản ở con cùa động vật thử nghiệm (xem mục Số liệu an
toản tiền lâm sảng).
Phu nữ cho con bú
Hiện tại chưa biết về việc Irinotecan có bải tiểt qua sữa người hay không. Nghiên cứu trên chuột cho
con bú cho thấy l4C-Irinotccan được tiết vảo sữa. Do đó, vì có khả năng xảy ra cảc phản ứng không
mong muốn ở trẻ bú mẹ, nên ngừng cho trẻ bú khi người mẹ điều trị Irinotecan 20 mng (xem mục
C hống chỉ định).
h-il
ẢNH HƯỞNG CỦA THUỐC LÊN KHẢ NĂNG LÁ! XE VÀ VẶN HÀNH MÁY MÓC
Bệnh nhân cần được cảnh bảo về khả năng bị chóng mặt hoặc rối loạn thị lực có thể xuất hiện trong
vòng 24 giờ sau khi truyền Irinotecan onkovis, và được khuyên không nên lải xe hoặc vận hảnh mảy
móc nếu cảc triệu chứng nảy xảy ra.
TƯỢNG TÁC với CÁC THUỐC KHÁC vÀ cAc DẠNG TƯỢNG TÁC KHÁC
Không loại trừ khả năng tương tác thuốc giữa Irinotecan và các thuốc ức chế thần kinh-cơ. Do
Irinotecan có hoạt tinh kháng cholinestcrase nên các thuốc có hoạt tính khảng cholinesterase có thể
kéo dải tảc dụng ức chế thần kinh—cơ của suxamethonium vả đối kháng tảo dụng ức chế thần kinh-cơ
của các thuốc không khử cực.
Một số nghiên cứu cho thấy dùng phối hợp các thuốc chống co giật gây cảm ứng CYP3A4 (như
carbamazepin, phenobarbital hoặc phenytoin) dẫn tới giảm tác dụng của Irinotecan, SN-38 vả SN-38
glucuronide và giảm dược lực học. Ành hưởng của các thuốc chống co giật nói trên được phản ảnh
thông qua việc giảm AUC (diện tích dưới đường cong) của SN—38 vả SN-38 giucuronide khoảng 50%
hoặc nhiều hơn. Ngoài việc gây cảm ứng enzym CYP3A4, việc tăng glucuronyl hóa và tăng bải tiết
mật có thể đóng vai trò lảm giảm tảc dụng của Irinotecan và chất chuyển hóa cùa nó.
Một nghiên cứu cũng chỉ ra rằng kết quả dùng chung với ketoconazole lảm giảm AUC cùa APC 87%
và lảm tăng AUC của SN-38 109% so với dùng Irinotccan đơn độc.
Cẩn trọng đối với cảc bệnh nhân dùng đồng thời với cảc thuốc ửc chế (như ketoconazole) hoặc gây
cảm ứng sự chuyển hóa thuốc bới cytochrome P450 3A4 (như rifampicin, carbamazepine,
phenobarbital hoặc phenytoin). Dùng đồng thời Irinotecan với một thuộc ức chế hoặc gây cảm ứng
con đường chuyền hóa nây có thế iảm thay đổi sự chuyển hóa Irinotccan và nên trảnh.
Trong một nghiên cứu nhỏ về dược động học cho thấy khi dùng Irinotecan liều 350 mglm2 đồng thời
với 900 mg St. John's Wort (Hypericum perforatum) lảm giảm 42% nồng độ trong huyết tương cùa
chất chuyến hóa có hoạt tính SN—38. Do đó, không nên dùng St. John’s Wort với Irinotecan (xem mục
Chống chỉ định).
Dùng đồng thời với 5-fiuorouracil vả folinic acid (S—FU/FA), không gây thay đổi dược động học cùa
Irinotecan.
Atazanavir sulphat:
Sử dụng đồng thời với atazanavir sulphat, một chất ức chế CYP3A4 vả UGTIAI, có khả năng lảm
tăng phơi nhiễm toản thân với SN—38, chất chuyến hóa có hoạt tính cùa Irinotecan. Bác sĩ nên cân
nhắc khi dùng đồng thời các thuốc nảy.
Cảc tuong tảc ohộ biến với ciẳgậỵ đôc tế bảo:
Việc sử dụng chất chống đông thường phổ biến do tăng nguy cơ huyết khổi trong cảc bệ i u.
Chất chống đông kháng vitamin K được chỉ định, yêu cầu tăng tần suất theo đõi INR do liệu
hẹp của các chất nảy, sự thay đổi cao theo nội tại cả nhân về huyết khối và khả năng tương tác giữa
thuốc chống đông đường uống và hóa trị liệu chống ung thư.
o
Sư ung đồng thời chống chỉ định
Vacxin sốt vảng: nguy cơ phản ứng toản thân với vacxin gây tử vong.
sn dung đồng thời không ớuớc khuỵến cảo
- Vacxin sống lảm giảm độc lực (trừ vacxin sốt vảng): nguy cơ bệnh toản thân có thể từ vong (vi
dụ: nhiễm trùng). Nguy cơ nảy tãng ớ bệnh nhân đã bị suy giảm miễn dịch do bệnh tiểm ẩn.
- Vacxin bất hoạt (ví dụ: vacxin bại liệt)
— Phenytoín: Có nguy cơ lảm trầm trọng cơn co giật do giảm hấp thu phenytoin từ đường tiêu hóa
bới thuốc gây độc tế bảo hoặc nguy cơ tăng độc tính do tăng chuyển hóa gan bởi phenytoin.
Sử dung đồng thời cần cân nhắc
Ciclosporin, Tacrolimus: Suy giảm miễn dịch quá mức với nguy co gia tãng iympho bảo.
Chưa có bằng chửng cho thấy sự an toân khi dùng Irinotecan bị ảnh hướng bời Cetuximab hoặc
ngược lại.
Trong một nghiên cửu, nồng độ Irinotecan gỉống nhau ở nhóm bệnh nhân chỉ điều tti bằng
Irinotecan/S—FUIFA và nhóm dùng phối hợp với bcvacizumab. Nồng độ SN-38 — chất chuyển hóa còn
hoạt tính của Irinotecan được định lượng trong một nhóm bệnh nhân (xấp xỉ 30 người trên một phảc
đồ điều trị). Nồng độ của SN-38 ở những bệnh nhân điều trị Irinotecan/S—FU/FA đồng thời với
bevacizumab cao hơn trung bình 33% so với những bệnh nhân chỉ dùng Irinotecan/S-FU/FA. Do sự
khác biệt iớn giữa các cá thế và giới hạn mẫu nên không thế kết luận việc tăng nồng độ SN-38 là do
bevacizumab. Có sự tăng nhẹ tác dụng bất lợi là tiêu chảy và giảm bạch cầu. Ngoài ra, đã có báo cáo
về việc giảm liều Irinotecan nhiều hơn trên những bệnh nhân dùng Irinotecan/S-FU/FA phối hợp với
bevacizumab. Những bệnh nhân phát hiện tiêu chảy nặng, giảm bạch cầu hoặc giảm bạch cầu trung
tính do dùng phối hợp bevacizumab vả Irinotecan nên hiệu chinh liều Irinotecan theo mục Cách dùng,
liều dùng.
Irinotecan và chất chuyến hóa của nó, SN-3 8, cũng được chuyển hóa qua uridine diphosphat-
glucuronosyl transferase IA] (UGTIAI). Bệnh nhân sử dụng đồng thời với ketoconazol, một chất ức
chế UGTIAI sẽ tăng tiếp xúc với Irinotecan và chất chuyển hóa hoạt tính cùa nỏ SN-38. Dùng đồng
thời lrinotecan với cảc chẩt ức chế UGTIAI (như atazanavir, gemfibrozil, indinavir) có thế lảm tăng
tiếp xúc toân thân với Irinotecan hay sms. Không dùng cảc chất ức chế mạnh UGTIAI cùng với
Irinotecan trừ khi không có phương pháp điều trị thay thế.
TÁC DỤNG KHÔNG MONG MUÔN CỦA THUỐC
Cảc tác đụng không mong muốn chi tiết ở mục nảy chỉ do Irinotecan gây ra.
Cảc tảc dụng không mong muốn thường xảy ra nhất là tiêu chảy sởm hoặc tiêu chảy muộn, giảm bạch
cầu trung tính, thiếu mảu, giảm tiếu cầu, rụng tóc vả sốt không có nhiễm trùng.
Liên hệ ngay với bác sĩ điều tii khi có cảc độc tinh giới hạn liều vả tảc dụng phụ nghiêm trọng sau:
tiêu chảy sớm và tiêu chảy muộn thể nặng và dai dẳng, giảm bạch cầu trung tính, buồn nôn vả/hoặc
nôn và khó thở.
Tần số của tác dụng bất lợi được phân loại theo bảng dưới đây:
Rấtthuờng gặp 21/10 f\ề ị
Thườnggặp ìl/lOOtới 150 mg/mz). Mối quan hệ giữa kỉếu gen UGTIAI v` "sự
xuất hiện tiếu chảy do Irinotecan không được thiết lập.
Bệnh nhân được biết có đồng hợp UGTIAI*28 nên dùng liều khởi đầu Irinotecan bình heo
chỉ định. Tuy nhiên, những bệnh nhân nảy nên được theo dõi độc tính huyết học. Nên giảm ' u khới
đầu Irinotecan cho bệnh nhân đã gặp độc tính huyết học với điều tiị trước. Việc giảm liều khới đầu
chinh xác ớ bệnh nhân nảy chưa được xác định và bất kỳ sự điều chinh liều nâo sau đó phải dựa trên
khả năng dung nạp của bệnh nhân. (Xem phần Ca'ch dùng, Iiều dùng và Cánh báo và thận trọng khi
dùng thuốc)
Hiện tại chưa có đủ dữ liệu dề kết luận về lợi ích lâm sảng cùa việc phân tích cấu trúc gen UGTIAI.
18
ĐẶC TÍNH DƯỢC ĐỌNG nọc
Trong một nghiên cứu pha 1 trên 60 bệnh nhân với phác đồ truyền tĩnh mạch trong vòng 30 phủt liều
100-150 ngm² mỗi 3 tuần, Irinotecan được đâo thải theo mô hinh 2 pha hoặc 3 pha. Hệ số thanh thải
huyết tương trung bình 15 thlm² và thể tich phân bố ớ trạng thái ổn định (Vd,,)z 151 LJm². Với mô
hình 3 pha, thời gian bán thải trong mảu trung bình là 12 phút cho pha đầu, 2,5 giờ cho pha 2 và 14,2
giờ cho thời gian bản thải pha cuối. Chất chuyển hóa có hoạt tính SN-38 được thải trừ theo mô hình 2
pha với thời gian bán thải cuối cùng là 13,8 giờ.
Tại thời điếm cuối khi truyền liều thông thường 350 mg/m² ttong 30 phút, nồng độ đỉnh trong huyết
tương trung bình của Irinotccan hydrochloride vả SN-38 tương ứng 1â 7,7 ưg/ml và 56 nglml, và diện
tích dưới đường cong (AUC) trung bình tương ứng là 34 pg.hlml và 451 ng.hlml. Sự khác biệt lớn
giữa các cá thế về cảc thông số dược động học thường được quan sát đối với SN—38.
Phân tích dược động học của Irỉnotecan theo dân cư được tiến hảnh trên 148 bệnh nhân ung thư đại
trực trảng di căn, điều trị với các phác đồ khảc nhau và ở cảc liều khảc nhau trong thử nghiệm pha 11.
Các thông số dược động học thu được từ mô hình 3 ngãn tương tự với kết quả nghiên cứu trên pha 1.
Tất cả cảc nghiên cứu đều cho thấy Irinotecan vả SN-38 tăng khả dụng sinh học tương ứng với liều
dùng của Irinotecan; dược động học cùa chủng không phụ thuộc vâo các đợt điều trị trước đó và thời
biếu dùng.
Trong in vitro, tỷ lệ liền kết với protein huyết tương của Irỉnotecan vả SN-38 tương ứng xấp xỉ 30-
68% và 95%.
Cảo nghiên cứu về cân bằng khối lượng và chuyến hóa với thuốc MC—labclled cho thấy hơn 50% liếư
tiêm tĩnh mạch cùa Irinotecan được đảo thải dưới dạng không đổi, với 33% trong phân chủ yếu qua
mật và 22% trong nước tiều.
Hai con đường sau chuyến hóa ít nhất 12% iiều dùng/con đường:
- Thùy phân bới carboxylcsterase tạo chất chuyến hóa có hoạt tính SN-38. SN-38 được thải trừ
chính qua mật và thận (ít hơn 0,5% liều In'notecan). SN-38 glucuronide sau đó được thùy phân
trong ruột.
- Quá trình oxy hóa cùa các enzym-phụ thuộc Cytochromc P450 3A4 dẫn đến việc mở vòng
piperidine tạo thânh APC (đẫn xuất aminopentanoic acid ) vả NPC (dẫn xuất cùa amine bậc 1)
(xem phần Tương tác với các thuốc khác vã các dạng tương tác khác)
Irinotecan không chuyển hóa là dạng tổn tại chính trong huyết tương, sau đó là APC, SN- ucur Jnide
vả SN—3 8. Chỉ có SN-38 có hoạt tính độc tế bảo đáng kế. APC cho thấy không có và NP rất ít
hoạt tính độc tế bảo.
Độ thanh thải của Irinotecan giảm khoảng 40% ở những bệnh nhân có bilirubin huyết vảo khoảng 1,5
và 3 lần giới hạn bình thường. Sinh khả dụng toản thân ở những bệnh nhân dùng liều Irinotecan 200
mglm2 tương đương với các bệnh nhân ung thư có chức năng gan bình thường dùng lỉều 350 mg/m2
sớ LIẸU AN TOÀN TIÊN LÂM SÀNG
Các nghiên cứu về độc tính của liều đơn và liều lặp lại đã dược tiến hảnh trên chuột nhắt, chuột cống
và chó. Cảo độc tính chinh xuất hiện trên hệ thống tạo mảu và bạch huyết. Ở chó, đă có bảo cảo về
việc tiêu chảy muộn kết hợp với việc teo vả hoại từ ổ niêm mạc ruột. Hiện tượng rụng lông cũng thấy
ở chỏ. Mức độ trầm trọng của tảc dụng phụ nây liên quan đến liều và có thế hồi phục.
19
Irinotecan vả SN-38 được chứng minh gây đột biến trong nghiên cứu in vitro về sai lệch nhiễm sắc
thể trên tế bảo CHO và nghiên cứu In vitro trên nhân sinh sản 6 chuột. Tuy nhiên, Irinotecan vả SN-
38 được chứng minh là không gây bất kỳ khả năng đột biến nảo ở thử nghiệm Ames.
ở chuột, điều trị 1 lần 1 tuần trong 13 tuần với liều tối đa 150 ngm² (liều thấp hơn % liều đề nghị ớ
người), không có khối u liên quan đến trị liệu được bảo cảo ở 91 tuần sau khi kết thủc điều trị.
Irinotecan gây quái thai ở chuột cống và thỏ ở liều thấp hơn iiều điều trị của người. Ở chuột, những
con được sinh ta từ chuột đã điều tiị có dị dạng bên ngoải, bị giảm khả năng sinh sản. Điều nảy không
thấy ở những con có hình thái bình thường. Đối với chuột đang mang thai, có sự giảm trọng lượng
nhau thai, giảm khả năng sống của thai nhi và gia tăng bất thường về hảnh vi.
ĐẶC ĐIÊM DƯỢC PHẢM
Danh mục tả được
Sorbitol, lactic acid, natn' hydroxide (để đỉều chỉnh pH), nước cất pha tiêm
] ml dung dịch Irinotecan onkovis chứa 0,9 -1,8 mg natri
Tương kỵ
Irinotecan onkovis tương thỉch với NaCl 0,9% vả glucose 5%.
Không trộn Irinotecan onkovis với các thuốc khác trừ cảc thuốc ở mục Thận trọng đặc biệt khi Ioại bó
và xử lý thuốc.
Quy câch đóng gói
Lọ thùy tinh mảu nâu chứa 5 ml dung dịch đậm đặc để pha tiêm truyền. Cảc lọ nảy được đóng kín
bằng nắp cao su bromobutyl.
1 đơn vị đóng gói gồm 5 hoặc 10 hộp, mỗi hộp gồm 1 lọ.
Điều kiện bâo quân
Bảo quản ở nhiệt độ dưới 30°C. Không đông lạnh.
Điều kiện bảo quản cùa dung dịch sau khi pha ioãng xem mục Hạn dùng.
Hạn dùng
Hạ dùng lg chưa mờ
24 thảng kể từ ngảy sản xuất.
Hạ_n dùng sau khi gha loãng
Độ ổn định về mặt lý hoá cho cảc dung dịch pha loãng vởi NaCl 0,9% và glucose 5% đã được chứng
minh là 12 giờ ở nhiệt độ 15 —25°C hoặc 48 giờ ở 2-8°C trảnh ảnh sáng.
Xét về mặt vi sinh, nên sử dụng ngay thuốc đã pha loãng. Nếu không sử dụng ngay, vifflử chờ
sử dụng và cảc điều kiện bảo quản khác thuộc trách nhiệm người sử dụng và thông thường ong quả
24 giờ ở nhiệt độ 2-8°C, trừ khi việc pha loãng được tiến hảnh trong cảc điều kiện có kiếm soát và
chứng minh 13 vô khuẩn.
Tiêu chuẩn chẩt lượng cũa thuốc:
Tiêu chuẩn cơ sở
Thận trọng đặc biệt khi Ioại bõ vè xử lý thuốc
Irinotecan onkovis lá thuốc gây độc tế bâo. Vì vậy, cần phải tuân theo các hướng dẫn về xử lý an toản
và loại bỏ độc tỉnh.
20
Giống như cảc thuốc chống ung thư khảo, Irinotecan onkovis phải được chuẩn bị và xử 1)? cấn thận.
Việc sử dụng kính, khẩu trang và găng tay là bắt buộc.
Nếu Irinotecan onkovis tiếp xúc với da, phải rửa xà phòng vả nước ngay lập tức và thật kỹ. Nếu
Irinotecan onkovis tiếp xúc với mảng nhầy, rửa ngay với nước.
Hướng đẫn cảch pha địch truỵền
Dung dịch Irinotecan onkovis phải được pha trong điều kiện vô trùng (xem mục Hạn dùng).
Trong điều kỉện vô trùng, dùng ổng tiêm có chia vạch rủt lượng Irinotecan cần thiết từ lọ và tiêm vảo
tủi truyền hoặc lọ 250 ml chứa dung dịch NaCl 0,9% hoặc dung dịch glucose 5%. Sau đó dùng tay lắc
thật kỹ dịch truyền. Nếu quan sát thấy có kết tùa trong lọ hoặc sau khi pha loãng, nên Ioại bỏ theo qui
trình chuấn của các thuốc độc tế bảo. ,
Xử lý
Thuốc không dùng hay vật liệu phế thải phải được xử lý theo qui trình chuẩn của 1ện cho thuốc
độc tế bảo và theo quy định của địa phương.
cơ sở SÂN XUẤT
Haupt Pharma Wolfratshausen GmbH
Pfaffcnrieder Str. 5
82515 Wolfratshausen, Đức
CHỦ sở HỮU GIẤY PHÉP LƯU HÀNH TẠI ĐỨC
onkovis GmbH
Grube 45
82377 Penzberg, Đức
cơ sở ĐĂNG KÝ THUỐC
Công ty TNHH Bình Việt Đức (Bivid Co., Ltd)
62l36 Trương Công Định, Phường 14, Quận Tân Bình, Thảnh phố Hồ Chí Minh
P.TRibNG PHÒNG
ạắạm %Ấị "Vần JÍỄmẤ
21
ý
uư\Ử
!
nt
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng