
















.81đ 1”214
ĐẬIDIẸN
im l riuniuun
ũ]uu asn alũuịs
1i]ud asn snuuaưnm_ m]
NOLDJIN'J UD! NO un 105
ium… 01
m……
ap_umựsmpAu unaa]nuụ]
aduuii] “““"ẵm“
PEX)O(XX
TẠ] i", P
\ ~-—f'” /
!
..f
ỔCHiMiNH é)
…. /
* ttulil-uuantltitiue cnmpositnili Docaqe: as recommended bythe
lEach m| cirJlngaínsm d physician.
n'nctecan mc ori c
lenmAnk trihydmte UẵP . 20.0 mg Len m ÂRk Posolouy: read accompanying
. _ ' . Excipients nackaq: insert for detaiiad
Hx Prascnptiun meúlcine ủ múc … mm ml Rx Prescription medicine instructions for use and precautions.
l ' nunmjli IOmzỉ2ml _ _ _ ' Store iielow 3ll'tt. Pmtect trum iiulit.
rl u 8 Dạng bn cllếẹ Dng d]ch tiem, Dung rl 0 B
ẹỀ diliingỄchẵiỵenliirĩhl mjục_h. . Dn nut tie em
ill p III: dl I'll Clưi unntecm Calllinn _ cymioxic Age Ỉll.
' hydrochlorid u-ihydnl USP 20 mg I
lrmotecan smc vn… iil notecan KEEP IJUT or mm] OF cmumsn
hydrochloride
Qu)` dch: Hũp 1 lọ 2ml.
Bin quin: Bão quán đuới 30"C. Tránh
hydrọchịoride
ĨhÍS medìcine must be HSOẾ undar
bar code area
. . . . , mediaal prescriptíon and
iniection “"“““i-Wfoti’tnt ~ ` in ection wu=M=fm…m…otie
Doc kỹ llll'lfl'lẵlllll su :lvng trwc Hn IGPBỔÍEd WỈÌMĐỈ
_ Ẻ’Í'fl’ R-gễ ĨJsẵm "S 'fỔ …- a ncw prescription.
13 ở , I _ HD xem ”Batch”,
' 40 mg/2 Mi I ~~Mfgf-ựEẫẵmia’ mini… h]. I 40 01012 ml l Ễlanmciiưẵd ny:_ SA
Chi uinii, c ng chí dinh, cánh dùng, _ :nmlr enencs . ,
zo m| tiễu dùng vì dc thõng tin khác: xem 2 m ml Caile 9 N“ 593 _ ,
"W …, ưi……g 46 8 dum … …. ° “ tmestm Pamue indusinai Piar
Sin vuấibỡĩ: GLENMAảR Provincia de Buenos Aires, Areentĩna
sozunou FOR imme GENER'CS S-^u socưnou pon imscrioiư Manufactured tuc
for intravenous use only c²"° °Ể 5,931BlÓẮỂ-ỔỤAXJỈ’WW 107 intravenous use only Glgnmark pnarmaggumas m_
. ' l Industnal Filu, Fmvmcla dc Eunncas _ I | B 12 Mahalaxmi Ghamheưs
Sin; 0 use on y Aim' M'hen'n'm' sms e … on y 22 'Bnulabhai De nm
Dnulenl: tlviat — min _. Coutuilz 1 vlal Mưmhai-4O dia l.
2 - B(J Ẹ" TF _ ụ,/
.—. '7 . _ ,
CỤC Q i.]AN m DƯỌC
nu Ả . A 1
' ' ' ' * . PEXXXXX
ĐA FHỀ DUYỆT “°“ỵ _
Miq.: , '
Ỉ n` ' . i à4 , ’
Lân đffll…Ảgni uuuẵni nẵỄầnìoì Exp. daÌe' i
i
i i
]— i“`ị—“li
Rletr'uúơin
Onl-untluin unpniuh, ma u…
I. n 1an mm… lmmu 182 200 me
| … ẵfflull u
. !
immm .…m“'° '… mụ
]W- mg ennm am… u. Ễ
dEnmak
MWIW
bin…mưly
SAME SIZE ARTWOFIK
LABLE SIZE: 55 nm x 22 mm
Fun… muum.
0 m n m… Ann Amin
Mnlmưlm MIIt n…… Il! g
!I1 Wani CMùII &. Bth MU R… ẳ
W _ 4… Inu
Em. date;
200% ENLARGED ARTWORK
LABLE SIZE: 55 mm x 22 mm
/
Rx Prescription medicine
Irihope
Irinotecan hydrochloride
in]ectionj 40 ng2 mil
20 mg/ml
6
qlen mzmk
s UTION FOR iNJECTION
intravenous use onty
Ouali-quantitative compositoin: Each ml contains:
lrinotecan hydrochloride trihydrate USP 20.0 mg
Excipients q.s.
Store baluw 30°C. Protect trom lioht.
Do not tram.
Manufactured by: Glenmark Generics S.A.
Calie N° 593 (BtGZSMAX) ẫ
Parque Industrial Pilar,
Provincia de Buenos Aires. Argentina
Manutactured 101: Glenmark Pharmaceuticals Ltd.
B/2, Mahalaxmỉ Chambers 22. Bhuiabhai Desai Road
Mumbat — 400026, India.
Batch:
Exp. date:
[
041 DIỆN
TẬi T.P
vi… PHÒNG
ĐẠI DIỆN
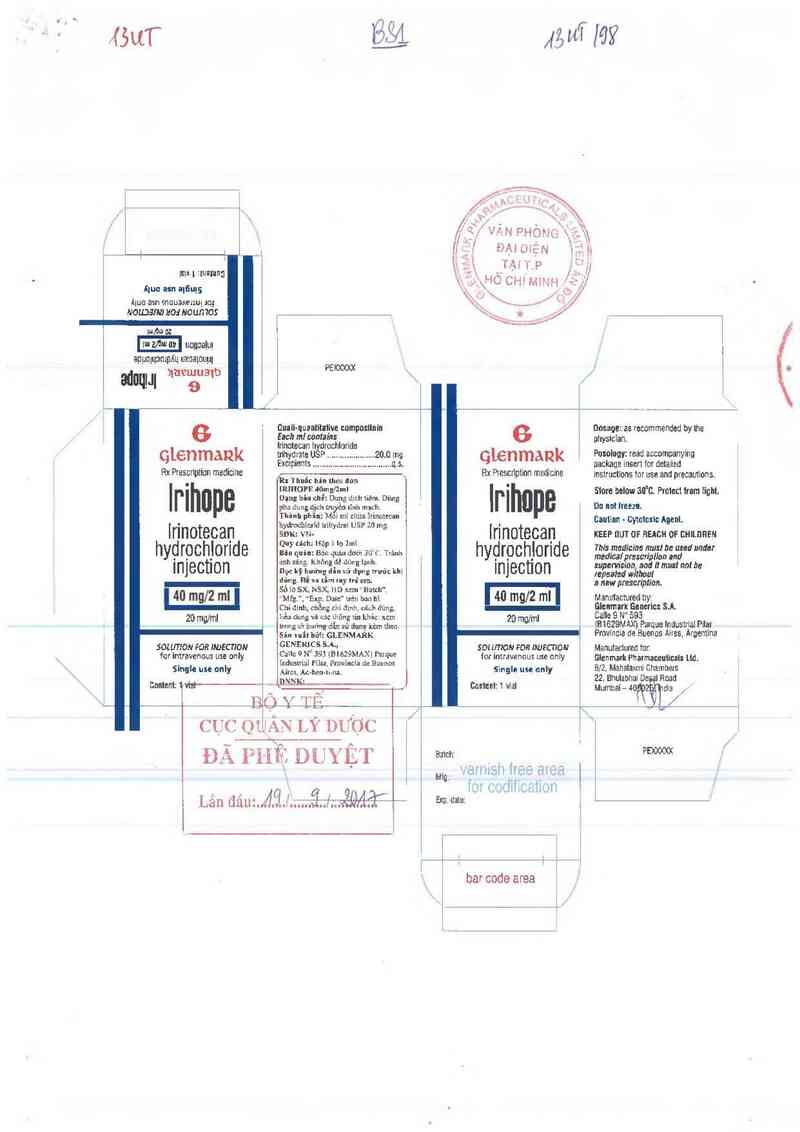
Rx Thuốc bán theo đơn
IRIHOPE
lrinotecan hydrochlorid trihydrat
Tẫt cả các thuốc có chứa irinotecan dưới dạng hoạt chẩt có khả năng gây ra những tãc động đề cập
dưới đây. Irinotecan chỉ nên được sử dụng bởi bác sĩ chuyên khoa ung bướu.
THÀNH PHẦN
Mỗi ml chứa
Irinotecan hydrochlorid trihydrat USP ............................................... 20,0 mg
Tá dược: Sorbitol, Natri hydroxid, Hydrochlorỉc acid, Lactỉc acid. Nước pha tiêm.
DẠNG BÀO CHẾ
Dung dịch tiêm. Dùng pha dung dịch truyền tĩnh mạch.
MÔ TẢ
Thuốc tiêm lrihope chứa irinotccan hydrochlorid trihydrat tả một tác nhân chống ung thư thuộc nhóm ức
chế topoisomerase I. Irinotecan hydrochlorid lả dẫn xuất bản tổng hợp của camptothecin, chiết xuất
aikaioid từ thực vật như Camptotheca acuminata hoặc được tổng hợp hóa học.
Tên hỏa học
(S)—4,l l—diethyl-S,4, l 2, l 4-tetrahydro-4-hydroxy—S ,] 4-dioxolH-pyrano[3’,4’:6,71-indolizino[l,Z—
b]quinolin-9-yl-[l ,4’bipiperidinl—i ’—carboxylat, monohydrochlorid, trihydrat.
’\ ,
Công thức thực nghiệm của irinotecan lả ngH;gN4OựHCl—3 HzO và trọng lượng phân từ lá 6Ề1119. Hoạt
chất nảy ít hòa tan trong nước và dung môi hữu cơ. Công thức cấu tạo như sau:
Công thức cẩu tạo
Irinotecan hydrochlorid có công thức hóa học như sau:
a HCl
' 3 H20
o
n;cn;
lrinotecan Hvdrochloriđe
Nhỏm dược điều trị: Chẩt ức chế topoisomerase I kìm hãm tế bảo
1
Mã ATC: LOIXXI9
DƯỢC LÝ LÂM SÀNG
Cơ chế tác dụng
Irinotecan là một dẫn xuất của camptothecin. Camptothccin tương tác đặc hiệu với enzym topoisomerase
I, thảo xoắn chuỗi ADN bằng cảch bẻ gãy chuỗi đơn có thể hồi phục. Irinotecan vả chẳt chuyền hóa có
hoạt tính cùa nó lả SN-38 liên kết vởi phức hợp topoisomerase I-ADN vả ngăn chặn sự kết tụ cảc mảnh
vỡ của chuỗi đơn. Nghiên cứu hiện nay cho thấy khả năng gây dộc tế bảo cùa irinotecan là do phá hủy
chuỗi kẻp ADN được sinh ra trong quá trình tổng hợp ADN khi cnzym sao chép tương tảc với tam phức
gồm topoisomerase I, ADN, vả irinotccan hoặc SN-38. Tế bâo động vật có Vũ không có khả nãng hản gắn
hiệu quả. các mảnh vỡ của chuỗi kép nảy.
Dược lực học
irinotccan hoạt động như một tiền chẳt tan trong nuớc cùa chẳt chuyến hóa thân dầu SN-38. SN-3S hỉnh
thảnh từ irinotccan do sự bẻ gãy liên kết carbamat giữa nửa camptothecin vả chuỗi bên dipiperidino dưới
tảo dụng cùa men carboxylesterase. Khả. nảng gây ức chế topoisomerase ] tinh chế từ dòng tế bâo khối u ở
người hoặc động vật gặm nhấm cùa SN—38 cao hơn khoảng 1000 lần so với irinotccan. Thử nghiệm độc
tinh tế bảo in vitro cho thấy hiệu lực của SN-38 so với itínotecan dao động từ 2 đến 2000 lần. Tuy nhiên,
diện tỉch dưới đường cong nồng độ trong huyết tương theo thời gian (AUC) cùa SN-3S 18 2% đến 8% so
vởi irinotecan vả 95% SN-3S gắn kết với protein huyết tương so với xấp xỉ 50% irinotecan gắn kết với
protcin huyết tương. Vai trò chính xảo cùa SN-3S trong hoạt động của irinotccan hỉện vẫn không rõ. Cả
in`notccan vả SN—38 đều tồn tại ở dạng lacton có hoạt tinh và dạng anion axit hydroxy không hoạt tính.
Trạng thải cân bằng giữa hai dạng phụ thuộc vảo pH, khi môi trường pH axit hinh thảnh dạng iacton,
trong khi môi trường pH kiềm hình thảnh dạng anion axit hydroxy.
Dùng irinotecan có tảc dụng kháng khối u ở chuột gặm nhấm mắc bệnh ung thư và tế bảo ung thư ngoại
lai của nhiều loại mô khảo nhau ở người.
Dược động học ở người
Hắp thu:
Sau khi truyền tĩnh mạch irinotecan ở người, nồng độ trong huyết tương của irỉnotccan giảm mạnh theo
hảm mũ, với thời gian bản thải cuối trung bình khoảng từ 6 dến 12 giờ. Thời gian bán thâi cuối trung hinh
của chẳt chuyến hóa có hoạt tính SN-38 là khoảng 10 đến 20 giờ. Thời gian bán thải của cảc dạn lacton
(có hoạt tính) của irinotccan vả SN-38 tương tự thời gian bản thải cùa tống irinotecan vả SN…ỂS“ _đạng
lacton và axit hydroxy ở ưạng thải cân bằng. U
Trong phạm vi liều lượng khuyến cáo từ 50 đển 350 mgl'mz, AUC cùa irỉnotecan tăng tuyển tính với liều;
AUC của SN-38 tăng tỉ lệ thấp hơn liều tương úng. Nồng độ tối đa cùa chất chuyền hỏa có hoạt tính SN-
38 thường được thấy trong vòng ] giờ sau khi kết thủc 90 phủt truyền irinotccan. Cảc thông số dược
động học cho irinotecan vả SN-38 sau khi truyền irinotecan 90 phút ở mức liễu 125 và 340 mg/m2 được
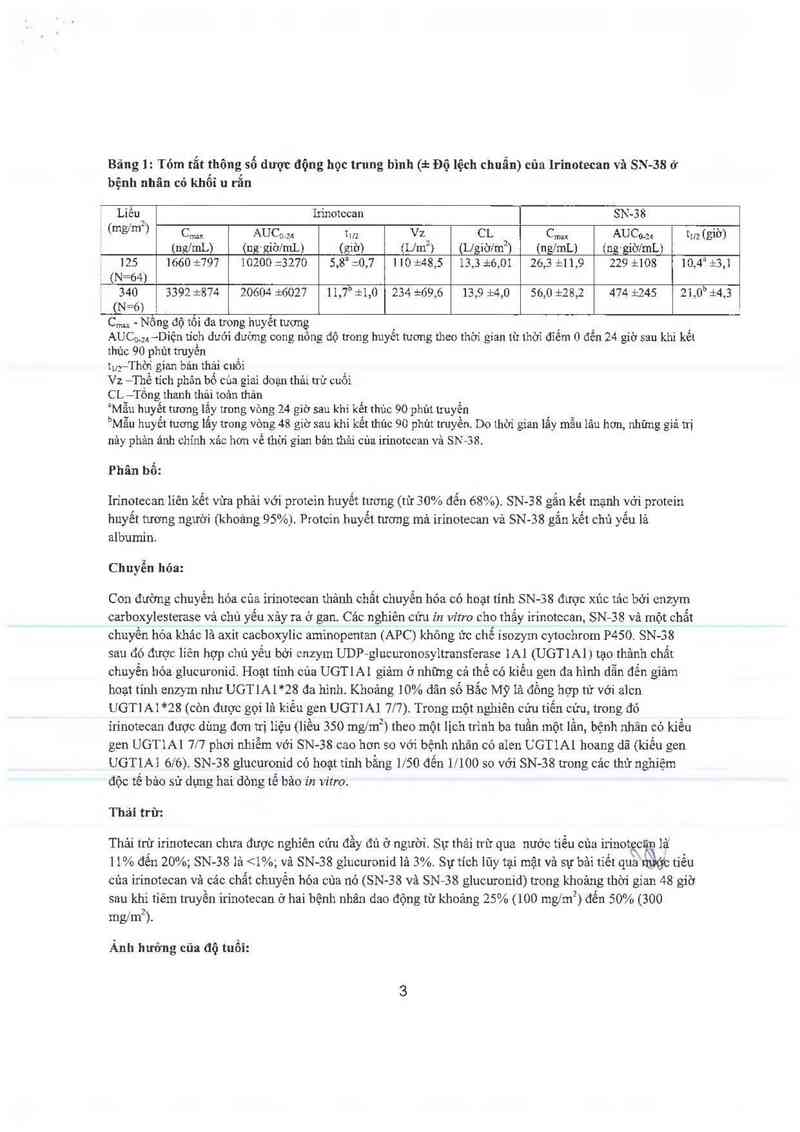
xác định ưong hai nghiên cửu lãm sảng ở bệnh nhân có khối u rắn được tóm tắt trong Bảng 1.
Bảng 1: Tóm tắt thông số dược động học trung bình (4: Độ lệch chuẩn) của Irỉnotecan vả SN-38 ở
bệnh nhân có khôi u răn
Liều In`notccan SN-38
J (mgfm') C… AUC… 1… Vz CL C… AUCo-za t… (giờ)
(nglmL) (ng ' giờ/mL) ( giờ) (le2) (L/giờlmzì (nglmL) (ng- giờlmL)
125 1660 d:797 10200 23270 5,8a =0,7 1 10 dz48,5 13,3 zizó,Ol 26,3 il 1,9 229 i108 10,4a :t3,Ì
' (N=64)
340 3392 d:874 20604 16027 11,7” il,0 234 i—69,6 13,9 i4,0 56,0 1:28,2 474 t245 21,0b i4,3
CtN-6)
Cmax - Nông độ tôi đa trong huyêt tương
AUCD. 24 —Diện tích dưới đường cong nông độ trong huyết tuong theo thời gian từ thời đĩếm 0 đễn 24 giờ sau khi kết
thủc 90 phủt truyền
Ìưỵ-Thờ'i gian bản thải CUỔ1
Vz —Thề tích phân bố cùa giai doạn thải trừ cuối
CL ——Tổng thanh thải toản thân
ịMẫu huyết tương lắy trong vòng 24 gíờ sau khi kết thủc 90 phủt lruyển
bMẫu huyết tuơng lắy trong vòng 48 giờ sau khi kết thúc 90 phủt truyền. Do thời gian lẳy mẫu lâu hơn, nhũng giá trị
nảy phản ảnh chinh xảc hơn về thời gian bản thải của irinotccan vả SN -38.
Phân bổ:
Irinotccan iiên kết vừa phải với protein huyết tương (từ 30% đến 68%). SN-38 gắn kểt mạnh vởi protein
huyết tương người (khoảng 95%). Protcin huyết tương mả irinotecan vả SN-38 gắn kết chủ yếu là
albumin.
Chuyển hóa:
Con đường chuyển hóa cùa in'notecan thảnh chất chuyền hóa có hoạt tính SN-38 được xúc tảo bởi cnzym
carboxylesterase và chủ yếu xảy ra ở gan. Cảc nghiên cứu in vitro cho thấy irinotccan, SN—38 vả một chẳt
chuyền hóa khác iả axit cacboxylic aminopentan (APC) không ức chế isozym cytochrom P450. SN-38
sau đó được liên hợp chủ yếu bởi cnzym UDP—giucuxonosyltransfcrase lAl (UGTIAI) tạo thảnh chất
chuyền hóa glucuronid. Hoạt tính cúa UGTIAI giảm ở những cá thế có kiểu gen đa hình dẫn đến giảm
hoạt tính enzym như UGTIAI*28 đa hinh. Khoảng 10% dân số Bắc Mỹ iả đồng hợp tử với aicn
UGT] A1 *28 (còn được gọi là kiểu gcn UGTl A1 717). Trong một nghiên cửu tiến cứu, trong đó
irinotecan được dùng đơn trị lỉệu (liều 350 mg7m²J theo một lịch trinh ba tuần một lẩn, bệnh nhân có kiểu
gen UGTIAI 717 phơi nhiễm với SN-38 cao hơn so với bệnh nhân có alcn UGTIAI hoang dã (kiến gen
UGTIAI 616). SN-38 glucuronid có hoạt tính bằng 1150 đển 11100 so với SN-38 trong cảc thử nghiệm
độc tế bảo sử dụng hai dòng tế bảo in vitro.
Thải trừ:
Thải trừ irinotccan chưa được nghiên cứu đầy đủ ở người, Sự thải trừ qua nuớc tiểu cùa irinot cãn lâ'
11% đến 20%; SN-38 lả <1%, vả SN-38 glucuronid là 3%. Sự tích lũy tại mật và sự bâi tiết quấnptỹc tiểu
của irinotecan vã các chẩt chuyển hóa cùa nó (SN-3S vả SN-38 glucuronid) trong khoảng thời gian 48 giờ
sau khi tiêm truyền irinotecan ở hai bệnh nhân dao động từ khoảng 25% (100 mg/mz) đến 50% (300
mg/mz).
Ảnh hưởng của độ tuổi:
Không khuyến các thay đối liễu khởi đầu đối với bệnh nhân cao tuổi dùng liệu trình irinotecan hảng tuần.
Ẩnh hưởng của giỏi tínhz
Dược động học của irinotccan dường như không bị ảnh hướng bới giới tính.
Ẩnh hưởng cũa chủng tộc :
Ảnh hướng cúa chủng tộc đến dược động học của irinotecan chưa được đánh giả.
Ảnh hưởng cũa Suy gan:
Độ thanh thải của irinotccan bị giảm ở bệnh nhân suy gan trong khi phơi nhiễm với chất chuyển hóa có
hoạt tinh SN-3S tăng so vởi ở những bệnh nhân có chức nảng gan binh thường. Mức độ ảnh hưởng tỷ lệ
thuận với mức độ suy gan được đo bằng sự tăng tống nồng độ bilirubin vả transaminase. Tuy nhiên, khả
nãng dung nạp cùa irinotecan ở bệnh nhân có rối loạn chức năng gan (bilirubin lớn hơn 2 mg/dl) chua
được đảnh giả đẩy đù, vả hiện vẫn chưa có khuyến cảo về iiều cho uhững bệnh nhân nảy.
Ảnh hưởng của Suy thận:
Sự ảnh hưởng của suy thặn trên dược động hỌc của irỉnotecan chưa được đảnh giả. Vì vậy, cần thận trọng
khi dùng thuốc ở những bệnh nhân suy chức năng thận. Khỏng khuyến cảo dùng irinotccan cho bệnh
nhân chạy thận nhân tạo.
cnỉ ĐỊNH VÀ SỬ DỤNG
Irihope được chỉ định như một thảnh phần cùa điều trị bước một kểt hợp với S-tiuorouracil (S-FU) vả
leucovorin [LV) cho bệnh nhân ung thư đại trảng hoặc trực trảng di căn.
Irihope được chỉ định cho bệnh nhân ung thư đại trảng hay trực trảng di căn tải phảt hoặc tiến triến sau
khi điều trị fiuorouracil ban đầu.
LIÊU DÙNG vÀ CÁCH DÙNG
Ung thư đại trực trăng phác đồ kễt hợp 1 và 2
Truyền tĩnh mạch irinotecan 90 phủt rổi sau đó dùng LV vả 5-FU. Cảo phác để khuyến cảo hìện tại được
thế hiện trong Bảng 2.
Xem xét giảm liều khởi đầu 1 mức liều irinotccan cho cảc bệnh nhân có bẩt kì tinh trạng sau: xạ trị vùng
chặufbtmg, thể trạng mức 2, hoặc nồng độ bilirubin tăng. Không khuyến cáo dùng thuốc cho hệiỊh nhân
với bilirubin >2 mg/dL vì hiện vẫn thiếu thông tin để khuyến cảo liều cho những bệnh nhân nảyằ "
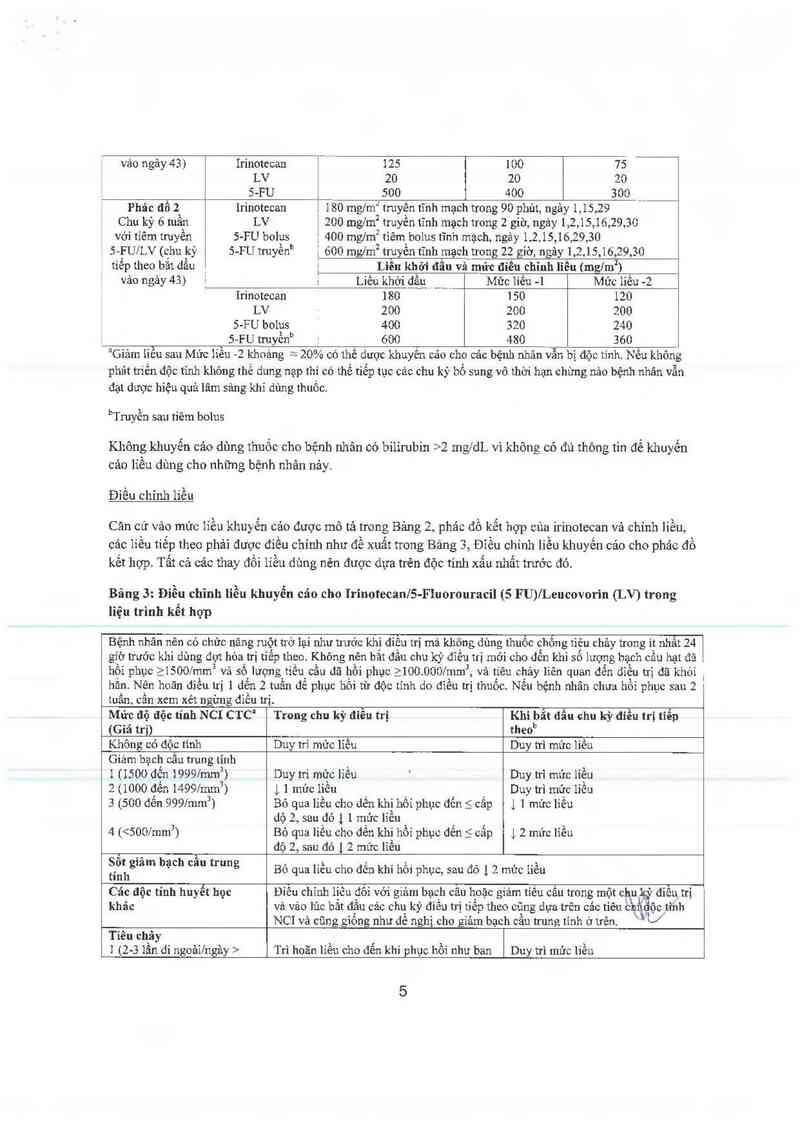
Bảng 2: Phác đồ kễt hợp nhiều thuốc vã khuyến cáo chỉnh liền“
Phâc đồ l` 125 mng truyền tĩnh mạch trong 90 phủt, ngây 1,8,15,22 i
Chu kỳ 6 tuân Irinotccan 20 mglmz tiêm bolus tĩnh mạch, ngây 1,8,15,22
với tiêm bolus 5- LV soc inglm² ti_6m bolus tĩnh mạch, ngảy 1,8,15,22
FỤ/LV (chu kỳ 5-FU Liêu khởi đãu và mức đíêu chỉnh lỉêu (mz/mz)
"eP ’h°° bat đa“ Liều khởi đẳu Mức liền -1 Mức iiều -2
4
vảo ngảy 43) Irinotecan 125 100 75
LV 20 20 20
S-FU 500 400 300
Phác đổ 2 [rinotccan 180 mg/m2 truyền tĩnh mạch trong 90 phút, ngảy 1,15,29
Chu kỳ 6 tuần LV 200 mg/m2 truyền tĩnh mạch trong 2 giờ, ngây 1,2,15,16,29,30
với tỉẽm truyền S-FU bolus , 400 mglm2 tỉêm bolus tĩnh mạch, ngảy 1,2,15,16,29,30
5—FU/LV (chu kỳ 5-FU truyềnb ] 600 mglm2 truyền tĩnh mạch trong 22 giờ, ngãy ],2,15,16,29,30
tiễp theo bắt dâu _ ] Liên khởi đâu và mức điểu chỉnh liều (mzlmz)
vảo ngảy 43) ² i` Liều khời dầẸ_ _ Mức liền -1 Mức liều -2
Irínotecan 180 150 120
LV 200 200 200
5-FU bolus 400 320 240
S—FU t…yènb . 600 480 360
“Gíảm iiều sau Mức liền —2 khoảng =— 20% có thẻ dược khuyên cảu cho cảc bệnh nhãn vẵn bị độc tính. Nêu khỏng
phát hiên độc tinh không thể dung nạp thi có thể tiếp tục cảc chu kỳ bổ sung vớ thời hạn chừng nảo bệnh nhân vẫn
đạt dược hiệu quả lãm sảng khi dùng thuốc.
bTruyền sau tiêm bolus
Không khuyến cảo dùng thuốc cho bệnh nhân có bilirubin ›2 mg/dL vì không có đủ thông tin để khuyến
cảo liều dùng cho những bệnh nhân nảy.
Điều chính liếư
Cản cứ vảo mức iiều khuyến cảo được mô tả trong Bảng 2, phác đồ kểt họp cùa irinotecan vả chỉnh iiều,
cảc iiẽu tiêp theo phải được điều chinh như đề xuất trong Bảng 3, Điêu chỉnh liều khuyến 0210 cho phác đồ
kết hợp. Tất cả các thay đổi liều dùng nẻn đuợc dựa trên độc tính xắn nhất trước đó.
Bảng 3: Điều chỉnh liễu khuyến cáo cho Irinotecan/S—Fluorouracil (5 FU)ÍLencovorin (LV) trong
liệu trình kết hợp
Bệnh nhân nên có chức nãng ruột trở lại như trước khi điêu trị mà không dùng thuôc chôn g tiêu chảy trong it nhắt 24
giờ trước khi dùng đụt hóa n-ị tiễp theo. Không nên bắt đầu chu kỳ đỉều trị mởi cho dến khi số lượng bạch cầu hạt đã
hội phục 215001mm² vả số lượng tiền cầu dã hội phục 2100.0001mm3, và tiêu chảy liên quan dến điều 11] dã khỏi ,
hăn. Nên hoãn điều trị ] dến 2 tuần để phục hôi từ độc tỉnh do điều trị thuốc. Nếu bệnh nhân chưa hổi phục sau 2
tuấn, cẩn xem xét ngùng điều trị.
Mức độ độc tính NCỊ crc’ Trong chu kỳ aièu trị Khi bắt đẩu chu kỳ điều trị tiểp
(Giá trị) theob
Không có độc tinh Duy m' mủc liều Duy trì mức liều
Giảm bạch cằn trun g tỉnh
111500 đến 19997mm3)
2 11000 đển i4991mm’)
3 (500 đến 9997mm²)
Duy trì mức liếư
Duy trì mức liêu
) 1 mức lỉẽu
Duy trì mức liều
ị ] mức liều
Bỏ qua liều cho dến khi hồi phục đến 5 cấp
dộ 2, sau đó ] 1 mửc líều
Bỏ qua liều cho đến khi hồi phục dến 5 cấp
độ 2, sau đó 1 2 mức lỉều
4 (<5001mmẵ) ] 2 mức líểu
Sổt giâm bạch cẩu trung
tính Bỏ qua liều cho dến khi hổi phục, sau đó 1 2 mức iiều
Câc độc tính huyểt học Điêu chĩnh lịêu đôi với giảm bạch cấu hoặc giảm tỉếu cẳu trong một ch\ukỳ điều trị
khảc vả vảo lúc bảt đậu cảc chư kỷ điêu trị tiêp theo cũng dựa trên các tiêu cmiiộộctinh
NC! vả cũng giông như dê nghị cho giảm bạch cẩu trung tính ở trên.
Tiêu chảy
1 (2—3 lân di ngoảĩlngầy >
Trì hoãn líều cho đến khi phục hồi như ban Duy trì mức liễu
5
trước điều trị“) dấu sau đó dùng cùng liều nhu trưởc
2 (4-6 lằn dì ngoải1ngảy > Bỏ qua liều cho đến khi phục hồi như ban Duy trì mức liều
trước điêu trị) đẩu, sau đó 1 1 mức liều
3 (7-9 lần đi ngoải/ngảy > Bỏ qua liều cho đến khi phục hồi như ban 1, ] múc liều
trước điêu trị) đẩu, sau đó 1 1 mức liều
4 (210 lần dì ngoải/ngảy > Bỏ qua liền cho đến khi phục hồi như ban 1 2 mức iiều
trước điều 81) đầu, sau đó 1 2 liều
Cải: độc t_ính khảc không
phải huyêt học’i
] Duy trì mức liều Duy trì mức liếư
2 Bỏ qua liều cho đển khi phục hối dến < cẳp Duy trì mức liều
dộ 1, sau đó 1, 1 mức líều
3 Bỏ qua liều cho đển khi phục hồi dến 5 cấp 1 ] mức liều
độ 2, sau đó ,L 1 mức líều
4 Bỏ qua liều cho dến khi phục hồi đến 5 cẩp ) 2 mức liều
độ 2, sau đó 12 mức liều
Đốt“ vó7 viêm m'êm mạc/viêm miệng
Đổi vởi viêm niêm mạc/viẽm miệng chi chỉ giảm liều 5-FU, không gíảm Iiểu
giâm liền 5 -F U, không giảm liều ỉrinotecan irínotecan
”Tiêu chí độc tính chung cùa Viện Ung thư Quốc gia (phiên bản 1.0)
b So với liều khởi đầu được sử dụng trong chu kỳ trước
° Trước đìều trị
” Không bao gồm rụng tóc, chản ăn, suy nhược
Đcm trị Đại trực trăng Phảc đồ 1 và 2
Dùng irinotccan dưới dạng truyền tĩnh mạch trong 90 phút. Các phảc đồ được khuyến cáo híện nay được
thế hiện trong Bảng 4.
Có thể xem xét gíảm liều khời đần ] mức liều irinotecan cho cảc bệnh nhân với bất kỳ tình trạng sau: xạ
trị vùng bụng/chậu trước, thể trạng mức độ 2, hoặc nồng độ bilirubin tãng. Không khuyến cảo dùng thuốc
cho bệnh nhân với bilirubin >2 mg/dL do thiếu thông tin để khuyến cáo liều dùng ở những bệnh nhân
nảy.
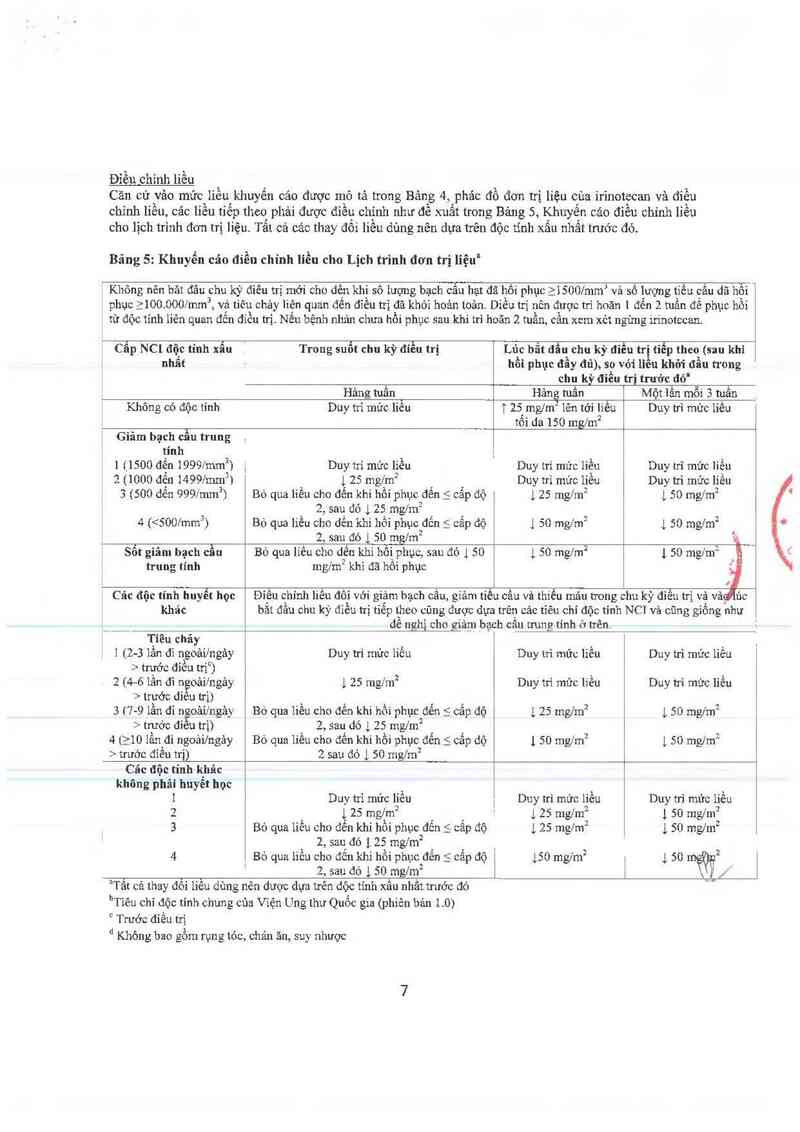
Bảng 4: Phác đồ đơn trị liệu của lrinotecan và điều chỉnh liều
Phác đồ 1 (hâng 125 mng truyền tĩnh mạch trong 90 phút, ngảỹ 1,8,15,22 sau đó nghỉ 2
tuần)" _t'uằn
Liễu khởi đẫu vả Mức liều điều chìnhc (mzlmz )
Liễu khời đầu Mức liễu ] Mức ]iểu-2
125 100 75 __
Phảc đồ 2 (mỗi 3 350 mng truyền tĩnh mạch t:rongr 90 phút, một lằn mỗi3 tuầnc
tuần) Liều khởi đầu và Mức liều đỉều chỉnh t… gim²i
Liễu khởi đầu Mức líều -1 Mức liều -2 ___
J "50 300 250
._`__ leA
Cảc iiều iiẽp2 túcu có thế được điều chỉnh cao dến mức i.… iìigz’iii hoặc thãp đên …ức 50 …g/iuz theo mức giâm 25
dến 50 mg1m2 tùy thuộc vảo khả năng dung nạp cùa từng bệnh nhân.
bCác liều tiểp theo có thể được điểu chỉnh thẳp đến mức 200 rnglm2 theo mức giảm 50 mglin2 tùy thuộcợvảo khả
năng dung nạp cùa từng bệnh nhân. \hèv
Nếu không phảt triển dộc tính không thể dung nạp thi có thể tỉếp tục cảc chu kỳ bổ sung vô thời hạn 6 ng nảo
bệnh nhân vân đạt được hiệu quả lâm sâng khi dùng thuốc.
Điểu chinh tiều
Căn cứ vảo mức liễu khuyến cáo được mô tả trong Bảng 4, Iphảc đồ đợn trị liệu cùa irinotecan và điều
chinh liều, các líều tíếp theo phải được điều chinh như đề xuất trong Bảng 5, Khuyến cáo điều chỉnh liều
cho lịch trình đơn trị liệu Tẩt cả các thay đối liều dùng nên dựa trên độc tính xâu nhẩt trước đó.
Bảng 5: Khuyến cảo điền chính lỉều cho Lịch trình đơn trị liệu”
Không nên băt đâu chu kỳ điều trị mới cho dẽn khi số tượng bạch cẩu hạt đã hồi phục >iSOO/mm và số lượng tiều cấu dã hôi
phục >100.0001mm, vả tiêu chảy liên quan đến điều trị đã khớì hoản toản. Diều trị nên được trì hoãn l đển 2 tuần để phục hồi
từ độc tinh liên quan đến điều trị. Nếu bệnh nhân chưa hồi phục sau khi trì hoãn 2 tuần, cẩn xcm xẻt ngừng irinotccan.
Cẫp NC! độc tính xẫu Trong suốt chu kỳ điều trị Lúc bắt đầu chu kỳ điếu trị tiểp theo (sau khi
nhẩt . hồi phục đầy đũ), so vói liều khởi đầu trong
chu kỳ điều trị trước đó’
Hảng tuần Hảng tuần Một lấn mỗi 3 tuần
Không có độc tính Duy ni mức liễu ] 25 ngm² lên tởi iiều Duy trì mửc liều
tối da 150 mg1m2
Giảm bạch cầu trung ,
tính
1 11500 đến 19991mm²] , Duy tn` mửc liều Duy trì mức liều Duy trì mức liền
2 (1000 đễu 14991…²i ] zs mgim² Duy trì mức líếu Duy từ mức liều
3 1500 dến 9991mm²) Bỏ qua liều cho đển khi hồi phục đến 5 cấp độ ] 25 mg1m² ] so mgfm²
2, sau đó 125 mg/m2
4 (<5001mm3) Bỏ qua liều cho dến khi hồi phục đến 5 cẩp độ ] so mgfm² ] so mgfm²
2, sau đó ] 50 mgim²
Sôt giãn] bạch cầu Bỏ qua liều cho dến khí hôi phục, sau đó 1 50 1 50 n'ig/m2 1 50 mng
trung tính mgf'm2 khi đã hồi phục
Các độc tính huyết học Điều chỉnh liếư đối với giảm bạch cẩu, giảm tiều cầu vù thiểu mảu trong chu kỳ điều trì và vả.
khác bắt đầu chu kỳ điều trị tiếp theo cũng được đực trên các tỉẽu chí độc tỉnh NC] vả cũng giống như
dề nzhị cho q_iảr_n bạch cầu trung tính ở trên.
Tiêu chảy
1(2-3 lẩn đi ngoải/ngảy Duy trì mức iiều Duy ni mửc iiều Duy trì mức liều
> trước điều trị )
2 (4 6 lần đi ngoảilngảy ] 25 mgfm² Dny tri mửc liều Duy trì mức liều
> trước diêu trị) . ` _ ,
3 ( 7—9 lân đi ngoải/ngảy Bỏ qua liều cho đên khi hôi phục đên S câp độ L 25 mg/mz l, 50 mglm2
> trước điêu trị) 2, sau dó 1 25 mg/m2
4 (210 lần đi ngoải/ngảy Bỏ qua liều cho đến khi hồi phục đển S cẳp dộ 1 50 mg/m2 1, 50 mng
› trước đỉều trị) 2 sau đó ] 50 mgfm²
Các độc tỉnh khác
không phãi huyết học
1 Duy tú mức liều l Duy trì mức liều Duy trì mức liều
2 1 25 mglm² ' 125 mng 1 50 mg/m2
3 Bỏ qua liều cho đểu khi hồi phục2 dến S cẳp độ 1 25 mgfm2 1 50 n'ig/m2
2, sau đó 125 mg/m2 _
4 Bỏ qua iiều cho đến khi hồi phụcz đến < cấp độ 1 150 mg/m2 1 50 mỂỢĨ
2, sau đó l50 mg1fn2 i l
“Tât cả thay đôi liêu dùng nên dược dụa trên dộc tinh xâu nhầt trước đó
l’Tiêu chỉ độc tỉnh chung của Viện Ung thư Quốc gia (phiên bản 1.0)
° Trước điều trị
” Không bao gổm rụng tóc, chản ăn, suy nhược
Liều dùng ở bệnh nhân có hoạt tính UGTIAI giảm
Khi dùng kết hợp vói cảc thuốc khảc, hoặc dưới dạng đơn trị liệu, nên xem xét giảm lìều khởi đầu của
iiinotecan ít nhất một bậc cho các bệnh nhân được biết là đồng hợp từ với alen UGTIA] *28. Tuy nhiên,
việc giảm liều chính xác ở các bệnh nhân nảy lá không rõ, vả việc điếu chỉnh liều sau đó nên được xem
xét dựa trên sự dung nạp của từng bệnh nhân vởì điều trị.
Thuốc dùng trưởc (premedỉcatỉon)
Khuyến cảo bệnh nhân dùng thuốc chống nôn trước. Trong cảc nghiên cửu lâm sâng cùa lịch trình liễu
hảng tuẫn, đa số bệnh nhân dùng 10 mg dexamethason kết hợp với một loại chắt chống nôn khảo, như
chất chẹn S—HTS (ví dụ, ondansetron hoặc granisetron). Nên dùng thuốc chống nôn vảo ngảy điều trị, bắt
đầu ít nhẩt 30 phủt trước khi dùng irinotecan Bảo sĩ cũng nên xem xét cung câp cho bệnh nhân phảc để
chống nôn (ví dụ, prochlorperazin) để sử dụng sau nảy khi cẩn thiểt. Nên dùng phảc đồ chống nôn tương
tự Với irinotecan trong liệu phảp phối hợp.
Dùng atropin dự phòng hoặc đíểu trị cằn được xem xẻt ở những bệnh nhân có các triệu chứng cholinergíc.
Php dung dịchtruỵền_
Kiêm tra lọ thuôo vê tiêu phân vả sự biên mảu vả kiêm tra lại khi thuôo được rủt tù lọ vảo bơm tiêm.
Thuốc tỉẽm Irinotecan 20 mg/mL chỉ dùng 1 lằn vả phần không dùng cần được loại bỏ.
Trước khi truyền phải pha loãng thuốc tiêm Irinotecan Irinotecan nên được pha loãng trong Dextrosc
tiêm 5% (ưa dùng) hoặc Natri clorỉd tiêm 0 ,9%, đến nồng đó cuối cùng khoảng 0,12 mglmL đến 2, 8
mg/mL Không được thêm cảc thuốc khác vảo dung dịch truyền.
Dung dịch ón định về vật lý vả. hỏa học trong vòng 24 giờ ở nhiệt độ phòng và dưới ánh sảng huỳnh
quang Dung dịch pha loãng trong Dextrose tiêm 5% vả bảo quản trong tủ lạnh (nhiệt độ khoảng 20C đến
8°C) vả trảnh ảnh sảng ôn định về vật lý và hóa học trong 48 gỉờ Không khuyến cảo bảo quản lạnh hỗn
hợp pha với Natri clorid tiêm 0,9% vì có thấy Iảc đảo vả it tiểu phân nhìn thấy được. Lâm đông lạnh thuốc
tiêm Irinotecan vả hỗn hợp thuốc tiêm Irinotccan có thể gây kểt tùa thuốc vả nên trảnh.
Nên sử dụng dung dịch tiêm Irinotecan ngay sau khi pha vỉ thuốc không chứa chất khảng khuẩn. Do có
khá nặng nhỉễm khuẩn khi pha loãng, nên dùng hỗn hợp đã pha vởi Dextrose tiêm 5% trong vòng 24 giờ
nếu để trong tủ lạnh (nhiệt độ 2OC đến 8°C). Trong trương hợp hỗn hợp pha với Dextrose tiêm 5% hoặc
Natri clorỉd tiêm, nên sử dụng dung dịch trong vòng 4 giờ nêu đế ở nhiệt độ phòng Nếu pha vả pha loãng
được thực hiện trong điều kiện vô khuẩn nghiêm ngặt (ví dụ, dưới LAF), nên sử dụng dung dịch tiêm
Irinotecan (kết thúc truyền) trong vòng 12 giờ ở nhiệt độ phòng hoặc 24 giờ khi bảo quản trong tủ lạnh
(2Ù C đến 80 C).
Xử lý an toản
Cần cẳn trọng trong vìệc xử lý vả pha cảc dung dịch truyền từ thuốc tiêm Irinotecan. Khuyến cảo nên
dùng găng tay Nếu dung dịch Irinotccan tiêp xúc vởi da, rừa da ngay lậẸ tức và kỹ bằng xã phòng vả
nước Nếu In'notecan tiếp xúc với níêm mạc, rửa kỹ bắng nước. Đã có săn một vải hướng dẫn được xuất
bản đề xử lý vả loại bỏ cảc chẩt chống ung thư.
Thoát mạch
Cần thận trọng để trảnh thoảt mạch, và nên theo dõi dấu híệu vỉêm tại vị tn' truyền. Nếu thoảt mạch\ủv/
ra, khuyến cảo dội sạch chỗ truyền bằng nước võ khuẩn và chườm đả.
CHỐNG cui ĐỊNH
Thuốc tỉêm Irihope chống chỉ định ở cảc bệnh nhân sau:
— Đã biết quá mẫn với thuốc hoặc cảc tá dược cùa thuốc
- Bệnh viêm ruột mạn tính vả/hoặc tắc ruột
- Cho con bú
- Bilirubin > 3 lần giới hạn trên cùa mức bình thường
- Suy tùy xương nặng
- Phân tinh trạng sức khóe trên độ 2 theo WHO*
- sư dụng đồng thời với có St. John
*Chủ thích: Phân loại thể trạng theo WHO:
Mức đó Tình trạng hoạt động
0 Hoạt động bình thường (như trước khi mắc bệnh), không hạn chế
! Hạn chế lrong cảc hoạt động lhể lực cần gắng sửa, nhưng đi lại được vả có thể Iảm được việc
nhẹ hoặc ít vận động, ví dụ như, việc nhả nhẹ nhâng, công việc văn phỏng.
2 Đi lại được vả có thể tự chăm sóc bãn thân hoản toản, nhưng khỏng thể lảm việc được. Có
]hế đúng lẽn >50% thời gian lhức tính.
3 Chỉ có thể tự chăm sóc bán thân một phần, phải nắm hoặc ngố] nghỉ tại giường/ghế >50%
thời gían thửc tỉnh.
4 Hạn chế hoản toản. Không thể tự chăm sóc bản ]hân. Phái nằm hoặc ngồi nghỉ tại giường
hoặc ghế trong toản bộ thời gian thức.
5 Tử vong
CẢNH BẤO VÀ THẬN TRỌNG
Việc sử dụng IRINOTECAN nên được giới hạn cho các đơn vị chuyên ngânh trong việc sử dụng
hóa trị gây độc tế bảo và chỉ nên được thực hỉện dưỏi sư gỉãm sảt của bác sĩ chuyên môn về hóa trị
chống ung thư
Tiêu chảy và phản ưng cholinergic
Tiêu chảy sớm (xảy ra trong hoặc ngay sau khi truyền irinotccan) thường là thoảng qua và hiếm khi
nghiêm trọng. Nó có thể đi kèm với các triệu chứng cholinergic cùa viêm mũi, tảng tiêt nước bọt, co đồng
từ, chảy nước mắt, toảt mồ hôi, đỏ bừng vả tăng nhu động ruột có thể gây đau quặn bụng. Nhịp tim chậm
cũng có thể xảy ra. Có thể phòng ngừa hoặc điều trị tiêu chảy som vả cảc triệu chứng chclinergic khác
Xem xét dự phòng hoặc đỉều trị với 0 ,2Smg đểu lmg atropin tiêm tĩnh mạch hoặc tỉêm dưới da (trừ khi có
chống chỉ định lâm sảng). Những triệu chửng nây có thể xảy ra thường xuyên hơn với liều irinotecan cao
hơn.
Tiêu chảy muộnì(thườnlg xảỵ ra hơn 24'giờ sal] khi dùng irinotccan) cỷ thể đe dọa tinh mạng vì nó có thể
kéo dải và có thẻ dân đên mât nước, mât cân băng đìện giải, hoặc nhiêm ttùng huyêt. Tiêu chảy muộn câp
độ 3-4 xảy ra ở 23-31% bệnh nhân dùng liều hảng tuần. Trong các nghiên cứu lâm sảng, trung vị thời
gian đến khi khời phảt tiêu chảy muộn lả 5 ngảy với liều môi 3 tuần vả 11 ngảy với liều hảng tuan] Tiẽú
]
chảy muộn có thế có biển chứng viêm đại trảng, loét, xuất huyết, tấc ruột, tắc nghẽn, vả nhiễm trổna/ẺJã
có báo cảo về cảc trường hợp phinh đại trảng vả thủng ruột. Bệnh nhân nên có săn loperamid đễìaẩỉđầu
điều trị tiêu chảy muộn. Bắt đầu loperarm'd ở kì đẳu tìên phân không thảnh khuôn hoặc lòng hoặc khởi
9
phát sớm nhất của tăng như động ruột. Chế độ liều cho lopcrarnỉd lả 4mg khi khởi phả] lần đẩu cùa tiêu
chảy niuộn vả sau đó 2 mg mỗi 2 giờ cho đển khi bệnh nhân hết tiêu chảy trong ít nhất 12 giờ. Không
khuyến cảo sử dụng lopcramid trong hơn 48 giờ liên tục ở cảc liều nảy do nguy cơ liệt ruột. Trong đêm,
bệnh nhân có thế uỏng 4mg loperamid mỗi 4 giờ. Theo dõi và bù dịch và chất điện giải. Sử dụng khảng
sinh hỗ trợ trong truờng hợp tảo ruột, sốt, hoặc giảm bạch cầu trung tính nghiêm trọng. Nên trì hoãn điểu
]rị hóa trị hảng tuần tiếp theo ở bệnh nhân cho đển khi chức năng ruột trở về như trước khi điểu trị trong it
nhất 24 giờ mà không cân dùng thuốc chống tiêu chảy. Bệnh nhãn không được đỉều trị với ]rinotecan cho
đến khi giải quyết được tắc ruột. Nếu tiêu chảy muộn cấp độ 2, 3, hoặc 4 tải phả], nên giảm cảc liều tiếp
theo của irinotecan Trảnh thuốc lợi tiểu hoặc thuốc nhuận trâng ở những bệnh nhân bị tiêu chảy.
Bệnh nhân cần được cảnh báo về khả nãng choáng váng hoặc rôi loạn lhị giảc có thể xảy ra trong vòng 24
giờ sau khi dùng ]rinotccan
Suy tủy
Tử vong do nhiễm trùng huyết sau giảm bạch cẩu trung tính nghiêm trọng đã được bảo cảo ở nhưng bệnh
nhân điểu trị vởi irinotecan. Trong các nghiên cứu lâm sảng đánh giá lịch trinh liều hảng tuần, sốt giảm
bạch cầu trung tính (giảm bạch câu trung tinh NC] cấp độ 4 vả sổ] câp độ 2 hoặc hơn xảy ra dồng thời}
xảy ra ở 3% bệnh nhãn; 6% bệnh nhân dùng G- CSF để điều trị giảm bạch cầu trung tính. Sứ dl,mg khảng
sinh hỗ trợ để kịp thòi kiếm soát giảm bạch cầu trung tinh có sốt Tạm dừng' ]rinotecan nếu sốt g]ảm bạch
cầu trung tinh xảy ra hoặc nếu số lượng bạch cầu trung tính tuyệt đối giảm <1000/mm. Sau khi sô lượng
bạch câu trung tinh tuyệt đối phục hồi đến mức >]OOO/mm3, nên giâm liều tiếp theo cùa irinotecnn
Khi đánh giá trong các thử nghiệm dùng liều hảng tuần, tần suất giảm bạch cầu trung tỉnh cắp độ 3vả 4
cao hơn ở những bệnh nhân được chiếu xạ vùng chậư/bụng trước đó so với những bệnh nhân không được
chiếu xạ (48% [13127] so với 24% [67/277]; p— 0 0,4). Bệnh nhân được chiếu xạ vùng chặulbụng trước
đó có nguy cơ gia tăng suy tùy nghiêm trọng sau kh] dùng irinotecan. Dựa trẽn dữ liệu thưa thớt sẵn có,
không khuyến cảo dùng đồng thòi irinotecan với chiếu xạ.
Bệnh nhân có tống nồng độ bilirubin ban đầu trong huyễt thanh >] ,0 mg/dL cũng có khả nãng bị giảm
bạch cầu trung tỉnh độ J hoặc 4 lớn hơn so với những người có nổng độ bilirubin dưới 1,0 mg/dL (50%
[19/38] so với 18% [4'7/266]; p <0 ,001). Bệnh nhân thiếu hụt glucuronid hóa bilirubin, chẳng hạn như
những người có hội chứng Gilbert, có thế có nguy cơ suy tùy lớn hơn khi được điều trị với irinotccan
Bệnh nhân giảm hoạt tính UGTIA]
Cẳc cả thế đông hợp tử vởi alcn UGTIAI*28 (kiểu gen UGTIAI 7/7) tăng nguy cơ bị giảm bạch cầu
trung tinh sau khi bắt đầu diều trị bằng í]inotecan.
Trong một nghiên cứu trên 66 bệnh nhân dùng irìnotecan đơn trị liệu (350 mg/m2 một lần mỗi 3 tuẫn),tỷ
lệ giảm bạch cằu trung tỉnh cấp độ 4 ở những bệnh nhân đồng hợp tử với alcn UGTIAI*28 lả 50%, vả ở
nhũng bệnh nhân dị hợp tử vởi alen nảy (kiều gen UGTIA] 6i7) lả 12,5%. Không quan sả] thẩy giảm
bạch cầu trung tính câp độ 4 0 những bệnh nhân đồng hợp tử vởi alen thể hoang dại (kiểu gen UGT ] Al
6/6)
Trong một nghiên cứu tiển cứu (n= 250) để điểu tra vai trò cùa UGTlAl *28 đa hỉnh trong sự phải triền
độc tính ở những bệnh nhân được điều trị với irinotecan [180 mg/m2 ) kết hợp với ]ruyên 5-FU/LV, tỷ lệ
giảm bạch câu trung tính cấp độ 4 ở những bệnh nhân đồng hợp tử với alen UGTlAl *28 lả 4 ,5%, và ở
những bệnh nhân dị hợp tử với alen nảy là 5 ,3%. Đã quan sát thắy giảm bạch cầu trung tính cấp độ 4 ở
1,8% bệnh nhân đồng hợp từ với alen thề hoang dại.
Trong một nghiên cứu khác, trong đó 109 bệnh nhãn được điểu trị với irinotecan (100-125 mglnuịìkết,
hợp với tiêm bolus 5- FU/LV, tỷ lệ giảm bạch cầu trung tỉnh cấp độ 4 ở những bệnh nhân đông hợỀịpầ với
alen UGTIAI *28 lá 18,2%, vả ở những bệnh nhân dị hợp từ vởi alen nảy là 11,1%. Đã quan sát thây
giảm bạch cầu trung tính câp độ 4 ở 6,8% bệnh nhân đồng hợp từ vói aien thế hoang đại.
10
Khi dùng kết hợp với cảc tảc nhân khảo hoặc dùng đơn độc, cần xem xét giảm liều khởi đầu innotecan ít
nhất một bậc cho cảc bệnh nhân được biết iả đổng hợp từ với alen UGTIAI*28. Tuy nhiẽn, chưa biểt
việc giảm liều chính xảc trong nhỏm bệnh nhân nây và nên xem xét điếu chỉnh liều tiếp theo dựa trên khả
năng dung nạp cùa từng bệnh nhân đối vởi điều trị.
Xét nzhiêm UGTIAI
Đã có xét nghiệm trong phòng thí ]] gh1em để xảc định tinh trạng UGTl A1 cùa bệnh nhân. Xét nghiệm có
thế phả] hiện cảc kiến gen UGTIAI 6/6, 6/7 vả 7/7.
Quả mẫn , __ ` _
Đã quan sát Ithây phản ứng quả mâu bao gôm phản ứng quả mân nặng hay phản ứng phản vệ. Ngững
irinotecan nêu xảy ra phản ứng phản vệ.
Suy thận .
Suy thận và sny thận câp đã được xác định, thường là ở những bệnh nhân giảm thê tích mảu do nôn
vâ/hoặc tiêu chảy nặng.
Độc tính ]] phổi
Cảo biển cố giông bệnh phổi kẽ (LPD), bao gồm cả trươn g hợp tử vong, đã xảy ra ở những bệnh nhân
dùng ]rinotccan (kể] hợp và đơn trị liệu) Yếu tô ngny cơ bao gồm bệnh phối từ trưởc, sử dụng thuốc gây
độc phối, xạ trị, vả yêu tố kích thích dòng. Bệnh nhân có yểu tố nguy cơ cân được theo dõi chặt chẽ cảc
triệu chửng hô hấp trước vả trong khi điều trị irinotccan. Trong cảc nghiên cửu của Nhật Bản, đã quan sảt
thắy u nhỏ dạng lưới trên X-quang ng]Jc ở tỷ lệ nhỏ bệnh nhân Khó thở, ho và sốt di] mới hay đang tiến
triên cũng đều gợi ý cần tạm dừng hỏa trị, trong khi chờ đánh giá chẩn đoản Nếu chẳn đoản bệnh phổi
kẽ, nên ngừng dùng irinotccan và hóa trị khác, vả thay thế điếu trị thích hợp nếu cần.
Độc tính của Phác đồ 5 ngảy
1\ gon] một nghiên cứu lâm sảng được thiết kế tốt, không nên sử dụng thuốc tiên] irinotecan kể] hợp vởi
phác đồ 5- FU/LV đùng trong 4-5 ngảy liên tiếp môi 4 tuần do có cảc bảo cảo vế tãng độc tinh, bao gồm
cả trường hợp từ vong đo nhiễm độc.
Tăng độc tính ở bệnh nhân Thể trạng mức độ 2
Ở những bệnh nhân dùng in'notecan/S-FUILV hoặc 5- FUfLV trong các thử nghiệm lâm sảng, đã quan sát
thấy tỷ lệ nhập viện, sốt giảm bạch cầu trung tinh, huyết khối, nngg điếu trị chu kỳ đầu tiến vả từ vong
sởm ở những bệnh nhân có thể trạng ban đằu mức độ 2 cao hơn so với ở nhưng bệnh nhân có thể trạng
ban đầu mức độ 0 hoặc 1.
Mang thai
Irinotecan gây hại cho thai khi dùng cho phụ nữ mang thai. Irinotãccan gây độc phôi ở chuột cống và thỏ ở
liều thấp hơn đáng kể so với liều dùng cho người tính theo mg/mẵ Ở chuột cống, tại mức phơi nhỉỗm
khoảng 0 2 lần mức phoi nhiễm đạt được ở người với liều 125 mgm2, irinotecan gây độc phôi và dẫn tới
giảm khả năng học tập và trọng lượng thai chuột cải ở cảc con còn sông sót, thuốc gãy quải thai (] mửc
phơi nhiễm thấp hơn (khoảng 0, 025 lần AUC ở người với liều 125 mg/m2 ) Chưa có nghiên cứu đầy đủ và
được kiếm soát tốt cùa irinotecan ở phụ nữ mang thai. Nếu thuốc nảy được sử dụng trong khi mang thại,
hoặc nếu bệnh nhân có thai trong khi dùng thuốc nây, nên thông bảo cho bệnh nhân về những nguy hiềm
tiềm tảng cho thai nhi. Phụ nữ có tiềm năng mang thai phải được khuyên nên trảnh có thai trong khi đang
được điều trị vởi irinotecan.
Bệnh nhãn Suy gan
Việc sử dụng irinotecan ở những bệnh nhân suy gan đáng kể chưa được thiết lập. Trong các th)Ệìghiệm
lâm sảng cùa cả ha] lịch ưình liều, irinotecan không được dùng cho bệnh nhãn cỏ bilirubin hưyết thanh
11
>2, 0 mg/dL, hoặc transaminase > 3 lần giởi hạn trên cùa mửc bình lhường nếu không có di cãn gan, hoặc
transaminase > 5 lần giới hạn trên cùa mức bình thường với di căn gan. Trong các thử nghiệm lâm sảng
với lịch trình liều hảng tuần, bệnh nhân với tống mức bilirubin huyết thanh hơi cao lúc ban đầu (1,0-2, O
mg/dL) có khả nãng cao hơn đảng kề bị giảm bạch cầu trung tính câp độ 3 hoặc 4 trong chu kỳ đầu tiên so
với bệnh nhân có mức bilirubin đưới 1, O mg/dL (50% [19/38] ]so với 18% [47/226]; p <0 ,.001)
Buồn nôn vả nôn:
Khuyến cảo điều trị dự phòng bầng thuốc chống nôn trước mỗi lần điễu trị với irinotccan. Buồn nôn vả
nôn đã được báo cảo thường xuyên. Bệnh nhân bị nôn kèm tíêu chảy muộn cẩn được nhập viện cảng sớm
cảng tốt để điều trị.
Thoát mạch:
Trong khi irínotccan không phải lả chất được biểt gây giộp da, cần cẩn thận để tránh thoát mạch và theo
dõi dấu hiệu viêm ở vị trí truyền. Nếu thoả] mạch xảy ra, phải rừa sạch chỗ truyền vả chườm đả.
Người caọ tuổi:
Do tần suất giảm chức năng sinh học ở bệnh nhân cao tuối lớn hơn, đặc biệt lả chức năng gan, nên thận
trọng khi lựa chọn liều in'notecan trong nhỏm dân số nảy.
Rối loạn tim mạch:
Thỉếu mảu cục bộ cơ tim đã được quan sát sau khi điều trị irinotecan chủ yếu ở những bệnh nhân bị bệnh
tim cơ bản, có cảc yếu tố nguy cơ đã biểt khác cùa bệnh tím, hoặc hóa trị liệu độc tế bảo trước đó.
Do đó, những bệnh nhân có cảc yếụ tố nguy cơ đã biết cằn được theo dỏi chặt chẽ, và cần hảnh động để
cố gắng giảm thiêu tất cả các yếu tố nguy cơ có thể thay đối được (ví dụ như hút thuốc lá, tăng huyết ap,
vả tăng lipid máu).
Tác dụng tư chế míễn dịch! tăng tịnh nhạy cảm với nhiễm trùng:
Sử dụng vắc- xin sống hay vẳc—xin sống giảm độc lực ở bệnh nhân suy giảm miễn dịch do cảc tảo nhãn
hóa trị bao gốm irìnotecan, có thể dẫn đến nhiễm trùng nặng hoặc tử vong. Nên tránh tiêm chủng với vẳc-
xin sống ở bệnh nhân dùng ]rinotecan. Có thể dùng vẳc—xín chết hay bất hoạt; tuy nhiên, đảp ưng với cảc
vắc-xin nảy có thế bị giảm
Câc đổi tượng khác:
Do thuốc có chứa sorbitol, thuốc không thích hợp ở bệnh nhân không dung nạp fructose di truyền Đã
quan sảt thấy nhưng không thường xuyên cảc ca suy thận, hạ huyết ap hay suy tuần hoản ơ nhũng bệnh
nhân bị mắt nước lỉên quan đến tiêu chảy vảlhoặc nôn, hoặc nhiễm trùng huyết
Biện phảp trảnh thai phải được thực hiện trong vả ít nhất ba tháng sau khi ngùng điều tn'
Dùng đổng thời irinotecan với một chất ưc chế CYP3A4 mạnh (ví dụ như ketoconazol) hoặc chất cảm
ứng CYP3A4 {ví dụ rifampicin, carbamazepin, phcnobarhital, phenytoin, cỏ St. John) có thể lảm thay đối
chuyền hỏa cùa irinotecan vả nên trảnh.
KHẢ NĂNG GÂY UNG THƯ, ĐỌT BIẾN VÀ SUY GIÁM KHẢ NĂNG SINH SẢN
Cảo nghỉên cửu về khả năng gây ung thư dải hạn vói irinotecan đã không được tiến hảnh. Tuy nhiên,
chuột cống đã được dùng liễu tĩnh mạch 2 mg/kg hoặc 25 mgfkg irinotecan một lần mỗi tuần trong 13
tuần (trong cảc nghiên cứu riêng bíệt, liền 25 mg/kg tạo ra Cmax vả AUC cùa irinotecan khoảng 7 ,0 lần vả
i, 3 [ẩn cảc giá trị tương úng ở những bệnh nhân dùng 125 mglm2 mỗi tuần) và sau đó đề phục hổi trong
91 Tuần. Dưới nhưng điều kỉện nảy, tỷ lệ kết hợp polyp mõ đện] nội mạc tử cung vả sacôm mô đệm nội
]]]ạc tư cung có xu hướng tuyến tính với liều. Irinotecan gây đứt gãy nhiễm sẳc thể cả in vitrẹ (Lạc nhiễm
sẳc thế ở tế bảo buồng trứng chuột đồng Trung Quốc) vả in vivo (thử nghiệm vì nhân ở chuột]nhẵtj. Cả
irinotccan vả chẳt chuyền hóa có hoạt tính SN-38 đểu gây đột biến trong thử nghiệm Amcs trên in vizro.
12
Không có tảc dụng phụ đảng kể đối vở] khả năng sỉnh sản và khả năng sinh sản nói chung đã được quan
sả] thấy sau khi dùng irinotecan đường tĩnh mạch với liều lên đến 6 mglkglngảy cho chuột cống và thò;
tuy nhiên, đã quan sát thẩy tco cơ quan sinh sản đực sau nhỉều liều innotccan hảng ngảy ở cả loâi gặm
nhắm với liều 20 mg/kg và ở chó với liều 0, 4 mg/kg Trong cảc nghiên cứu rỉêng biệt ở loải gặm nhẩm,
1iều nảy đã tạo ra Cmax vả AUC irinotecan tương ứng khoảng 5 và 1 lần cảc giá trị tương ứng ở những
bệnh nhân đùng 125 mglm' hảng tuần. Ở chó, liều nảy tạo ra C.… vả AUC irinotecan tương ứng khoảng
1/2 và 1/1 5 cảc giá trị tương ứng ở những bệnh nhân dùng 125 rng/m2 hảng tuần.
TÁC DỤNG PHỤ
Do các thử nghiệm lâm sảng được tiểu hảnh trong điều kiện rất khảo nhau, tỷ lệ phản ửng bất lọ] trong
cảc thử nghiệm lãm sảng cùa một thuốc có thể khỏng so sánh trưc tiếp được với tỷ lệ trong các Ihừ
nghiệm lãm sảng của thuốc khảc và có thể không phản ánh tỷ lệ quan sát thắy trong thực hảnh lâm sảng.
Các phản úng phụ phổ biến (> 30%) quan sả] thẳy trong cấu: nghiên cửu lâm sảng vớ] liệu pháp kết hợp
lả: buồn nôn, nỏn, đau bụng, tiêu chảy, tảo bỏn, chản an, viêm nỉêm mạc, giảm bạch cầu trung tính, giảm
bạch cầu (bao gồm cả giảm lympho bảo), thiểu mảu, giảm tiểu cầu, suy nhược, đau, sốt,rú1iễmtrùng,
bilirubin bẩt thường, vả rụng tỏc.
Cảo phản’ ưng phụ phổ biến (> 30%) quan sảt thấy trong các nghiên cứu lâm sảng với líệu phảp đơn trị lả:
buồn nôn, nôn, đau bụng, tiếu chảy, tảo bón, chán ăn, gỉảrn bạch câu trung tính, giảm bạch câu (bao gồm
cả giảm lympho bảo), thiểu mảu. Suy nhược, sốt, giảm trọng lượng cơ thế, và rụng tóc. Không quan sảt
thắy nhiễm trùng cơ hội nậng, và không có biền chứng được cho lả do giám lympho bâo.
Lịêu nhảp kết ]]gg bước môt
Tông cộng có 955 hệnh nhân ung thư đại trực trả…ng di căn đã dùng phác để khuyến cảo irinotecan kết hợp
với 5- FUva, 5-FU/LV đơn trị liệu, hoặc irinotccan đơn trị liệu. Trong hai nghiên cứu pha“ 3, 370 bệnh
nhãn đùng ]rinotecan kết hợp với 5-FU/LV, 362 bệnh nhân dùng 5-FU/LV đơn trị liệu, và 223 bệnh nhân
dùng irinotccan đơn trị iiệu
Trong N gh1en cứu 1,49 (7, 3%) bệnh nhân tử vong trong vòng 30 ngảy điều trị cuối: 21 (9, 3%) dùng
irinotecan kết hợp với 5- FU/LV, 15 (6, 8%) dùng 5- FUfLV đơn trị liệu, vả 13 (5,8%) đùng irinotecan đơn
trị liệu. Tử vong lìên quan đến điều trị xảy ra ở 2 (0,9%) bệnh nhân dùng' ]rỉnotecan kết hợp với 5—FUÍLV
(2 sốt giảm bạch cầu trung tính] nhiễu] trùng huyết), 3 (1,4%) bệnh nhân dùng 5- FU/LV đơn trị liệu (1 sốt
giảm bạch cằu trung tính/ nhiễm trùng hưyết, 1 xuất huyết thần kỉnh trung ương trong khi giảm tiều câu, 1
không rõ) vả 2 (0,9%) hệnh nhân dùng irinotccan đơn trị liệu (2 sốt giảm bạch cãu trung tính). Tử vong
do bẩt kỷ nguyên nhân nảo trong vòng 60 ngảy điều trị đầu tiên đã được báo cảo ở 15 (6,7%) bệnh nhân
đùng irínotccan kểt hợp với 5- FU/LV, 16 (7, 3%) bệnh nhân dùng 5 —FU/LV đơn trị liệu, vả 15 (6,7%)
bệnh nhân dùng irinotecan đơn trị liệu. Ngưng thuốc do téc dụng phụ đã được bảo cáo ở 17 (7,6%) bệnh
nhân dùng irinotecan kết hợp với SFUJLV, 14 (6,4%) bệnh nhân dùng 5FU/LV đon trị liệu, vả 26 (1 1 ,7%)
bệnh nhân đùng irinotecan đơn trị liệu.
Trong Nghiên cứu 2,10 (3, 5%) bệnh nhân tư vong trong vòng 30 ngảy điều trị cuối: 6 (4,1%) đùng
irinotccan kểt hợp với 5-FU/LV và 4 (2,8%) dùng 5— FUfLV đơn trị liệu. Có một ca tử vong có khả năng
liên quan đển điểu trị, xảy ra ở một bệnh nhân đùng irínotecan kết hợp với 5— FU/LV (0, 7%, nhiễm trùng
huyết do giảm bạch cầu trung tỉnh). Tư vong do bắt kỷ nguyên nhân nảo trong vòng 60 ngầy đỉểư trị đầu
tiên đã được báo cáo ở 3 (2,1%) bệnh nhảm dùng irinotecan kết hợp với 5- FUILV và 2 ( 1 ,4%Ìxbẫìũấl nhân
dùng 5- FU/LV đơn trị liệu. Ngưng thuốc do tác đụng phụ đã được bảo cảo ở 9 (6,2%) bệnh nhầụ_đ ùng
irínotecan kểt hợp với 5FU!LV vả ] {(), 7%) bệnh nhân dùng 5- FU’LV đơn trị liệu.
Cảc tác dụng phụ đảng kề nhắt trên lâm sảng với bệnh nhân đỉều trị bằng irinotecan lả tiêu chảy, buồn
13
nôn, nôn, giảm bạch cầu trung tính, và rụng tóc. Cả]: tác dụng phụ đáng kể nhất trên lâm sảng vở] bệnh
nhân dùng 5-FUILV lả tiêu chảy, giảm bạch cầu trung tính, sốt giảm bạch cằu trung tính, và viêm niêm
mạc. Trong Nghiên cứu 1, gíảin bạch cầu trung tính cắp độ 4, sốt giảm bạch cẩu trung tính (được định
nghĩa là sốt cấp độ 2 vả giảm bạch cầu trung tính cấp độ 4), vả viêm niêm mạc đã được quan sả] thấy it
thưòng xuyên hơn khi dùng irinotecan/S-FU/LV hảng tuần so với dùng 5-FU/LV hảng tháng.
Bảng 6 vả 7 lỉệt kê cảc tảo đụng phụ có 1]ên quan trên lâm sảng được bảo cáo trong Nghiên cửu ] và 2,
tướng ứng.
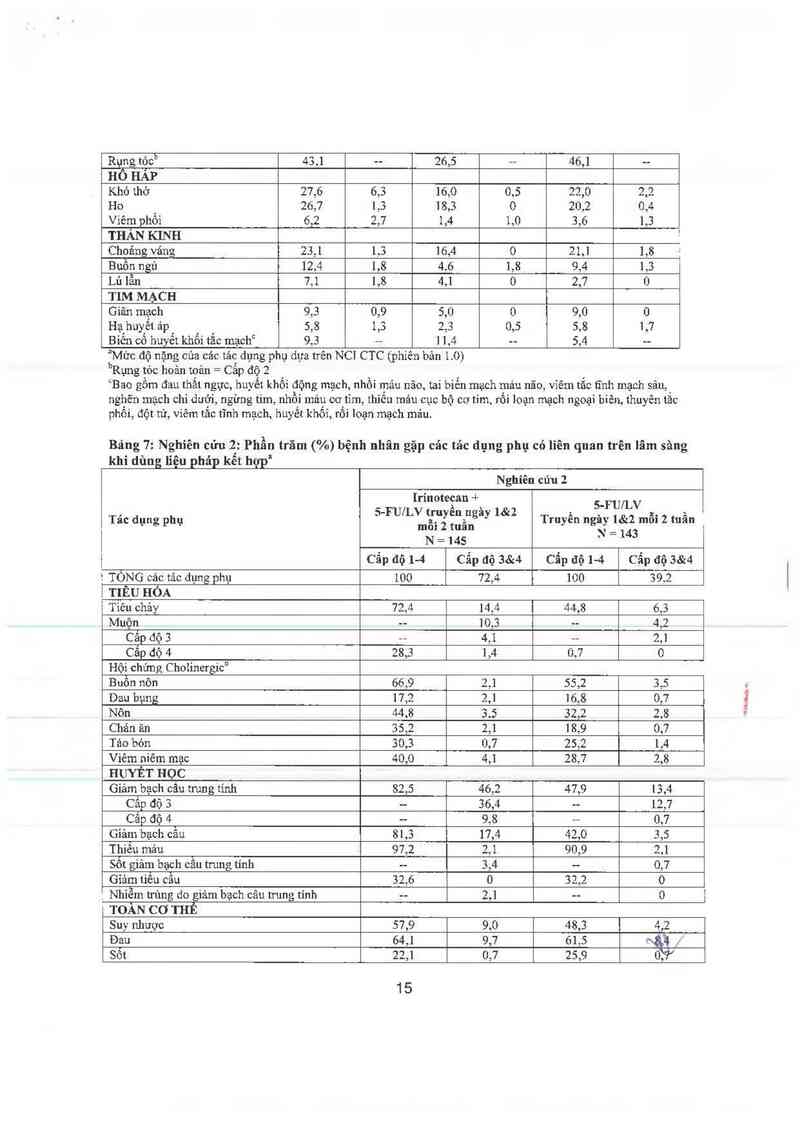
Bảng 6: Nghiên cứu 1: Phẫu trăm ("/o) bệnh nhân gặp tảc dụng phụ có liên quan trên lâm sảng khỉ
dùng lỉệu phãp kết hợp².
Nghỉên cửu 1
Irinotecan + Bolus 5-FU/LV lriuotecan
Bolus 5-FU/LV hảng hãng ngây x 5 mỗi 6 hâng tuần x 4 mỗi 4
Tác dụng phụ tuần ]] 4 tuần tuần
N=225 X=219 N=223
Cẫp độ Cẩp độ Cẩp độ Cẫp độ Cẩp aạ Cáp aạ
1-4 3&4 1-4 3&4 l-4 3&4
TÒNG các tảc dụng phụ 100 53,3 100 45,7 99,6 45,7
TIÊU HÓA
Tiêu chảy 84,9 22,7 69,4 13,2 83,0 31,0
Muộn -- 15,1 -- 5,9 —- 18,4
Cắp độ 3 … 7.6 -- 7,3 -- 12,6
Cấp độ 4 45,8 4,9 31,5 1,4 43,0 6,7
Sớm
Buôn nôn 79,1 15,6 67,6 8,2 81,6 16,1
Đau bụng 63,1 14,6 50,2 11,5 67,7 13,0
Nôn 60,4 9,7 46,] 4,1 62,8 12,1
Chản ăn 34,2 5,8 42,0 3,7 43,9 7,2
Táo bón 41,3 3,1 31,5 1,8 32,3 0,4
Viẽm niêm mạc 32,4 2,2 76,3 16.9 29.6 2.2
HUYẾT HỌC
Gỉảm bạch câu trung tính 96,9 53,8 98,6 66,7 96,4 31,4
| Cấp độ 3 … 29,8 … 23,7 … ]9,3
' Câp dộ 4 …… 24,0 -… 42,5 -- 12,1
Gỉảm bạch câu 96,9 37,8 98,6 23,3 96,4 21,5
Thỉêu máu 96,9 8,4 98,6 5,5 96,9 4,5
SỐ! giảm bạch cẩu trung tỉnh —- 7,1 —— 14,6 -- 5.8
Gỉảịn tiểu câu 96,0 2,6 98,6 2,7 96,0 ],7
Nhlcm'trung do g1am bạch cau __ 1,8 __ 0 _ 2`2
-lẸnịả.Flflll….._.- .….……… . - -… .… … ………- ..… - . .… . … .- _ -. … -. _
TOÀN cơ THẺ
Suy nhược 70,2 19,5 64,4 11,9 69,1 13,9
Đau 30,7 3 ] 26,9 3,6 22,9 2,2
Số] 42,2 17 32,4 3,6 43,5 0,4
Nhỉễm trùng 22,2 0 ]6,0 1,4 13,9 0,4
CHUYÊN HÓA VÀ DINH
DƯỞNG
Bilirubin 87,6 7,1 92,2 8,2 83,9 7,2
DA
Viêm da trỏc da 0,9 0 3,2 0,5 0 ,_ '
Phả] ban 19,] ]] 26,5 0,9 14,3 ỀỆỄ), ]
14
Rụng tócb 43,1 -- 26,5 -— 46,1 …
HỒ HẤP
Khó thở 27,6 6,3 16,0 0,5 22,0 2,2
Ho 26,7 13 18,3 0 20,2 0,4
Viêm phố] 6,2 2,7 ],4 1,0 3,6 1,3
THÀN KINH
Choáng vảng 23,1 1,3 ]6,4 0 21,] 1,8
Buôn ngủ 12,4 1,8 4.6 1,8 9,4 1,3
Lủ lẫn 7,1 1,8 4,1 0 2,7 0
TIM MẠCH
Giãn mạch 9,3 0,9 5,0 0 9,0 0
Hạ huyết ảp 5,8 1,3 2,3 0,5 5,8 1,7
Biến cố huyết khối tắc mạch0 9,3 —— ] 1,4 -- 5,4 --
3Mức độ nặng cùa các tác dụng phụ dụa trên NCI CTC (phìên bản 1.0)
bRụng tóc hoản toản = Cấp độ 2
"Bao gổm đau thẳt ngục, huyết khối động mạch, nhồi máu não, tai biến mạch máu não, vỉêm tắc tĩnh mạch sâu,
nghẽn mạch chi duới, ngùng tim, nhồi máu cơ tĩm, thiêu máu cục bộ cơ tim, rô] loạn mạch ngoại bỉên, thuyên tăc
phôi, đột tử, vìêm tãc tĩnh mạch, huyêt khô], rõ] loạn mạch mảu.
Bảng 7: Nghiên cứu 2: Phần trăm (%) bệnh nhân gặp các tác dụng phụ có liên quan trên lâm săng
khi dùng liệu pháp kểt họpI
Nghíên cúu 2
Irinotecan +
, S-FUILV truyền ngảy 1&2 ]. SỈFUÍLV x. ›,
Tac dụng phụ mỗi 2 tuần Truyen ngaẹ 181:2 mm 2 tuan
N = 145 *` _ 143
] Cẩp độ ]-4 Cẫp độ 3&4 Cẫp 66 ]-4 Cẫp độ 3414
] TÒNG các tảc dụng phụ 100 72,4 ]00 39,2
| TIÊU HÓA
Tiêu chảy 72,4 14,4 44,8 6,3
Muộn -— 10,3 -— 4,2
Câp độ 3 -- 4,1 -- 2,1
Cắp dộ 4 28,3 1,4 0,7 0
Hội chứng CholinergicD
Buôn nôn 66,9 2,1 55,2 3,5
Dau bụng 17,2 2,1 16,8 0,7
Nôn 44.8 3.5 32,2 2,8
Chản ãn 35,2 2,1 18,9 0,7
Tảo bỏn 30,3 0,7 25,2 1,4
Viêm níêm mạc 40,0 4,1 28,7 2,8
HUYẾT HỌC
Giảm bạch câu trung tính 82,5 46,2 47,9 13,4
Cấp độ 3 -- 36,4 -- 12,7
Cắp độ 4 -- 9,8 -- 0,7
Giảm bạch câu 81,3 17,4 42,0 3,5
Thiêu máu 97,2 2,1 90,9 2,1
Sốt giảm bạch câu trung tính -- 3,4 -- 0,7
Gìảm tiếu câu 32,6 0 32,2 0
, Nhỉễm trùng do giảm bạch câu trung tính -- 2,1 -- O
TOÀN cơ THẾ
Suy nhược 57,9 9,0 48,3 4,2
Đau 64,1 9,7 61,5 «ẳầ/ .
863] 22,1 0,7 25,9 0,
Om.
Nghiên cứu 2
Irinotecan +
, 5-FU!LV truyền ngảy 1&2 : SỈFUILV :. :
Tac dụng phụ :. ;. Truyen ngay 1&2 mm 2 tuan
mm 2 tuan N =143
N = 145
Cẩp độ 1-4 Cẫp độ 3824 Cẫp độ 1-4 Cẫp độ sau
Nhiễm trùng 35,9 7,6 33,6 3,5
CHUYÊN HÓA VÀ DINH DƯỞNG
Bilirubin 19,1 3,5 35,9 10,6
DA 10,3 0,7 12,6 0,7
Hội chửng tay vả chân 17,2 0,7 20,3 0
Các dâu hiệu da: Rụng tỏcc 56,6 -- 16,8 ~—
HỒ HẤP
Khó thở 9,7 1,4 4,9 0
TIM MẠCH
Hạ huyêt ảp 3,4 1,4 0,7 0
Biến cố huyết khối tắc mạchd 11,7 -- 5,6 --
aMức độ nặng cùa các tảc dụng phụ dựa trên NCI CTC (phiên bản 1 0)
bBao gồm vỉêm mũi, tảng tiểt nuớc bọt, co đổng từ, chảy nước mắt, toảt mồ hôi, đỏ bừng mặt, đau quặn bụng hoặc
tiêu chảy (xảy ra trong hoặc ngay sau khi truyền ìrinotecan)
ịRụng tỏc hoân toản= Cấp độ 2
Bao gồm đau thắt ngực, huyết khối dộng mạch, nhồi mảu não, tai biến mạch mảu não, víêm tắc tĩnh mạch sâu,
nghẽn mạch chi dưới, ngừng tim, nhổ1 mảu oo tím, thìểu máu cục bộ cơ tim, rối loạn mạch ngoại bìên, thuyên tắc
phổi, đột từ, viêm tắc tĩnh mạch, huyết khối, rối loạn mạch máu
Liêu nháp đơn tri liêu buớc 2
Lịch trình liều hảng tuần
Trong ba nghiên cứu lâm sảng đảnh giả lịch trình líễu hâng tuần, 304 bệnh nhân ung thư di căn đại trâng
hoặc trưc trảng đã tái phảt hoặc tiến triển sau liệu pháp 5-FU đã được đìều trị với innotecan 17 bệnh
nhân tử vong trong vòng 30 ngảy dùng irinotecan; trong 5 trường hợp (1,6%, 51304),tử vong là có khả
năng rlỉẽn quan dến thuốc. ] bệnh nhân tử vong vì nhỉễm trùng huyết do gíảm bạch cằu trung tính mã
không sốt Sốt giảm bạch cầu trung tỉnh xảy ra ở 9 (3, 0%) bệnh nhân khác ,nhưng bệnh nhân nảy phục
hồi vớ1 chăm sỏc hỗ trợ
119/304 (39,1%) bệnh nhân nhập vỉện do cảc tảc dụng phụ; 81 (26,6%) bệnh nhân nhập viện do các biến
cố được đánh giá có 1ỉên quan đển việc dùng irinotecan. Những lý do chính cho vỉệc nhập viện liên quan
đến thuốc lá tiêu chảy, có hoặc không có buồn nôn vả/hoặc nôn (18, 4%]; giảm bạch câu trung tính/giảm
bạch cầu, có hoặc không có tiêu chảy vâ/hoặc sốt (8,2%); vả buồn nôn vả/hoặc nôn (4, 9%)
Liễn đầu tiên cùa it nhất một chu kỳ irỉnotecan đã được giảm cho 67% số bệnh nhãn bắt đầu nghlẽn cửu ở
liều khời đầu 125 mg/mẫ Giảm líều trong chu kỳ đã được yêu cầu cho 32% chu kỳ bắt đầu ở mức líều
125 mglm². Những lý do phố biển nhất cho gíảm liều là tiêu chảy muộn, giảm bạch cầu trung tính, và
giảm bạch cầu. 13 (4, 3°/o) bệnh nhân ngừng điểu trị với ìrỉnotecan vì cảc tảo dụng phụ. Các tảo dụng phụ
trong Bảng 8 dựa trên kinh nghiệm của 304 bệnh nhân tham gia trong ba nghiên cứu được mô tả trong các
nghiên cứu lâm sảng.
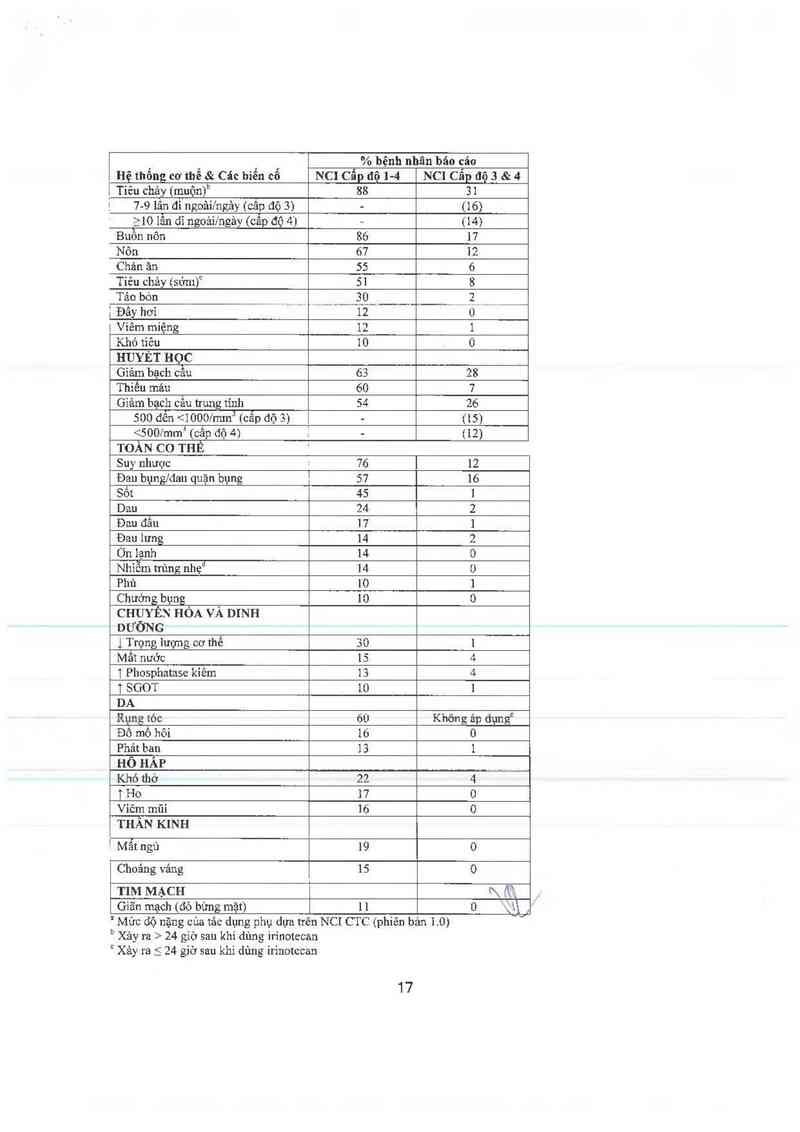
Bâng 8: Các tảc dụng phụ xảy ra ở >10% trong số 304 hệnh nhân ung thư biễu mõ đại trânch
trực trâng di căn đã được điều trị trươc đó
% bệnh nhân bảo cáo
Hệ thổng cơ thể & Các bìển cổ NC] Cẩp dộ … NCI Cẩp độ 3 & 4
TIÊU HOA
16
nhân bảo cáo
H th cơ thể & Các biến cố 1-4 NC]
Tiêu
7-9 đi
>10 di
nôn
Nôn
Chán ăn
Tiêu
Tảo bón
hơi
Viêm
Khó tiêu
T I-l
Giảm
' mảu
Gìảm tính
500 <1000/mm
<500/mm 4
T0 CO
Đau đau
Dau
]
Phù
Chướn
' H A V DINH
DƯỞNG
T cơ 30
nước 15
kỉ 13
SGOT 10
DA
tóc 60
mô hôi 16
Phảt ban 13
H
Khó thủ 22
HO 17
Viêm mũi 16
KINH
. M ngủ 19
Choáng váng 15
TIM CH
Giãn đỏ 1 l
" Mức dộ nặng cùa tảo dụng phụ dựa trên NCI CTC (phiên bản 1.0)
b Xảy ra > 24 gíờ sau khi dùng irinotecan
“ Xảy ra 5 24 giờ sau khi dùng irinotccan
17
31
1
14
17
12
6
° Chủ yểu nhiễm trùng đường hô hẳp trên ,
' Không ảp dụng; rụng tóc hoân toản = NCI câp độ 2
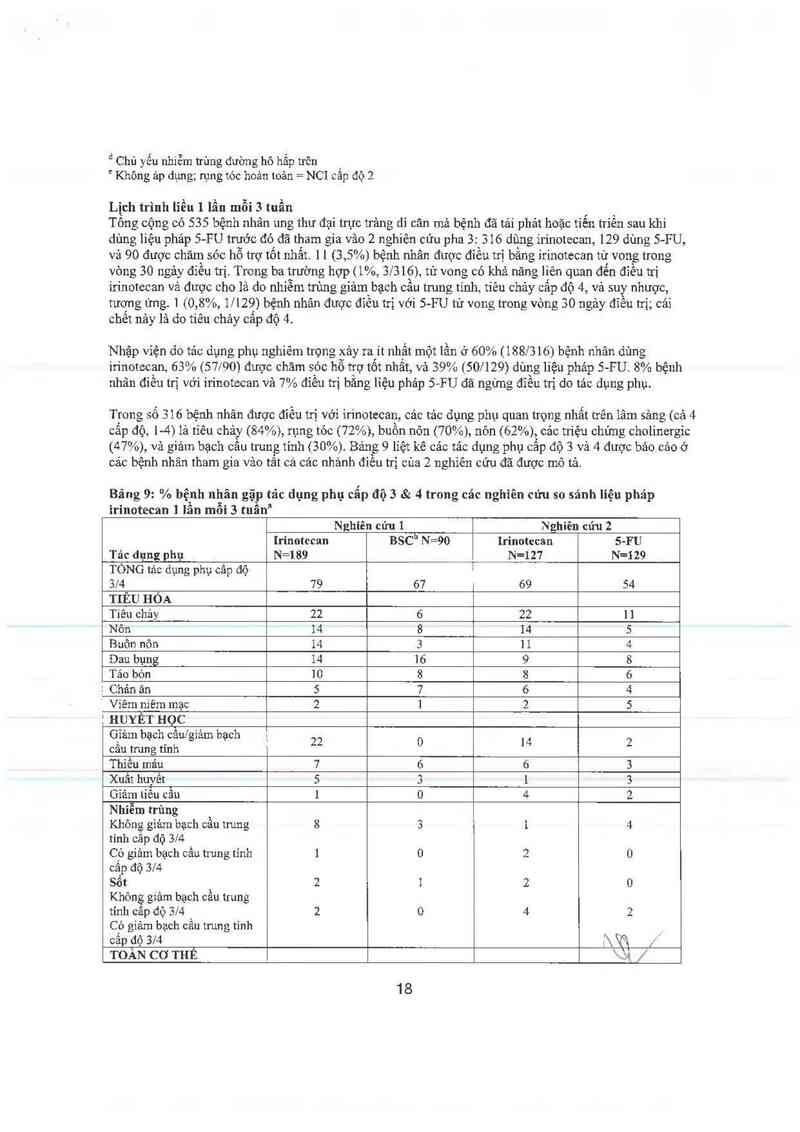
Lịch trình liều 1 lần mỗi 3 tuần _
Tồng cộng có 535 bệnh nhân ung thư đại trực trảng di căn mả bệnh đã tải phảt hoặc tiến triên sau khi
dùng liệu phảp S-FU trước đó đã tham gia vảo 2 nghiên cứu pha 3: 316 dùng írinotecan, 129 dùng 5-FU,
vả 90 được chăm sóc hỗ trợ tốt nhắt ] l (3, 5%) bệnh nhân được điểu trị bằng irinotecan tử vong trong
vòng 30 ngảy đỉễu trị. Trong ba trường hợp (1%, 3/316), tử vong có khả năng liên quan đển đìều trị
innotccan vả được cho lả do nhiễm trung,, ũrìảm bạch cầu trung tính, tiêu chảy cấp độ 4, vả suy nhược,
tương ứng. 1 (0, 8%, 1/129) bệnh nhân được đỉều trị vởi 5- FU tử vong trong vòng 30 ngảy đỉều trị; cải
chết nảy lả do tiêu chảy câp độ 4.
Nhập vỉện đo tảc dụng phụ nghiêm trọng xảy ra ít nhất một lần 0 60% (188/316) bệnh nhãn dùng
irinotecan, 63% (57l90) được chăm sóc hỗ trợ tốt nhất, và 39% (50! 129) dùng liệu pháp 5-FU. 8% bệnh
nhân điều trị với irinotecan và 7% điều trị bằng liệu pháp 5-FU đã ngừng đỉều tu do tác đụng phụ
Trong số 316 bệnh nhân được điều trị với ìn`notecan, cảc tảo dụng phụ quan trọng nhất trên lâm sảng (cả 4
cấp độ, 1-4) lả tỉêu chảy (84%), rụng tỏc (72%), buồn nôn (70%), nôn (62%), cảc triệu chửng cholinergìc
(47%), và gỉảm bạch cằu trưng tỉnh (30%). Bảng 9 lỉệt kê các tảc đụng phụ cẳp độ 3 và 4 được báo cảo ở
các bệnh nhân tham gia vâo tất cả cảc nhánh điều trị cùa 2 nghiên cứu đã được mô tả.
Bảng 9: % bệnh nhãn gặp tảc dụng phụ cẩp độ 3 & 4 trong các nghiên cửu so sánh liệu pháp
ìrinotecan ] lần mỗi 3 tuẫn
Nghiên cứu 1 Nghiên cún 2
Irinotccan BSCb N=90 Irinotecan 5-FU
Tảc dụng phụ N=189 N=127 N=129
TÒNG tản: dụng phụ cắp độ
3/4 79 67 69 54
TIÊU HÓA
Tiêu chảy 22 6 22 11
Nôn 14 8 14 5
Buôn nôn 14 3 1 1 4
Dau bụng 14 16 9 8
Tảo bón 10 8 8 6
E Chản ản 5 7 6 4
' Viêm niêmmạc 2 1 2 5
' HUYẾT HỌC
Gẫỉảm bạchcẫw’giảm bạch 22 0 l 4 2
cau trung nnh
Thiếu mảư 7 6 6 3
Xuất huyết 5 3 1 3
Giảm tiêu cẫu 1 o 4 2
Nhiễm trùng
Không gìảm bạch cầu trung 8 3 1 4
tinh câp độ 3/4
Có giảm bạch cấu trung tính 1 0 2 0
cẳp độ 374
Sổt 2 1 2 0
Không gíảm bạch cầu trung
tính câp độ 314 2 0 4 2
Có gỉảm bạch cầu trung tỉnh ,
cấp độ 374 =Ầ % ; `
TOÀN cơ THẺ N`JẶ /
18
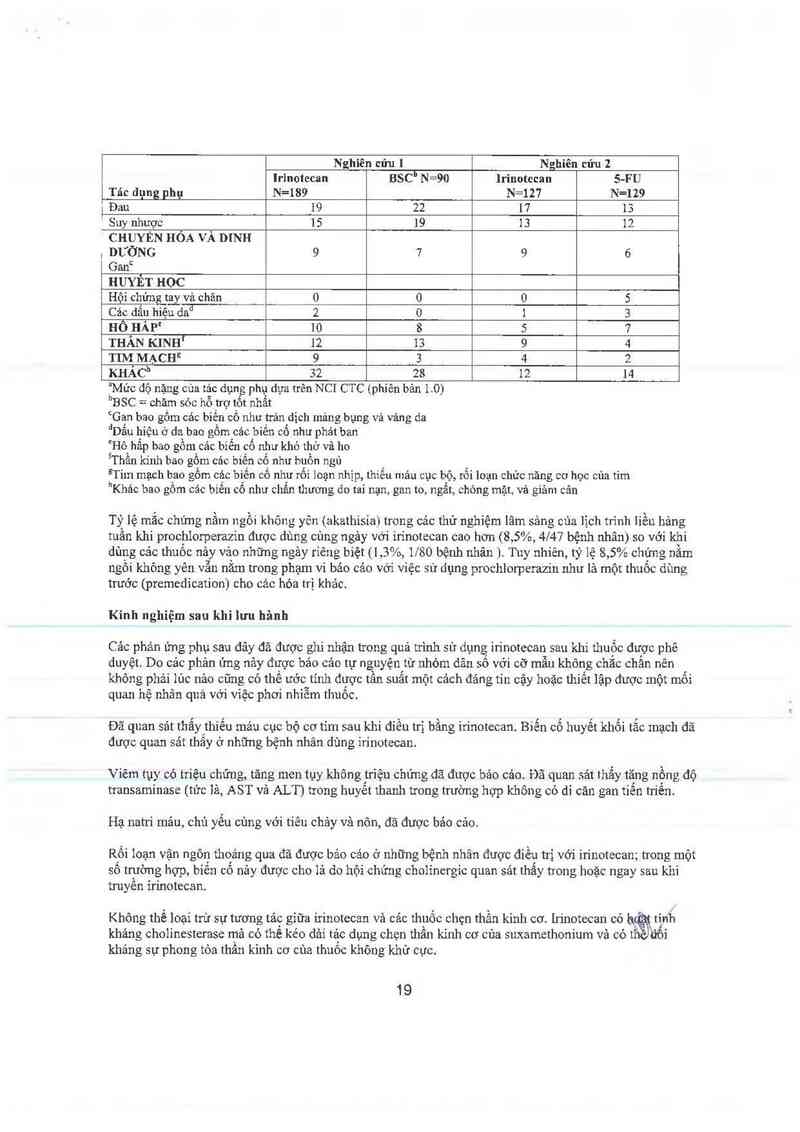
Nghỉẽn cửu 1 Nghiên cửu 2
lrinolecan BSCIÌ N=90 lrinotecan 5-FU
Tác dụng phụ N=189 N=127 N=129
| Đau 19 22 17 13
Ể Suy nhược 15 19 13 12
' CHUYÊN HÓA VÀ DINH
, DƯỜNG 9 7 9 6
Ganc
HUYẾT HOC
Hội chứng tay và chân 0 0 0 5
Cảo dấu hiệu dad 2 o 1 3
HỒ HẤP“ 10 8 5 7
THẨN KINH' 12 13 9 4
TIM MẠCH² 9 3 4 2
KHẢỞ' 32 28 12 14
"Mức dộ nặng cùa tảc dụng phụ đựa trên NCI CTC (phiên bản 1 O)
bBSC= ohăm sỏc hỗ ượ tốt nhất
°Gan bao gồm cảc biền cô như trản dịch mảng bụng vả vảng da
dDẫu hiệu 0 da bao gồm các bìến cổ như phải ban
Hô hấp bao gồm cảc biến cổ như khó thở và ho
ÍThần kinh bao gõm các biến cổ như buồn ngủ
IITim mạch bao gõrn các biến cổ như rối loạn nhịp, thiểu mảu CỤC bộ, rối loạn chức năng cơ học của tim
hKhác bao gồm cảc biến cổ như chẩn thương do tai nạn, gan to, ngắt, chóng mặt, và giảm cân
Tỷ lệ mắc chứng nầm ngỗi không yên (akathisia) trong các thử nghiệm lâm sảng của 1ịch trình liều hảng
tuần khi prochlorperazỉn được dùng cùng ngảy với irínotccan cao hơn (8,5%, 4147 bệnh nhân) so với khi
dùng cảc thuốc nảy vảo những ngảy rĩêng biệt (1,3%, 1/80 bệnh nhan ) Tuy nhiên, tỷ lệ 8, 5% chúng nằm
ngõi không yên vẫn nằm trong phạm vi báo cảo với việc sử đụng prochlorperazin như là một thuốc dùng
trước (premeđìcation) cho cảc hóa trị khảc.
Kinh nghiệm sau khi lưu hânh
Các phản ứng phụ sau đây đã được ghi nhận trong quá trình sử dụng irinotecan sau khi thuốc được phê
duyệt. Do cảc phản ứng nây được báo các tự nguyện từ nhỏm dân số với cỡ mẫu không chắc chẳn nên
không phải lủc nảo cũng có thể ước tỉnh được tần suất một cảch đảng tin cậy hoặc thiết lập được một mối
quan hệ nhân quả vởi việc phơi nhiễm thuốc.
Đã quan sảt thấy thiếu mảu cục bộ cơ tỉm sau khi điều trị bằng irinotecan. Biến cố hưyết khối tắc mạch đă
được quan sảt thây ở những bệnh nhân dùng irinotecan.
Viêm tụy có triệu chửng, tăng men tụy không trìệu chứng đã được báo cản. Đã quan sảt thắy tăng nồng độ
transaminase (tức 1ằ, AST vả ALT) trong huyết thanh trong trường hợp không có di căn gan tiến triển
Hạ natri mảu, chủ yếu cùng với tiêu chảy và nôn, đã được bảo Cảo.
Rối Ioạn vận ngôn thoáng qua đã được bảo cảo ở những bệnh nhân được điều trị với irinotccan; trong một
số trường họp, biên có nảy được cho lả do hội chửng cholỉnergỉc quan sảt thây trong hoặc ngay sau khi
truyên irinotecan.
Không thể loại trừ sự tương tảc giữa irinotecan và các thuốc chẹn thần kinh cơ. Innotecan có 11 tỉnh
khảng cholinesterase mã có thế kẻo dải tảc dụng chẹn thần kính cơ của suxamethonium vả có 1 ỏốỉ
kháng sự phong tỏa thần kình cơ cùa thuốc không khử cực.
19
TƯỢNG TÁC THUỐC
5-Fluorouracil (S-FU) vã Leucovorin (LV)
Trong một nghiên cứu 1âm sảng pha ] hên quan đến irinotccan, 5-fiuơrouracil (5 FU) vả leucovorin (LV)
ở 26 bệnh nhân có khối u rân, innotccan không bị thay đổi đảng kể khi cảc thuốc được dùng phối hợp.
Mặc dù Clmx vả AUC,» 24 của SN-38, chất chuyền hỏa có hoạt tinh, g1ảm xuống (14% và 8%, tương ứng)
khi dùng irìnotecan rồi sau đó dùng 5-FU vả LV so với khi dùng irinotccan đơn độc, tnnh tự sử đụng nảy
được dùng trong cảc thư nghiệm kểt hợp và được khuyến cảo. Các nghíên cứu tương tảc thưốc chính thức
trên in vwo vè ín vỉtro để đánh giá. ảnh hưởng của irinotccan đối vởi S—FU vả LV chưa được tiễn hảnh.
Cảo chẩt gây cảm ứng CYP3A4 mạnh
Thuốc chông co ziât vả cảc thuốc ưâv cảm 1’me manh khảo: Phơi nhiễm với ínnotecan vả chắt chuyến
hỏa có hoạt tinh SN- 38 bị giảm đáng kể ở người lớn vả bệnh nhi dùng đổng thời thuốc chống co giật gây
cảm ứng CYP3A4 như phenytoin, phenobarbital hay carbamazepin. Liều khởi đầu thích hợp cho bệnh
nhân dùng các thuốc chống co g1'ật nảy hoặc cảc thuốc gây cảm ứng mạnh khảo như rifampin vả rifabutin
chưa được xảo định. Cần xem xét để thay thế phương phảp đìều trị không gây cảm ứng enzym ít nhẩt 2
tuẫn trưởo khi bắt đầu điều trị írínotecan.
Cò St. John: Phơi nhỉễm với chẳt chuyền hóa có hoạt tính SN-38 bị giảm ở bệnh nhân dùng có St. John
đồng thời. Nên ngùng cò St. John ít nhẩt 2 tuần trước chu kỳ đầu tỉên của innotecan, vả chống chỉ định
dùng có St. John trong khi điểu trị bằng irinotecan.
Dexamethasone. một chẳt cảm ửng vừa phải CYP3A4, dường như không lảm thay đối dược động hỌc của
irinotecan.
Cảc chẫt ức chế mạnh CYP 3A4
Ketoconazol lả một chất ức chế mạnh cnzym CYP3A4. Bệnh nhân dùng ketoconazol đồng thời đã tăng
phơi nhiễm với irinotccan vả chất chưyến hỏa có hoạt tinh SN 38 Bệnh nhân nên ngừng ketoconazol ít
nhất 1 tuần trước khi bất đằu điều trị irinotccan vả chống chỉ định dùng ketoconazol trong khi điều trị
bằng irinotccan.
Atazanavir Sulfat
Dùng đồng thời atazanavỉr sulfat, một chất ưc chế CYP3A4 vả UGT1A] có tiềm năng tăng phoi nhiễm
toản thân vởi SN-S8, chắt chuyền hỏa có hoạt tính của ín'notecan. Các bác sĩ nên cân nhắc điều nây khi
dùng đồng thời cảc thuốc nảy.
Tương tấc thuốc vói xét nghỉệnm
Không có tương tảc được bỉết đên giữa in'notccan vả câc xét nghiệm trong phòng thí nghiệm.
Tương tác ưiữa ỉrinotecan vả các chất chen thần kỉnh cơ không thể được loại trừ. Do iri.notccan có hoạt
tỉnh khảng chohncsterasc, cảc thuôo kháng cholincsterasc có thẻ kéo dâi tảc dụng chẹn thân kinh cơ của
suxamethonium và có thẻ đôi khảng sự phong tóa thân kinh cơ cúa cảc thuôc không khư cực.
Tượng tác chung cho tẩt cả các chẩt gãy độc tế bâo: f
Việc sử dỤHg các thuốc chống đông mảu là phổ biến do tăng nguy cơ biến cố huyết khôi trong cảc bệnh
khối ư. Nếu thuốc chống đông máu đối khảng vitamin K được chỉ định, cần phải tăng tần suất theo đôi
INR (hệ số bình thường hóa quốc tế) do chỉ số điều trị hẹp cùa cảc thuốc nây, biến thiên cao giũa Êầc cá
thể vẻ khá nãng thúc đẳy hinh thảnh cục mảu đông trong mảu và khả năng tương tác giưa các athuẩưilhống
đông đường uỏng vả hóa trị chống ung thư.
20
Sứ dung đồng thời bi chống chỉ đinh
- Văc-xin sôt vảng: nguy cơ phản ửng toản thân với vãc-xin gây tử vong
Sử dung đồng thời không đươc khuvến cảo
- Vắc-xin sống giâm độc lực ( trư bệnh sốt vảng): nguy cơ bệnh toản thân, có thể gây tử vong (ví dụ như
nhiễm khuẩn) N guy cơ nảy tăng lên ở những đối tượng vốn đã bị suy giảm miễn dịch do bệnh cơ bản cùa
họ.
Sử dụng một loại vắc-xin bắt hoạt khi có nguy cơ nảy (bại liệt)
- Phenytoín: Nguy cơ đợt co giật đo giảm hẩp thu phenytoin qua đường tiêu hỏa gãy ra bới thuốc gây độc
tê bảo hoặc nguy cơ tãng độc tỉnh do tăng chuyền hỏa ở gan bởi phenytoin.
Sử dung đồng thời cần cân nhắc
~ Ciclosporin, Tacrolimus: ức chế miễn dịch quá mức với nguy cơ tăng nhanh lympho bảo. Không có
bằng chứng cho thấy độ an toản cùa irinotccan bị ảnh hưởng bởi Cctuximab hoặc ngược lại.
Kết quả từ một thử nghiệm tương tảo thuốc-thuốc chuyên biệt cho thẳy bcvacizumab không có ảnh hướng
đảng kế trên dược động học của irinotecan vả chẩt chuyển hỏa có hoạt tỉnh SN-38. Tuy nhiên, điều nảy
không ngăn được bất kỳ sự tãng độc tính do đặc tính dược lý cùa chủng.
SỬDỤNG (3 CÁC NHÓM ĐÓI TƯỢNG cụ mí:
Mang thai
Phản loại thai kỳ D
Irinotecan có thể gây hại cho thai khi dùng cho phụ nữ mang thai Phỏng xạ liên quan đến 14C- irinơtccan
đi qua được nhau thai cùa chuột sau khi dùng 10mg/kg theo đường tĩnh mạch (mã trong cảc nghiên cứu
riêng biệt tạo ra C,… và AUC irinotccan lần lượt khoáng 3 vả 0, 5 ìần cảc giá trị tương ửng ở những bệnh
nhân dùng 125 mng ). Tiêm tĩnh mạch irinotecan 6 mg/kg/ngảy cho chuột cỏng và thỏ nong thời kỳ
hinh thảnh co quan đẫn đến tăng tổn thất sau cẳy vả giảm sô lượng bảo thai sỏng. Trong các nghiên cứu
riêng biệt ở chuột cống, liều nảy tạo ra C,… vả AUC irinotecan lần lượt khoảng 2 và 0, 2 lần cảc giá trị
tương ứng ở những bệnh nhân dùng 125 mg/mz. Ở thò, liều gây độc phôi lả khoảng một nứa liều khởi đầu
khuyến cáo hảng tuần trên người tính theo mg/m².1rinotecan gây quải thai ở chuột cống với liều lớn hơn
1 ,2 mg/kg/ngảy và ở thỏ với liều 6, 0 mg/kglngảy. Trong cảc nghiên cứu riêng biệt ở chuột cống, liều nảy
tạo ra Cmmẵ vả AUC irinotecan lần lượt khoảng 2/3 vả 17'40 cảc giá trị tương ứng ở nhưng bệnh nhãn dùng
125 mg/mz. Ở thò, líểu gây quải thai là khoảng một nửa liều khới đầu khuyến cảo hảng tuần ở người tỉnh
theo mg/mz. Tảo dụng gây quải thai bao gôm một loạt các bất thường bên ngoải, nội tạng và xương
Irinotccan dùng ở chuột cống mẹ trong giai đoạn sau hình thảnh cơ quan đến qua cai sữa ở liền 6
mg/kg/ngảy gây giảm khả năng học tập và giảm trọng lượng cơ thể chuột cải con.
Chưa có nghiên cứu đầy đủ vả được kiểm soát tốt cùa irinotecan ở phụ nữ mang thai. Nếu thuốc nảy được
sử dụng trong khi mang thai, hoặc nếu bệnh nhân có thai trong khi đùng thuốc nảy, phải thông báo cho
bệnh nhân về những nguy hiểm tiềm tảng với thai nhi. Phụ nữ có tiềm năng mang thai phải được khuyên
nên trảnh có thai trong khi đang được điều trị với irinotccan
Khuyên bệnh nhân dùng hiện pháp trảnh thai trong vả sau khi dùng thuốc tới 1 thảng với nữ vả 3 thảng
với nam.
Phụ nữ cho con bú
Phỏng xạ xuất hiện trong sữa chuột cống trong vòng 5 phút tiêm tĩnh mạch irinotccan đảnh dấu phóng xạ
và có nồng độ lên đển 65 lần ở 4 giờ sau khi tiêm so với nồng độ trong huyết tương Irỉnotecan
hydrochlorid lảm suy gíảm khả năng học tập vá găy chậm phảt triển sau sinh ở chuột công. Không biết
liệu thuốc có bải tiết vâo sữa mẹ Vì có nhiều thuốc bải tiểt vảo sữa mẹ và vì những tiễm nărỄg ẩâặẵjiản
ứng phụ nghiêm trọng từ irinotccan ở trẻ bú mẹ, cần quyểt định cho trẻ ngùng bú hoặc mẹ ngưng ỏc,
có tính đển tầm quan trọng cùa thuốc đối vởi người mẹ.
21
Sử dụng cho trẻ em
Hiệu quả cùa irinotccan ở bệnh nhi chưa được thiết lập. Kết quả từ hai nghiên cứu nhãn mơ, đơn nhảnh đã
được đảnh giá. 170 trẻ em có khối u rắn khó trị đã được đưa vảo một thử nghiệm pha 2 trong đó
in`notecan 50 mgfrn2 được truyền trong 5 ngảy liên iiếp mỗi 3 tuần. Đã có 54 (31,8%) bệnh nhân bị giảm
bạch cằu trung tính cấp độ 3-4. Giảm bạch câu trung tỉnh vởi biến chứng sốt xảy ra ở 15 (8,8%) bệnh
nhân Tiêu chảy cấp độ 3-4 được quan sảt ở 35 (20,6%) bệnh nhân. Hồ sơ tảc dụng phụ nảy có thể sánh
với khi quan sát ở ngưòi lớn Trong thư nzghiệm pha 2 thứ 2 ở 21 trẻ em có ung thư mô liên kết trước đây
không được điếu trị, irinotccan 20 n1g/m2 được truyền trong 5 ngây liên tiêp vảo tuần 0, 1, 3 và 4. Liệu
pháp đơn trị liệu nảy được tiếp nối bằng liệu phảp đa phương pháp. Tích lũy vảo giai đoạn irinotecan đơn
tn_ liệu được tạm dừng đo tỷ lệ cao (28,6%) bệnh tiến triển và tử vong sớm (14%) Hồ sơ tảo dụng phụ
trong nghiên củu nảy khảc với tảc dụng phụ quan sảt thấy ơ người lớn; tác dụng phụ cấp độJ hoặc 4 quan
trọng nhẩt lả mất nước quan sát được ở 6 bệnh nhân (28,6%) kết hợp với hạ kali mảu nặng ở 5 bệnh nhân
(23,8%) và hạ natri mảu ở 3 bệnh nhân ( 14,3%); ngoải ra, nhiễm trùng cẳp độ 3-4 đã được bảo cảo ở 5
bệnh nhân (23,8%) (qua tẩt cả cảc đợt điểu trị và không kể quan hệ nhân quả).
Cảc thông số dược động học cùa irinotccan vả SN-38 được xác định trong 2 thử nghiệm khối u rắn ở trẻ
em với cảc mức liều 50 1'ng/rn2 (truyền 60 phủt, n=48) và ]25 mg/rn2 (truyền 90 phủt, n=6). Thanh thải
in'notecan (trung binh i SD) lả 17, 3£ 6, 7 L/giờỉm2 với liều 50 mg/m2 vả 16,2 i- 4,6 L/giòtlm2 với liều 125
mg/mz, mức nảy có thể so sánh với ngưòi lớn. Liều bình thường SN 38 giá trị AUC có thế so sánh giữa
người lớn vả trẻ em. Đã quan sảt thấy tích iũy tối thiểu của irinotecan vả SN—38 ở trẻ em trên chế độ liều
hảng ngảy [hảng ngảy x 5 mỗi 3 tuân hoặc (hảng ngảy x 5) x 2 tuần mỗi 3 tuẫn].
Sử dụng cho bệnh nhân cao tuổi
Cẩn theo dõi chặt chẽ bệnh nhãn trên 65 tuổi vì nguy cơ lớn hơn bị tiêu chảy sớm và muộn ở nhóm đối
tượng nảy. Liều khới đẫu cùa innotecan ở bệnh nhãn >70 tuồi với lịch trình liều một lần mỗi 3 tuần nên 1ả
300 mg/m".
Tần suất tiêu chảy muộn cấp 3 và 4 theo độ tuối lớn hơn đáng kể ở những bệnh nhân >65 tuối so với ở
những bệnh nhân <65 tuối (40% [531133] so với 23% [40/171]; p= 0 ,.002) Trong một nghiên cứu khảo
trên 183 bệnh nhân điếu trị với lịch trình hèng tuần, tần sụất tiêu chảy muộn câp 3 hoặc 4 ở bệnh nhân
ì65 tuồi lả 28,6% [26/91] và ờnhững bệnh nhân < 65 tuối iâ 23,9% [22192].
Bệnh nhân Suy thận
Ành hưởng của suy thận trên dược động học cùa ỉrỉnotecan chưa được đánh giả. Vì vậy, cần sử dụng thận
trợng ở những bệnh nhân suy chức nảng thận. Không khuyến cáo dùng irinotecan ở bệnh nhân chạy thận
nhân tạo.
Bệnh nhân Suy gan
Thanh thải innotccan giảm ở bệnh nhân suy gan trong khi phơi nhiễm với chắt chuyển hóa có hoạt tinh
SN- 38 tãng tương đối so với ở những bệnh nhân có chửc nãng gan bình thường. Mức độ ảnh hưởng tỷ lệ
thuận với mức độ suy gan được đo bằng sự tã.ng tống nồng độ bilirubin vả transaminase. Vì vậy, cân sử
dụng thận trợng ở bệnh nhân suy gan. Khả năng dung nạp cùa irinotccan ở bệnh nhân có rốiAl chức
năng gan (bilirubin lớn hơn 2 mgde) chưa được đảnh giả đẩy đủ, và hiện vẫn chưa có khuyến c _thfiều
dùng
ẨNH HƯỞNG ĐẾN KHẢ NĂNG LÁI XE VÀ VẶN HÀNH MÁY MÓC
22
Bệnh nhân cần được cảnh bảo về khả năng choáng vảng hoặc rối loạn thị giác có thể xảy ra trong vòng 24
giờ sau khi đùng irinotecan, và khuyên không nên lải xe hay vận hânh máy mỏc nếu các triệu chứng nảy
xảy ra
QUÁ LIÊU
Trong cảc thử nghiệm pha 1 tại Mỹ, liều duy nhất lên đểu 345 mg/m2 irinotecan được dùng cho bệnh nhân
ung thư khác nhau. Liêu duy nhất lên đến 750 mgjm2 irinotecan đã được sử dụng trong các thử nghiệm
ngoâỉ nước Mỹ. Các tảc dụng phụ ở những bệnh nhãn nảy cũng tương tự như các tác dụng phụ được bảo
cảo với liều vả phảc để khuyến cảo.
Đã có báo cáo về quá liều ở liều lên đểu khoảng hai lần liều đíều trị khuyến cáo, 1iểu nảy có thể gây tử
vong. Cảc phản ứng phụ quan trọng nhẩt được báo cáo là giảm bạch câu trung tinh nghiêm trọng và tiêu
chảy nặng. Không có thuốc giải độc đã biết nảo cho quá liều ỉrinotecan Châm sỏc hỗ trợ tối đa nên được
thực hiện để ngăn chặn tình trạng mất nước do tiêu chảy và đề đỉều trị bất kỳ biến chứng nhíễm trùng nảo.
TÍNH TƯỢNG Kỵ
Không áp dụng.
ĐIỀU KIỆN BÀO QUẢN
Bảo quản dưới 30°C, trảnh ánh sảng. Không đề đông lạnh.
HẠN DÙNG ,
24 thảng kê từ ngảy sản xuât
TRÌNH BÀY
Irihope 40mg/2ml: Hộp 1 lọ 2ml.
Iríhope lOOmg/Sml: Hộp 1 lọ Snal.
Thuốc nây chỉ dùng theo đơn của bác sỉ.
Đọc kỹ hưởng dẫn sử dụng trước khi dùng.
Đê xa tầm tay trẻ em
Nếu cẩn thêm thông tin xin hỏi ý kiểu bảc sĩ ,
Thông bảo cho bảc sĩ những tác dụng không mong muốn gặp phải khi sử dụng t
Sân xuất bởi
Glenmark Generics S.A.
Calle 9 N° 593 (BlõZ9MAX) Parque Industrial Pilar,
Provincia de Bucnos Aires, Ac-hen-ti-na
Sân xuất cho
Glenmark Pharmaceuticals Ltd.
B/2, Mahalaxmi Cha_mbers 22, Bhulabhai Desai Road,
Mumbai - 400 026, An Độ
23 TUQ.CỤC TRLÙNG
P.TRLỦNG PHÒNG
Ỹẵạm gổ: "VaPn ẩfcịnẨ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng