
















\ R ./f—~x.
ME» …en chứa 250 mg genunib. ' ị
Vrản nén bao phim. Hộp 1 túi nhỏ… 1 3 vì x vo vrèn nén bao phịm. `
® Chỉ dinh. cách dùng. chong chỉ dinh vả những lhỏng tin khảo-
xin dọc Iớ Huởng Dẫn Sử Dung Thuỏc
Khỏng bảo quản qua 30"C. Bảo quản trong bao bì gõc.
' ' ' THUỐC BẢN THEO Đơn. ĐỀ XA TAM TAY TRẺ EM.
.` geffflmb 250 mg ĐỌC KỸ HƯỞNG DAN sứ DỤNG TRƯỜC KHI DÙNG.
lũ… J.,
VS'SỂỦI
Nhã sản xuất: AstraZoneca UK Limited. Silk Road Business Park.
Macelesũeld. Cheshire. SK10 2NA. Anh.
Xuất xứ: Anh.
Số lô SX. NSX, HD: xem "LOT'. "MADE'. 'EXP" lrên bao bl.
SDK: VN-XXXX-XX
… \
` \
\
um… ….. . . `
…… .. …
I ASÍ raZenecaở
ư'
….ưJl !
pmum1 ›m Z…Nv '… ~ … ư… … H
L29660d
enauaz ausv
6… oge q…uụaô
Slelqm os YSSỄlH/I Ể Ề\ ả
6… 098 =
uaumma ao mm 10 mo am
3NIOIIBW A1NO NOIMIHOSBHA 8
Do nm slnre abcve 30 'C Slan … me onqmal cackngn
… g mm… f ›J w ….,… … w3
@MĐJ’
e…Aj uznmỵa v_o.ụ p.;… .g..d
£ỂF
ẽì Í
—fy
ỵđ
.fề
ĩì
ĐẠI ỮỆN
vẦu PHòf-ỉ\ .
w THẢMH ~
»/
z
uJ
Viewed from Iidding foil side
cn! mun
i.…w
Ầụ.Q .ựr:ỉ
@
*
….ỸwÍ
\…
. z: Boãmẫẳ
_.`. ›…ễoẳẵ uE
__, ẵ
.Êẵẻ.
;( jễ
» EE …! .…x …
\r ồ_
!… Suẩnẵẵ
ìẵẩ
_
_
_
_
_
.. o.:Ễw _
_
_
I(fẳ
›x Ia: co ml.
1 »O: .
Éễ. . …ẵắ
Ìsẫỉẵ
ẳ
_ Ê.…Ếc ..
ẫ….
_ mã:Ễ
on n.x
ằfb. ..………/
_
z. » EẤnx…/…
/ ồ: …
ẫẩ
.…….……..Ẹ...ẵ .
:
Ê
E
.ẵa
<…mmắ
.» EE ẫv ux …
…O..
K: cỂẫ
›: ẫầuưẾ
Ể
......EỄ .:
mẾ\…
'NB FOR HAPA ARTWORK PLEASE MATCH
VARẢABLE DATA AREA TO THE ARTWORK
,
/'
Hesewnú Area ior lanaoie Un
!exf Dn'echor
ầ/
ỄỂ
6.0 pt
Ở
6
m
P
\
Technical Info
Non Print:
6.0 pt
Printable Colnurs:
Black
lressa 250mg Foil: Print Mat VN
454222-A01
22-12-14
T4410LV1 P
NIA
KW
Bar prints 100mm @ 100%
nps Gomponent Code: P039628
Schawk lob Nu.:
Bate:
Drawing Ret:
Pharma Cuda:
Description:
Croated By:
>mẩNmzmnm AỸ
4- unwind direction
windlng dlagram no. 3
_.fjỄửeE pỂỊ›
&" vỉ… PHQNG g
; ĐAlDìẸN _
From; › Mmkl'. Pan ho Bag.c anzc : menmnm …q Crealư 5y anem zi À Arrcrẹeu by Annoed cy \ ẮÌíÁcurm
AstraZenecaậ F²ow wraD fc<ì ` °01218? 001215² Flpl le…g1hmo 00 WM" " '” \ `Ẩ'² "`"“"' '“Na'” .' PMS 343 Grun
_ (lressa) m WICỈh … oo TT _ ___ _ www Backwash
PGU ` Hei_th no «› nm. Dutt o… Daln
m…wwvmm. 1 C’ 1 1~ m e? .
| \U; m THẦNH PHỊa Qj IT
This area Ieft tegt froe _ _ HỒ GHÍ MWH /
for applymg vanable data/regnstratvon numbers etc. .1 V Ềỳ
A /\ A A A A /\ /\
IRESSA IRESSA IRFSSA IRESSA IRESSA IRESSA IRESSA IRESSA
MM” mmứ"mltub anủ mủ mam… Mm g'mn'b Poman
mm @ ĩmsì ĩm”sì ẵẵssÌ @ ĩnsì Ĩm=sÌ
gununm gom… goũtinlb wma qeũum» g…nlb gemìnb gefflmb
^ ẾESSÌ ĨREẸÌ IRESSA [RESSA Ĩnẫ ĨREỀẵ ỂỄSA
ngtinb gofnimb qefmnia … noffflnỉb geũttnlb gemìrib guũtiúíb
A A A A A A A »"
IRFSSA IRESSA IRESSA IRFSSA lRESSA IRESSA IRESSA lRESSA
gditìnib gofltlnib gdeb gohurib goficinib gefmnib
----- … -- …—---— —1RESSA…lRESủ—Ệkfflì—ỂRỆ…ĨREỀ [RẸSSk— ẾfSỀ ĨREỈSA
MIInID gofttlnũb gdlllnb gofflmìb gelìlìnìb
This area Ioft text free
for appIyõngvadable daa/rogiatraũon numbers om.
] \ I_
LOT XXXX custou wma um.
EXP DD-MM-YY Ẹgcgìzfm°Ẹậịỉgản
MADE DD—MM-YY ……men
,..f
HƯỞNG DÃN sứ DỤNG THUỐC CHO NGƯỜI BỆNH
IRESSA®
Gefitinib 250 mg
Viên nén bao phim
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Để xa tắm tay trẻ em.
Thông báo ngay cho bảc sỹ hoặc dược sỹ những tác dụng không mong muổn gặp phải
khi sử dụng thuốc.
Thuốc nảy chỉ dùng theo đơn của bác sỹ.
THÀNH PHÀN VÀ HÀM LƯỢNG CÙA THUOC:
Mỗi viên chứa:
Hoat chất: Gefitinib 250 mg
Tá dươc: Lactose monohydrat, cellulose vi tinh thể, croscarmellosepatri, povidon, 'natri laurilsulfate,
magnesi stearat, hypromellose, macrogol 300, tìtan dioxyd, oxyd săt vảng. oxyd săt đỏ.
MÔ TẢ SẢN PHẢM:
Viên nén bao phim.
Viên nén bao phim, hai mặt lồi. hình tròn, mảu nâu, một mặt có khắc “IRESSA 250” và một mặt trơn.
QUY CÁCH ĐỎNG GÓI:
Hộp 1 túi nhôm x 3 vỉx 10 vỉên nèn bao phim.
THUOC DÙNG CHO BỆNH GÌ:
IRESSA được sử dụng để điều trị cho bệnh nhân người lớn ung thư phối loại không phải tế bảo
nhỏ. Đây lả bệnh ung thư do hình thảnh tế bảo ác tính (ung thư) ở trong mô phỗi.
NÊN DÙNG THỤỎC NÀY NHƯ THẺ NÀO VÀ LIỆU LƯỢNG:
Luôn sử dụng thuốc theo đúng chỉ dẫn của bác sỹ Hỏi lại thông tin với bảo sỹ hoặc dược sỹ nếu
bệnh nhân không chắc chắn.
Liêu khuyến cáo la một viên 250 mg mỗi ngảy.
Uống thuốc cùng một thời điếm mỗi ngảy.
Bệnh nhân có thể uống thuốc trong hoặc ngoải bữa ăn.
Không dùng thuố_c kháng ạcid (thụốc lảm giảm nồng độ acid trong dạ day) trong vòng 2 giờ trước
hoặc sau 1 giờ kê từ khi uỏng thuôc IRESSA.
Hòa tan viên thuốc trong nửa ly nước (không chứa ga) nếu bệnh nhân, khcị nuốt nguyên viên thuôo.
Khộng dùng bât kỳ các chât lõng khảo. Không nghiên viên thuôo. Khuây đêu nước cho đẻn khi viên
thuôo hoả tan.
Có thể mắt đến 2Ọ phút để hòa tan yiên thuốc. Uống dịch thuộc ngạy lập tức. Sau đó, tráng với một
nửa ly nước vả uỏng để đảm bảo rảng bệnh nhân đã uông hêt thuôo.
J\ỈWV
,/~
Trường hợp bệnh nhân lỡ uống nhìều hơn liều thuốc qui định:
Nếu bệnh nhân lở dùng nhiều viên thuốc so với liều khuyến cáo, bệnh nhân cần bảo bác sỹ hoặc
dược sỹ ngay lập tức.
Nếu bệnh nhân CÓ bắt kỳ thắc mắc về việc dùng thuốc nảy, nên tham vấn bác sỹ hoặc dược sỹ.
KHI NÀO KHÔNG NÊN DÙNG THUỐC NÀY:
Khỏng nẻn dùng thuốc nảy nếu bệnh nhân dị ứng với gefitinib hoặc bất kỳ thảnh phần tá dược nảo
cùa thuốc.
Không nên dùng thuốc nêu bệnh nhân đang trong thời kỳ cho con bú.
TAC DỤNG KHỎNG MONG MUON:
Cũng như các thuốc khác. thuốc nảy có thể gây ra tác dụng không mong muốn mặc dù điều nảy
không phải xảy ra ở tât cả bệnh nhân.
Tham vắn bác sỹ ngay lặp tức nếu bệnh nìhântcó phản ứng không mong muốn iiệt kê dưới đãy —
bệnh nhân có thẻ cân được điêu trị y tê khân câp.
0 Phản ứng dị ứng (ít gặp), đặc biệt nêu gặp các triệu chứng như sưng mặt. lưỡi hoặc cổ
họng. khó nuốt. viêm thanh quản vả khó thở. ' _
o Hêt hơi, hoặc đột ngột khòng thờ được. có khả năng xảy ra khi bị ho hoặc sôt. Điêu nảy
nghĩa lả bệnh nhân bị viêm phối, còn gọi là bệnh phối mô kẻ. Có thể xảy ra ở 1/100 bệnh
nhân dùng thuốc lressa và có thể đe dọa tính mạng.
0 Phản ứng da nghiêm trọng (hiếm gặp) ảnh hưởng đến diện tĩch lớn bề mặt cơ thế. Dấu hiệu
bao gồm đỏ da, đau, loét, giộp da và bong tróc da. Môi, mũi, mắt vả cơ quan sinh dục ngoải
có thế bị ảnh hưởng.
0 Mắt nước (thường gặp) có nguyên nhản là do ỉa chảy kéo dải hoặc trầm trọng, nỏn ói (đang
bệnh) buồn nôn (cảm thắy bệnh) hoặc mầt cảm giác ngon m]ệng.
0 Có vản đề ở mất (ít gặp) như lá đau đỏ mắt chảy nước mắt nhạy cảm vơi ánh sáng. thay
đổi thị lực hoặc lông mi quặm. Điều nảy có nghĩa lả bệnh nhân bị Ioéttrẻn bề mặt mắt (giác
mạc)
Tham vần bảo sỹ ngay khi có thể nếu bệnh nhân có bắt kỳ phản ứng không mong muốn dưới
đây:
Phản ứng không mong muốn rắt thường gặp (ảnh hưởng > 11 10 bệnh nhân):
Tiêu chảy
Nôn ói
Buôn nôn . ,
Phản ưng da như phát ban giông nôi mụn, mả thỉnh thoảng ngứa với da khô vả/hoặc nứt
da.
Mật cảm giảc ngon miệng
Yêu ởt
Miệng khô đỏ đau.
Tăng enzym gan như lá ạlanin aminotransferase trong xét nghiệm máu; nêu enym tăng cao
quá bác sỹ có thể yêu cầu ngừng dùng thuốc lressa.
0000
0000
Phản ứng không mong muốn thường gặp (ảnh hưởng từ 1-10 người/1OO bệnh nhản):
o Mắt khô, đỏ hoặc ngứa.
o Mí mắt đỏ và đau.
o Móng có vắn đề
0 Rụng tóc
__,JƯ1Â’Ệ/
NVW' \
0000
0
O
Sôt.
Chảy máu (ví dụ như chảy máu mũi hoặc có máu trong nước tiễu).
Protein trong nước tiều (hiển thị trong xét nghiệm nước tiều).
Tảng bilirubin vả enzym gan khác được gọi [ả aspertat arninotransferase trong xét nghiệm
máu; nệu kết quả xét nghiệm quá cao bác sĩ có thế yêu cầu ngừng ciùng thuốc lressa
Tảng nồng độ creatinin trong xét nghiệm mảu (liên quan đến chức năng thận).
Viêm bảng quang (cảm giác bỏng rát khi đi tiều vả thường xuyên có nhu câu tiểu gấp).
Phản ứng không mong muốn it gặp (ảnh hưởng từ 1-10 ngườil1000 bệnh nhân):
O
O
Viêm tụy. Các dắu hiệu bao gồm đau rất nặng ở phần trên của vùng bụng. buồn nôn vả nôn
ói dữ dội
Việm gan. Các dấu hiệu bao gồm cảm giác không khỏe, có hoặc khòng có vảng da (da và
mắt có mảu vảng). it gặp tác dụng không mong muốn nảy; tuy nhiên, một sô bệnh nhân đã
bị tử vong.
Thủng dạ dây-ruột.
Phản ứng không mong muốn hiếm gặp (ảnh hưởng từ 1-10 ngườil10.000 bệnh nhân):
0
O
Viêm mạch mảu trong da. Điều náy có thế biếu hiện bằng vết thâm tĩm hoặc những mảng
phát ban không xanh tái ở trên da.
Viêm bảng quang xuất huy_ét (cảm giảc bỏng rảt khi đi tiều và thường xuyên có nhu cầu tiểu
gâp, có mảu trong nước tiêu).
NÊN TRÁNH DÙNG NHỮNG THUỐC HOẶC THỰC PHẢM GÌ KHI ĐANG SỬ DỤNG THUỐC NÀY:
Hãy báo bác sĩ hoặc dược sĩ nếu bệnh nhản đang dùng hoặc gần đảy đã dùng bât kỳ loại thuốc
khảo
Đặc biệt iả báo bác: sĩ hoặc dược sĩ nêu bệnh nhân đang dùng bất cứ loại thuốc nảo sau đây:
OOOOO
Phenytoin hay carbamazepin (thuôo điêu trị động kinh).
fflảmffldnftủỏcfflềufflbamkm)
ltraconazol (thuốc điều trị nhiễm nắm).
Barbiturat (thuốc điều trị rối loạn giâc ngủ)
Thuốc thảo dược có chứa cỏ St John (tèn latinh la Hypericum perforatum, được sử dụng
điều trị bệnh trầm cảm va lo âu).
Các thuốc ức chế bơm proton, thuốc đỏi kháng Hz và các thuốc kháng acid (thuốc điều trị
bệnh ioét, khó tiêu. ợ nóng vả lảm giảm acid trong dạ dảy).
Những loại thuốc nảy có thể ảnh hưởng đến cơ chế tảc dụng của lressa.
O
Warfarin (thuốc chống đông đường uống, để ngăn ngưa cục máu đông). Nêu bệnh nhân
đang dùng thuỏc có chứa hoạt chảt nảy. bác sỹ có thẻ cân phải cho iảm các xét nghiệm
máu thường xuyên hơn.
Nến gặp phải bất kỳ phản ứng không mong muốn liệt kê ở trên. hoặc nêu bệnh nhân không chắc
chăn, hảy hỏi bảo sỹ hoặc dược sĩ trước khi dùng lressa.
CẢN LÀM GÌ KHI MỌT LẢN QUÊN KHÔNG DÙNG THUỐC:
Việc cần phải lảm gì trong trường hợp quên dùng thuốc còn phụ thuộc vảo khoảng bao lâu mởi đến
thời điếm dùng liêu kế tiếp.
Nếu lớn hơn hoặc bằng 12 giờ tĩnh tự thời điểm dùng liều kế tiếp thì uống Iièu đã quên ngay khi
bệnh nhân nhớ ra. Sau đó dùng liêu kê tiêp như binh thường.
Nệu nhỏ hơn 12 giờ tinh từ thời điểm dùng Iièu kế tiếp: bỏ qua liều đã quên uống. Sai đó dùng liều
kè tiêp như bình thường.
Không được uống gấp đỏi Iìều (2 viên cùng một thời điểm) để bù cho liều đã quên.
CẢN BẢO QUẢN THUỐC NÀY NHƯ THẺ NÀO:
Không bảo quản quá 30°C. Bảo quản trong bao bì gốc.
DÁU HIỆU VÀ TRIỆU CHỨNG KHI DÙNG THUỐC QUÁ LIẺU:
Ghi nhận tăng tần số vả mức độ nghiêm trọng của một số phản ứng không mong muốn, chủ yếu iả
ỉa chảy vả phát ban ở da.
CÀN PHẢI LÀM GÌ KHI DÙNG THUỐC QUÁ LIẺU KHUYÉN CÁO:
Khỏng có điều trị đặc hiệu trong trường hợp quá liều.
Cảc phán ứng không mong muốn có Iièn quan đến quá liều nên được điều trị triệu chừng; đặc biệt
lả nẻn kỉêm soát việc tiêu chảy nặng theo chỉ định iảm sảng.
NHỮNG ĐIEU CÀN THÀN TRỌNG KHI DÙNG THUOC:
Lưu ý vả thận trọng khi sử ơụng
Kiềm tra vởi bác sỹ hoặc dược sĩ trước khi dùng lressa:
o Nến bệnh nhân đã từng có bắt kỳ vắn đề khác về phối. Một số bệnh phối có thề tồi tệ hơn trong
khi điêu trị với lressa.
o Nêu bệnh nhân có vắn đề về gan.
Trẻ em về thanh thiểu niên
Iressa không được chỉ định ở trẻ em vả thanh thiếu niên dưới 18 tuổi.
Phụ nữ có thai, phụ nữ cho con bú va“ phụ nữ có khả năng có thai
Ịham vắn bảc sĩ trước khi dùng thuốc nảy nếu bệnh nhân có thai, có thể có thai hoặc đang cho con
u.
Khuyên cảo tránh mang thai trong khi điều trị với Iressa vì lressa thể gây hại cho thai nhi.
Khỏng dùng Iressa nếu bệnh nhản đang cho con bú vì sự an toán của em bé.
Khả năng iái xe và vận hảnh máy móc
Nếu bệnh nhản cảm thắy yếu ớt trong khi dùng thuốc náy. cần trọng khi lái xe hoặc vận hảnh cỏng
cụ hoặc mảy móc.
iressa chứa iactose
Nếu bệnh nhản được chẩn đoán iả không dung nạp một số ioại đường. liên hệ với bác sĩ trước khi
dùng thuôo nảy.
KHI NÀO CẢN THAM VĂN BÁC SỸ, DƯỢC sĩ:
Tham vắn bảo sỹ hoặc dược sĩ trước khi dùng lressa
Báo bác sỹ trước khi dùng thuốc nảy nếu bệnh nhân đang có thai. có thể có thai hoặc đang cho con
bú
Nếu bệnh nhân có bắt kỳ phản ứng khòng mong muốn báo với bác sỹ dược sĩ hoặc y tá. Bao gồm
bất kỳ phản ứng không mong muôn mã không liệt kê ở trong phần hướng dẫn sử dụng cho bệnh
nhân nảy.
Nếu cần thém thông tin xin hỏi ý kiến bác sỹ hoặc dược sĩ.
-W°fL
HAN DÙNG CỦA THUỐC:
3 nảm kế từ ngảy sản xuất.
TÊN, ĐịA CHỈ CÙA CƠ SỞ SẢN XUẢT:
AstraZeneca UK Limited, Silk Road Business Park, Macciesfield. Cheshire, SK1O 2NA, Anh.
NGÀY XEM XÉT SỬA ĐÒI, CẬP NHAT LAI NỌI DUNG HƯỚNG DĂN SỬ DỤNG THUỐC:
ddlmmlyy.
Doc ID-… Version…
@ AstraZeneca 2003-2016
Iressa is a trade mark of the AstraZeneca group of companies.
AstraZenecaỄ
IL
i..uL
ãlkọ
.….v.
HƯỚNG DĂN SỬ DỤNG THUỐC CHO CÁN BỘ Y TẾ
Rx Thuốc bán theo đơn
IRESSA®
Gefitinib 250 mg
Viên nén bao phim
THÀNH PHẢN VÀ HÀM LƯỢNG
Mỗi viên chứa:
Hoat chắt: Gefitinib 250 mg
Tả dươc: Lactose monohydrat, cellulose vi tinh thể, croscarmellose natri, povidọn, natri
lauriisuifate, magnesi stearat, hypromeliose, macrogol 300, titan dioxyd, oxyd săt vảng,
oxyd săt đỏ.
DẠNG BÀO CHẾ
Viên nén bao phim.
Viên nén bao phim, hai mặt lồi, hình tròn, mảu nảu, một mặt có khắc "lRESSA 250" và
một mặt trơn.
ĐẶC TÍNH Dược LÝ
Đăc tinh dươc lưc hoc: ' ’ '
Nhóm giược lý trị liệu: thuôo chông ung thư, ức chê protein kinase, mả ATC: L01XE02.
Cơ chê tác động về fác dụng dược iực
Yếu tố phát triển biều bỉ (epidermal growth factor — EGF) và thụ thể (EGFR [HER1;
ErbB1]) đóng vai trò chủ yếu trong quá trình phát triền vả tãng sinh cũa tế bảo bình
thường và tế bảo ung thư. Đột biến hoạt hóa EGFR trong tế bảo ung thư là yếu tố quan
trọng trong việc phát triển khối u, ngăn tế bảo chết theo chương trinh, tăng hình thánh
các mạch máu mới vả thúc đẩy quá trình di căn của bướu.
Gefitinib lá hoạt chắt có phân tử nhỏ, ức chế chọn lọc tyrosin kinase trên thụ thể của yêu
tố phát triển biểu bì vả điều trị hiệu quả ở bệnh nhân có khối u mang đột biên hoạt hóa
của EGFR tyrosin kinase bắt kể bước điều trị. Không có tác động lâm sảng liên quan ở
bệnh nhân có khối u không mang đột biến EGFR.
Đột biên hoạt hóa EGFR thường gặp (mất đoạn trên exon 19, L858R) có nhiều dữ liệu
đáp ứng hỗ trợ cho nhạy cảm với gefitinib; ví dụ: thời gian sống còn không tiến triến bệnh
HR (95% Cl) 0,489 (0,336; 0,710) trong nhóm gefitinib so VỚÌ nhóm hóa trị đôi
[WJTOGS4OS]. Ít dữ iiệu đáp ứng với gefitinib hơn ở các bệnh nhân có khối u chứa đột
biến it gặp, các dữ liệu sẵn có cho thấy G719X, L861Q và 87681 iả cảc đột biến nhạy
thuốc; vả T790M đơn độc hoặc đột biến chèn đoạn ở exon 20 đơn độc iả các cơ chế để
khảng thuốc.
DNA cửa khổi u frong hệ fuần hoán (ctDNA)
JMỚỄ\Ề " "
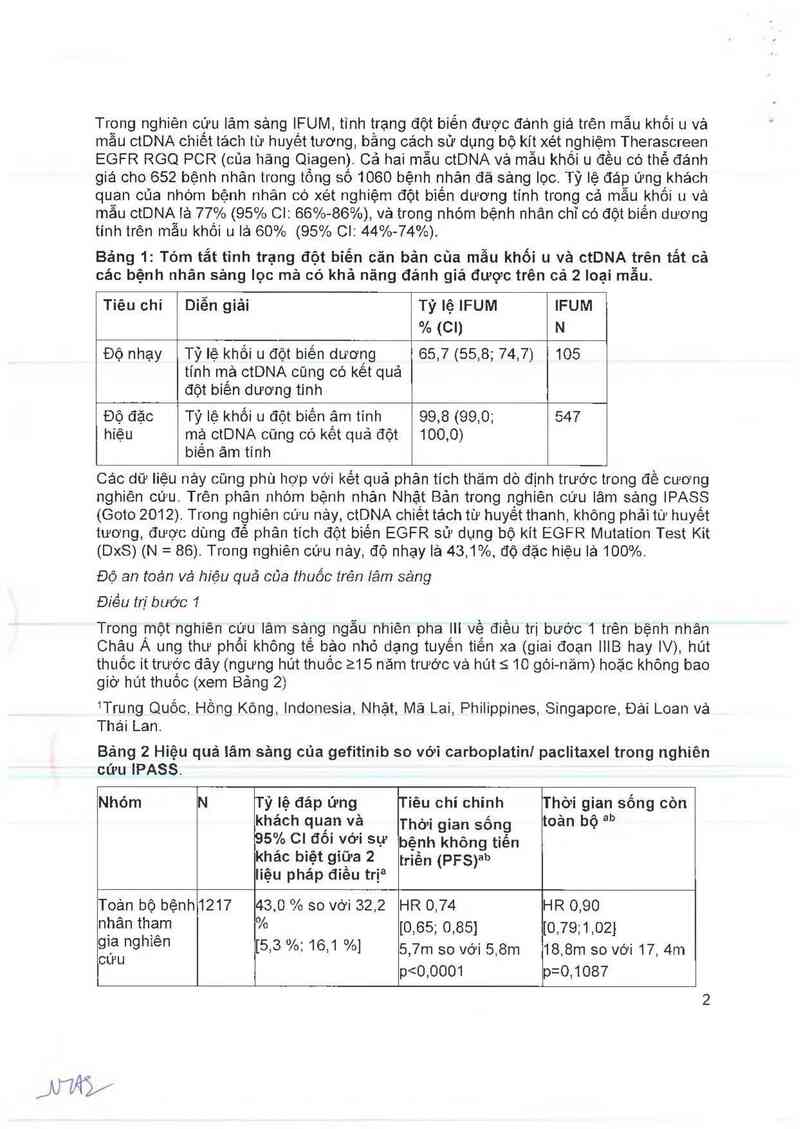
Trong nghiên cứu lâm sảng IFUM, tỉnh trạng đột biến được đánh giá trên mẫu khối u vả
mâu ctDNA chiết tảch từ huyêt tương, bằng cách sử dụng bộ kít xét nghiệm Therascreen
EGFR RGQ PCR (của hảng Qiagen). Cả hai mẫu ctDNA vả mẫu khối u đều có thế đánh
giá cho 652 bệnh nhân trong tồng sô 1060 bệnh nhản đă sảng lọc. Tỷ lệ đáp ứng khách
quan của nhóm bệnh nhân có xét nghiệm đột biến dương tính trong cả mẫu khối u và
mâu ctDNA iả 77% (95% Cl: 66%- 86%) vả trong nhóm bệnh nhân chỉ có đột biến dương
tính trên mẫu khối u lả 60% (95% Cl: 44%-74%).
Bảng 1: Tóm tắt tình trạng đột biến căn bản của mẫu khối u và ctDNA trên tắt cả
các bệnh nhân sảng lọc mã có khả năng đánh giá được trên cả 2 Ioại mâu.
Tiêu chí Diễn giải Tỷ lệ IFUM IFUM
% (cn N
Độ nhạy Tỷ lệ khối u đột biến dương 65,7 (55,8; 74,7) 105
tính mả ctDNA cũng có kêt quả
đột biên dương tinh
Độ đặc Tỷ lệ khối u đột biến ậm tỉnh 99,8 (99.0; 547
hiệu mậ ctDNA cũng có kêt quả đột 100,0)
biên âm tinh
Các dữ liệu nảy củng phù hợp với kết quả phân tích thăm dò định trước trong đề cương
nghìên cứu. Trên phân nhộm bệnh nhân Nhật Bản trong nghiên cứu lâm sảng IPASS
(Goto 2012). Trong nghiên cứu nảy, ctDNA chiết tách từ huyết thanh, không phải từ huyết
tương, được dùng để phân tich đột biến EGFR sử dụng bộ kít EGFR Mutation Test Kit
(DxS) (N = 86). Trong nghiên cứu nảy, độ nhạy là 43,1%. độ đặc hiệu iá 100%.
Độ an toản vả hiệu quả của thuốc frén iảm sảng
Điều frị bước 1
Trong một nghiên cứu lâm sảng ngẫu nhiên pha ili vệ điều trị bước 1 trên bệnh nhãn
Châu A ung thư phối không tê bảo nhỏ dạng tuyên tiên xa (giai đoạn lilB hay IV), hút
thuốc it trước đây (ngưng hút thuốc 215 năm trước vá hút 5 10 gói-nảm) hoặc không bao
giờ hút thuôo (xem Bảng 2)
1Trung Quốc, Hồng Kông, Indonesia, Nhật, Mã Lai, Philippines, Singapore, Đái Loan vả
Thái Lan.
Bảng 2 Hiệu quả iâm sảng của gefitỉnib so với carboplatini paclitaxel trong nghiên
cứu IPASS.
Nhóm N Tỷ iệ đáp ứng Tiêu chí chính Thời gian sống còn
khách quạn và Thời gian sống toản bộ ab
95% CI đôi với sự bênh khỏng tiến
khác biệt gỉữa ² triền (strb
liệu phảp điêu trịa
Toản bộ bệnhi21? 43,0 % so vơi 32,2 HR 0,74 HR 0,90
nhân thệ… % [0,65; 0,85] 10,79;1,021
Ễ’úỆunghle“ [5,3 % 16.1 %] 5,7m so với 5,8… 18,8m so với 17, 4m
p<0,0001 p=0,1087
/ƯÝỞ'
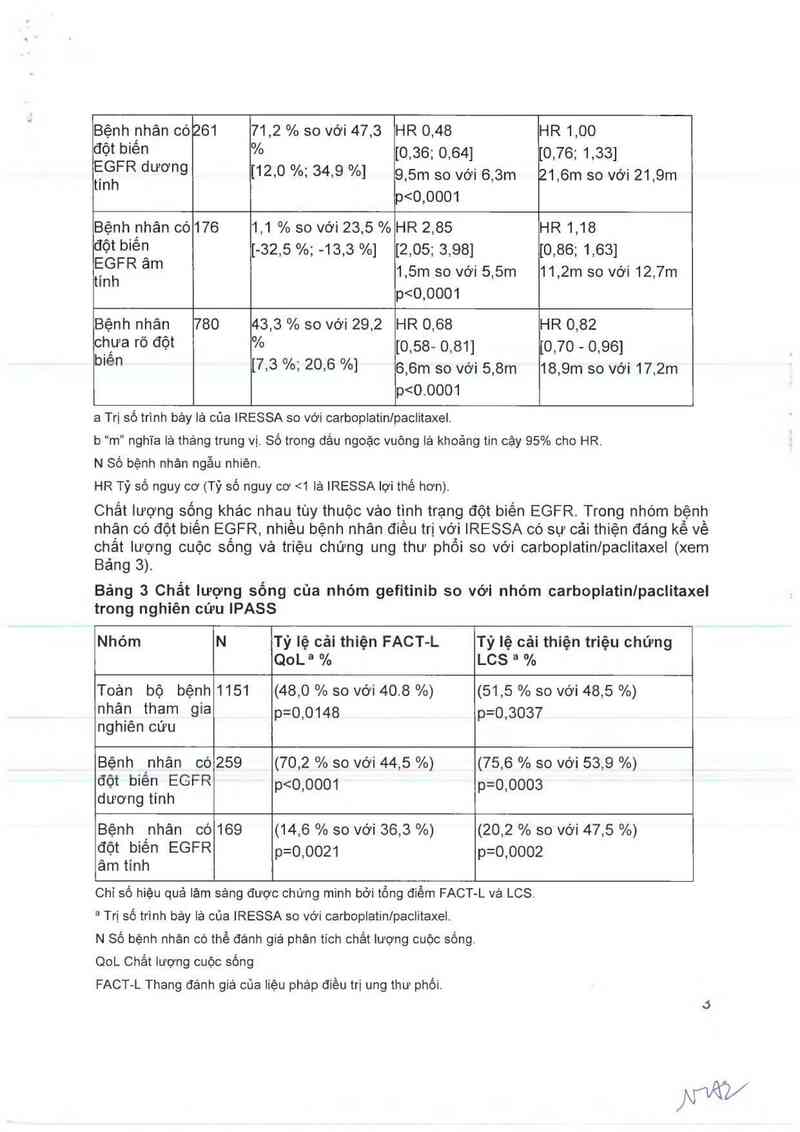
Bệnh _nhân có 261 71,2 % so với 47,3 HR 0,48 HR 1,00
đột biên % [0,36; 0,64] [0,76; 1,33]
ỄẵFR dương [12.0 %: 34,9 %] 9,5… so với 6,3… 21,6m so với 21 ,9m
p<0,0001
Bệnh hhân có176 1,1 %so với 23,5%HR 2,85 HR 1,18
đột biêfj [-32,5 %; -13,3 %] [2,05; 3,98] [0,86; 1,63]
ỂẵFR am 1,5… so với 5,5… 11,2… so với 12,7…
p<0,0001
Bệnh nhân 780 43,3 % so với 29,2 HR 0,68 HR 0,82
Ch,ưa rõ đôt % [0,58- 0,81] 10,70 - 0,96]
b'en [7,3 %; 20,6 %] 6,6m so với 5,8m 18,9… so với 17,2…
p<0.0001
a Trị số trình bảy lá của IRESSA so vởi carboplatinlpaclitaxel.
b “m" nghĩa lả thảng trung vị. Số trong dâu ngoặc vuông lả khoảng tin cậy 95% cho HR.
N Số bệnh nhản ngẫu nhiên.
HR Tỷ số nguy cơ (Tỷ số nguy cơ <1 lả IRESSA lợi thế hơn).
Chắt lượng sống khác nhau tùy thuộc vảo tình trạng đột biến EGFR. Trong nhóm bệnh
nhặn có đột biên EGFR, nhiều bệnh nhân điêu trị với IRESSA có sự cải thiện đáng kể vê
chât lượng cuộc sông vả triệu chứng ung thư phôi so vởi carboplatinlpaclitaxel (xem
Bảng 3).
Bảng 3 Chẩt lượng sống của nhóm gefitinib so vởi nhóm carboplatinlpaclitaxel
trong nghiên cứu IPASS
nghiên cứu
Nhóm N Tỷ lệ cải thiện FACT-L Tỷ lệ cải thiện triệu chứng
QoLa % LCS ² %
Toản bộ bệnh 1151 (48,0 % so vởi 40.8 %) (51,5 % so với 48,5 %)
nhân tham gia pzolo148 pzo_gogỹ
Bệnh _nhân 00259
đột biên EGFR
dương tỉnh
(70,2 % so với 44,5 %)
p<0,0001
(75,6 % so với 53,9 %)
p=0,0003
Bệnh nhân có 169
đột biến EGFR
âm tính
(14,6 % so vởi 36,3 %)
p=0,0021
(20,2 % so với 47,5 %)
p=0,0002
Chỉ số hiệu quả lảm sảng được chứng minh bởi tỗng đìẻm FACT—L vả LCS.
² Trị số trình bảy lá của IRESSA so vởi carboplatinlpaclitaxel.
N sô bệnh nhản có thế đánh giả phản tích chất lượng cuộc sống.
QoL Chắt lượng cuộc sống
FACT-L Thang đánh gỉá của liệu pháp điều trị ung thư phối.
LCS Thang đảnh gìả ung thư phồi
Trong nghiên cứu IPASS, IRESSA chứng minh hiệu quả vượt trội trẻn PFS, ORR, QOL
và giảm triệu chứng mã không có sự khác biệt đáng kể về khả nảng sống còn toản bộ 50
với carboplatinlpaclitaxel ở nhóm bệnh nhảm chưa được điều trị trước đó, bị bệnh ung
thư phối ioại không phải tế bảo nhỏ tiến triền tại chỗ hay di căn, cảc khối u nảy có đột
biến hoạt hóa EGFR tyrosin kinase.
Trén các bệnh nhân đã đươc điều rrị trước đó.
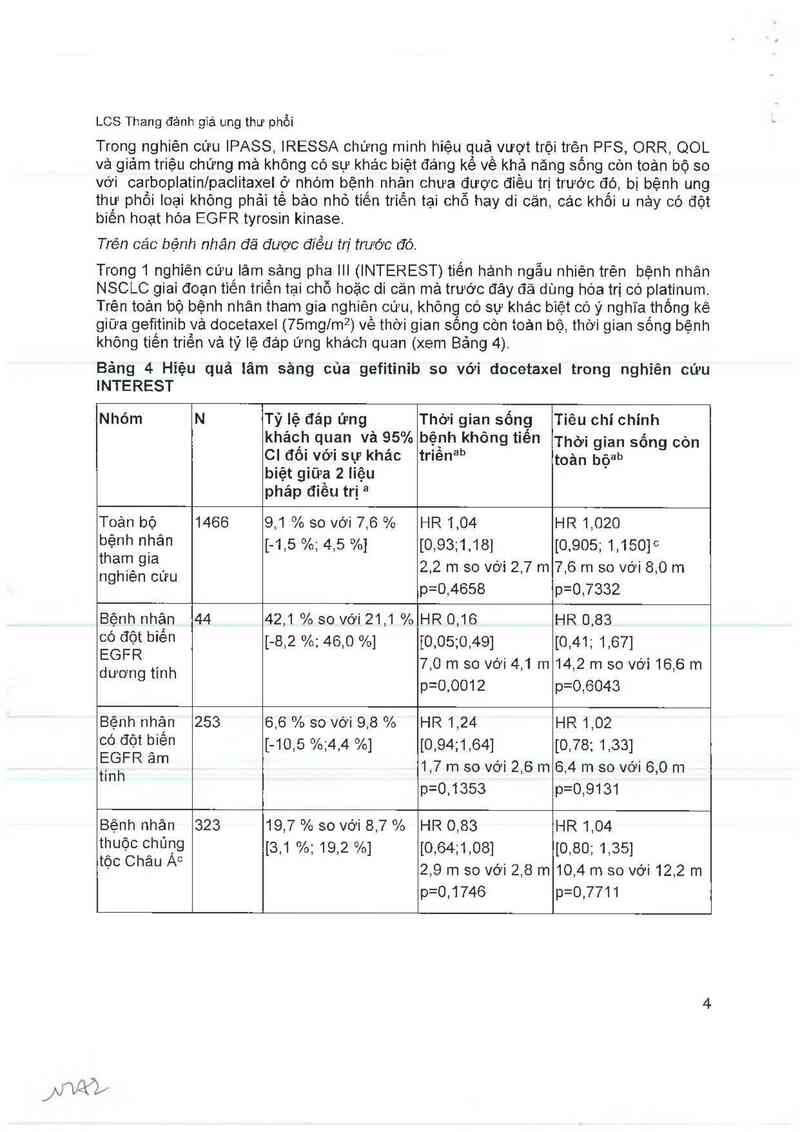
Trong 1 nghiên cứu lâm sảng pha III (INTEREST) tiến hánh ngẫu nhiên trên bệnh nhân
NSCLC giai đoạn tiến triền tại chỗ hoặc di căn mả trước đây đã dùng hóa trị có platinum
Trên 105… bộ bệnh nhân tham gia nghiên cứu, khõng có sự khác biệt có ý nghĩa thống kê
giữa gefitinib vả docetaxel (75mglm²) vê thời gian sông còn toản bộ, thời gian sông bệnh
không tiến triển và tỷ lệ đáp ứng khách quan (xem Bảng 4).
Bảng 4 Hiệu quả iâm sảng của gefitinib so với docetaxel trong nghỉên cứu
INTEREST
Nhỏm N Tỷ lệ đáp ứng Thời gian sống Tiêu chí chính
khảch quan và 95% bệph không tiên Thời gian sống còn
Cl đôi với sự khảc triênab toàn bôab
biệt giữạ 2 liệu '
pháp điêu trị 8
Toản bộ 1466 9,1 % so với 7,6 % HR1,04 HR 1,020
bệnh nhân ]-1,5 %; 4,5 %] [0,93;1,18] ]0,905; 1,150]0
tha'Tlg'a. 2.2 … so với 2,7 … 7,6 … so với 8,0 …
nghien cưu
p=0,4658 p=0,7332
Bệnh nhận 44 42,1 % so với 21,1 % HR 0,16 HR 0,83
có đột biên [-8,2 %; 46,0 %] ]0,05;0,49] ]0,41; 1,67]
EGFR , 7,0 … so với 4,1 m 14,2 m so với 16,6 m
dương tinh
p=0,0012 p=0,6043
Bệnh nhận 253 6,6 % so với 9,8 % HR 1,24 HR 1,02
có đột Ềiên ]-10,5 %;4,4 %] [0,94;1,641 [0,78; 1,33]
ỄẸhFR am 1,7 m so với 2,6 rn 6,4 m so với 6,0 m
p=0,1358 p=0,9131
Bệnh nhân 323 19,7 % so với 8,7 % HR 0,83 HR 1,04
thUỘC chủng [3,1 %; 19,2 %] [0,64;1,08] [0,80; 1,35]
tộc Châu AC 2,9 m so vởi 2,8 m 10,4 m so với 12,2 m
p=0,1746 p=0,7711
fflẨJÒ/
Bệnh nhân
không phải
chủng tộc
Châu Á
1143
[-4,3 %; 2
6,2 % so với 7,3 %
HR 1,12
,0 %] [0,98; 1,28]
p=0,1041
2,0 m so vởi 2,7 m
HR 1,01
[0,89; 1,14]
6,9 m so với 6,9 …
p=0,9259
a Trị số được trình bảy lá của IRESSA so sánh với docetaxei.
b "m" lả tháng trung vị. Số liệu trong dấu ngoặc đơn là khoảng tin cặy 96% trên tỷ số nguy cơ của thởi gian
sống còn toản bộ trên toản bộ bệnh nhản tham gia nghiên cứu, hoặc khoảng tin cậy 95% cho HR.
c Khoảng tin cậy hoản toản nằm dưới giới hạn xác định không kém hơn 1,154.
N Số bệnh nhân lựa chọn ngẫu nhiên
HR Tỷ số nguy cơ (HR <1 thi IRESSA có lợi thế hơn)
Biểu đồ 1 và 2 Hiệu quả của thuốc trong phân nhóm bệnh nhân không thuộc
chủng tộc Châu A trong nghiên cứu INTEREST
(N = Số bệnh nhân được lựa chọn ngẫu nhiên)
Thời gian sống còn to
N Sổ bệnh nhẽn
1143
27
222
133
1010
600
543
369
774
ản bộ
Tống số bệnh nhên
EGFR !.1+ '
EGFR % t-I—-—I———c
Khỏng hút thuốc ’———._'
Có hủi lhuốc 1"".'“'
Ung lhư bnểu mẻ luyến i—-A_- —q
Không phái ung ihư biểu mô tuyển Ièí-ơ-—w
Hử p-—a-Ẻ
Ham vầiiủ_.
0.5 1.0 1 s 2 o
Tỷ số nguy co (Gefmnib so vỏn Doceiaxel). 95%Cl
Phán iich mòng mẻu Đảnh giả yêu 16 lám sảng dua
chĩnh
trên dên sô PP
Đủnh giá chỉ số sinh hoc dua irên
dãn sổ in
Thời gian sổng bệnh không tiến triển
ORR (°!õ)
N Eệnh nhin Gefitinib v. Domtuel
1143 62v.7.3
21 429v. 20.0
222 5.5 v 9.1
133 237v 13.3
101 3.5 v 5.5
em] 94 v.B.A
543 2.8 v. 5.0
369 3 8 v. 13.1
774 44v4,6
Tổng số bệnh nhân
EGFR + r-———t
EGFR-
Không hứtthuốc
Củ húitnuốc
Ung thư biền mô tuyến
Khỏng phii ung thư biễu mô tuyến
Nữ
Nam
,_-._._4
F, I !
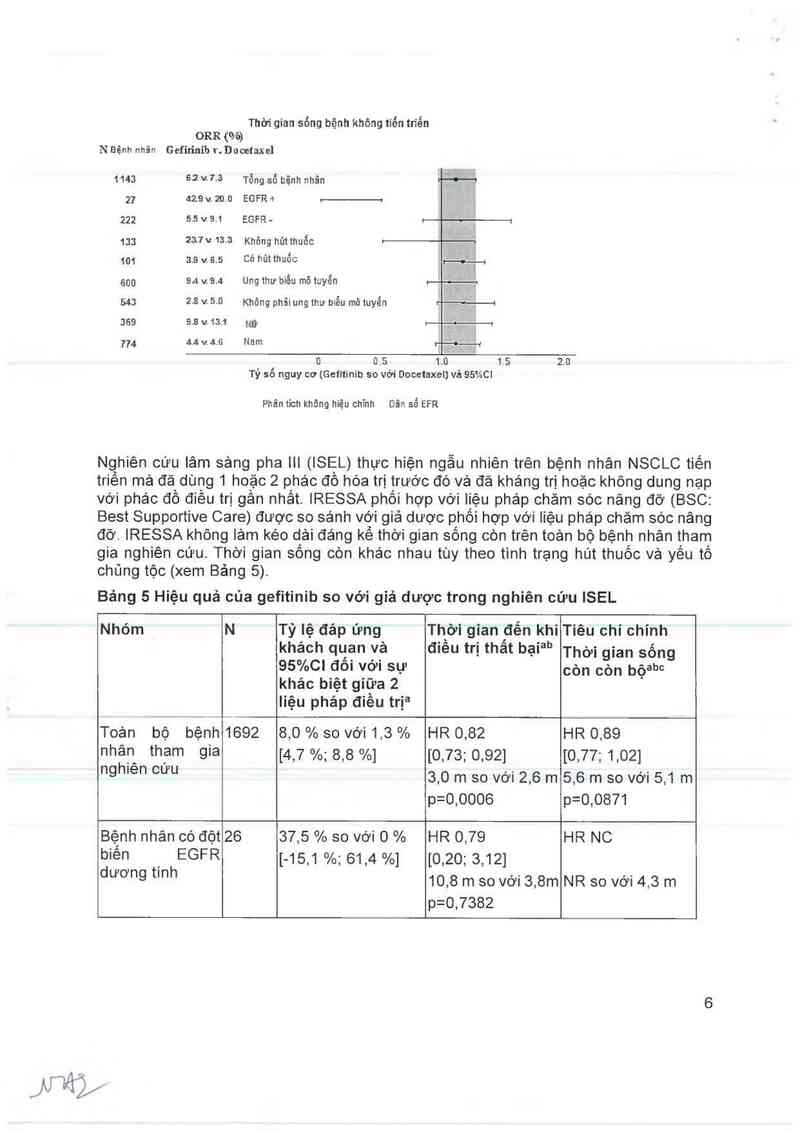
Nghiên cứu lâm sảng pha III (ISEL) thực hiện ngẫu nhiên trên bệnh nhân NSCLC tiến
0 0.5
1.0 1 5
Tỷ số nguy cơ (Gefitinib so với Docetaxel] vả 95%C]
Phân tich khõng hiệu chỉnh
Dãri số EFR
2.0
triền mả đả` dùhg 1 hoặc 2 phác đồ hóa trị Ịrước đó và đã kháng trị hoặc không dung nạp
với phác đô điêu trị gân nhât. IRESSA phôi hợp với liệu pháp chăm sóc nâng đỡ (BSC:
Best Supportive Care) được so sánh với giả dược phối hợp với iiệu phảp chăm sóc nâng
đở. IRESSA không iảm kéo dải đáng kể thời gian sông còn trên toản bộ bệnh nhân tham
gia nghiên cứu. Thời gian sống còn khác nhau tùy theo tinh trạng hút thuốc vả yêu tố
chủng tộc (xem Bảng 5).
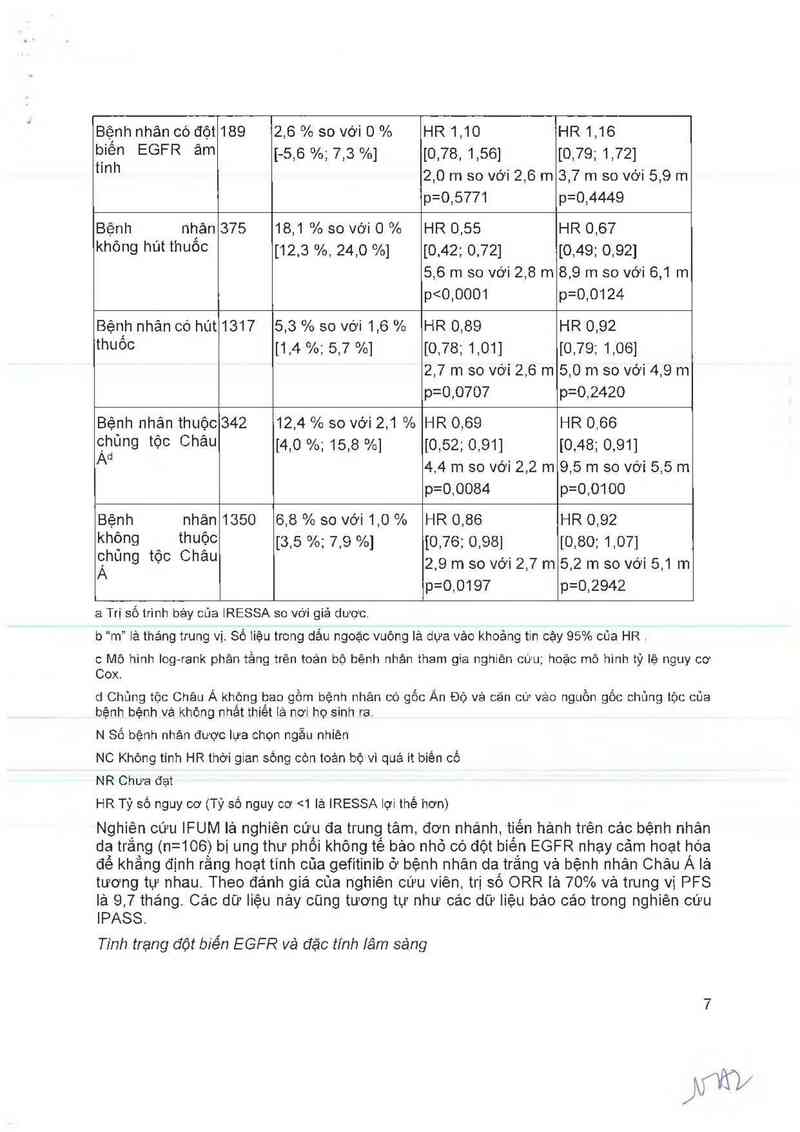
Bảng 5 Hiệu quả của gefitinib so với giả dược trong nghiên cứu ISEL
Nhóm N Tỷ lệ đảp ứng Thời gian đến khi Tiêu chí chính
khảch qưan và điêu trị thất bạiah Thời gian sống
95%Cl đoi vởi sự còn còn bôabc
khảo biệt giưa 2 '
liệu phảp điêu trịa
Toản bộ bệnh 1692 8,0 % so với 1,3 % HR 0,82 HR 0,89
nhâ_n_ th_am 9ia ]4,7 %; 8,8 %] [0,73; 0,92] ]0,77; 1,02]
“gh'en °ưu 8.0 m so với 2,6 m 5,6 … so với 5,1 m
p=0,0006 p=0,0871
Bệnh nhân có đột 26 37,5 % so với 0 % HR 0,79 HR NC
biên , EGFR ]-15,1 %; 61,4 %] ]0,20; 8,12]
dương t'"h 10,8 m so với 3,8m NR so với 4,3 m
p=0,7382
W/
Bệnh nhân có đột189 2,6 % so với 0% HR 1,10 HR 1,16
b_iên EGFR âm [-5,6 %, 7,3 %] [0,78, 1,56] ]0,79; 1,72]
mm 2,0 m so với 2,6 m 3,7 m so vởi 5,9 m
p=0,5771 p=0,4449
Bệnh nhân 875 18,1 % so với 0 % HR 0,55 HR 0,67
không hút thuôo [12,3 %, 24,0 %] [0,42; 0,72] [0,49; 0,92]
5,6 m so với 2,8 m 8,9 m so với 6,1 m
p<0,0001 p=0,0124
Bệnh nhản có hút 1817 5,3 % so với 1,6 % HR 0,89 HR 0,92
thuôo ]1,4 %; 5,7 %] [(),78; 1,01] ]0,79; 1,06]
2,7 m so với 2,6 m 5,0 m so với 4,9 m
p=0,0707 p=0,2420
Bệnh nhân thuộc 342 12,4 % so với 2,1 % HR 0,69 HR 0,66
Qhủng tộc Châu 140 %; 15,8 %] ]0,52; 0,91] [0,48; 0,91]
Ad 4,4 m so vởi 2,2 m 9,5 m so với 5,5 m
p=0,0084 p=0,0100
Bệnh nhân 1350 6,8 % so với 1,0 % HR 0,86 HR 0,92
khệng , thuỂJc [3,5 %; 7,9 %] [0,76; 0,98] [0,80; 1,07]
ẵhung tọc Chau 2,9 m so với 2,7 m 5,2 m so với 5,1 m
p=0,0197 p=0,2942
a Trị số trinh bảy của IRESSA so với giả dược.
b “m” lả tháng trung vị. SỐ iiệu trong dảu ngoác vuông lả dựa vảo khoảng tin cậy 95% của HR .
0 Mô hinh log—rank phân tầng trên toản bộ bệnh nhản tham gia nghiên cưu; hoặc mô hình iỳ lệ nguy cơ
Cox.
d Chủng tộc Châu Á kh6ng bao gồm bệnh nhản có gốc Ản Độ và cản cứ vảo nguồn gốc chủng tộc của
bệnh bệnh vả Không nhảt thiêt 18 nơi họ Sinh ra.
N Số bệnh nhảm được lựa chọn ngẫu nhiên
NC Không tính HR thời gian sõng còn toản bộ vì quá it biên cố
NR Chưa đạt
HR Tỷ số nguy cơ (Tỷ số nguy cơ <1 lả IRESSA lợi thế hơn)
Nghiên cứu IFUM là nghiên cứu đa trung tâm, đơn nhánh, tiến hảnh trên các bệnh nhân
da trắng (n=106) bị ung thư phồi không tế bảo nhỏ có đột biến EGFR nhạy cảm hoạt hóa
để khẳng định rằng hoạt tính của gefitinib ở bệnh nhân da trắng vả bệnh nhân Châu Á lả
tương tự nhau. Theo đánh giá của nghiên cưu viên, trị số ORR 18 70% và trung vị PFS
lả 9,7 tháng. Các dữ liệu nảy cũng tương tự như cảc dữ liệu báo cáo trong nghiên cứu
IPASS.
Tinh trạng đột biển EGFR về đặc tính lâm sáng
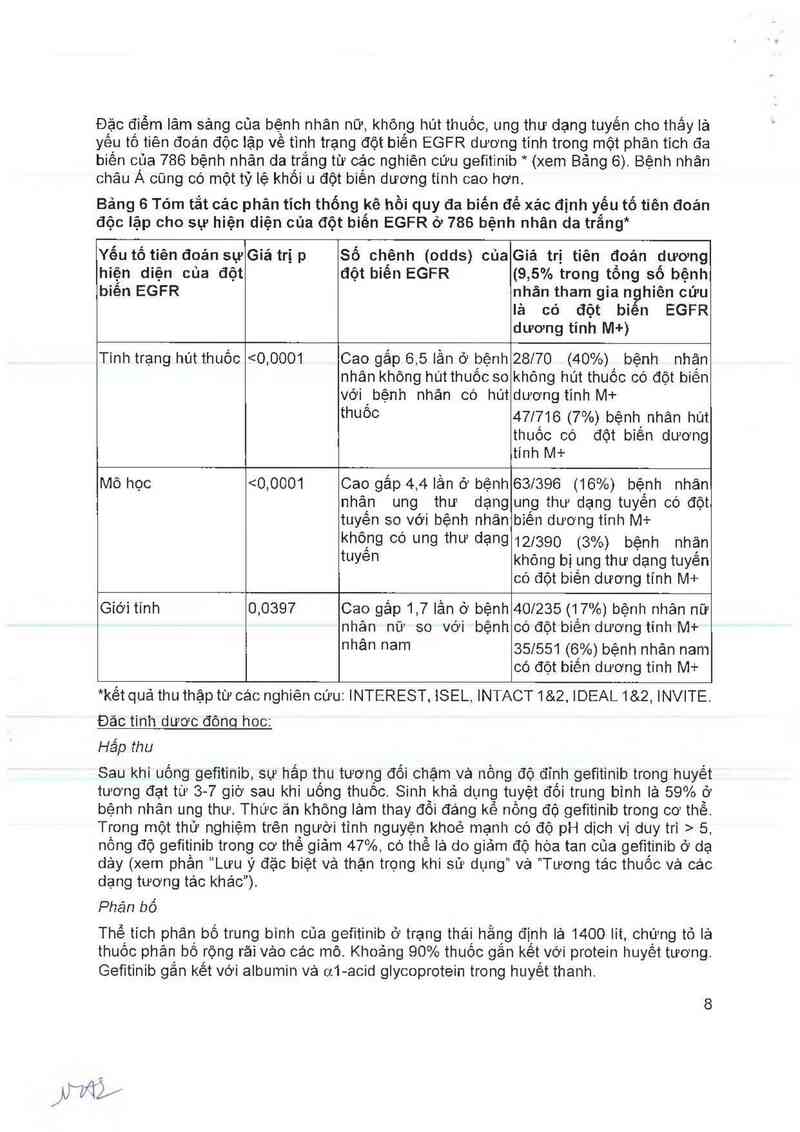
Đặc điếm lâm sảng của bệnh nhân nữ, khõng hút thuốc, ung thư dạng tuyến cho thấy là
yếu tổ tiên đoản độc iặp về tình trạng đột biến EGFR dương tinh trong một phân tich đa
biến của 786 bệnh nhân da trắng từ 080 nghiên cứu gefitinib * (xem Bảng 6). Bệnh nhân
châu Á củng có một tỷ lệ khối u đột biến dương tinh cao hơn.
Bảng 6 Tóm tắt các phân tỉch thống kê hồi quy đa biến để xác định yếu tổ tiên đoản
độc lặp cho sự hiện diện của đột biến EGFR ớ 786 bệnh nhân da trắng*
Yếu tổ tiên đoản sự
hiện diện của đột
biến EGFR
Giá trị p
Số chênh (odds) của
đột biến EGFR
Giá trị tiên đoản dương
(9,5% trong tổng số bệnh
nhân tham gia nghiên cứu
lá có đột biến EGFR
dương tỉnh M+)
Tình trạng hút thuốc
<0,0001
Cao gắp 6,5 lần ở bệnh
nhân không hút thuốc so
với bệnh nhản có hút
thuốc
28170 (40%) bệnh nhân
không hút thuốc có đột biền
dương tĩnh M+
471716 (7%) bệnh nhân hút
thuốc có đột biến dương
tính M+
Mô học
<0,0001
Cao gấp 4,4 lần ở bệnh
nhân ung thư dạng
tuyến 80 với bệnh nhân
không có ung thư dạng
63/396 (16%) bệnh nhân
ung thư dạng tuyên có đột
biên dương tĩnh M+
121390 (3%) bệnh nhân
tuyên không bị ung thư dạng tuyến
có đội biên dương tính M+
Giới tính 0,039? Cao gáp 1,7 lần ở bệnh 401235 (17%) bệnh nhân nữ
nhân nữ 80 với bệnh có đột biên dươngtính M+
nhân nam 35|551 (6%) bệnh nhân nam
có đột biến dương tinh M+
*kếtquả thu thập từ các nghiên cứu: INTEREST, iSEL, INTACT1&Z, IDEAL1&2, INVITE.
Đảo tinh dươc đông hoc:
Hắp thu
Sau khi uống gefitinib, sự hắp thu tương đối chậm vả nồng độ đỉnh gefitinib trong huyết
tương đạt từ 3-7 giờ sau khi uống thuốc. Sinh khả dụng tuyệt đối trung binh là 59% ở
bệnh nhân ung thư. Thưc ăn không lảm thay đỗi đáng kể nồng độ gefitinib trong cơ thể.
Trong một thử nghiệm trên người tinh nguyện khoẻ mạnh có độ pH dịch vị duy tri > 5,
nồng độ gefitinib trong cơ thể giảm 47%, có thể là do giảm độ hòa tan của gefitinib ở dạ
dảy (xem phần ”Lưu ý đặc biệt vả thận trọng khi sử dụng" vả ”Tương tác thuốc vả các
dạng tương tác khác”).
Phản bổ
Thẻ tich phân bố trung bình của gefitinib ớ trạng thải hảqg định lả 1400 lít, chớng tỏ lả
thuôo phân bộ rộng rãi vảo các mô. Khoảng 90% thuôo gãn kêtrvới protein huyêt tương.
Gefitinib găn kết với albumin vá oc1-acid glycoprotein trong huyêt thanh.
___wiL
Dữ liệu in vitro cho thắy rằng gefitinib là chắt nền cho sự vận chuyển qua mảng tế bảo
cùa protein ng.
Chuyến hóa
Dữ liệu in vitro chqthấy rằng CYP3A4 vả CYD2D6 lả isozym P450 chinh có liên quan
đên quá trình chuyên hóa oxy hóa cùa gefitinib.
Các nghiên cứu in vitro đã chứng tỏ gefitinib ít có khả nảng ức chế CYP2D6. Gefitinib
cho thậy không có tác động cảm ứng enzym trong các nghiên cứu ở động vật và không
ức chê đáng kê (in vitro) trên bât kỳ cytochrom P450 enzym.
Gefitinib được chuyến hóa rộng răi ở người. 5 chắt chuyển hóa đã được nhặn biết đầy
đủ trong phân vả 8 chắt chuyến hóa trong huyết tương ở người. Chắt chuyến hóa chính
được định danh lả O-desmethyl gefitinib, hoạt tính kém 14 lần so với gefitinib về khả năng
ức chế sự phát triền tế bảo được kích hoạt bởi EGFR và không có tác động ức chế sự
phát triển tế bảo khối u ở chuột. Vì vậy, chất chuyển hóa nảy được xem như không đóng
góp vảo tác động lâm sảng cùa gefitinib.
ln vitro, O-desmethyl gefitinib đã được chứng minh là sản sinh qua men CYP2D6. Vai trò
của men CYP2D6 trong quá trình thanh thải chuyến hóa gefitinib đă được đánh giá trong
1 nghiên cứu lâm sáng trên người tinh nguyện khỏe mạnh đã khảo sát kiều gen về tinh
trạng CYP2D6 (genotyped for CYP2D6 status). Ở người chuyền hóa kém, không phát
hiện O-desmethyl gefitinib được sản sinh ở mức độ có thể đo lường được. Nồng độ vả
thời gian tiêp xúc với gefitinib trong máu ở cả nhóm chuyền hóa mạnh vả nhóm chuyển
hóa kém đều biến thiên rộng và trùng lắp nhau nhưng nồng độ vả thời gian tiếp xúc trung
bình với gefitinib trong máu ở nhóm chuyển hóa kém thì cao gắp đỏi. Hiện tượng người
không có CYP2D6 có nồng độ thuốc vá thời gian tiếp xúc với thuốc trong mảu cao hơn
có thế có ý nghĩa lâm sảng vì đã gặp các phản ứng ngoại ý liên quan đến Iièu vá nồng
độ thuốc trong cơ thế.
Thải trừ
Gefitinib được bải tiết chủ yếu dưới dạng chắt chuyển hóa qua phân, độ thải trừ thuốc và
các chât chuyển hóa qua thận ít hơn 4% liêu dùng.
Tồng thanh thải gefitinib trong huyết tương lả khoảng 500 mllphút vá trung bình thời gian
bán thải cuối là 41 giờ ở bệnh nhân ung thư. Uống gefitinib một lần mỗi ngảy sẽ dẫn đến
tich lũy thuốc từ 2 đến 8 lần, với nồng độ và thời gian tiếp xúc ở trạng thái Ổn định đạt
được sau 7 —— 10 Iièu dùng. Ở trạng thái ồn định, nồng độ thuốc trong huyết tương tuần
hoản được duy tri gấp 2-3 lần với khoảng cách liều 24 giờ.
Các nhóm dân số đặc biệt
Khi phân tích đữ liệu dựa trên nhóm dân số ở bệnh nhân ung thư, không xác định có mối
liên hệ giữa nông độ đáy ở trạng thái ổn định đã tiên đoán trước (predicted steady state
trough concentration) và độ tuổi bệnh nhân, thể trọng, gìới tính, chủng tộc hoặc độ thanh
thải creatinin (>20 mi/phút).
Suy gan
Trong một nghiên cứu nhăn mớ pha | dùng liều đơn gefitinib 250mg trên bệnh nhân suy
gan nặng, trung bình hoặc nhẹ do xơ gan (theo phân Ioại Chiid—Pugh), đá có sự gia tăng
về nồng độ thuốc trong máu trong tắt cả nhóm so với nhóm chứng khỏe mạnh. Đã ghi
nhận có mức độ phơi nhiễm với gefitinib tăng trung bình gắp 3,1 lần ở bệnh nhân suy
9
gan trung binh vá nặng. Không có bệnh nhân nảo bị ung thư, tắt cả đèu bị xơ gan và vải
người bị viêm gan. Sự tăng mức phơi nhìễm nảy có ý nghĩa iảm sảng vì đã gặp các phản
ưng ngoại ý liên quan đến liều và mức phơi nhiễm với thuốc trong cơ thề.
Gefitinib đă được đánh giá trong một thử nghiệm lâm sảng thực hiện trên 41 bệnh nhân
có bướu đặc (solid tumour) và chức nãng gan bình thường, suy chức năng gan trung
bình hoặc nặng (phân loại Tiêu chuẩn Đảnh giá Độc tinh Thường gặp dựa vảo AST,
alkalin phosphatase vả bilirubin) do di căn gan. Kết quả cho thắy sau khi dùng liêu hảng
ngảy IRESSA 250 mg, các trị 86 như thời gian đạt nồng độ ôn định trong máu, tồng độ
thanh thải huyết tương và mức tiếp xúc ở trạng thái ỗn định (C…axss, AUCz4ss) tương tự ở
các nhóm có chức năng gan binh thường vả chức năng gan suy giảm mức độ trung bình.
Dữ liệu của 4 bệnh nhân có chức nảng gan rối ioạn trầm trọng do di căn gan cho thắy
mức phơi nhiễm ở trạng thái Ổn định của các bệnh nhân náy củng tương tự như ở bệnh
nhân có chức năng gan bình thường.
QUY CÁCH ĐÓNG GÓI
Hộp 1 túi nhôm x 3 ví x 10 viên nén bao phim.
CHỈ ĐỊNH ĐIẺU TRỊ
IRESSA được chỉ định điệu trị chg bệnh nhân ngưới lớn ung thư phồi loại không phải tế
bảo nhỏ giai đoạn tiên triẻn tại chõ hoặc di căn má có đột biên hoạt hóa EGFR TK.
LIẺU DÙNG VÀ CÁCH DÙNG
Việc điệu trị với IRESSA nên được tiến hảnh và theo dõi bới cảc bác sỹ có kinh nghiệm
trong điêu trị ung thư.
Liều khuyến cáo IRESSA là 1 viên 250 mg, ngảy 1 lần. Nếu quên dùng 1 liều thuốc, nên
uộng ngay khi nhớ ra. Nếu việc quên uống thuốc dưới 12 giờ tỉnh đến thời điểm dùng
iiều kế tiếp, bệnh nhân không nên dùng liều thuốc đã lỡ quên uống. Bệnh nhản không
nên dùng liều gắp đôi (uống cùng lúc 2 liều thuốc) để bù cho liều đã quên uống
Trẻ em
Độ an toản vả hiệu quả của IRESSA ở trẻ em và thiếu niên dưới 18 tuổi chưa được thiết
iập. Chưa có sử dụng gefitinib trên trẻ em Với chỉ định ung thư phòi ioại khỏng phải tê
nảo nhỏ.
Suy gan
Bệnh nhân suy gan trung bình đến nặng (Child Pugh B hoặc C) 00 xơ gan có tảng nồng
độ gefitinib trong huyết tương. Nên theo dõi chặt chẽ các phản ứng ngoại ý ở các bệnh
nhân náy. Nổng độ trong huyết tương không tăng ở bệnh nhân có tăng aspartat
transaminase (AST), alkaiin phosphatase hoặc biiirubin do di căn gan (xem phần "Đặc
tinh dược động học").
Suy thận
Không cần điều chinh liều ở bệnh nhân suy giảm chức nảng thặn có độ thanh thải
creatinin >20 mllphút. Có rât ít số iiệu ở bệnh nhân độ thanh thải creatinin S20 mllphút
và cần thận trọng khi sử đụng thuốc ở nhóm bệnh nhân náy (xem phần “Đặc tính dược
động học”).
Bệnh nhân cao tuổi
10
N"'L’Úz
Không cần điều chỉnh liêu dưa vảo lứa tuỗi cùa bệnh nhân (xem phần "Đặc tinh dươo lực
học”).
Bệnh nhân có suy giảm enzym CYP2DG
Không có khuyến cáo chỉnh liều cụ thể ở bệnh nhân có kiểu gen chuyền hóa qua CYP2D6
giảm, nhưng ở các bệnh nhân nảy nên được theo dõi chặt chẽ các phản ứng ngoại ý
(xem phân “Đặc tính dược lực học”).
Điểu chĩnh fiều khi có độc tính của thuốc
Bệnh nhân bị tiêu chảy hoặc có phản ứng ngoại ý trên da mả không dung nạp có thể
được kiểm soát thảnh cỏng khi ngưng dùng thuốc trong một thời gian ngăn (s 14 ngảy)
vả sau đó dùng trở lại liều 250 mg (xem phần Tảo dụng không mong muôn ”.) Đối với
bệnh nhân không thể dung nạp thuốc sau một đợt ngắt quăng điều trị, nên ngưng sử
dụng gefitinib và cân nhắc phương pháp điều trị thay thề.
Cảch dùng:
Có thể uống thuốc trcng hoặc ngoải bữa ản, cùng một thời gian trong ngảy Thuốc có thể
được nuốt nguyên viên cùng với một ít nước hoặc trường hợp không thể uống nguyên
viên thuốc thì có thể phân tán viên thuốc trong nước Nên thả viên thuốc trong nửa ly
nước uống (không chưa carbonat). Khộng nên dùng chung với các thức uống khảo
Không được nghiền viên thuốc, thả nguyên viên thuốc trong nửa ly nước. Khuắy đều cho
đến khi viên thuốc phân tán hoản toản (khoảng 20 phút) vả uống dịch thuốc ngay lặp tức
sau khi thuốc phân tán hoản toản (nghĩa là trong vòng 60 phút). Tráng ly vơi nửa ly nước
và uống Dịch thuốc phân tán cũng có thể được dùng qua ồng thông mủi- dạ dáy hoặc
ống thông dạ dảy.
CHỐNG CHỈ ĐỊNH
Quá mẫn Với hoạt chắt hay tá dược.
Phụ nữ đang cho con bú.
LƯU Ý ĐẶC BIỆT VÀ THẬN TRỌNG KHI SỬ DỤNG
Thân trong
Khi xem xét sử dụng IRESSA để điều trị cho bệnh nhân ung thư phổi loại không phải tế
bảo nhỏ giai đoạn tiến triễn hoặc di căn, khuyến cảo xét nghiệm đánh giá đột biến EGFR
tại mỏ khối u cho tầt cả các bệnh nhân. Nếu mẫu khối u không thể đánh giá được, thi có
thể sử dụng mẫu DNA của khối u trong hệ tuần hoán (ctDNA) thu thập từ mẫu máu (huyết
tương). Chỉ dùng các phương pháp xét nghiệm có độ tái lặp, độ tin cậy, độ nhạy cùng
với tiện ích đă được chưng minh về xác định tinh trạng đột biên EGFR của khối u hay
ctDNA để tránh kết quả âm tính giả hay dương tính giả (xem phần Đặc tinh dược lực
học”).
Bệnh phổi mô kẽ (ILD)
Bệnh phối mô kê, có thề khới phát cấp tính, đã được quan sát thắy ơ 1,3% bệnh nhân
đang dùng gefitinib, vả một vải trường hợp có thế bị tử vong (xem phần Tác Dụng Không
Mong Muốn) Nếu bệnh nhân có biểu hiện xầu đi với 080 triệu chứng hô hắp như khó
thở, ho và sốt, nên ngưng IRESSA và cho kiểm tra ngay. Nếu xảo nhận chẩn đoán là
bệnh phổi mô kê, nên ngưng dùng IRESSA vả điều trị bệnh nhân bằng các biện phảp
thich hợp.
11
Trong một nghiên cứu dược lý dịch tế có đối chứng tại Nhật thực hiện trên 3159 bệnh
nhân ung thư phối loại không tế bảo nhỏ (NSCLC) đã được theo dõi trong 12 tuần khi
dùng gefitinib hoặc hóa trị, các yếu tố nguy cơ phát triển bệnh phồi mô kẽ (ILD) như sau
đã được xác định (bất kể bệnh nhân dùng IRESSA hoặc hóa trị) lả: hút thuốc, tình trạng
thể chắt kém (PSEZ), giảm thể tích phối binh thường có chứng cứ chụp cắt lớp CT
(s50%), mới được chẩn đoán NSCLC (< 6 tháng), bệnh phồi mô kẻ (ILD) có sẫn trước,
iớn tuỗi (2 55 tuồi) và bệnh tim đồng thời. Đã ghi nhận gia tăng nguy cơ bệnh phối mô kê
ở nhóm dùng gefitinib so với hóa trị chủ yếu trong vòng 4 tuần đầu sử dụng (giá trị OR
hiệu chỉnh 3,8; 95% Ct 1.9 — 7,7); sau đó nguy cơ tương đối thắp hơn (giá trị OR hiệu
chỉnh 2,5; 95% Cl 1,1-5,8). Trong số bệnh nhân bị ILD ở cả 2 nhom iRESSA vả hộa trị
thì nguy cơ tử vong cao ở nhóm bệnh nhân có 086 yếu tố nguy cơ sau: hút thuốc, giảm
thế tich phối bình thường có chứng cứ chụp cắt lớp CT (S.50%), bệnh phổi mô kẽ (ILD)
có sẳn trước, lớn tuồi (2 65 tuổi) vả các vùng dính liền với mảng phồi quá rộng (250%).
Ngộ độc gan vả suy giảm chức năng gan
Bắt thường xét nghiệm chức năng gan (bao gồm tăng aianin aminotransferase, aspartat
aminotransferase, bilirubin) đã được ghi nhận nhưng ít khi có biều hiện viêm gan (xem
phần "Tác dụng không mong muốn"). Vải báo cáo riêng lẻ suy chức năng gan mè một số
trường hợp dẫn đến tử vong. Vì vậy, bệnh nhân được khuyến cáo nên kiềm tra chức
năng gan định kỳ. Gefitinib nên được dùng thận trọng trên bệnh nhãn có thay đồi chức
năng gan ở mưc độ nhẹ hoặc trung binh. Cản nhắc ngưng sử dụng thuốc nếu các thay
đối là nghiêm trọng.
Suy giảm chức nãng gan dọ xơ gan đă được ghi nhận lả dẫn đến tăng nồng độ gefitinib
trong huyêt tương (xem phân "Đặc tính dược lực học”).
Tương tác với các thuốc khác
Các chắt gây cảm ứng với hệ enzym CYP3A4 có thể Iảm tăng chuyền hớa gefitinib và
giảm nồng độ gefitinib trong huyết tương. Vì vậy, khi phối hợp với các chắt gảy cảm ứng
CYP3A4 (như phenytoin, carbamazepin, rifampicin, barbiturat hoặc chế phẫm từ dược
liệu có chứa St John’s WortlHypericum perforatum) có thề Iảm giảm hiệu lực của thuốc
vả vì thế nên tránh sử dụng chung các thuốc nảy (xem phần Tương Tác Thuốc và các
Dạng Tương Tác Khác).
Ở các bệnh nhân có kiếu gen chuyền hộa qua CYP2D6 giảm, điều trị bằng thuốc ức chế
mạnh CYP3A4 có thể dẫn đến tăng nồng độ của gefitinib trong huyêt tương. Khi bắt đầu
điều trị bằng thuốc ưc chế CYP3A4, bệnh nhân cần được theo dõi chặt chẽ các phản
ứng ngoại ]? của gefitinib (xem phần "Tương tác với cảc thuốc khác vả các dạng tương
tảc khác").
Tăng INR (international Normalised Ratio) vả/hoặc các biến cô xuất huyết đă được báo
cáo ở một số bệnh nhân đang dùng warfarin (xem phần "Tương Tảo Thuốc và các Dạng
Tương Tác Khác”). Nên thường xuyên theo dõi sự thay đối về thời gian prothrombin (PT)
hoặc INR ở bệnh nhân đang dùng warfarin.
Các thuốc Iảm tăng đáng kể vả kéo dải độ pH dịch vị như thuốc ức chế bơm proton vá
thuốc đối kháng thụ thể Hz có thể lảm giảm sinh khả dụng và nồng độ gefitinib trong huyết
tương và vì thế có thệ giảm hiệu lực của thuốc. Thuốc khảng acid nếu dùng thường
xuyên gần thời điểm uống thuốc gefitinib có thế có tảo động tương tự (xem phần’ Tương
Tác Thuốc vả cảc Dạng Tương Tác Khác“ vả 'Đặc Tinh Dược Động Hoc )
12
.iJ-vi-i. …
Dư liệu từ 086 nghiên cưu iâm sảng pha II, khi dùng đồng thời gefitinib vả vinorelbin cho
thây gefitinib có thẻ lảm tăng tảo động giảm bạch câu trung tính của vinorelbin.
Lactose
IRESSA có chứa lactose. Bệnh nhân có vấnđê di truyền hiếm gặp kém dung nạp
galactosẹ, thiêu hụt Lapp Iactose hoặc kém hâp thu glucose—galactose thi không nên
dùng thuôo nảy.
Các thận trọn g khác:
Nên khuyên bệnh nhân khám bác sỹ ngay lập tức khi có tiêu chảy trầm trọng hoặc dai
dẳng, buồn nôn, nôn hoặc biếng ản mã có thể gián tiếp dẫn tới mất nước cơ thể. Các
triệu chứng nảy có thế được xử trí theo bệnh cảnh lâm sảng (xem phần Tác Dụng Không
Mong Muốn).
Bệnh nhân có cảc dắu hiệu vả triệu chưng nghi ngờ viêm giác mạc như tình trạng cắp
tính hay trâm trọng hơn: viêm măt, tuyên_iệ, mân cảm với ánh sảng, nhỉn mờ, đau mảt
vả/hoặc đỏ măt nên nhanh chóng tham vân bác sĩ chuyên khoa măt.
Nêu chần đoán đã xác định l3ả viêm loét giảc mạc, nẻn ngưng điều trị với gefitinib vả nếu
các triệu chứng khõng hêt hăn hoặc tái phát khi sử dụng lại gefitinib, cân nhão ngưng sử
dụng lâu dái gefitinib.
Trong 1 nghiên cứu pha Illl sử dụng gefitinib vả xạ trị ở bệnh nhân nhi mới được chần
đoán u thần kinh đệm cuống nảo (brain stem glioma) hoặc u thần kinh đệm ác tính trên
lều đã được cắt bỏ không hoản toản (incompletely resected supratentorial malignant
glioma), có 4 trường hợp xuất huyết ở hệ thần kinh trung ướng (trong đó có 1 trường
hợp tử vong) đã được ghi nhận trong 45 bệnh nhân tham gia nghiên cứu. Một trường
hợp xuất huyết ở hệ thần kinh trung ương ở trẻ u mảng não thất (ependymoma) củng
được ghi nhận trong thử nghiệm dùng gefitinib đơn thuần Việc tăng nguy cơ xuất huyết
năo ở bệnh nhân trưởng thảnh bị ung thư phồi loại không phải tế bảo nhỏ dùng iRESSA
chưa được thiết lập.
Đã có ghi nhận thũng dạ dảy ruột ở bệnh nhân dùng gefitinib. Trong đa số các trường
hợp, điều nảy có liên quan đến các yếu tố nguy cơ đã biết khảo, bao gồm tuỗi cao, sử
dụng đồng thời các thuốc khác như steroid, kháng viêm NSAID, bệnh nền loét dạ dảy
ruột, hút thuốc hoặc di cản ở ruột tại vị trí thíing.
Phu nữ có thai và cho con bú
Phụ nữ trong độ tuổi sinh sản
Khuyến các phụ nữ trong độ tuỗi sinh sản không nên có thai trong quá trinh điêu trị với
thuôo nảy.
Phụ nữ mang thai
Chưa có dữ iiệu về việc dùng gefitinib cho phụ nữ có thai. Các nghiên cưu trên động vặt
đã chứng tỏ thuốc có độc tính trện hệ sinh sản. Chưa biết khả nảng nguy cơ đối với con
người. Không nên dùng IRESSA trong thai kỳ trừ khi thật sự rắt cân thiết.
Phụ nữ đang cho con bú
Hiện vẫn chưa biết liệu gefitinib có bải tiết qua sữa ở người hay không. Gefitinib và các
chât chuyên hóa của gefitinib đi vảo sữa của Chuột thí nghiệm. Chông chỉ định dùng
13
gefitinib trong Ifth đang cho con bú vả vi thệphụ nữ đang cho oon bú phải ngưng cho con
bú trong khi điêu trị băng IRESSA (xem phân”Chông chỉ định").
Ành hưởng trện khả năng lải xe và vản hảnh mảv móc
Đã có bảo các về triệu chứng suy nhược trong khi điều trị bằng gefitinib. Do đó, các bệnh
nhản có triệu chứng nảy nên thận trọng khi iái xe hoặc vận hảnh máy.
TƯỢNG TÁC CÙA THUỐC VỚI cÁc THUỐC KHÁC VÀ cÁc LOẠI TươNG TÁC
KHAC
Gefitinib chuyển hộa qua cytochrom P450, chủ yếu lá isoenzym CYP3A4 và qua
CYP2D6.
Các th uổc có thể iảm táng nồng độ gefitinib trong máu
Các nghiên cứu in-vitro chợ thắy gefitinib là một chầt nền của giycoprotein. Các dữ iiệu
hiện nay không có chi ra bât kỳ mội liên quan iảm sảng với phát hiện in-vitro nảy.
Các thuốc ưc chế CYP3A4 có thề lảm giảm độ thanh thải của gefitinib. Sử dụng đồng
thời vởi các thuốc ức chế mạnh hoạt động của CYP3A4 (như ketoconazol, posaconazol,
voriconazol, thuốc ưc chế enzym protease, ctarithromycin, telithromycin) có thế lảm tăng
nồng độ gefitinib trong huyết tương. Sự gia tăng nảy Có thể có ý nghĩa về mặt lâm Sảng
vì đã ghi nhận cảc phản ứng ngoại ý liên quan đên liều vả nồng độ thuốc trong cơ thế.
Sự gia tăng nảy có thế cao hơn ở cá thể bệnh nhản có kiểu gen chuyến hóa qua CYP2D6
giảm. Điều trị trước với itraconazoi (một thuốc ức chế CYP3A4 mạnh) đã lảm tảng 80%
trị số AUC trung binh của gefitinib ở người tỉnh nguyện khoẻ mạnh. Nếu dùng đồng thời
với thuốc ức chế CYP3A4, nên theo dõi chặt chẽ các phản ứng ngoại ý của gefitinib.
Chưa có dữ iiệu về việc điều trị đồng thới với thuốc ức chế CYP2D6 nhưng cảc thuốc ưc
chế mạnh enzym nảy có thế iảm tăng nồng độ gefitinib trong huyết tương khoảng 2 lần
ở các bệnh nhân có chuyển hóa mạnh qua CYP2D6. Nếu dùng đồng thời với thuốc ức
chế mạnh CYP2D6, nên theo dõi chặt chẽ các phản ứng ngoại ý trên bệnh nhản.
Các thuốc lâm giảm nồng độ gefitinib frong huyết tương
Các thuốc cảm ưng CYP3A4 có thể iảm tăng chuyển hóa vả Iảm giảm nồng độ gefitinib
trong huyết tương vả vì thế lảm giảm hiệu lực của gefitinib. Nên tránh sử dụng đồng thời
với các thuốc cảm ứng CYP3A4 (như phenytoin, carbamazepin, rifampicin, barbiturat
hoặc có St John's wort (Hypericum perforatum». Điều trị trước với rifampicin (thuốc cảm
ứng CYP3A4 mạnh) ở người tình nguyện khỏe mạnh lảm giảm khoảng 83% trị SỔ AUC
trung binh (xem phần "Lưu ý đặc biệt và thận trọng khi sử dụng").
Các thuốc Iảm tảng đáng kể nồng độ pH dịch vị có thể lảm giảm nồng độ gefitinib trong
huyết tương vả vì thế Iảm giảm hiệu lực của gefitinib. Liều cao các thuốc khảng acid tảo
động ngắn có thể có tác động tương tự nếu dùng thướng xuyên sảt thời điếm dùng
gefitinib. Dùng đồng thời gefitinib với ranitidin ở mức liều Iảm tảng kéo dải pH dịch vị E5
dẫn đến giảm khoảng 47% trị số AUC trung bình ở người tình nguyện khỏe mạnh (xem
phần "Lưu ý đặc biệt và thận trọng khi sử dụng” và “Đặc tính dược lực”)
Các thuốc bị thay đổi nồng độ trong huyết tương do ảnh hưởng của gefitinib
Các nghiên cứu in- vitro cho thắy gefitinib it có khả năng ưc chế CYP2DG Trong một thử
nghiệm iảm sảng, gefitinib được dùng đồng thời với metoprolol (một chắt nền của
CYP2D6). Điều nảy lảm tăng 35% nông độ và thời gian tiếp xúc với metoprolol. Việc gia
14
Wffl
tăng nảy có ý nghĩa với các chầt nẻn CYP2D6 có chỉ số điều trị hẹp. Cân nhắc khi sử
dụng các chắt nên CYP2D6 phối hợp với gefitinib, cần điều chỉnh liều của chắt nền
CYP2D6, đặc biệt iả cảo thuốc có cửa số trị liệu hep.
Gefitinib ức chế protein vận chuyền BCRP in-vitro, nhưng vẫn chưa rõ cảc mối liên quan
trện lâm sảng với phát hiện nảy.
Các khả năng tương tác khác
Tăng INR vảlhoặc các biến cố xuất huyết đã được báo cáo ở một vải bệnh nhân dùng
warfarin (xem phần 'Lưu ý đặc biệt vả thận trọng khi sư dụng’ ’)
TÁC DỤNG KHÔNG MONG MUỐN
Tóm tắt dữ liệu an toản thuốc
Dữ liệu gộp từ các 111ử nghiệm lâm sáng pha 111 như ISEL, INTEREST vả IPASS (thưc
hiện trên 2462 bệnh nhân điếu trị với IRESSA), cảc phản ứng ngoại ý do thuốc (ADR)
thông thường nhất được ghi nhận xảy ra trên > 20% bệnh nhân lả tiêu chảy và phản ưng
trên da (bao gồm nồi mấn, mụn, da khô và ngưa). Các phản ứng ngoại ý do thuốc thường
xuất hiện trong tháng đầu điều trị và nói chung có thể tự hết. Khoảng 8% bệnh nhân có
phản ứng ngoại ý trầm trọng (độ 3 vả 4 theo Tiêu chuẩn Đánh giá Độc tính Thường gặp
- CTC: Common Toxicity Criteria). Tuy nhiên, chi có 3% bệnh nhân lả phải ngưng điêu trị
do phản ứng ngoại ý.
Bệnh phồi mô kê (ILD) xảy ra ở 1,3% bệnh nhân, thường gặp mưc độ nghiêm trọng (độ
3-4 theo theo Tiêu chuẩn Đánh giá Độc tính Thường gặp). Củng có ghi nhận hậu quả lả
tử vong.
Bảng phản Ioai phản ứng nqoai \?
Dữ liệu an toản thuốc trinh bảy trong Bảng 7 được dưa trên các chương trình phát triền
lâm sảng của gefitinib. Phản ứng ngoại ý được sắp xếp theo cột tần 86 ở Bảng 7 nếu có
thể dựa trên tỷ lệ các báo các phản ứng ngoại ý có thể so sánh được trong dư iiệu gộp
từ các thử nghiệm lâm sảng pha il! như ISEL, INTEREST vả IPASS (trên 2462 bệnh
nhân điêu trị với IRESSA).
Tần số xảy ra các phản ứng ngoại ý được xảo định như sau: rắt thường gặp (2 1110);
thướng gặp (> 11100 - < 1110); it gặp (2 111, 000— < 11100), hiếm gặp (2 1/10, 000- <
111 ,;000) rắt hiềm gặp (< 1110 ,,000) chưa biết (không thể dự đoán từ các dữ liệu sẵn có).
Trong mỗi nhóm phân loại, cảc phản ứng ngoại ý được sắp xếp theo trinh tự mức độ
giảm dản.
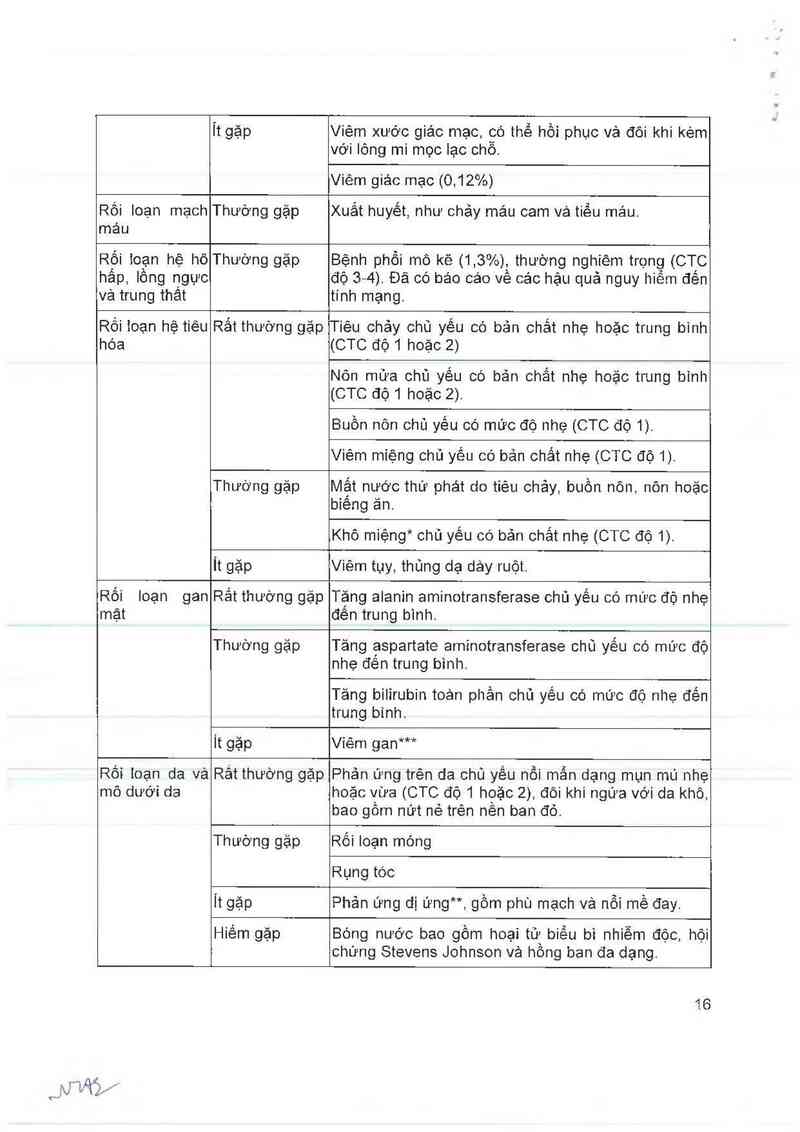
Bảng 7 Phản ứng ngoại ỷ
Phản ứng ngoại ỷ phản loại theo cơ quan vả tần số
Rối loạn Rắt thường gặp Biếng ăn có bản chắt nhe hoặc trung bình (CTC độ 1
chuyền hóa và hoặc 2).
dinh dưỡng
Rối loạn mắt Thường gặp Việm kết mạc, mống mắt vả khô mắt*, chủ yếu có bản
Chât nhẹ (CTC độ 1).
15
,ƯifAil’
Ít gặp
Viêm xước giảc mạc, có thể hồi phục và đôi khi kèm
với lộng mi mọc lạc chô.
Viêm giác mạc (0,12%)
Rối loạn mạch Thường gặp Xuất huyết, như chảy mảu cam vả tiều máu.
mảu
Rối toạn hệ hô Thường gặp Bệnh phổi mô kẽ (1,3%), thường nghiêm trọng (CTC
hắp, lồng ngực
vả trung thât
độ 3—4). Đã có báo các vệ các hậu quả nguy hiềm đến
tính mạng.
Rối toạn hệ tiêu
hóa
Rắt thường gặp
Tiêu chảy chủ yếu có bản chắt nhẹ hoặc trung bình
(CTC độ 1 hoặc 2)
Nôn mửa chủ yếu có bản chắt nhẹ hoặc trung binh
(CTC độ 1 hoặc 2).
Buồn nôn chủ yếu có mức độ nhẹ (CTC độ 1).
Viêm miệng chủ yêu có bản chắt nhẹ (CTC độ 1).
Thướng gặp Mật nước thứ phát do tiêu chảy, buồn nôn, nôn hoặc
bỉêng ăn.
Khô miệng* chủ yếu có bản chất nhẹ (CTC độ 1).
it gặp Viêm tụy, thủng dạ dảy ruột.
Rối Ioạn gan
mật
Rắt thường gặp
Tảng alanin aminotransferase chủ yếu có mức độ nhẹ
đên trung bình.
Thường gặp Tăng ạspartate aminotransferase chủ yếu có mức độ
nhẹ đên trung bình.
Tăng bilirubin toán phần chủ yếu có mức độ nhẹ đến
trung binh.
it gặp Viêm gan***
Rối ioạn da và
mô dưới da
Rảt thường gặp
Phản ứng trên da chủ yếu nồi mần dạng mụn mú nhẹ
hoặc vừa (CTC độ 1 hoặc 2). đôi khi ngứa với da khô,
bao gôm nứt nẻ trẻn nên ban đỏ.
Thường gặp Rối loạn móng
Rụng tóc
Ít gặp Phản ứng dị ứng”, gồm phù mạch và nỗi mề đay.
Hiếm gap Bóng nước bao gồm hoại từ biểu bì nhiễm độc, hội
chứng Stevens Johnson và hồng ban đa dạng.
,_…iify
16
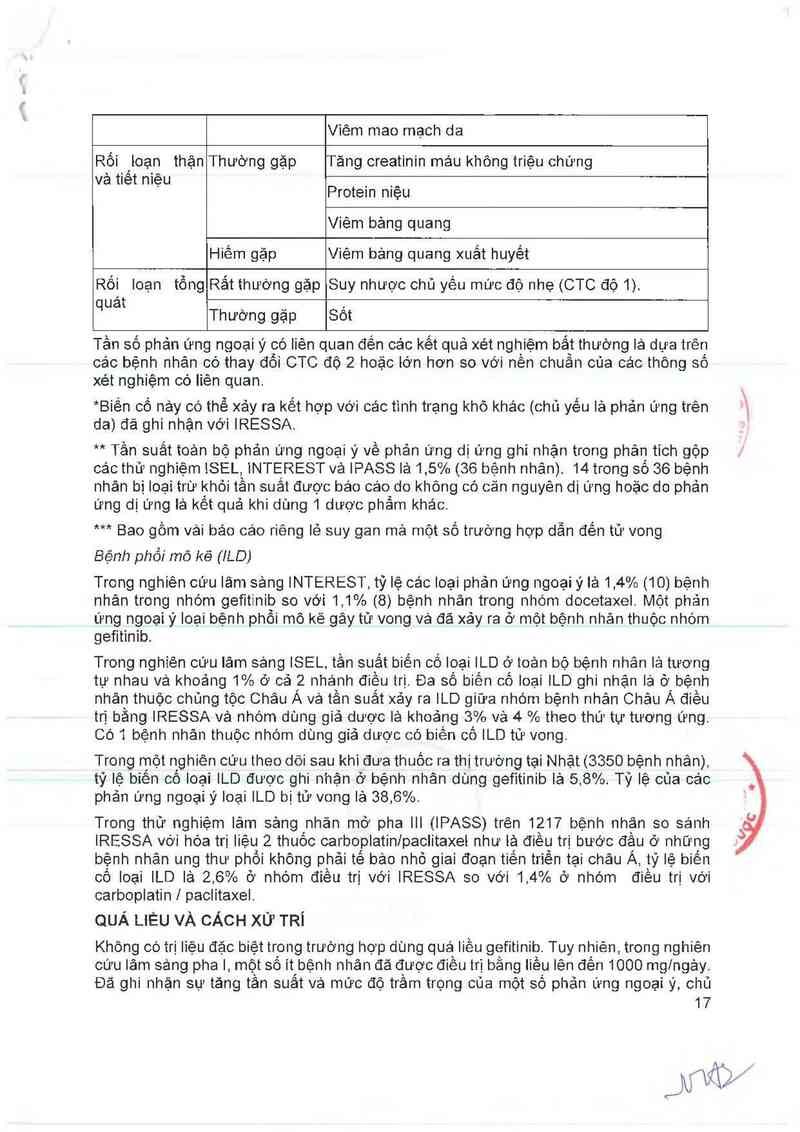
Viêm mao mạch da
Rối 'ioạn thặn Thường gặp Tảng creatinin máu không triệu chứng
vả tiêt niệu
Protein niệu
Viêm bảng quang
Hiếm gặp Viêm bảng quang xuất huyết
Rối loạn tồng Rắt thường gặp Suy nhược chủ yếu mức đó nhe (CTC độ 1).
quảt
Thường gặp Sốt
Tần số phản ứng ngoại ý có Iièn quan đến các kết quả xét nghiệm bắt thường lả dựa trên
các bệnh nhân có thay đổi CTC độ 2 hoặc iớn hơn so với nên chuân của các thông sô
xét nghiệm có liên quan.
*Biến cố nảy có thể xảy ra kết hợp Với các tinh trạng khô khác (chủ yếu lả phản ứng trên \
da) đã ghi nhặn với IRESSA.
** Tần suất toản bộ phản ưng ngoại ý về phản ưng dị ứng ghi nhận trong phân tich gộp
các thử nghiệm iSEL, iNTEREST vả IPASS lả 1,5% (36 bệnh nhân). 14 trong số 36 bệnh
nhân bị Ioại trừ khỏi tần suất được báo cáo do không có căn nguyên dị ứng hoặc do phản
ưng dị ứng iả kết quả khi dùng 1 dược phầm khảo.
*** Bao gồm vải báo cáo riêng iẻ suy gan mà một số trường hợp dẫn đến tử vong
Bệnh phổi mô kẽ (1LD)
Trong nghiên cứu lâm sảng INTEREST, tỷ lệ các Ioại phản ứng ngoại ý là 1,4% (10) bệnh
nhân trong nhóm gefitinib so với 1,1% (8) bệnh nhân trong nhóm docetaxel. Một phản
ứng ngoại ý loại bệnh phổi mô kẽ gây tử vong và đã xảy ra ở một bệnh nhân thuộc nhóm
gefitinib.
Trong nghiên cứu lâm sảng ISEL, tần suất biến cố ioại ILD ở toản bộ bệnh nhân là tương
tự nhau vả khoảng 1% ở cả 2 nhánh điếu trị. Đa số biến cố loại ILD ghi nhận là ở bệnh
nhân thuộc chủng tộc Châu Á và tần suất xảy ra ILD giữa nhóm bệnh nhân Châu Á điếu
trị bằng IRESSA và nhóm dùng giả dược là khoảng 3% vả 4 % theo thứ tự tương ứng.
Có 1 bệnh nhân thuộc nhóm dùng giả dược có biến cố ILD tử vong.
Trong một nghiên cứu theo dõi sau khi đưa thuốc ra thị trường tại Nhật (3350 bệnh nhân),
tỷ lệ biên có Ioại ILD được ghi nhận ở bệnh nhãn dùng gefitinib 15] 5,8%. Tỷ lệ cùa các
phản ửng ngoại ý loại ILD bị tử vong lả 38,6%.
Trong thử nghiệm lâm sảngnhản mớ pha III (IPASS) trên 1217 bệnh nhận so sánh
IRESSA với hóa trị liệu 2 thuôo carboplatinlpaclitaxel như iặ điếg trị bước đậu ở những
bệnh nhân ung thư phồi không phải tế bảo nhỏ giai đoạn tiên triên tại châu A, tỷ lệ biên
có loại ILD lả 2,6% ở nhóm điêu trị với IRESSA so với 1,4% ở nhóm điêu trị với
carboplatin 1 paclitaxel.
QUÁ LIẺU vÀ CÁCH xư TRÍ
Không có trị liệu đặc biệt trọng trường hợp dùng quá` liều gefitinib. Tuy nhiên, trong nghiên
cứu lâm sáng pha I, một sô itbệnh nhân đã được điêu trị băng liệu Ièn đên 1000 mglngảy.
Đã ghi nhặn sự tăng tân suât và mức độ trâm trọng của một sô phản ưng ngoại ý, chủ
17
yếu là tiêu chảy và ban da. Các phản ứng ngoại ý do dùng quá liều nên được điếu trị
triệu chứng; đặc biệt tình trạng tiêu chảy nặng nên được điếu trị theo chỉ định lâm sảng
Trong một nghiên cứu với sô lượng giới hạn bệnh nhân được điếu trị hảng tuần với liều
từ 1500 mg đến 3500 mg. Trọng nghiên cứu nảy, nồng độ và thời gian tiếp xúc với
IRESSA không tăng cùng với liếu, các phản ứng ngoại ý chủ yếu ở mức độ nhẹ đến trung
binh vả phù hợp với các dữ iiệu an toản thuốc IRESSA đã biết
cÁc oÁu HIỆU CÀN LƯU Ý VÀ KHUYẾN cÁo
Không áp dụng.
ĐIỀU KIỆN BẢO QUẢN, HẠN DÙNG CÙA THUỐC
Điều kiên bảo quản: Không bảo quản qua' 30°C. Bảo quản trong bao bì gốc.
Han dùng: 3 năm kế từ ngảy sản xuất.
TÊN, ĐỊA CHỈ CÙA cơ sơ SÀN XUẤT
AstraZeneca UK Limited
Siik Road Business Park, Macclesfield, Cheshire, SK1O 2NA, Anh.
NGÀă XEM XÉT SỬA ĐỎI, CẬP NHẬT LẠI NỘI DUNG HƯỚNG DẢN SỬ DỤNG
THU C
ddlmmlyy
Doc lD— ....... Version
@ AstraZeneca 2003-2016
IRESSA is a trade mark of the AstraZeneca group of companies.
AstraZenecaẾ
TUQ.CỤC TRLỞNG
P.TRƯỈJNG PHÒNG
18
ftfflứ’ởx
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng