






















///////////
vsn m .
nuan itinđn'llomwx
mmmũĩt mun… wmunyam
cnmwuwv 011 MW
km Ju…
uMuumm
211.115 0184)
L
QthW
nỀỊANQUJỊ
nmtđn ng
BỘ Y TẾ
cư QUẢN LÝ nuoc
Đ…ễgPHÊ nunì1
Lân đáÚẵ..ẳầĩJhuẳ.....thẩĩit'fs
Wapluloc
. . J'L
1mbruv1oa'
140 mg
Ibruttnlb
Each capsuie comains
140 mg ot btutinib.
Directions im use: tot om!
edmlnictrntion. Pie… read
packagc incen.
Keep outct the cightmd mach
olchiiđren.
Donotuiorc above 30'0. l
Rx only
. . 'L
1mbruv1ẻa*
ibrutinib
Rx THUOC BAN THEO ĐơN.
tbmtlnlb 140mg Hop 1 10 90 vien
nnng
cni <11m. cam dùng. móng mt
đinh vi! các thong tin khác: xin
xem từ hướng dẫn sử dung kèm
theo.
Bủo quản khóng quá 30°C
Sân xuất tại: Catatent CTS, LLC.
10245 thtman Mills Drive.
Kansas City. Mo 64137. Mỹ,
Dán nhãn vả dòng gói lai: Ander~
sonBrecon inc 4545 Assembly
Drive, Rodđord. IL 61109. Mỹ
imbruviểẵ°
Each eepsule oontaim
140 mg oi lbrutinlh
Direotions tot use: iol orai
administretion. Piessc read
peckage insert.
Keep cut ot the cight and reech
oi chtidren.
Do not store ahơve 30°C
leonly
tẺharmacifflljcs' Janssenj' i
SP_lmbruvica_Sũ_v2
imisiuụni-m i … -tm… mmu›auuz
10315104
OJ~Cxxxx
OPtunnccycitccnctx
4,1 M/gg
A B
imbruviểẵ'
140 mg
lbrutlnib
ĐỌC Ki HUỚN_G DAN sử DỤNG
mươc KHI DUNG.
ĐỂ XA TAM TAY TRẺ EM.
SĐKI VN-XXXXX—XX
CTĐK JANSSEN-CILAG Ltd
Thái Lan
DNNK xxxx
vANFnOnẦ\ "
011101É11
Label of primary packaging: ,
| 1
h
ị 00mulu N _
. . '.
Ểẳ 1mbruv1ổa'
, …
ịặ . ibrutintb ,
ẵễ Ể Ench ccpoulocomnlns \
ỉs ẫ Ê 140mgotlbruttnib. E
Ê ẵ 'Ễ \
ỆSẽỄ 11 …… ị
ẻẳẵỆ ẵỄ :
ẵẵẫ ẵ ễ ẳ Bnharmacycllcs° ianssenÌ' E
@
PP_lmbruvicu_90_ v2
o\
`ỀL
r `~
.a,.
/ìiễt .
A
D
|
vsn vcn
euus1rm ưmon MM
Mua 11… Mr Womn ulmu spah
au1 ucwgmw 31“ `S.LO MMO
zin Mum :m omnqun
m…umm
…
…ỡịANQUJỊ
a1mdn ou
… uu
M…
-UOÌ im
LABEL
(Box of 1 bottle x 120 capsules)
Label of seoondary packaging:
A.
\\
L lA_ìì"
._,ợ \\
v…1 PHOẬtIG`Ả _Ắ`Ể1
nm DIỄN _ g,
11_11 1.17 HA 1111111)1
J.
/
.-^ " c ›
1 ²0 cnpsules 1²0 clpluiu
` . . % . . ›tẵ . . . ýẵ
1 D R E G
-__ , 1mbruvnca 1mbruv1c 1mbruvnc
. \\ ,
, … 140 mg 140 mg 140 mg
…. g ` ` ibrutinlb ibrutinib ibrutinib ibrutinib
Ế — ~ ' Each capsule oontains , _ Each oapsule contains ĐỌC Kĩ HƯỚNG DẢN sử DUNG
—— " - : 140 of ibrutinlb. Rx TNUÓC BAN THEO ĐON 140 m 61 ibrutinib. -
_ ; _ _- mg lbmtinib 14ũng 1166 1 16 1211 viên nmg g TRƯỔC KH’ DUNG-
" i — ' Directions for use fov oral Chl đlnh. côdt dùng, chông mi anh va Directions 161 use: lor oral ĐỂ XATAM TAY TRẺ EM-
._ ` _ ` aửninistration. Please read dc thOng ttn khảo: xin xem 16 hương dấn ndmỉn'lstration Please read SĐK- VN
_ `. `_ package inseft. sử dung kem meo, package insert. -xxxxx-n
. ' Keep out oi the sight and reach o Keep cut of the sight and reach
. " _ otchiidren. Bá° wản “ ũ' ° ““ 30 o ơtchildren. cmx: JANSSEN—CILAG 1.111 ,Thái Lan
\ \\ Do not store above 30'C. Sản xuất tẹiz Cataleni CTS. LLC. Do not store abơve 30'C. "
—ì\x\\\\ 111245 Hickman Mlils Drive, Kaneas Clty. ~
: : ~ MO 64137, M .
ẫ ỈQ\ Rx oniy Ỹ Rx only ” ì;
Ồ\\\\ Dủn Min vú đỏng gói tn: . . `v
~— ` ` 1 AndetsonBrecm Inc , 4545Assembiy _ “'._
\ Drive. Rodtfovd. IL 61169. Mỹ DNNK ’… `
\ 'vg .
Ề Qaharmacyc/Icr 1611550117 ẳ
1 .
| 10015²04 J
| om xxxx › `
i 0 Pnumocycia 1611111 d
, t ;
/ ' l /
\
SP_Imbruvioa_t 20_v2
mnnn~humuùmmzzmceoưn
1
1
1
.114'
Z^ OZIìJỊAn—qul dd
Dừections tot use: tot oral ndminictmton. Please reễd
MAH: Janssen-Cilag Ltd.. Thailand
0 Jsmm-Cilag uu
0 Phlmocydtìigỉ ,
fẵ
Q —.
ẳ 1Ể… 3
11 =c°' Ưa
1—~ ỉ ẫ' `Ễỉẵ Eẵ
`J² i ẵẵa s.1
1 1" 1²
Ê o
mcw.uoecm
\\\`
// …
JIỈÌIIIIIII
:SuịSmped AJer ;o pqe1
138V'1
\\
'Ii Lii" -'1"`\
Íí/iưi ’Nl- .11f
\1111131’ ii'Ội/Ĩ
IMBRUVICA®
Thuốc bán theo đơn.
Đợi: kỹ hướng dẫn sử dụng trước khi dùng.
Đê xa tầm tay trẻ em.
Thông báo ngay cho bác sỹ hoặc dược sĩ các phản ứng bất lợi gặp phải khi dùng thuốc.
Nếu cần thêm thông tin xin hỏi ý kiến bác sỹ hoặc dược sĩ.
THÀNH PHÀN
Hoạt chất: Viên nang cứng IMBRUVICA ohứa 140 mg ibrutinib.
Tả dược
Lõi viên nang: crosoarmellose sodium, magnesium stearate, microcrystaltíne cellulose, sodium
Iauri lsulfate.
Vo' nang: gelatin; titanium dioxide (E171).
Mực in: sheilac, oxid sảt đen (E172), propylene giycol.
DẠNG BÀO CHẾ
Viến nang cứng . ` `
Viến nang cứng mảu trăng đục, với chiêu dải 22 mm, có in chữ "ibr 140 mg" băng mực den.
CHỈ ĐỊNH
IMBRUVICA đơn trị liệu được chỉ định đề điếu trị cho bệnh nhân người lớn bị 11 lympho tế bảo v
(mantle cell lymphoma - MCL) tải phát hoặc kháng trị.
1MBRUVICA dơn trị liệu được chỉ định dễ điều trị cho bệnh nhân người lớn bị bệnh bạch cằu mạn
tính dòng lympho (C LL) chưa được điêu trị trưởo đó (xem ĐẶC TINH DƯỢC LỰC HỌC).
IMBRUVICA đơn trị liệu hoặc kết hợp với bendamustine vả rituximab (BR) được chi dịnh để điều
trị cho bệnh nhân người lớn bị CLL đã được điều trị ít nhất một trị liệu trước đó.
IMBRUVICA đơn trị liệu được chỉ định đề điếu trị cho bệnh nhân người lớn bị bệnh tăng
macroglobulin huyết (Waldenstrỏm’s macroglobulinaemia - WM) đã được điếu trị ít nhất một trị
liệu trước đó, hoặc trong điếu trị hảng một (tìrst-line) oho bệnh nhân không phù hợp với điều trị hóa
miễn dịch( chemo-immunotherapy).
LIÊU DÙNG VÀ CÁCH DÙNG
Điều trị với thuốc nảy nên được khởi dẫu và theo dõi bởi bảo sĩ có kinh nghiệm sử dụng thuốc
khảng ung thư.
Pl _lmbruvica_Capsule 140mg _US _EU SPF vl
Page ! on3
fi
Liều dùng
U lympho tế bảo vỏ ( MCL)
[ lêu khuyến cảo để điều trị MC L 111 560 mg (bốn viên nang) một lần mỗi ngảy.
Bệnh bạch cầu mạn lính dỏng lympho (CLL) và bệnh tăng macroglobulỉn huyết (Waldenstrỏm’s
macroglobulinaemia-WMJ
Liều khuyến cáo để điếu trị C,LL hoặc đơn trị lỉệu hoặc kết hợp, tả 420 mg (ba víến nang) một lẳn
mỗi ngảy (xem DẶC TÍNH DƯỢC LỤC HỌC đế có thông tỉn chi tiết về phảc đồ kết họp).
Liêu khuyến cảo để điếu trị WM là 420 mg (ba viên nang) mộti ần mỗi ngảy
Nên điều trị liôn tục cho đến khi bệnh tiến triền hoặc bệnh nhân không dung nạp.
lỉiêu cmm'1 liều %
Cảo thưốc ủc chế CYP3A4 trung bình và mạnh lảm tặng nỗng độ ibrutinib (xem CÁNH BÁO VÀ
THẬN TRỌNG vả TƯONG TẢC VỚI CÁC THUOC KHÁC VÀ CẢC DANG TƯỢNG TÁC
KHÁC).
Khi kết hợp với cảc thuốc ức chế CYP3A4 trung bình, nên dùng IMBRUVICA liếư thắp 140 mg
một lân môi ngảy (một viên nang).
Khi kết hợp với cá_c Lhuốc ửc chế CYP3A4 mạnh, nên giảm iiếu IMBRUVICA xuống còn
140 mg một lân môi ngảy (một viên nang) hoặc tạm ngừng dên 7 ngảy.
Nên tạm ngừng điếu trị với IMBRUVICA khi có bất kỳ khởi phải mới hoặc tiểu triến xẫu đi của độc
tinh không phải huvểt học độ > 3, giảm bạch cẩu trun g tính có nhiễm trùng hoặc sốt
> độ 3, hoặc độc iính huyết học độ 4. Khi triệu chứng độc tính được giải quyết về độ 1 hoặc độ ban
đầu (phục hồi) thì có thể tải điểu trị IMBRUVICA với liếư khởi đầu Nếu độc tính tải phát, iiều một
lần mỗi ngảy nên giảm đi một Viên (140 mg) Nếu cẩn thiết nên cân nhắc giảm thêm một viên 140
mg. Ngừng điếu trị nêu độc tinh còn dai dắng hoặc tải phải sau hai lần giảm liếu.
Khuyến cảo hiệu chỉnh liều được mô tả dưới đây:
Xuất hiện MCL: tiiệu chỉnh liều sau hồi phục CLL/WM: hiệu chỉnh liều sau hồi
độc tính phục
Lần đầu Tải điếu trị với tiếu 560 mg mỗi ngảy Tái điếu trị với liều 420 mg mỗi ngảy
Lần hai Tái điều trị với liếư 420 mg mỗi ngây Tải điều trị với iiều 280 mg mỗi ngảy
Lần ba Tải điếu trị với liều 280 mg mỗi ngảy Tải điếu trị với liều 140 mg mỗi ngảy
Lần bốn Ngừng IMBRUVICA Ngừng IMBRUVICA
Quên liều thuốc
Nếu không uống một liếư theo thời gian đã định thì nên uống thuốc cảng sớm cảng tốt vảo cung
ngảy đó vả tiếp tục lịch trình đã định vảo ngảy tiếp theo. Bệnh nhân không nên uông thếm thuốc để
bù liếư đã quên.
Pỉ_lmhruvica_Capsula 1'40111g US, EUSPC . vl
l'age 2 of2.ĩ
v.~ ,ù.` \
Ỉ.\Ẩ;
Nhóm dân số đăc biẻt
Cao tuồi 1
Không cân hiệu chinh liều ohuyên biệt cho bệnh nhân cao tuôi (2 65 tuôi).
Suy thận
Không tiến hảnh nghiên cứu lâm sảng chuyên bỉệt ở bệnh nhân suy thận. Trong các nghiến cứu lâm
sảng với IMBRUVICA, bệnh nhân suy thận nhẹ hoặc trung bình đã được điếu trị. Không oần hiệu
chinh liếư ở bệnh nhân suy thận nhẹ hoặc trung bình (thanh thải creatinine > 30 mL/phút) Nên duy
trì bù nước và theo dõi nông độ creatinine huyết thanh định kỳ Sử dụng IMBRUVICA cho bệnh
nhân suy thận nặng (thanh thải creatinine < 30 lephút) chỉ khi lợi ích vượt trội nguy cơ và theo dõi
sảt cảc dấu hiệu độc tính. Không có dữ liệu trên bệnh nhân suy thận nặng hoặc bệnh nhân lọc mảu
(xem ĐẶC TÍNH DƯỢC ĐỘNG HỌC). jì—Í
Suy gan ,
Ibrutinib được chuyển hóa tại gan. Trong một nghiên cứu suy gan, dữ liệu cho thấy nồng độ
ibrutinib tăng (xem ĐẶC TFNH DƯỢC ĐỘNG HỌC). Đối với bệnh nhân suy gan nhẹ (Child— Pugh
loại A), liều khuyến cảo iả 280 Img mỗi ngảy (hai viên nang). Đối với bệnh nhân suy gan trung bình
(Chiid- Pugh loại B), liều khuyến cảo là 140 mg mỗi ngảy (một viên nang). Theo dõi các dấu hiệu
độc tinh của IMBRUVICA trên bệnh nhân và tuân thủ hướng dẫn hiệu chinh liều nếu cần. Khuyến
cảo không sử dụng IMBRUVICA cho bệnh nhân suy gan nặng (Child-Pugh ioại C).
Bệnh lim nặng
Bệnh nhãn bị bệnh tim mạch nặng đã bị loại trừ khói cảc nghiên cứu lâm sảng cùa IMBRUVICA.
Bệnh nhân nhi ' …
Chưa thiêt lập tính an toản và hiệu quả của IMBRUVICA ở trẻ từ 0 đên 18 tuôi. Hiện chưa có dữ
liệu.
Cách dùng
Uống IMBRUVICA một lần mỗi ngảy với một cốc nước vảo khoảng cùng một thời điếm mỗi ngảy.
Nên nuốt nguyên viên nang với nước mà không mở, bè hoặc nhai. Không được uống 1MBRUVICA
vởi nước bưới hoặc nước cam đắng (Seville orange) (xem TUONG TẢC VỚI CẢC THUỐC
KHẢC VÀ CÁCH DẠNG TƯỢNG TÁC KHÁC).
CHỐNG CHỈ ĐỊNH
Quá mẫn với hoạt chất hoặc bất kỳ tá dược nảo.
Sử dụng oác chế phẩm chứa cò St. John bị chống chỉ định ở những bệnh nhân điều trị với
IMBRUVICA.
CẢNH BÁO VÀ THẬN TRỌNG
Biến cố liên quan đến chảy mảu
Đã có báo cáo biến cố xuất huyết ở bệnh nhân điếu trị IMBRUVICA có hoặc không có giảm tiếu
cẩu, bao gồm cảc biến cố xuất huyết nhỏ như thâm tím, chảy máu mũi và đốm xuất huyết; và oảc
P] _ Imbruvica Capsule l40mg _US __E U SPC . … _vl
Page 3 of23
`-:1 fr,\
.11 jl`~ '
biến cố xuất huyết lớn, đôi khi tử vong, bao gồm chảy mảu đường tiêu hóa, xuất huyết nội sợ và tiếu
mảu.
Bệnh nhân bị loại khỏi nghiên cứu pha 2 và 3 của 1MBRUVICA nếu họ cần dùng warfarin hoặc cảc
thuốc đối kháng vitamin K khảo. Không nên sử dụng warfarin hoặc cảo thuốc đối kháng vitamin K
khác cùng với IMBRUVICA. Nên tránh thực phẩm bổ sung như chế phẩm dầu cả và vitamin E. Sử
dụng 1MBRUVICA ở bệnh nhân cần thuốc chống đông mảu hoặc các thuốc ức chế chức năng tiều
cẳu có thể gây tãng nguy cơ chảy máu, cần thận trọng đặc biệt nếu có sử dụng trị liệu chống đông.
Bệnh nhân tạng chảy mảu bẩm sinh không tham gia nghiên cứu.
Nên ngừng điều trị IMBRUVICA ít nhất 3 đến 7 ngảy trước và sau phẫu thuật tùy thuộc loại phẫu
thuật và nguy cơ chảy máu. ỈD-i
Ngưng tập bạch cầu (leukostasis) z
Đã có báo cảo ngưng tập bạch cằn ở bệnh nhân điếu trị với IMBRUV1CA. Số lượng 1ớn tế bảo
lympo trong tuẫn hoản (> 400. OOO/mcL) có thế lảm tăng nguy cơ. Cân nhắc tạm ngừng
IMBRUVICA. Nên theo dõi bệnh nhân chặt chẽ và chỉ định ohăm sóc hỗ trợ bao gồm bù nước
vả/hoặc giảm số lượng tế bảo.
Nhiễm trùng
Nhiễm trùng (bao gổm nhiễm trùng huyết, nhiễm trùng huyết gìảm bạch cầu trung tính, nhiễm
khuẩn, virus hoặc nấm) đã gặp ở bệnh nhân điếu trị với IMBRUVICA. Một vải trường hợp nhiễm
trùng nảy cần nhập viện vả tử vong. Phần lớn bệnh nhân bị nhiễm trùng gây tử vong cũng có giảm
bạch cầu trung tính. Cần theo dõi bệnh nhân về sốt, giảm bạch cầu trung tính và nhiễm trùng vả nến
điểu trị chống nhiễm trùng thích hợp nếu cẩn.
Đã có bảo cáo về cảc trường hợp bệnh não ohất trắng đa ổ tìến triến (Cases of Progressive
Muitifoca] Leukoencephalopathy - PML) bao gồm các ca tử vong sau khi sử dụng ibrutinib trong
bối cảnh có điều trị trước đó hoặc đống thời với liệu phảp ức chế miễn dịch. Bảo sĩ nên nghĩ đến
PML trong chẩn đoản phân biệt ở những bệnh nhân có cảc dấu hiệu hoặc triệu chứng mới hoặc xắu
đi cùa bệnh lý thần kinh, nhận thức hoặc hảnh vi. Nếu nghi ngờ PML thì cần đảnh giả chấn đoản
thích hợp và ngừng điếu trị cho đến khi loại trừ PML. Nếu có nghi ngờ nên giới thiệu đến khảm bảo
sĩ chuyên khoa thẩn kinh và tiến hảnh chẩn đoản PML thich hợp bao gồm chụp MR1 mà thường ưa
chọn MRI với dộ tương phản, xét nghiệm DNA virus JC trong dịch não tủy vả đảnh giả về mặt thấn
kinh lặp lại.
Giảm 1ế bảo mảu
Giảm tế bảo máu do điêu trị độ 3 hoặc 4 (giảm bạch oâu trung tính, giảm tiêu câu và thiêu máu) đã
được bảo cáo ở bệnh nhân điêu trị với IMBRUVICA. Theo dõi công thức máu toản bộ mỗi thảng.
Bệnh phồi kẽ (Interstitial Lung Disease- ILD)
Đã có báo cảo 1LD ở bệnh nhân diếu trị với IMBRUVICA. Theo dõi bệnh nhân về cảc triệu ohứng
phổi chỉ điểm 1LD. Nếu xuất hiện trệu chứng, ngừng IMBRUVICA và kiếm soát 1LD thích hợp.
Nếu triệu chứng dai dẳng, cân nhắc nguy cơ và lợi ích cứa điều trị IMBRUVICA và tuân thủ hướng
dẫn hiệu chỉnh liều
Pl Imbruwm Cupsule l40mg_ýUS _EU SPC , . v]
Page 4 of 23
": ề'Ã t"
Loạn nhịp tim
Đã oó bảo cáo cảc trường hợp rung nhĩ, cuồng nhi và loạn nhịp nhanh thất ở bệnh nhân điếu trị với
IMBRUVICA. Rung nhĩ vả cuồng nhĩ được báo cảo chủ yếu ở bệnh nhân oó yếu tố nguy cơ về tim,
tăng huyết’ ap. nhiễm trùng câp, vả oó tiến sử rưng nhĩ. Theo dõi dịnh kỳ trên lâm sảng biếu hiện cùa
ioạn nhịp tim ở tất cả bệnh nhân. Bệnh nhân oó triệu chứng Ioạn nhịp hoặc khởi phảt mới cùa triệu
chứng khó thờ, choáng vảng hoặc ngất thì nên được đảnh giá lâm sảng và nếu cằn nên lảm điện tâm
đồ (ECG).
Bệnh nhân có dấn hiệu vả/hoặc triệu\chứng của loạn nhịp nhanh thất thi nến tạm ngừng
IMBRUVICA và cân đánh giá lãm sảng đây đủ lợi ích/nguy cơ trước khi tái điều trị.
Bệnh nhân đã oó bị rung nhĩ trước đó cần điếu trị chống đông thì nên cân nhắc lựa chọn trị liệu khảo
thay thế 1MBRUVICA. Nếu bệnh nhân xuất hiện rung nhĩ khi điều trị với IMBRUVICA thì nên tiến
hảnh đánh giá toản bộ nguy oơ bệnh lý thuyên tắc huyết khối. Nếu bệnh nhân có nguy cơ cao và khi
không phù hợp với liệu phảp thay thế IMBRUVICA khác thì cân nhắc điếu trị kiểm soát chặt chẽ
với thuốc chống dông. Ở1
Hội chứng ly giải khối u '
Hội chứng ly giải khối u được bảo cảo khi điều trị với IMBRUVICA. Bệnh nhân có nguy cơ bị hội
chứng ly giải khối u là người bị gảnh nặng khối u oao (high tumour burden) trước khi diếu trị. Cần
theo dõi bệnh nhân ohặt chẽ và thận trọng thich hợp.
Ung thư da khóng hẳc tố
Ung thư da không hắc tố được báo cáo một cảch thường xuyên ở những bệnh nhân dược diều trị với
IMBRUVICA hơn là những bệnh nhân được điếu trị với oảo thuốc chứng trong cảc nghiến cứu gộp
so sảnh ngẫu nhiên pha 3. Theo dõi biếu hiện ung thư da không hắc tố trên bệnh nhân dùng
IMBRUVICA.
Tái hoạt động virus
Đã có báo oảo tái hoạt viếm gan B ở bệnh nhân Idùng IMBRUVICA. Cần xảo dịnh tinh trạng virus
viêm gan B (HBV) trước khi bắt đầu điều trị với IMBRUVICA. Khuyến cảo tư vấn bảo sĩ oỏ kinh
nghiệm điếu trị điếu trị viêm gan B ở bệnh nhân có xét nghỉệm HBV dương tính. Nếu bệnh nhân có
huyết thanh viếm gan B dương tinh, cần tư vấn chuyến gìa bệnh gan trước khi bắt đầu điếu trị và
bệnh nhân nên được theo dõi và kiếm soát theo tiêu chuẩn y khoa tại địa phương để phòng ngừa tải
hoạt viêm gan B.
Tương tác thuốc — Ihuồc
Sử dụng cảc thuốc ức chế CYP3A4 trung binh hoặc mạnh đồng thời vởỉ IMBRUVICA có thể gây
tăng nồng độ ibrutinib và hậu quả là nguy cơ độc tính cao hơn. Ngược lại, sử dụng cảc thuốc cảm
ứng CYP3A4 có thể gây giảm nông độ IMBRUVICA và hậu quả là nguy oơ thiếu hiệu quả diếu trị.
Do đó, nếu có thế, nên trảnh sử dụng IMBRUVICA đồng thời với oảo thuốc ức chế/oảm ứng
CYP3A4 mạnh hoặc trung bình và nên cân nhắc điều trị đổng thời chỉ khi lợi ích vượt trội rõ rảng
so với nguy cơ tiếm ấn. Nến theo dõi bệnh nhân chặt chẽ về cảc dấu hiệu độc tính của IMBRUVICA
nếu phải sử dụng thuốc ức chế CYP3A4 mạnh (xem LIÊU DÙNG VÀ CẢCH DÙNG vả TƯONG
TÁC với CÁC THUỐC KHÁC vÀ CÁC DẠNG TƯỚNG TÁC KHÁC). Nếu phải dùng thuốc
Pl_lmbruvica_ C apsule 140mg _US _EU SPC _vl
Page 5 of 23
\0 \ỔẺKJ VI
oảm ứng CYP3A4, theo dõi bệnh nhân chặt chẽ các dắu hiệu thìếu hiệu quả điếu trị với
IMBRUVICA.
Phụ nữ có khả năng sinh sản
Phụ nữ có khả năng sinh sản phải sử dụng biện phảp trảnh thai hiệu quả cao trong thời gian dùng
IMBRUVICA (xem PHỤ NỮ CÓ THAI CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN).
PHỤ NỮ có THAI, CHO CON BỦ VÀ KHẢ NĂNG SINH SẢN
Phu nữ oó khả năng sinh sản/trảnh thai ở phu nữ
Dựa trên cảc phảt hiện ở động vật, IMBRUVICA có thể gây hại cho phôi khi dùng oho phụ nữ mang
thai. Phụ nữ nên trảnh mang thai khi dùng IMBRUVICA và đến 3 thảng sau khi kết thủc điếu trị
Do đó, phụ nữ có khả nãng sinh sản phải sử dụng biện phảp trảnh thai hiệu quả cao khi dùng
IMBRUVICA và đến 3 thảng sau khi kết thủc điếu trị. Cho đến nay chưa rõ liệu ibrutinib có Iảm
giảm hiệu quả cùa thuốc trảnh thai nội tiết hay không, và do đó phụ nữ sư dụng thuốc trảnh thai nội
tiết nên dùng thêm phương pháp mảng ngăn. 331
Phu nữ mang thai —
Không sử dụng IMBRUVICA cho phụ nữ trong thời kỳ mang thai. Không có dữ liệu về việc sử
dụng IMBRUVICA cho phụ nữ mang thai. Nghiên cứu trên động vật cho thấy độc tính trên khả
năng sinh sản (xem DỮ LIỆU TIỂN LÂM SÀNG).
Cho con bú
Chưa rõ 1iệu ibrutinib hoặc chất chuyến hóa của nó có bải tiết vảo sữa người mẹ hay không. Không
thể loại trừ nguy cơ cho trẻ sơ sinh/nhũ nhi. Nên ngừng cho con bú trong thời gian điếu trị với
IMBRUVICA.
Khả năng sinh sản
Không quan sảt thắy tác động trên khả năng sinh sản ở chuột cống đực hoặc oải khi dùng liếư
nghiên oứu tối đa đến 100 mg/kg/ngảy (liều tương đương ở người 16 mg/kg/ngảy) (xem DỮ LIỆU
TIỂN LÂM SÀNG). Không có dữ liệu vê ảnh hướng đến khả năng sinh sản của ỉbrutínib trên người.
ẢNH HƯỞNG ĐẾN KHẢ NĂNG LÁI XE VÀ VẶN HÀNH MÁY MÓC
Đã có bảo cảo mệt mòi, chóng mặt và ngắt ở một vải bệnh nhân dùng iMBRUVICA và cần cân
nhắc khi đảnh giá khả năng lải xe hoặc vận hảnh mảy móc cùa bệnh nhân.
TƯỢNG TÁC VỚI CÁC THUỐC KHÁC VÀ CÁC DẠNG TƯO’NG TÁC KHÁC
Ibrutinib được chuyến hóa chủ yếu bởi enzyme 3A4 của cytochromo P450 (CYP3A4).
Cảo thuốc lảm tăngnồng đô ibrutinib trong huyết tương
Sử dụng IMBRUVICA cùng với cảo thuốc ức chế CYP3A4 mạnh hoặc trung binh có thể gây tãng
nồng độ ibrutinib và nên trảnh dùng cùng.
PI_Imbrm—im_Capsule l40mg _(1'S_EUSFF . . _yl
Page 6 of23
".i> v]
\`uh
Thuốc ức chế C YP3A4 mạnh
sn dụng đồng thời với ketoconazole, là một chất ức chế CYP3A4 mạnh, trên 18 đối tượng khóe
mạnh lủc đói đã thấy nồng độ ibrutinib tc… vả AUC) tăng tương ứng 29 và 24 lần. Mô phòng điều
kiện lúc đói cho thấy chất ức chế CYP3A4 mạnh, clarithromycin, có thể gây tăng AUC của ibrutinib
bời yếu tố 14. Nên trảnh dùng cảc chất ức chế CYP3A4 mạnh (như ketoconazole, indinavir,
nelfinavir, ritonavir, saquinavir, clarithromycin, telithromycin, itraconazoie, nefazodon vả
cobicistat). Nếu lợi ích vượt trội nguy cơ và cân phải sử dụng thuốc ức chế CYP3A4 mạnh thì giảm
lỉếu 1MBRUVICA còn 140 mg (một viên nang) hoặc tạm ngừng điều trị (7 ngảy hoặc ít hơn) Theo
dõi bệnh nhân chặt chẽ về độc tính trên và tuân thủ khuyến cảo hiệu chỉnh liếu nếu cần (xem LIÊU
DÙNG VÀ CÁCH DÙNG vả CẢNH BÁO VÀ THẬN TRỌNG).
Thuốc ửc chế C YP3A4 trung binh
Mô phòng điếu kiện lúc đói cho thấy thuốc ức chế CYP3A4 trung bình, diitiazcm, erythromycin vả
voriconazole, có thể gây tãng AUC oủa ibrutinib 5-9 lần. Nến trảnh dùng thuốc ức chế CYP3A4
trung binh (như voriconazole, erythromycin, amprenavir, aprepitant, atazanavir, ciprofioxacin,
crizotinib, dmunavir/ritonavir, diltiazem, fluconazole, fosamprenavir, imatinib, verapamil,
amiodarone, dronedarone)Nếu oằn phải sử dụng thuốc ức chế CYP3A4 trung binh thì giảm iiều
IMBRUVICA còn 140 mg (một viên nang) trong suốt thời gian dùng thuốc ức chế nảy. Theo dõi
bệnh nhân chặt chẽ về độc tính và tuân thủ hướng dẫn hiệu chinh liều nếu cần (xem LIÊU DÙNG
VÀ CÁCH DÙNG vả CÀNH BÁO VÀ THẬN TRỌNG). ®“1
Thuốc ửc chế C YP3A4 nhẹ
Mô phỏng sử dụng điều kiện 1úc đói có 1iên quan lâm sảng cho thấy thuốc ức chế CYP3A4 nhẹ,
azithromycin vả fiuvoxamine có thể gây tăng AUC cùa ibrutinib < 2 lần. Không cần hiệu chinh liếư
khi kết hợp với thuốc ức chế nhẹ Theo dõi bệnh nhân chặt chẽ về độc tính và tuân thủ hưởng dẫn
hiệu ohinh liều nểu cần.
Sử dụng đồng thời với nước bưởi, chứa ohất' ưc chế CYP3A4, trên 8 người tình nguyện khỏe mạnh_
đã ghi nhận nồng độ ibrutinib (me vả AUC) tăng tương ứng khoảng 4 và 2 lần. Cần trảnh dùng
nước bưởi và nước oam đắng trong thời gian điều trị IMBRUVIC A do có chứa chất ức chế CYP3
trung binh (xem LIÊU DÙNG VÀ CẢCH DÙNG).
Các thuốc có thế lảm giảm nồng độ ihrutinib trong huvết tương , `
Sứ đụng IMBRUVICA cùng với chât cảm ứng CYP3A4 có thẻ lảm giảm nông độ ibrutinib trong
huyêt tương.
sư dụng đồng thời rifampicin, một thuốc cảm ứng CYP3A4 mạnh, trên 18 đối tượng khỏe mạnh lúc
đói đã thấy nồng độ (Cmax vả AUC) của ibrutinib giảm tương ứng 92 và 90%. Trảnh sử dụng đồng
thời cảc thuốc cảm ứng C YP3A4 mạnh hoặc trung binh (như carbamazepine, rifampicin,
phenytoin). Chống chỉ định sử dụng chế phẩm chứa cỏ St. John trong thời gian điếu trị với
iMBRUVICA do có thế giảm hiệu quả. Cân nhắc thuốc thay thế với it cảm ứng C YP3A4 hơn. Nếu
lợi ich vượt trội nguy cơ và cần phải dùng thuốc cảm ửng CYP3A4 mạnh hoặc trung bình thì nên
theo dõi bệnh nhân chặt chẽ về giảm hiệu quả điều trị (xem CHỐNG CHỈ ĐỊNH vả CÁNH BÁO
VÀ THẬN TRỌNG ĐẶC BIỆT). Thuốc cảm ứng CYP3A4 nhẹ có thể dùng cùng iMBRUVICA
nhưng nên theo dõi bệnh nhân chặt chẽ về nguy cơ giảm hiệu quả.
PI _ Imbruvica _ Capsule I40mg _US _EU SPC _ vl
Page 7 on3
"
\
/.C
Ibrutinib có độ hòa tan phụ thuộc pH, với độ hòa tan thấp hơn khi pH oao hơn. Đã quan sát thấy
Cmax thấp hơn ở đối tượng khóe mạnh lúc đói khi dùng liếư ibrutinib duy nhất 560 mg sau khi dùng
omeprazole liếư 40 mg một lần mỗi ngảy trong 5 ngảy (xem ĐẶC TINH DƯỢC ĐỘNG HỌC).
Không có bằng chứng về Cmax thấp hơn sẽ có thay đổi lâm sảng đáng kế, và cảo thuốc lảm tăng pH
dạ dảy (như ức chế bơm proton) được sử dụng không hạn chế trong các nghiến cứu lâm sảng then
chốt. ỉD'ị
Các thuốc có thề bi thay đồi nồng đô trong huvết tương do ibrutinib
Ibrutinib tả một P-gp và lá chẩt ức chế protein khảng ung thư vú (BCRP) trên in vitro. Do chưa có
dữ liệu lâm sảng vê tương tảo nảy, nên không thế loại trừ ibrutinib có thế ức chế P- -gp vả BCRP ở
ruột sau khi uông một liếư điếu trị. Để giảm thiếu khả năng tương tác trong đường tiêu hóa, với
phạm vi điều trị hẹp theo đường uống, cảc cơ chất P-gp hoặc BCRP như digoxin hoặc methotrexate
nến được dùng ít nhất 6 giờ trước hoặc sau IMBRUVICA Ibrutinib có thể ức chế BCRP ở gan và
tãng nồng độ của các thuốc mà được chuyến hóa tại gan qua tnmg gian BCRP như rosuvastatin.
Dựa trên dữ liệu in vitro, tại nồng độ ở một ibrutinib là chất ức chế C YP3A4 yếu có hồi phục và do
đó có thể lảm tăng nồng độ cơ chất CYP3A4 nhạy cảm với chẩt ohuyến hóa CYP3A4 tại ruột. Chưa
có sẵn dữ liệu lâm sảng về tương tác nây. Nên thận trọng khi dùng đồng thời ibrutinib với cơ chất
CYP3A4 dùng đường uống với khoảng điếu trị hẹp (như dihydroergotamine, ergotamine, fentanyl,
cyclosporine, sirolimus vả tacrolimus).
Dựa trên dữ liệu in vitro, ibrutinib lả ohắt cảm ứng CYP2B6 yếu và có thế có khả năng ảnh hưởng
dến bộc lộ các enzyme và chất vận chuyến khác mả được điếu hòa qua thụ thể Cấu trúc androstane
(constitutive androstane receptor - CAR) như CYP2C9, CYP2CI9, UGTIAI vả MRP2. Chưa rõ
mối liên quan lâm sảng nhưng nồng độ cơ chẩt của CYP2B6 (như efavirenz vả bupropion) và của
cảc cơ chất đồng diếu hòa có thể giảm khi dùng oùng ibrutinib.
TẢC DỤNG KHÔNG MONG MUÔN
Tóm tắt dữ liêu hồ sơ an toản
Hồ sơ an toản dựa trên dữ lỉệu gộp từ 981 bệnh nhân được điều ni với IMBRUVICA trong ba
nghiên cứu lâm sảng pha 2 và bốn nghiên cứu ngẫu nhiên pha 3 vả từ kinh nghiệm hậu mãi. Bệnh
nhân MCL được điếu trị trong cảc nghiên cứu lâm sảng dùng IMBRUVICA với liếư
560 mg một lần mỗi ngảy và bệnh nhân CLL hoặc WM được điều trị trong các nghiên cứu lâm sảng
với liếư 420 mg một lần mỗi ngảy. Tất cả bệnh nhân trong nghiến cứu lâm sảng dùng IMBRUVICA
cho đến khi bệnh tiến triến hoặc không còn dung nạp được.
Phản ứng bất lợi phổ biến nhất (2 20%) là tiêu chảy, giảm bạch cầu trung tinh, xuất huyết (như
mảng tím), đau cơ xương, buồn nôn, phải ban và sốt. Phản ứng bất lợi độ 314 phổ biến nhất (a 5%)
lả giảm bạoh cầu trung tính, viêm phối, giảm tiểu cầu và giảm bạch cẩu có sốt.
Phản ứng bất lơi dang bảng
Các phản ứng bắt lợi ở bệnh nhân bị u ảo tính tế bảo B được điếu trị với ibrutinib và phản ứng bất
lợi sau khi thuốc được đưa ra thị trường được liệt kê dưới đây theo hệ cơ quan và nhóm tần suất.
PI_ meruwca_ C apsule | 40mg _ US _El .i' SPC _vl
Page 8 of 23
Tẩn suất dược xảc định như sau: rẩt thuờng gặp (> 1/100), thuờng gặp (> 1/100 đến <1/10), không
thường gặp (> 1/1000 đến <11100), không rõ (không ước lượng đuợc từ dữ lìệu hiện có) Với môi
nhóm tần suất, tảo dụng ngoại ý được Sãp xếp theo độ nghiêm trọng giảm dần.
nv
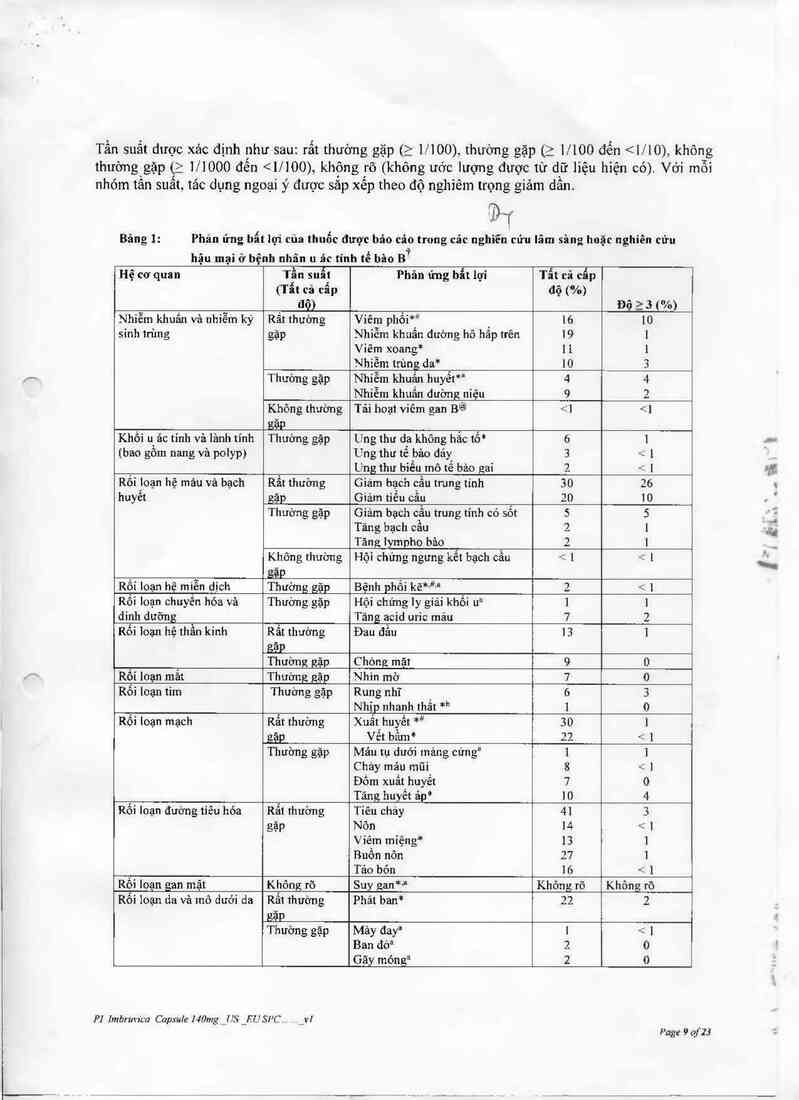
Bãng !: Phản ứng bẫt lợi của thuốc được báo cảo trong các nghiền cửu lãm sâng hoặc nghiên cứu
hậu mại ở bệnh nhân u âc tính tế bảo Bi
Hệ cơ quan Tần suất Phân ửng bất lợi Tẩt cả cẫp
(Tất cả cẫp độ (%)
độ) Độ 2 3 ( %)
Nhiễm khuấn và nhiễm ký Rất thường Viêm phỏi*i 16 10
sinh trùng gặp Nhiễm khuẩn đường hô hấp trên 19 1
Viêm xoang* 11 1
Nhiễm trùng da* 10 3
Thường gặp Nhiễm khuẩn huyết” 4 4
Nhiễm khuẩn dường niệu 9 2
Không thường Tái hoạt viêm gan B@ <1
3 xuãt hiện thường xuyên hơn trong số bệnh nhân oao tuổi điều trị với IMBRUVICA (13% ở bệnh
nhân > 65 tuôi so với 7% bệnh nhânD < 65 tuổi)
Báo cảo phản ứng bất lơi nưhi nườ
Báo cảo phản ứng bất lợi nghi ngờ sau khi thuốc được cấp phép luu hảnh là quan trọng vì nó cho
phép theo dõi iiến tục cân bằng nguy cơ/ lợi ích cùa thuốc. Cần yếu cẩu cản bộ y tế bảo cảo bất kỳ
phản ứng bắt lợi nghi ngờ nảo qua hệ thống bảo cảo quốc gia.
QUÁ LIÊU VÀ ĐIỂU TRỊ
Dữ liệu về ảnh hưởng cùa quá liếư IMBRUVICA còn hạn chế. Không đạt được liếư dung nạp tối đa
trong nghiên cứu pha ] mã trong đó bệnh nhân dùng lìếu lến đến 12,5 mg/kg/ngảy
(1400 mg/ngảy). Trong một nghiên cứu rỉêng biệt, một người khỏe mạnh đã nhận liều 1680 mg và
đã có tăng men gan độ 4 có hồi phục ịaspaưate aminotransferase (AST) vả alaninc aminotransferase
(ALT)]. Không có thuốc giải độc đặc hiệu đối với IMBRUVICA. Bệnh nhân uống nhiều hơn tìếu
khuyến cảo cấn được theo đõi chặt chẽ và điếu trị hỗ trợ thích họp.
ĐẶC TỈNH DƯỢC LỰC HỌC
Nhóm dược lý điếu trị: thuốc chống1oạn sản, ức chế protein kinase, mã ATC: LOIXEZ7.
Cơ chế tảo dung
Ibmtiníb là một chất ức chế tyrosìne kinase Bruton (BTK) mạnh, phân tử nhỏ. Ibrutinib tạo liến kết
cộng hóa trị với một nhảnh cystein (Cys-48l) tại vị trí hoạt động của BTK. dẫn đến sự ức chế bến
vững hoạt động của enzyme B'I`K. BTK, thảnh viên nhóm kinase Tec, là một phân tử tin hiệu quan
trợng của thụ thể kháng nguyên tế bảo B (BCR) và con đường thụ thể cytokine. Con đường BCR
l~’l_lmớmvưa_Capsule 140mg_iiĩ_ìĩU SJ’C ,. .. _vJ
Page l0 of 23
i
Ì'Acểwim'.
liên quan đến sỉnh bệnh học của một số bệnh lý ảc tính tế bảo B, bao gổm MCL, u lympho tế bảo B
lớn lan tòa (diffuse large B-cell lymphoma - DLBCL), u lympho thề nang và CLL. Vai trò then chốt
cùa BTK trong dẫn truyền tín hiệu thông qua các thụ thể bề mặt tế bảo B dẫn đến hoạt hóa cảc con
đường cần thỉết cho tế bảo B hưởng động, hóa động và bám dính. Cảo nghiên cứu tiền lâm sảng cho
thấy ibrutinib ức chế một cách hiệu quả sự tăng sinh và sự sống còn của tế bảo B ác tinh trên in vivo
cũng như sự di cư cùa tế bảo và sự bảm dính vảo cơ chất trên in vitro.
Tăng tế bảo lỵmpho mảu
Khi bắt đầu điều trị, số lượng tế bảo lympho tãng có hồi phục (chắng hạn tảng >50% so với giá trị
ban dẩu và số lượng tuyệt đối > 5000/mcL), thường đi kèm gỉảm hạch bạch huyết, đã gặp ở khoảng
ba phần tư số bệnh nhân CLL điều trị với IMBRUVICA. Cũng quan sảt thấy ảnh hưởng nảy trên
khoảng một phần ba số bệnh nhân MCL tái phảt hoặc kháng trị được điều trị với IMBRUVICA.
Tăng tế bảo lympho mảu quan sảt được nây là một tảc dụng dược lực học và không được coi là bệnh
tiến triến khi không thấy cảc dấu hìệu lâm sảng khảc. Trong cả hai loại bệnh, tăng tế bảo lympho
điền hình thường `xuất hiện trong thảng đẩu điếu trị với IMBRUVICA và thường hồi phục trong
vòng trung vị 8 tuần ở bệnh nhân MCL và 14 tuần ở bệnh nhân CLL. Cũng quan sảt thấy ở một sô
bệnh nhân có tãng số lượng lớn lympho bảo lưu thông (ví dụ > 400. OOO/mcL).
Không quan sảt thấy tãng tế bảo lympho ở bệnh nhân WM điều trị với IMBRUVICA.
Ảnh hưởng đến khoảng OT/OTc vả đỉên sinh lý tim
Ảnh hưởng của ibrutinib đến khoảng QTc dược dánh giá trên 20 nam giới và nữ giới khỏe mạnh
trong một nghiên cứu QT mù đôi, ngân nhiên với giả dược và thuốc có hoạt chất. Tại một liều trên
liều điều trị ở mức 1680 mg, ibrutinib không Iảm kéo dải khoảng QTc mà gây ra bất kỳ bỉểu hiện
lâm sảng nảo. Giới hạn trên lớn nhất cùa 2 bên khoảng tin cậy C] 90% đối với sự khảc biệt trung
bình được điều chỉnh ban đẩu gỉữa ibrutinib và giả dược là thấp hơn 10 ms. Trong cùng nghỉên cứu
nảy, đã thấy sự ngắn lại khoảng QTc phụ thuộc liều (-5 3 ms [90%C1:-9,;4-1,1] tại Cinax là
719 ng/mL sau liều cao hơn liều điều trị ở mức 1680 mg).
An toản vả hiêu quả lâm sảng
U lympho tế bảo vỏ
An toản vả hiệu quả cùa IMBRUVICA trên bệnh nhân MCL tải phảt hoặc khảng trị đã được đảnh
giá trong một nghiên cứu pha 2 đa trung tâm, nhãn mớ (PCYC-l 104—CA) trên 1 l 1 bệnh nhân. Tuổi
trung vị là 68 tuồi (từ 40 đến 84 tuổi), 77% lá nam giới và 92% là da trắng. Những bệnh nhân có
tình trạng hoạt dộng theo ECOG (Eastern Cooperative Oncology Group) 2 3 bị Ioại khỏi nghiên
cứu. Trung vị thời gian từ khi chẩn đoản lả 42 tháng, và trung vị số lượng đỉều trị trước dó lả 3
(trong khoảng ] dến 5 diều trị), bao gồm 35% với hóa trị liều cao trưởc đó, 43% với bortezomỉb
trước đó, 24% với lenalidomide trước đó, vả ! 1% vởi cấy ghép tế bảo gốc tự thân hay dổng loại
trước đó. Tại thời điềm ban đầu, khi sảng lọc có 39% bệnh nhân có khối u lớn (ì 5 cm), 49% có
điếm nguy cơ cao theo chi số tiên lượng quốc tế MCL đơn giản hóa (MIPI), và 72% có bệnh tiến
trĩến (ngoải hạch vả/hoặc ảnh hưởng đến tùy xương).
Uống IMBRUVICA 560 mg một lần mỗi ngảy cho đến khi bệnh tiến triển hoặc độc tính khộng chấp
nhận được. Đảp ứng khôi u được đảnh giả theo tiêu chí của Nhóm lảm việc quôc tê (IWG-
Pl_lmbruwca_ C apsule I40mg _US _EU SPC . _vl
Page ! [ of23
\ … *Si….—it \ I
International Working Group) cho bệnh u lympho không Hodgkin (NHL). Tiêu chí chính cùa
nghiên cứu nảy là tỷ lệ đảp ứng chung (ORR) theo đảnh giả của nghiên cứu viên. Đảp ửng vởi
IMBRUVICA được trình bảy trong Bảng 2. iDT
Bảng 2: Tỷ lệ đáp ứng chung (ORR) và thời gian đáp ửng (DOR) 6 bệnh nhân bị MCL tải
phát hay kháng trị (Nghiên cứu PCYC-llO4-CA)
Tổng số
N = 111
ORR (%) 67,6
95% C] (%) (58,0; 76,1)
CR (%) 20,7
PR (%) 46,8 ,
Trung vị DOR (CR+PR) (thảng) 17,5 (15,8; NR) ___]
Trung vị đến đảp ứng ban đầu, thảng (khoảng giá tri) 1,9 (1,4-13,7) `
Trung vị thờigian dến CR, tháng (khoảnggiả trị) 5,5 (1,7-1 1,5)
CI = khoảng tin cậy; CR = đáp ửng hoản toân; PR = đáp ứng một phần; NR = không đạt
được.
Dữ liệu về hiệu quả được đảnh giả thêm bởi Hội đồng Đảnh giả độc lập (IRC) cho thấy ORR là
69%, với tỷ lệ đảp ứng hoản toản (CR) 21% và tỷ lệ đảp ứng một phần (PR) 48%. IRC ước tinh
trung vị DOR là 19,6 thảng.
Tỷ lệ đảp ứng toản bộ của IMBRUVICA là độc lập với điều trị trước đó bao gồm bortezomib vả
lenalidomỉde hoặc các yếu tố nguy cơltiên lượng nên, bệnh lan rộng (bulky disease), giới tính hoặc
tuốỉ tác.
Đã chứng minh được tính an toản và hiệu quả của IMBRUVICA trong một nghiên cứu pha 3 ngẫu
nhiên, nhãn mở, da trung tâm trên 280 bệnh nhân MCL đã được diều trị ít nhất một trị liệu trước đó
(Nghiên cứu MCL3OOI). Bệnh nhân được lựa chọn ngẫu nhiên 1: 1 để nhận IMBRUVICA 560 mg
uống một lần mỗi ngảy trong 21 ngảy hoặc temsỉrolimus đường tĩnh mạch ở 1iều 175 mg vảo cảc
Ngảy 1, 8, 15 của chu kỳ đầu tiên, tiếp nối bời 75 mg vảo cảc Ngảy 1,8,15 cùa mỗi chu kỳ 21 ngảy
sau đó. Cả hai nhóm được đìểu trị liên tục cho đến khi bệnh tiến triển hoặc độc tính không chắp
nhận được. Tuổi trung vị là 68 tuối (khoảng 34, 88 tuổi), 74% lả nam giới và 87% da trắng. Thời
gian trung vị cho dến khi chẩn doản là 43 thảng, trung vị số lượng trị lỉệu trước đó lả 2 (khoảng 1
đến 9 trị liệu), bao gồm 51% hóa trị liều cao trước đó, 18% vởi bortezomib trước đó, 5% với
1enalidomide trước đó, và 24% cấp ghép tế bảo gốc trước đó. Tại thời điểm ban đầu, khi sảng lọc có
53% bệnh nhân có bệnh lan rộng (2 5 cm), 21% có diếm nguy cơ cao theo chỉ số MIPI dơn giản
hóa, 60% có bệnh ngoải hạch và 54% có ảnh hưởng tủy xương.
Sống còn không tiến trìến bệnh (PFS) đã được đảnh gìả bởi IRC theo số lượng tiêu chí IWG sửa đổi
đối với bệnh u lympho không Hodgkin (NHL). Kết quả hiệu quả cho Nghiên cứu MCL300] được
trình bảy trong Bảng 3 và đường cong Kaplan- Meier đối với PFS trong Hình 1.
PI_Imbruvica_ Capsule MOngva _EU SPC. . .. _vl
Page 12 of 23
’Y
\Ế’w
\\
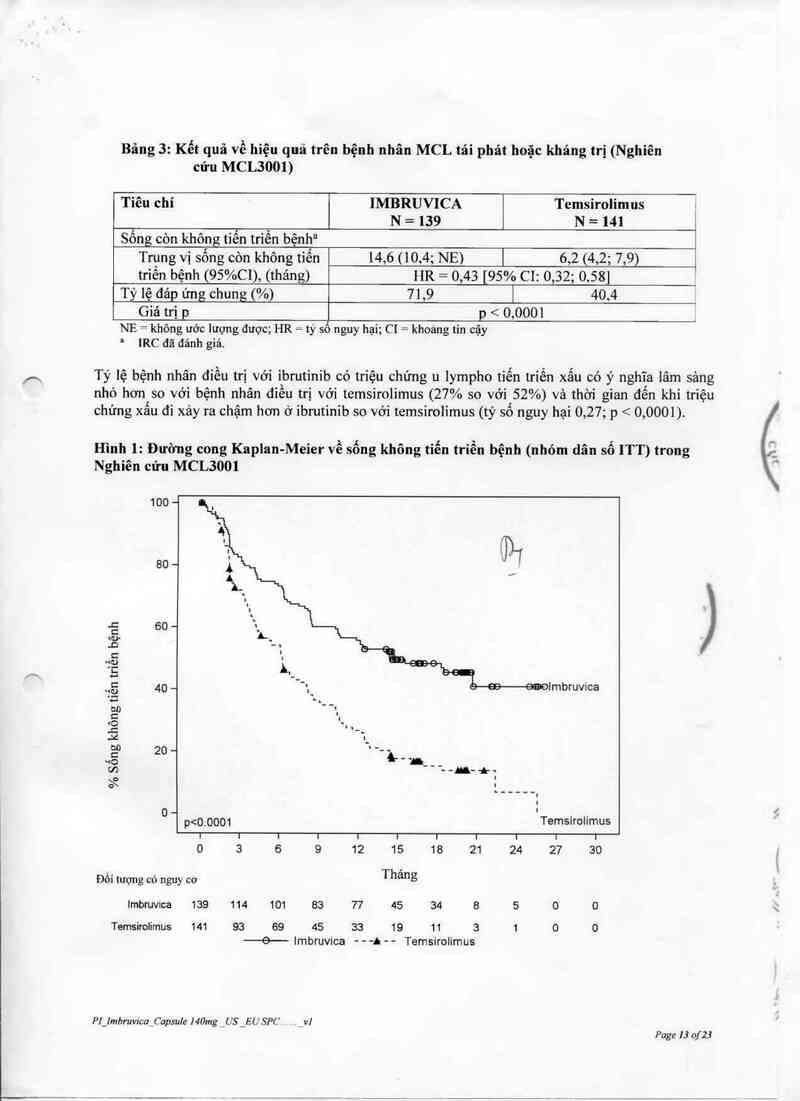
Băng 3: Kểt quả về hiệu quả trên bệnh nhân MCL tái phát hoặc kháng trị (Nghiên
cứu MCL3001)
Tiêu chí IMBRUVICA Temsirolimus
N = 139 N = 141 ,
Sống còn không tiên triến bệnh“' 1
Trung vị sống còn không tiến 14,6 (10,4; NE) ] 6,2 (4,2; 7,9) }
triển bệnh (95%C1), (thảng)
HR = 0,43 [95% C1: 0,32; 0,58]
Tỷ lệ đảp’ ưng chung (%)
71,9 | 40.4
Giá trị p
p < 0,0001
NE = không ước lượng được; HR = ty sô nguy hại; CI = khoáng tin cặy
= IRC dã đảnh giả.
Tỷ lệ bệnh nhân điều trị với ibrutinib có triệu chứng u lympho tiển triền xẩu có ý nghĩa lâm sảng
nhỏ hơn so với bệnh nhân điểu trị với temsirolimus (27% so với 52%) và thời gian đến khi triệu
chứng xấu đi xảy ra chậm hơn ở ibmtinỉb so với temsirolimus (tỷ số nguy hại 0,27; p < 0 ,0001).
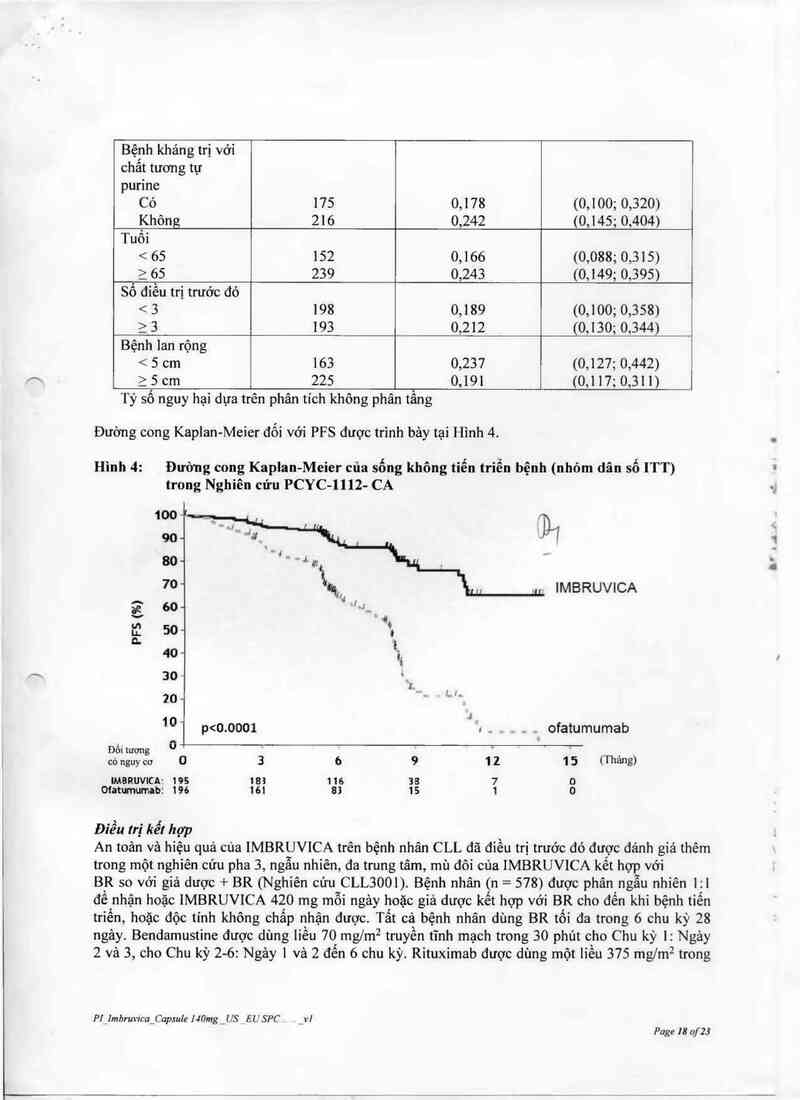
Hình 1: Đường cong Kaplan-Meier về sống không tiến triễn bệnh (nhóm dân số ITT) trong
Nghiên cứu MCL3001
100 ~
80 -
Ễ 60 —
zo-
.D
:
°f9
}:
,,ễ 40 -
oo ',
E 1
(O `1 _
Ế ~._
co 20 - - .
::
~< ' `L
=\° : .....
0 _ :
p<0.0001 Temsirolimus
| | 1 1 T 1 | I 1 T |
0 3 6 9 12 15 18 21 24 27 30
Đối tượng có nguy cơ Tháng
lmbruvica 139 114 101 83 77 45 34 8 5 0 O
Temsirolimus 141 93 69 45 33 19 11 3 1 0 O
—e- lmbruvica
PI_Imbruvica_Capsule I40mg _US _E U SPC _vl
- - -A - - Temsirolimus
Page 13 nf 23
,1
Bệnh bạch cầu mạn tính dòng lympho D'1
Bệnh nhân CLL chưa điều trị trước đó
Một nghiến cứu pha 3 ngẫu nhiến, đa trung tâm, nhãn mở (PCYC-l ] 15-CA) so sánh IMBRLJVICA
với chlorambucil đã được thợc hiện trên bệnh nhân > 65 tuổi bị CLL chưa từng được điều trị. Bệnh
nhân từ 65 đến 70 tuổi cần có it nhất một bệnh kèm mà bị loại khói việc sử dụng liệu phảp hóa miễn
dịch tuyến đầu (front- line) với fÌudarabine, cyclophowhamide, vả rituximab. Bệnh nhân (n— = 269)
được phân ngẫu nhiên 1: 1 để dùng hoặc IMBRUVICA 420 mg mỗi ngảy cho đến khi bệnh tiến tríến
hoặc độc tính không chấp nhận được, hoặc chlorambucil với liều khởi đầu 0, 5 mg/kg vảo ngảy 1 và
15 cho mỗi chu kỳ 28 ngảy trong tối đa 12 chu kỳ, với sự chắp nhận tăng liều cho tưng bệnh nhân
1ến đến 0,8 mg/kg phụ thuộc vảo khả năng dung nạp. Sau khi khẳng định bệnh tiến triến, bệnh nhản
trong nhỏm dùng chlorambucil được chuyến sang dùng ibrutinib.
Trung vị tuổi là 73 tuối (từ 65 đến 90 tuổi), 63% lả nam giởi, vả 91% là da trắng. 91% bệnh nhân có
tình trạng hoạt động ECOG ban đầu là 0 hoặc ] và 9% có tình trạng hoạt động ECOG là 2. Nghiên
cứu tuyến chọn 269 bệnh nhân CLL. Tại thời điếm ban đầu, 45% bệnh nhân ở giai đoạn lâm sảng
tiến xa (Giai đoạn Rai 111 hoặc IV), 35% bệnh nhân có ít nhắt một khối u > 5 cm, 39% có thiếu mảu
tại thời điếm ban đầu, 23% có giảm tiểu cầu tại thời điếm ban đẩu, 65% có tăng microglobulin 132
> 3500 mcg/L, 47% có CrCL < 60 mL/phút, và 20% bệnh nhãn có bỉểu hìện dell 1q.
Sống không tiến triển bệnh (PFS) được đảnh giả bởi IRC theo tiêu chí của Hội nghị quốc tế về CLL
(IWCLL) cho thấy giảm có ý nghĩa thống kê 84% nguy cơ tử vong hoặc tiến triển 6 nhóm dùng
IMBRUVICA. Kết quả về hiệu quả cúa Nghiên cứu PCYC 1115-CA được trình bảy ở Bảng 4 và
đường cong Kaplan- Meíer cho PFS vả OS được trình bảy ở ] lỉnh 2 và 3 tương ứng.
Đã có cải thiện tỉếu cẩu và hemoglobin một cách bền vưng đáng kể có ý nghĩa thống kê trong nhóm
dân số lTT ưu thế cho nhóm íbrutinib hơn nhóm chlorambucìl. Ở bệnh nhân có giảm tế bảo ở thời
điểm ban đầu, cải thiện về mặt huyết học bền vững ở nhóm ibrutinib so với chlorambucỉl tương ứng
1ả:tiếu cầu 77,1% so với 42,9%; hemog1obìn 84, 3% so với 45, 5%
Bâng 4: Kết quả về hiệu quả của Nghiên cửu PCYC-ll lS-CA
Tiêu chí IMBRUVICA Chlorambucil
N = 136 N = 133
Sống không tiểu triễn hệnha
Số lượng biến cố (%) 15 (11,0) 64 (48,1)
Trung vị (95% CI), thảng Chưa đạt 18,9 (14,1; 22,0)
HR (95% 01) 0,161 (0,091, 0,283)
Tỷ lệ đáp ứng chung“ (cu +PR) 82,4% | 35,3%
Giá trị P < 0,0001 _
Sống còn toản bộb
Số lượng tử vong (%) 3 (2,2) | 17 (12,8)
HR (95% Cl) 0,163 (0,048; 0,558) ;
Pl_lmbruvica_Copsule MOmg _ US __EUSPC vỉ
Page 14 of23
ka.
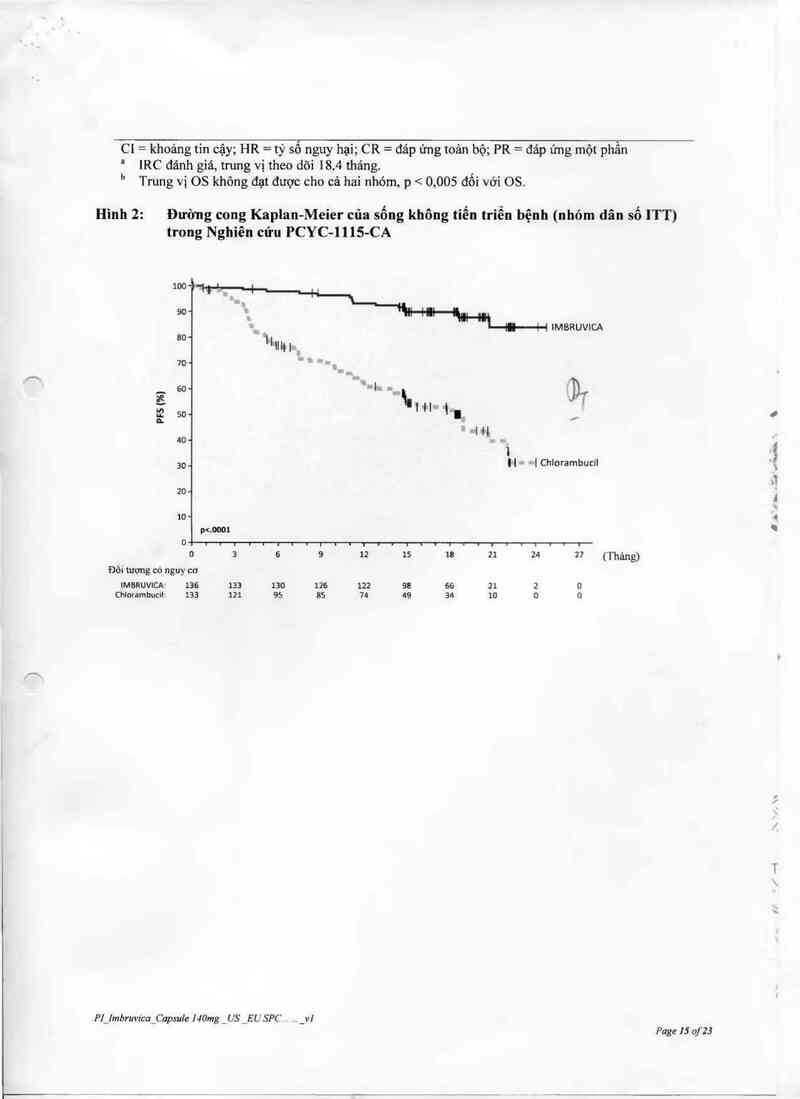
c1 = khoảng tin cậy; HR = tỷ số nguy hại; CR = đáp ứng toản bộ; PR = đảp ứng một phần
' IRC đánh giá, trung vị theo dõi 18,4 tháng. ’
" Trung vị OS không đạt được cho cả hai nhóm, p < 0,005 đôi với OS.
Hình 2: Đường cong Kap1an-Meỉer của sống không tiến triễn bệnh (nhóm dân số ITT)
trong Nghiên cứu PCYC-lllS-CA
IMBRUVICA
_ 60 - “ 1² ² 3 D”
ẵ 1'1 11 '
Ề so ~ 1"I, -
g 6-1 11
40 ~ .
1
30- ll~ | Chlorambucil
20 '
10 “
p<.0001
0 1 n u 1 I u ' ' I 1 v 1 . i ! i i u :
0 3 6 9 12 15 lũ 21 2Ả 27 ( T`hủg)
Đối tượng có nguy cơ
IMBRUVICA' 136 133 130 126 122 98 66 21 2 o
Ch!orambucỉlr 133 121 95 85 74 49 34 10 o o
Pl_lmbnưica_Capwle 140mg _US _E U SPC ..
_v/
Page 15 of23
.1n“ .fmnụ
«B.
A
Hình 3: Đường cong Kaplan-Meier của sống còn toân bộ (nhóm dân số ITT) trong Nghiên
cứu PCYC-lllS-CA
1°°°H-Lv _ l : … imeRuwcA
= ²~13 ›,
90 _ , =~IllunliHllli mun MH H 11 Chiorambudl
80 *
70~
60 <
507 CDT
404
Sống còn toản bộ (%)
30-
20-
10-
p=0.0010
o . . . , . i . . . . i , . . . . . . . . . . . . . . .
o 3 6 9 12 15 13 21 24 27 (Thảng)
Đổi tương có nguy co
IMBRUVICA: 136 134 131 131 131 123 74 32 4 0
Chlorambucilz 133 127 125 121 118 113 62 24 1 0
Bệnh nhân CLL đã nhận ít nhất một trị liệu trưởc đó
Đã chứng minh tinh an toân và hiệu quả của IMBRUVICA trên bệnh nhân CLL trong một nghiên
cứu không đối chứng và một nghiên cứu ngẫu nhiến có đối chứng. Một nghiên cứu nhãn mở, đa
trung tâm (PCYC-l lO2-CA) bao gồm 51 bệnh nhân CLL tái phảt hoặc khảng trị đã dùng 420 mg
IMBRUVICA một lần mỗi ngảy cho đến khi bệnh tiến triến hoặc độc tính không chấp nhận được.
Trung vị tuổi lả 68 tuổi (từ 37 đến 82 tuối), trung vị thời gian từ khi chấn đoản là 80 thảng, và trung
vị số lượng trị liệu trước đó là 4 (từ 1 đến 12 trị liệu), bao gồm 92,2% với thuốc tương tự nucleoside
trước đó, 98,0% với rituximab trước đó, 86,3% với một thuốc alkyl hóa trưởc đó, 39,2% với
bendamustine trước đó và 19,6% với ofatumumab trưởo đó. Tại thời điểm ban đầu, 39,2% bệnh
nhân với giai đoạn Rai IV; 45,1% có bệnh lan rộng (2 5 cm); 35,3% có mất đoạn 17p và 31,4% có
mất đoạn ] 1q.
Đã đảnh giá ORR theo tiêu chí IWCLL 2008 bởi cảc nghiên cứu viên và 1RC. Tại trung vị thời gian
theo dõi 16,4 tháng, ỌRR đánh giá bời IRC cho 51 bệnh nhân tải phát hoặc khảng trị là 64, 7% (95%
C | 50,1%; 77 ,6,%) tất cả các đảp’ ưng một phần (PRs). ORR bao gôm cả đáp ứng một phần với tăng
lympho bảo là 70, 6%. Trung vị thời gian đến khi đáp ứng là 1,9 thảng DOR trong khoảng từ 3, 9
đển 24,2+ tháng. Trung vị DOR chưa đạt.
Một nghiên cứu pha 3 ngẫu nhiên, đa trung tâm, nhãn mớ so sảnh IMBRUVICA với ofatumumab
(PCYC-l 1 12-CA)được tiên hảnh trên bệnh nhân CLL tải phát hoặc khảng `trị. Bệnh nhân (11 =, 391)
được lựa chọn ngân nhiên 1:1 đê điều trị hoặc IMBRUVICA 420 mg một lân môi ngảy cho đên khi
P] Almbnm'ca_Capsule l 40mg _LS _E 1.7 SP(` . _vl
Page 16 of23
\A Crl
l~ '
I .
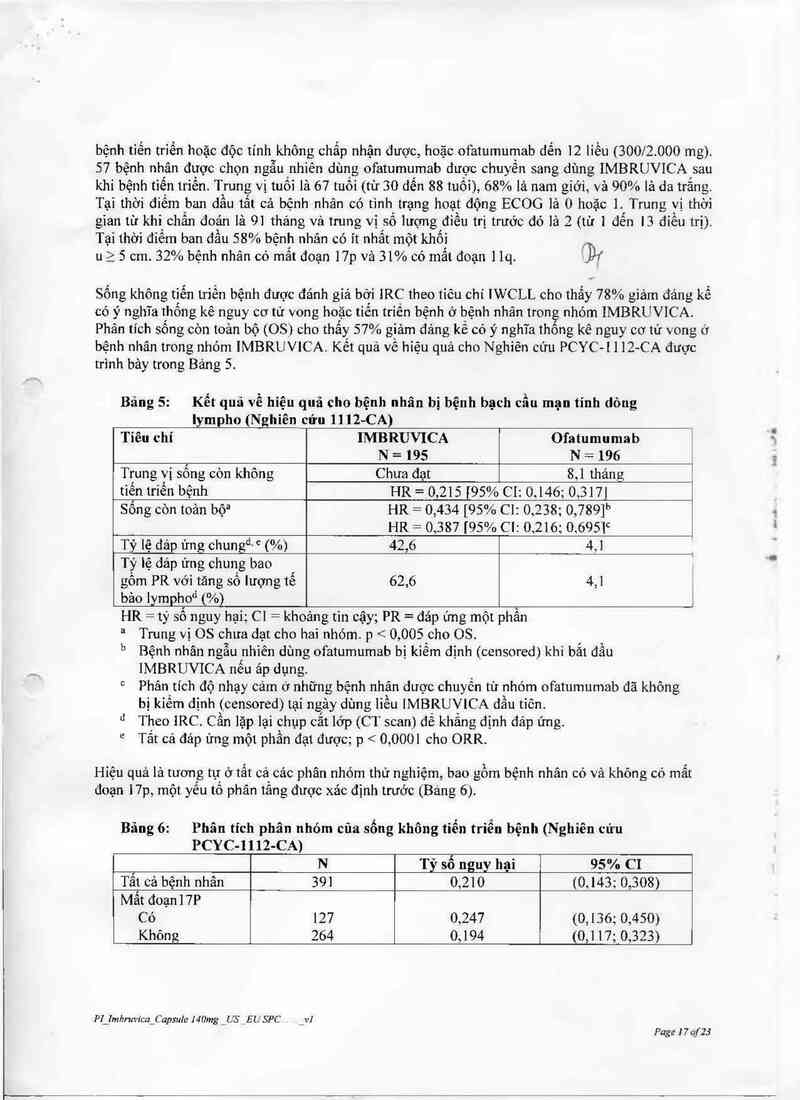
bệnh tiến trỉến hoặc độc tinh không chẩp nhận được, hoặc ofatumumab dến 12 liều (300/2.000 mg).
57 bệnh nhân được chọr1 ngẫu nhiên dùng ofatumumab dược chuyển sang dùng IMBRUVICA sau
khi bệnh tiến triến. Trung vị tuối là 67 tuổi (từ 30 đến 88 tuối), 68% lá nam giới, vả 90% lá da trắng
Tại thời điếm ban dẩu tất cả bệnh nhân có tình trạng hoạt động ECOG lả 0 hoặc 1 Trung vị thời
gian từ khi chấn đoản là 91 thảng vả trung vị số lượng điều trị trước đó là 2 (từ 1 đễn 13 điểu trị).
Tại thời điểm ban đẩu 58% bệnh nhân có ít nhất một khối _
u 2 5 cm. 32% bệnh nhân có mất đoạn 17p và 31% có mất đoạn 11q. Dĩ
Sống không tiến triển bệnh được đánh giá bởi IRC theo tỉỏu chi IWCLL cho thấy 78% gỉảm đáng kể
có ý nghĩa thống kê nguy cơ tử vong hoặc tiến triến bệnh ở bệnh nhân trong nhóm IMBRUVICA.
Phân tích sông còn toản bộ (OS) cho thẩy 57% giảm đảng kế có ý nghĩa thống kê nguy cơ tử vong ở
bệnh nhân trong nhóm IMBRU VlCA. Kết quả vê hiệu quả cho Nghiên cứu PCYC- 1112- CA được
trình bảy trong Bảng 5.
Bãng 5: Kết quả về hiệu quả cho bệnh nhân bị bệnh bạch cẩu mạn tính dòng
lympho (Nghiên cứu lllZ-CA)
Tiêu chí IMBRUVICA Ofatumumab
N = 195 N = 196
Trung vị Sống còn không Chưa đạt 8,1 tháng
tiến triền bệnh HR = 0,215 195% CI: 0,146; 0,317)
Sống còn toân bộ² HR = 0,434 [95% c1: 0,238; 0,789]b
HR = 0,387 195% c1: 0,216; 0,6951c
Tỷ lệ đảp ứng chungd e (%) 42,6 4,1
Ty lệ dáp ứng chung bao
gôm PR vởi tăng sô lượng tế 62,6 4,1
bảo lymphod (%)
HR= tỳ sô nguy hại; CI= khoảng tin cậy; PR= đảp ứng một phần
Trung vị OS chưa dạt cho hai nhóm. p < 0,005 cho OS.
b Bệnh nhân ngẫu nhỉên dùng ofatumumab bị kiểm định (ccnsored) khi bắt đầu
IMBRUVICA nếu áp dụng
° Phân tích độ nhạy cảm (1 những bệnh nhân được chuyến từ nhóm ofatumumab đã không
bị kiếm dịnh (censored) tại ngảy dùng liểu IMBRUVICA dầu tiên.
d Theo IRC Cần lặp lại chụp cẳt lớp (C1 scan) để khẳng định đảp ứng.
²² Tắt cả đáp ứng một phần đạt được; p < 0, 0001 cho ORR.
Hiệu quả là tương tự ở tắt cả các phân nhỏm thử nghỉệm, bao gồm bệnh nhân có và khỏng có mất
đoạn 17p, một yêu tô phân tâng được xảo định trước (Báng 6).
Bãng 6: Phân tích phân nhỏm của sống không tiến triễn bệnh (Nghiên cứu
PCYC-lllZ-CA)
N Tỷ số nguy hại 95% c1
Tẩt cả bệnh nhân 391 0,210 (0,143; 0,308)
Mất đoạn 1 7P
Có 127 0,247 (0,136; 0,450)
Khỏng 264 0,194 (0,1 17; 0,323)
Pl_lmbmvica_Capmle 140mg , US __ EU SPC _v1
Page 1 ? of23
Bệnh kháng trị với
chẩt tương tự
purine
Có 175 0,178 (0,100; 0,320)
Không 216 0,242 (0,145; 0,404)
Tuổi
< 65 152 0,166 (0,088; 0,315)
2 65 239 0,243 (0,149; 0,395)
Số diều trị trước đó
< 3 198 0,189 (0,100; 0,358)
2 3 193 0,212 (0,130; 0,344)
Bệnh lan rộng
< 5 cm 163 0,237 (0,127; 0,442)
ìScm 225 0,191 (0,117; 0,311)
Tỷ số nguy hại dựa trên phân tich không phân tầng
Đường cong Kaplan-Meier đối với PFS được trình bảy tại Hình 4.
Hình 4: Đường cong Kaplan-Meier của sống không tiễn triễn bệnh (nhỏm dân số ITT)
trong Nghiên cứu PCYC—lllZ- CA
100~l DI,
90- .
80- __
70` q, › IMBRUVICA
a °°- ' ,
… ”t
u. 50“ t
² 1.
40- 11
30~ ",
L M
20—
10- ’
p<0.0001 . . . . ofatumumab
Đố1tượng 0 . , .
cónguycơ 0 3 6 9 12 15 (Tháng)
IMBRUVICA: 195 183 116 38 7 0
01atưnumab: 196 161 83 15 1 0
Điều trị kểt họp
An toản và hiệu quả của IMBRUVICA trên bệnh nhân CLL dã điều trị trước đó được đánh giá thêm
trong một nghiên cứu pha 3, ngẫu nhiên, đa trung tâm, mù đôi của IMBRUVICA kết hợp với
BR so với giả dược + BR (Nghiên cứu CLL3OOI). Bệnh nhân (n — 578) được phân ngân nhiên 1:1
để nhận hoặc IMBRUVICA 420 mg mỗi ngảy hoặc giả dược kết hợp với BR cho đến khi bệnh tiến
triến, hoặc dộc tinh không chấp nhận được. Tất cả bệnh nhân dùng BR tối đa trong 6 chu kỳ 28
ngảy Bendamustine được dùng liều 70 mglm2 truyền tĩnh mạch trong 30 phút cho C hu kỳ 1: Ngảy
2 và 3, cho Chu kỳ 2- 6: Ngảy 1 và 2 đến 6 chu kỳ. Rituximab được dùng một liều 375 mg]…2 trong
Pl_lmbruvica_Capsule I-fflmg _ US EU SPC __vl
Pnge 18 of 23
.' l
Chu kỳ đầu: Ngảy 1, vả 500 mg/m2 trong Chu kỳ 2 đến 6: Ngảy l. Chín mươi bệnh nhân được chọn
ngẫu nhiên dùng giả dược + BR đã chuyến sang dùng IMBRUVICA sau khi IRC xảo định bệnh tiến
triến. Trung vị tuổi lả 64 tuối (từ 31 đến 86 tuổi), 66% 13 nam giới, và 91% là da trắng. Tất cả bệnh
nhân có tình trạng hoạt dộng ECOG ban đầu là 0 hoặc 1. Trung vị thời gian từ khi chần đoản là 6
năm và trung vị số trị lỉệu trước đó là 2 (từ 2 đến 1 ] trị liệu). Tại thời điềm ban đằu, 56% bệnh nhân
có it nhất một khối u 2 5 cm, 26% có mất đoạn dell 1q.
Sống không tiến triền bệnh (PFS) được dánh giả bời IRC theo tiêu chí IWCLL. Kết quả về hiệu quả
cùa Nghỉên cứu CLL300] dược trình bảy trong Bảng 7.
Bảng 7: Kết quả về hỉệu quả trên bệnh nhân bạch cầu 11 lympho mạn tính (Nghiên cứu
CLL3OOI)
IMBRUVICA + BR Giả dược + BR
Tiêu chí N = 289 N = 289
Sống còn khộnffliến triến bệnh“ Ỉ
. , Không đạt được 13,3 (1 1,3; 13,9)
Trung vi (95% CD’ thang HR = 0,203 195% c1: 0,150; 0,276]
Tỵ' lệ đảp ứng toản bộb % 82,7 ] 67,8
Sống còn toản bộ (OS)c HR = 0,628 195% c1: 0,385; 1,024)
CI = khoảng tin cậy; HR = tỷ số nguy hại;
' IRC đảnh giá.
" IRC đánh giá, ORR (đảp ứng hoản toản, đáp ứng hoản toản với hồi phục tùy xương không toản
bộ, đảp ứng hạch một phần, đảp ứng một phần).
°"1rung vị OS không đạt được cho cả hai nhóm. ịj)1
T ăng macroglobulin huyết (Bệnh Waldenstrôm)
An toản và hiệu quả của IMBRUVICA trong WM (u lympho 1ymphoplasmacytic tiết IgM) được
đảnh giá trong một nghiên cứu đơn nhánh, nhãn mớ, đa trung tâm trên 63 bệnh nhân đã diều trị
trước đó Trung vị tuối là 63 tuổi (từ 44 đến 86 tuổi), 76% lá nam giởi, và 95% là da trắng. Tất cả
bệnh nhân có tình trạng hoạt động ECOG thời điếm ban đầu là 0 hoặc 1. Trung vị thời gian từ khi
chấn đoản là 74 thảng, và trung vị số trị liệu trước đó là 2 (từ 1 đến 11 trị liệu). Tại thời điếm ban
đầu, trung vị giá trị lgM huyết thanh là 3, 5 g/dL, và 60% bệnh nhân bị thiếu mảu (haemoglobin
S 1 1 g/dL hoặc 6,8 mmol/L).
Uống IMBRUVICA với lỉều 420 mg một lần mỗi ngây cho đến khi bệnh tiến triến hoặc độc tinh
không chẩp nhận được Tiêu chí chính cùa nghiên cứu nảy lả ORR theo đảnh giá cùa nghiên cứu
viên. ORR vả DOR đã dược đảnh giả bằng cảch sử dụng tiêu chí cùa Hội nghị Quốc tế lần thứ ba về
bệnh tăng macroglobu1in huyết Waldenstrõm. Đảp' ưng với IMBRUVICA được trình bảy ở Bảng 8
Bảng 8: Tỷ lệ đáp ứng toân bộ (ORR) và thời gian đáp ứng (DOR) ở bệnh nhân
WM
T = 63
ORR 87
95% C ]
VGPR 14
PR
PI VImbrwica_Capsu/e 140mg J v'S _EI/ SPC vl
Page 19 onJ
\ 'c›>- ,,
\
MR (%) 17,5
Trung vị DOR thảng (khoảng) NR (0,03%1`. 18,8+)
C] = khoảng tin cậy; NR f không đạt được; MR = đảp ửng không đáng kế; PR = đáp ứng một phần;
VGPR = đảp ửng một phân rât tôt; ORR = MR+PR+VGPR
Trung vị thời gian đến khi đạt đảp ưng là 1,0 thảng(khoảng 0,7 đến 13, 4 thảng).
Kết quả về hiệu quả cũng được đảnh giả bời Hội đồng đảnh gỉả độc lập (IRC) cho thấy ORR là 83%
với tỷ lệ đáp ửng một phần rất tốt (VGPR) 11% và tỷ lệ đảp ứng một phần (PR) 51%.
Nhóm dân số trẻ em
Cơ quan quản lý dược phấm Châu Âu đã miễn trừ nộp kết quả nghiên cứu IMBRUVICA trên tất cả
phân nhóm bệnh nhân nhi bị MCL, CLL và u lympho dạng 1ymphoplasmacytic (LPL) (xem LIÊU
DÙNG VÀ CÁCH DÙNG đế có thông tin sử dụng cho trẻ em).
ĐẶC TÍNH DƯỢC ĐỘNG HỌC ỀĨ
Hấp thu
Ibrutinib được hấp thu nhanh sau uống với trung vị me từ 1 đến 2 giờ. Sinh khả dụng tuyệt đối
trong điều kiện nhịn đói (n = 8) là 2,9% (90% CI = 2,1 - 3,9) và tăng gấp dôi khi dùng cùng thức ăn.
Dược động học của ibrurinib không thay đối đảng kế ở bệnh nhân u ảc tính tế bảo B. Nồng độ
ibrutinib tăng khi dùng liều lên đến 840 mg. Đã ghi nhận AUC ở trạng thái ốn định trên bệnh nhân
với liều 560 mg là 953 :E 705 ng h/mL (trung binh d: dộ lệch chuẩn). Sử dụng ibrutinib trong tình
trạng đói, nồng độ (AUC…) đạt khoảng 60% so với 30 phút trước, 30 phủt sau (tình trạng ăn no)
hoặc 2 giờ sau bữa sảng gỉảu chất béo.
Ibrutinib có độ hòa tan phụ thuộc pH, với độ hòa tan thấp hơn khi pH cao hơn. Ở người khỏe mạnh
lúc đói đã dùng liều duy nhất 560 mg ibrutinib sau khi dùng omeprazole liễu 40 mg một lần mỗi
ngảy trong 5 ngảy, so với dùng ibrutinib đơn độc, tỷ lệ hình học trung binh (geometric mean ratios)
(90% Cl) của AUC024, AUClast, vả Cmax tương ứng là 83% (68-102%), 92% (78-110%), và 38%
(26-53%).
P_hân bố
In vitro, sự gắn kết có hồi phục của ibrutinib vởi protein huyết tương người là 97, 3 % và không phụ
thuộc nồng độ trong khoảng 50 đến 1000 ng/mL. Thể tích phân bố biều kiến ở trạng thải ôn định
(Vd, ss/F) xấp xỉ khoảng 10000 L
Chuỵến hóa
Ibrutinib được chuyến hóa chủ yếu bởi CYP3A4 tạo thảnh một chất chuyến hỏa dihydrodiol vởi
hoạt tính ức chế BTK thấp hơn khoảng 15 lần so với ibrutinib. Mối liên quan với CYP2D6 trong
chuyến hóa ibrutinib dường như là tối thiểu. Do đó, không cần thận trọng ở bệnh nhân có kiếu gen
CYP2D6 khác.
PI_Imbruwca Capsule I 40mg _ US _EUSPC , … yvl
Page 20 of 23
\o`ỐGL …dx
Thảỉ trừ
Độ thanh thải biều kiến (CL/F khoảng 1000 L/giờ. Thời gian bản hùy cùa ibrutinib là 4 đến 13 giờ.
Sau liều uống duy nhất [MC]- ibrutinib được đánh dắu phóng xạ ở người khỏe mạnh, khoảng 90%
hoạt chẩt đảnh dấu phóng xạ đã được bảỉ tìết trong vòng 168 giờ, với hầu hết (80%) bải tiết trong
phân và dưới 10% trong nước tiểu. Ibrutinib không chuyến hỏa chỉếm khoảng 1% sản phấm bải tiết
được đảnh dấu phóng xạ trong phân và không có trong nước tiểu.
Nhóm dân số đăc biêt
C ao tuối
Dược động học quần thể cho thấy tuối tảc không ảnh hướng đáng kể dến thanh thải ibrutinib từ tuần
hoản.
T re em ' _ ,-
Không tiên hảnh nghiên cứu dược động học cùa ở bệnh nhân dưới 18 tuôi. ÍDĩ
Giới tính
Dược động học dân số cho thấy giới tính không ảnh hưởng đảng kể đến thanh thải ỉbrutinib từ tuần
hoản.
Chúng tộc , ' '
Không có đủ dữ liệu đê đảnh giả tảc dụng tiêm tảng của yêu tố chủng tộc đên dược động học
ibrutinib.
Ĩ71ế trọng ` _ ' `
Dữ liệu dược động hộc guân thế cho thây thê trỌng (41-146 kg; trung binh [SD]: 83 [19 kg]) có ảnh
hưởng không đảng kê đên sự thanh thải íbrutinib.
Suy thận
Ibrutinib được thanh thải tối thiếu ở thận; thải trừ qua nước tiểu của cảc chất chuyển hóa < 10% lỉếu
dùng. Cho đên nay chưa tiên hảnh nghiên cứu chuyên biệt ở bộnh nhân suy `thận. Không có dữ liệu
trên bệnh nhân suy thận nặng hoặc bệnh nhân lọc mảu (xem LIEU DUNG VA CACH DUNG).
Suy gan
Ibrutinib được chuyển hóa tại gan. Đã tiến hảnh một nghiên cứu về suy gan trên đối tượng khỏng
ung thư dùng liều duy nhất 140 mg trong tình trạng đói. Ảnh hưởng suy giám chức năng gan thay
đổi đảng kể giữa cảc cả thể, nhưng đã ghi nhận nông độ ỉbrutinib tăng trung bình iả 2,7; 8,2; và 9, 8
lần tương ứng ở đối tượng suy gan nhẹ (11 = 6, Child- -Pugh loại A), trung bình (n— = 10, Child- -Pugh
loại B) và nặng (11 =8, Child Pugh Ioại C). Phần ibrutinib tự đo cũng tăng theo mức đó suy gan,
tương ứng 3, 0; 3, 8 vả 4, 8% ở đối tượng suy gan nhẹ, trung bình vả nặng so với 3, 3% trong huyết
tương đạt được ở đối tượng khỏe mạnh trong nghiên cứu nảy. Tăng tương ứng nồng độ ibrutinib
không liên kết (AUCunbounct Iast) ước tính từ 4,1 đến 9,8 vả 13 lẩn ở đối tượng suy gan nhẹ, trung binh
và nặng (xem LIÊU DÙNG VÀ CẢCH DÙNG).
Dùng đồng thời vởi cơ chất C Y P
Pl_lmbruvica_Capxule l40mg US EUSP(` . _v]
Page 2] of 23
sÀ.ư_ 'ì`l
"Vn
Nghiên cứu in vitro cho thấy ibrutinib ức chế yếu có hồi phục CYP2B6, cvpzcs, CYP2C9,
C YP2CI9, C YP2D6, vả CYP3A4 trong đường tiêu hóa (nhưng không tại gan) và không cho thấy ức
chế phụ thuộc thời gian có liên quan lâm sảng đến CYP1A2, CYP2Bõ, CYP2C8, CYP2C9,
CYP2CI 9 và CYP2D6. Chất chuyển hóa dihydrodiol của ỉbrutinib ức chế yếu CYP2B6, CYP2C8,
CYP2C9, vả CYP2D6 Chất chuyền hóa dihydrodiol cảm ửng yếu lsoenzyme cvp4so trên in vitro
Mặc dù ỉbrutinib nhạy cảm cơ chất CYP3A4 nhưng nó không có tác dụng lâm sảng iỉên quan đến
nồng độ.
Sử dụng đồng thời với chất ửc chế/ cơ chất vận chuyến
Cảc nghiên cứu in vilro cho thấy ỉbrutiníb không phải là cơ chất của P-gp, hoặc chất vận chuyền
chính nảo khác, ngoại trừ OCT2. Chất chuyển hóa dihydrodiol vả cảc chât chuyến hóa khác là cơ
chất cùa P- -gp. In vitro ibrutinib ức chế P-gp vả BCRP (xem TƯỜNG TẢC VỚI CÁC THUỐC
KHÁC VÀ CÁC DẠNG TƯONG TẢC KHAC). j)Ĩ
THÔNG TIN TIÊN LÂM SÀNG ,
Đã gập những biến cố bất lợi sau đây trong cảc nghiên cửu kéo dải 13 tuần 6 chó vả chuột. Đã thắy
íbrutinib gây ảnh hưởng trên hệ tiêu hóa (phân nảt/tiêu chảy vả/hoặc viêm) và giảm số lượng và kích
thước nang bạch huyết (lymphoid depletion) ở chuột và chó với nổng độ không quan sảt thắy tảc
dụng phụ (NOAEL- No Observed Adverse Effect Level) 30 mg/kg/ngảy ở cả hai loải. Dựa trên
nồng độ trung bình (AUC) tại liều dùng trên lâm sảng 560 mg/ngảy, tỷ lệ AUC là 2,6 và 21 tại
NOAEL ở chuột đực và cải, và 0,4 và 1,8 tại NOAEL ở chó đục và cải, tương ứng. Mức độ ảnh
hướng thấp nhắt quan sảt được (LOEL- Lowest Observed Effect Level) (60 mg/kg/ngảy) ở chó lả
3, 6 lần (đực) và 2, 3 lằn (cải). Ó chuột, teo tế bảo nang tụy mức độ trung binh (được coi 1ả tảc dụng
bất lợi) đã ghi nhận với liều > 100 mg/kg ở chuột đực (nồng độ AUC gâp 2,6 lần) và không quan sảt
thấy ở chuột cải với liều lên đến 300mg/kg/ngảy (nồng độ AUC gấp 21,3 lẫn). Giảm mức độ nhẹ
xương xốp và xương đặc đã được ghi nhận ở chuột cải với liều > 100 mg/kg/ngảy (nồng độ AUC
gấp 20, 3 lần). Tất cả phát hiện trên đường tiêu hóa, bạch huyết và xương hồi phục sau gỉai đoạn hồi
phục 6- 13 tuần. Những phát hiện trên tụy hồi phục một phần trong thời gỉan phục hồi tương tự.
Chưa tiến hảnh nghiên cứu độc tính 6 trẻ vị thảnh niên.
T ính sinh ung thư/độc tính gen
Chưa tiến hảnh nghiên cửu vết1'nh sinh ung thư với ibrutinib. …
Ibrutinib không có đặc tính độc gen khi nghiên cứu trên vi khuân, tế bảo động vật có vú hoặc trên
chuột nhăt.
Độc tính về sinh sản
Trên chuột cống mang thai, ỉbrutinib với liếu 80 mg/kg/ngảy đã gây tăng mất thai và tăng dị tật trên
tạng (tim vả mạch mảu chính) và thay đổi hệ xương với nông độ tăng 14 lần AUC so với bệnh nhân
dùng liều hảng ngảy 560 mg. Tại liều 2 40 mg/kglngảy, ibrutinib liên quan đến giảm trọng lượng
thai (tỷ lệ AUC ì 5,6 khi so sánh với liều hảng ngảy 560 mg cho bệnh nhân). Hậu quả, NOAEL của
phôi là 10 mg/kglngảy (khoảng 1,3 lần AUC cùa ibrutinib tại liều hảng ngảy 560 mg) (xem PHỤ
NỮ có THAI, CHO CON BÚ VÀ KHẢ NĂNG SINH SẢN).
Ở thỏ mang thai, ibrutinib với liều `15 mg/kg/ngảy hoặc cao hơn liên quan đến bắt thường hệ xương
(mêm xương ửc) yả ibmtinỉb với liêu 45 mg/kgfngảy liên quan đến tăng mất phôi thai. Ibrutinib gây
dị tật ở thỏ với liêu 15 mg/kg/ngảy (khoảng 2 lân nông độ (AUC) ở bệnh nhân MCL dùng ibrutinib
Pl_lmbrmica_Capsule 140mg _ ( JS _ El " SP(` _ vl
Page 22 qf23
liều mỗi ngảy 560 mg vả 28 lần nồng độ 6 bệnh nhân CLL hoặc WM dùng ibrutinib liều 420 mg
mỗi ngảy). Hậu quả, NOAEL của phội lả'5 mg/kg/ngảy (khoảng 0,7` lần AỵUCúcủa ibmtinỉb yới một
liều 560 mg mỗi ngảy) (xem PHỤ NƯ co THAI, CHO CON BU VA KHA NANG SINH SAN).
Khả năng sinh sán , ' '
Không quan sảt thây ảnh hướng đên khả năng sinh sản ở chuột đục hoặc cái với liếư tôi đa nghiên
cứu 100 mg/kg/ngảy (liêu tương đương ở người [HED] 16 mg/kg/ngây).
QUY CÁCH ĐÓNG GÓI
Chai HDPE với nắp bảo vệ trẻ em bằng polypropylene. Mỗi hộp chứa 1 chai 90 hoặc 120 viên nang
cứng.
Không phải tất cả quy cách đóng gói đều được lưu hảnh.
ĐIÊU KIỆN BẢO QUẢN ji1
Báo quản không quá 30°C. -
HẠN DÙNG
24 thản g từ ngảy sản xuất.
TÊN, ĐỊA CHỈ cơ sở SẢN XUẤT
Sản xuất tại: Catalent CTS, LLC (địa chỉ: 10245 Hickman Mills Drive, Kansas City, MO 64137,
Mỹ).
Dán nhãn và đỏng gói tại: AndersonBrecon Inc. (địa chỉ: 4545 Assembly Drive, Rockford, [
61109, Mỹ).
Công ty đăng ký: JANSSEN-CILAG Ltd., Thải Lan
Mọi câu hỏi/Báo cáo tác dụng ưg0ại ýlThan phiền chất lượng sản phẩm xin liên hệ:
VPĐD Janssen-Cilag Ltd., T P Hô Chí Minh.
ĐT: ...........
E-mail: [email protected]
Tải liệu tham khảo: E U SPC
Phíên bán: ỆI_Imbruvica_Capsule I40mg _US _E U SPC ...... _v]
Ngảy sửa đói: 25/07/ 201 7
Đồng phảt triến cùng Pharmacyclics \
1v1—' ~
©Janssen-Cilag YYYY
©Pharmacyclics YYYY
Logo
TUQ.CỤC TRUỜNG
P.TRUỚNG PHÒNG Page 23 of23
ỹẨạ/m % %Ền ẩfểmổ
PJ_ Imbrm'lca_ Capsule I 40mg _US _E U SPC _v1
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng