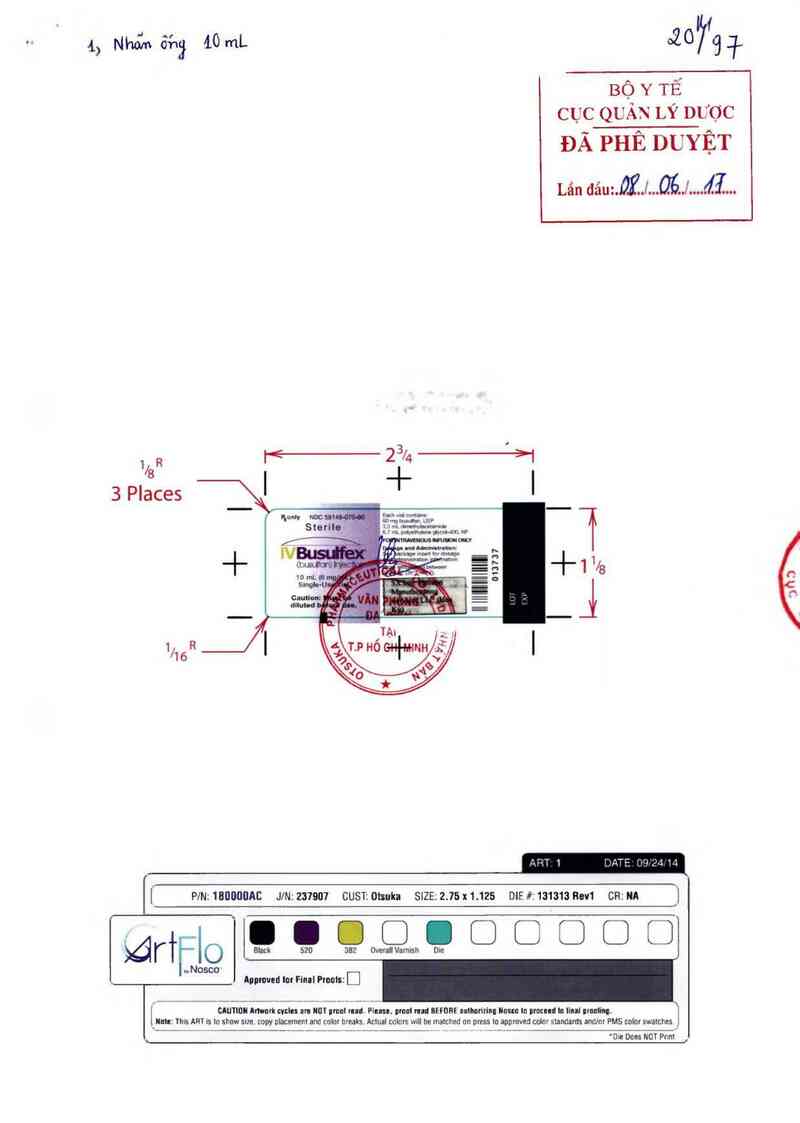












L, N…“… 6413 LomL °20797
BỘ Y TẾ
cục QUẢN LÝ DUỢC
ĐÃ PHÊ DL'YỆT
Lân đâuz.0f.J….QấJ……dL
R Ỉ< 2 3/4 ›'l
Us | Ỉ' l
3 Places
Eva(thVfiMP 1
. . ' …“ ỄỄ 1/
ẵ S + 1 8
Ễ i
1 R
%
Íl PlNZ ÌỦỦỦÚỦAC JlN1237907 CUSĨI OỈSIIKB SlZEI 2.75 X1.125 DlF #: 131313 RBV1 CRI NA I
ẵớ r†F I O Black 520 … OveralíVarmsh Die [
l lulc: This ART is lu show size. copy placemenl and coku ùreaks. AcLual cochs will be maLched on oress Lu apumved celnr sLandards amlor PMS mlm swalches J
'… Dces N01 PnnL
J
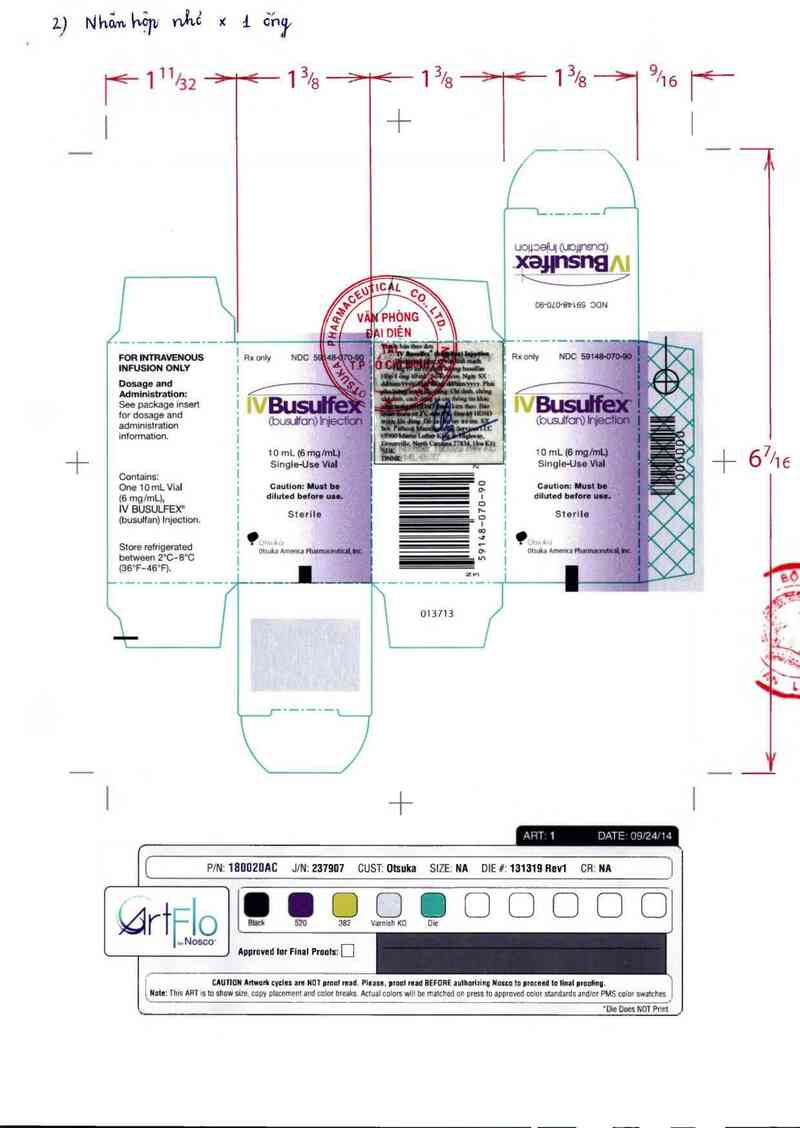
2.) Nhỏ…hệp nha x & ỡhỳ
lé 1 11/32 ++ 1 3/8 —è--ê 1 3/8 13/8 9/16 l'f-
| + i \
_. /___ — _Ã
UOHDSÍUI (UOJFSỮQ)
OG’DLD'BNSS OON
FOR NTRAVENOUS
INFUSION ONLY
|
|
Dosage and I
Administration:
See package insert l
for dosage and
administration '
information. I
| 10 mL (6 mg
SingIe-Usc
|
|
|
|
I
I
10 mL (6 m '
SingIe-Uu
—L— 67/16
Contains:
ã l
. Ể .
One 10 mL Vìal Caulion: Iud __ 2 l
(6 mg/mL), dum… bum Ẹ è _ diluted …
IV BUSULFEX' : ,. | ~
(busulfemì Iniection. St°'"' ẫ ẹ i 5²“… -
_ ' =:— 3 _ ọ _
~ : L- ……
Ễễctxweereertnzgeẳ'aĩaeetễ otsuka Amema . . _ __ o ! ouuka Amema ~
' Ể_' '"
(36°F-46"F)- = !
[[ PlNz`lũllll2llAC JIN:237907 CUST:OIsuka SIZEINA DIE#I131SIBROH CR:NA ]
gggooooooo
Varnish KO Die
m…… Im Final Pmuls: lị]
CWIION nm…t cycle: IN N01 numl mld. Pluu, lmnl rud BEFĐRE unlnrhlnu Num ln ucth In hal umdìnu.
_lule: ĩhL's ART is to shơw size. copy plaoement and cnlm hreaks Actual colurs will be ma1ched un ums to appmved color standards and/m PMS colm swaLches
_ '… o… NOT an _
Hướng dẫn sử dụng thuốc
ùng Iheo đon cu'a Bác sỹ
ân sử dụng trưởc khi dùng
/ \
IVBusulfex
(busutfm) Injecfỉon
Dung dịch tiêm truyền tĩnh mạch
W
Mỗi ống IV BUSULFEX® (busulfan) [njection 10 ml có chứa 60 mg busulfan vả cảc tá dược
polyethylen glycol 400 (Macrogol 400), dimethylacetamid (DMA ).
_M__Ô TẢ:
Busulfan lá là tảc nhân alkyl hóa hai nhóm chức có công thức hỏa học là 1 ,4- butanedìol,
dỉmethanesulfonat. BUSULFEX dược dùng theo đường tiêm truyền tĩnh mạch.
BUSULFEX là dung dịch trong suốt, không mảu, vô khuẩn được dựng trong ống 10 ml. Mỗi
ống BUSULFEX có chứa 60 mg (6 mg/mL) busulfan— hoạt chất— là bột tinh thể mảu trắng có
công thức phân tử là CHSSOZO(CHÙ4OSOZCHJ và có trọng lượng phân tử là 264 g/mol.
Busulfan tan trong N,N-dimethylacetamỉd (DMA) 3,3 mL qv` polyethylen glycol 400, NF 6,7
mL. Độ tan cùa busulfan trong nước là 0,1 g/L và độ pH] Ểac BUSULFEX đã pha loãng tởi
khoảng 0,5 mglmL busulfan trong dung dịch Natri clorid 0, 9h cdung dịch Dextrose 5% như
khuyến cáo để tiêm truyền tương ứng với độ pH cùa dung môi pha loãng đã dùng và ở trong
khoảng 3, 4 đến 3, 9. BUSULFEX được chủ định hòa tan vởi dung dịch Natri clorỉd 0,9% hoặc
dung dịch Dextrose 5% trước khi tiêm truyền tĩnh mạch.
DANG BÀO CHẾ: Dung dịch tiêm truyền tĩnh mạch.
QUY CÁCH ĐÓNG GÓI: Hộp lởn x 8 hộp nhỏ x 1 ống 10 mL
cui ĐLNH:
BUSULFEX (busulfan) Injectíon được chỉ định dùng phối hợp vởỉ cyclophosphamỉd trong phảc
đồ điều kìện hóa trước khi ghép tế bảo gốc tạo mảu đổng loại cho cảc bệnh bạch câu túy bảo mạn
tính.
LIÊU DÙNG VÀ CÁCH DÙNG:
Lưu ý: Thuốc phãi được pha loãng trước khi dùng.
Khỉ BUSULFEX được dùng như là một phần trong phảc đồ điều kiện hóa BuCy (busulfan —
cyclophosphamid) trưởc khi thay thế tế bảo gôc tùy xương hoặc tế bảo gốc máu ngoại vi, liều
dùng khuyến cảo như sau:
Người lớn (Bucy2): Liều thường dùng ở người lớn là 0,8 mg/kg thể trọng lý tưởng hoặc thể
trọng thực tê, bất cứ cải nảo thấp hơn, dùng môi 6 giờ trong 4 ngảy (tống là 16 liều). Đối với
bệnh nhân béo phì, hoặc béo phì trầm trọng, liều BUSULFEX được cho dùng dựa trên thể trọng
lý tưởng đã điều chỉnh.
Thế trọng lý tưởng (IBW) được `tính như sau (chiều cao bằng cm, và cãn nặng bằng kg): IBW
(kg; nam giới) = 50 + 0,91 x (chiêu cao băng cm — 152);
IBW (kg; nữ giới) = 45 + 0,9] x (chỉều cao bằng cm — 152).
Cân nặng lý tưởng đã điều chinh (AIBW) được tính như sau:
AIBW = IBW + 0,25 x (cân nặng thực tế - IBW).
Pugc 1 of l2
Cyclophosphamid được dùng mỗi ngảy trong 2 ngảy, liều dùng 60 mg/kg truyền trong 1 giờ bắt
đầu vảo ngảy ghép tủy xương (BMT)- 3, không sớm hơn 6 giờ sau liều BUSULFEX thứ 16
Sự thanh thải BUSULFEX được dự bảo tốt nhất khi liều dùng BUSULFEX được dựa trên cản
nặng lý tưởng đã điều chính. Liều dùng BUSU LFEX được dựa trên cân nặng thực tế, cân nặng lý
tường hoặc cảc yếu tố khảo có thể tạo ra sự khác biệt quan trọng trong việc thanh thải
BUSULFEX Injectỉon ở những bệnh nhân gầy, bình thường và béo phì.
BUSULFEX được truyền tĩnh mạch qua ca-tê- te tĩnh mạch trung tâm, truyền 2 giờ mỗi 6 giờ
trong 4 ngảy liên tiếp với tồng là 16 liều. Tất cả các bệnh nhân cần được dùng trước vởỉ
phenytoin vỉ busulfan được biết lả có đi qua hảng rảo mảu năo và gây ra cơn động kinh.
Phenytoin giảm 15% AUC cùa busulfan trong huyết tuong. Việc sử dụng cảc thuốc chống co
giật khảc có thể tạo ra AUC của busulfan trong huyết tương cao hơn và tăng nguy cơ tắc tĩnh
mạch ở gan (VOD) hoặc cơn động kỉnh. Trong trường hợp phải dùng các thuốc chống co giật
khảo, cần kiềm soát lượng busulfan có trong huyết tương (xem phần Tượng tác thuốc) Cảc
thuốc chống nôn cần được dùng trưởc lỉều BUSULFEX đầu tiên và được tiếp tục theo kế hoạch
cố định trong suốt quá trình dùng BUSULFEX Khi có thể, nên xem xét vìệc kiềm soát dược
động học để tăng thêm mục tiêu điếu trị.
Trẻ em: Hiệu quả của BUSULFEX trong điều trị bệnh bạch cầu tủy bảo mạn tính (CML) chưa
được nghiên cứu một cảch chuyên biệt ở trẻ em. Xem thêm thông tin ở mục Sử dụng ở các đôi
tượng đặc biệt — Sử dụng ở trẻ em.
Lưu ý khi chuẩn bị và khi truyền thuốc:
KHÔNG SỬ DỤNG xv LANH POLYCARBONAT HOẶC KIM LỌC POLYCARBONAT VỚI
BUSULFEX.
Nên sử dụng bộ dây truyền với khoang dư tối thiều (2 - s mL) khi truyền thuốc nảy.
Như cảc thuốc độc tế bảo khảo, nên thận trọng khi lưu giữ vả an 131 ung dịch BUSULFEX.
Các phản ứng trên da có thế xưẳt hiện khi vô tỉnh tiểp xúc vớrỆazN’ắdsir dụng găng tay. Nếu
BUSULFEX hoặc dung dịch BUSU LFEX pha loãng tỉếp xủc với da hoặc niêm mạc, cân rứa da
hoặc níêm mạc kỳ cảng với nước.
BUSULFEX là dung dịch trong suốt, không mảu Những thuốc dùng ngoải đường tiêu hóa cần
được kíểm tra bắng mắt các tiếu phân và sự đối mềm trước khi tìêm truyền bất cứ lủc nảo nếu có
thể kiểm tra được dung dịch và bao gói Nếu nhìn thấy tiều phân trong ống BUSULFEX thì
khõng được dùng.
Chuẩn bị để truyền Lĩnh mạch:
BUSULFEX phải được pha loãng trước khi tiêrn truyền với _dung dịch Natri clorid 0,9% hoặc
dung dịch Dextrose 5%. Lượng pha loãng nên gâp 10 lân thê tích BUSULFEX, do vậy nồng độ
cuôi cùng của busulfan lả khoáng 0,5 mg/mL.
Tính liều cho bệnh nhân 70 kg như sau:
(70 kg thể trọng) x (0,8 mg/kg) + (6 mg/mL) = 9, 3 mL BUSULFEX (tồng liều lả 56 mg)
Để chuẩn bị dung dịch truyền cuối cùng, thêm 9, 3 mL BUSULFEX vảo 93 mL dung dịch pha
loãng (nước muôi sinh lý hoặc Dextrose 5%) như sau:
(9,3 mL BỤSULFEXJ) x (10) = 93 mL dung dịch pha loãng thêm 9,3 mL BUSULFEX vảo dung
dịch nảy, nông dộ cuôi cùng cúa busulfan lả 0,54 mg/mL (9,3 mL x 6 mg/mL + 102,3 mL = 0,54
mg/mL).
Toản hộ quy trình cần tuân thủ nghiêm ngặt kỹ thuật vô trùng, nên dùng từ hốt cùng với găng tay
và quân ảo bảo vệ.
KHỎNG ĐƯỢC cho BUSULFEX vảo tủi truyền tĩnh mạch hoặc xy lanh thể tích lớn mà không
chứa dung dịch Natri clorid 0,9% hoặc dung dịch Dextrose 5%. Luôn luôn thêm BUSULFEX
Page 2 of12
c"JI—l
li
vảo dung dịch pha loãng, không phải thêm dung dịch pha loãng vảo BUSULFEX. Trộn dếu kỹ
cảng bằng cảch lắc xuôi ngược vải lần. Nên dùng bơm truyền để truyền dung dịch BUSULFEX
đã pha loãng. Đặt tốc độ chảy của bơm để truyền toản bộ liếu lượng BUSULFEX đã kế trong 2
giờ. Trước và sau mỗi lần truyền, dội rừa bên trong ca-tê-te vởi khoảng 5 mL dung dịch Natri
clorid 0, 9% hoặc dung dịch Dextrose 5%. KHÔNG ĐƯỢC truyền đồng thời với dung dịch tiêm
truyền khác mà chưa biết Lính tương hợp của chúng LƯU Ý: VIỆC TRUYỀN NHANH
BUSULFEX CHƯA ĐƯỢC KIẺM TRA VA KHÔNG ĐƯỢC KHUYẾN CẢO.
CHỐNG CHỈ ĐINH:
BUSULFEX được chống chỉ định ở nhũng bệnh nhân có tiến sử mẫn cảm vởi bất cứ thảnh phần
nâo cùa thuôc.
CẢNHBÁOVÀTHÁNTRONG:
CÀNH BÁO:
BUSULFEX lnjection lá thuốc gây độc tế bảo mạnh có thể ức chế tủy bảo hoản toản ở liếu
khuyến cảo. Thuốc nên được dùng dưới sự giảm sát cùa bảc sỹ có kinh nghiệm trong việc
ghép tế bảo gốc tạo mảu đồng loại sử dụng thuốc hóa trị liệu ung thư và quản lý bệnh nhân
giảm toản thế huyết cầu trầm trọng Việc quản lý điều trị và xử trí biến chứng một cảch thỉch
hợp chỉ có thế được thực hiện khi có đầy đủ và săn sảng các phương tiện chần đoản và điều trị.
XEM MỤC C“CÀNH BÁO” VỀ CẢC THÔNG TIN LIỂN QUAN ĐỄN VIỆC GlÀM TOÀN
THỂ HUYẾT CẨU Ở NGƯỜI DO BUSULFAN.
CẨNHBÁO:
Nên sử dụng BUSULFEX dưới sự giảm sảt của bác sĩ có kinh nghiệm trong vìệc ghép tế bảo gốc
tạo mảu. Việc xử trí các biến chừng khi tiêm truyền thuốc chỉ có thể thực hiện được khi có đằy
đủ và sẵn sùng các phương tỉện chấn đoản vả điếu trị.
Các cảnh báo sau gắn liền vởi các tác dụng sinh lý khảo nhau của BUSULFEX trong víệc ghép
đồng loại.
Huyết học: Hậu quả nghỉêm trọng thường xuyên nhất của việc điếu trị với BUSULFEX ở [Lếu
khuyến cảo 1ả ức chế tủy bảo hoản toản, xảy ra ở tắt cả các bệnh nhân. Giảm bạch cầu hạt, giảm
tiều câu, thiếu mảu nghiêm trọng, hoặc giảm kết hợp cảc yếu tố nảy có thế xảy ra. Xét nghiệm
công thức mảu thường xuyên, bao gồm sự khảo nhau của c ĨÉ thức bạch cầu, và lượng tiêu cậu
nên được kiếm soát trong quá trình điếu trị và đến khi đạti Hgg,sựhồí phục. Lượng bạch cầu
trung tính giảm xuống dưới 0, ỔXIOỌÍL ở khoảng 4 ngảy sau k'L Lghép trên 100% bệnh nhân được
điều trị trong thử nghiệm lâm sảng với BUSULFEX Lượng bạch câu được hồi phục vảo khoảng
13 ngảy sau ghép đồng loại khi G- CSF dự phòng được sử dụng ở phần lớn số bệnh nhân. Giảm
lượng tiếu câu (<25 OOO/mm3 hoặc cằn truyền tiêu cầu) xảy ra ở khoảng 5- 6 ngảy trên 98% số
bệnh nhân. l“hìếu máu (hcmoglobin <8, 0 g/dL) xảy ra trên 69% số bệnh nhân. Nên sử dụng điều
trị khảng sinh và cung câp tiều câu và hồng câu khí có chỉ định y khoa.
Thần kinh: Đã có báo cáo về cảc cơn động kinh ở bệnh nhân dùng busulfan đường uống liếu
cao mà liếu nây tạo ra nồng độ thuốc trong huyết tượng tương tự như nồng độ đạt được theo như
liều dùng khuyến cáo của BUSULFEX. Bất chấp đìếu trị dự phòng với phenytoín, một cơn động
kình (1/42 bệnh nhân) đã được báo cảo trong thử nghiệm lâm sảng ghép tự thân có dùng
BUSULFEX. Cơn nảy xảy ra trong khi dùng cyclophosphamid trong phác đồ điều kiện hóa, 36
giờ sau líễu BUSULFEX cuôi cùng Nên bắt đầu trị hệu phòng ngừa chống co giật trưởc khi điều
trị vởi BUSULFEX. Cần lưu ý khi cho dùng BUSULFEX vởi liếu khuyến cảo ở những bệnh
nhân có tiến sử rổi loạn động kinh hoặc có chấn thương ở đầu hoặc bệnh nhân đang dùng cảc
thuốc khác có khả nãng gây động kỉnh.
Gan: Các tải liệu hiện thời cho rằng gỉá trị diện tích dưới đường cong (AUC) của busulfan cao
(>1. 500 ụM'phủt) có thể liên quan vởi tăng nguy cơ phảt triến bệnh tắc tĩnh mạch ở gan
Page 3 of [2
. \'A\l
If er “z
(HVOD). Những bệnh nhân đã dùng liệu phảp phóng xạ trưởc đó nhiếu hơn hoăc tương đương 3
đợt hóa trị lỉệu, hoặc đã có ghép tế bảo gôc trước đó có tăng nguy cơ phảt triến HVOD ở liều
BUSULFEX vả điếu tLL khuyến cáo Dựa trên kiếm tra iâm sảng và các phát hiện xét nghiệm,
bệnh tắc Lĩnh mạch ở gan được chẳn đoản trên 8% (5161) bệnh nhân đã điếu trị với BUSULFEX
trong ghép đồng loại, bị chết 2/5 ca (40%), vả số tử vong toản bộ từ HVOD trong toản bộ nghiên
cứu là 2/61 (3%). Ba trong số năm bệnh nhân được chẩn đoản HVOD khi kiếm tra hồi cứu cho
thắy phù hợp vởi tìếu chí của Jonc Tỉ lệ HVOD được bảo cảo trong tải liệu từ cảc thư nghìệm
ngẫu nhìên thử nghiệm có đối chứng lả 1 7%-12%.
Tim mạch: Biếu hiện chèn ép tim đã được bảo cảo ở những bệnh nhân nhi mắc thalasscmia
(8/400 hoặc 2% trong một đợt) có dùng liếu cao busulfan đuờng uống vả cyclophosphamid trong
phảc đồ điếu kiện hóa cho ghép tế bảo gốc tạo máu Sáu trong sô tảm trẻ đã tử v0ng và hai trẻ
được cửu nhờ chọc mảng ngoải tim nhanh. Đau bụng và nôn thường xuất hiện trưởc khi có chèn
ép ở phần lớn bệnh nhân. KhônƯ có bệnh nhân nảo được điều trị bởi BUSULFEX Injection trong
thử nghiệm 1âm sảng có biếu hiện chèn ép tim.
Phỗi: Hiếm gặp loạn sản phế quản phối với xơ hóa phổi, nhưng lả biến chứng nghiêm tLỌng sau
điếu trị busulfan mãn tính. Khởi phát của cảc triệu chứng thường là 4 năm sau điều trị (trong
khoảng 4 thảng đến 10 nãm).
Khả năng gây ung thư, khả năng gây đột biến, suy gỉảm khả nãng sinh sản:
Busulfan là một Lác nhãn gây dột bỉến và gây thay đổi nhiễm sắc thế. Trong các thí nghiệm in
virra nó gâv đột biến ở Salmonella typlximurium vả Drosophila melanogaster Sự bất thường về
nhiễm săc thể gây ra bởi busulfan đă được báo cảo in vívo (chuột công, chuột nhắt, chuột đồng,
vả người) và in vilro (loải gặm nhấm, tế bảo người) Busưìfan tiếm truyền tĩnh mạch (48 mg/kg
được dùng mỗi hai tuấn cua 12 mg/kg, hoặc 30% của tồng liều BUSULFEX dụa trên cơ sở
mg/m²) có tăng tỉ lệ u nang tuyến ức hoặc u nang buồng trL’m nỗi chuột nhắt. Bốn ca bạch cầu cấp
tính xuất hiện trong sô 19 bệnh nhân đã bị giảm toả…n thế hu lcầư’ĩrong tông số 243 bệnh nhân
của nghiến cứu có kết hợp busulfan như lá một trị liệu bổ trợ tiêp sau phẫu thuật cắt bỏ ung thư
biếu mô phế quản. Sự xuất hiện lâm sảng cùa bệnh bạch cầu được thấy sau 5- 8 năm sau khi uống
bưsulfan. Busulfan được cho là chất gây ung thư trên người.
Tảo dụng kiếm chế buồng trứng và mãn kinh thường xuất hỉện ở phụ nữ tíền mãn kình khi đang
dùng busulfan liều thấp lâu đải để điều Lrị bệnh bạch cầu tủy bảo mãn tính. Busulfan lảm tiêu
dịch noãn bảo của chuột cống cải. Busulfan gây mất khả năng sinh sản ở chuột cống đực và
chuột đỗLLg. Hìện tượng mất khả năng sình sản, không có tính trùng, teo tinh hoản ở bệnh nhân
nam giới cũng đã được báo cảo.
Dung môi DMA cũng có thế gây suy giảm khả năng sinh sản Dùng một liều DMA hảng ngảy là
0,45 g/kg/ngảy cho chuột cống LL’0ng vòng 9 ngảy (tương đương 44% iiếu hảng ngảy của DMA
cỏ trong liếu khuyến cáo cua BUSULFEX trên cơ sở mg/mz) gây giảm đảng kể sự sinh tinh
trùng ở chuột công Dùng một lỉếu đơn dưới đa 2,2 g/kg (27% của tổng liếu DMA có trong
BUSULFEX trên cơ sở mg/mz) trong bốn ngảy sau khi thụ tỉnh đã chẳm dứt hiện tượng mang
thai của 100% số chuột đồng lảm thử nghiệm.
Phụ nữ mang thai Busulfan có thể gây ảnh hưởng xấu tởi phôi thai khi cho dùng ở phụ nữ
mang thai Busulfan sinh ra cảc thay đổi gây quái thai ở con của chuột nhắt, chuột công vả thỏ
khi cho dùng thuốc nảy ở thởi kỳ mang thai. Cảc dị tật và bất thường bao gồm sự thay đối đáng
kể ở hệ cơ xương, cân nặng cơ thế, Vả kích cỡ. Ở chuột cống mang thai, busulfan gây ra sự vô
sinh ở cá con đực và con cải cùa chùng do không có tế bảo gốc ở tinh hoản và buồng trưng.
Dung môi, DMA cũng có thể gây hại cho phôi thai khi được cho đùng ớ phụ nữ mang thai. Ở
chuột cống cho dùng các liếu DMA 400 mg/kg/ngảy (khoảng 40% liếu hảng ngảy cùa DMA có
trong liếu BUSULFEX trên cơ sở mg/mễ) trong thời kỳ phảt triến cảc cơ quan cũng gây ra những
bất thường đáng kể về phảt triến. Nhũng bất thường nôi bật bao gồm phù toản thân, hở vòm
họng, bắt thường về cột sông, bắt thường về xương sườn, và cảc bẩt thường nghiêm trọng về các
mạch ơ tim. Chưa có cảc nghỉên củu phù hợp vả có đối chứng tốt của busulfan hoặc DMA 0 phụ
Page 4 of 12
\\
nữ mang thai. Nếu BUSULFEX được sử dụng ở phụ nữ đang mang thai, hoặc nếu bệnh nhân có
thai khi đang dùng BU SULFEX, nên bảo cho bệnh nhân biểt được mối nguy hiếm tiếm tảng với
phôi thai. Cần thông bảo cho những phụ nữ trong độ tưổi có khả năng sinh đẻ tránh có thai trong
khi dùng thuốc nảy.
THẶN TRỌNG:
Huyết học: Ở liếu dùng khuyến cảo cùa BUSULFEX lnjection, việc ức chế tủy bảo hoản toản lả
phổ biến và có biến híện là giảm bạch cầu trung tính, gỉảm lượng tiếu cầu, thiếu mảư, hoặc kết
hợp các biếu hiện nảy. Cẩn kiếm soát cảc dắu hiệu nhỉễm trùng khu trú hoặc nhiễm trùng toản
thân hoặc chảy mảu ở bệnh nhân. Cần đánh giả thường xuyên tình trạng huyết học cùa bệnh
nhân
Thông tin cho bệnh nhân: Cần giải thích cho bệnh nhân về việc tăng nguy cơ có một khối u ảc
tính thứ hai
Kết quả xét nghiệm: Cần theo dõi hảng ngảy bầng tổng phân tích mảu ở những bệnh nhân dùng
BUSULFEX, bao gôm số lượng tiếu câu và sự khảo nhau về sô lượng, cho đến khi đã ghép xong
Đề phảt hỉện s\ự độc hại cho gan, mả sự độc hại nảy cớ thể báo trước sự khởi phảt bệnh tắc tĩnh
mạch ớ gan, cân đảnh gìả hảng ngảy transaminase huyêt tương, alkalin phosphatase, vả bilirubin
cho đên ngảy BMT +28.
Phụ nữ mang thai: xem mục CẢNH BÁO
Phụ nữ cho con bủ: Chưa biết liệu thuốc nảy có tiết qua sữa người mẹ hay không Vì nhiếu
thuốc được tiểt qua sữa mẹ và vì busưlfan có khả nảng sinh ra khối u trên người và động vật
nghiên cứu. nên cân ra quyết định ngừng cho con bú hay ngừng dùng thuốc, có tính đến tầm L
quan trọng cùa thuốc với người mẹ.
Sử dụng ở các đổi tượng đặc biệt:
Trẻ em: Hiệu quả của BUSULFEX trong điều trị bệnh bạch cằu tủy bảo mãn tính (CML) ở trẻ
em chưa được nghiến cứu một cách chuyên bỉệt.
Một nghiên cửu mở, không có đồi chứng để đảnh giả dược động học cùa BUSULFEX cư 24 bệnh
nhân nhi dùng BUSULFEX trong phảc đồ điếu kiện hóa trước khi ghép tế bảo gốc tạo mảu cho
cảc bệnh huyết học ác tinh (N= 15) hoặc không ảc tính (Nỉ .Bệnh nhân có độ tuổi trong khoảng
5 tháng dến 16 tuổi (trung bình 3 tuổi). Cho líều BUSU L mục đích đạt được diện tích
dưới đường cong (AUC) lả 900- 1350 ụM~phùt với liếu k ởi đầu là 0,8 mg/kg hoặc 1,0 mglkg
(dựa trên ABW) nêu bệnh nhân tương ứng > 4 hoặc 5 4 tuổi. Liều dùng dược điều chỉnh dựa trên
nồng độ huyết tương sau khi hoản thảnh liếu l.
Bệnh nhân dùng cảc liều BUSULFEX mỗi 6 gỉò vả truyền trong 2 giờ trong 4 ngảy cho tống 16
lìều, tiếp theo cho dùng cyclophosphamid 50 mg/kg ngảy một lần dùng trong 4 ngảy. Sau mộtỀ «
ngảy nghi, cho truyền tế bảo gôc tạo máu. Tắt cả bệnh nhân đều được cho dùng phenytoin đế
phòng ngừa cơn động kinh. AUC mục tỉêu (900- 1350 i 5% pM'phút) đạt được ở liếu 1 trong sô,
71% (17/24) bệnh nhân Kiếm tra trạng thải dược động học ôn định được tiến hảnh ơ liền 9 v` `
13 Nồng độ BUSULFEX nằm trong khoáng mục tiêu ở 21 trong số 23 bệnh nhân.
V
Tất cả 24 bệnh nhân đến có giảm bạch cầu trưng tính (lượng bạch cầu trung tính tuyệt đối < 0, 5 x
lOg/L) và giảm lượng tiếu câu (truyền tiếu câu hoặc lượng tiến cầu < 20 OOO/mm3). 79% (19/24)
bệnh nhãn có giảm lympho bảo (lượng 1ympho bảo < 0,1 x 10°). Ở 23 bệnh nhân, lượng bạch câu
trung tính tuyệt đối (ANC) phục hồi > 0 ,5 x lOỌÍL (thời gian trung bình để phục hồi — ngảy BMT
+ 13, khoảng thời gian hồi phục — ngảy BMT +9 tới +22). Một bệnh nhân tử vong trong ngảy
+20 đã khỏng phục hồi tới lượng bạch câu trung tính tuyệt đối (ANC) > 0 ,5 x 109/L Bốn (17%)
bệnh nhân đã tử vong trong khi nghiên cứu. Hai bệnh nhân đã tử vong trong vòng 28 ngảy sau
khi ghép, một bệnh nhân do viêm phổi vả hội chửng rò mao mạch, và bệnh nhân kia do viếm
phôi và bệnh tắc tĩnh mạch. Hai bệnh nhân tử vong trước ngảy thứ 100; một do bệnh tiến triến và
một do sưy giảm đa cơ quan.
Page 5 of 12
Phản ứng có hại được báo cảo ở tất cả 24 bệnh nhân trong giai đoạn nghiến cứu (ngảy BMT -10
đến ngảy BMT +28) hoặc giai đoạn theo dõi sau nghiên cứu (ngảy +29 đến +100). Những phản
ứng nảy bao gồm nôn (100%), buồn nôn (83%), viêm miệng (79%), bệnh tăc tĩnh mạch ở gan
(HVOD) (21%), bệnh thải ghép (GVHD) (25%), và vìêm phổi (21%).
Dựa vảo kết quả nghiến cửu trên 24 bệnh nhân, liếu gợi ý trên bệnh nhân nhi được nêu trong
bảng sau:
Bảng liều BUSULFEX
Cân nặng thực tế cùa bệnh nhân (ABW) Liều BUSULFEX
S 12 kg 1,1(mg/kg)
> 12 kg 0,8 (mgfkg)
Thực nghiệm dựa trên mô hinh dược động học lứa tuôi nhi khoa đã chỉ ra răng 60% bệnh nhân
nhi sẽ đạt được AUC của BUSULFEX giữa 900 đến 1350 LLMơphút với lỉếu đằu tiên cùa
BUSULFEX theo như bảng liều trên. Việc kiếm soát thuốc điếu trị và điếu chinh liếu sau liếu
BUSULFEX đầu tìên được khuyến cảo
. -› 0 n . R : Ả . A .
Đ1ều chmh hều dựa tren ktem soat thuoc đLeu trL:
Hướng dẫn đo AUC của liếu busưlfan số 1 (xem Lấy mẫu mảu đế xảc định AUC), vả công thức
để đíếu chinh cho cảc liếư tiếp sau để đạt được mục tiếu AUC mong muốn (1 125 ụM—phút), như
sau:
Liều điều chỉnh (mg) = Liều thực tế (mg) x AUC mục tiêu (ụM~phút)/AUC thục tế (ụM-phút)
Ví dụ, nếu bệnh nhân dùng một liều 11 mg bưsulfan vả nếu đảp ứng AUC đo được lả 800
ụM'phút, cho AUC mục tiêu là 1 125 Ị.LM'phÚÌ, liêu mục tiêu (theo mg) sẽ lả:
Mg liếu== 11 mg x 1125 ụMơphút /800 LLM—phủt= 15,5 mg
Việc điều chinh liếu BUSULFEX có thể dùng công thức và hưởng dẫn sau:
Lấy mẫu máu để xác định AUC :
Việc tính toán AUC (ụM~phút) dựa trên việc lấy mẫu mảu tại cảc thời điếm sau:
Cho liếu l: 2 giờ (kết thúc truyền), 4 giờ vả 6 Igiờ (ngay lập tức trước khi cho dùng tiếp
BUSULFEX theo kế hoạch). Cần ghi lai thời tzian 1ấvanẫuthưc tế
Cho các liếư không phải liếu 1: trước khi truyền (mILỆ cợaớ), 2 giờ (kết thúc truyền), 4 gỉờ và 6
giờ (ngay lập tửc trước khi cho dùng tiếp BUSULFEX theo kế hoạch).
Viêc tinh toán AUC dưa trên ít hơn 3 mẫu cu thế nên trên có thế cho kết guả AUC khôna chính
Ệ.
Với mỗi mẫu mảu, lấy 1 đến J mL máu vảo ống Vacưtaincr® tráng heparin (natri hepa1in hoặc
lithi hepmin) Mẫu máu nên được để ngay trong khay đả ướt sau khi lấy vả nên được ly tâm (ở
40C) trong vòng 1 giờ. Huyết tương, thu được trong ông bảo quản lạnh thích hợp, được lảm đông
lạnh ngay lập tức ở -200C. Tất cả các mẫu hưyết tương được gừi trong trạng thái đông lạnh (ví dụ
như đã khô) tởi phòng thí nghiệm để xác định nông độ busulfan huyết tương
Tính toán AUC:
Việc tính toán AUC của BUSULFEX có thể dùng hưởng dẫn sau và cõng thức dược động học
tiêu chuẩn thích hợp:
Tính toán AUC liếu 1:ẢAUCVỒ … = AUCo_G giở + AUCngoại suy, trong đó AUCo.Ổ gLỜ được ước tính
dựa trên công thức tuyên hình thang vả AUCngoại suy có thể tính được bằng cảch lấy tỉ số nồng độ
busulfan lủc 6 giờ vả hằng số tỉ lệ kết thủc thải trừ lỵ. Ầz phải được tinh toán dựa từ pha kết thúc
thải trừ cùa nồng độ busulfan so với đường cong thời gian. Cần giả định một nổng độ “0” trước
khi dùng bưsulfan, và dùng nó để tính toán AUC.
Page 6 of12
uc
IA'
Nếu đảnh giả Ath tiếp sau liếư 1, trạng thái-ổn định cùa AUCss (ẠUCLLỐ ,…) được ước lượng từ
vùng giữa cảc nông độ lúc 2 gỉờ, 4 giờ và 6 giờ dùng công thức tuyên hình thang.
Hưởng dẫn dùng thuốc vả Iẩy mẫu máu để theo dõi thuốc điều trị:
Nên dùng bộ dây truyền có thể tích khoang dư tối thiểu (1 — 3 mL) để truyền thuốc để chắc chẳn
rằng đã truyền chính xác toản bộ liếư thuốc đã kế đơn và để chắc chắn lấy mâu mảu chính xảo để
kiếm soát thuốc đìếu trị và điếu chỉnh liều.
Bắt dẩu truyền dung dịch thuốc và ghi lại chính xác thời gian bắt đầu truyền BUSỤLFEX. Lấy
mẫu mảu từ một tĩnh mạch ngoại biên để tránh lảm tạp nhỉễm vởí thuốc đang truyền. Nếu mâu
mảu được lắy trực tỉếp từ ca- -tê- te tĩnh mạch trun ' tâm (C VC ) đang truyền, KHÔNG ĐƯOC
LẨY MẨU MÁU TRONG KHI ĐANG TRUY N THUỐC để chắc chắn rằng mẫu mảu khi
kết thủc truyền không bị tạp nhỉễm với bất kỳ lượng thưốc dư nảo. Sau khi truyền xong (2 giờ),
rút ống truyền và dội rưa dãy CVC với 5 mL dung dịch nước mưối sinh lý trưởc khi lấy mâu máu
khi kết thủc trưyến tù cống CVC Lắy cảc mẫu máu từ một cống khác vởi cổng CVC để truyền
BUSULFEX Khỉ ghi lại thời gìan ngừng truyền BUSULFEX, không tính thời gian cần để dội
rừa bên trong ca- -tế- te. Loại bỏ ong truyền sau khi kết thúc 2- g-iờ tiếm truyền
Xem phần Chuẩn bị đế tiêm truyền tĩnh mạch để biết chi tíết hưởng dẫn cách chuẩn bị thuốc.
Người giâ: Nãm trong số sậu bệnh nhân được điếu trị trong thử nghiệm BUSULFEX lả hơn 55
tuôỉ (trong khoảng 57—64 tuôi), Tât cả đẽu đạt được sự loại bỏ tùy bảo và ghép vảo được.
6… tính, chủng tộc: Chưa có nghiên cứu phù hợp về việc điều chĩnh lỉếu BUSULFEX dựa trên
giới tính và chủng tộc.
Suy giảm chức năng thận: BUSULFEX chưa được nghìên cứu trên bệnh nhân có suy giảm
chức năng thận.
Suy gỉảm chức năng gan: BUSULFEX chưa được cho dùng ở bệnh nhân có suy gỉảm chức
nãng gan.
Ẩnh hưởng của thuốc lên khả năng lái xe và vận hảnh máy móc: không áp dụng.
Khác: Busuifan có thể gây chứng loạn sản tế bảo ở rất nhỉếu cơ quan C ac bất thường về tế bảo
học như có tế bảo khổng lồ, nhân có nhiếu thế nhiễm sắc đã được bảo cáo trong cảc hạch bạch
huyết tụy, tuyến giáp, tuyến thượng thận, gan, phổi và ttiỷixươn Chứng loạn sản tế bảo nảy có
thể đủ nghiếm trọng để gây ra khó khăn trong việc đọc kếẩnẩ'iỗỉm tra tế bảo bong ở phổi, bảng
quang, vú và tử cung.
TƯỚNG TẤC THUỐC:
Intraconazol giảm múc thanh thải busulfan lên tói 25%, vả có thế tạo ra một AUC > 1500
ụM°phút ở một số bệnh nhân Tất cả cảc thuốc fiuconazol, Vả odansetron 5 HT3 chống nôn
(Zofran®) vả granisetron (Kytril®) đến đã được dùng vởi BUSULFEX
Phenytoin tăng mức thanh thải busulfan lên 15% hoặc hơn, có thế do có cảm ửng với glutathion-
S-transferase. Do được động học của BUSULFEX dược nghiên cứu ở bệnh nhân có điếu trị vởi
phenytoin, mức thanh thải cùa BUSULFEX ở liều khuyến cáo có thể thắp hơn và có mức AUC
cao hơn ở bệnh nhân không điều trị vởì phenytoin. Do busulfan được thải trừ từ cơ thể thông qua
việc kết hợp với glutathìon, víệc dùng acetamỉnophen trưởc (< 72 giờ) hoặc đổng thời với
BUSULFEX có thế gây ra gỉảm thanh thải busulfan dựa trến đặc tính đã biết là acetaminophen
lảm gỉảm nồng độ glutathion trong máu và các mô
TÁC DUNG KHÔNG MONG MUÔN:
Dimethylacetamid (DMA), lả dung môi có trong công thức BUSULFEX, được nghíên cứu vảo
năm 1962 có khả năng là một thuốc hóa trị liệu ung thư. Trong một nghiến cứu pha 1, liếư tối đa
dung nạp được (MTD) là 14 ,8 g/mz/ngảy trong 4 ngảy. Liều khuyến cảo hảng ngảy cùa
BUSULFEX chứa DMA tương đương vởi 42% của MTD trên cơ sở mg/mẵ Tính độc giởi hạn
liếư ở nghiên cứu pha ] lả tính gây độc gan với bằng chứng là gây tăng múc transaminase gan
Page 1 of 12
(SGOT) và triệu chứng thần kinh vởi bằng chứng lả gây ảo giác. Ảo giảc thường khởi phảt một
ngảy sau khi kết thúc dùng DMA vả có liên quan với thay đổi EEG. Liều thấp nhất mã có thể
nhận ra ảo gỉác lả tương đương với 1, 9 lẳn liếư dùng trong trị liệu chưẳn bị dùng BUSULFEX
0,8 mg/kg môi 6 giờ x 16 liếư Cảo tính độc thần kinh khác bao gỗm buốn ngù, lơ mơ và lẫn lộn.
Khó biết dược chính xác sụ liên quan của DMA vảlhoặc các thuốc dùng kèm tới việc gây độc
gan và độc thần kỉnh quan sát được
Điếu trị với BUSULFEX ở liếư khưyển cáo và theo kế hoạch sẽ dẫn dến việc ức chế tủy bảo
hoản toản ở 100% số bệnh nhân, bao gồm giảm bạch cẩu hạt giảm lượng tìếu cầu, thiếu máu,
hoặc kết hợp mắt cảc yếu tố tạo mảu. Thông tin cảc phản ứng có hại được lấy chủ yếu từ thử
nghiệm lâm sảng (N= 61) của BUSULFEX vả cảc dữ liệu thu được khi cho uông busulfan liều
cao trong cảc thử nghiệm ngẫu nhiến, có đối chứng được biết qua vỉệc xem xét cảc tải liệu
Cảc thủ nghỉệm lâm sảng BUSULFEX: Trong thử nghiệm lâm sảng dùng BUSULFEX
Injection trong ghép tế bảo gôc đồng loại, tẳt cả cảc bệnh nhân được điếu trị với BUSULFEX 0,8
mg/kg truyền trong 2 giờ, dùng môi 6 giờ với 16 lỉếu trong 4 ngảygỀtu hợp với cyclophosphamid
60 mglkg x 2 ngảy. 93% sô bệnh nhân có thế đánh gìả được dùn BUSULFEX nảy đã duy
trì mức AUC thấp hơn 1500 LLM-phủt với liếư 9, mức nảy thường đỄợ/c xem là mức để giảm đến
mức tối thiều nguy cơ cùa HVOD.
Bảng 1. Tóm tắt tẩu suất (220%) các phân ứng có hại không-lỉên quan đến huyết học đến
tận ngảy BMT +28 ở bệnh nhân đã dùng `BUSULFEX trước khi ghép tế bảo gôc tạo mảu
đông loại
Phản ứng có hại không liên quan đển huyết học* % Tần suất
TOÀN THÀN
Sốt 80
Đau đẳu 69
Suy nhược 51
Rùng mình 46
Đau 44
Phù chung 28
Phản ứng dị ứng 26
Đau ngực 26
Viêm chỗ tiêm truyền 25
Đau lưng 23
HỆ TIM MACH
Tỉm đập nhanh 44
Tăng hLLyểt' ap 36
Huyết khối 33
Giãn mạch 25
HỆ TIÊU HÒA
Buồn nôn 98
Viêm mỉệng (Viêm nỉêm mạc) 97
Nôn 95
Chản ăn 85
Tiêu chảy 84
Đau bụng 72
Khó tiêu 44
Tảo bón 38
Khô miệng 26
Rối loạn trực trảng 25
Trướng bụng 23
HỆ THỐNG CHUYÊN HÒA VÀ DINH DƯỐNG
Giảm magiê mảu 77
Tăng glucose mảu 66
Giảm ka1i mảu 64
Giảm canxi máu 49
Page 8 of 12
Tăng bilirubin mảu 49
Phù 36
Tăng SGPT 31
Tăng creatinin 21
HỆ THÁN KINH
Mất ngủ 84
Lo âu 72
Chóng mặt 30
Suy nhược 23
HỆ HỒ HẢP
Viêm mũi 44
Rối loạn phồi 34
Ho 28
Chảy mảu cam 25
Khó thở 25
DA VÀ PHẨN PHỤ
Phát ban 57
Ngứa 28
*Bao gổm tất cả các phản ứng có hại dược bảo cáo không tính đến mức độ nghiêm trọng (mức
độ độc 1-4).
Phẩn tiếp theo mô tả các phản ứng có ý nghĩa lâm sảng xảy ra trong các thử nghiệm lâm sảng
BUSULFEX, không tính đến việc có liến quan tởi thuôc hay không. Xem mục Sử dụng ở các
đối tượng đặc biệt- Trẻ em để có thông tin trên trẻ em.
Huyết học: Ở liếư chỉ định và dùng theo liệu trinh, BUSULFEX gây ức chế tùy bảo hoản toản ở
100% số bệnh nhân. Sau khi truyền tế bảo gốc tạo máu, lượng Ệr cau trung tính hổi phục tới
>500 tế bảớ/mm3 được xuất hiện trưng bình vảo ngảy 13 khi dù ỤỄÌJ/—CSẸphòng ngùa cho phần
lớn số bệnh nhân tham gia trong nghiên cứu. Số lần truyền tiếuẻâu/ trung bình cho một bệnh
nhân trong nghíến cứu lả 6, vá sô 1ần truyền mảu trung bình trong thử nghiệm lả 4. Kéo dải thời
gìan prothrombin đă được báo cảo xảy ra trên một bệnh nhân (2%).
Tiêu hóa: Độc tỉnh đường tiêu hóa xảy ra thưòng xuyên và thuờng được xem là có liên quan tới
thuốc. Một số được phân loại lá nghiếm trọng. Buồn nôn nhẹ hoặc trung bình xuất hỉện ở 92% số
bệnh nhân trong thử nghiệm iâm sảng dị sinh, và nôn nhẹ hoặc trung bình xuất hiện ở 95% đến
tận ngảy BMT +28, buồn nôn nghiếm trọng lả 7%. Tần suất nôn khi dùng BUSULFEX (ngảy
BMT -7 đến -4) là 43 % trong thư nghỉệm lâm sảng đồng loại. Viêm miệng mức 3-4 xuất hiện ở
26% số người tham gia, và vìếm thục quản mức 3 xưất hiện ở 2%. Tiêu chảy mức 3—4 được bảo
cáo ở 5% sô người tham gia nghìên cứu đồng loại, trong khi tiêu chảy xưất hỉện ở 75%. Táo bón
nhẹ hoặc trung bình xảy ra Ở 38% số bệnh nhân; tắc ruột xảy ra ở 8% số bệnh nhân và nghiếm
trọng ở 2% sô bệnh nhân. 44% số bệnh nhân được bảo cảo có chứng khó tíếu nhẹ hoặc trung
bình. 2% số bệnh nhân bị nôn ra máu nhẹ. Viêm tụy xảy ra ở 2% số bệnh nhân. Rối loạn trực
trảng nhẹ hoặc trung bình xảy ra ở 24% số bệnh nhân. Chán ản nặng xảy ra ở 21% số bệnh nhân
vả mức nhẹ!trung bình là 64%.
Gan: Tăng bilirubin mảu xảy ra ở 49% số bệnh nhân trong thử nghiệm BMT đồng loại. Tăng
bìlirubin mảu mức độ 3/4 xảy ra ở 30% số bệnh nhân trong vòng 28 ngảy ghép và được xem là
đe dọa tính mạng ở 5% số bệnh nhân nảy. Tăng bỉlỉrưbỉn mảu có kết hợp với bệnh thải ghẻp ở 6
bệnh nhân và có kểt hợp với bệnh tắc tĩnh mạch ở gan ở 5 bệnh nhân. Tăng SGPT mức 314 xảy
ra ở 7% số bệnh nhân. Tăng phosphatase kiếm nhẹ hoặc trung bình xáy ra ở 15% số bệnh nhân.
Vảng da nhẹ hoặc trung bình xảy ra ở 12% số bệnh nhân, gan to mức độ nhẹ hoặc trung bình xảy
ra ở 6% sô bệnh nhân.
Bệnh tắc tĩnh mạch ở gan: Bệnh tắc tĩnh mạch ở gan (HVOD) là một biến chứng tiếm tảng cùa
phảc đồ điếu kiện hóa trưởc khi ghép. Dựa trên thăm khảm lâm sảng và kết quả xét nghìệm, bệnh
tắc tĩnh mạch ở gan được chẩn đoán ở 8% (5/61) số bệnh nhân được đíều trị với BUSULFEX khi
ghép dồng loại, bị tử vong 2/5 ca (40%), vả dẫn đến tỉ lệ tử vong chung từ HVOD trong toản bộ
Page 9 of 12
nghiên cửu là 2161 (3%). Ba trong số nãm bệnh nhân được chẳn đoán HVOD được hồi cứu thấy
là phù hợp với tiêu chí của J one.
Bệnh mảnh ghép chống chủ (G VHD): Bệnh mảnh ghép chống chủ xuất hiện ở 18% số bệnh
nhân (11/61) có ghép đông loại; nghiêm trọng lả 3%, vả nhẹ hoặc trung bình lả 15%. Có 3 (5%)
ca tử vong do GVHD.
Phù: Bệnh nhân ghép đồng 10ại có biếLL hỉện một số dạng phủ (79%), tăng 1… lượng mảu, hoặc
ghi nhận có tăng cân (8%); tât cả các biêu hiện được báo cáo 1ả nhẹ hoặc trung binh.
Nhiễm trùng/sốt: 51% số bệnh nhân có xuất hìện một giai đoạn nhiễm trùng hoặc nhiều hơn.
Viêm phổi gây tư vong ở một bệnh nhân (2%) vả đe dọa tính mạng ở 3% sô bệnh nhân 80% số
bệnh nhân được bảo cáo bị sốt, nhẹ hoặc trung bình là 78% và nặng lả 3%.4 46% bệnh nhân xuất
hiện rét run.
Tỉm mạch: Chứng tim đập nhanh được báo cảo ở 44% số bệnh nhân Trong 7 bệnh nhân (11%)
thì chửng tim đập nhanh được bảo cảo lần đầu tỉến trong khi dùng BUSULFEX. Cảc bẳt thường
về nhịp là nhẹ hoặc trưng bình, bao gồm loạn nhịp tim (5%), rung tâm nhL (2%), ngoại tâm thu
trên thắt (2%) và phong bế tim dộ 3 (2° o) Huyết khối nhẹ hoặc trung bình xảy ra ở 33% số bệnh
nhân, vả tất cả cảc mửc có liên quan đến ca-tế- te tĩnh mạch trung tâm. Tăng huyết áp được bảo
cáo ở 36% số bệnh nhân và ở mức 3/4 16) 7% Hạ huyết ảp xảy ra ở 11% sô bệnh nhân vả ở mức
3/4 là 3%. Giăn mạch nhẹ (đỏ bừng, cơn bốc hỏa) được bảo cáo ở 25% số bệnh nhân. Cảo biếu
hỉện về tim mạch khác bao gồm chứng tim to (5%), ECG bất thường mức độ nhẹ (2%), suy tim
trải độ 3/4 Ở một bệnh nhân (2%), và trản dịch mảng tim trung bình (2%). Những phản ứng nảy
được bảo cáo chủ yếu ở giai đoạn sau cyclophosphamid.
PhỗL': Khó thở nhẹ hoặc trung bình xảy ra ở 25% số bệnh nhân và nghiêm trọng ở 2% số bệnh
nhân. Một bệnh nhân (2%) bị tình trạng thở sâu và nhanh nặng; vả thêm 2 (3%) bệnh nhân bị nhẹ
hoặc trung bình.Viếm mũi nhẹ và ho nhẹ hoặc trung bình được báo cáo tương ứng ở 44% vả
28% số bệnh nhân Hiện tượng chảy mảu cam nhẹ được báo cảo " 25% số bệnh nhân. Bạ bệnh
nhân (5%) trong nghiên cứu ghép đồng loại có ghi nhận bị chảy 'u ch“ răng. Tât cả đên cần
mảy thở hỗ trợ vả tât cả đếu tử vong. Có thắy xơ hóa mô kẽ kh ạc hiệu khi tỉến hảnh sinh
thiết nêm khi nội soi ngực có VLdeo hỗ Lrợ trên một bệnh nhân trong nghỉên cứu ghép tự thân mà
sau đó bệnh nhân nảy đã từ vong do suy hô hẳp vảo ngảy BMT+98. Một số biếu hiện về phối
khảc, được bảo các lá nhẹ hoặc trung bình, bao gom viêm họng (18%), nắc (18%), hcn suyễn
(8%), xẹp phối (2%), trản dịch mảng phổi (3%), gìảm oxy máu (2%), ho ra mảu (3%), và viêm
xoang (3%).
Thẩn kinh: Những phản ứng có hại thông thường nhất được bảo cảo của hệ thần kinh trung
ương là mất ngủ (84%),10 lắng (75° /,o) chóng mặt (30%), và trầm cảm (23%). Mức độ nghiêm
trọng là nhẹ hoặc trung bình trù với một bệnh nhân (1%) gây chảy máu não de dọa tính mạng và
hôn mê lả biếu hiện cuối cùng tiếp sau suy gìám đa cơ quan sau HOVD Cảo phản ứng khảc
được xem lả nghiếm trọng bao gôm mẽ sẻLng (2%),10 âu (2%), và bệnh não (2%). Tần suất
chung của phản ứng lẫn lộn lả 11% và 5% sô bệnh nhân được báo cáo có biến hiện ao gìảc. Thời
gỉan bắt đầu xuất hiện phản ứng lẫn lộn ơ bệnh nhân có cơn mê sảng vả ảo giảc trong nghiến cứu
ghép đồng loại là khi đã điếu trị hết BUSULFEX lnjectỉ0n. Tần suất chung cua tình trạng hôn
mẽ ở các thử nghiệm lâm sảng ghép đồng loại có dùng BUSULFEX là 7% và của tình trạng lơ
mơ là 2% Một bệnh nhân (2%) được điếu trị trong một nghiên cứu ghép tự thân có phản ứng của
cơn động kỉnh khi đang dùng cyclophosphamỉd, bất chấp điều trị dự phòng với phenytoin.
Thận: Tăng creatinin nhẹ hoặc trung bỉnh ở 21% số bệnh nhân. BUN tăng ơ 3% số bệnh nhân vả
lẽn mức độ % ở 2% số bệnh nhân. 7% số bệnh nhân có biếu hiện khó tiểu tiện, 15% giám niệu,
vả 8% tiếu tiện ra mảu. Có 4 (7%) trường hợp viếm bảng quang xuất huyết mức độ % ở thử
nghiệm lâm sảng ghép đồng loại.
Da: phảt ban (57%) vả ngứa (28%) được bảo cáo, chủ yếu là nhẹ. Rụng tóc nhẹ ở 15% số bệnh
nhân và trung bình là 2%. Mụn nước nhẹ được báo cảo ở 10% số bệnh nhân, ban sần nhẹ hoặc
trung bình là 8%. Ban bọng nang được bảo cáo ở 10% số bệnh nhân, và viêm da tróc vảy ở 5%
Page 10 of 12
sô bệnh nhân. Ban đỏ nôi cục ở 2% sô bệnh nhân, mụn ở 7% sô bệnh nhân, và đôi mảu da ở 8%
sô bệnh nhân.
Chuyển hóa: Tăng đường mảu quan sảt thẳy ở 67% số bệnh nhân và tăng đường mảu mức độ %
được báo cáo ở 15% số bệnh nhân. Giảm magiế máu nhẹ hoặc trung bình ở 77% số bệnh nhân,
giảm kali máu nhẹ hoặc trung bỉnh ở 62% số bệnh nhân vả nghiêm trọng ở 2% số bệnh nhân,
giảm canxi mảu nhẹ hoặc trung bình ở 46% số bệnh nhân và nghỉêm trọng ở 3% số bệnh nhân,
giảm phốt phát máu nhẹ hoặc trung bỉnh ở 17% số bệnh nhân, và giảm natri mảu được bảo cáo ở
2% số bệnh nhân.
Khác: Cảo phản ứng có hại khảo được bảo cảo bao gồm đau đầu (nhẹ hoặc trung bình 64%,
nghiêm trọng 5%), đau bụng (nhẹ hoặc trung bình 69%, nghiếm trọng 3%), suy nhược (nhẹ hoặc
trung bình 49%, nghiêm tLỌng 2%), đau không rõ rảng (nhẹ hoặc trung bình 43%, nghỉêm trọng
2%), phản úng dị ứng (nhẹ hoặc trung bình 24%, nghiêm trọng 2%), viêm chỗ tiêm (nhẹ hoặc
trung bình 25%), đau chỗ tiêm (nhẹ hoặc trung bình 15%), đau ngực (nhẹ hoặc trung binh 26%),
đau lưng (nhẹ hoặc trung bình 23%), đau cơ (nhẹ hoặc trung bình 16%), đau khớp (nhẹ hoặc
trung bình 13%), và rối loạn tai 3%.
Tử vong: Có hai ca tử vong dến hết ngảy BMT+28 trong khi ghép đồng loại. Có thêm 6 ca tử
vong từ ngảy BMT+29 đên ngảy BMT+IOO trong khi ghép đông loại.
Kinh nghiệm sau khi lưu hỉth: Các phản ứng có hại sau (được bảo cáo theo thuật ngữ
MedDRA) đuợc ghi nhận khi sư dụng BUSULFEX sau khi đ ơc 1ưu hảnh: sốt giảm bạch câu
trung tinh; hội chửng phân giải khối u; huyết khối mao mạch (TZfA); nhiễm khuẩn trằm trọng do
vi khuẩn vi rút (ví dụ nhiễm virút mảu cự bảo) vả nắm; nhiễm , niên sản mcn rãng. Do cảc
phản ứng nảy được bảo cảo tự nguyện từ luợng bệnh nhân không biết được chính xác nến
thường không thể xác định được nguyên nhân gây ra do thuốc hay không .
Thông báo cho Bác sỹ các tác dụng khóng mong muốn gặp phải khi sử dụng ỉhuốc.
DƯƠC ĐÔNG HOC :
Dược động học của BUSULFEX được nghiến cứu trên 59 bệnh nhân tham gia vảo một thử
nghiệm dùng phác đồ điều kiện hóa BUSULFEX-Cyclophosphamid trưởc khi ghẻp đồng loại tế
bảo gôc tạo mảu. Bệnh nhân được cho dùng 0,8 mg/kg BUSULFEX mỗi 6 gỉờ, cho tông 16 liếư
trong 4 ngảy. 55 trong số 59 bệnh nhân (93%) đã dùng BUSULFEX duy trì được mửc AUC dưới
mức mục tiêu (<1500 ụM—phút).
Bảng 2. Các thông số Dược động học ở trạng thái ổn định sau khi truyền BUSULFEX
(busulfan) (0,8 mg/kg; N=59)
Giá trị trung bình cv (%) Khoảng
c… (ng/mL) 1222 18 496—1684
AUC (LLM—phút) 1167 20 556—168
CL (mL/phútfkg)* 2,52 25 1,494,31
*Độ thanh thải đã được bình thường hóa theo cân nặng thực tế cùa tẩt cả các bệnh nhân.
Dược động học cùa BUSULFEX chi ra sự tương tư giữa liếư 9 vả tiếu 13 được chứng minh bằng
khả năng tái tạo ra cmax trạng thái Ổn định và hệ số thay đối thấp cùa cảc thông số nảy. Trong
một nghiên cứu dược động học của BUSULFEX ở 24 bệnh nhân trẻ cm, đã xảo định được dược
động học cho lứa tuổi nảy (PPK) để dự đoản về độ thanh thải (CL) cùa BUSULFEX và thể tỉch
phân bố (V). Với cân nặng thực tế, PPK dự đoán CL và V là 4,04 L/gìờ/ZO kg (3,37 mL/phútlkg;
mức biến thỉến giữa cảc bệnh nhân là 23%); vả 12,8 L/20 kg (0,64 L/kg; mức biến thiên giữa các
bệnh nhân là 11%).
Phân bổ, Chuyến hóa, Thăi trừ:
Page 11 of12
\".
Nghiện cứu về phân bố, chuyến hóa và thải trừ của BUSULFEX chưa được thục hiện; tuy nhiên,
có thể tham khảo cảc tải liệu về busulfan đường uống. Hơn nữa, về tác dụng thay đổi các thông
số dược lý xem phần Tương tảc thuốc.
Phân bố: busulfan đạt được nồng độ trong dịch não tưy là gần như tương đương với nồng độ
trong hưyết tương. Phấn gắn kểt với các yêu tố hưyết tương, chủ yếu với albumin, được dự đoản
là 32,4 i 2, 2% cũng phù hợp với đặc tính ải đỉện từ phản ứng của busulfan.
Chuyển hóa: busulfan chủ yếu chuyến hóa bẳng cách kết hợp với giutathionz cả tự phảt vả vởi sự
xúc tác của glutathion S-transferase (GST). Kết hợp nảy tiếp tục được chuyên hóa bảng cảch oxi
hóa ở gan.
Thải trừ: Sau khi cho dùng busulfan có đảnh dẳu 14C ở người, khoảng 30% chẳt đảnh dẳu được
thặi trừ qua nước tiêu trong 48 gỉờ; một lượng khu ; đáng kê được thếy ở phân. Việc không tìm
thây toản bộ chât đánh dâu có thế do sự hi ' . _ _ _ L huyến hóa tôn tại lâưhoặc do sự alkyl
hóa không đặc hiệu của cảc đại phân tử. ' " `
DƯỢC LƯ C HOC:
Cơ chế tảc dụng:
Busulfan lả tảc nhân alkyl hóa hai nhóm ,
được gắn cảc đầu đối nhau trong một chuồn . . . bon. Trong môi trường nước, bụsulfan
thủy phân để gìải phóng các nhóm methanesulfonat. Quá trình nảy sản sỉnh ra ion carboriXphản
ứng mà chất nảy có thế aikyl hóa DNA. DNA bị hư hại được cho là ngưyên nhân chinh ' ra
tính độc tế bảo cùa busulfan. TUQ CỤC TRUỜNG ả
. , P TRUỜNG PHONG z
OUÁ LIÊU VÀ XỬ TRÍ OUA LIEU: Ảp J(u
au yễn ,`ĩể
Chưa bỉết được thuốc giải độc BUSULFEX khảo hơn lả fflLép tế bảo gấcij tạo ânẵ. KHÍ không
ghép tế bảo gốc tạo máu được, lỉếu khuyến cảo cho BUSULFEX có thể gây ra sự quá liếư
busulfan. Tảo dụng gây độc chĩnh là sự giảm sảnfgiảm tải tạo tùy xương hoản toản và giảm toản
thế hưyết cầu, nhưng hệ thần kinh trung ướng, gan, phổi và đường tiêu hóa cũng có thể bị ảnh
hưởng Cần kiếm soát tình trạng mảu chặt chẽ và có cảc biện hảp hỗ trợ tích cực theo chỉ định y
khoa. Đã có bảo cảo về sự sông sót sau khi dùng liếư đơn 1 Mỵleran® (\bưsulfan) Tablets 0
một trẻ 4 tuối nặng 18kg. Một trẻ 2 tuối vô tình uống busuifẫn nhiếu hơn liếư bình thường (2,1
mg/kg; tống liếư 23, 3 mg/kg) trước khi ghép tùy xương theo kế hoạch mà không có di chửng.
Liều câp tính 2, 4 g gây chết một bé trai 10 tuổi. Có một bảo cảo cho thẳy busulfan có thế bị thẩm
tách, do vậy sự thẳm tảch nên được xem xẻt trong trường hợp quá liếư. Busuifan được chuyến
hóa bằng cách kết hợp với glutathìon, do vặy nên xem xét khi cho dùng cùng glutathion.
ĐIỀU KIÊN BẢO OUẢN: Bảo quản từ 2% đến 8°C.
HAN DÙNG: Óng thuốc BUSULFEX chưa mở có hạn dùng 30 tháng kể từ ngảy sân xuất khi
bảo quản lạnh ở nhiệt độ 2°C đên 8°C.
BUSULFEX đã được pha loãng với dung dịch Natri clorỉd 0,9% hoặc dung dịch Dextrose 5%
ổn định ở nhiệt độ phòng (25°C) trong 8 giờ nhưng cần truyền xong thuốc trong thời gỉan nảy.
BUSULFEX đă được pha loãng với dung dịch Natri clorỉd 0,9% ôn dịnh trong điếu kiện lạnh
2OC đến 80 trong 12 giờ nhưng cân truyền xong thuốc trong thời gian nảy.
Sản xuất bỏi: Patheon Manufacturing Scrviccs LLC. (5900 Manin Luther King Jr. Hìghway,
Greenvilie, North Carolina 27834 - Hoa Kỳ)
Chủ sở hữu giẫy phép lưu hânh: Otsuka Pharmaceutỉcal Co., Ltd. (2-9 Kanda Tsukasamachi,
Chỉyoda-Ku, Tokyo, Nhật Bán).
Page 12 ofl2.
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng