









6…ooz BUzqapm…a 2 6…ooc uxoadosgp Jịonoual
L
.~I o- c
oc o un H l
.. N:
o o Io.v oc u
0 .o - uo.` "'
» ẫo oo o 1 N
00
—on o o u ' ,
. uo. c .
'
D
|
Ầ. . o '
I. .oo
,› ~ n.
’.
Ju
' I
II !
CH EPAZO L @
Tenofovir disoproxil 300mg & E-mtricitabine 200mg
\
BỘYTỂ
CỤC QUẢN LÝ DƯỢC
ĐÀ PHE DUYỆT
Lắn đauÁỉ’tfÌl/Ủ
& Prescription Medicine Batch No: M A9001
Mfg. Date: 01/12/2009
Exp. Date : 01/12/2011
Tenofovir disoproin 300mg & Emtricitabine 200mg
Composilion:
Each fulm coated tablet contams: ẩỹếỀẩỄ Ệầ APC Pharmaceuticals
Tenofovir disoproxil fumarate -.300mg `aỵ.mỵgự and Chemical Ltd
Emtricitabine ...200mg G L 013 A L '
_, …uuu…
Il'ĩL""\" \
lndicatiịonz Dqsage and adminis1ration. Manưĩactured in India by:
Contrannducaùon . refer to pack mseưt. _
Store Below 30°C, protectfrom Iight. APC Pharmaceutncals & Chemlcals
Keep out of reach of children. 43 Vikas Centre. 106. S.V.Road. Santacruz (West)
PaferlỊY read the accompanying Mumbaỉ 400 054 A! Plot No. J—76 MIDC Tarapur
'"sm'd'm's bef°'° "se~ Boisar 401506 Dist. Thane - mom
& Prescription Medicine B atch No: M A9001
Mfg. Date: 01/12/2009
Exp. Date : 01/12/2011
Tenofovir disoproin 300mg & Emtricitabine 200mg
Composltion:
Each 1ilm coated tablet contains:
Tenotovir disoproxil fumarate ...300mg
Emtricitabine -.200mg
n APC Pharmaceuticals
’ and Chemical Ltd.
lndication. Dosage and administration. Manufacturer! in India by:
Contraindication : referto pack insert. APC Pharmaceuticals & Chemicals
Store Below 30°C. protect from light.
Keep out ofreach ofchildren. 43 Vikas Centre, 106. S.V.Road, Santacruz (West)
Carefully read the acoompanying Mumbaỉ 400 054 At Plot No. J-76 MIDC Tarapur
instructions beforeuse. Boisar 4o1sos Dist. Thane - INDIA
& Prescription Medicine Batch No: M A9001
Mfg. Date: 01/12/2009
Exp. Date : 01/12/2011
Tenofovir disoproxil 300mg & Emtricitabine 200mg
Composition:
Each film coated tablet contains: .1'“"ầ'ẮmỸĩỉìL APC Pharmaceuticals
Tenofovir disoproxil fumarate ...300mg ':ềịỄịạặ') and Chemical Ltd
Emtricitabine ...200mg G L 08 A L '
Indication. Dosage and administration.
. . . _ Manufactured in India by:
Contramdtcahon : refer to pack lnsert.
Store Below 30°C, protect from light. APC fhannaceuticals & Chamicals
Keep out of reach of children 43 Vlkas Centre, 106, S.V.ROâd. Santacruz (West)
Carefully read the accompanying Mumbaỉ 400 054 At Plot No. J-76 MIDC Tarapur
instructions before use.
Boisar 401506 Dist. Thane - INDIA
Thuốc nảv chỉ dùng theo đơn của thầy thuốc
VIÊN NÉN BAO PHIM HEPAZOL E
Thảnh phần:
Mỗi viên nén bao phỉm chứa:
Emtricitabine ..................................... 200mg
Tenofovir disoproxil fumarate .......... 300mg
Tá dược: Cellulose vi tinh thế, Dibasic Calci Phosphat, Lactose, Povidone K—30, Polysorbate 80,
Tale tinh khiết, Magnesi Stearat, Colloidal Anhydrous Silica, Tinh bột Na Glycollat, Tình bột
bắp, Natri Lauryl Sulphat, Natri Croscarmellose, Titan Dioxid, Indigo Carmine.
ĐẶC TÍNH DƯỢC LỰC HỌC
C ơ chế tác dụng và hiệu lưc dược lưc học: Emtricitabine là một đồng đắng nucleoside thuộc
nhóm cytidine. Trong cơ thể, Tenofovir disoproxil fumarate được chuyền thảnh tenofovir, một
đồng đẳng nucleoside monophosphat (nucleotide) cùa adenosìne monophosphat. Cả
emtricitabine vả tenofovir đều có hoạt tính đặc hiện đối với virus gây suy giảm miễn dịch ở
người (HIV—] và HIV-2) và virus vỉêm gan B. Emtricitabine vả tenofovir được phosphoryl hóa
bới cảc enzyme trong tế bảo để tạo thảnh emtricitabine triphosphat vả tenofovir diphosphat,
tương ứng. Các nghiên cứu in vitro chỉ ra rằng cả emtricitabine vả tenofovir đều có thế bị
phosphoryl hóa hoản toản khi dùng kết hợp với nhau trong tế bảo. Emtricitabine triphosphat vả
tenofovir dỉphosphat ức chế cạnh tranh men sao chép ngược HIV-l , lảm kết thúc chuỗi DNA.
Cả emtricitabine trỉphosphat vả tenofovir diphosphat đều là chất ức chế yếu đối với polymerase
DNA của động vật có vú và không có dấu hiệu dộc tính đối với ty thể cả in vitro và in vivo.
Hoạt tính kháng virus in vítro. Hoạt tính hiệp dồng khảng virus dã dược thấy đối với viên kết
hợp emtricitabine vả tenofovir in vitro. Đã thấy có hiệu lực cộng hoặc hiệp đồng trong các
nghiên cứu phối hợp thuốc vởi cảc thuốc ức chế protease và với các thuốc ức chế men sao chép
ngược HIV nucleoside vả non- -nucleoside.
Kháng thuốc: Tính khảng thuốc dã được quan sảt thấy in vitro và trên một số bệnh nhân nhiễm
HIV-l do có sự xuất hiện đột biến MI 84V/1 vởi emtricitabine vả KôSR với tenofovir. Không xảc
định được nguyên nhân nảo khác gây kháng emtricitabine vả tenofovir. Cảc virus khảng
emtricitabine có mang đột biến M184V/1 cũng đề kháng chéo với lamivudine, nhưng vẫn duy trì
độ nhạy cảm vởi didanosine, stavudine, tenofovir, zalcitabine vả zidovudine. Đột biến K65R
cũng có thế được chọn lọc với abacavir, didanosine hoặc zalcitabỉne vả lảm giảm nhạy cảm với
các thuốc như lamivudine, emtricitabine vả tenofovir. Trảnh dùng tenofovir disoproxil fumarate
cho những bệnh nhân nhiễm chùng HIV—l có mang đột biến K65R.
Những bệnh nhân bị nhiễm HIV-l có ba đột biến liên quan đến các đồng đắng thymidine
(TAMs) hoặc nhiều hơn bao gồm đột biến hoặc M4l L hoặc L21 OW trên men sao chép ngược thế
hiện gỉảm nhạy cảm với tenofovir dísoproxil fumarate.
Kinh nghíệm lăm sảng. Trong một nghiên cứu lâm sảng ngẫu nhiên mở(GS-OI- 934), nhưng
bệnh nhân nhiễm HIV- ] khảng retrovirus— —naive dùng hoặc chế đó mỗi ngảy một lần
emtricitabine, tenofovir disoproxil fumarate vả efavirenz (n= 255) hoặc một sự kết hợp cố định
lamivudine vả zidovudine (Combivir) được dùng hai lằn mỗi ngảy vả efavirenz mỗi ngảy một
lần (n=254). Những bệnh nhân trong nhóm emtricitabine vả tenofovir disoproxil fumarate được
cho dùng thuốc nẻn emtricitabine/tenofovir disoproxil fumarate vả efavirenz từ tuần 96 đến tuần
144. Tại đường chuẩn cảc nhóm ngẫu nhiên có HIV l RNA huyết tương trung gian tưong đồng
(5.02 và 5.00 loglO bản sao/ml) vả lượng CD4 (233 và 241 tế bảo/mm3 ). Điếm cuõi hiệu quả sơ
câp của nghiên cửu nảy là đạt đuợc và duy trì nông dộ HIV— l RNA < 400 bản sao/ml trên 48
tuần. Hiệu quả thử câp phân tích trên 144 tuần bao gôm tỷ lệ bệnh nhân có nồng độ HIV- l RNA
< 400 hoặc < 50 bản sao/ml, và thay đổi từ đường chuẩn ở lượng tế bảo CD4.
Dữ liệu về đỉểm cuối sơ cấp 48 tuần cho thấy rằng sự kết hợp của emh 1c1tabme tcnofovir
disoproxil fumarate vả efavirenz có tảc dụng khảng virus cao hơn khi so sánh với sự kết hợp cố
Trang 1/10
định cùa lamivudine vả zidovudine (Combivir) với efavìrenz như được trình bảy ờ Bảng 1. Dữ
liệu về điểm cuối thứ cấp 144 tuần cũng được trình bảy ớ Bảng 1.
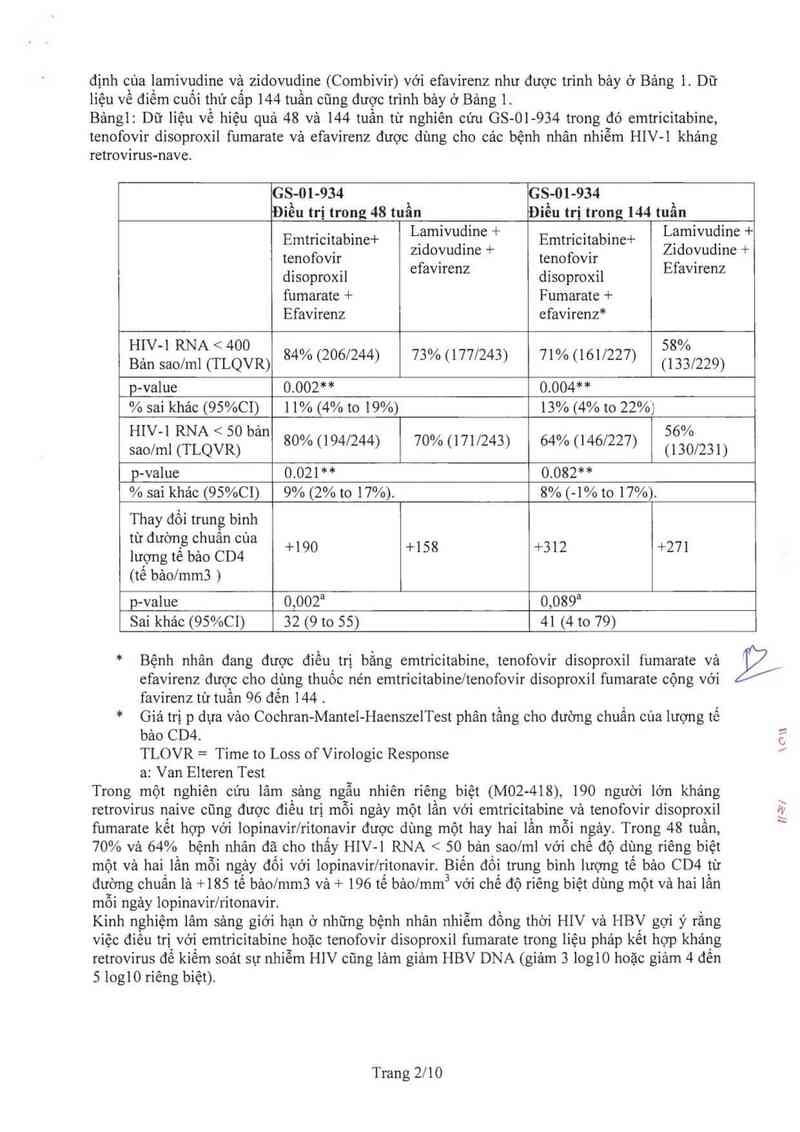
Bảngl: Dữ liệu về hiệu quả 48 và 144 tuần từ nghiên cứu GS-Ol-934 trong đó cmtricitabine,
tenofovir disoproxil fumarate vả efavirenz được dùng cho cảc bệnh nhân nhiễm HIV-l khảng
retrovirus-nave.
lcs_-m-9s4 ` s`-01-934 `
Điêu trị trong 48 tuân iêu trị trong 144 tuân
Emtricitabine+ Lịamwuđme + Emtricitabine+ Lạmwuđme +
tenofovir zidovudine + tenofovir Zidovudme +
. . efavirenz . . Efavirenz
dlSOpI'OXII disoproxd
fumarate + Fumarate +
Efavirenz efavirenz*
HIV-l RNA < 400 o o o 58%
Bản sao/ml (TLQVR) 844 (206/244) 73 A› (177/243) 71 Ai (161/227) (133/229)
p-value 0.002“ 0.004“
% sai khảc (95%C1) ] 1% (4% to 19%) 13% (4% to 22%
HIV-l RNA < 50 bản 0 0 o 56%
sao/ml (TLQVR) 80A› (194/244) 7OA› (171/243) 64/o (146/227) (130/231)
p-valưe 0.021“ 0.082**
% sai khác (95%C1) 9% (2% to 17%). 8% (—1% to 17%).
Thay đồi trung binh
từ đường chuân của
lượngtế bảo CD4 +190 +158 +312 +271
(tê bảo/mm3 )
p-value 0,002a 0,089a
Sai khảo (95%C1) 32 (9 to 55) 41 (4 to 79)
* Bệnh nhân đang được điều trị bằng emtricitabine, tenofovir disoproxil í'umarate vả
efavirenz được cho dùng thuốc nén emtricitabine/tenofovir dìsoproxil fumarate cộng với
favircnz từ tuần 96 đến 144 .
Giá trị p dựa vảo Cochran-Mante]-HaenszelTest phân tầng cho đường chuẩn cùa lượng tế
bảo CD4.
TLOVR = Time to Loss of Virologic Response
a: Van Elteren Test
Trong một nghiên cứu lâm sảng ngẫu nhiên riêng biệt (MO2-418), 190 người lớn khảng
retrovirus naive cũng được điều trị mỗi ngảy một lần với emtricitabine vả tenofovir disoproxil
fumaratc kết hợp với lopinavir/ritonavir được dùng một hay hai lằn mỗi ngảy. Trong 48 tuần,
70% và 64% bệnh nhân đã cho thấy HIV-l RNA < 50 bản sao/ml với chế đó dùng riêng biệt
một và hai lần mỗi ngảy đối với lopinavir/ritonavir. Biến đổi trung bình lượng tế bảo CD4 từ
đường chuẩn là +185 tế bảo/mm3 vả + 196 tế bảo/mm² vởi chế độ riêng biệt dùng một và hai lần
mỗi ngảy lopinavir/ritonavir
Kinh nghiệm lâm sảng giới hạn ở những bệnh nhân nhiễm đồng thời HIV vả HBV gợi ý rằng
việc điều trị với emtricitabine hoặc tenofovir disoproxil fumarate trong liệu pháp kết hợp kháng
retrovirus để kiểm soát sự nhiễm HIV cũng lảm giảm HBV DNA (giảm 3 logIO hoặc gỉảm 4 đến
5 logIO riêng biệt).
Trang 2/ 10
%
\Ô\\
l/ è`/
ĐẶC TÍNH DƯỢC ĐỌNG HỌC
Hấp thu: Tương đương sinh học cùa viên nén bao phim kết hợp liều cố định emtricitabine vả
tenofovir disoproxil fumarate so với một viên nang cứng emtricitabinc 200mg và một viên bao
phim tenofovir disoproxil fumarate 245mg đã dược xác lập sau khi cho người tình nguyện khỏe
mạnh dùng liều duy nhất lủc đói. Sau khi cho người tinh nguyện khỏe mạnh uống viên kết hợp
liếư cố dịnh emtricitabine vả tenofovir disoproxil fumarate, emtricỉtabine vả tenofovir disoproxil
fumarate được hấp thu nhanh chóng vả tenofovir disoproxil fumaratc được chuyến thảnh
tenofovir. Nồng độ emtricitabine vả tenofovir tối đa đạt được trong huyết thanh từ 0, 5 tới 3 giờ
sau khi uỏng trong tình trạng đói. Uống viên kết hợp liếư cô định` emtricitabine vả tenofovir
disoproxil fumarate với thức ăn lảm chậm thời gian đế đạt được nồng độ tối đa cùa tenofovir
khoảng 45 phút và lảm tãng AUC vả Cmax của tenofovir tương ứng khoảng 35% và 15%, khi
dùng kèm với bữa ăn nhẹ hoặc nhiều béo, so với uống thuốc lủc đói. Đế tối ưu hóa sự hấp thu
tenofovir, người ta khuyên rằng nên uống viên kết hợp với thức ăn.
Phân bố: Sau khi truyền tĩnh mạch, thể tích phân bố của emtricitabine vả tenofovir tương ứng lả
khoảng 1,4 I/kg và 800 ml/kg. Sau khi uống emtricitabine hoặc tenofovir disoproxil fumarate,
emtricitabine vả tenofovir được phận bố rộng rãi trên khắp cơ thể. Trên in vítro, tỷ lệ
emtricỉtabine gắn kết với protein huyết tương người < 4% và độc lập với nồng độ trong khoảng
0,02 đến 200ug/ml. Trên in vitro, tỷ lệ tenofovir gận kết với protein huyết tương hoặc huyết
thanh tương ứng là dưới 0, 7 và 7, 2%, trong khoảng nông độ tenofovir từ 0 ,0—1 25 ug/ml.
Chuyến dạng sinh học. Hiếu bỉết về quá trình chuyến hoả cùa emtricitabin còn hạn chế. Chuyển
dạng sinh học cùa emtricitabin bao gôm quá trình oxy hoá nhóm Thiol tạo thảnh đồng phân lập
thế 3’-sulphoxide (khoảng 9% liều) vả liên kết với Glucuronic acid để tạo thảnh 2’-O-glucuronid
(khoảng 4% liếư). Cảo nghiên cứu in vitro đã khắng định rằng cả Tenofovir disoproxil fumarate
lẫn Tenofovir đếu không là cơ chất của hệ enzym CYP4SO. Trong quá trình chuyển dạng sinh
học, cả Emtricitabine vả Tenofovir đếu không ức chế quá trình chuyến hoả cảc thuốc trung gian
qua bất kỳ đồng dạng nảo cùa CYP4SO người. Đồng thời Emtrỉcitabine củng không ức chế
Uridine 5’-diphosphoglucuronyl transferase, lả enzyme cùa quá trình Glucuronid hoá.
Thải trừ: Emtricitabine được thải trừ chủ yếu qua thận, 86% trong nước tiếu, qua phân (khoảng
14%). 13% liếư Emtricitabine trong nước tiều là ba chất chuyền hoá. Độ thanh thải cùa
Emtricitabine trung bình là 307ml/phút. Sau khi uống, thời gian bản thải cùa Emtricitabine
khoảng 10 giờ. Tenofovir được thải trừ chủ yếu qua thận bằng cả con đường lọc ở cầu thận và
qua hệ thống vận chuyền chủ động ở ống thận, khoảng 70- 80% Iiếu truyền tĩnh mạch được bải
tiết qua nước tiếu dưới dạng không đổi Độ thanh thải của Tenofovir trung bình là 307ml/phút.
Độ thanh thải cùa thận ước tính lả khoảng 210 ml/phủt, tốc độ thanh thải cùa Tenofovir cao hơn
nhiều so với tốc độ lọc ở cầu thận. Điều nảy chỉ ra rằng bải tiết chủ động qua ống thận đóng vai
trò quan trọng trong quá trình thải trừ Tenofovir. Thời gian bán thải cùa Tenofovir sau khi uống
là khoảng 12 — 18 giờ.
Tuổi tác, giới tính và chủng lộc: Dược động học cùa Emtricitabinc vả Tenofovir lá như nhau ở
nam, nữ. Nói chung, dược động học của emtricitabine ở trẻ sơ sinh, trẻ nhỏ vả thiểu nỉên (tuối từ
4 thảng tới 18 tuối) là tương đương với ở người lớn. Các nghiên cứu dược động học cùa
tenofovir chưa được thực hiện ở trẻ em và thiếu niên (dưới 18 tuổi). Cảc nghiên cứu dược động
học chưa được thực hiện với emtricitabỉne hoặc tenofovir ở người giả (trên 65 tuồi).
Suy thận: Dược động học của Emtricitabine vả Tenofovir disoproxil fumarate ở dạng bảo chế
riêng rẽ hay dạng viên kết hợp liếu cố định chưa được nghiên cửu trên bệnh nhân suy thận. Cảc
chỉ số dược động học được xảc định sau khi cho bệnh nhân không nhiễm HIV có cảc mức đó suy
thận khảo nhau uống một liều đơn Emtricitabine 200mg hoặc Tenofovir disoproxil 245mg. Mức
độ suy thận được xác định dựa vảo độ thanh thải creatinine ban đầu (CrCl) (chức năng thận là
bình thường nếu chỉ số CrCl > 80ml/phủt; suy thận nhẹ nếu CrCl = 50-79 mllphút; trung bình
nếu CrCl= 30- 49 ml/phút và nặng nêu CrCl- — 10- 29 ml/phút).
Người ta khuyên răng nên điếu chỉnh khoảng cách giữa cảc lần uống viên thuốc kết hợp liều cố
định emtricitabine vả tenofovir disoproxil fumarate ở những bệnh nhân có độ thanh thải
creatinine từ 30 đến 49 ml/phủt. Viên nén Tcnofovir vả Emtricitabine không thích hợp với những
Trang 3/10
bệnh nhân có độ thanh thải creatinine CrCl < 30 ml/phủt hoặc những bệnh nhân cần thẩm tảch
mau.
Suy gan: Dược động học cùa thuốc kết hợp lỉếu cố định Emtricitabine vả Tenofovir disoproxil
fưmarate chưa được nghiên cứu trên bện nhân suy gan. Tuy nhiên, hầu như không cần điều chinh
liêu cho bệnh nhân suy gan.
Dược động học cùa Emtricitabine chưa được nghiên cứu trên bệnh nhân không nhiễm HBV
nhưng có tốn thương gan ở những mức độ khảo nhau. Nhìn chung, dược động học cùa
Emtricitabine ở bệnh nhân nhiễm HBV củng tương tự như ở người khoẻ mạnh và bệnh nhân
nhiễm HIV.
Liều đơn tenofovir disoproxil 245 mg được dùng cho các bệnh nhân không nhiễm HIV có các
mức độ suy gan khác nhau được xảc định theo cảch phân loại Child— Pugh- Turcotte (CPT). Dược
động học cùa tenofovir thực chẳt không bị ảnh hướng ở cảc đối tượng bị suy gan, điều nảy gợi ý
răng không cần điếu chỉnh liều ớ cảc bệnh nhân nảy Các giá trị trung bình nông dộ tenofovir
(%CV) C…ax vả AUC… tương ứng là 223 (34,8%) ng/ml và 2050 (50,8%) ng.giờ/ml ở những
bệnh nhân chức năng gan bình thường, so với 289 (46,0%) ng/ml và 2310 (43,5%) ng.giờ/ml ở
những bệnh nhân suy gan mức độ trung bình và 305 (24,8%) ng/ml và 2740 (44,0%) ng.giờ/ml ở
những bệnh nhân suy gan nặng.
CHỈ ĐỊNH
Thuốc kết hợp liều cố định Emtricitabine vả Tenofovir disoproxil fumarate được chỉ định trong
liệu phảp kết hợp thuốc khảng retrovirus cho người lớn bị nhiễm HIV- 1.
Sự khẳng định lợi ich cùa thuốc phối hợp Emtricitabine vả Tenofovir disoproxil fumarate trong
điều trị kháng rctrovirus dựa chủ yêu vảo các nghiên cứu thực hiện trên bệnh nhân chưa từng
điếu trị trước đó.
LiỀU_LỰỢNG VÀ CÁCH DÙNG \ Z
Nên băt đâu dùng thuôc theo chỉ định cùa bảc sỹ có kinh nghiệm trong điêu trị nhiễm HIV.
Liều dùng:
Người Iởn: Liều khuyến cáo là một viên, uống ngảy một lần. Đế tối ưu hóa sự hấp thu cùa
tenofovir, nên uống viên kết hợp nảy cùng với thức ản. Thậm chí một lượng nhỏ thức ăn cũng
lảm tăng sự hấp thu cùa tenofovir từ viên kết hợp.
Khi cân phải ngừng điều trị một trong hai thảnh phần của viên kết hợp hoặc khi cần điếu chinh
liều, nên sử dụng cảc chế phấm có chứa riêng từng thảnh phần emtricítabine vả tenofovir
disoproxil fumarate.
Trẻ em vả vị thảnh niên. Tính an toản vả hiệu quả của viên kết hợp liếư cố định emtrỉcitabine vả
tenofovir disoproxil fumarate chưa được khẳng định ở bệnh nhân dưới 18 tuối. Do đó, không nên
dùng viên kết hợp cho trẻ em và thiếu niên.
Người giả. Không có đủ dữ liệu để đưa ra khuyến cáo về liều dùng cho bệnh nhân trên 65 tuổi.
Tuy nhiên, không cần thiết phải điều chinh liều khuyến cảo cho người lớn trừ khi có bằng chứng
cùa tình trạng suy thận.
Suy chức nãng thận: Các thông số hấp thu cùa emtricitabine vả tenofovir có thể tăng đảng kể khi
thuốc emtricitabine/tenofovir disoproxil fumarate được dùng cho cảc bệnh nhân bị suy thận vữa
đến nghiêm trọng do emtricitabine and tenofovir được loại bỏ chủ yếu qua sự bảí tiết ở thận.
Dữ liệu giới hạn từ cảc nghiên cứu ửng hộ liều dùng mỗi ngảy một lằn tenofovir disoproxil
fumarate với emtricitabine ở các bệnh nhân bị suy thận nhẹ (thanh thải creatinine SO-SOmI/phủt).
Cần điếu chinh khoảng cách giữa cảc liều của thuốc emtricitabine/tenofovir disoproxil fumarate,
tuy nhiên ở tất cả bệnh nhân bị suy thận vùa phải (thanh thải creatininc giữa 30 và 49ml/phủt).
Cảo chỉ dẫn về điều chinh khoảng cách giữa các liếư cho nhóm nảy dưới đây được dựa vảo mô
hình cùa dữ liệu động dược học đơn liếư ở những đối tượng không bị nhiễm HIV với cảc mức độ
suy thận khảc nhau. Chưa có dữ liệu về tính an toản vả hỉệu quả ở những bệnh nhân thải loại
creatinine giữa 30 và 49ml/phút được diếư trị tenofovir disoproxil fumarate với emtricitabine sữ
Trang 4/ 10
dụng sự điếu chinh khoảng cảch giữa liếư nảy. Do đó, đảp ứng lâm sảng với việc điều trị và chức
năng thận nên được giảm sảt chặt chẽ ở những bệnh nhân nảy.
Thanh thải Creatinine (ml/phút)*
50-80 30-49
Mỗ124 giờ Mỗi 48 giờ
Khoang cach g1ưa lieu khuyen cao (không cần điều chinh)
*Sử dụng thế Irọng lý tưởng (gầy) đã được ước tính
Không nên dùng viên kết hợp cho bệnh nhân suy thận rắt nặng (có độ thanh thải creatinine < 30
mllphút) vả ớ những bệnh nhân phải thẩm tảch mảu vì không thế giảm liều viên kểt hợp cho phù
hợp với yêu cầu điếu trị.
Suy gan Dược động học cùa viên kết hợp cũng như cùa emtricitabine chưa được nghiên cứu ở
bệnh nhân suy gan Dược động học cùa tenofovir đă được nghiên cứu ở những bệnh nhân suy
gan và không thấy cần phải điếu chinh liều cho những bệnh nhân nảy.
Cách dùng.
Nếu bệnh nhân khó nuốt, có thế phân tán viên kết hợp trong khoảng 100 ml nước, nước cam
hoặc nước nho vả uống ngay sau khi pha.
CHỐNG cnỉ ĐỊNH
Quá mẫn với emtricitabine, tenofovir, tenofovir disoproxil fumarate hoặc bất cứ thảnh phần nảo
cùa thuốc.
NHỮNG KHUYẾN CÁO ĐẶC BIỆT VÀ THẶN TRỌNG KHI SỬ DỤNG
Không nên dùng viên kết hợp đồng thời với cảc thuốc khác có chứa cmtricitabine, tenofovir
disoproxil (dưới dạng fumarate) hoặc cảc đồng đẳng cytidine khảc, như lamỉvudine vả
zalcitabine.
Líệu pháp kết hợp 3 nucleoside: Đã có báo cáo về tỷ lệ thất bại cao trong điếu trị kháng virus và
xuất hiện chủng khảng thuốc vảo giai đoạn sớm khi tenofovir disoproxil fumarate được kết hợp
với lamivudine vả abacavir củng như với lamivudine vả didanosine trong phác đồ ngảy một lần.
Lamivudine vả emtticỉtabine có cấu trúc rất giống, nhau và hai chất nảy cũng có sự giông nhau về
dược động học và dược lực học. Do đó, có thể xuất hiện những vấn đề giông nhau khi dùng viên
kết hợp đồng thời với một thuốc tương tự nucleoside thứ ba.
Những bệnh nhân đang điểu trị bằng viên kểt hợp hoặc bất kỳ thuốc kháng Retrovirus nảo khảc
vẫn có thề mắc nhiễm trùng cơ hội vả cảc biến chứng khác cùa nhiễm HIV. Vì vậy những bệnh
nhân nảy phải được theo dõi chặt chẽ bởi cảc bác sỹ có kinh nghiệm trong điều trị bệnh nhân bị
bệnh có liên quan tới HIV.
Bệnh nhân phải được khuyên rằng, cảc liệu phảp khảng retrovirụs, kể cả viên kểt hợp nảy, không
ngăn ngừa được nguy cơ lây truyên HIV cho ngưới khác qua tiếp xúc tình dục hoặc truyền máu
Cần phải tiếp tục ảp dụng cảc biện phảp phòng ngừa thích hợp.
Viên kết hợp có chứa lactose monohydrate. Vì vậy, những bệnh nhân bị các vấn để di truyền
hiếm gặp như bất dung nạp galactose, thiếu men Lapp-lactase, hoặc kém hấp thu gluco-galactose
không nên dùng thuốc nảy.
Suy thận: Emtricitabine vả tenofovir được thải trừ chủ yếu qua thận bằng cảch lọc ở cầu thận kết
hợp với bải tỉết chủ động qua ống thận. Cảo thông số hấp thu của emtricitabine vả tenofovir có
thề tảng đáng kế ở những bệnh nhân bị suy thận mức độ từ trung bình đến nặng. Do đó, cần phải
điều chinh khoảng cách giữa cảc lần uống thuộc đối với những bệnh nhân có độ thanh thải
creatinine từ 30 đến 49 ml/phút Tính an toản và hiệu quả cùa Tenofovir vả Emtricitabine ở
những bệnh nhân bị suy thận còn chưa được xác lập. Cần phải giám sát cẩn thận cảc dấu hiệu
nhiễm độc, như sự suy giảm cùa chức năng thận, và cảc biến đổi cùa nồng độ virus, đối với cảc
bệnh nhân bị suy thận từ trước, khi bắt đầu dùng viên kết hợp, vả kéo dải khoảng cách giữa cảc
lần uống thuốc. Không nên dùng viên kết hợp liều cố định emtricitabine vả tenofovir disoproxil
Trang 5/10
fưmarate cho những bệnh nhân có độ thanh thải creatinine < 30ml/phút hoặc những bệnh nhân
cần phải thầm tách máu, vì không thế giảm liều viên kết hợp cho phù hợp với yêu câu điều trị.
Nếu phosphat huyết thanh < 1,5 mng (0,48 mmol/l) hoặc độ thanh thải creatinin bị giảm xuống
< 50 mllphút, chức năng thận cần được đảnh giá lại trong vòng 1 tuần, bao gồm cả đo nông độ
glucose mảu, kali máu và glucose nước tiếu, và khoảng cảch giữa các lần dùng thuốc cân được
điếu chỉnh. Cũng nên cân nhắc ngừng điếu trị vởi những bệnh nhân có độ thanh thải creatinine <
50 mllphút hoặc phosphat huyết thanh giảm xuống < 1,0 mg/dl (0,32mm01/1).
Nên trảnh dùng viên kết hợp khi đang dùng hoặc mới dùng trước đó không lâu một thuốc gây
độc thận.
Nên trảnh dùng viên kết hợp với cảc bệnh nhân đã điều trị kháng retrovirus trước đó mà nhiễm
HIV- ] có mang đột bỉến KôSR. Trong một nghiên cứu lâm sảng có đối chứng kẻo dải 144 tuần
so sánh tenofovir disoproxil f'umarate với stavudine trong công thức kết hợp với lamivudine vả
efavirenz trên cảc bệnh nhân dùng thuốc kháng retrovirus lần đầu, người ta thấy có sự giảm nhẹ
mật độ xương ở xương hông và cột sống trong cả hai nhóm điếu trị. Ở tuần 144, sự giảm mật độ
xương ở cột sống và bìến đổi cảc chỉ số sinh học cùa xương so với lúc bắt đầu ti hiên cứu ở
nhóm điều trị bằng tenofovir disoproxil [`umarate lớn hơn đáng kể so vởi nhóm kia. ổ nhóm nảy,
sự giảm mật độ xương ớ hông cũng lớn hơn đảng kể so với nhóm kia cho tới tuần thứ 96. Tuy
nhiên, sau 144 tuần điều trị, không có nguy cơ gãy xương tăng hoặc dấu hiện lâm sảng về bất
thường xương. Nên tham vân bác sĩ nếu nghi ngờ có bất thường xương.
Bệnh nhân nhiễm đồng thời H] V và virus viêm gan B hoặc viêm gan C: Bệnh nhân bị viêm gan B
hoặc C mạn tính, khi điếu trị bằng phác đồ kháng Retrovirus phối hợp sẽ có nguy cơ cao bị biến
chứng nặng ở gan và có thế tử vong.
Cảc bác sỹ lâm sảng nên tham khảo tải liệu hưởng dẫn điều trị HIV hiện tại để có hiện phảp điều
trị tốt nhất cho bệnh nhân đồng thời nhiễm cả HIV và HBV.
Độ an toản và hiệu quả của thuốc kết hợp liếư cố định Emtricitabine vả Tenofovir disoproxil
i`umarate chưa được nghiên cứu trong điếu trị nhiễm HBV mạn tính. Trong nghiên cứu dược lực
học cho thấy Emtricitabine vả Tenofovir khi sử dụng riêng rẽ hay kết hợp đếu có khả năng kháng
virus HBV. Với kinh nghiệm lâm sảng còn hạn chế cho thấy Emtricitabine vả Tenofovir
disoproxil fumarate có hoạt động kháng HBV khi được sử dụng trong phác đồ kết hợp khảng
Retrovirus để kiềm soát nhiễm HIV.
Bộc phảt viêm gan đã xảy ra sau khi ngững điều trị Emtricìtabỉne hoặc Tenofovir disoproxil
fumarate.
Bệnh nhân nhiễm đồng thời HIV và HBV phải được giảm sảt chặt chẽ cả về lâm sảng và xét
nghiệm trong thời gian ít nhất vải thảng sau khi ngừng điều trị bằng thuốc kết hợp.
Bệnh gan: Tính an toản và hiệu quả của viên kết hợp liếu cố định emtricitabine vả tenofovir
disoproxil fumarate chưa được xảc định ở những bệnh nhân có các rối loạn nặng ở gan. Dược
động học cùa thuốc kết hợp vả cùa emtricitabine chưa được nghiên cứu ở những bệnh nhân bị
suy gan. Dược động học cùa tenofovir đã được nghiên cứu ở bệnh nhân suy gan và không thấy
cần thiết phải điếu chinh liều cho những bệnh nhân nảy. Dựa trên việc emtricitabine chỉ chuyến
hóa phần nhỏ ở gan và đường thải trừ chủ yếu là qua thận, dường như không cần phải điếu chính
liếu cho những bệnh nhận suy gan.
Những bệnh nhân có rối loạn chức năng gan từ trước bao gồm cả viêm gan mãn tính thể hoạt
động có tằn suất cao hơn bị cảc bất thường chức năng gan khi điều trị bằng thuốc kháng
Retrovirus kết hợp và nên được giám sát theo thực hảnh tiêu chuẩn. Nếu có các bằng chứng là
bệnh gan nặng lên ở những bệnh nhân nảy, nên cân nhắc điếu trị ngắt quãng hoặc ngừng việc
điêu tri.
Nhiễm acid Iactic: Đã gặp các trường hợp nhiễm acid lactic, thường kèm theo gan nhiễm mở, khi
sử dụng các chắt tương tự nucleoside. Cảc dấu hiệu sớm (tăng lactat mảu triệu chứng) bao gổm
các triệu chứng tiêu hóa nhẹ (buồn nôn, nôn và đau bụng), mệt mòi không đặc hiệu, ãn kém
ngon, giảm cân, cảc triệu chứng hô hắp (thớ chậm vả/hoặc sâu) hoặc cảc triệu chứng thần kinh
(kể cả yêu vận động) Nhiễm acid lactic có tỷ lệ tử vong cao và thường kèm theo viêm tụy, suy
gan hoặc suy thận. Nhiễm acid lactic thường xuất hỉện sau một vải hoặc nhiều tháng điều trị.
Trang 6/ 10
Nên ngừng điều trị bằng cảc chất tương tự nucleoside khi có các dấu hiệu tăng lactat mảu và
nhiễm acid lactic/chuyến hóa, phi đại gan tiến triến, hoặc men gan tăng nhanh
Cẩn thận trọng khi dùng các chất tương tự nucleoside cho bẳt kỳ bệnh nhân nảo (đặc biệt lả phụ
nữ béo phì) bị phì đại gan, viêm gan hoặc có cảc yếu tố nguy cơ bị bệnh gan đã biết vả gan
nhiễm mỡ (kể cả một sô thuốc nhất định và cồn). Các bệnh nhân đồng thời nhiễm viếm gan C và
được điều trị bằng alpha interferon vả ribavirin có thế có nguy cơ đặc biệt.
Cần theo dõi chặt chẽ các bệnh nhân có nguy cơ cao.
Loạn dưỡng mỡ: Phác đồ điếu trị phối hợp thuốc chống Retrovirus thường gây ra tái phân bố
mỡ trong cơ thể (loạn dưỡng mỡ) ở bệnh nhân nhiễm HIV. Hậu quả lâu dải cùa những biến
chứng nảy hỉện vẫn chưa rõ. Hiều biết về cơ chế chuyến hoá hiện vẫn chưa dầy đù. Có giả thuyết
cho răng có mối liên quan giữa tích mỡ nội tạng với chất ức chế men Protease (Pls) vả teo mô
mở với chất ức chế men sao chép ngược nucleoside (NRTIs). Nguy cơ cao của loạn đường mở
có liên quan tới những yếu tố có tính chất cá nhân như tuổi cao, và những yếu tố liên qưạn tới
thuốc như thời gian điếu trị thuốc khảng Retrovirus kéo dải và liên quan tới những rôi loạn
chuyến hoá. Khám lâm sảng nên bao gôm cả việc đảnh giả các triệu chứng thực thể cùa tải phân
bố mỡ. Nên cân nhắc lảm xét nghiệm Lipid huyết thanh và Glucose máu. Rối loạn Lipid cũng
nên được điều trị một cảch phù hợp theo lâm sảng. Tenofovir có liên quan về cấu trúc với cảc
thuốc tương tự nucleoside do đó thể không loại trừ nguy cơ loạn dưỡng mỡ. Tuy nhiên, dư liệu
từ nghiên cứu lâm sảng 144 tuần trên các bệnh nhân điều trị khảng retrovirus lằn đầu chỉ ra rằng
nguy cơ của loạn dưỡng mở với tenofovir disoproxil fumarate là thấp hơn so với stavudine khi
dùng kết hợp với lamivudine vả efavirenz.
Rối loạn chức nãng ly thể: Cảc chất tương tự nucleoside vả nucleotide đã được chứng minh in
vitro và in vivo là gây huỷ hoại ty thế ở nhiều mức độ khác nhau. Đã có những bảo cảo về rối
loạn chức năng ty thế ở trẻ nhỏ HIV âm tính nhưng đã bị phơi nhiễm với cảc chất tương tự
nucleoside từ trong tử cung và sau khi sinh. Các tảc dụng bất lợi chính được bảo cảo lá các rối
loạn huyết học (thiếu mảu, giảm bạch cầu trung tính), cảc rối loạn chuyến hoả (tăng lactat máu,
tăng lipid mảu). Những tảc dụng có hại nảy thường lả nhất thời. Đã có bảo cáo một số rối loạn
thần kinh khời phảt muộn (tăng trương lực, co giật, rối loạn hảnh vi). Hiện vẫn chưa xảc định
được liệu cảc rôi loạn thần kinh là tạm thời hay vĩnh viễn. Bất cứ trẻ nảo đã có phơi nhiễm với
cảc chất tương tự nucleoside vả nucleotide từ trong tử cung, ngay cả với trẻ HIV âm tính, đếu
phải được theo dõi về mặt lâm sảng và xét nghiệm và nên thăm dò đằy đủ về khả năng rối loạn
chức năng ty thế trong trường hợp có các triệu chứng liên quan. Những phảt hiện nảy không ảnh
hướng đến các khuyến cáo hiện nay về sử dụng điếu trị khảng Retrovirus ở phụ nữ mang thai đề
phòng ngừa lây truyền HIV theo chiếu dọc.
Hội chứng phục hồi miễn dịch: Bệnh nhân nhiễm HIV bị suy giảm miễn dịch nặng tại thời điếm
sử dụng phảc đồ phối hợp thuốc chống Retrovirus (CART), phản ứng viêm không triệu chứng
hoặc các nhiễm trùng cơ hội sẽ có thể xuất hiện vả gây nên tình trạng lâm sảng trầm trọng hoặc
lảm cảc triệu chứng bị nặng lên. Cảo phản ứng như trên thường xuất hiện trong vải tuần hoặc vải
thảng đầu tiên từ khi bắt đẩu liệu pháp chống Retrovirus phối hợp. Cảc biều hiện liên quan là
viêm võng mạc đo C ytomegalovirus relim'tis, nhiễm nấm khu trú hoặc toản thế vả viêm phổi do
Pneumocystis carinii. Bất kỳ triệu chứng viêm nảo cũng nên được đảnh giả và điếu trị ngay khi
cân thiết.
Sử dụng đồng thời tenofovir disoproxil fumarate vả didanosine lảm tãng 40— 60% phơi nhiễm
toản thân cùa didanosine dẫn đến tăng nguy cơ gặp cảc phản ứng ngoại ý liên quan tới
didanosine. Đã có bảo cáo về cảc trường hợp hiếm gặp viêm tụy vả nhiễm acid lactic có cả một
số ca tử vong.
Việc sử dụng đồng thời tenofovir disoproxil fumarate vả didanosine với liều lượng 400 mg mỗi
ngảy đã lảm giảm đảng kế một lượng tế bảo CD4, có thế là nhờ một tương tảc nội bảo lậm tăng
didanosine được phosphoryl hoá (hoạt động). Liều giảm 250 mg didanosine được dùng đông thời
với liệu pháp tenofovir disoproxil fumarate kèm theo cảc bảo cảo về tỷ lệ cao cùa sự thât bại
virus học trong nhiều sự phối hợp được thứ nghỉệm.
Trang 7/ 10
Ấnh hưởng lên khá nãng lái xe vả vận hảnh máy móc
Không có nghiên cứu nảo về ảnh hướng cùa viên kết hợp liếư cố định emtricitabine vả tenofovir
disoproxil fumarate.
Tuy nhiên, bệnh nhân cần được thông báo rằng đã có báo cáo về tình trạng chóng mặt trong quá
trình điều trị bằng emtricitabine cũng như bằng tenofovir disoproxil fumarate.
PHỤ NỮ có THAI VÀ CHO CON BÚ
Phụ nữ có thai:
Đối với emtricitabine vả tenofovir disoproxil fumarate, tảc hại cùa thuốc trên phụ nữ mang thai
không đầy đù. Các nghiên cứu trên động vật không cho thấy tác hại trực tiếp hoặc gián tiêp cùa
emtricitabin hoặc tenofovir disoproxil fumarate về khía cạnh thai nghén, sự phảt triến cùa
phôi/bảo thai, quá trình sinh nở hoặc sự phát triền sau khi ra đời.
Tuy nhiên, chỉ nên dùng viên kết hợp trong quá trình mang thai khi không có lựa chọn nảo khác
phù hợp hơn. Khi dùng viên kết hợp phải đồng thời sử dụng một biện phảp trảnh thai hiệu quả.
Phụ nữ cho con bú:
Hiện còn chưa biết liệu emtricitabine hoặc tenofovir có được bải tiết qua sữa mẹ hay không.
Phụ nữ nhiễm HIV được khuyến rằng không nên nuôi con bằng sữa cùa mình trong bất kỳ
trường hợp nảo để tránh lây truyền HIV cho con.
TƯONG TÁC THUỐC
Dược động học ở trạng thái ổn định của emtricitabine vả tenofovir không bị ảnh hướng khi
Emtricitabine vả tenofovir disoproxil fumarate được dùng kết hợp với nhau so với khi dùng riêng
từng thuốc.
Các nghiên cứu tương tảc dược động học trên lâm sảng và in vilro đã cho thắy ít có khả năng xảy
ra các tương tác có trung gian lả CYP4SO liên quan tới emtricitabine vả tenofovir disoproxil
fumarate với cảc thuốc khác.
Cảc tương tác Iiên quan đến emtricitabine:
Trên in vitro, emtricitabine không ức chế sự chuyển hóa có trung gian là bất kỳ đồng dạng
CYP4SO nảo sau đây cùa người: 1A2, 2A6, 2B6, 2C19, 2D6 vả 3A4. Emtricitabine không ức chế
enzyme của quá trình glucuronid hóa. Không có tương tảc đảng kề nảo vế lâm sảng khi
emtricitabine được dùng cùng lủc với indinavir, zidovudine, stavudine hoặc famciclovir.
Emtricitabine được bải tiết chủ yếu bằng cách lọc ở cầu thận và bải tiết chủ động ở ống thận.
Ngoại trừ famciclovir vả tenofovir disoproxil fumarate, hiệu lực của việc dùng kết hợp
emtricitabine với cảc thuốc được bải tiết qua thận, hoặc cảc thuốc được biết lá có ảnh hưởng tới
chức nãng thận, còn chưa được đảnh giả. Việc dùng kết hợp với cảc thuốc cũng được bải tiết chủ
động ở ống thận có thể dẫn tới tăng nồng độ cùa cả emtricitabine và thuốc kết hợp do sự cạnh
tranh đường thải trừ nảy.
Không có kinh nghiệm lâm sảng về việc sử dụng kết hợp emtricitabine với cảc chắt đồng đằng
cytidine. Do đó, không nên dùng kết hợp emtricitabine với lamivudine hoặc zalcitabine để điều
1rị nhiễm HIV.
Các tương rác Iiên quan rởi tenofovir:
Việc phối hợp lamivudine, indinavir, efavirenz, nelfinavir hoặc saquinavir (có bổ sung ritonavir)
với tenofovir disoproxil fumarate không gây ra bất kỳ tương tác nảo về lâm sảng. Khi tenofovir
disoproxil fumarate được phối hợp với lopinavir/ritonavir, không có biến đối nảo về dược động
học cùa lopinavir vả ritonavir. AUC cùa tenofovir tăng lên khoảng 30% khi tenofovir disoproxil
fumarate được phối hợp với lopinavir/ritonavir.
Khi dùng didanosine dưới dạng viên nang tan trong ruột 2 giờ trước khi dùng tenofovir
disoproxil fumarate hoặc cùng một lúc, AUC cùa didanosine tãng tương ứng trung bình lệ 48%
và 60%. Mức tăng trung bình giá trị AUC của didanosine là 44% khi dùng viên nén có chât đệm
1 giờ trước khi dùng tenofovir. Trong cả hai trường hợp cảc chỉ số dược động học cùa Tenofovir
được dùng kèm theo một bữa ăn nhẹ là không thay đồi. Không nên dùng phối hợp tenofovir
disoproxil fumarate với didanosine.
Trang 8/10
Khi tenofovir disoproxil fumarate được dùng phối hợp với atanazavir, nồng độ atanazavir giảm
(mức giảm tương ứng của AUC và C…… là 25% và 40% so với atanazavir 400 mg). Khi dùng
thêm ritonavir với atanazavir, ảnh hướng tiêu cực của tenofovir lên C…… cùa atanazavir đã giảm
đi rõ rệt, trong khi mức giảm của AUC vẫn giữ nguyên (mức giảm tương ứng cử AUC và C…… là
25% và 26% so với atanazavir/ritonavir 300/l OOmg).
Tenofovir được bải tiết qua thận bằng cả hai cách lọc ở cầu thận và bải tiết chủ động qua con
đường vận chuyển anion hữu cơ 1 ở người (hOATI). Dùng phối hợp tenofovir disoproxil
fumarate với cảc thuốc khác cũng được bải tiết chủ động qua hệ thống vận chuyển anion hữu cơ
(ví dụ như cidofovir) có thế lảm tăng nồng độ của tenofovir hoặc cùa thuốc phối hợp.
Tenofovir disoproxil fumarate chưa được đánh giá ở những bệnh nhân đang dùng cảc thuốc gây
độc thận (chẳng hạn như cảc aminoglycoside, amphotericin B, foscamet, ganciclovir,
pentamidine, vancomycin, cidofovir hoặc interleukin- —2) Trảnh sử dụng Tenofovir disoproxil
fumarate khi đang dùng hoặc mới ngừng dùng các thuốc gây độc thận. Nếu bắt buộc phải kết
hợp Tenofovir disoproxil fumarate với cảc thuốc gây độc thận, nên kiểm tra chức năng thận hảng
tuần.
Việc phối hợp tenofovir disoproxil fumarate với methadone, ribavirin, ạdefovir dipivoxil hoặc
cảc thuốc tránh thai norgestimate/ethinyl oestradiol không gây ra bất kỳ tương tác dược động học
nao.
TÁC DỤNG KHÔNG MONG MUỐN
Trong một nghiên cứu mờ lâm sảng ngẫu nhiên trên những bệnh nhân khảng retrovirus naive
(GS-Ol-934), bệnh nhân dùng emtricitabine, tenofovir disoproxil fumarate vả efavirenz trong
144 tuần (dùng như công thức kết hợp thuốc nén emtricitabine/tenofovir disoproxil fumarate,
cộng thêm efavirenz từ tuần 96). Dữ liệu về tính an toản cũa emtricitabine vả tenofovir
disoproxil fumarate phù hợp với thí nghiệm trước đây với các tác nhân nảy khi một trong chủng
được dùng với cảc tảo nhân khảng retrovirus khảo. Các phản ứng có hại được bảo cáo thường
xuyên nhất xem như có thế hay gần như có liên quan với emtricitabine vả/hoặc tenofovir
disoproxil fumarate lả buồn nôn (12%) và tiêu chảy (7%).
Những phản ứng ngoại ỷ nghi ngờ có liên quan tới việc điều trị (ít nhất là có thể liên quan) bằng
các thảnh phần cùa viên kết hợp từ thử nghiệm lâm sảng và trong theo dõi hậu mãi được 1iệt kê
dưới đây theo hệ thống cảc cơ quan trong cơ thế và tân suất gặp phải. Tần suất được xảc định là
rất hay gặp(2 mo), hay gặp(> moo, < 1/10), không hay gặp(Z mooo < 1/100), hiếm gặp (2
1/10 000, < 1/1000) hoặc rât hiếm gặp (< 1/ 10 000) bao gôm cả những báo cảo riêng lè.
Các rối loạn vê hệ máu và bạch huyết:
Hay gặp: giảm bạch cầu trung tính
Các rối Ioạn ở hệ miễn dịch:
Hay gặp: phản ứng dị ứng
Các rói Ioạn vê chuyển hóa và dinh dưỡng:
Rất hay gặp: hạ phosphat mảu
Hay gặp: tăng triglycerid máu, tăng đường máu.
Hiếm gặp: nhiễm acid lactic
Nhiễm acid lactỉc thường kèm theo gan nhiễm mỡ, đã được bảo cáo trong quá trình sử dụng các
thuốc tương tự nucleoside.
Các rối loạn tăm thần:
Thường gặp: giấc mơ bất thường, mất ngủ
Các rối Ioạn hệ thẳn kinh
Rất hay gặp: chóng mặt, đau đầu
Các rói Ioạn hệ hô hấp, ngực, và trung rhất.
Rất hỉếm gặp: khó thở
Các rối loạn ở dạ dảy ruột:
Rất hay gặp: tiêu chảy, buồn nôn, nôn
Trang 9/ 10
Hay gặp: đầy hơi, khó tiêu, đau bụng, lipase huyết thanh tăng, amylase tãng bao gổm amylase
cùa tuyến tụy.
Hiếm gặp: viêm tụy
Các rôi loạn ở gan mật:
Hay gặp: tảng bilirubin mảu, tăng transaminase
Rất hiểm gặp: viêm gan
Các rối Ioạn ở da và mô dưới da:
Hay gặp: nối ban, ngứa, ban dảt—sần, mảy đay, ban rộp, ban mù, và biến mảu da (tăng sắc tổ)
Các rối Ioạn cơ khớp vả mô liên kết:
Rất hay gặp: tăng creatine kinase
Các rối Ioạn thận và tiết niệu:
Hiếm gặp: suy thận (cấp và măn), bệnh lý đầu ống thận bao gồm hội chứng Fanconi, protein
niệu, tăng creatinine.
Các rối Ioạn toản thân và lại nơi dùng thuốc:
Hay gặp: đau, suy nhược
Ngoài ra, thiếu mảu lá hay gặp và biến mảu da (tăng sắc tố) lả rất hay gập khi dùng emtricitabine
cho bệnh nhân nhi.
Các ghi chép về phản ứng ngoại ý ở bệnh nhân bị nhiễm đồng thời HIV/HBV hoặc HIV/HCV
cũng tương tự như bệnh nhân chi nhiễm HIV. Tuy nhiên, đối với nhóm bệnh nhân nảy, sự tăng
AST vả ALT xuất hiện thường xuyên hơn so với nhóm bệnh nhân nhiễm HIV nói chung.
Liệu phảp kháng retrovirus kểt hợp thường kèm theo các bất thường chuyến hóa như tăng
triglycerid mảu, tăng cholesterol máu, để khảng insulin, tăng đường máu và tăng lactat máu.
Liệu phảp kháng retrovirus kết hợp cũng kèm theo tái phân bố mở trên cơ thể (loạn dưỡng mỡ) ở *
bệnh nhân HIV bao gồm mất mỡ ngoại vi và mỡ dưới da mặt, tăng mỡ bụng và nội tạng, phì đại Â
ngực và tích mỡ vùng cổ lưng (bướu trâu).
Những bệnh nhân nhiễm bị suy giảm míễn dịch nặng ở thời điểm bắt đầu liệu phảp khảng
retrovirus kết hợp (CART), có thể xảy ra phản ứng viêm với sự xâm nhiễm không có triệu chứng
hoặc cơ hội sót lại.
Những trường hợp hoại từ xương đã được bảo cảo, đặc biệt ở những bệnh nhân có những nhân tố
nguy cơ đã được nhận biết tống quát, bệnh mv cấp tiến hoặc điều trị lâu dải với liệu pháp kháng
retrovirus kết hợp (CART). Tần số cứa trường hợp nảy vẫn chưa được biết.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng lhuốc.
QUÁ LIÊU
Nếu xảy ra quá liều, bệnh nhân phải được giảm sảt chặt chẽ về cảc dấu hiệu ngộ độc vả được ảp
dụng các biện pháp hỗ trợ tiêu chuẩn khi cần thiết. Tới 30% liếu emtricitabine và khoảng 10%
liếu tenofovir có thế loại bỏ bằng cách thẳm tảch mảu. Hiện còn chưa biết có thế loại bò
emtricitabine hoặc tenofovir bầng thẩm phân phúc mạc hay không.
ĐÓNG GÓI : Hộp 1 vi 10 viên nén bao phim.
THỜI HẠN SỬ DỤNG: 24 thảng kế từ ngảy sản xuất.
Không dùng thuốc quá hạn sư đung.
BẢO QUẢN: Không quá 30°C. Trảnh ảnh sáng.
Đọc Kỹ HƯỚNG DẨJ~J SỬ DỤNG TRỰỚỌ KHI DÙNG. _
NEỊJ CANỊTHEMI THONG TJN, XĨN HQI Y KIỆN BAC SI. _
GIƯ THUOC TRANH XA TAM TAY CUA TRE. PHÓ CỤC TRUONG
APC PHARMACEUTICALS AND CHEMICALS
43 Vikas Centre, 106, SV Road Santacruz (West), Mumbaỉ 400_054
At: Plot No. J-76 MIDC Tarapur, Boisar 401 506 Dist. Thane, An Đi:
Trang 10/10
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng