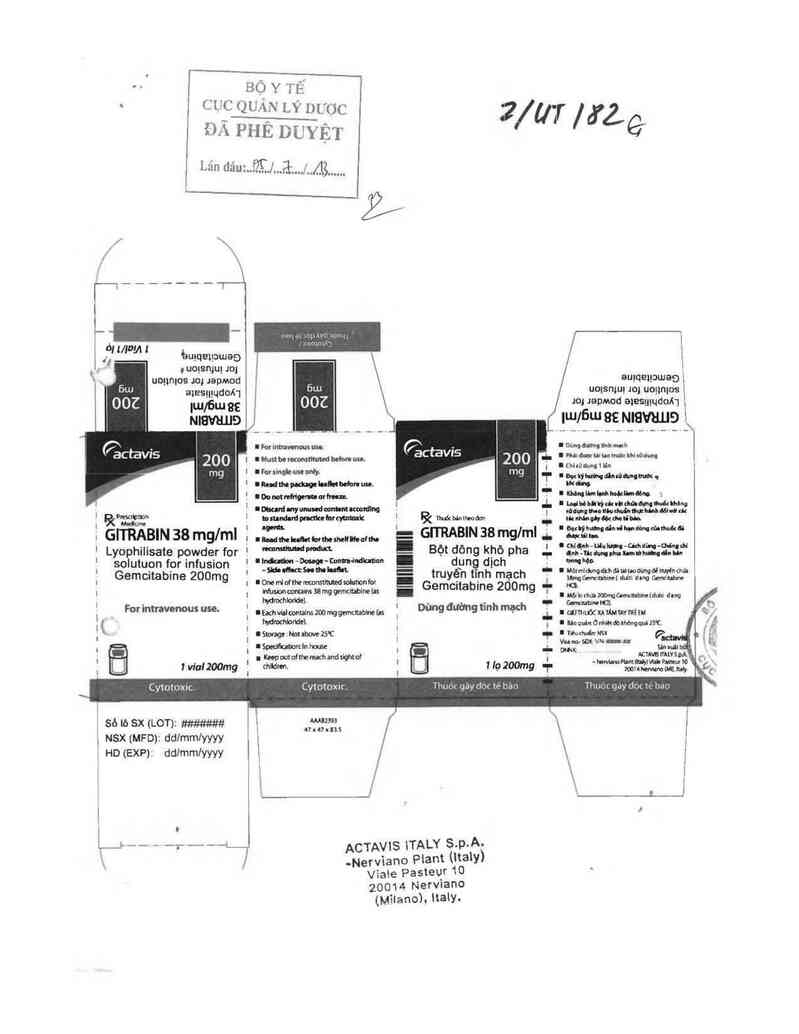











BỘ Y TẾ
, cuc QUAN LÝ D…C
ĐÃ PHÊ DUYỆT
Lz`in dauf’TJ'đ/AỄ
r J …. ,1JpAÊU Jiflvu;
ỎI mm ! è "“"“
- mqeuowao
. uoqsn;ug JOJ
uoumos .IOJ Jâpmod
axesmudM1
l…l6w se
NISW.UĐ
IFocinmvmousuu.
! lMustbemonstltmedbefomuu.
l IForsingleusemly.
' Ikuđtheudupblflưbchmm.
' IDomlnMWcrfrnn.
I Mld my umud mhnt umudlng
bshndlrdpndkehuyủtnxk
lụlù.
lRudìhcthbtđưshdllíeơídu
man
|
|
|
|
|
[ llndqdm—Deuoe-Cnnn-iMlmảon
. -summam
| IOnemidlhemfflìhleđsohưnnbr
, híusionwnu'mưmggemdnhlndu
|
I
|
|
|
|
I
GliỂẢBIN 38 mglml
Lyophilisate powder for
solutuon for infusion
Gemcitabine 200mg
GITRABIN 38 mglml
Bột dông khô pha
dpng dịch
truyền tĩnh mạch
Gemcitabine 200mg
lydroch lon'de].
| M viilcomalns 200 mg guncnablne [a
bydrochlnride].
ISloragezNolabơueB'f
ISgeufuam' ' ư.lnhouse
I Ktepouiofifemachandsiglưol
cthren.
For intravenous use. Dùng đường tĩnh mạch
.`
C1
LIJ
+ I— 1+ ] —I— [ 1-l l—F-l1—
1 vlal²OOmg
Cy10toxic.
! lọ 200mg
Cytotoxic. Thuỏc gáy doc tè báo
sò lò SX (LOTJz …
NSX (MFD): ddlmmlyyyy
HD (EXP): ddlmmlyyyy
47 x 47 I 51.5
ACTAVIS 1TALY S.p.A.
-Nerviano Plant (Ita1y)
Vìa\e Pasteur10
20014 Nervìano
(mĩlano). 1taly.
7/Ừ'Ỉ |ấểe
l
eumeuouuae l
uo;sn;ug Jo; uoumos l
Jo; mpmod azesụquoh
l
l…J6m 8s Nlavưua 1\
I nưngaưm;mnmh
. PhiìMu'lmmkhùửdanq
I€Mnửdunoliln 1
u…ýMhdlmMnoMu
……
I magunlụmhoulhnuu -
I uuunnỷdnụimammmug
uMwnhcllủchuinlhưlúnhưlvlck
Ianngbydỳcdwh'bh
I m:tẹnmanloụdùngủamkni
mung.
l Cquh—Lluhnm—Cn'ùding-Nngdi
I_nh-mm;hụlnúhưhuan
°°MMs
' Mỏlmlúmgdkhđimmm'mgđítnqlnchù
]ùqufmnhblml đil'Ji Glng Cưưưiuhư
Hí!
I ma b mcg mmủ'ùblmlđủỉ duvg
chmbme PD).
I dmmóc uuumme …
: … uuln. ơn… m khđngquđ …;
I ne…mh: … ữ . r
Vham-SĐK vN~m-u su: …
. ]
MK ›cnvs mưst
- Ne…th(hMVU: qur …
Thucìc gáy dòc te bao
,,
«.
v
›?
0.
o
›`
er
Z/aT— 22
ru mmmnus mfusmu mu
nermsllu tìnn
GITRABIN 38mglml
rufaztunu ty
Lynphllìsau puwnulnr sclulinu
xbuts
ínr mfuilon Glmcỉtahlnn 200mg MMJm Par— mm»in hsw :
mu unlnn(Ulị u»;
qu' nnul ưFCI MJtMWyyy EXP un…wyyyy
ACTAVIS ITALY S.p.A.
-Nerviano Plant (Italy)
Vỉale Pasteur 10
20014 Nerviano
(Mìlano), Italy.
th - Thuốc bán theo đơn
GITRABIN 38 mglml (Lọ 200 mg)
Bột đông khô pha dung dịch truyền tĩnh mạch Gemcìtabin 200 mg
Dung dịch sau tái tạo dùng để truyền chứa Gemcitabin 38 mglml
CẢNH BÁO ĐẶC BIỆT:
Chỉ dùng lheo sự kê đơn căn bác sĩ.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cần thêm thông tin, xin hỏi ý kiểu bác sĩ.
Xin thông báo cho bác sĩ biêỉ các tác dụng không mong muốn xảy ra !rong quá !rình sữ dụng.
Đểlhuốc xa tấm tay rrẽ em.
Không dùng thuốc đã quá hạn sử dụng.
THÀNH PHẨN:
Mỗi lọ bột đông khô có chứa:
Hoạ! châ'l: Gcmcitabin hydrochlorid tương đương vỏi Gcmcitabin ........................... 200 mg
Tá dược: Mannitol, natri acetat, natri hydroxid. b
DƯỢC LỰC HỌC:
Gcmcilabin có tính đặc hiệu chu kỳ tế bảo, chủ yếu đối với tế bảo trong giai đoạn tổng hợp DNA
(phasc S) đống thời ngãn chặn sự tiến triển của tế bão qua ranh giới cũa giai đoạn GllS.
Gemcitabin được chuyển hoá trong tế bão bởi mcn nuclcosidc kinasc thânh điphosphate (dFdCDP)
vả triphosphatc (dFdCTP) nuclcosidc có hoạt tính. Tác dụng độc tế băo cũa Gemcitabin là do kểt
hợp tác dụng ức chế tổng hợp DNA của diphosphate vả triphosphate nuclcosidc. Trước hết,
Gemcitabin diphosphatc ức chế ribonuclcotidc rcductasc, lã mcn xúc tác phãn ứng tạo
deoxynucleoside triphosphates (dCTP) để tổng hợp DNA. Tác dụng ức chế mcn nảy lảm giâm
nổng độ deoxynuclcosidcs, trong đó có dCTP. Thứ hai. Gcmcitabin triphosphatc cạnh tranh với
dCTP để gắn vão DNA.
Tác dụng giãm nổng độ dCTP trong tế băo gia tăng sự gắn kết của Gemcitabin triphosphatc vâo
DNA (sclf—potcntiation). Sau khi Gcmcitabin nucleotide gắn kểt vâo DNA, chỉ có thêm một
nucleotide được thêm văo chuỗi DNA đang phát triển. sau đó sẽ ức chế quá trình tổng hợp tiếp …
. . , _, . , . . . 1 VIS ITAL
theo cua DNA. DNA polymcrasc epsxlon khong the loạt bo dược Gcmcuabm nucleotide Vàfễỹềiano Plal
chữa được chuỗi DNA đã được hình thânh (kết thúc chuỗi bầng cho chắn — maskcd chạ'ynme Paste
termination). Đối với tế bảo CEM T lymphoblastoid. Gemcitabin gây phân doạn DNA giữa nhâ210014 NeF
thúc đẩy quá trình huỷ diệt tế băo theo chương trình định trước. được gọi lã “apoptosis”. (Milano),__l
Gcmcitabin vã cisplatin có hoạt tính hiệp lực với nhau phụ thuộc liễu ín vitro. Không quan sát '
được tác dtmg của Cisplatin tăng tích luỹ Gemcitabin triphosphatc hoặc phá vỡ chuỗi kép DNA. [n
w'vo, Gcmcitabin có hoạt tĩnh khi kểt hợp với cisplatin trên mô ghép phổi người LX—l vả CALU—ô
nhưng chỉ có hoạt tĩnh hạn chế trên mô ghép NCI—H4ÓO hoặc NCI~HS20. Gemcitabin hiệp lực với '.
cisplalin trên mô ghép phổi chuột Lewis. Dùng Gcmcitabin 4 giờ trước cisplatin tạo ra tương tác 5
tốt nhất.
DƯỢC ĐÒNG HỌC:
Hã]r› thu vè phân bố:
Dược động học của Gemcitabin được nghiên cứu trên 353 bệnh nhân với các dạng ung lhư khác
nhau. Các thống số dược động học thu được từ các bệnh nhãn có thời gian điều trị khác nhau bao
gổm cả truyền nhanh (<70 phút) và trưyến kéo dãi (70 ~ 285 phút). Tổng liếu Gemcitabin tử 500
đểu 3600 mg/mz.
Thể tỉch phân bố của Gcmcitabin tãng lên theo thời gian truyền. Khi truyền nhanh (<70 phút). thể
tĩch phân bố đạt so L/ m², khi trưyền chậm, thể tích phân bố tảng lên 370 L/m².
Gemcitabin có được động học tuyến tĩnh được mô tả bởi mô hình 2 ngãn. Phân tích dược động học
Trang 1 | 10
quấn thể vđi các chẻ.r độ liẻu đơn vì đa liẻu cho thấy thể tích phin bố cùa Gcmcỉtabin inh hưởng
nhiẻu bởi giđi tinh vù thời gian truyền. Độ thanh thâi ânh hưởng bởi tuổi vì giơi. Sự khảc biệt về
độ thanh thăi vì thể tích phân bố theo cđc địc điểm bệnh nhân hoac thời gian ưuyèn lim thay đổi
thời gian bán thỉi vi nông độ trong huyết tương.
Chuyển Ma:
Chuyển hóa thuốc cũa Gemcitabin được nghiên cứu trén 5 bệnh nhân vđi liếu đơn 1000 mglm²/3O
phút. Ttong vòng ! tuấn. 92% — 98% liêu được chuyển hóa. chủ yểu được băi tiốt văo nưđc tiểu.
Gcmcitabin (<10%) vì sân phẩm chuyển hoá urac'tl khỏng hoạt tính lã 2'—deoxy—Z'. 2'-
dilluorouridinc (_dFdU). chiếm 99% Iiẻu bâi tiết. Săn phẩm chuyển hoá dFdU còn dược phđt hiện
trong huyết tương. Gcmcitabin hấu như không két hợp vđi protein huyết tương. Chất chuyển hóa
còn hoạt tính Gcmcitabin ưiphosphat có thể được bhi tiểt tử tế báo đơn nhãn máu ngoại vi. Thời
gian bán thăi đ pha thâi trừ của Gcrncitabin ưiphosphat tử tế bão đơn nhân đụt từ 1.7 đến 19.4 gìờ.
Thai trừ:
Độ thanh thii vã thời ginn bín thii của Gcmcitabin ở những bệnh nhân tiếu biểu:
Tuổi Độ thanh thải nam Độ thanh thái nữ Thời giln bán thii“ Thời ginn bín thải"
(Ugiờlmở (Ugiờlm’) Nam (phút) Nữ (phút)
29 92.2 69.4 42 49
45 75,7 57.0 48 57
65 55.1 41.5 61 73
79 40.7 30.7 79 94
' Thời gian bin thăi ở bệnh nhân truyền nhanh (< 70 phút).
Gemcitabin truyền nhanh có thời gian bín thit 42 ~ 94 phút. ưuyẻn kéo dãi li 245 — 638 phút. phụ
thưộc vầo tuổi vã giơi. phăn ánh thể tich phân bố tãng cao khi truyền kéo dâi. Độ thanh thâi thĩp
hơn ở phụ nữ vì người có tuối gia tăng nông độ Gcmcitahin cho tất cả các liêu sử dụng.
cui ĐỊNH:
Ung thư buđng rrứng: .
Gcmcitabin phối hợp vđi carboplntin ưong điếu u-i ung thư buông Ẹtiển tríển đã tđi phát tối
thiểu 6 thđng sau khi kết thúc điêu ưị platin.
Ung thư vú:
Gcmcitabin két hợp vơi pactitaxcl lả trị liệu ban đấu cho bệnh nhãn ung thư vú đi căn mã trưđc đó
đã thí t bại vđi nhóm anthracyctin. Ngoại trừ các trường hợp chống chỉ định vđi nhóm anthracyclin
Ung thưphổi khỏng Iểbùo nhỏ ( NSC LC ):
Gcmcitahin sử đụng phối hợp cisplatin trong điếu trị ban đấu NSCLC tiến triển tại chỗ. không
phẫu thuật được (giai đoạn Illa hoac Hlb) hoặc di cln (giai đoạn IV).
Ung thư Iuỵ:
Gcmcitabin II một chọn lựa cho điếu tri bưđc đẩu cho carcinom tuyển tuỵ ác tính tại chỗ ( khòng
phấn thuũt được. giai đoạn 11 hoặc 111) hoặc di căn (giai đoạn IV). Gcmcitabin cũng được sử dnng
cho bệnh nhân đã điếu tri vđi 5-FU .
Ung lhư bảng quang: carcinom tế bâo tuyển (TCC) bã ng quang có đi cãn.
Gemcitahin sử dung đơn độc hoác phối hợp vđi cisplatin lã một chon lưa cho điêu trị tuyến ! TCC
bảng quang có di cãn giai đoạn IV (tiến triến tụi chỗ hoặc đi cãn).
uỂu LƯỢNG vÀ cÁcn DÙNG:
Thưốc dùng đường ưưyẻn tĩnh mạch. Dùng theo sự chỉ dẫn cũa bác sĩ điếu tn`.
Chỉ được sử dụng Gcmcitnbin hydrochlorid dưđi sự theo dõi cũa bác sĩ có kình nghiệm về hot tn“
liệu cảc chí t độc đối vđi tE bâo.
Qộì.vsiị_nzưđttđn
Sử đụng đơn độc:
Ung thưtuỵ: Gcmcitabin được sử dụng vđi liều 1000 mg/m2 truyền tĩnh mạch trong vòng 30 phút
cho mỗi tuấn kéo dăi 7 tuần (hoặc cho tơi khi biếu hien độc ttnh tđi mưc độ phâi giãm tiẻu hoặc
ngừng thuốc) vì sau đó nghỉ 1 tuấn. Đợt kế tiếp lã ! lấnltuấn. kẻo dâi trong 3 tuấn vì nghỉ ở tuần
Trang 2l 10
-`
-.D
thứ 4.
ủlúg Liêu cấn hiệu chinh theo mức độ độc ttnh máu ở bộnh nhân (tham khão phẳn Lưu
ý); phụ nữ về người có tuổi có độ thanh thỉi tth vì có độ dung nạp thấp vđi liẻu kế tiểp (tham
khảo phẳn Dược động học). Trưđc khi truyền Gcmcitabin bệnh nhân cẩn kiểm tra công thức máu
bno gỏm các loại bạch cẩu vè tiểu cẩu. Nén có biểu hiện ửc chế tuỳ cẩn tham khâo “Bâng hiệu
chỉnh liéu' để điêu chĩnh tiếu hoặc ngửng thuốc.
Bãng !. “Băng hữu chính It'ểu "
Số lượng bụch cấu hụt (x 56 lượng tiểu cẳu % liều đẩy đủ
iO°JL) (x 10°1L1 m»
2 l.fflO vi 2 100.ffl0 100
500—999 hoặc 50,000 - 99.000 75
< 500 hoặc < 50,000 Ngừng thuốc
Chửc ning gan vã thận như transaminase vã creatininc huyết cấn được kiểm tn thường xuyến
ưưdc vi sau khi điêu trị. Đối vđi bệnh nhân suy giăm đáng kể chức nin; gan hoặc thặn cấn đặc
biệt chú ý khi sử dụng Gcmcitabin. do các nghiên cứu lim sảng chưn đủ để xác đinh Iiẻu khuyên
dùng.
Đối vđi bệnh nhin đã kốt thúc tohn bộ đợt điếu ưị ma lượng bạch cẩu hạt ›1.500 x iO°JL. iiẻu ctu
>100.000 x 10°/L, các độc tinh khỏtig thuộc máu khỏng vượt quá Class 1 theo WHO. đợt điếu trị
kể tiếp có thế tlng 25% liêu.
Phối hợp vđl cỉc thuốc khđc /
fflfflMggM: Có 2 phác đồ điếu trị đã được ién cứu tuy nhien chưa mé xác
định phác đô nầo ưu việt hdn (tham khảo phấn thử nghiệm lâm săng). Đđi vđi phác đó 4 tuấnlđợt.
Gemcitabin được truyền tĩnh mạch trong 30 phút vđi liẽu 1000 mglm2 vâo các ngây thơ 1. 8 vì 15;
cisptatin 100 mglm² được tiêm tĩnh mạch vâo ngìy thứ 1 sau khi truyền Gemcitabin. Đối vđi phác
đồ 3 tuấnlđợt. Gemcitabin được truyền tĩnh mạch trong 30 phút vơi liêu 1250 mglmz vão các ngầy
thứ 1 vì 8; cisplatin 100 mglmz được tiếm tĩnh mạch vâo ngãy thử 1 sau khi truyền Gemcitabin.
Ẹịệgthlgltịiệu; Khi có độc tính máu cẩn hiệu chỉnh liêu đối vđi cả Gemcitabin vã cisplatin. Hiệu
chỉnh liẻu Gemcitabin dựa tren số lượng bạch cẩu hạt vã tiếu cấu trong ngăy dùng thuốc. Trưđc
khi truyền Gcmcitabin bệnh nhin cẩn kiểm tra công thửc máu bao gỏm các loại bụch cắn vã tiểu
cẩu. Nếu có biểu hiện ức chế tuý cẩn tham khảo "Bẩng hiệu chỉnh liêu" để điếu chỉnh liẻu hoịc
ngừng thuốc. Hìệu chỉnh liẻu đối vđi cisplatin cẳn tham khảo hướng dẫn sử dụng cún nhã sân xuất.
Nói chung. khi có các biểu hiện độc tính khỏng thuộc máu nặng (độ 3 hoặc 4). ngoại trừ rụng tóc
hoặc buôn nòn/nỏn. phác đó phối hợp Gcmcitabin vã cisplatin cẩn tuin thù quyết định của thấy
thuộc ngừng điếu trị hoặc giâm 50% liẻu. Cẩn theo dõi creatinine. kali. calci. vả magnesi huyết
(creatinin huyết độ 314 tăng tỷ lệ tai biến tđi 5% đối vđi phíc để phối hợp trong khi sử dụng đon
độc cisplatin lì 2%).
Qgg thư vú: Đợt điếu ưi 21 ngăy. Gcmcitabin ( 1250 mg/m²) truyẻn tĩnh mạch trong vòng 30 phút
vão các ngãy thư 1 vì 8; và paclitaxcl (175 mglm²) truyền tĩnh mạch trong 3 giờ vâo ngây 1 trưđc
khi truyến Gemcitabin. Trưđc khi ưuyẻn cấn kiểm tra công thức máu. Trưđc mổi đợt điểu m cin
đảm bảo bệnh nhân có lượng bạch cấu hat 21.500 x 10% về tiểu cẩu zmo.ooo x iO“JL.
Híệu chinh liểu: Bệnh nhân có thể phii hiệu chỉnh liêu Gemcitahin do dộc tinh thuộc máu. Việc
hiệu chỉnh liêu cản cứ vâo vâo số lượng bụch cẩu hạt vã tiểu cẩu trong ngây dũng thuốc (ngây thử
8) theo bảng dưOi đây.
Ở 2. Hìệu chỉnh !iểu Gemcửabt'n (sử dụng phối hợppaclímxel) vògggịy 8
Số lượng bạch cẩu ›… sơ lượng tiểu du % liều đẩy đủ
(x io°rL> … xo°a.› …
2 1.200 vã z 75.000 mo
1000—1 199 hoặc so.ooms.ooo vs
700999 vã z 50.000 so
< 700 hoặc < 50.000 NgỆg thuốc
Trang 3] 10
Nói chung, khi có các biểu hiện độc tính không thưộc máu nặng (độ 3 hoặc 4). ngoại trừ rụng tóc
hoặc buổn nôn/nôn, cẩn tưân thủ quyểt dịnh cũa thấy thuốc ngừng điều trị hoặc giảm 50% liều.
Hiệu chinh 1iều đối với paclitaxcl cẩn tham khảo hướng đẫn sữ dụng thuốc.
Ung rhư buổnt7 trứng: Đợt điều trị 21 ngăy, Gemcitabin (1250 mg/mz) truyền tĩnh mạch trong vòng
30 phút Văo các ngây thứ 1 vả 8. Carboplatin được truyền tĩnh mạch Với AUC 4 văo ngảy thứ 1 sau
khi truyền Gcmcitabin. Trước khi truyền cẩn kiểm tra công thức máu. Trước mỗi đợt điểu trị cẩn
đãm bão bệnh nhân có lượng bạch cẩu hạt 21,500 x 106|L vả tiểu cẩu 2 100.000 x 106lL.
Hiên chỉnh liều: Bệnh nhân có thể phải hiện chinh liều Gemcitabin do độc tính thuộc mán. Việc
hiệu chỉnh ]ìều cãn cứ vảo vảo số lượng bạch cẩu hạt và tiểu cẩu trong ngăy dùng thuốc (ngăy thứ
8) theo Bãng 3.
_Jịz_igg 3. Hiệu chỉnh liễu Gemcítabin (sữ dụng phối hợp Carboplatin ) vảo ngãy 8
Số lượng bạch cắu hạt Số lượng tiểu cẩu % liễu đẫy đủ
(x iO'Vi.) (x 10611…) (%)
2 1.500 và z 100.000 100
1000- 1499 vâ/hoặc 75,000-99,999 50
< 1000 vảlhoặc < 75,000 Ngừng thuốc
Nói chưng, khi có cãc biểu hiện độc tĩnh không thưộc máu nặng (độ 3 hoặc 4). ngoại trừ rụng tóc
hoặc buổn nôn/nôn, cẩn tưân thủ quyểt định của thẩy thuốc ngừng diển trị hoac giâm 50% liều.
Hiệu chinh liều đối với Carboplatin cẩn tham khão hướng dẫn sử dụng thuốc.
Đối với đợt điều trị tiếp theo. phác đồ phối hợp Gcmcitabin vả Carboplatin cẩn phải hiện chĩnh
iiểu theo phân ứng độc tính quan sát được. Liều Gemcitabin cẩn được giảm tới 800 mg/mz, truyền
tĩnh mạch vâo ngãy 1 vã 8 nếu xuất hiện độc tính máu:
Lượng bạch cẩu hạt < 500 x lOGÍL trong vòng 5 ngảy
Lượng bạch cẩu hạt < 100 x lOf'lL trong vòng 3 ngăy iỷ
Sốt giãm bạch cẩu trung tính
Số lượng tiểu cẩu < 25,000 x 10%
Trì hoãn điều trị trên 1 tuần
Sau khi giảm liều mã các phân ứng độc tỉnh trên vẫn xuất hiện thì liễu kể tiếp Gemcitabin sẽ
giãm tới 800 mg/mz, chỉ truyền tĩnh mạch ngăy thứ 1.
Ung thưbìme auang: TCC bản quan có di cãn
Đợt điếu trị 28 ngảy, Gemcitabin 1000 mglm7 truyền tĩnh mạch trong 30 phút văo các ngảy ], 8 và
15. Cisplatin 70 mglm2 tiêm tĩnh mạch ngảy [ sau khi truyền Gemcitabin.
Hỉệu chĩnh líều : tham khão hiệu chĩnh liểu trong ung thư phổi không tổ băo nhỏ.
Hướng dẫn cách pha dung dịch
GITRABIN lộ 200 mg Gcmcitabin được hòa với 5 ml dung dịch tiêm truyền NaCl 0,9%; lọ 1000
mg Gemcitabin được hòa vôi 25 ml dung dịch tiêm truyền NaCl 0.9%. Lắc kỹ để thuốc tan hốt.
Dung dịch hoà tan năy có nỗng độ Gemcitabine 38 mg/ml và có thể được dùng ngay hoặc được
tiếp tục pha loãng với dung dịch NaCl 0,9'7r sao cho đạt nống độ không nhỏ hơn O,lmglml trưởc
khi tiêm truyền.
Pha loãng dung dịch thuốc với dung dịch tiêm truyền NaCl 0.9% hoặc Dextrosc 5% sao cho đạt
nồng độ không nhỏ hơn O,lmglml trước khi trưyền.
Nỗng độ của Gemcitabin không nên vượt quá 40mg/ml hoặc nhỏ hơn O,lmglmL Nổng độ dung
dịch Gemcitabin lớn hơn 40 mglml có thể dẫn đến tình trạng không hoà tan hoãn toân.
Sau khi pha loãng, dung dịch phãi không có cặn vả không đổi mảu. Nếu có cặn hoặc đổi mảu phải
bỏ đi. Nên dùng dưng dịch ngay khi mới pha, phẩn dung dịch không dùng đến phãi được huỷ bỏ.
Không được trữ dung dịch sau khi pha trong tủ lạnh vì có thể lăm xuất hiện sự kểt tinh.
Sự tương thich của Gcmcitabin với các thuốc khác chưa được biết rõ. Không được trộn lẫn
Gcmcitabin với các thuốc khác hoặc dịch pha loãng của thuốc khác. Không có sự tương kỵ giữa
Gemcitabin với chai, túi hay dây truyền polyviny] clorid.
Cẩn tuân thủ các qui định an toân về pha chế Vả huỷ bỏ của các sản phẩm độc tố băo. Phâì mang
Trang 4/ 10
gãng tay bão vệ. mặc Ao choâng. Nểu bị dung dịch Gemcitab'm dinh len tay hoặc niệm mạc phâi
rửa nhe nhãng vđi nưđc sạch.
CHỐNG cai mua:
Chống chỉ định Gemcitabin đối với bệnh nhân được cho lù quá mẫn câm vđi thuốc (xem Di ửng
trong phẩn “Tác dụng không mong muốn ').
KHUYẾN cÁo VÀ THẬN TRỌNG:
Lưu ý I_thi sử đung:
QLụịj: Kéo dãi thời gian truyền quá 60 phút vã rút ngẩn tiêu dưới 1 tuấn có thể tlng độc tinh.
M Gemcitahin có thế ưc chế chức năng tuỳ xương vđi các biểu hiện như giăm bạch cẩu,
giăm tiểu củ vù thiểu máu ( xem phẩn Tác dụng khỏng mong muốn). Độc tính t1'c chế tuỳ thường
phụ thuộc liếư Bệnh nhân cẩn dược theo dõi trong quá trình điêu tri. Xem phấn liêu lương và cích
sử dung cho khuyến cảo hiệu chỉnh Iiẽu.
effl: Độc …… phối đi đươc báo cáo khi sử dụng Gemcitabin. Trong trường hợp độc …… phổi
nặng. cẩn ngừng sử đụng thuốc vã có chế độ chăm sóc hỗ trợ thỉch hợp.
Ịịẻa: Hội chứng urê huyết tan máu vălhoặc rối Ioạn chức nãng thận đã được báo cảo sau khi sử
đụng Gemcitabin. Suy thận cẩn phâi lọc máu hoặc đẫn đểu tử vong rất hiếm khi xảy ra. Hấu hết
các trường hợp suy thận dẫn đểu tử vong đẽo do hội chưng urê huyết tan míu.
Qgg: Độc tỉnh gan mửc độ nặng bao gỏm suy gan vì tử vong rất hiếm gặp ở bệnh nhân sử dụng
Gemcitahin đợn độc hoặc phối hợp vơi các thuốc khác có khả nãng gây độc gan.
Thân trong:
TMn trgug chung: Bệnh nhân điêu tn“ vđi Gcmcitabin cỉn được theo dội c ch” bởi thấy thuốc
có kinh nghiệm trong hoả trị liệu. Hẩu hết cảc tác dụng không mong muốn ể hỏi phục được
vì không cln phâi ngừng thuốc mặc dẩu có thể bỏ hoặc giâm một văi liẻu.
Qég ;,él uglu'ệm cận lãm sãug: Bệnh nhân cắn được theo dõi công thức mảu trưđc mõi liẻu
Gemcitabin. Khi có ức chế tuỳ cấn giăm hoặc điêu chỉnh liều (xem Liêu lượng vã cích dùng).
cm náng gan vè thặn cấn được kiểm tra ưưđc khi bđt đấu điêu trị vi đinh kỳ … điếu ưị.
Khả uđng gịỵ ung lbự, g_ịỵffl @ :, ịnh hưởng Qị'g kịă ụđng ;inh ;ăn : Chưa có nghiên cứu lâu
dăi trẻn động vặt thưc nghiệm để xác địng khi nã ng gây ung thư của Gemcitabin. Gemcitobin gây
đột biến in vitro tể bầo Lympho chuột ( L5178Y). Gemcitabin không có tác đung biến đối nhiễm
sẩc thể khi nghiên cứu in vivo vđi Ames. không tãm sai lệch nhiẽm sẩc thể in vitro, không gãy
tổng hợp bẩt thường DNA in vitro. Gcmcitabin tiêm mìng bụng chuột đưc với liểu 0,5 mg/kglngây
(khoảng 1/7001iêu cho người tính theo mglm²) tăm giảm khả nãng sinh tinh trùng mưc độ vừa đến
nộng. Khả ning sinh sản cũa chuột cđi không bị ănh hưởng nhưng độc tính đối vđi mẹ dã được
quan sát vđi tiéu tiếm tĩnh mach 1.5 mg/kglngây (khoảng 1l200 liếu dùng); độc tính vơi thai vã
chết thai được quan sát ở liẻu úém tĩnh mẹch 0.25 mglkg/ngầy (khoảng 1l13001iẽu ở người).
Eêab_nhậmmjị Độ thanh thãi của Gemcitabin được báo cđo phụ thuộc tuổi. Tuy nhiên không
có bằng chưng cẩn thiõ't phâi có hiệu chỉnh tiẻu ở bệnh nhân trẽn 65 tuối (ngoãi khưyến cảo hiệu
chỉnh tiếu ưong phẩn Liều lương vã cách đùng). Kểt quả nghiến cửu đối vơi Gemcitabin dũng đợn
chẩt trên 979 bệnh nhăn cho thẩy tỷ tệ tác dung không mong muốn tương tự cho cả hai nhóm ưện
vã dưới 65 tuối. Ở người cao tuổi thường bị giâm tiều cấu độ 3/4.
Qig' fí_r_th: Độ thanh thâi của Gemcitabin được báo cđo ãnh hưởng bởi giới tinh Tuy nhiên. theo
ké't quả nghiến cứu độ an toân khi sử dụng Gemcitabin đơn châ't không có bầng chứng cẩn thiết
phải hiệu chỉnh 1iếu ở phụ nữ. Tỳ tệ tíc dụng khõng mong muốn tương tư giữa nam vì nữ. tuy
nhién phụ nữ có tuổi thường có khuynh hướng khỏng tiếp tục đợt điếu tri tiểp theo vì có giảm
bạch cấu ưung tinh vả giảm tiểu cấu độ 3/4.
[chm Hiệu quả của Gcmcitabin ở trẻ em chưa được báo cáo. Nghiện cứu pha 1 ở bệnh nhân nhi
ung thưbạch cẩu có kháng chỉ ra liẻu chịu đựng tối đa của Gcmcitabin It 10 mglm²lphũt trong 360
phút. 3 Iẳn trong 1 tuấn sau đó nghỉ 1 tuấn. Một nghiến cửu pha 2 đối vđi 22 bệnh nhãn leưkemia
nguyen bùo lympho cấp tái phát vã 10 bệnh nhân 1eukemin tuỳ cấp sư dụng Gemcitabin 10
mglm²lphtit trong 360 phút. 3 lấn trong ] tuấn sau đó nghỉ 1 tuấn. Độc tính quan sát tượng tự nhưò
Trong 51 10
ACT
—Ner
người lớn hao gỏm ưc chế tuỳ xương. sốt giảm bạch cẩu ưung tinh. tãng transaminasc huyết. buổn
nòn vi nổi ban đỏltróc vỉy. Khỏng có hoạt tính lâm sâng có ý nghĩa được ghi nhận trong nghiến
cứu pha 2 nây.
WũmslfflaMamMuhđm Gemeinbin cẩn dược sử dụng thân trọng ở bệnh
nhân trưđc đó đi suy giâm chức nđng thặn hoặc gan do chưa có đủ thỏng tin lâm sing để chi ra
1ìêu khuyến dùng cho những bộnh nhin nãy. Sử đụng Gcmcitabin ở bệnh nhân đóng thời có đi cđn
gan hoặc có tiến sử viêm gan. nghiện rượu. hoặc xơ gan có thể lâm trlm trong tình trạng gan.
M Chưa có nghiến cửu tượng tác thuốc địc biệt được báo cáo. Thông tin về dược
động học cùa Gemcitahin vì cisplatin khi sử dụng phối hợp xem phẳn Tương tác thuốc.
Xg m“: Chưa xiy đưng được phíc đó hiệu quả vè an toân sử dụng đỏng thời Gemcitabin vã xa trị.
Tổn thường mô lien quan đến độc tlnh tia xạ tả những báo các chủ yếu khi kết hợp đỏng thời hoác
không đông thời xạ tri vđi Gemcitabin.
Kết hợp khỏng đông thời (cách nhau › 7 ngây): Kết qui phđn tích đã không chi ra sự gia ting độc
tính khi Gemcitabin được sử dụng cách xa trén 7 ngây trước hoặc sau xạ tri. Kểt qui gợi ý rầng
Gcmcitabin có thể khời đẩu sau khi các tác dụng cấp tỉnh của tia xa đã qua đi hoặc ít nhÍt 1 tuấn
sau xạ trị.
Kểt hơp dống lhời' (sử dụng dốug thời hoặc cảch nhau 5 7 ngảy): Các nghiên cưu tiên lám săng vã
lim sâng đã chi ra Gemcitabin có hoạt tinh nhạy câm tia xạ. Độc tinh lien quan đển mỏ hinh điêu
tri ni y phụ thuộc rít nhiêu yếu tố. hao gổm liêu lượng vã tẳn xuất sử dụng Gemcitabin. liẻu tia xạ.
kỹ thuật xạ trị. mỏ đich vã thổ tich đich. Một nghiên cửu đã sử dụng đống thời Gemcitabin với xạ
tri ngưc trong ô tuấn liến tiểp cho bệnh nhân ung thư phổi không tế băo nhò. Độc tinh chủ yếu bao
gỏm viêm miệng. đac biệt li viem thưc quản vì viêm phổi đi được ghi nhận. địc biệt ở bệnh
nhãn nhân thế tỉch xạ tri lđn (thể tích điêu trị trung hinh 4795 cm’). Các nghiến cửu tiếp theo đã
được báo cáo vi chi ra rằng kết hợp đỏng thời xa trị vì Gcmcitabi i liếu thấp hợn có độc tính
có thể dự tinh được về 11 độc hơn. Tuy nhién chưa có phác đồ phốiỆổt ưu cho tất cũ các đạng
ung thư.
sử DỤNG cao PHỤ NỮ có THAI vÀ CHO CON BỦ:
Thời kỳ có thaí: Gemcitabin có thể lãm hại thai nhi khi sử dụng cho phụ nữ mang thai. Gemcitabin
lì tác nhãn giy độc với thai gây đi dạng thai (hở vòm. cốt hoá khỏng hoãn chỉnh) vđi liẻu 1.5
mg/kglngìy ở chuột (khoắng 1/200 liẽu thường dùng ở người tinh theo mglmz). Gemcitabin gảy
rối loạn động mạch phổi. thiếu túi mật vđi 1iẻu 0.1 mglkg/ngìy ở thỏ (khoâng 1/600 liétt thường
dùng ở người tinh theo mglm²). Độc linh vđi thai đặc trưng bời giâm khá nãng sống của thai. giảm
kich thưđc lửa. trì hoãn phát triển. Chưa có nghiên cứu về Gemcitabin ở phụ nữ mang thai. Nếu
Gemcitabin được sử dụng ở phụ nữ mang thai hoặc nểu bệnh nhãn có thai khi đang sử dung
Gcmcitabin. hệnh nhăn cấn được thõng háo về khi nãng rủi ro đối vđi thai nhi.
Thời kỳ cho con bú: Việc hải tiểt Gemcitahin hoặc các chất chuyển hoá cũa nó vão sửa chưh được
biết đến. Do khá nãng gây ra các tác dung khỏng mong muốn nẽn phụ nữ cho con bú cấn được lưu
ý vã quyết đinh tiếp tục cho con bú hay ngửng thuốc.
ẢNH nướnc TRÊN KHẢ NĂNG LÁ! xe VÀ VẬN HÀNH MÁY MÓC:
Không thấy báo cáo liên quan. Tuy nhiên đã có báo cáo Gemcitabin gảy ngủ gả nhẹ tđi vừa khi
uống cùng rượu. Bệnh nhân cẩn thặn trọng khi 1ái xe hay vặn hãnh máy móc cho tđi khi được xác
định lả không bị ngủ gi.
TUONG TẮC muõc:
Khi sử dung kểt hợp Gemcitahin t1250 mg/m² vio ngăy 1 vù 8) vì cisplatin (75 mg/ml vão ngây 1)
ở bệnh nhãn ung thư phối khỏng tể băo nhỏ. độ thanh thải cùa Gemcitabin vão ngìy 1 lá 128
1Jgiờ/fn2 vã ngây thứ 8 lá 107 ngiờlm’. Đô thanh thăi của cisplatin trong nghiến cửu nây lã 3.94
mt.lphútlmz vđi thời gian băn thâi la 134 giờ (xem Tường tác thuộc trong phđn Thận trong). Phân
tich ctc kết quả ở hệnh nhân ung thư vú di cản cho thẩy nói chung giữa Gcmcitabin vè paclitaxel
khỏng hoặc chỉ ănh hưởng nhe đối vđi dược động học cũa nhau (độ thanh thit vè thời gian bán
huỷ). Kểt quả uén bệnh nhân ung thư phổi không tể bâo nhỏ cho thđ'y phối hợp Gemcitahin vả
Trangó/ 10
15
thí
c !
14
llêf
carboplatin không ình hưởng đến dược động học cùa từng thuốc so với khi sử đụng đớn độc. Tuy
nhiện đo số lượng mẫu nghiên cưu hạn chế vì không tin cậy rộng nến cấn theo dõi sự khác biệt
giữa các bệnh nhin
TÁC DỤNG KHỒNG MONG MUỐN:
Tác đụng khớng mong moô'n khi sử đụng đớn tri
Gemcitabin đã được sử dỤng cho rất nhiẻu dạng ung thư ác tinh bao gôm sử dụng đơn độc hoic
phổi hợp với các thuốc độc tố bâo khíc.
Độc tinh giới han liéu chủ yểu của Gemcitabin lì ưc chế tuỳ. Hiệu chinh liêu cho các độc tinh máu
xem phấn Liêu lượng vì cách dùng.
Kết quả nghiên cứu trên 979 bộnh nhân ung thư đc tính các đạng khác nhau. sử dụng đơn độc
Gemcitabin mõi tuấn. ưuyén trong vòng 30 phút. liẻu bẩt đấu từ 800 đến 1250 mglm². Khoảng
10% bệnh nhân ngừng thuộc do các tác dụng không mong muốn. Trong thử nghiệm so sánh ở bệnh
nhân ung thưtuỵ, tỷ lệ ngửng thuõc 12 14.3% với Gemcitabin so với 4.8% so với S—FU
Hệ mảu: Trong nghiên cứu ở bộnh nhân ung thư tuỵ. ưc chế tuỳ 13 độc tinh giới hạn liêu của
Gemcitabin. nhưng chi <1% bệnh nhân phãi ngừng thưốc do hoãc lã thiếu máu hoặc giâm bạch
cẩu hoác tiểu cẩu. Truyến hống cẳu cẩn thiết cho 19% bệnh nhin. Tỷ lệ nhiễm khuẩn <1%. Đốm
xuất huyết hoac mất máu nhe (xuất huyết) với 151 cả các nguyên 11th được báo cto ở 16% bệnh
nhãn. <1% bộnh nhãn cẩn phải ưuyén tiểu câu. Bệnh nhân cẳn được theo dội vã điếu chinh hoặc
ngừng liẻu tuỳ thuộc vùo mức độ độc tinh hệ máu.
Dường riêu hoá: Buồn nớn vì n6n thường được ghi nhận (69%) nhưng thường với mức độ nhe vã
vừa. Buớn nớn vì nôn mửc độ nịng (WHO Grade 314) xuất hiện ở <1591» bệnh nhãn. Có 19%
bộnh nhin bị in chây. 11% bị viêm miệng.
Gan: Gemcitabin liệu quan tới tãng nhít thời 1 hoặc cả 2 men transaminase ở khoảng 70% bộnh
nhãn. Tuy nhiên khóng có bầng chưng tã ng độc tỉnh gan khi sử dun o dăi hoặc ting tống iiẻu
tlch Iuỹ Gemcitnbin. _ ,
Thận: Các tác dụng không mong muôn thường được báo cáo 1â prote' Ắiệu hoặc huyết niệu mức
độ nhẹ. Cảc triệu chửng lâm sâng cũa hội chưng urê huyết tan máu (HUS) được ghi nhận ở 612429
bệnh nhân (0.25'ử). Trong số đó có 4 bệnh nhân bị HUS trong khi điêu tri Gemcitabin. 2 bi ngay
sau khi điếu tri. Cẩn cân nhẩc chẩn đoản HUS néu bệnh nhân bị thiểu mảu có tan mâu đ mao
mạch, tăng bilirubin hoac LDH. tãng hỏng cấu. giãm tiểu cẩu nặng; vi/hoặc có băng chứng suy
thận (titng creatinin huyết hoặc BUN) cấn ngửng sử đụng Gemcitabin ngay lập tưc. Có thể phầi lọc
thận. Suy thặn có thể sẽ không thể hôi phục,
Sổl: Tỷ te sốt các loại 11 419… Điếu nảy trái với tỷ 1ẹ nhiếm khuẩn uo9m vì chi ra an
Gemcitabin có thể gây sốt khỏng có nhiễm khuẩn lâm sãng. Sốt thường kem theo các triệu chứng
giống như cúm thường mưc đó nhe vỏ có thể kiểm soát vẻ lâm sâng.
Nổi ban đỏ: xuất hiện ở 30% bệnh nhân. Ban đó thường đạng vết hoặc ban dạng hạt sấn ngứa mức
đó nhe hoặc vừa phải ở cả thãn vì đâu chi. Khoảng 13% bộnh nhân bị ngứa.
Phổi: 23% bệnh nhân có ưiộu chứng khó thờ trong đó mửc độ nãng lã 3%. Khó thờ có thể do tinh
tra ng bệnh. ví đụ ung thư phổi (40%) hoặc các triệu chửng ớ phổi do các ung thưác tinh khác. Khó
thớ thường kèm theo co thđt phế quản (<2%). Một vâi báo cáo chỉ ra viêm phối kê lién quan ớè'n
sử dụng Gemcitabin. Khi sử dụng Gemcitabin có một vải trường hợp phù phổi không rõ nguyên
nhi n. Đoa khi triệu chứng phối ở mưc độ nộng cẩn ngờng thuốc vả điêu 111 hỗ trợ thỉch hợp.
Phù: Theo bío cáo. có 13% bệnh nhân bị phù. 20% phủ ngoại vi vã <1% phù lan rộng. Tỷ 1ệ
ngừng thuốc đo phù <1%
Hõi chửng giống củm: “Hội chưng giống cúm" được báo cáo ở 19% bệnh nhân. Cảc triệu chứng
rieng 1ẻ bao gốm sõt. suy nhược. chán ăn, đau đẩu. ho. lạnh vã đau cơ. Sớt vả suy nhược thường
được báo cáo như các triệu chứng riêng biệt. Mất ngủ, viếm mũi. ra mô hội vã khó chiu đôi khi
được bio cáo. Việc ngưng thuốc do các triệu chứng giống cúm xây ra dưới 1% bộnh nhã n.
Nhiễm khuẩn: Nhiễm khuẩn được háo cáo ở 16% bệnh nhân.
Rựng tóc: Rụng tóc được báo cảo ở 15% bệnh nhân.
Trang 7] 10
"A
=’h
st
'ot
). 1
Dớc tỉnh thắn kinh: Tỷ lệ đi câm mửc độ nhe lã 10% vì <1% mưc độ ning.
Thoảr mạch: Các triệu chửng tại chỗ tiêm được ghi nhận ở 4% hệnh nhân. Không có bảo cío vẻ
hoại tử tại vị trí tiêm. Gemcitabin không gây phộng rộp da.
bị ửng: Co thất phế quản được háo cío 0
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng