





BỘ Y TẾ
cục QUẢN LÝ DƯỢC 4]…“(8’2
ĐA PHÊ DUYỆT Ạ
Lãn daubỹi’Ễi/Ổ
ởl M°Mt \ Z
61 aqqupmag 61 ĐmBPUĐD
0015n1u1101 UOISWUI l01
uognos …; :apmcd ưoumos mg apmod
NIGVH.IJĐ NIGVH.UĐ `
il Ru … uu. I Dím … M M
` . m……nguyui u…mam
_ ochùúnqt …
' I MM…dhndhdưewe.
«: Fudldunemiỵ
l Wứnplúlẹlnlhtbúlm 'mgsfflnfflílmm
` IũMnllglIeưiun. .
mlimlựùhịclinm
'ẸTẮJẸẸẸẸỦ'Ủ . J .tqauunwunụmmm
""“ i mẫhỀeưằn QTỄh \
nluddnluũnlurùeMlledh ' R ! ưu. w “
, mqu unszn Mnhmm I ủ "
lĐoc … Inn '
GITRABIN 'ẩẵímẫfĩ'ffl i GITRABIN ', J…………gẳ""
. - ủGÊ Im _ › ` - _ _ .
powderforsoluuon .…………………c Ẹ Bọt phfthanhdung › '8'tzziầf'23ẳưxz.
' ' un… ' ' ' _ ' wma..—
ÍOYII'IÍFSIDP MIcctiỉẵi.mumgnmnlũ - dịd'tđetluyen .….mmumdhẳẵgm'Ễma
Gen'tcttabme1g lEưptemsưỵmzndịủlgodmnm Ề Gemcltahlne1g .. cthmmunenmig
ane. lúlum bJủơide ifhv DH
JQuM.
For lntnvenous use. : Smugz mah… ]ơL
5pưíuim … mu
: mpmtdnre Qathmdugtlnf
m'ldm
. Lotours/ctatn
GPmmahlnc 10me pnwrim ( atton VEỈ wtth cnmquarđ › Vlelndtn ỉ_.
() nem …. wma dvrnenstchs SS Ms wnĩ l PMSâ77 I
. 3 PMS “BÍ
… plỉM prool mx m nhYmỉfndP _ ' ` _.
4 PMS us .
? N…IJ7IJI'Im mgnalmdaư2Uiũ/iũ mnwp _
l muini …… S-W'ỨC !
0 mwumdhiMJm, …. nnqmatec by. CPahl ;,
apt:tovedfol andeave .wsmn cate: 0411 l ,… ĩmanừpm' Nnn Pnnunq Cdours
' PvơNe .
wisec w; C,Pautt đanm 2
Bmer … mu m Mr.
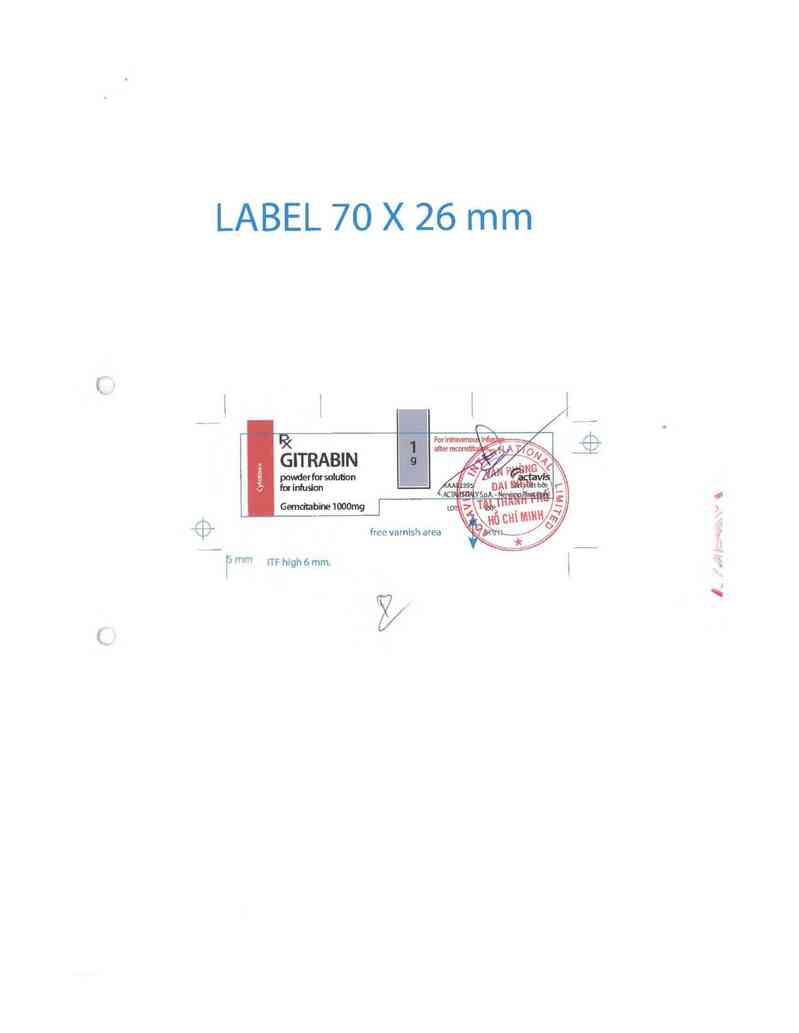
LABEL 70 X 26 mm
me ITF htgh 6 mm. \
Đọc kỹ hướng dẫn sử đụng trước khi dùng
Nếu cần thêm thông tin, xin hỏi ý kiểu bảc sĩ. Thuốc nây chỉ dùng theo đơn của háo sĩ
Rx Thuốc bán theo đơn
THÔNG TIN KÊ TOA
GITRABIN
Bột để pha dung dịch truyền tĩnh mạch.
1. TÊN THUỐC
GITRABIN, bột pha dung dịch truyền tĩnh mạch
2. THÀNH PHÀN ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
1 ml dung dich hoản nguyên để truyền chứa 38 mg gcmcitabine dạng hyđrochloride
Lọ 200 mg: Mỗi lọ chứa 200 mg gemcitabine (dạng hydrochioride). Mỗi lọ 200 mg chửa khoảng 0.15
mmol (3.56 mg) natri.
Lọ Ig: Mỗi lọ chứa 1 g gemcitabine (dạng hydrochloride). Mỗi lo 1 g chứa khoảng 0.77 mmol (17.81
mg) natri.
Danh sách tả dược đầy đù, xem mục 6.1
3. DẠNG BÀO CHẾ
Bột đông khô để pha dịch truyền tĩnh mạch.
Mâu trắng hoặc gần trắn. Sau khi hoản nguyên trong natri clorua 0. 9%, dung dịch trong đển trắng
đục nhạt và không mảu đen vảng nhạt. PH cùa dung dịch hoản nguyên trong natri clorua 0. 9% là 3.0 i
0.3.
Độ thẳm thẩu của dung dich hoản nguyên trong natri clorua o.9% lả 775 mOsm/I.
4. THÔNG TIN LÂM SÀNG
4.1 Chỉ định
0 Gemcitabine được chi đinh để điểu tri ung thư bảng quang tiến triền tại chỗ hoặc di cản kểt hợp
với cispiatin.
o Gemcitabine được chỉ đinh cho điều trị bệnh nhân ung thư biều mô tuyến tụy tiến triến tại chỗ
hoặc di căn
. Gemcitabìne, kểt hợp với cisplatin được chi đinh như biện pháp điều trị đẩu tiên ở bệnh nhân
ung thư phổi khộng phải tê bâo nhỏ tiểu triến tại chỗ hoặc di căn. Gemcitabine đơn tri liệu có
thể được cân nhắc` 0 những bệnh nhân lớn tuối hoặc những người có performance status 2.
o Gemcitabine kết hợp với carboplatin là biện pháp điều trị đầu tiên được chi đinh ở bệnh nhân
ung thư biểu mô buồng trứng tiển triển tại chỗ hoặc di căn, ở những bệnh nhân tải phảt sau
một khoảng thời gian it nhất là 6 tháng sau khi dùng platin.
o Gemcitabine, kểt hợp với paclitaxel, được chỉ đinh dễ điều tri bệnh nhân ung thư vú tái phát tại
chỗ hoặc di căn không thể phẫu thuật. Những bện nhân nảy đã được hóa trị liệu bổ trợ sau
phẫu thuật/xạ trị. Trước khi hóa tri nên dùng một anthracycline, trừ khi có chống chỉ định lâm
sảng.
4. 2 Liều dùng và cách dùng \ /
Liều khuyến cáo Ĩ/
Ung thư bảng quang: Sử dụng kết hợp- Liều khuyến cảo của gemcitabine lả ], 000 m,ng truyền tĩnh
mạch trong 30 phủt. Nên dùng vảo ngây 1,8 vả 15 cùa mỗi chu kỳ 28 ngảy khi kết hợp với cisplatin
Cisplatin được dùng ở liều khuyến cảo 70 mg/m2 vảo ngảy Isau gemcitabine hoặc ngảy 2 của mỗi chu
kỳ 28 ngảy, chu kỳ 4 tuần nảy được lặp lại. Có thể giảm liều sau môi chu kỳ hoặc trong chu kỳ dựa
vảo mức độ độc tính trên bệnh nhân.
Ung thư tụy: Liều khuyến cáo của gemcitabine là 1,000 mg/mz, truyền tĩnh mạch trong 30 phút, lặp
lại 1 lần mội tuần trong 7 tuần, nghỉ 1 tuần. Chu tiểp theo, tiêm tĩnh mạch 1 lần mỗi tuần trong 3
tuần liên tiếp, nghỉ 1 tuần trong mỗi 4 tuần Có the giảm liều sau mỗi chu kỳ hoặc trong chu kỳ dựa
vảo mức độ độc tính trên bệnh nhân.
Ung thư phổi không phải tế bảo nhỏ: Đơn trị liệu - Liều khuyến cáo cùa gemcitab' = ~
mg/mz, truyền tĩnh mạch trong 30 phủt, lặp 1ại ] lần mỗi tuần trong 3 tuần, nghi ] tu ' —
nây được lặp lại. Có thể giảm liều sau môi chu kỳ hoặc trong chu kỳ dựa vảo mức 7
bệnh nhân. Điều trị kểt hợp- Liều khuyến cảo của gemcitabine là 1,250 mg/mz,
trong 30 phủt vảo ngảy I và ngảy 8 cùa chu kỳ 21 ngảy. Có thế giảm liếu sau mỗi
chu kỳ dựa vảo mức độ độc tính trên bệnh nhân. Cisplatin được sử dụng ở liều 75-100 ngm² một lần
mỗi 3 tuần.
Ung thư vú: Điểu rri kết hợp- Dùng Gemcitabỉne kết hợp với paclitaxel được khuyến cáo. Paclitaxel
(175 mg]… ) truyền tĩnh mạch trong khoảng 3 giờ vảo ngảy [, tiêp theo gemcitabinc (1250 mglm2 )
truyền tĩnh mạch trong ngảy l vả ngảy 8 của chu kỳ 21 ngảy Có thế giảm liều sau mỗi chu kỳ hoặc
trong chu kỳ đựa vảo mức độ độc tính trên bệnh nhân. Nên đêm bạch câu hạt toản phấn của bệnh nhân
(tối thiểu lả 1,500 x lOủll) trước khi khởi đầu điểu tri kết hợp gemcitabinc vả paclitaxel.
Ung lhư buỗng trứng: Điểu lri kết 2họp- Dùng Gemcitabine kết hợp với carboplatin được khuyến
cảo. Dùng gcmcitabine (1, 000 mg/m2 ) truyen tĩnh mạch trong ngây 1 và ngảy 8 của chu kỳ 21 ngảy.
Sau gemcitabine, dùng carboplatin vảo ngảy 1 phủ hợp với AUC mục tiêu, 4 mg/ml/phủt. Có thể giảm
liều sau môi chu kỳ hoặc trong chu kỳ dựa vảo mức độ độc tính trên bệnh nhân.
Theo dõi độc tính vả chỉnh Iiều do độc tính
Chỉnh Iiểu do độc tính huyết học. Nên khám lâm sảng định kỳ và kiềm tra chức nảng gan thận để phát
hiện độc tính huyết học Giảm 1ìều sau mỗi chu kỳ hoặc trong chu kỳ dựa vảo mức độ độc tính trên
bệnh nhân. Nhìn chung, những trường hợp độc tính nặng không do huyết học (mức độ 3 hoặc 4),
ngoại trừ buồn nônl nôn, nên ngưng hoặc giảm liều gcmcitabine cho đến khi giâi quyết được vẫn để
độc tính.
Chinh liều do độc tính huyết học:
Khởi đầu chu kỳ: Tất cả chỉ định, nên theo dõi số 1ượngtiều cầu vả bạch cầu hạt trước mỗi liều dùng
Bệnh nhân phải có số lượng bạch cầu hạt toản phần tối thiểu 1ả100, 000 x lOóll trước khi khởi đẩu chu
kỳ điều tri.
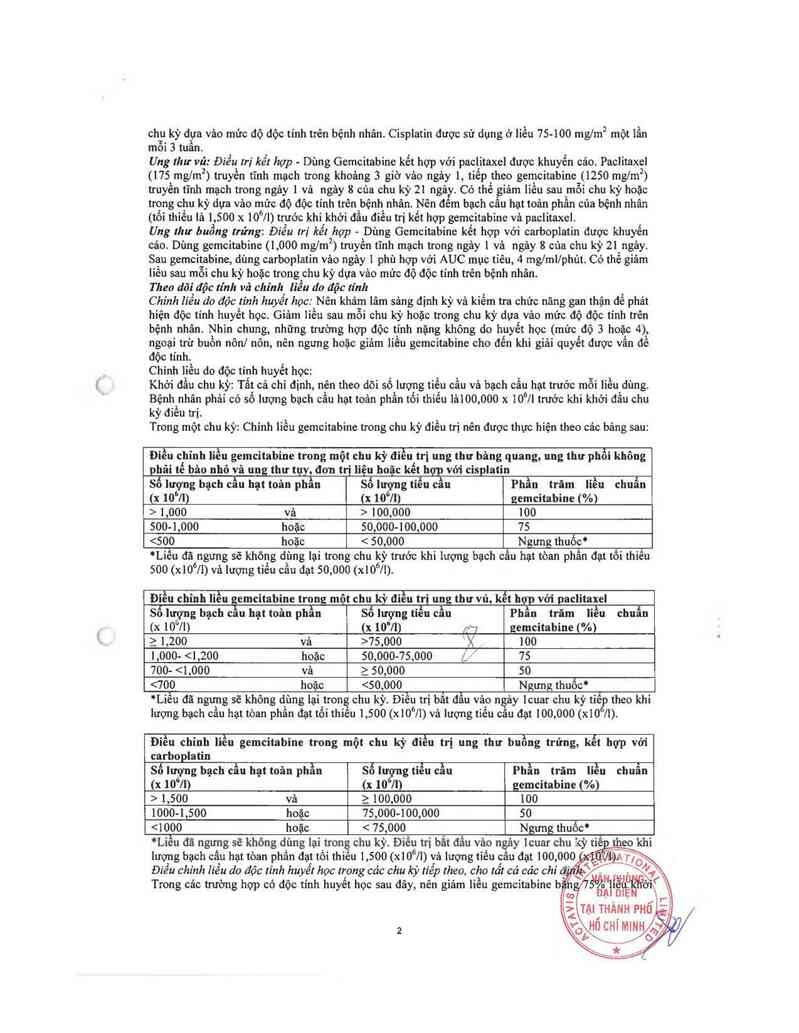
Trong một chu kỳ: Chính liều gemcitabine trong chu kỳ điều trị nên được thực hiện theo các bảng sau:
Điều chỉnh liều gemcitabine trong một chu kỳ đỉều trị ung thư bâng quang, ung thư phổi không
phâi tế bâo nhỏ vè ung thư tuyì đơn tri liệu hoăc kết hợp vởi cisplatin
Số lượng bạch cầu hạt toãn phần Số lượng tiểu cầu Phần trăm liều chuẩn
ụ mm) (x iơ’Vt) gemcitahine (%)
> 1,000 vả > 100,000 100
500-1,000 hoặc 50,000-100,000 75
<500 hoặc < 50.000 Ngưng thuốc°
"Liếu đã ngưng sẽ không dùng lại trong chu kỳ trước khi lượng bạch cẩu hạt tòan phần đạt tối thiêu
soo (xlOỏ/l) và lượng tiêu cần đạt so ,ooo (x106/1).
Điều chinh liều gemcitabine trong một chu kỳ điều trị ung thư vú, kết hợp với paclitaxel
Số lượng bạch cầu hạt toản phẫn Số lượng tiến cầu Phần trăm liều chuẩn
(x lO“llì (x 10"/1) p~y gemcitabine (%)
2 1,200 vả >75,000 )( 100
1,000- <1,200 hoặc 50,000-75,000 /,’ 75
700- <1,000 và 2 50,000 50
<700 hoặc <50, 000 Ngưng thuoc“
*Liểu đã ngưng sẽ không đùng lại trong chu kỳ. Điều trị bắt đầu vảo ngảy lcuar chu kỳe tiề theo khi
lượng bạch câu hạt tòan phần đạt tối thiểu 1 ,500 (x106/1) vả lượng tiểu câu đạt 100, 000 (x1 II).
Điều chinh liều gemcitabine trong một chu kỳ điểu trị ưng thư buồng trứng, kểt hợp vởi
carhoplatin
Phần trăm lỉều chuẩn
Số Iượug bạch cầu hạt toân phần
(x 10"/1)
Số lượng tiểu cầu
(x 10%
gemcỉtabine (%)
> 1,500 vả ì 100,000 100
1000-1,500 hoặc 75,000-100,000 50
<1000 hoặc < 75, 000 Ngưng thuốc*
*Liều đã ngưng sẽ không dùng lại trong chu kỳ. Điều trị bằt đấu vâo ngảy lcuar chu' <ỳ tiể '
" itihftihtễĨ
DAI DIẸN
đầu của chu kỳ đầu tiên:
sô lượng bạch cầu hạt toản phần < 500 x 10% kéo dải hơn 5 ngảy
Số lượng bạch cầu hạt toản phần < 100 x 106/1 kéo dải hơn 3 ngảy
Sốt giảm bạch cầu trung tính
Tiểu cầu < zs,ooo x io°n
Chu kỳ bị hoãn trên 1 tuấn do độc tính
Cách dùng
Thuốc được dung nạp tốt trong khi truyền. Nếu xảy ra tinh trạng thoảt m,ạch nên ngưng thuốc ngay
lặp tức vả bắt đầu lại với một tĩnh mạch khảo. Nên theo dõi bệnh nhân cẩn thận sau khi dùng thuốc
Các đối tượng đặc bỉệ!
Bệnh nhản sưy thận hoặc suy gan: Gemcitabine nên dùng thận trọng ở bệnh nhân suy gan hoặc suy
thận do không đủ thông tin từ cảc nghiên cứu lâm sảng về lìếu dùng rõ rảng đối với cảc đối tượng
nảy.
Nguời lớn luối (> 65 tuổi): Gemcitabine được dung nạp tốt ở bệnh nhân trên 65 tuối. Không cần
chinh liều, trừ khi đã được khuyến cảo cho tẳt cả bệnh nhân.
Bệnh nhi (<18 luối): Gemcitabine không khuyến cảo dùng cho trẻ đười 18 tuổi do không có dù dữ
liệu về hiệu lực và độ an toản.
4.3 Chống chỉ định
Nhạy cảm vởỉ hoạt chất hoặc bắt cứ thảnh phần nảo của thuốc
Cho con bù
4. 4 Cânh báo vả biện pháp phòng ngừa:
Tăng độc tính khi kéo dải thời gian truyền và tảng tần suất liều dùng đã được chứng minh.
Độc lỉnh huyết học: Gemcitabine có thế ức chế chửc năng cùa tùy xương với biểu hiện giảm bạch cầu,
giâm tiểu câu và thiểu máu.
Bệnh nhân đùng gemcitabine cần được theo đõi trưởc mỗi liều về số lượng tìểu cầu, bạch cầu vả bạch
cầu hạt. Nên cân nhẳc ngưng thuốc hoặc chinh liều khi phát hiện ưc chế tủy do thuốc. Tuy nhiên, suy
tùy không tồn tại 1âu và thường không dẫn đến giảm liều và hiếm khi ngưng thuốc.
Công thức mảu ngoại VI co the tiếp tục xấu đi sau khi đã ngưng gemcitabine Ở những bệnh nhân suy
chức nảng rủy xương, việc điều trị nên được bắt đầu một cách thận trọng Như các phương phả điều
tri gây độc tế bảo khảc, nguy cơ ức chế tủy tích lũy phải được can nhẳc khi điều trị ket hợp
gemcitabine với hóa trị 1ỉệu khảo.
Suy gan: Sử dụng gemcitabine ơ bệnh nhân có di căn gan đồng thời hoặc có tiền sử viêm gan, nghiện
rượu hoặc gan xơ gan có thể dẫn đễn suy gan trầm trỌng hơn.
Nên thực hiện đánh giá cận iâm sảng chức nảng gan và thận (bao gồm cả kiểm tra virus) đinh kỳ.
Gemcitabine nên dùng thận trọng ở bệnh nhân suy gan hoặc suy thận do không đủ thông tin từ các
nghiên cứu lâm sảng vê liều dùng rõ rảng đối với cảc đối tượng nảy. n_^7
Xạ trị đống thời ( 7 ngây)— Phân tich dữ liệu không thấy tãng độc tính khi
sử dụng gemcitabine cách trên 7 ngảy xạ tri. Dữ liệu cho thẩy gemcitabine có thế được bắt đầu sau khi
những ảnh hướng cấp tính cùa xạ trị đã được giải quyểt hoặc ít nhắt lả một tuần sau khi xạ tri
Tổn thượng bức xạ dã được báo cáo trên các mô mục đích (như viêm thực quản, viêm đại trảng, và
viêm phối) kểt hợp với việc sử dụng cặ hai đồng thời vả không đồng thời gemcitabine.
Tương lác khác: Bệnh sốt vảng vả vẳc-xin giảm độc lực khảc không được khuyến cảo đo nguy cơ
toân thân, có thể gây từ vong, hệnh tật, đặc biệt lả' ơ những bệnh nhân suy giảm miên dich.
4. 6. Mang thai vả cho con bú
Mang thai: Không có đủ dữ liệu về việc sử dụng gemcitabine ở phụ nữ mang thai. Các nghiên cứu
trên động vật đã cho thẩy độc tinh sinh sản. Dựa trên kết quả từ cảc nghiên cứu động vật vã cơ chế tảc
động cùa gemcitabine, không nên sử dụng thuốc nảy trong khi mang thai trừ khi thật sự cần thiết. Phụ
nữ không nên có thai trong khi điều trị với gcmcitabinc và nếu có thai, nên bảo ngay cho bâc sĩ.
Cho con bú: 10tông biết gemcitabinc có được bải tiết trong sữa mẹ hay không và không loại trừ ảnh
hướng xẩu đến trẻ bú mẹ. Do đỏ, nên ngưng cho con bú trong khi điều trị với gcmcitabine
Khả năng sinh sản: Trong các nghiên cứu về khả năng sinh sản, gemcitabine gây giảm sinh tinh ở
chuột đực. Vì vậy, những người đản ông dang được điều trị với gemcitabine không nên sinh con trong
khi điều tri và 6 tháng sau khi điều trị vả cần tư vấn về bảo quản lạnh tinh trùng trước khi điều tri vì
khả năng vô sinh do điểu trị với gemcitabine.
4. 7 Ẩnh hưởng đểu khả năng điều khiến tâu xe và vận hảnh mảy móc
Không có nghiên cứu nảo được thực hiện về ảnh hướng lên khả năng điểu khiển tảu xe và vặn hảnh
máy móc. Tuy nhiên, gemcitabine đã được báo cáo gây buồn ngủ nhẹ đền trung binh, đặc biệt là kết
hợp với uống rượu Bệnh nhân nên được cảnh bảo không nên lải xe hoặc vận hânh máy móc cho đến
khi chắc chẳn không bị ngủ gật.
4. 8 Tác dụng phụ g
Thông bảo vơi bảc sĩ những rác dụng bất lợi gặp phải khi sử dụng thuốc.
Các tác dụng phụ thường gặp nhât liên quan đển điều trị gemcitabine bao gồm: Buồn nôn có kèm
hoặc không kẻm nôn ói, tăng men gan (AST | ALT) vả phosphatase kiềm, được bảo cảo trong khoảng
60% bệnh nhân, protein niệu vả tiêu máu được báo cáo trong khoảng 50% bệnh nhân, khó thờ được
bảo cảo trong 10- 40% bệnh nhân (tỷ lệ cao nhất“ 0 những bệnh nhân ung thư phổi), phát ban đo dị ưng
da xảy ra ở khoảng 25% bệnh nhân và kèm vởi ngửa trong 10% hệnh nhân.
Tần suất và mức độ nghiêm trọng của các phán ứng bất lợi bị ảnh hưởng bới liều lượng, tốc độ truyền
và khoảng cảch giữa cảc liều. Cảc tác dụng phụ có giới hạn liều đùng là giảm số lượng tiếu cẩu, bạch
cầu và bạch cầu hạt.
Tần số được xảc đinh lả: Rất phổ biến (> 10%), thường gặp (2 1% - <10%), Không phổ biến (_ 0,1%
-
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng