



















NLIJHFWGQ_FIVZ pdf
I insits
lch| M
W NWW Vơiì
ĐUỊQEỊỊOWỔB
wHVZWED
Rx Thuỏc bin thue dơn
Ilỏp l lo
Hột dõlg khê ph: dung dịch liếm
lư_vển
Cùi dùng liẽn truyền linh mựh
1 lọ chín gemcmbm hydrợckiriil
l…mg d…mg | g gcmcilahm
Bin quiu:
Lọ_clịffl Kht’mg Mn quan n uhlệi
dó lrên ]D"('
w… mm … men *… '…
quán ở nhu do Irộn SM thrvg bâc
quán lam Phù sí: uung bong 24 giờ
nc XA 'ỊÀM TAY TRE EM.
uoc ịư HUỞN_G uAn SL. num
TIlIJỜC KHI DUNG _
On úmh. uảch dùng. chóng th! dịnh
va các thòng lin Ithic xin xem it'y
Huz'mg dẵn xứ dong
SIJK: XX-XXXX XX
56 ở SX, NSX. HD' xm ncm Lm.
Míg Dai: stịi` mẻn hon bi
6627
Each v1alcontatns gcmclllbmc
HCl cquivalent In | g gemcitabine,
1 g mannitol. 62 5 mg sodium
nceuutc. Hydrochloric acul andlur
snduum hydroxtdc my hIVC hccn
used … Ideh'l pH
Eli Ltlly and Cumpauy
1ndiaunpưlnS. IN 46185. USA
Bui d 1 vini
H7502
… pvustl ption uriy
GEMZAR'
gemcitabine
Lvtìciiy…HC co….:ct ici minh
f iDr Mu r~'
lntnvcnous Inlusion uu Only
Slnrgg nndllhn:
Uma] vial~ Da nui mm ubwe W'C
Rcmlimlod JMon: Do ml s…
:hovn WC. Do ml nIiủmlu.
Mniniúr ulutiou within 24 hourl.
To preplre iulnvcnolls mhliun
- See accompany'mg lilenlum.
DO NOT REFHIGERATE
[ETFM CODE]
cuollạZOuơichzngp uẹ1
PACKAGiNG SITE“
.I UPC J EAN Jmtmmu
h_uự J OTHtR
J lum mv » PDA? .I omm
OiMER FEGULATED [TỈMS NIA
cwmcs
COLORS
Blle
485
328
nm com LVERSION uc mmnwum PWI ý
cau…m H nm 26Jan2016
SIPFRSEHES N/A
IIE NO. r.sn7 (c75777_17.u1
VENDOR mc NOI 26101!
VẾW` PRNTED SDE XP
IIMBJSIWB Lot mm W—01 mm 0415 mm
VERSiON'
D
C-57274101 … ,
85052”
96l4d7
GEMZMi`
gemcitabine
?.
m
3
o
o
0
E!
LILLY INDIANAPOLIS PPD SITE
|
EXP. DAib- EXP' _ __ _ ỳ__
ẸCHNJUL
ổ MfGDẶEỆ __Ữ _… __ _
Ễ AFhBARCODE iYPE .t UPC .: FAN JDATAMATRIX
c _ ịRỉ__ _n_NlẠ_ ẺFL _ _
Ề PACKAGiNGSiTE. JiNDY DRY XIPDAP .lOTHER
ffl
á 0ihER REGULA1ED It'EMS: NIA
DitN0- 0~7021 (D-7021 12A»
@ VENDOR DRAWING NO N/A
ẫ v1tw PRINTED SIDE UP
DIMENSIONS' L-92mm.W—S5mm", n - ibm…
VERSIONt 1
Each vial contains gemcitabine HCl
equivalent to 1 g gemcitabine
Manuhcturer:
Eli Lilly and Company
Ind'unapolis. IN 46285. USA.
COLORS:
BLACK
485
IMPRINT BLACK D-7021-LE05
c0mue 0—7021-LE01
BRAPHICS
CREATED BY: EF Daieì 26 Jan 2016
ITEM CODE & VERSION NO: NLOOSIPVNOO PiVi
SUPERSEDES: N/A
]. TÊN THUỐC
GEMZAR®
z. THÀNH PHẨN ĐỊNH TÍNH VÀ ĐỊNH LƯỢNG
Một lọ chửa gemcitabin hydroclorid tương đương với 1000 mg gemcitabin.
Sau khi hoản nguyên được dung địch chứa gemcitabin 38 mgfml.
Tả dược
Mỗi lọ 1000mg chứa 17,5 mg ('<1 mmol) natri.
Danh mục đây đủ cảc tả dược xem mục 6.1.
3. DẠNG BÀO CHẾ
Bột động khô pha dung dịch tiêm truyền.
Bột trăng đên trăng đục.
4. CÁC ĐẶC ĐIỀM LÂM SÀNG
4.1 Chỉ định điếu trị
Gemcitabin được chỉ định điều trị ung thư bảng quang tiến triến tại chỗ hoặc di cản kết họp
với cisplatin.
Gemcitabin được chỉ định điều trị cho cảc bệnh nhân với ung thư tụy dạng tuyến tiến triển tại
chõ hoặc di căn.
Gemcitabin, kết hợp với cisplatin được chỉ định trong điề_u trị khời đầu cho cácgbệnh nhẫm với
ung thư phôi không phải tế bảo nhỏ (NSCLC) không phân thuật được, tiên triên tại chõ (giai
đoạn IIIA hoặc IIIB) hoặc có di căn (giai đoạn IV).
Gemcitabin đơn trị liệu có thể xem xét cho nhũng bệnh nhân 1011 tuối hoặc nhũng bệnh nhân
được phân loại tỉnh trạng trạng thải 2.
Gemcitabin được chỉ định điều trị cho các bệnh nhân với ung thư biểu mô buồng trúng tiến
triến tại chỗ hoặc di căn, kết hợp với carboplatin, ở những bệnh nhân bệnh tải phảt sau một
khoảng thới gian không bị tải phát it nhất 6 thảng sau khi điều trị bằng platin. 1iệư pháp điều
trị bước một.
Gemcitabin kết hợp với paclitaer được chỉ định điều trị cho những bệnh nhân tải phảt với
ung thư Vũ không cắt bỏ được, tải phát tại chỗ hoặc di cãn sau khi đổ hỏa trị hỗ trợ tân
hỗ ttợ. Trước khi sử dụng hóa trị bệnh nhân cằn được điếu trị bằng ant racyclin trừ khi có
những chống chỉ định trên lâm sảng.
4.2 Liều lượng và cảch dùng
Gemcitabin chỉ nên được kê đơn bới thầy thuốc có chuyên môn trong việc sử dụng hóa trị
chông ung thư.
Liên khuvên cảo
Gemzar Jg_vìal_E U SmPC 5JunI 4_ VN_.MarI 6_proposed frulh_v02 }
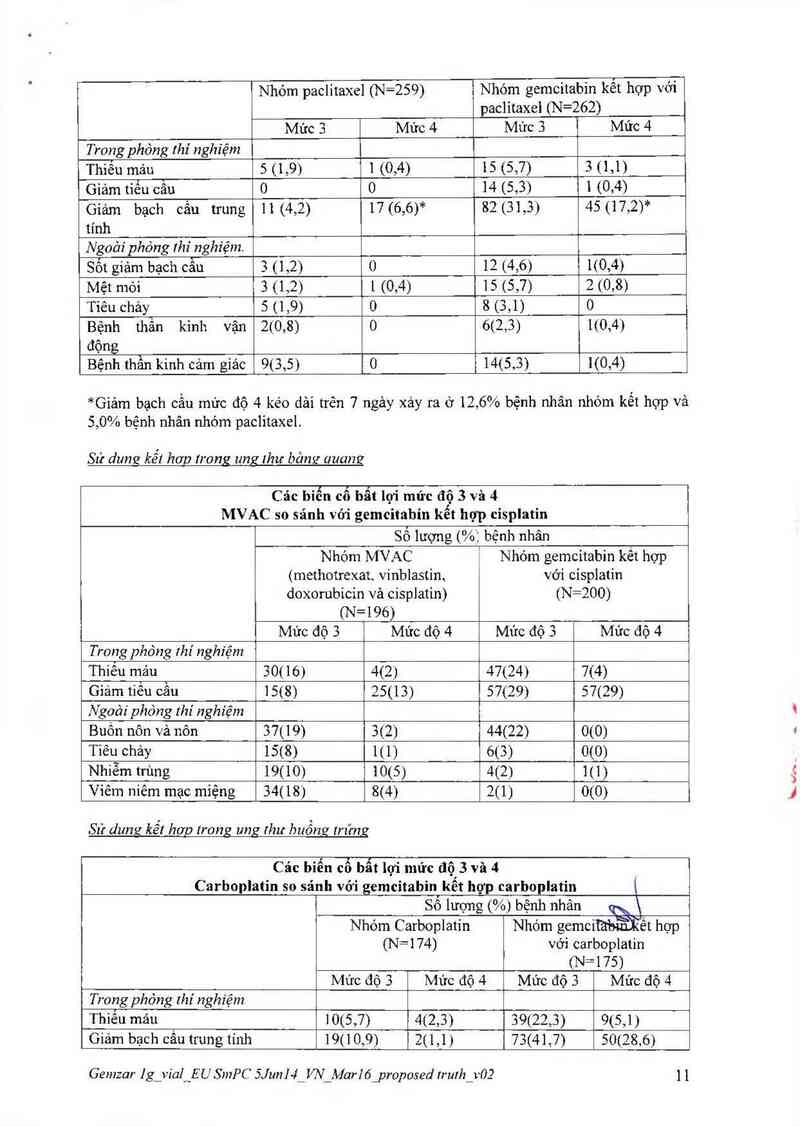
Unz rhư bảng auanz
Sử dụng kể! hợp
Liều đề nghị của gemcitabin lả 1.000 mg/m2 truyền tĩnh mạch trong 30 phút. Trong phảc đô
kết hợp với cisplatin, gemcitabin được sử đụng vảo ngảy thứ 1, 8 và 15 của chu kỳ 28 ngảy.
Liều cisplatin được đề nghị lả 70 mg/m2 truyền vảo ngảy thứ nhất sau khi dùng gemcitabin
hoặc ngảy thử 2 của chu kỳ 28 ngảy Sau đó lặp lại chu kỳ 4 tuần nảy. Có thế ảp đụng giảm
liều thuốc với mỗi chu kỳ hoặc trong một chu kỳ tùy vảo mức độ độc tính xảy ra trên người
bênh.
Ung thư Iszến ruỵ
Liều đề nghị của gemcitabin lả ] 000 mg/m2 truyền tĩnh mạch trong 30 phút Lặp lại liều nảy
liên tiếp môi tuần 1 lần trong 7 tuấn, sau đó ngưng ] tuần. Dùng tiếp liếu nảy môi tuần 1 lần
trong 3 tuần 1iên tiếp, rồi ngưng 1 tuần. Có thế áp dụng giảm liếu thuốc với mỗi chu kỳ hoặc
trong một chu kỳ tùy vảo mức độ độc tính xảy ra trên người bệnh.
Umz 77… phồi' khỏmz phải lề bâo nhỏ
Sử dụng đơn trị liệu
Liều đề nghị của gemcitabin lả 1 000 mglnn2 truyền tinh mạch trong 30 phút
Lặp lại liều nảy liên tiếp môi tuần 1 lần trong 3 tuần sau đó ngưng 1 tuần Tiếp theo lại lặp
lại chu kỳ 4 tuần nảy. Có thế' ap dụng giảm iiếu thuốc với mỗi chu kỳ hoặc trong một chu kỳ
tùy vảo mức độ độc tính xảy ra trên người bệnh.
sư dụng kết họp
Liều khuyến cáo của gemcitabin là 1250 mng2 diện tích bề mặt cơ thể truyền tĩnh mạch
trong 30 phút vảo ngảy thứ 1 vả 8 cúa chu kỳ 21 ngảy. Có thế áp dụng giảm iiều thuốc vởi
mỗi chu kỳ hoặc trong một chu kỳ tùy vảo mức độ độc tính xảy ra trên người bệnh.
Cisplatin được sử dụng ở các liều từ 75 - 100 mgfm² mỗi 3 tuần một lần.
Ung [hư vú
Sử dụng kết họp
Phối hợp với paclitaxel: Khuyến cảo sử dụng paclitaer (175 mg/m 2) dùng vảo ngảy thứ ],
truyền tĩnh mạch trong 3 tiếng, tiếp theo lá gemcitabin (1250 mg!m2 ) ttuyền trong 30 phút
vảo ngảy 1 và ngảy 8 của chu kỳ 21 ngảy Có thế áp dụng giảm liểu thuốc với môi chu kỳ
hoặc trong một chu kỳ tùy vâo mức độ độc tính xảy ra trên người bệnh. Bệnh nhân nên có sô
lượng bạch cẩu hạt ít nhắt 1.500 (x 10°/1) ttước khi bắt đầu dùng kết hợp gemcitabin với
paclitaer
Ung rhư buồng trứng.
Sử dụng kết hợp
1
Kết hợp gemcitabin vởi carb0piatin, khuyến cảo sử đựng gemcitabin iổipg/mz vảo ngảy 1
và ngảy 8 cùa môi chu kỳ 21 ngảy và truyền tĩnh mạch trong J ủt Sau khi dùng
gemcitabin, đùng carboplatin vảo ngảy ] dế đạt được diện tích duới đường cong (AUC ) mục
tiêu 4 ,0 (mgxml)*phút Có thế áp dụng giảm iiều thuốc với mỗi chu kỳ hoặc trong một chu kỳ
tùy vảo mức độ độc tính xảy ra trên người bệnh.
Theo dõi đôc tinh và điều chinh liều do đôc tinh
Gemzar Ig_viaỉ_E U SmPC 5Junl 4_ VN_zƯarl 6_proposed truth_v02 2
Điều chỉnh liều do cảc đôc tính khỏnQ liên auan đẽn hê mo máu
Nên định kỳ kiếm tra sức khỏe vả chức năng gan, thận để phát hiện độc tính không liên quan
đến hệ tạo mảu. Có thể ảp dụng giảm lỉếu thuốc với mỗi chu kỳ hoặc trong một chu kỳ tùy
vảo mức độ độc tính xảy ra trên người bệnh Nói chung, với độc tính không liên quan đến hệ
tạo máu nghiêm trọng (mức độ 3 hoặc 4), trừ trường hợp buồn nôm’nỏn, nên tạm ngừng điều
trị với gemcitabin hoặc giảm iiều phụ thuộc vảo kêt iuận cùa thấy thuốc điều trị Nên tạm
ngừng cho tới khi cảc độc tính đã được xử trí theo quan điếm cùa thầy thuốc.
Điều chinh iiếu với cisplatin, carboplatin, vả paclitaer ttong liệu pháp kết hợp nên tham
khảo phần tóm tắt đặc tinh sán phẳm của từng thuốc tương ứng
Điều chinh liều do đôc linh Irên hê lao máu
Bốt đầu một chu kỳ
Với tất cả cảc chỉ định, trước mỗi liều dùng bệnh nhân phải được theo dõi số lượng bạch cẩu
hạt và tiếu cầu. Bệnh nhân nên có số lượng bạch cầu hạt tuyệt đối it nhất 1.500 (x 10 6/1) vả số
lượng tiến cằn 100.000 (x 10671) trước khi bắt đằu một chu kỳ
Trong một chu ký
Sự điếu chỉnh ]iếu gemcitabin trong một chu kỳ nên được thực hiện theo cảc báng dưới đây:
Điểu chỉnh liều gemcitabin trong một chu kỳ vói bệnh ung thư bâng quang,
NSCLC và ung thư tuyến tụy trong liệu pháp đơn trị hoặc kễt họp vỏi cisplatin
Sô luọng bạch cầu hạt Sổ luợng tiễu câu (x 10Ỉ li) Phần trăm của liều
tuyệt đổi Gemzar chuẩn (%)
(x 10671)
> 1.000 và > 100.000 100
500—1.000 hoặc 50.000-100000 75
<500 hoặc < 50 000 Bỏ qua liếu *
*Việc điều trị bị bỏ qua sẽ không được tải thiết lập trong 1 chu kỳ trước khi số lượng bạch
cằn hạt đạt được it nhất 500 (xl Oôt’i) và số lượng tiếu câu đạt được 50. 000 (xiOỦ/l).
Điếu chỉnh liếu gemcitabin trong 1 chu kỳ với bệnh ung thư vú,
sử dụng kết hợp với paclitaxel.
Số lượng bạch cầu hạt Số lượng tiễu cầu (x 10°71) Phần trăm cũa liếu
tuyệt đổi Gemzar chuẩn (%)
(x 10“11)
2 1.200 và >75.000 100
1.000- <1.200 hoặc 50.000-75.000 75
700- <1.000 vả ì 50.000 50
<700 hoặc <50 000 Bỏ qua liều *
* Việc điếu trị bị bỏ qua sẻ không được tải thiết lập trong 1 chu kỳ Vìệc Ềirị sẽ bắt đầu
vảo ngảy thứ nhắt cùa chu kỳ tiếp theo ngay sau khi sô iượng bạch cầu h tJđược it nhất
1 500 (x10 ô|l) vả số lượng tiếu câu đạt được 100.000 (xlOófl)
Điều chỉnh iiều với gemcitabin trong 1 chu kỳ với bệnh ung thư buồng trứng, ]
sử dụng kết hợp với carboplatin
Số lượng bạch cầu hạt Số lượng tỉễư cẫu Phần trăm của liều
tuyệt đổi (x 10611) Gemzar chuẩn (%)
(x 10°11)
Gemzar Ig_vial _E USmPC 5Junl 4_ VN_ịMarl 6_proposed Irtưh_ v02 3
> 1.500 và 2 100.000 100
1000-1.500 75.000-100.000 50
hoặc `
<1000 < 75.000 Bỏ qua liêu *
hoặc
* Việc diều trị bị bỏ qua sẽ không được tái thiết lập trong 1 chu kỳ. Việc điều trị sẽ bắt đầu
vảo ngảy thứ nhất của chu kỳ tiếp theo ngay sau khi sô lượng bạch cầu hạt đạt được ít nhất
1.500 (x106/1) và số lượng tiêu câu đạt được 100. 000 (xlOóli).
Điều chỉnh lỉều do độc lính trên hệ tạo máu Irong các chu kỳ tiếp rheo, cho tẩt cả các chỉ
định. `
Nên giảm liều gemcitabin tới 75% cùa liều bắt đấu của chu kỳ khởi đâu, trong trường hợp có
cảc độc tính trên hệ tạo mảu dưới đây:
~ Số iượng bạch cầu hạt tuyệt đối < 500 x lOỆ/l nhiều hơn 5 ngảy
~ Số iượng bạch cầu hạt tuyệt đổi < 100 x 106 /1 nhiều hơn 3 ngảy.
~ Sốt do thiếu bạch cầu hạt trung tính
~ Tiểu cầu < 25.000 x 10°71.
~ C hu kỳ bị trì hoãn nhiếư hơn 1 tuần do độc tính.
Cách dùng
Gemzar được dung nạp tốt trong khi truyền và còn có thế được truyền khi bệnh nhân đi lại.
Nếu sự thoảt mạch xảy ra, nói chung phải dừng việc truyền ngay lập tức và bắt đầu lại với
mạch máu khác. Nên theo dõi bệnh nhân cân thận sau khi truyền.
Với cảc chỉ dẫn về việc hoản nguyên, xin xem mục 6.6.
Cảc dôi tương dăc biêt
Bẽnh nhân suv thân hoãc suv 2an
Nên dùng thận trọng gemcitabin ớ cảc bệnh nhân suy chức năng gan hoặc thận do không có
đầy dù thông tin từ cảc nghiên cứu lâm sảng đế có thể khuyến cảo liều cụ thể cho những đối
tượng bệnh nhân nảy (xem phần 4 4 và 5.2).
Bênh nhân cao tuồi (> 65 luổi)
Gemcitabin được dung nạp tốt ở cảc bệnh nhân trên 65 tuổi. Không có bằng chứng cho rằng
việc điều chinh 1iều ở bệnh nhân cao tuôi lả cần thiết ngoải sự diển chinh đã được khuyến cáo
cho tất cả các bệnh nhân (xem phần 5 2).
Benh nhan lre em (< 18 tuoz)
Không khuyến cảo sử dụng gemcitabin cho trẻ em dưới 18 tuổi do khôổ 7 ngảy)— Phân tich dữ liệu không cho thấy bất kỳ sự
táng độc tính nảo khi dùng gemcitabin cách trên 7 ngảy trước hoặc sau chiếu xạ, ngoải độc
tính do chỉếu xạ gây ra. Cảc dữ liệu cho thẳy có thể bắt đầu dùng gemcitabin sau khi cảc ảnh
hướng cấp thời của chiếu xạ đă được phục hồi hoặc it nhất 1 tuân sau chiếu xạ.
Tôn thương do chiêu xạ đã được bảo cảo với cảc mô đich (như viêm thực quản, viêm ruột
kêt, và viêm phôi) liên quan đên cả việc dùng đông thời hoặc không đông thời với
gemcitabin.
Những vấn đề khác
Vắc xin sốt vảng vả cảc vắc xin sống giảm độc lực khảo không được khuyến cảo do nguy cơ
toản thân, có thẻ gây tử vong, gây bệnh. đặc biệt lá ở các bệnh nhân bị ửc chê miên dịch.
4.6. Khả nãng sỉnh sản, phụ nữ mang thai và cho con bú
Mang thai
Không có đầy đủ dữ liệu về việc sử dụng gemcitabin ờ phụ nữ mang thai. Các nghiện cứu ở
động vật cho thấy độc tinh trên khả năng sinh sản (xem phần 5.3). Dựa trên các kết quả từ
nghiên cứu trên động vật và cơ chế tác dụng của gemcitabin không nên sử dụng hoạt chất
nảy trong khi mang thai trừ khi thực sự cân thiết. Nên khuyên phụ nữ không được mang thai
trong khi điều trị với gemcitabin và cảnh báo họ phải xin tư vân thầy thuốc ngay lập tức nếu
điều đó xảy ra.
Phu nữ đang cho con bú
Khỏng biết được liệu gemcitabin bải tiết qua sữa mẹ hay không và những tác dụng có hại đối
với trẻ đang bú lả khộng thế loại trừ. Nên trảnh sư dụng gemcitabin trên phụ nữ đang cho con
bú do các nguy hại tiếm tảng đổi với trẻ
Khả năng sinh sản
Trong cảc nghiên cún về khả năng sinh sán, gemcitabin gây giảm sinh tinh trùngiờ chuột đực
(xem phần 5 3) Vì vậy, nam giới đang điếu trị với gemcitabin không được * n trong khi
điếu trị vả trong 6 tháng sau khi ngùng điều trị và nến xin tư vân liên quan é iệc báo quản
lạnh tinh trùng trước khi điều trị bời vi điều trị với gemcitabin có thể gây giảm khả năng sinh
sản.
4.7. Ẩnh hưởng đến khả nãng lải xe và vận hảnh mảy mỏc
Không có nghiên cứu về ảnh hướng đên khả nãng lái xe và vận hảnh mảy móc được thực
Gemzar Jg_ vial_E U SmPC 5Jun] 4_ VN_MarJ ó_proposed truiỉi_ v02 7
lz
hiện Tuy nhiên gemcitabin đã được báo cáo là gây ra trạng thải ngủ gả mức độ từ nhẹ đến
trung bình, đặc biệt sự dụng cùng với chắt cỗn. Bệnh nhân không được lải xe hoặc vận hảnh
máy móc cho đến khi xác định rõ rằng họ không bị buồn ngù.
4.8. Tác dụng không mong mưốn
Cảc phản ứng có hại cùa thuốc được báo cảo phổ biến nhất liên quan đến điểu trị với Gemzar
bao gôm: buồn nôn kèm theo hoặc khỏng kèm theo nôn, tăng enzym gan (ASTJALT) vả
phosphat kiềm, được báo CấO trong khoảng 60% bệnh nhăn; tiêu đạm, tiều máu được bảo cảo
trong khoảng 50% bệnh nhân; chúng khó thờ được bảo Cảo trong 10 — 40% bệnh nhân ( tỉ lệ
cao nhất ở các bệnh nhân ung thư phối); phảt ban da dị ứng xảy ra trong khoảng 25% bệnh
nhãn vả liên quan đến ngửa trong 10% bệnh nhân.
Tần suất và mừc độ nghiêm trọng cùa cảc phản ứng có hại bị tác động bời liếu dùng, tốc độ
truyền và khoảng cảch gỉữa các iiếu ( xem phần 4. 4). Cảc phản' ưng có hại trong giới hạn liều
lả giảm tiếu câu, bạch câu vả số luợng bạch câu hạt ( xem phần 4. 2)
Dữ liêu từ thủ nghiêm lâm sảng
Tần suất được định nghĩa như sau: Rẳt phổ biến (>] 110), phổ biến (>1i 100 đến 1/1000 đến <14100), hiếm (ì1'10 000 đến
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng