








Y
Í J cục QUẢN LÝ DƯỢC
1 ĐẶ PHÊ DUYỆT
` 011100sz31 _ Lân aâuầtlẵ....91131ỉ1ễ...
ENIGVIIOWHĐ '
BỘYTỂ
ƯIƯVOcIIfN
WHDKUJxIWMWA'IWI ,
,/
1 v… 1.vm1uzto mm ma scwnou 1 v… ưomumả ìoùẵn ìèu soiunm
FOR NFUmN Fon INỈUSON
]
FN IIIFUSION
* sax: vn-xxxx-xx. Hutchit:
] Gemdhuno t-tỵdmehloridc
Rx lhuếc ki đ… ng đương Gemcitaban
GEMCITABINE 'ị'Ễẵẵ'Ễí'ìằf'ảẵhĩắ’ằẵẵ? GEMCITABINE
11 mm mụeh NSX
TEVA 200 MG Ểiồmsẫ'i'ẵễx xom 'MFG
N0.’ tren hoc bt Bỏo quân
30°C. Nu tâm ny tr! om
roa smcư us: mu Am uu cenmus
ễwzmnms uvnao—
monnz eoumưwr
Foư lntơavenous use To nmcluams … MG
ifter reconst1tulion. ana ỤẺCDNSIIYUTIM
THES MVTÌ NC ONỸAI NS
IC MGMI 0s GíMCIĨAIINE
nm me PMIAGE
ưsz mone us:
sỗẵmw AỂỂrỀTă
CYTOTOXIC uvnnocmcnc ư»
SEỈ LEÀỈLET FOR FUIỨHEÙ
. n n u ! A ri INFOUMAHON
lAA\AYl
DATE'. 'EXP. omr vl ~axrcn 1
TEVA 200 MG
dWI
ỈOI SINGLE USE 0NLV.
For intnvennus use
after rech 3titution.
IEAD ĨNE DMKAũỂ
LỂNLH BUW USE
CYTOTOXIC
PHARMACHEMIE BV PHAFiMACHEMIE BV
/
,
GEMCITABINE TEVA 200 MG
Gemtltnllne ltydmhlutde eqv. ln
Gemlnhlne … mg
l le. I.VOMIUIED ?GWDEIM SOLƯTION
FOR INFUSION
FOI INTIAVENOUS USE
AF7ER IICONSTITUYION
pưhọe blflct
udthe
bdoveuse
ummu
1
IATEII m.
EIF. 0ATE:
BATCH No.:
MFG. DATỂ:
EXP. DATE:
l VIAI. LVOPMILIIID ma FOR soumon ! VIAL LYOPNIUIED W! f0l sotưtlou
m INFUSION
ft_Ẻ, OU 90457 0T | 80
I
1 \ _
Sấn xtẢt bbi
anmchunln nv
Swemweg 5, 2001. GA Haavlem
The hblfmlnm:
cnl dnn, chóng on1cm, cech dũng,
Iiếu dùm, tnr. dutg khong mong
1 muốn vù dc dáu huệu oAn iưu ý:
um trong tù nuúrq dản cù mng
cac ang lin khúc 6! nghi xem
. lmrq to mong dln lù qu m…
` theo Doc kỷ huong oăn sử dung
` llvùc ìứtl n'mg DNNK XX)OíX
UNUENED VIA[
stoas m.ow :o'c
mu: ms LEAFLH son THE
sMEL : u 6 o YHE
ucoumruvm nouqu
m N07 IIEFIIGIOATE TN!
KEDNSYITUTED ml.ullgu
mv u…sm vnoouc1 on mIẸỂ
MAYEẸIAL moum u: usIosm ~
0
N KC m
LOCAI. ẺOUIIEWNTS
KEEP WT Ự N! lÌỂACN
AND SIGNT DF CNILWN
93.100.567~A
100301 1'
Pct-isu ||
, 1 1 3 mm
1
i /
cố PHẨN
Dược PHẨM
Đọc kỹ hương dẫn sử dụng trươ'c khi (lùng. Nếu cẩn thêm thông tin xin hỏi ý kiểu bảc sỹ. Để thuốc
ngoâi tẩm tay tre em. T huoc nây chỉ dùng theo đơn của bác sỹ.
GEMCITABINE TEVA `200 MG
Bột đông khô pha tiêm !ruyẽn
Thãnh phận: Mỗi 16 có chứa:
- Họat chân Gemcitabine hydrochloride tương đương với Gemcitabine 200 mg
- Tả dược: Mannitol, Sodium acetate trihydrate, Sodium hydroxide (IN), Hydrochloric acid, Nước pha
tiêm
Chỉ định
Gemcitabin được chỉ định phối hợp với cisplatin trong điếu trị ung thư bảng quang tiến triển tại chỗ
hoặc di cãn. Gemcitabine được chỉ định điếu trị cho những bệnh nhân ung thư biều mô tuyến tụy tiến
triến tại chỗ hoặc di cãn. Gemcitabine được chỉ định phối hợp với cisplatin như liệu phảp điếu trị ban
đầu cho những bệnh nhân ung thư phổi không phải tế bảo nhỏ tiển triển tại chỗ hoặc di cãn. Có thế cãn
nhắc sử dụng gemcitabine đơn trị liệu cho bệnh nhân cao tuối hoặc bệnh nhân ung thư phồi không
phải tế bảo nhỏ giai đoạn 2. Gemcitabin được chỉ định phối hợp với carboplatin để điều trị cho nhũng
bệnh nhân ung thư biểu mô buồng trứng tiến triển tại chỗ hoặc di căn, bệnh nhân ung thư tái phảt sau
khoảng thời gian tối thíếu là 6 tháng sau khi điếu trị bằng liệu phảp ban đầu là một dẫn chắt cùa platin.
Gemcitabin được chỉ định phối hợp với paclitaxel để điếu trị cho nhũng bệnh nhận mắc ung thư vú tải
phát tại chỗ hoặc di căn không thế phẫu thuật sau khi được điều trị bằng một thuốc chống ung thư ,
thuộc nhóm dẫn chất anthracyclin. Ả L/
Liều lượng và cách dùng: Chỉ những bảo sĩ đã có kinh nghiệm dùng thuốc chống ung thư mới được
phép sử dụng gemcitabine.
Liều để nghỉ
Ung rhư bòng guang
Phối hợp rhuốc: Liều gemcitabine đề nghị là 1000 mg/m2 bề mặt cơ thề, truyền tĩnh mạch trong 30
phủt. Nên sử dụng thuốc vảo 2ngảy thứ I, 8 và 15 cùa đợt điểu trị 28 ngảy, phối hợp vói cisplatin. Liều
cisplatin đề nghị lả 70 mg/m2 vảo ngảy thứ 1 sau khi sử dụng gemcitabin hoặc vảo ngảy thứ 2 cùa đợt
điếu trị 28 ngảy. Sau đó lặp lại chu kì điểu trị 4 tuần. Có thế giảm Iiếu sau mỗi đọt điều trị hoặc trong
một đợt điểu trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân.
Ung thưtuv. Liều gemcitabin đề nghị 153 1000 mg/mz, truyền tĩnh mạch trong 30 phút. Sử dụng lặp lại
một lần mỗi tuần trong thời gian tới 7 tuần, sau đó nghỉ 1 tuần. Trong các đọt điều trị tiếp theo, sử
dụng thuốc một lần môi tuần trong 3 tuần liên tiếp cùa đợt điều trị 4 tuần. Có thế giảm liều sau mỗi đợt
điếu trị hoặc trong một đợt điếu trị tùy theo mức độ độc tính của thuốc đối vói bệnh nhân.
Ung thư phối không phải tế băo nhỏ
Đơn trị liệu. Liều gemcitabin đề nghị là 1000 mg/mz, truyền tĩnh mạch trong 30 phút. Sử dụng lặp lại
một lằn mỗi tuần trong thời gian tới 7 tuần, sau đó nghỉ 1 tuần. Sau đó lặp lại chu kì điếu trị 4 tuần. Có
thể giảm liều sau môi đợt đỉêu trị hoặc trong một đợt điếu trị tùy theo mức độ độc tính của thuốc đối
với bệnh nhân.
Phổi hợp thuốc: Liều gemcitabine đề nghị là 1250 mg/m2 bề mặt cưthê.,ttuyen tĩnh mạch trong 30
phủt vảo ngảy thứ ] vả 8 của đọt điếu trị 21 ngảy. Có thể giảm 1_,iẾu săn môi đột điều trị hoặc trong một
đợt điểu trị tùy theo mức độ độc tính cùa thuốc đối với bệnh nhẩn. SỔỒụqgcispÌatin liếu từ 75— 100
mg/m2 mộtlần saumỗi3tuần. …ỂfỆ` có PHẢN ;
Unglhưvú Q,, DUOC HẨM tả
Phối hợp thuốc: Gemcitabine được khuyến cảo sử dụng phối gpvợị,paciitảxèl Uềịả' 175 mglm²,
truyền2 tĩnh mạch trong 3 giờ vảo ngảy thứ 1 của đợt đieu trị, sẩu độ sử dụng gemcitabine Iiếu 1250
mg/m2 truyền tĩnh mạch trong 30 phủt vảo ngảy thứ 1 và 8 của đọf~ổiếịtrị `__Ị2Lngảy Có thể giảm liếu
sau mỗi đọt điếu trị hoặc trong một đọt điều trị tùy theo mức độ độc tính của thuốc đối vói bệnh nhân.
Số lượng bạch cầu hạt cùa bệnh nhân tối thiếu phải là 1500 x 106 te bảo/L trước khi bắt đẳu điều trị
bằng gemcitabine phối hợp với paclitaxel.
Ung [hư buồng !rứng
).z/
Phối họp thuốc: Gemcitabine được khuyến cáo sử dụng phối hợp với carboplatin trong điếu trị ung
thư buổng trứng. Liều gemcitabine lả 1000 mg/m, truyền tĩnh mạch trong 30 phủt, sử dụng vảo ngảy
thứ ] vả 8 cùa đợt điếu trị 21 ngảy. Sau khi sử dụng gemcitabine, tiếp tục dùng carboplatỉn vảo ngảy
thứ 1 đề đạt trị số diện tích dưới đường cong (AUC) mục tiêu của carboplatỉn là 4, 0 mglml~phút. Có
thế giảm 1iếu sau môi đợt điếu trị hoặc trong một đợt điếu trị tùy theo mức độ độc tính cùa thuốc đối
với bệnh nhân
Theo dõi đôc tính cùa thuốc và hiêu chinh liều
Híẻu chinh liều do đôc tính ngoải hê tao máu. Cần kiếm tra sức khỏe định kì và đảnh giả chức nãng
thận vả gan đế phảt hiện độc tính cùa thuốc ngoải hệ tạo mảu. Có thế giảm liếu sau môi đọt điều trị
hoặc trong một đọt điều trị tùy theo mức độ độc tinh của thuốc đối với bệnh nhân. Thông thường, đối
với trường hợp độc đính ngoải hệ tạo mảu nặng (độ 3 hoặc 4), trừ buồn nôn/nộn, nên ngừng sử dụng
gemcitabine hoặc giảm liểu tùy theo chỉ định cùa bảc sĩ. Nên ngừng dùng thuốc cho đến khi độc tính
của thuốc đã được khắc phục.
Để hiệu chinh liếu cisplatin, carboplatin vả paclìtaxel khi sử dụng phối họp với gemcitabine, cần tham
khảo Tóm tắt đặc tính sản phẩm cùa mõi thuốc.
Hiẻu chinh liều do đôc tính trên hê tao máu
Bắt đầu đợt điều trị: Với tất cả cảc chỉ định, cần kiểm tra số lượng tiếu cầu và bạch cầu hạt cùa bệnh
nhân trước mỗi lần sử dụng thuốc. Bệnh nhân phải có số lượng bạch cầu hạt tối thiểu là 1 5.00 x 106 tế
bảo/L vả it nhất 100. 000 x 106 tiểu cầu/L trước môi đợt điếu trị.
T rong đợt điều lri: Nên hiệu chinh liều gemcitabine trong một đợt điểu trị theo bảng dưới đây:
Hiệu chinh liễu gemcitabine trong một đợt điếu trị ung thÃư bâng quang, ung thư phổi không
phâi tế bảo nhỏ và ung thư tụy, sử dụng đơn độc hoặc phối hợp với cisplatin
Sổl n b ch cẫu h t 6 Phần trâm so vỏi liều
(x lilrỏọlLi)ẵ ạ ạ Số lượng tiểu cầu (x 10 lL) gemcitabine chuẩn (%)
> 1.000 vả > 100.000 100
500 — 1000 hoặc 50.000 — 100.000 75
< 500 hoặc < 50.000 Ngừng sử dụng*
* Không nẽn sứ dè…g thuộc trở lại Itrong cùng một đợt điều trị cho đên khi số lượng bạch cẩu hạt dạt
tối thiếu 500 x 10 /L vả số lượng tiêu câu ít nhất lả 50.000 x 106/L.
* Không nên sử dụng thuốc trở lại trong cùng một đọt điếu trị. Bắt đầu dùng thuốc vảo ngảy thứ 1 của
đọt điếu trị tiếp theo nếu số lượng bạch câu hạt đạt 1.500 x 106 tế bảo/L vả số lượng tỉểu câu lả 100 00
x 106 lL.
* Không nên sử dụng thuốc trở lại trong cùng một đợt điều trị. Bắt đầu dùng thuốc vảo ngảy thứ 1 cùa
đọt tẫiều trị tiếp theo nếu số lượng bạch câu hạt đạt 1.500 x 106 tế bâo/L vả số lượng tiều câu lả 100 00
x 10 /L.
Hiệu chỉnh liều gemcitabine trong một đợt điếu trị ung thư vú, phối hợp với paclitaxcl
Số lượng bạch cầu hạt Số lượng tiễu cẫu (x 106/L) Phẫn trăm so với liễu
(x 106/L) gemcitabine chuẩn (%)
> 1.200 và > 75.000 100
1.000 —— < 1.200 hoặc 50.000 — 75.000 75
700 - < 1.000 vả ì 50.000 50
< 700 hoặc < 50.000 Ngừng sử dụng*
Hiệu chinh liều gemcitabine trong một đợt điếu trị ung thư buồng tcửhìr) phổi `hộử't vỏi carboplatin
Số lượng bạch cầu hạt Số lượng bạch cẫu hạt S_ố lìrộng bạ_ch cầíị`hạt
(x 10°7L) (x 10°71.) `(x 10913) “ (…o ._
> 1.500 và > 100.000 100 _. _.… f11
1.000 — 1.500 hoặc 75.000 — 100.000 50 1. ; ,,ỵLIIJ'ỒỈ
< 1.000 hoặc < 75.000
Hiệu chmh liều gemcitabine do độc tỉnh trên huyết học trong các đợt điều trĩ'Ìĩếịjĩẵu cho tất cả các
chỉ định ' ` , _ ,
Nên giảm liếu gemcitabine xuông còn 75% so với liêu khời đâu trong cảc trường hợp nhiêm độc huyêt
học sau:
0 Số lượng bạch cầu hạt < 500 x ]06/L kéo dải quả 5 ngảy
0 Số lượng bạch cầu hạt < 100 xí lOó/L kéo dải quả 3 ngảy
0 Giảm bạch cầu trung tính có sốt
0 Số lượng tiều câu < 25. 000 x lOó/L
O Chậm bắt đẩu đợt điếu trị quả 1 tuần do độc tính.
Cảch dùng: Gemcitabine được dung nạp tốt khi truyền tĩnh mạch vả có thể sử dụng trong khi di
chuyến. Nếu xảy ra tinh trạng thoảt mạch, cần ngừng truyền ngay lập tức và chuyển sang truyền vảo
một tĩnh mạch khác. Cần theo dõi chặt chẽ tình trạng bệnh nhân sau khi truyền
Về hướng dẫn cách pha chế, xem mục Những lưu ý đặc biệt về việc pha chế và xử lý loại bò.
Cảc nhóm bênh nhân đãc biêt
Bénh nhân suy thân hoãc suv sam: Cần thận trọng khi sử dụng gemcitabine cho bệnh nhân suy thận
hoặc suy gan do chưa có đủ thông tin từ các nghiên cứu lâm sảng cho phép đưa ra khuyến cảo liếu
chính xảc cho nhũng bệnh nhân nảy (xem mục Những cảnh bảo đặc biệt và thận trọng khi sử dụng và
Cảo đặc tính dược động học).
Bênh nhân cao tuổi (> 65 tuồi): Gemcitabine dược dung nạp tốt ở những bệnh nhân trên 65 tuối. Chưa
có bắng chứng thấy cần phải hiện chinh liều khi sử dụng cho bệnh nhân cao tuổi (xem mục Cảo đặc
tính dược động học).
Trẻ em: Gemcitabine đã được nghiên cứu trên trẻ em trong cảc thử nghiệm lâm sảng pha [ và pha II
trong nhiều trường hợp khối u khảc nhau. Cảc nghỉên cứu nảy chưa cung cấp đủ dữ liệu chứng minh
hiệu quả và độ ạn toân của gemcitabine trên trẻ em.
Chống_chi định , , _
Quả mân với gemcitabine hoặc bât ki thảnh phân nảo cùa thuôc. M
Phụ nữ cho con bú (xem mục Sử dụng cho phụ nữ có thai và cho con bủ).
Những cảnh báo đặc biệt và thận trọng khi sử dụng
Sử dụng thuốc theo đường truyền tĩnh mạch trong thời gian dải vả tăng số liều dùng có thế lảm tảng
độc tính.
Đôc tính trên hè tao mảu: Gemcitabine có thể ức chế chức năng của tủy xương, biếu hỉện bằng giảm
bạch cầu, giảm tiếu cầu và thiếu máu Bệnh nhân được điều trị bằng gemcitabine cần được kiềm tra số
luong tiều câu, bạch cầu và bạch cầu hạt trước mỗi lỉểu sử dụng. Nên cân nhắc ngừng thuốc hoặc hiệu
chinh liều khi phát hiện tình trạng ức chế tùy xương do thuốc (xem mục Liều lượng vả cảch dùng).
Tuy nhiên, tình trạng ức chế tủy xương chỉ kéo dải trong thời gian ngắn và thường không cần phải
giảm liếu và hiếm khi phải ngứng thuốc Số lượng tế bảo mảu ngoại vi có thể tiếp tục giảm sau khi đã
ngừng sử dụng gemcitabine. Ó bệnh nhân bị giảm chức năng tủy xương, cần thận trọng khi bắt đầu
điếu trị bằng gemcitabine Giống như cảc thuôo gây độc tế bảo khác, cân lưu ý nguy cơ ức chế tủy
xương tich lũy khi gemcitabine được sử dụng cùng vởi các thuốc hóa trị liệu khảo.
Suv ean: Sử dụng gemcitabine cho bệnh nhân mang khối u gan di cãn hoặc có tiến sử viêm gan,
nghiện rượu hoặc xơ gan có thể lảm nặng thêm tinh trạng suy gan sẵn có.
Cần định kỳ kiếm tra chức năng gan vả thận (bao gồm cả cảc xét nghiệm vi sinh vật).
Cần thận trọng khi sử dụng gemcitabine cho bệnh nhân suy thận hoặc suy gan do chưa có đủ thông tin
từ cảc nghiên cứu lâm sảng cho phép đưa ra khuyến cáo liều chính xác cho những bệnh nhân nây (xem
mục Liều lượng và cách dùng)
Xa trí đồng thòi: Xạ trị (sử dụng đồng thời hoặc cách xa_ < 7 ngảy): Độc tính đã được ghi nhận (xem
mục Tương tảc với cảc thuốc khác và cảc dạng tưong tảo khảo để biểt thông tin chi tiết vả khuyến cảo
sử dụng).
Cảo vắc- xin chừa vi sinh vâtl sống: Không khuyến cảo sủ dụng vắc- xin sốt vảng hoặc cảc chế phẩm
vắc-xin có chứa vi sinh vật sống đã được lảm yêu cho bệnh nhân đang diều trị bằng gemcitabine (xem
mục Tưong tảo với cảc thuốc khảc và các dạng tương tác khảc).
Tim mach: Do nguy cơ rối loạn tim vả/hoặc mạch mảu khi sử dụng gemcitabine, phải đặc bỉệt thận
trọng khi sử dụng thuốc cho bệnh nhân có tiến sứ gặp cảc biến cố tim mạch. _ ,
P_hổi: Tảc dụng bất lợi cùa thuốc trên phổi, đôi khi ở mức độ nghỉêm _ ílĨhĨrềpĩJ hôi, viêm phôi
kẽ hoặc hội chứng suy hô hấp) đã được ghi nhận khi sử dụng gemcỉt ' " '
xảc cùa các tinh trạng nảy. Nếu phát hiện cảc tinh trạng như v
gemcitabine. Áp dụng cảc biện phảp đíều trị hỗ trợ sớm có thể giúp a; thigâỂểfd'ủìhtr
* DƯỢC PHAM *
Thân: Kết quả nghíên cứu lâm sảng ghi nhận hội chứng tan huyết tăng urê máu vởi tần suất hiếm gặp
ở bệnh nhân điếu trị bằng gemcitabine (xem mục Tác dụng không mong muốn). Nên ngừng sử dụng
gemcitabine khi phát hiện bắt kì dấu hiện thiếu máu tan mảu vi mạch nảo như giảm hemoglobin nhanh
kèm theo giảm tiều cầu, tăng bilirubin huyết thanh, creatinin huyết thanh, nitơ urê huyết hoặc Iactat
dehydrogenasc (LDH). Tình trạng suy thận không thể phục hồi khi ngửng thuốc và bệnh nhân có thề
cẳn phải đ lọc mảu nhân tạo.
Chức năng sinh sản: Trong cảc nghiên cứu về sình sản, gemcitabine gây giảm sinh tinh ở chuột dực.
Vì vậy, nam giới đang được điếu trị bằng gemcitabine không nên có con trong khi đùng thuốc và tới 6
thảng sau khi ngừng điều trị và nên bâo quản lạnh tỉnh trùng trưởc khi điếu trị bằng gemcitabine do
nguy cơ vô sinh sau khi dùng thuốc (xem mục Sử dụng cho phụ nữ có thai và cho con bủ).
N_atri: Gemcitabine 200 mg có chứa 3,5 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho
bệnh nhân đang ảp dụng chế độ ãn giảm natri. _Gemcitabine 1000 mg có chứa 17, 5 mg (< 1 mmol)
natri trong môi lọ Cần lưu ý khi sử dụng cho bệnh nhân đang ảp dụng chế độ ăn giảm natri.
Gemcitabine 2000 mg có chứa 35 mg (< 1 mmol) natri trong môi lọ. Cần lưu ý khi sử dụng cho b
nhân đang' ap dụng chế độ ãn giảm natri. /4ỵĨL/Ih
Tương tác vói cảc thuốc khảc vả cảc dạng tương tác khảc
Chưa tiến hảnh nghiên cứu đặc hiệu nảo về tương tảo thuốc (xem mục Cảo đặc tinh dược động học).
X_a tri: Sứ dụng đông thời (sử dụng cùng lủc hoặc cảch xa < 7 ngảy): Độc tính đã được ghi nhận khi sử
dụng phối hợp hóa trị vả xạ trị phụ thuộc vảo nhiếư yếu tố khảc nhau bao gồm liếu gemcitabine, tần
suất sử dụng, liếu xạ trị, kỹ thuật xạ trị, mô đich và thể tích xạ trị. Cảc thử nghiệm tiên lâm sảng vả
lâm sảng cho thấy gemcitabine có hoạt tinh nhạy cảm xạ trị. Trong một thử nghiệm lâm sảng, khi sử
dụng gemcitabine liều 1.000 m …2 trong 6 tuần liên tiếp cùng vởi xạ trị vùng ngực cho bệnh nhân
mắc ung thư phối không phải tế bảo nhỏ, tình trạng độc tính ở mức độ nghiêm trọng và vỉêm niêm
mạc có thể đe dọa tinh mạng, đặc biệt là viêm thực quản vả viếm phổi đã được ghi nhận, nhắt lá ở
bệnh nhân sử dụng thể tích xạ trị lớn [thể tích xạ trị trung bình lả 4.795 cm ]. Cảo nghiên cứu tiếp sau
cho thẩy có thể sử dụng gemcitabine liếu thẳp hon cùng với xạ trị do có thể kiếm soát được độc tinh,
chắng hạn như trong một nghiên cứu pha Il trên bệnh nhân ung thư phổi không phải tzế bảo nhờ sử
dụng liều xạ trị là 66 Gy cùng với gemcitabine (600 mg/m², 4 iần) vả cisplatin (80 mglml, 2 lần) trong
6 tuần. Chế độ trị liệu tôi ưu an toản khi sử dụng gemcitabine cùng với xạ trị chưa được xảo định trong
điếu trị tất cả các loại khối u _Không sử dụng đống thời (cảch > 7 ngảy): Phân tích dữ liệu nghiên cứu
không phảt hiện thấy bất kỳ nguy cơ tăng độc tính nảo khi sử dụng gemcitabine tại thời điềm cảoh hon
7 ngảy trưởc hoặc sau xạ trị so với khi tíến hảnh xạ trị nhắc lại. Dữ liệu nghiên cứu cho thẩy có thể bắt
đầu sử dụng gemcitabine sau khi cảc tác dụng bắt lợi cẳp tinh cùa xạ trị đã được khắc phục hoặc ít
nhất 1 tuần sau xạ trị
Tổn thương do xạ trị đã được ghi nhận tại cảc mô đich (như viêm thực quản, viêm kết trảng và viêm
phổi) cả khi sử dụng đồng thời và không sử dụng đồng thời cùng với gemcitabine.
Cảc chế phẩm khảo: Không khuyến cảo sử dụng văc- xin sốt vảng da cũng như cảc chế phấm vẳc- xin
có chứa vi sinh vật sống đã được Iảm yếu do nguy cơ gây ra tảc dụng bất lợi toản thân, thậm chí lả cảc
tình trạng hết sức nghiêm trọng có thể dẫn đển tử vong, đặc biệt là ở bệnh nhân bị ức chế miễn dịch.
Sử dụng cho phụ nữ có thai và cho con bú
Phu nữ có thai: Chưa có đủ dữ liệu về việc sử dụng gemcitabine cho phụ nữ có thai Cảc nghiên cứu
trên động vật cho thẩy độc tính của gemcitabine đối với sinh sản. Dựa trên kết quả từ các nghiên cứu
trên động vật và cơ chế tảc dụng của gemcitabine, không nên sử dụng gemcitabine trong thai kì trừ khi
thục sự cần thiết. Phụ nữ không nến có thai trong khi đang đỉều trị bằng gemcitabine và phải thông
báo ngay cho bảo sĩ nếu có thai trong quá trình dùng thuốc.
Phu nữ cho con bủ: Chưa rõ gemcitabine có được tiết vảo sữa mẹ hay không vả không thể loại trừ tảo
dụng bất lợi của thuốc trên trẻ bú mẹ Người mẹ phải ngừng cho con b ạng dùng thuốc.
Ảnh hưởng đến sinh sản: Trong cảc nghiên cứu về sinh sản, gemciúfi biồe gãỹ giầfnỀsmh tinh ở chuột
đực. Vì vậy, nam giới đang được điếu trị bằng gemcitabine khôn ’e cg@gn, trong khiỂùng thuốc và
tới 6 thảng sau khi ngừng điếu trị và nên bảo quản lạnh tinh trùn trướcởđahđiềultrị băn gemcitabine
do nguy cơ vô sinh sau khi dùng thuốc. Ểi\ DƯỢC PHẢN ’…
UY TẨN ’ ằ/
Ành hưởng đến khả năng lái xe và vận hânh máy mỏc
Chưa tiến hảnh cảc nghỉên cứu về ảnh hướng của thuốc đến khả nảng lải xe và vận hảnh máy móc
Tuy nhiên, đã ghi nhận gemcitabine có thể gây buồn ngủ mức độ nhẹ đến vừa, đặc biệt là khi sử dụng
cùng với rượu Bệnh nhân cân thận trọng không nên lái xe và vận hảnh mảy móc cho đến khi chắc
chẳn không còn bị buồn ngủ.
Tác dụng không mong muốn
Cảc tảc dụng bât lợi hay gặp nhất khi sử dụng gemcitabine bao gồm: buồn nôn có hoặc không kèm
theo nôn, tăng transaminase gan (AST/ALT) vả phosphatase kiếm đã được ghi nhận ở khoảng 60%
bệnh nhân; protein niệu và huyết niệu được ghi nhận ở gân 50% bệnh nhân; khó thờ ở 10-40% bệnh
nhân (tỷ lệ cao nhất ở bệnh nhân ung thư phối); phảt ban kiếu dị ứng ở 25% bệnh nhân và ngứa ở 10%
bệnh nhân. Tần suất và mức độ nghiêm trọng cùa các phản ứng bất lợi tùy thuộc vảo liếu dùng, tốc độ
truyền tĩnh mạch và khoảng cảch giữa các liếu (xem mục Những cảnh bảo đặc biệt và thận trọng khi
sử dụng). Cảc tảc dụng bất lợi giới hạn liệu là giảm số lượng tiểu cầu, bạch cầu và bạch cầu hạt (xem
mục Liêu lượng và cảch dùng).
Dữ Iiếu từ các thứ nghiêm lâm sảng: Tần suất phản' ưng bất lợi được quy ước như sau: Rất hay gặ (> ,
l/IO), Hay gặp (> 1/100 đến < 1/10), Ít gặp (> lll. 000 đến < i/IOO), Hiếm gặp (> 1/10 000 đên 71 1/
]l1000), Rất hiểm gặp (< lllO 000)
Bảng dưới đây Iỉệt kê cảc tác dụng bất lợi vả tần suất xuất hiện dựa trên cảc thử nghiệm lâm sảng.
Trong mỗi nhóm tần suất, cảc tảc dụng bất lợi được sẳp xếp theo thứ từ giảm dần mức độ nghiêm
trọng
Hệ cơ quan Nhỏm tần suất
Rối loạn mảu và hệ bạch huyết Rất hay gặp: Giảm bạch cẫu (giảm bạch cầu trun
tính độ 3: 19,3%; độ 4: 6%). Tinh trạng ức chế
tủy xương thường ở mức độ nhẹ đến vừa và chủ
yêu ảnh hưởng đến số lượng bạch cần (xem mục
Liều lượng vả cách dùng). Giảm tiều cẳu. Thiếu
mảu.
Hay gặp: Giảm bạch cầu trung tính có sốt.
Rất hiếm gặp: Tăng tiểu cầu.
Rối loạn hệ miễn dịch
Rất hiếm gặp: Phản ứng phản vệ
Rối loạn chuyến hóa và dinh dưỡng
Hay gặp: Chản ăn
Rối loạn hệ thần kinh
Hay gặp: Đau đầu, mất ngù, ngủ gả
Rối loạn tim
Hiếm gặp: Nhồi mảu cơ tim
Rôi loạn mạch mảu
Hiếm gặp: Tụt huyểt' ap
Rối loạn hô hấp, ngực và trung thất
Rất hiếm ,gặp: Khó thờ, thường ở mức độ nhẹ và
tự biến mất mà không cần điếu trị.
Hay gặp: Ho, viếm mũi.
Ít gặp: Viêm phổi kẽ (xem mục Những cảnh bảo
đặc biệt vả thận trọng khi sử dụng), co thắt phế
quản, thường ở mức độ nhẹ và thoảng qua, không
cần điếu trị.
Rôi loạn tiêu hóa
Rất hay gặp: Nôn, buồn nôn.
Hay gặp: la chảy, viêm miệng và loét miệng. Tảo
bón.
Rõỉ loạn gan mật
Rất hay gặp: Tăng men gan (AST vả ALT) vả
phosphatase kiếm.
Hay gặp: Tảng bilirubin.
Hiếm gặp: tãng gamma-glutamyl transferase
(CGT)
Rôi loạn da và mô mêm
Rất hay gặp: Phát ban dị__ứn thường kèm theo
ngứa. Rụng tóc Ắủĩẵ\
Hay gặp: Ngứa, độúẹ 9hồi. ` C`\
Hiếm gặp: Loét, ,Ểẵnhc thậm hậliẩbẫốg nước hoặc vết
loét, tróc vảy. Ì`" li
› lth Ền
\lĩ` uuvu run…
\… DUY TAN/è/
\
Rất hiếm gặp: Cảc phản ứng nghiêm trọng trên da
như tróc vảy vả bỏng rộp.
Rối loạn cơ xương vả mô liên kết Hay gặp: Đau lưng, đau cơ
Rối Ioạn thặn vả tiết niệu Rất hay gặp: Huyết niệu, protein niệu nhẹ.
Rối loạn toản thân vả phản ứng tại vị trí tiếm Rẩt hay gặp: Cảc triệu chứng giảm củm — cảc
truyền triệu chứng hay gặp nhắt là sốt, đau đầu, ớn lạnh,
đau cơ, suy nhược vả chản ăn Ho, viêm mũi, khó
chịu, đổ mồ hôi và khó ngủ cũng đã được ghi
nhận.
Phùlphù ngoại vi, bao gồm phù mặt. Tinh trạng
phủ thường tự phục hồi sau khi ngừng thuốc.
Hạy gặp: Sốt, suy nhược, ớn lạnh.
Hiếm gặp: Các phản ứng tại vị trí tỉêm truyền,
chủ yếu ở mức độ nhẹ.
Tốn thương, nhiễm độc và cảc biến chứng Nhiễm độc xạ trị (xem mục Tương tảc với cảc
thuôc khảc vả cảc dạng tương tác khảo)
Dữ liêu hâu mai (các bảo cảo tư phảt): chưa rõ tần suất (chưa thể ước lượng tần suất từ dữ liệu hiện
có).
Rõịi Ioan hé thần kinh: Tại biến mạch nãoắ Ả Zt/I
Rôi Ioan tim: Loạn nhịp tim, chủ yếu là rôỉ loạn nhịp trên thẳt. Suy tim. M
Rối loan mach mău. Cảc triệu chứng viêm mạch ngoại vi vả hoại tử.
Rối Ioan hô hấp. ngưc vả trung thăt: Phù phổi, hội chứng suy hô hẳp ở người lớn (xem mục Những
cảnh bảo đặc biệt vả thận trọng khi sử dụng).
Rối Ioan tiêu hóa: Viêm kết trảng do thiếu mảu cục bộ.
Rối loan 2an mât: Nhiễm độc gan nặng, bao gổm suy gan và tử vong.
Rối loan da và mỏ mếm: Cảo phản ứng nghiêm trọng trên da như tróc vảy vả bọng nước, hội chứng
Lyell, hội chứng Stevens-Johnson.
Rối Ioan Ihăn vả riết niên: Suy thận (xem mục Những cảnh bảo đặc biệt và thận trọng khi sử dụng).
Hội chứng tan mảu tảng urê huyết (xem mục Những cảnh báo đặc biệt và thận trọng khi sử dụng).
Tốn thương. nhiễm đỏc vả bỉển chúng: Xạ trị nhắc lại.
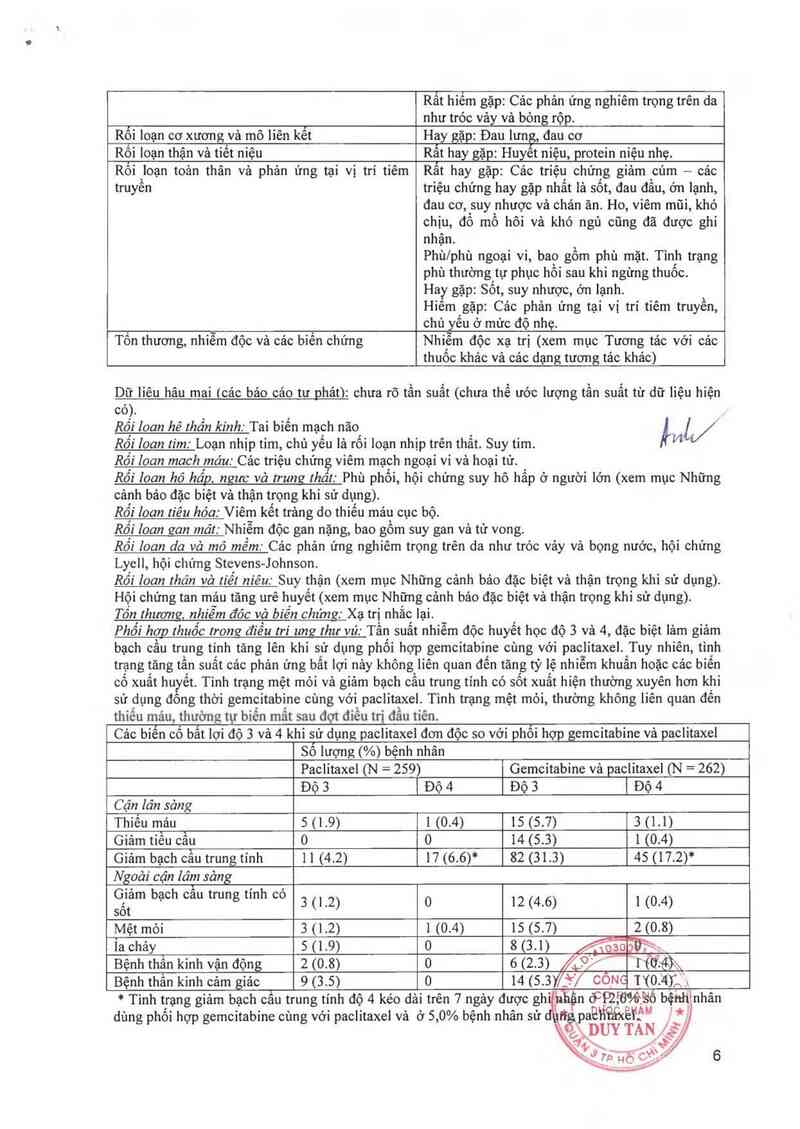
Phối hơp thuốc trong điều tri ung thư vú. Tần suất nhiễm độc huyết học độ 3 và 4, đặc biệt lảm giảm
bạch cầu trung tính tăng lến khi sử dụng phối hợp gemcitabine cùng với paclitaxel. Tuy nhiên, tình
trạng tăng tần suất cảc phản ứng bất lợi nảy không liên quan đến tăng tỷ lệ nhiễm khuẩn hoặc cảc biển
có xuất huyết. Tinh trạng mệt mòi vả gỉảm bạch câu trung tinh có sốt xuất hiện thường xuyên hơn khi
sử dụng đông thời gemcitabine cùng với paclitaxel. Tinh trạng mệt mòi, thường không liên quan đến
thiếu mảu, thường tự biến mât sau đọt điều trị đầu tiên.
Cảo biến cố bất lợi đó 3 và 4 khi sử dụng paclitaxcl đơn độc so vởỉ phối hợp gemcitabine vả paclitaxel
Số lượng (%) bệnh nhân
Paclítaxel (N = 259) Gemcitabine vả paclitaxel (N = 262)
Độ 3 | Độ 4 Độ 3 | Độ 4
Cận lăn sảng
Thiếu mảu 5 (1 .9) 1 (0.4) 15(5.71 3 (1.1)
Giảm tiếu cầu 0 o 14 (5.3) 1 (0.4)
Giảm bạch cẳu trung tính 11 (4.2) 17 (6.6)* 82 (31.3) 45 (17.2)*
Ngoài cận lâm sảng
sGốitam bạch cau trung tmh co 3 (12) 0 12 (4.6) 1 (0.4)
Mệt mòi 3 (1 .2) 1 (0.4) 15 (5.7) 2 (0.8)
Ìachảy 5(1.9> o 8(3.1) …… ,
Bệnh thắn kinh vặn động 2 (0.8) 0 6 (2.3) /Ảỷỳ ươ:4)xx
Bệnh thần kinh cảm giảc 9 (3. 5) o 14 (5. 31/+'/ cỏue wo 41; ,
ỔằQịồ%ẵ ẵố bệiìhìnhân
* Tình trạng giảm bạch câu trung tính độ 4 kéo dải trên 7 ngảy được gh' ủÌiện ]
' ứ
dùng phối hợp gemcitabine cùng với paclitaxel và (1 5,0% bệnh nhân sử
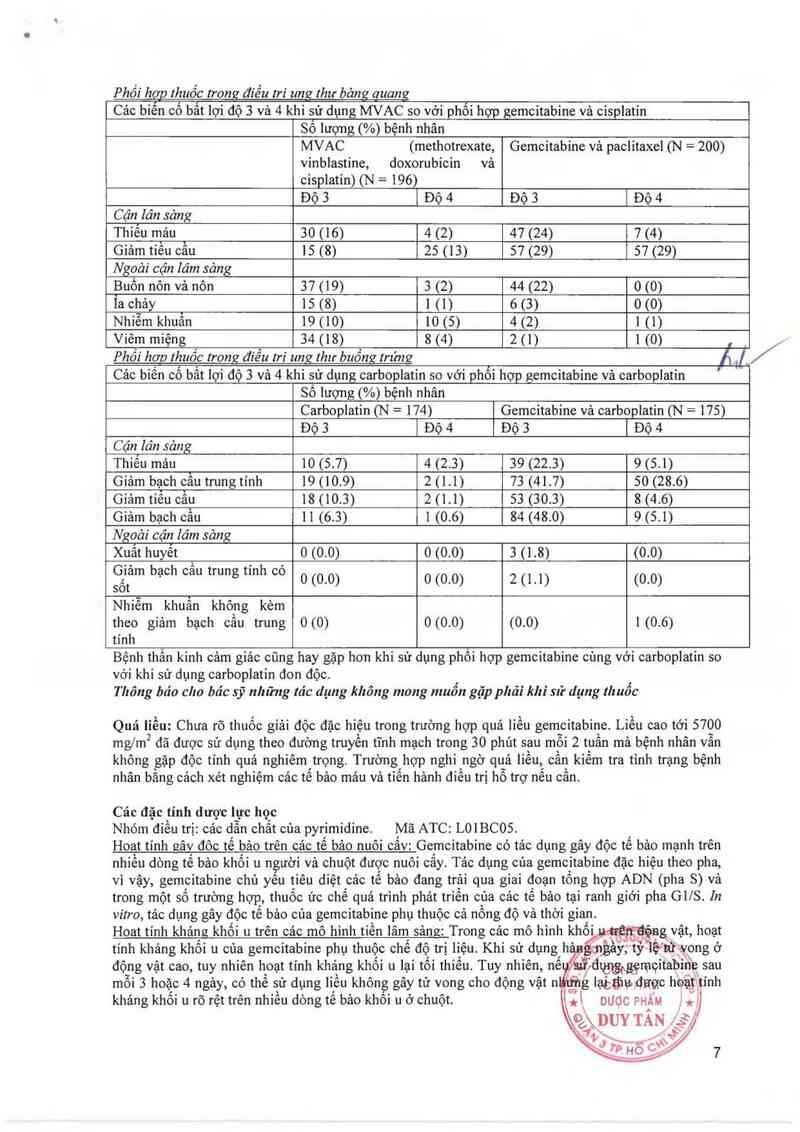
Phối hơp Ihuốc trong điếu tri ung thư bảng auang
Cảc biến cố bẵ lợi độ 3 và 4 khi sử dụng MVAC so với phối hợp gemcitabine vả cisplatin
Số lượng (%) bệnh nhân
MVAC (methotrexate, Gemcitabine vả paclitaxel (N = 200)
vinblastine, doxorubicin vả
cisplatin) (N = 196)
Độ 3 | Độ 4 Độ 3 | Độ 4
Cận lăn sảng
Thiếu mảu 30 (16) 4 (2) 47 (24) 7 (4)
Giảm tiếu cầu 15 (8) 25 (13) 57 (29) 57 (29)
Ngoải cận lăm sảng
Buổn nôn vả nôn 37 (19) 3 (2) 44 (22) mm
Ỉa chảy 15 (8) 1 (1) 6 (3) o (0)
Nhiễm khuẩn 19 (10) 10 (5) 4 (2) 1 (1)
Viêm miệng 34 (18) 8 (4) 2(1) 1(0) , _
Phối hơn Ihuốc rrong điểu tri ung thư buồng trứng 11, ]
Các biến cố bất lợi độ 3 và 4 khi sử dụng carboplatin so với phối hợp gemcitabine vả carboplatin
Số lượng (%) bệnh nhân
Carboplatin (N = 174) Gemcitabine vả carb0plạtin (N = l75)
Độ 3 ] Độ 4 Độ 3 | Độ 4
Cận lân sảng
Thiếu máu 10 (5.7) 4 (2.3) 39 (22.3) 9 (5.1)
Giảm bạch cầu trung tính 19 (10.9) 2 (1.1) 73 (41.7) 50 (28.6)
Giảm tiếu cầu 18 (10.3) 2 (1.1) 53 (30.3) 8 (4.6)
Giảm bạch cầu 11 (6.3) ] (0.6) 84 (48.0) 9 (5.1)
Ngoải cận lâm sảng
Xuất huyết Á 0 (0.0) 0 (0.0) 3 (1.8) (0.0)
ễễltam bạch cau trung t1nh co 0 (0.0) 0 (0-0) 2 (1.1) (0.0)
Nhiễm khuẩn không kèm
theo giảm bạch cầu trung 0 (0) 0 (0.0) (0.0) 1 (0.6)
tính
Bệnh thẩn kinh cảm giảc cũng hạy gặp hon khi sử dụng phối hợp gemcitabine cùng vởi carboplatin so
với khi sử dụng carboplatin đon độc. '
Thông báo cho bác sỹ những tác dụng không mong muôn gặp phải khi sử dụng thuốc
Quá l2iều: Chưa rõ thuốc gỉải độc đặc hiệu trong trường hợp quá liếu gemặcitabỉne. Liều cao tới 5700
mgm2 đã được sử dụng theo đường truyền tĩnh mạch trong 30 phủt sau môi 2 tuần mả bệnh nhân vẫn
không gặp dộc tinh quả nghiêm trọng. Trường hợp nghi ngờ quá Iiếu, cần kiểm tra tinh trạng bệnh
nhân bằng cảoh xét nghiệm cảc tế bảo mảu và tiến hảnh điều trị hỗ trợ nếu cần.
Cảc đặc tính dược lực học
Nhóm điếu trị: các dẫn chẳt của pyrimidine. Mã ATC: LOIBCOS.
Hoat tính Eâv đôc tế bảo trên cảc tế bảo nuôi cấv: Gemcitabine có tảc dụng gây dộc tế bảo mạnh trên
nhỉều dòng tế bảo khối 11 người và chuột được nuôi cẩy. Tác dụng của gemcitabine đặc hiệu theo pha,
vì vậy, gemcitabine chủ yêu tiêu diệt cảc tế bảo đang trải qua gỉai đoạn tông hợp ADN (pha S) vả
trong một sô trường hợp, thuốc ức chế quá trình phát triến của cảc tế bảo tại ranh giởi pha Gl/S. In
vitro, tác dụng gây độc tế bảo cùa gemcitabine phụ thuộc cả nồng độ và thời gian.
Hoat tính khảng khổi 11 trên cảc mô hình tiến lâm sảng: Trong các mô hình khối ẹg vật, hoạt
tính kháng khối u của gemcitabine phụ thuộc chế độ trị liệu. Khi sử dụng h` ` ' JỀẫy, ty ế%ữ gvong ở
động vật cao, tuy nhiên hoạt tinh khảng khối 11 lại tối thiếu. Tuy nhỉên, nệ _ xđtgỵghgẹmcitạbỉne sau
g Iạèfflụđưqc hộặt tính
Ỉị oưoc PHẢM ịỂj
O\DUY TÂN íg/
môi 3 hoặc 4 ngây, có thể sử dụng liếu không gây tử vong cho động vật n ,
kháng khối u rõ rệt trên nhiều dòng tế bảo khôi u ở chuột.
Cơ chế tảc dung: Chuyến hóa tế bảo và cơ chế tảo _dụng: Gemcitabine (dFdC) lá thuốc kháng chuyến
hóa thuộc nhóm dẫn chất pyrimidine, được chuyến hóa nội bảo bởi nucleoside kinase thảnh dạng
nucleoside diphasphat (dFdCDP) vả triphosphat (dFdCTP) có hoạt tinh. Tảc dụng gây độc tế bảo của
gemcitabine là do thuốc ức chế quá trình tổng hợp ADN qua 2 cơ chế tảc dụng của dFdCDP vả
dFdCTP. Trưởc tỉên, dFdCDP ức chế ribonucleotide reductase, lả enzym đặc hiệu xúc tảo cho phản
ứng tạo ra deoxynucleoside triphosphat (dCTP) cần cho quá trình tống hợp ADN. Tảo dụng ức chế
enzym nảy của dFdCDP lảm giảm nồng độ deoxynucleoside và đặc biệt là dCTP. Sau đó, dFdCTP
cạnh tranh vởi dCTP trong quá trình kết hợp với ADN.
Tương tự, một l_ượng nhỏ gemcitabine có thế kết hợp với ARN. Do đó, việc giảm nổng độ dCTP nội
bảo lảm tăng găn kêt cùa dFdCTP với ADN. ADN polymerase epsilon không có khả năng Ioại bò
gemcitabine vả sứa chữa cảc chuỗi ADN đang hoản thiện. Sau khi gemcitabine kết hợp với ADN, chi
có một nucleotide nữa được thêm vảo chuỗi ADN đang hoản thiện. Tiếp đó, quá trình tổng hợp ADN
bị ức chế hoản toản (che đầu tận cùng của chuỗi ADN). Sau khi gắn kết với ADN, gemcitabine gãy
chết tế bảo theo chương trình. #1 L/
Dữ Iiếu lâm _s_ảnz b
Ung thư bảng g_uangz Một nghiên cứu ngẫu nhiên pha III được tiến hảnh trên 405 bệnh nhân mắc ung
thư tế bảo chuyến tiếp niêm mạc tiết niệu tiến triển hoặc di căn cho thấy không có sự khảo biệt giữa 2
nhóm nghiên cứu lả nhóm sử dụng gemcitanine/cỉsplatin so với nhóm sử dụng
methotrexate/vinblastineladriamycinlc_isplạtin (MVAC) khi so sảnh tỷ lệ sống trung binh (lần lưọt là
12,8 vả 14,8 thảng, p= 0 ,,547) thời gian tiển triến bệnh (lần lượt là 7, 4 và 7 ,6 thảng, p= 0,842) và tỷ
Kệ đảp ứng điếu trị (tương ứng là 49,4% vả 45 ,7%, p = 0 ,.512) Tuy nhiên, sử dụng phối hợp
gemcitabine vả cisplatin gây độc tính cao hơn MVAC.
Ung thzr1uv. Trong một nghiên cứu ngẫu nhiên pha III được tiến hảnh trên 126 bệnh nhân mắc ung
thư tụy tiến triển hoặc di cãn, gemcitabine cho tỷ lệ đảp ứng lâm sâng cao hơn đáng k_ế so vởi 5-
fiuorouracil (lần lượt là 23,8% và 4,8%, p= 0 ,0.022) Ngoải rạ, bệnh nhân dược điếu trị bằng
gemcitabine cũng có thời gian tiến triến bệnh kéo dải hơn đáng kể, từ 0,9 đến 2, 3 thảng (p < 0 ,0002)
vả thời gian sông trung binh dải hơn, từ 4, 4 đến 5,7 tháng (p < 0 ,0024) so với nhóm điêu trị bằng 5-
f]uorouracil
Unz thư phối khónz phải tế bảo nhỏ. Trong một nghiên cứu ngẫu nhiến pha III trên 522 bệnh nhân
ung thư phổi không phải tế bảo nhỏ tiên triên tại chỗ hoặc di căn không thế phẫu thuật, sử dụng phối
hợp gemcitabine cùng vởi cisplatin cho tỷ lệ đảng ứng cao hơn rõ rệt so với điều trị bằng cisplatin đơn
độc (lằn lượt là 31,0% vả 12,0%, p < 0 ,.0001) Thời gian tiến triến kéo dải hơn đảng kề, từ 3 ,7 đến 5,6
thảng (p < 0 ,0012) vả thời gian sông trung bình cũng dải hơn, từ 7 ,6 tháng đển 9,1 thảng (p < 0 ,004)
đã được ghi nhận ở những bệnh nhân điếu trị bằng gemcitabine/cisplatin so với nhóm bệnh nhân điếu
trị bằng cisplatin. Trong một thử nghiệm lâm sảng ngân nhiên pha III khảc được tiển hảnh trên 135
bệnh nhân măc ung thư phối không phải tế bảo nhỏ giai đoạn IIIB hoặc IV, phối hợp gemcitabine vả
cisplatin cho tỷ lệ đảp ứng cao hơn rõ rệt so với sử dụng _phối hợp cisplatin vả etoposỉde (lẩn lượt là
40,6% và 21,2%, p = 0 ,.025) Thời gian tiến triên ở nhóm bệnh nhân điếu trị bằng
gemcitabine/cisplatín cũng kéo dải hon đảng kể so với nhóm bệnh nhân sử dụng etoposỉdelcisplatin, từ
4 ,3 đển 6, 9 tháng (p= 0 ,01.4) Trong cả hai nghiên cứu, mức độ dung nạp thuốc là tương tự nhau giữa
2 nhóm điếu trị.
Ung thư buồng trưng Trong một nghiên cứu ngẫu nhiến pha 111,356 bệnh nhân ung thư biếu mô
buồng trứng tỉến triền có tải phảt ít nhất 6 thảng sau khi ngứng điểu trị bằng các thuốc lá dẫn chất cùa
platin được cho dùng ngẫu nhiến cả gemcitabine vả carboplatin hoặc chỉ dùng carbopiatin Thời gian
tiến triển bệnh kéo dải rõ rệt, từ 5,8 đến 8,6 thảng (p = 0,0038) dược ghi nhặn ở nhóm bệnh nhân được
điếu trị bằng gemcitabine vả cạrboplatin so với nhóm bệnh nhân chỉ được sử dụng carboplatin. Sự
khác biệt vê tỷ lệ đáp ứng lả 47,2% ở nhóm dùng gemcitabine cùng với carboplatin so với 30,9% ở
nhóm điếu trị bằng carboplatin (p= 0 ,0016) vả thời gian sông trung binh là 18 thảng (gemcitabine vả
carboplatin) so với 17, 3 thảng (carboplatin) (p = 0 ,73) cho thấy hiệu quả tốt hơn được ghi nhận ở
nhóm sử dụng gemcitabine cùng với carboplatin.
Ung thư vú_. Trong một nghiên cứu ngâu nhiên pha III trên 529 bệ_nh nhâ1_t mắc /.— '. . -,ĩ\s ảt tại
nhóm điếu trị bằng gemcitabine/paclitaxcl là 18, 6 thảng so với 15, 8 thảng ở nhóm sử dụng paclitaxel
(p= 0 ,0489) còn tỷ lệ đáp’ ưng lẩn lưọt là 41 ,4% và 26, 2% (p= 0 ,0002).
Cảo đặc tính dược động học
Dược động_ học của gemcitabine đã được nghiên cứu trên 353 bệnh nhân trong 7 nghiên cứu khảo
nhau, bao gồm 121 nữ và 232 nam tuổi từ 29 đến 79. Trong số bệnh nhân nảy, khoảng 45% bệnh nhân
mắc ung thư phối không phải tế bảo nhỏ và 35% được chẳn đoán ung 2thư tụy. Cảo thông số dược động
học sau đây thu được khi sử dụng khoảng liều tử 500 đến 2.592 mg/m2 sử dụng theo đường truyền tĩnh
mạch trong thời giạn từ 0, 4 đến 1,2 giờ.
Nồng độ đinh của thuốc t_rong huyết tương (được xác định trong vòng 5 phủt sau khi ngừng truyền) là
từ 3, 2 đến 45,5 ụglml. Nồng độ gemcitabine sau khi sử dụng liêu 1.000 mgm_2 truyền tĩnh mạch trong
30 phủt cao hơn 5 pglml kéo dải trong khoảng 30 phủt sau khi kết thúc truyền tĩnh mạch vả cao hơn
0, 4 ụg/ml trong thêm một giờ.
Phân bố: Thể tích phân bố ở ngãn trung tâm là 12,4 le2 đối với nữ vả 17, 5 L/m2 đối với nam (biển
thíên giữa cảc cả thế lả 91 ,.9%) Thể tích hân bố ở ngăn ngoại vi là 47, 4 L/m2. Thể tích ngãn ngoại vi
không biến thiên theo giới tinh. Tỷ lệ thuoc gắn protein huyết tương không đảng kế. Thời gian bản thải
nằm trong khoảng từ 42 đến 94 phút tùy thuộc tuôi và giới tính. Khi sử dụng liêu đề nghị, gemcitabine
được đảo thải gân như hoản toản trong khoảng thời gian từ 5 đến 1 1 giờ tính từ lủo bắt đằu truyẵn/ tĩnh
mạch. Gemcitabine không bị tích 1ủy khi sử dụng chế độ 1iếu một lần môi tuần.
Chuvến hóa: Gemcitabine được chuyến hóa nhanh bởi cytìdine deaminase ở gan, thận, mảu và các mô
khảo. Quá trình chuyến hóa nội bảo của gemcitabine tạo ra gemcitabine mono, di vả triphosphạt
(dFdCMP, dFdCDP vả dFdCTP), trong đó dFdCDP vả dFdCTP lả cảc chẳt có hoạt tính. Cảo chất
chuyền hóa nội bảo nảy không được tim thẫy trong huyết tương hoặc nước tiếu. Dạng chuyến hỏa
chính là 2’-deoxy-2’, 2’-dif1uorouridine (dFdU) không có hoạt tính và được tim thấy cả trong huyết
tương và nước tỉếu.
Thải trừ: Tốc độ thanh thải toản thân cùa thuốc là từ 29, 2 L/giờ/m2 đến 92, 2 L/giờ/m2 tùy thuộc giới
tinh và tuổi (biến thiến giữa cảo cá thể là 52 ,.2%) Độ thanh thải ở nữ giới thấp hơn gân 25% so vởi_ ở
nam giới Mặc dù thuốc được đảo thải nhanh nhưng_ tốc độ thanh thải ở cả nạm và nữ giảm theo tuổi.
Khi sử dụng liếu gemcitabine đề nghị là 1000 mg/m2 truyền tĩnh mạch trong 30 phút, không oần giảm
liếu gemcitabine nêu độ thanh thải ở nam iới hoặc nữ giới giảm. Tỷ lệ thuốc đảo thải 2qua nước tỉểu ít
hơn 10%, dưới dạng không chuyến hóa. Tôc độ thanh thải qua thận lả 2 đển 7 L/giờ/mẤ
Trong tuần sử dụng thuốc, 92 đển 98% liều gemcitabine được đảo thải, 99% qua nước tiếu, chủ yếu
dưới dạng dFdU và 1% được thải trừ qua phân. _ _ _
Dươc đông hoc oùa dFdCTP: Chât chuyên hóa nảy có thế tim thây ở cảc tế bảo đơn nhân trong mảu
ngoại vi và cảc dữ liệu tiếp theo thu được khi nghiên cứu trên cảc tế bảo nảy. Nồng độ dFdCTP nội
bảo tăng tỳ_ lệ với liếu gemcitabine trong khoảng liếu từ 35- 350 mg/m²l3O phứt còn nồng độ thuốc ở
trạng thái ôn định là 0, 4 — 5 pg/ml. Khi nông độ gemcitabine cao hơn 5 ug/ml, nông độ dFdCTP
không tăng. Điều nảy cho thắy qu_ả trình tạo ra dFdCTP đã bão hòa trong các tế bảo nảy. Thời gian bản
thải của dFdCTP lả từ 0, 7— 12 giờ.
Dươc đông hoc cùạ dFdU: Nồng2 độ đinh của dFdU trong huyết tương (3-15 phủt sau khi kểt thủc
truyền tĩnh mạch liều 1000 mg/m trong 30 phút) lả 2852 ụglm1. Nồng độ đảy ẹau khi sử dụng thuốc
một lần mỗi tuần là 0, 07 — 1, 12 ụg/ml và thuốc không bị tích lũy. Đường cong nồng độ dFdU theo thời
gian chia lảm 3 pha, thời gian bán thải trung binh ở pha cuối lả 65 giờ (trong khoảng 33— 84 giờ). Tỷ
lệ dFdU hinh thảnh từ gemcitabine là 91— 98%. Thể tích phân bố trung binh ở ngăn trung tâm là 18
L/m2 (trong khoảng 11 — 22 L/m2 ).
Thể tích phân bố trung bình cùa dFdU ở trạng thái ổn định là 150 LJm² (trong khoảng 96-228 LJm²>.
Loại mô phân bố: rộng rãi.
Tốc độ thanh thải biếu kiến trung bình: 2, 5 L/giờ/m2 (trong khoảng 1 — 4 L/giờlm2 ).
Đảo thải qua nước tiếu: 100%
Phối hop gemcitabine vả paclitaxel : Sử dụng phối hợp gemcitabine vả paclitaxel không ảnh hưởng
đến dược động học của mỗi thuốc. _ “
Phối hơp gemcitabine vả carboplạtin : Khi sử dụng phôi hợp với oarbopl '
gemcitabine không thay đổi.
Suv thân : Suy thận nhẹ đến vừa (tốc độ lọc cầu thận từ 30 ml/phủt đến 80
đáng kể đến dược động học cùa gemcitabine.
Tuong kỵ
Không được trộn lẫn gemcitabine với bất kì thuốc nảo khảo, trừ cảc chế phầm được đề cập ở mục
Những lưu ý đặc biệt vế việc pha chế vả xử lý loại bò.
Hạn đùng
Lo chưa mở: 24 thảng kế từ ngảy sản xuất.
Dung dich sau khi pha: Dung dịch sạu khi pha có nồng độ 38 mng ổn định về mặt hóa học và vật lý
trong 35 ngảy khi bảo quản ở 25°C. Không nên bảo quản dung dịch gemcitabine sau khi pha trong tủ
lạnh do thuốc có thế bị kết tinh.
Dung dịch gemcitabine pha loãng trong natri clorid 0, 9% có nồng độ từ 0,1 mg/mL đến 30 mg/mL ỏn
định vẻ mặt vật lý vả hóa học khi bảo quản ở điếu kiện thường (nhiệt độ từ 15— 25°C, ánh sáng thông
thường) hoặc trong tủ lạnh (2— 8°C) trong gần 72 giờ (3 ngảy).
Để đảm bảo chế phẳm không bị nhiễm vi sinh vật, dung dịch sau khi pha và pha loãng phải sử dụng
ngay. Nếu chưa sử dụng ngay, phải bảo quản dung dịch ở điểu kiện thich hợp vả thông thường không
nên bảo quản trong thời gian hơn 24 giờ ở nhiệt độ phòng, trừ khi việc pha chế dung dịch (vả pha
loãng thêm) được tiến hảnh trong điếu kiện vô khuẩn và môi trường pha chế được kiểm soát chặt chẽ.
Những luu ý đặc biệt về vỉệc pha chế và xử lý loại bỏ
Luu v khi sử dung: _Cần tuân thủ những lưu' y vê an toản đối với cảc thuốc gây độc tể bâo khi chuẩn bị
pha chế và loại bỏ dịch truyền. Việc xử lý dịch truyền phải được tiến hảnh trong hộp an toản với quần
áo vả găng tay bảo hộ Nếu không có hộp an toản, cần sử dụng thêm mặt nạ và kính bảo hộ. Nếu để
chế phấm tỉếp xúc với mắt, thuốc có thể gây kích' ưng mạnh. Phải rừa kỹ mắt ngay lập tức bằng nước
sạch. Nếu mắt vẫn còn bị kich' ưng, cần tham vấn ý kiến bác sĩ. Nếu dung dịch bị rây vảo da, phải rứa
kỹ vởi nước sạch.
Hướng dẫn pha chế (vả tiếp tuc nha loãng): Dung môi duy nhẩt được phép sử dụng để hòa tan bột võ
khuẩn gemcitabine là dung dịch natri clorid 9 mglml (0, 9%) dùng để pha tiêm (không có chẳt bảo
quản). Do giới hạn về độ tan, nổng độ dung dịch gemcitabine tối đa có thể đạt được sau khi pha là 40
mglml. Cẩn trảnh pha dung dịch có nổng độ cao hơn 40 mglml vì có thế thuốc không tan hoản toản.
1 Sử dụng kỹ thuật vô trùng trong quá trình pha và pha loãng dung dịch gemcitabine truyền tĩnh
mạch.
2. Đề pha dung dịch, thêm 5 ml dung dịch natri clorid 9 mng (0, 9%) vô khuẩn dùng để pha tiêm,
không có chất bảo quản vảo lọ 200 mg hoặc thêm 25 ml dung dịch natri clorid 9 mglml (0, 9%) vô
khuẩn vảo lọ 1 g hoặc thêm 50 ml dung dịch natri c1orid 9 mglml (0, 9%) vảo lọ 2 g. Tồng thể tích
dung dịch sau khi pha lần lượt lả 5,26m1(1ọ 200 mg), 26, 3 ml(1ọ 1 g) vả 52,6m1(1ọ 2 g). Dung dịch
gemcitabine sau khi pha có nổng độ 38 mglml. Lắc đế bột tan hoản toản. Tiếp tục pha loãng bầng
dung dịch natri clorid 9 mglml (0. 9%) không chứa chất bảo quản. Dung dịch sau khi pha phải trong,
không mảu hoặc có mảu vảng nhạt. _,
3. Phải kiếm tra cảc chế phẩm tiêm truyền bằng mắt thường để phát hiện bất kỳ tiếu phân nảo không
tan hoặc hiện tượng bỉến mảu trước khi sử dụng. Nếu quan sảt thấy tỉếu phân không tan thi không
được sử dụng.
Bất kỳ phần thuốc nảo không sử dụng cần phải loại bỏ theo đủng quy trình chuẩn tại cơ sở điều trị.
Bão quản: Bảo quản dưới 30°C
"ỔỂÃWR
Đóng gỏi : Hộp 01 lọ ,yỊỌ; ?ỉ—_O\
›r/ CÔNG TY \Ềw\
Sản xuất bởi : íVỆ cỏ PHẢN ịĨị
ouoc PHẨM , Ị/
-\OỘ\ DUY TÂN ếễ/
Pharmachemie BV
Swensweg 5, 2031 GA Haarlem
PHÓ cuc TRUÒNG
Jiỷuyéẵz7’aửn %ámả …
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng