









"' ỒWW/uĩ Im
BỘ Y TẾ
cục QUÁN LÝ DƯỌC
ĐÃ PHÊ DUYỆT
Lân đẩuz.,i- ..l...… ….lẵíềfiở.
ĐW 000ZVA31. ị __
ENIGV.LDWBĐ `
nusngm IOl i
nounm uoc !… OHHINOA1 … I
" | VÌAI. LVOỈHILIIED POWDỂR FOR ml.me IVIÀI. LVOFHIUZED POWDER FOR SOLUTĐON Ì VlẦl. LmPNIUÉD meỀR ỈOR 5amlơl ÌVIAL LVOFHIUĨỂO POWDỂỂ ỂOR SuƯnffl
f0ll lỈỔUSDN FOR INFU5ỒN FOR lNFUSÀON ỂOR INFUSION
_. _ SĐK: VN-xxxx-xx. Hoat ehát: Sinxuẩl bởi:Ị
RX thuoc ke đơn Gemcitabine Hydrochloride Phì…ỉcmm'e BV
} tương đương Gemcitabine ỆỂ'Ệ'ỄẮẺỂSL GA Hunem
GEMCITABINE * 2009mng. Hôp 91 lo bòt đong 1 GEMCITABINE c…m .…. .….nh, ……ng. nè.. ;
khó pha tiêm truyền. Đường \ dùniẫảliịdeunảni'ỏnc mong i'nuõn lvả i
' - ² “ iu nuu':xomro '
TEVA 2000 MG ẵuDrĩgsẵrỏyesatịnerịnmệẵịc-ẵNỀỀTE. TEVA 2000 MG . ỉằngĩdãẹrựịịcìụntgù ẻaễmủggrliẵ'ẵ't
“EXP DATE' vả 'BATCH NO.“ dunỉkẻrxn theo. ẵoc kỷvhưnẵng diunưcừ
trèn beo bl. Bảo quán duởi dung mm … dùng. DNNK: xxxxx
30°C. Đê xa tảm tay trẻ em.
ỂAEN WL CONĨẦINS
GEMOTẦEINE NVDHOCNIOIIDỂ
!…
E VAI.
T0 GỂMCITMINE ]… MG
FOR SINGLE USS om. Y. uNovENEn WAL-
srơư ustow ›o°c
KM] YH! LEAFLI'Y Fm YH!
SNKIFƯECI TN
FOR SINGLE USE ONLY
luv tnuavenous use
aftev ơeconnltullon
Ior lntravenous use
after reconstttulion.
AFTEQ chousmtmcu
ẫ“ằẵằf 'smẩwẵẵ"ỗe “mum'u'm ' mm
nno THE nchs: ° “ ”c' ' READ me PAchse Dow mmAư …
LEAFLE'I sEFORE use mưun ezscas use ucoumnnm su.ưnou
MA…ỈĨOL ỚỂỐÌÌ],
sẫẫẵ'ốấcẵviầẫẵm u^Ể'ẵwsn ' "°… °“ ""“
. TẾ Ầl SWLD If UVDSỂD Ư
CV T OT OXIC wmmcumucaqn CY T OT OXIC … Accou DAth wmc
l.ưẨL KWưUẺN'Tẩ
Sli MLỈĨ … ỈUITM
Mith VlIn ưWẦW llơ M ơ M IlẦCN
.. N …… … neu ơ Mn
lu…uuv
PN›`.HMJU HlM1t r(.
Ìỉ
'Mi4Rh'ĩi`ni 'HM! li`L
11
1 t-AỈÌMACZMEMII 1^
93 IM 573-A
EAYCM NO.
MFG.DAỈI' — Í = ===
EXF DATE'
1
Foưhựun .Mthe
padagebnfflgzzlhleuse.
’ ’ _ 1II 1 ị
GEMCITABINE TEVA 2000 MG ' )
Gundtúlu au…mmu cqv. to —’———— “~ .
Gcntllalinl nu mg 1
1 VIAL ưomuzso mwntu mu sou.ưnou
ron Muan …
Foa mnuvmous usE : ` _
Ế ama nscousmunou —
ỉ —
ư…udwdstợư
out of
ầẫldtm
IATEH ND
ĐIF. NV 5
cố PHẨN
DƯỌC PHẨM
Đọc kỹ hướng dẫn sử dụng Irước khi dùng. Nếu cẩn Ilzêm leõng tin xin Im'i ý kiến bác sỹ. Để thuốc
ngoải lẩm lay Irẻ em. T lmoc năy chỉ dùng theo đơn của bác sỹ.
GEMCITABINE TEVA 2000 MG
Bộ! đông khô pha tiêm truyền
Thânh phần: Mỗi lọ có chứa:
- Họat chải: Gemcitabine hydrochloride tương đương với Gemcitabine 2000 mg
- T a' dược: Mannitol, Sodium acetate trihydrate, Sodium hydroxide (IN), Hydrochloric acid, Nưỏc pha
tiêm ư
Chỉ đinh điểu trị Ả'"L
Gemcitabin được chỉ định phối hợp với cispiatin trong điều trị ung thư bảng quang tiển tríền tại chỗ
hoặc di cản. Gemcitabine được chỉ định điều trị cho những bệnh nhân ung thư biểu mô tuyến tụy tiến
triền tại chỗ hoặc di căn. Gemcitabine được chỉ định hối hợp với ciSplatin như liệu phảp điều trị ban
đầu cho những bệnh nhân ung thư phổi không phải te bảo nhỏ tiến triển tại chỗ hoặc di căn. Có thế cân
nhắc sử dụng gemcitabine đơn trị Iỉệu cho bệnh nhân cao tuồi hoặc bệnh nhân ung thư phồi không
phải tế bảo nhỏ giai đoạn 2. Gemcitabin được chỉ định phối hợp với carboplatỉn đề điểu trị cho những
bệnh nhân ung thư bỉểu mô buồng trứng tiến triển tại chỗ hoặc di cãn, bệnh nhân ung thư tải phảt sau
khoảng thời gian tối thiểu lả 6 tháng sau khi điếu trị bằng liệu phảp ban đầu là một dẫn chất của platin.
Gemcitabin được chỉ định phối hợp với paclitaxel để điều trị cho nhũng bệnh nhân mắc ung thư vú tái
phát tại chỗ hoặc di căn không thể phẫu thuật sau khi được điều trị bằng một thuốc chống ung thư
thuộc nhóm dẫn chắt anthracyclin.
Liều lượng và cảch dùng
Chỉ những bác sĩ đã có kinh nghiệm dùng thuốc chống ung thư mới được phép sử dụng gemcitabine.
Liều để nghỉ
Ung thư bảng guang
Phối hợp thuốc. Liều gemcitabine đề nghị 121 1000 mglm2 bề mặt cơ thể, truyện tĩnh mạch trong 30
phủt. Nên sử dụng thuốc vảo ngảy thứ 1, 8 vả 15 của đợt điếu trị 28 ngây, phối hợp với cisplatin. Liều
cisplatin đề nghị lả 70 mg/m2 vảo ngảy thứ 1 sau khi sử dụng gemcitabin hoặc vảo ngảy thứ 2 của đọt
điều trị 28 ngảy. Sau đó lặp lại chu kì điều trị 4 tuần. Có thể giảm liều sau môi đọt điều trị hoặc trong
một đọt điều trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân.
Ung thưtuv. Liều gemcitabin đề nghị lả 1000 mglm², truyền tĩnh mạch trong 30 phút. Sử dụng lặp 1ại
một lần mỗi tuần trong thời gian tới 7 tuần, sau đó nghi 1 tuần. Trong các đọt điếu trị tiếp theo, sử
dụng thuốc một lần môi tuần trong 3 tuần liên tiếp cùa đợt điếu trị 4 tuần. Có thể giảm liêu sau mỗi đợt
điều trị hoặc trong một đợt điều trị tùy theo mức độ độc tính cùa thuốc đối vói bệnh nhân.
Uma thzmhối không phải tế bảo nhỏ
Đon trị liệu: Liều gemcitabin đề nghị là 1000 mglm², truyền tĩnh mạch trong 30 phủt. Sử dụng lặp lại
một lần mỗi tuần trong thời gian tới 7 tuần, sau đó nghỉ 1 tuần. Sau đó lặp lại chu kì điếu trị 4 tuần. Có
thể giảm liều sau mỗi đọt điều trị hoặc trong một đợt đỉều trị tùy theo mức độ độc tính cùa thuốc đối
với bệnh nhân.
Phối hợp Ihuổc. Liều gemcitabine đề nghị lả 1250 mg/m2 bề mặt cơ thể, truyền/tmlị 'mạch Sfong 30
phút vảo ngảy thứ 1 và 8 của đợt điểu trị 21 ngảy. Có thể giảm liều sau môi đgtịĩiềii trị hoặcụ thang một
đợt điều trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân. Sử dụng oisbiatifiÔỉềữ tửY75- 1.00
mglm2 mộtlầnsaumỗi3tuần. …. co PHẢN f_
Unglhưvủ \r .'11L111'. n'1M -ứl
Phối hợp lhuốc. Gemcitabine được khuyến cảo sử dụng phối hợp với pacl1ta›xễihẽu'Ữấ l
truyền tĩnh mạch trong 3 gíờ vảo ngảy thứ 1 của đọt điêu trị, sau đó sư dụng gem'bịỉabiue li_cụ ,
mg/m2 truyền tĩnh mạch trong 30 phủt vảo ngảy thứ 1 và 8 cùa đọt điểu trị 21 nga `
sau mỗi đọt điều trị hoặc trong một đợt điều trị tùy theo mức độ độc tính cùa thuốc đối với bệnh nhân.
Số lượng bạch cầu hạt của bệnh nhân tối thiểu phải là 1500 x 10°1ê’ bảo/L trước khi bắt đầu điều trị
bằng gemcitabine phối hợp với paclỉtaxel.
Ung [hư buống trứng
nzằ~
Phối hợp thuốc: Gemcitabine được khuyến cáo sử dụng phối hợp với carboplatin trong điều trị ung
thư buồng trứng Liều gemcitabine là 1000 mglm², truyền tĩnh mạch trong 30 phủt, sử dụng vảo ngảy
thứ ] và 8 của đợt điếu trị 21 ngảy. Sau khi sử dụng gemcitabine, tiếp tục dùng carbopiatin vảo ngảy
thứ 1 để đạt trị sô diện tich dưới đường cong (AUC) mục tiêu cùa carboplatỉn lả 4 ,0 mglml~phứt. Có
thế giảm liều sau môi đợt điều trị hoặc trong một đợt đỉều trị tùy theo mức độ độc tính cùa thuốc đối
với bệnh nhân.
Theo dõi đôc tính của thuốc và hiêu chinh liếu
Hiéu chinh liều do đôc tính ngoải hê lao mău: Cần kiếm tra sức khỏe định kì và đảnh giả chức năng
thận và gan đế phảt hiện độc tính cùa thuốc ngoải hệ tạo máu. Có thể giảm liếu sau môi đọt điều trị
hoặc trong một đợt điều trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân. Thông thường, đối
vởi trường hợp độc đính ngoải hệ tạo mảu nặng (độ 3 hoặc 4), trừ buồn nôn/nôn, nên ngứng sử dụng
gemcitabine hoặc giảm liếu tùy theo chỉ định của bảc sĩ. Nên ngừng dùng thuốc cho đển khi độc tmh
của thuốc đã được khắc phục_ Đề hiệu chinh liểu cispiatin, carboplatin vả paclitaxel khi sử dụng phối
hợp với gemcitabine, cần tham khảo Tóm tắt đặc tính sản phầm cùa môi thuốc.
Hiêu chinh liều do đôc tính Irên hê tao máu
Bắt đồn đợt điều tri. Với tất cả cảc chỉ định, cần kiếm tra số lượng tiếu cầu và bạch cầu hạt cùa bệnh
nhân trước mỗi lần sử dụng thuốc. Bệnh nhân phải có số lượng bạch cầu hạt tối thiểu là 1.500 x 106 tế
bảo/L và ít nhất 100.000 x 10ô tiểu cầu/L trưởc môi đọt điều trị.
Trong đợt điều lrị. Nến hiệu chỉnh liếu gemcitabine trong một đọt điếu trị theo bảng duới đây:
Hiệu chỉnh liều gemcitabine trong một đợt điều trị ung thÃư bâng ơquang, ung thư phổi không
phãi tế bảo nhỏ và ung thư tụy, sữ dụng đơn độc hoặc phổi hợp vói cisplatin
Số lượng bạch cầu hạt Phần trăm so với liều
Số lượng tiễu cầu (x 106/L)
(x 106/L) gemcitabine chuẩn (%)
> 1.000 vả > 100.000 100
500 - 1000 hoặc 50.000 - 100.000 75
< 500 hoặc < 50.000 Ngừng sử dụng*
* Không nên sử dụng thuốc trở lại trong cùng một đọt điêu trị cho đên khi sô lượng bạch cấu hạt đạt
tối thiếu 500 x 10 6/I.. và số lượng tiêu câu ít nhất lả 50. 000 x lOỏ/L.
* Không nên sử dụng thuốc trở lại trong cùng một đợt điểu trị. Bắt đằu dùng thuốc vảo ngảy thứ 1 cùa
đọt <ẳiếu trị tiếp theo nểu số lượng bạch câu hạt đạt 1.500 x 106 tế bảo/L và số lượng tiếu câu là 100.00
x 10 lL.
* Không nên sử dụng thuốc trờ iại trong cùng một đợt điều trị. Bắt đằu dùng thuốc vảo ngảy thứ 1 cùa
đợt điếu trị tiếp theo nếu số lượng bạch câu hạt đạt 1 5.00 x 106 tể bảo/L và số 1ượng tiếu cầu là 100.00
x 10°7L.
Hiệu chỉnh liều gemcitabine trong một đợt điếu trị ung thư vú, phổi hợp với paclitaxel
Số lượng bạch cầu hạt
Số lượng tiễu cầu (x 106/L)
À - … .À
Phan tram so VO'I lieu
(x 10°7L) gemcitabine chuẩn (%)
› 1.200 và › 75.000 100
1.000 - < 1.200 hoặc 50.000 - 75.000 75
700 - < 1.000 vả 2 50.000 50
< 700 hoặc < 50.000 Ngừng sứ dụng*..ạ
/ › ""4. .,
Hiệu chỉnh liều gemcitabine trong một đợt điếu trị uug thư buồng trứng, p'hẺi lỀợỔJY'ỞifV ` …\
carboplatin
iG Pnạ.› \. "1ỂI11
Số lượng bạch cầu hạt
(x 10°71.)
Số lượng bạch cầu hạt
(x 10°71.)
Số lượhẵbạcịỵqầu hạm ắryi
(x10°711)ẹ -,,, t…
› 1.500 và › 100.000 100 ~_JỈ ,P/
1.000 - 1.500 hoặc 75.000 - 100.000 50 ỉ ~» ~. _ 7/
< 1.000 hoặc < 75 000 Ngừng sử dụng*
Hiệu chinh Iiếu gemcitabine do độc lính !rẻn huyế! học lrong các đợt điêu lrị Iỉêp suu cho lá! cờ cảc
chỉ định
Nên iảm liểu emcitabine xuốn còn 75% so với liều khới đầu tron cảc trườn h, nhiễm độc huyết
g 8 8 g g o'P
học sau:
0 sỏ iượng bạch cầu hạt < 500 x 10°71. kéo dải quả 5 ngảy
0 Số lượng bạch cầu hạt < 100 x lOôlL kéo dải quá 3 ngảy
0 Giảm bạch cầu trung tính có sốt
0 Số lượng tiếu câu < 25. 000 x 106/L
O Chậm bắt đầu đợt điếu trị quả 1 tuần do độc tính.
Cách dùng: Gemcitabine được dung nạp tốt khi truyền
,pỳffllỡ
cố FHẤN
ocđc PHÁỀ
và xứ lý loại bò.
th Ồ.—S dụng trong khi di
, Ếzỹáityền sang truyền vảo
một tĩnh mạch khác. Cần theo dõi chặt chẽ tình trạng bệnh nh
Về hướng dẫn cách pha chế, xem mục Những lưu ý đặc biệt về vi_`
Các nhóm bênh nhân đảo biêt
Bênh nhân suv thân hoãc suv zan: Cần thận trọng khi sử dụng gemcitabine cho bệnh nhân suy thận
hoặc suy gan do chưa có đủ thông tin từ các nghiên cứu lâm sảng cho phép đưa ra khuyến cảo liều
chính xảc cho những bệnh nhân nảy (xem mục Những cảnh báo đặc biệt và thận trọng khi sử dụng và
Cảc đặc tính dược Ịđộng học).
Bênh nhân cao tuỏi (> 65 mồiị: Gemcitabine được dung nạp tốt ở những bệnh nhân trên 65 tuồi. Chưa
có băng chứng thẳy cần phải hiệu chỉnh liều khi sử dụng cho bệnh nhân cao tuổi (xem mục Cảo đặc
tính dược động học).
Trẻ em: Gemcitabine đã được nghiên cứu trên trẻ em trong cảc thử nghiệm lâm sảng pha [ và pha II
trong nhiều trường hợp khối u khác nhau. Cảc nghiên cứu nảy chưa cung cấp đủ dữ iiệu chứng minh
hiệu quả và độ an toản cùa gemcitabine trên trẻ em. Ị1’M ,Ll/
Chống chỉ định
Quả mân với gemcitabine hoặc bất kì thảnh phần nảo của thuốc.
Phụ nữ cho con bú (xem mục Sử dụng cho phụ nữ có thai vả cho con bủ).
Những cãnh báo đặc biệt và thận trọng khi sử dụng: Sử dụng thuốc theo đường truyền tĩnh mạch
trong thời gian dải và tăng số liều dùng có thề lảm tăng độc tính.
Đôc tinh trên hê tao mảu: Gemcitabine có thế ức chế chức năng của tùy xương, biều hiện bằng giảm
bạch cầu, giảm tiểu cầu và thiếu mảu. Bệnh nhân được điểu trị bằng gemcitabine cần được kiếm tra sô
lượng tiểu câu, bạch cầu và bạch cầu hạt trước môi liều sử dụng. Nên cân nhắc ngửng thuốc hoặc hiệu
chỉnh liều khi phảt hiện tinh trạng ức chế tủy xương do thuốc (xem mục Liều lượng và cảch dùng).
Tuy nhiên, tình trạng ức chế tùy xương chỉ kéo dải trong thời gian ngắn và thường không cẩn phải
giảm liếu và hiếm khi phải ngừng thuốc. Số lượng tế bảo mảu ngoại vi có thế tiếp tục gìảm sau khi đã
ngừng sử dụng gemcitabine. Ở bệnh nhân bị giảm chức năng tủy xương, cần thận trọng khi bắt đầu
điếu trị bằng gemcitabine. Giống như cảc thuốc gây độc tế bảo khác, cân lưu ý nguy cơ ức chế tủy
xương tích lũy khi gemcitabine được sử dụng cùng vởi cảc thuốc hóa trị liệu khảc
Suv gan: Sử dụng gemcitabine cho bệnh nhân mang khối u gan di căn hoặc có tiền sử viêm gan,
nghiện rượu hoặc xơ gan có thể lảm nặng thêm tình trạng suy gan sẵn có.
Cận định kỳ kiềm tra chức năng gan và thận (bao gồm cả cảc xét nghiệm vi sinh vật).
Cần thận trọng khi sử dụng gemcitabine cho bệnh nhân suy thận hoặc suy gan do chưa có đủ thông tin
từ cảc nghiên cứu lâm sảng cho phép đưa ra khuyến cảo liều chinh xảc cho những bệnh nhân nảy (xem
mục Liều lượng và cách dùng).
Xa tri đổng thời: Xạ trị (sử dụng đổng thời hoặc cảch xa < 7 ngậy): Độc tính đã được ghi nhận (xem
mục Tương tảo vởi các thuốc khảo và cảc dạng tưong tảc khác để biết thông tin chi tiết và khuyến cảo
sử dụng).
Các vảc- -xin chừa vi sinh vât sốn1z:Không khuyến cáo sử dụng vẳc- -xin sốt vảng hoặc cảc chế phẩm
vắc- xin có chứa vi sinh vật sống đã được lảm yêu cho bệnh nhân đang điếu trị bằng gemcitabine (xem
mục Tương tảc vởi cảc thuốc khảc vả cảc dạng tương tảc khảc).
Tỉm mach: Do nguy cơ rối loạn tim vả/hoặc mạch mảu khi sử dụng gemcitabine, phải đặc biệt thận
trọng khi sử dụng, thuốc cho bệnh nhân có tiến sứ gặp cảc biến cố tim mạch.
_P__hổiz Tảo dụng bất lợi của thuốc trên phổi, đôi khi ở mức độ nghiêm trọng (như phù phổi, viêm phối
kẽ hoặc hội chứng suy hô hấp) đã được ghi nhận khi sử dụng gemcitabine. Chưa rõ nguyên nhân chính
xác của cảc tình trạng nảy. Nếu phảt hiện cảc tình trạng như vặy, cân cân nhắc ngừng sử đụng
gemcitabine. Áp dụng cảc biện phảp điếu trị hỗ trợ sớm có thể giúp cải thiện các tình trạng nảy.
T_hân: Kết quả nghiên cứu lâm sảng ghi nhận hội chứng tan huyết tăng urê máu với tẩn suất hiếm gặp
ở bệnh nhân điếu trị bằng gemcitabine (xem mục Tảc dụng không mong muốn). Nên ngừng sử dụng
3
)..1/
gemcitabine khỉ phảt hiện bẫt kì dấu hiệu thiếu mảu tan mảu vi , '… ơn hemoglobin nhanh
kèm theo giảm tiêu cầu, tăng bilirubin huyết thanh, creatini , ijyeẻ ỔỀỸỔhP 1tơĨgÌ e huyết hoặc lactat
dehydrogenase (LDH). Tình trạng suy thận không thể phục àl(khL—QEEỌẶỊIIUỔỀ bệnh nhân có thế
cần phải đ lọc mảu nhân tạo. uSịệ DUOC PHAM 1
-300-
. #.
Chức năng sinh sản: Trong cảc nghiên cứu về sinh sản, ge 1fflgậyrfflìgnJ/Sùịh tinh ở chuột đực.
Vì vậy, nam giới đang được điếu trị bằng gemcitabine không ' po con tron & ildùng thuốc và tới 6
thảng sau khi ngừng điểu trị và nên bảo quản lạnh tinh trùng t Ềrị bằng gemcitabine do
nguy cơ vô sinh sau khi dùng thuốc (xem mục Sử dụng cho phụ nữ c 1 va cho con bủ).
N_a_tri: Gemcitabine 200 mg có chứa 3,5 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho
bệnh nhân đang' ap dụng chế độ an giảm natri. Gemcitabine 1000 mg có chứa 17, 5 mg (< 1 mmol) natri
trong mỗi lọ. Cần lưu ý khi sử dụng cho bệnh nhân đang áp dụng chế độ ăn gíảm natri. Gemcitabine
2000 mg có chứa 35 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho bệnh nhân đang’ ap
dụng chế độ ăn gỉảm natri.
Tương tác với các thuốc khảc và các dạng tương tác khảc
Chưa tiến hảnh nghiên cứu đặc hiệu nảo vê tương tảo thuốc (xem mục Các đặc tính dược động học)
Xa _tri: Sử dụng đổng thời (sử dụng cùng lúc hoặc cảch xa < 7 ngảy): Độc tinh đã được ghi nhận khi sử
dụng phối họp hóa trị và xạ trị phụ thuộc vảo nhiều yếu tố khảo nhau bao gồm liều gemcitabine, tẩn
suất sử dụng, liếu xạ trị, kỹ thuật xạ trị, mô đích và thế tich xạ trị. Cảo thử nghiệm tiền lâm sảng vả
lâm sảng cho thấy gemcitabine có hoạt tinh nhạy cảm xạ trị. Trong một thử nghiệm lâm sảng, khi sử
dụng gemcitabine liều 1.000 mg/m2 trong 6 tuần 1iên tiếp cùng với xạ trị vùng ngực cho bệnh nhân
măc ung thư phổi không phâi tế bảo nhò, tình trạng độc tính ở mức độ nghiêm trọng và viêm niêm
mạc có thể đe dọa tinh mạng, đặc biệt lả viêm thực quản vả viêm phổi đã được ghi nhận, nhất là ở
bệnh nhân sử dụng thể tích xạ trị lởn [thể tích xạ trị trung bỉnh lả 4.795 cm 3_]. Cảc nghiên cứu tiếp sau
cho thẳy có thế sử dụng gemcitabine liếu thấp hon cùng với xạ trị do có thể kiếm soát được độc tính,
chẳng hạn như trong một nghiên cứu pha [1 trên bệnh nhzân ung thư phối không phải t2ế bảo nhờ sử
dụng liếu xạ trị lả 66 Gy cùng với gemcitabine (600 mglmz, 4 lấn) vả cisplatin (80 mglm², 2 lần) trong
6 tuần. Chế độ trị liệu tối ưu an toản khi sử dụng gemcitabine cùng với xạ trị chưa được xác định trong
điều trị tất cả các loại khối 11 _Không sử dụng đông thời (cảch > 7 ngảy): Phân tích dữ liệu nghiên cứu
không phảt hiện thấy bất kỳ nguy cơ tăng độc tính nảo khi sử dụng gemcitabine tại thòi điểm cảoh hơn
7 ngảy trước hoặc sau xạ tri so với khi tiến hảnh xạ trị nhắc lại. Dữ liệu nghiên cứu cho thấy có thể bắt
đầu sử dụng gemcitabine sau khi cảc tảc dụng bất lợi cấp tinh của xạ trị đã được khắc phục hoặc ít
nhất ] tuần sau xạ trị.
Tổn thương do xạ trị đã được ghi nhặn tại cảc mô đích (như viêm thực quản, viêm kết trảng và viêm
phổi) cả khi sử dụng đồng thời vả không sử dụng đồng thời cùng với gemcitabine.
Cảc chế phẩm khảc: IKhông khuyến cáo sử dụng vẳc-xin sốt vảng da cũng như cảc chế phẩm vắc-xin
có chứa vi sinh vật sống đã được lảm yếu do nguy cơ gây ra tác dụng bẳt lợi toản thân, thậm chi là cảc
tình trạng hết sức nghiêm trỌng có thể dẫn đến tử vong, đặc biệt là ở bệnh nhân bị ức chế miên dịch.
Sử dụng cho phụ nữ có thai và cho con bú
Phu nữ có thai: Chưa có đủ dữ liệu về việc sử dụng gemcitabine cho phụ nữ có thai. Cảc nghiên cứu
trên động vật cho thấy độc tính cùa gemcitabine đối với sinh sản. Dựa trên kết quả từ cảc nghiên cứu
trên động vật và cơ chế tảc dụng cùa gemcitabine, không nên sử dụng gemcitabine trong thai kì trừ khi
thực sự cần thiết. Phụ nữ không nên có thai trong khi đang điếu trị bằng gemcitabine và phải thông
bảo ngay cho bác sĩ nểu có thai trong quả trinh dùng thuốc. _
Phu nữ cho con bủ: Chưa rõ gemcitabine có được tiết vảo sữa mẹ hay không và không thế loại trừ tảc
dụng bất lợi cùa thuốc trên trẻ bú mẹ. Người mẹ phải ngừng cho con bú trong khi đang dùng thuốc.
Ảnh hưởng đến sinh sản: Trong cảc nghiên cứu vê sinh sản, gemcitabine gây giảm sinh tinh ở chuột
đực. Vì vậy, nam giới đang được điếu trị bằng gemcitabine không nên có con trong khi dùng thuốc và
tới 6 thảng sau khi ngừng điếu trị và nên bảo quản lạnh tinh trùng trước khi điểu trị bằng gemcitabine
do nguy cơ vô sinh sau khi dùng thuốc.
Ẩnh hưởng đến khả năng lải xe và vận hânh máy móc
Chưa tiên hảnh cảc nghiên cứu về ảnh hướng cùa thuốc đến khả nãng lải xe và vận hảnh mảy móc.
Tuy nhiên, đã ghi nhận gemcitabine có thể gây buồn ngủ mức độ nhẹ đến vùa, đặc biệt là khi sử dụng
4
° . .
cùng với rượu. Bệnh nhân cần thận trọng không nên lái xe v. ` ' \niồn cho đên khi chăc
chắn không còn bị buồn ngủ. °f cổ PHẨM
10 01100 PHẨM *)
Tác dụng không mong muốn DUY TẨN ’ễ/
Cảc tảc dụng bât lợi hay gặp nhất khi sử dụng gemcitabine bo m; buộn… ồ/ ,
theo nôn, tãng trạnsaminase gan (AST/ALT) vả phosphatase kie 1 nhận ở khoảng 60%
bệnh nhân; protein niệu và huyết niệu được ghi nhận ở gân 50% bệnhRì n n; khó thờ ở 10—40% bệnh
nhân (tỷ lệ cao nhắt' ơ bệnh nhân ung thư phổi); phát ban kiếu dị ứng ở 25% bệnh nhân và ngứa ở 10%
bệnh nhân. Tần suất và mức độ nghiêm trọng của các phản ứng bẩt lợi tùy thuộc vảo liều dùng, tốc độ
truyền tĩnh mạch vả khoảng cách giữa cảc liều (xem mục Những cảnh báo đặc biệt và thận trọng khi
sử dụng). Cảc tảc dụng bất lợi gỉới hạn liệu là giảm sô lượng tiêu cầu, bạch cầu và bạch cầu hạt (xem
mục Liêu lượng và cảch dùng).
Dữ liêu từ cảc thứ nghiêm lâm sảng: Tẩn suất phản ứng bất lợi được quy ước như sau: Rất hay gặp (>
1/10), Hay gặp (> 1/100 đến < 1l10), Ỉt gặp (> 1/1.000 đến < 1/100), Hiếm gặp (> 1l10.000 đên <
1/1000), Rất hiếm gặp (< 1/10. 000).
Bảng dưới đây liệt kê cảc tảc dụng bất lợi và tần suất xuất hiện dựa trên cảc thử nghiệm lâm sảng.
Trong mỗi nhóm tẩn suất, các tác dụng bắt lợi được sẳp xếp theo thứ tứ giảm dần mức độ nghiêm
trọng.
HỆ cơ quan Nhóm tần suất
Rôi loạn mảu và hệ bạch huyêt Rât hay gặp: Giảm bạch cầu (giảm bạch cầu trung
tính độ 3: 19,3%; độ 4: 6%). Tinh trạng ức chế
tủy xương thường ở mức đó nhe đến vừa và chủ
yêụ ảnh hưởng đến số lượng bạch cầu (xem mục
Liều lượng vả cảch dùng). Giảm tiểu câu. Thiếu
máu.
Hay gặp: Giảm bạch cầu trung tính có sốt.
Rất hiếm gặp: Tăng tiểu cầu.
Rối loạn hệ miễn dịch Rất hiếm gặp: Phản ứng phản vệ
Rối loạn chuyến hóa và dinh dưõng Hay gặp: Chản ăn
Rối ioạn hệ thẳn kinh Hay gặp: Đau đẳu, mẩt ngù, ngủ gả
Ĩối loạn tim Hỉếm gặp: Nhồi máu cơ tim
Rối loạn mạch mảu Hiểm gặp: Tụt huyết ảp
Rối loạn hô hấp, ngực và trung thất Rẫt hiêỀi gặp: Khó thở, thường ở mức độ nhẹ và
tự biến mât mã không cần điều trị.
Hay gặp: Ho, vỉêm mũi.
Ít gặp: Viêm phổi kẽ (xem mục Những cảnh báo
đặc biệt vả thận trọng khi sử dụng), co thắt phế
quản, thường ở mức độ nhẹ và thoáng qua, không
cẩn điếu trị.
Rối Ioạn tiêu hóa Rất hay gặp: Nôn, buổn nôn.
Hay gặp: la chảy, viêm miệng và loét miệng. Tảo
bón.
Rối loạn gan mật Rẩt hay gặp: Tăng men gan (AST vả ALT) vả
phosphatase kiem.
Hay gặp: Tăng bilirubỉn.
Hiếm gặp: tăng gamma-glutamyl transferase
(CGT)
Rối loạn da và mô mềm Rất hay gặp: Phát ban dị ứng thường kèm theo
ngứa. Rụngtóc.
Hay gặp: Ngứa, đổ mồ hôi
Hiếm gặp: Loét, hinh thảnh bọng nước hoặc vết
loét, tróc vảy.
Rất hiếm gặp: Cảc phản ứng nghiêm trọng trên da
như tróc vảy vả bỏng rộp.
\03009
o'~I J'J.
+` @
_? CỐNG TY \f`_,
Rối loạn cơ xương và mô liên kết Hay gặp: Đau Iưn đau coll.,,- ( CỔ PHẦN \.Ề)
Rối loạn thận vả tiết niệu Rất hay gặp: Huyet niệu, pĩptếin R |*
Rôi loạn toản thân và phản ứng tại vị trí tiêm Rắt hay gặp: Cảo triệu ch , `
truyền triệu chứng hay gặp nhẫt lả s ,
đau cơ, suy nhược vả chản ăn. 1, khó
chịu, đổ mồ hôi vả khó ngủ cũng đã được ghi
nhận.
Phù/phù ngoại vi, bao gổm phù mặt. Tinh trạng
phù thường tự phục hồi sau khi ngừng thuốc.
Hay gặp: Sốt, suy nhược, ón lạnh
Hiếm gặp: Cảc phản ứng tại vị trí tỉêm truyền,
chủ yếu ở mức độ nhẹ.
Tốn thương, nhiễm độc và các biến chứng Nhiễm độc xạ trị (xem mục Tương tảc vởi cảc
thuốc khác và cảc dạng tương tảo khảo)
Dữ liêu hâu mai (các bảo cảo tư phảt): chưa rõ tân suất (chưa thể ước lượng tần suất từ dữ liệu h'ện
có).
Rối Ioan hê thần kinh: Tai biến mạch não
Rối Ioan tim. Loạn nhịp tim, chủ yếu lả rối loạn nhịp trên thất. Suy tim.
Rối Ioan mach máu. Cảc triệu chứng viêm mạch ngoại vi và hoại tứ.
Rôi loan hô hẩp nguc vả IrunQ thât: Phù phồi, hội chứng suy hô hấp ở người lớn (xem mục Những
cảnh bảo đặc biệt vả thận trọng khi sử dụng).
Rối Ioan tiêu hóa. Viêm kểt trảng do thiếu máụ cục bộ.
Rối Ioan gan mât: Nhiễm độc gan nặng, bao gồm suy gan và tử vong
Rỏi loan da vả mỏ mềm: Cảo phản ứng nghiêm trọng trên da như tróc vảy vả bọng nước, hội chứng
Lyell, hội chứng Stevens—Johnson.
Rối Ioan thân vả tiết niên: Suy thận (xem mục Những cảnh bảo đặc biệt và thận trọng khi sử dụng).
Hội chứng tan mảu tảng urê huyết (xem mục Những cảnh bảo đặc biệt và thận trọng khi sử dụng).
T ồn thương. nhiễm đỏc vả biến chứng: Xạ trị nhắc lại.
Phối hơp thuốc rrom,7 điều tri ung thư vú: Tần suất nhiễm độc huyết học đó 3 vả 4, đặc biệt lảm giảm
bạch cầu trụng tinh tăng lên khi sử dụng phối hợp gemcitabine cùng vởi paclitaxel. Tuy nhiên, tinh
trạng tăng tân suất các phản ứng bất lợi nảy không liên quan đến tăng tỷ lệ nhiễm khuẩn hoặc cảc biến
có xuât huyết. Tình trạng mệt mòi và giảm bạch cầu trung tính có sốt xuất hiện thường xuyên hơn khi
sử dụng đông thời gemcitabine cùng với paclitaxel. Tình trạng mệt mòi, thường không liến quan đến
thiếu máu, thường tự biến mât sau đợt điều trị đầu tiên.
Cảo biến cố bất lợi độ 3 và 4 khi sử dụng paclitaxel đơn độc so với phối hợp gemcitabine vả paclitaxel
Số lượng (%) bệnh nhân
Paclitaxel (N = 259) Gemcitabine vả paclitaxel (N = 262)
Độ 3 [Dộ 4 Độ 3 | Độ 4
Cận lân sảng
Thiếu mảu 5 (1.9) 1 (0.4) 15 (5.7) 3 (1.1)
Giảm tiễu cẫu 0 0 14 (5.3) 1 (0.4)
Giảm bạch cầu trung tính 1 1 (4.2) 17 (6.6)* 82 (31.3) 45 (17.2)*
Ngoài cận lân: sảng
Ẹễ1tam bạch cau trung tinh co 3 012) 0 12 (4.6) 1 (0.4)
Mệt mòi 3 (1.2) 1 (0.4) 15 (5.7) 2 (0.8)
Ìa chảy 5 (1.9) 0 8 (3.1) 0
Bệnh thần kinh vận động 2 (0.8) 0 6 (2.3) 1 (0.4)
Bệnh thần kinh cảm giảc 9 (3.5) 0 14 (5.3) 1 (0.4)
* Tình trạng giảm bạch cấu trung tính độ 4 kéo dải trên 7 ngảy được ghi nhận ở 12, 6% số bệnh nhân
dùng phối hợp gemcitabine cùng với paclitaxel và ở 5,0% bệnh nhân sử dụng paclitaxel
Phỏi hơp thuốc trong điều tri ung thư bảngu ơ_ạag
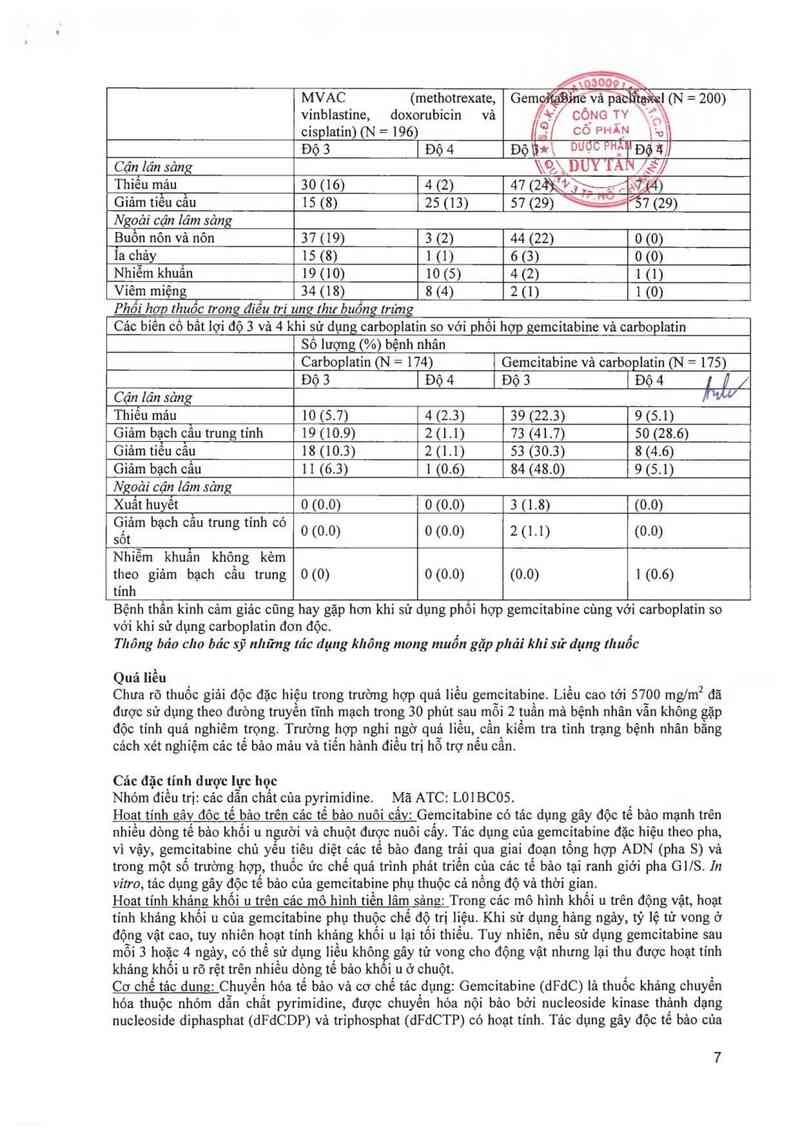
Cảo biển cổ bẩt lọi độ 3 vả 4 khi sử dụng MVAC so với phôi hợp gemcitabine vả ciSplatin
] Số lượng (%) bệnh nhân
MVAC (methotrexate,
vinblastine, doxorubicin vả
cisplatin) (N = 196)
Độ 3 | Độ 4
Cận lân sảng \\èXDUY IẨN ể“//
Thiếu mảu 30 (16) 4 (2) 47 (2NM ,_ , @,(Ã)
Giảm tiếu cầu 15 (8) 25 (13) 57 (29) ®’57 (29)
Ngoài cận lâm sảng
Buồn nôn vả nôn 37 (19) 3 (2) 44 (22) 0 (0)
Ĩa chảy 15 (8) 1 (1) 6 (3) 0 (0)
Nhiễm khuấn 19 (10) 10 (5) 4 (2) 1 (1)
Viêm miệng 34 (18) 8 (4) 2 (1) 1 (0)
Phối hơn Ihuồc trong điều m“ ung lhư buồng lrủỵ
Cảc biên có bât lợi độ 3 và 4 khi sử dụng carboplatỉn so với phôi hợp gemcitabine vả carboplatin
Số lượng (%) bệnh nhân
Carboplatin (N = 174) Gemcitabine vả carboplatin (N = 175)
Độs lĐộ4 Độs lĐộ4 77x
Cận lân sảng W
Thỉểu mảu 10 (5.7) 4 (2.3) 39 (22.3) 9 (5.1)
Giảm bạch cầu trung tinh 19 (10.9) 2 (1.1) 73 (41.7) 50 (28.6)
Giảm tiểu cầu 18 (10.3) 2 (1.1) 53 (30.3) 8 (4.6)
Giảm bạch cầu 1 1 (6.3) 1 (0.6) 84 (48.0) 9 (5.1)
Ngoải cận lâm sảng
Xuất huyễt , 0 (0.0) 0 (0.0) 3 (1.8) (0.0)
Ẹễltam bạch cau trung tmh co 0 (0.0) 0 (0.0) 20.1) (0,0)
Nhiêm khuẩn không kèm
theo giảm bạch cầu trung 0 (0) 0 (0.0) (0.0) 1 (0.6)
tính
Bệnh thần kinh cảm giảc cũng hay gặp hơn khi sử dụng phối hợp gemcitabine cùng với carboplatin so
vói khi sử dụng carboplatin đon độc.
Thông báo cho bác sỹ những rác dụng không mong muốn gặp phải khi sử dụng thuốc
Quả liều
Chưa rõ thuốc giải độc đặc hiệu trong trường hợp quá liều gemcitabine. Liều cao tới 5700 mg/m2 đã
được sử dụng theo đường truyền tĩnh mạch trong 30 phút sau môi 2 tuần mả bệnh nhân vẫn không gặp
độc tính quá nghiêm trọng. Trường hợp nghi ngờ quả liếu, cần kiểm tra tinh trạng bệnh nhân bằng
cảch xét nghiệm cảc tế bảo mảu và tiến hảnh điều trị hỗ trợ nếu cẩn.
Các đặc tính dược lực học
Nhỏm điều trị: các dẫn chất của pyrimidine. Mã ATC: L01 13c05.
Hoat tính gâv đôc tế bảo trên cảc tế bảo nuôi cáy_Gemcstabine có tác dụng gây độc tế bảo mạnh trên
nhiều dòng tế bảo khối 11 người và chuột được nuôi cấy. Tác dụng cùa gemcitabine đặc hiệu theo pha,
vì vậy, gemcitabine chủ yêu tiêu diệt cảc tế bảo đang trải qua giai đoạn tổng hợp ADN (pha S) vả
trong một sô trường hợp, thuốc ức chế quá trinh phảt triến của cảc tế bảo tại ranh giới pha Gl/S. ln
vitro, tảc dụng gây độc tế bảo của gemcitabine phụ thuộc cả nồng độ và thời gian.
Hoat tính khảng khối 11 trên cảc mô hinh tiền lâm sảng: Trong các mô hình khối u trên động vật, hoạt
tính khảng khối u của gemcitabine phụ thuộc chế độ trị liệu Khi sử dụng hảng ngảy, tỷ lệ tử vong ở
động vật cao, tuy nhiên hoạt tính khảng khối u lại tối thiếu. Tuy nhiên, nêu sử dụng gemcitabine sau
môi 3 hoặc 4 ngảy, có thế sử dụng liều khỏng gây tử vong cho động vật nhưng lại thu được hoạt tính
khảng khối u rõ rệt trên nhiếư dòng tế bảo khôi 11 ở chuột.
Cơ chế tảo dung: Chuyến hóa tế bảo vả cơ chế tảc dụng: Gemcitabine (dFdC) lá thuốc khảng chuyển
hóa thuộc nhóm dẫn chất pyrimidine, được chuyền hóa nội bảo bởi nucleoside kinase thảnh dạng
nucleoside diphasphat (dFdCDP) vả triphosphat (dFdCTP) có hoạt tinh. Tảo dụng gây độc tế bảo của
7
`03009 [
gemcitabine là do thuốc ức chế quá trình tông hợp ADN qua 2 cơ ỀểểẩụxngỀsề', FdCDP vả
dFdCTP. Trước tiên, dFdCDP ức chế ribonucleotide reductase, là e '.1',n đặốfflẽềtĩkúềx cho phản
ứng tạo ra deoxynucleoside triphosphat (dCTP) cần cho quá trình t hơị$ ơỀỄẮWỮảcÌđỌ g ức chế
enzym nảy cùa dFdCDP 1ảm giảm nồng độ deoxynucleoside và đã biềt lfflđềfi“Ếả ổ. dFdCTP
cạnh tranh với dCTP trong quá trình kết hợp với ADN 0 \ DUY TAỀỈ ỀZễ
Tương tự, một lượng nhỏ gemcitabine có thể kết hợp với ARN. Do đó, ộ dCTP nội
bảo lảm tăng `gắn kết cùa dFdCTP với ADN. ADN polymerase epsilon a năng loại bỏ
gemcitabine vả sứa chữa cảc chuỗi ADN đang hoản thiện. Sau khi gemcitabine kết hợp với ADN, chỉ
có một nucleotide nữa được thêm vâo chuỗi ADN đang hoản thiện. Tiếp đó, quá trình tồng hợp ADN
bị ức chế hoản toản (che đầu tận cùng của chuỗi ADN). Sau khi gắn kết với ADN, gemcitabine gây
chết tế bảo theo chưong trình
Dữ liêu lâm sảng
Ung thư bảng guang. Một nghiên cứu ngẫu nhiên pha III được tiến hảnh trên 405 bệnh nhân mắd ung
thư tế bâo chuyến tiêp niêm mạc tiết niệu tiến triến hoặc di căn cho thấy không có sự khảc biệt giữa 2
nhóm nghiên cứu là nhóm sử dụng gemcitanine/cisplatin so với nhỏm sử dụng
methotrexate/vinblastine/adríamycin/cisplatin (MVAC) khi so sảnh tỷ lệ sống trung bình (lần lượt là
12,8 vả 14,8 tháng, p= 0 ,,547) thời gian tiến triến bệnh (iần lượt là 7, 4 và 7 ,6 thảng, p= 0,842) và tỷ
lệ đảp ứng điều trị (tương ứng lả 49,4% và 45,7%, p = 0,512). Tuy nhiên, sử dụng phối hợp
gemcitabine vả cisplatin gây độc tính cao hơn MVAC.
Ung lhư tuv: Trong một nghiên cứu ngẫu nhiên pha III được tỉến hảnh trên 126 bệnh nhân mắc ụng
thư tụy tiến triên hoặc di căn, gemcitabine cho tỷ lệ đáp ứng lâm sảng cao hơn đảng kể so với 5—
tÌuorouracil (lần lượt là 23,8% và 4,8%, p = 0,0022). Ngoài ra, bệnh nhân được điều trị bằng
gemcitabine cũng có thời gian tiến triền bệnh kéo dải hon đảng kế, từ 0,9 đến 2, 3 thảng (p < 0 ,0002)
và thời gian sông trung bình dải hon, từ 4 ,4 đến 5,7 thảng (p < 0 ,0024) so với nhóm điều trị bằng 5-
fluorouracil
Ung thư phối khỏng nhải tế bảo nhó. Trong một nghiên cứu ngẫu nhiến pha 111 trên 522 bệnh nhân
ung thư phối không phải tế bảo nhỏ tiến triên tại chỗ hoặc di cãn không thế phẫu thuật, sử dụng phối
hợp gemcitabine cùng vởi cisplatin cho tỷ lệ đảng ưng cao hơn rõ rệt so với điều trị bằng cisplatin đon
độc (lần lượt là 31,0% và 12 ,O%, p < 0 ,0001) Thời gian tiến triển kéo dải hơn đảng kể, từ 3, 7 đến 5,6
thảng (p < 0 ,0012) và thời gian sông trung binh cũng dải hơn, từ 7, 6 thảng đến 9,1 thảng (p < 0 ,004)
đã được ghi nhận ở những bệnh nhân điếu trị bằng gemcitabine/cisplatin so với nhóm bệnh nhân điếu
trị bằng cisplatin. Trong một thử nghiệm lậm sảng ngân nhiên phả III khảo được tiến hảnh trên 135
bệnh nhân mãc ung thư phổi không phải tế bảo nhỏ giai đoạn IIIB hoặc IV, phối hợp gemcitabine vả
cisplatin cho tỷ lệ đảp ứng cao hơn rõ rệt so với sứ Idụng phối hợp cisplatin vả etoposỉde (lẩn lượt iả
40,6% vả 21,2%, p = 0 ,.025) Thời gian tiến triến ở nhóm bệnh nhân điếu trị bằng
gemcitabinelcisplatin cũng kéo dải hơn đảng kể so với nhóm bệnh nhân sử dụng etoposỉde/cisplatin, từ
4 ,3 đến 6, 9 thảng (p= 0 ,0.14) Trong cả hai nghiên cứu, mức độ dung nạp thuốc là tương tự nhau giữa
2 nhóm điếu tri.
Ung thư buồng trth. Trong một nghiên cứu ngẫu nhiên pha 111,356 bệnh nhân ung thư biểu mô
buồng trứng tiển triền có tải phảt ít nhắt 6 thảng sau khi ngừng điếu trị bằng cảc thuốc lá dẫn chất của
platin được cho dùng ngẫu nhiên cả gemcitabine vả carboplatin hoặc chỉ dùng carboplatin. Thời gian
tiến triển bệnh kéo dải rõ rệt, từ 5, 8 đển 8, 6 thảng (p= 0 ,0038) được ghi nhận ở nhóm bệnh nhân được
điếu trị bằng gemcitabine vả carboplatin so với nhóm bệnh nhân chi được sử dụng carboplatin. Sự
khác bíệt vê tỷ lệ đảp ứng là 47, 2% ở nhóm dùng gemcitabine cùng vởi carboplatin so với 30 ,ở9%
nhóm điều trị bằng carbopiatin (p= 0 ,0016) và thời gian sông trung bình là 18 thảng (gemcitabine vả
carboplatin) so với 17,3 thảng (carboplatin) (p = 0,73) cho thấy hiệu quả tôt hơn được ghi nhận ở
nhóm sử dụng gemcitabine cùng với carboplatin.
Ung thư vú: Trong một n hiên cứu ngẫu nhiên pha 111 trên 529 bệnh nhân mắc ung thư vú tải phảt tại
chỗ hoặc di căn không thế phẫu thuật có tải phảt sau khi được điêu trị bằng hóa trị liệu, gemcitabine
phối hợp với paclitaxel gỉúp kéo dải đáng kể thời gỉan tiến triến bệnh từ 3,98 thảng đến 6,14 thảng (p
= 0,0002) so với khi sử dụng paclitaxel. Sau khi 377 bệnh nhân tử vong, thời gian sông tông cộng ở
nhóm điều trị bằng gemcitabine/paclitaxel là 18,6 thảng so với 15,8 thảng ở nhóm sử dụng paclitaxel
(p = 0,0489) còn tỷ lệ đáp ứng lằn lượt là 41,4% và 26,2% (p = 0,0002).
Cảc đặc tính dược động học: Dược động học của gemcitabine đă được ngh“^ g 53 bệnh
nhân trong 7 nghiên cứu khảo nhau, bao gồm 12] nữ và 232 nam tuổi từ 2 fi 79Ĩ'l`rong
nhân nảy, khoảng 45% bệnh nhân mắc ung thư phổi không phải tế bảo nh .ạlẵ 3 ửđượơ c
ung thư tụy. Cảc thông sô dược động học sau đây thu được khi sử dụng kh âhg li tí5từrS00 đêụ—lj
mg/m2 sử dụng theo đường truyền tĩnh mạch trong thời gian từ 0, 4 đến 1,2 ' .1` DUỌC PHÂN /1*
Nồng độ đinh của thuốc trong huyết tương (được xác định trong vòng 5 ph Wg'ửẫỳitnẩổh`
từ 3, 2 đến 45,5 11ng Nồng độ gemcitabine sau khi sử dụng liêu ] 000 mg/ tỄ`ụỵêxự_mh
30 phủt cao hơn 5 ụg/ml kéo dải trong khoảng 30 phủt sau khi kết thủc truyền 6 ' ` ’
0, 4 ụg/ml trong thêm một giờ.
Phân bố: Thể tích phân bố ở ngăn trung tâm là 12 ,4 L/m2 đối với nữ và 17, 5 Lm2 đối với nam (biến
thiên giữa các cả thế là 91,9%). Thể tích phân bố ở ngăn ngoại vi là 47, 4 L/m². Thể tích ngăn ngoại vi
không biến thiên theo giới tính. Tỷ lệ thuôc găn protein huyết tương không đảng kể. Thời gian bản thải
nằm trong khoảng từ 42 đến 94 phủt tùy thuộc tuồi vả giới tính Khi sử dụng liêu đề nghị, gemcitabine
được đảo thải gần như hoản toản trong khoảng thòi ian từ 5 đến 11 giờ tính từ 1ủc bắt đầu truyền tĩnh
mạch. Gemcitabine không bị tích lũy khi sử dụng chế độ iiếu một lần môi tuần.
Chuvến hóa: Gemcitabine được chuyến hóa nhanh bời cytìdine deaminase ở gan, thận, mảu vả cảc mô
khảc. Quá trình chuyển hóa nội bảo của gemcitabine tạo ra gemcitabine mono, di vả triphosphat
(dFdCMP, dFdCDP vả dFdCTP), trong đó dFdCDP vả dFdCTP lả cảc chất có hoạt tính. Cảo chất
chuyến hóa nội bảo n2ảy không được tìm thấy trong huyết tương hoặc nước tiều Dạng chuyến hóa
chính là 2’ -deoxy-2’,2 ’-difluorourỉdine (dFdU) không có hoạt tính và được tim thẩy cả trong huyết
tưong vả nước tiêu.
Thâi trừ: Tốc độ thanh thải toản thân của thuốc là từ 29, 2 L/giờ/m2 đến 92, 2 L/giờ/m2 tùy thuộc giới
tính và tuổi (biến thiến giữa các cá thế lả 52,2%). Độ thanh thải ở nữ gíới thẳp hơn gân 25% so với ở
nam giới Mặc dù thuốc được đảo thải nhanh nhưng2 tốc độ thanh thải ở cả nam và nữ giảm theo tuối.
Khi sử dụng liểu gemcitabine đề nghị là 1000 mg/m2 truyền tĩnh mạch trong 30 phút, không cẩn giảm
liếu gemcitabine nêu độ thanh thải ở nam iới hoặc nữ giới giảm. Tỷ lệ thuốc đảo thải 2qua nước tiêu ít
hơn 10%, dưới dạng không chuyến hỏa. Tôc độ thanh thải qua thận là 2 đến 7 L.lgiờ/m².
Trong tuần sử dụng thuốc, 92 đến 98% liều gemcitabine được đảo thải, 99% qua nước tiếu, chủ yểu
dưới dạng dFdU vả 1% được thải trừ qua phân
Dươc dông hoc cùa dFdCTP: Chẳt chuyến hóa nảy có thể tìm thẳy ở cảc tế bâo đơn nhân trong mảu
ngoại vi và cảc dữ liệu tiếp theo thu được khi nghiên cứu trên cảc tế bảo nảy. Nổng độ dFdCTP nội
bảo tãng tỷ lệ với liếu gemcitabine trong khoảng liếu từ 35— 350 mg/m2 /30 phủt còn nông độ thuốc ở
trạng thải ôn định là 0, 4 — S ụg/ml. Khi nông độ gemcitabine cao hơn 5 ụg/ml, nông độ dFdCTP
không tăng. Điếu nảy cho thẳy quả trình tạo ra dFdCTP đã bão hòa trong cảc tế bảo nảy. Thời gian bản
thải của dFdCTP là từ 0, 7— 12 giờ. ,
Dươc đông hoc cùa dFdU: Nồng độ đinh cùa dFdU trong huyết tương (3-15 phút sau khi kêt thủc
truyền tĩnh mạch liều 1000 mg/m2 trong 30 phút) lả 2852 ụg/ml. Nồng độ đảy `sau khi sử dụng thuốc
một lân môi tuân là 0,07 — 1,12 ụg/ml vả thuôo không bị tích lũy. Đường cong nông độ dFdU theo thời
gian chia lảm 3 pha, thời gian bản thải trung bình ở pha cuối lả 65 giờ (trong khoảng 33 — 84 giờ). Tỷ
lệ dFdU hình thảnh từ gemcitabine là 91 — 98%. Thể tích phân bố trung binh ở ngăn trung tâm là 18
le2 (trong khoảng 11 — 22 le²).
Thể tích phân bố trung bình của dFdU ở trạng thải ổn định là 150 L/m2 (trong khoảng 96- 228 L/m2 ).
Loại mô2 phân bố: rộng rãi. Tốc độ thanh thải biểu kỉến trung bình: 2, 5 L/giờlm2 (trong khoảng 1 — 4
L/giờ/m2 ). Đảothải qua nước tiều: 100%
Phối hơp gemcitabine vả paclitạxel: Sứ đụng phối hợp gemcitabine vả paclitaxel không ảnh hưởng
đến dược động học của mỗi thuốc.
Phối hơp gemcitabine vả carboplatin : Khi sử dụng phối hợp với carboplatin, dược động học của
gemcitabine không thay đồi.
Suv thân : Suy thận nhẹ đến vừa (tốc độ lọc cầu thận từ 30 ml/phút đến 80 mllphút) không ảnh hướng
đảng kế đến dược động học của gemcitabine.
Tương kỵ : Không được trộn lẫn gemcitabinevới bất kì thuốc nảo khảo, trừ các chế phẳm được để
cập ở mục Những lưu ý đặc biệt về việc pha chế và xử lý loại bò.
Hạn dùng
Lo chưa mớ: 24 thảng kể từ ngảy sản xuất.
Dung dich sau khi pha:
Dung dịch sau khi pha có nồng độ 38 mglml ốn định về mặt hóa học và vật lý trong 35 ngảy khi bảo
quản ở 25°C. Không nên bảo quản dung dịch gemcitabine sau khi pha trong tủ lạnh do thuốc có thế bị
kết tỉnh.
Dung dịch gemcitabine pha loãng trong natri clorid 0, 9% có nồng độ từ 0,1 mg/mL đến 30 mg/mL ỏn
định về mặt vật lý vả hóa học khi bảo quản ở điểu kiện thường (nhiệt độ từ 15— 25°C, ảnh sảng thông
thường) hoặc trong tủ lạnh (2— 8°C) trong gần 72 giờ (3 ngảy).
Để đảm bảo chế phẳm không bị nhiễm vi sinh vật, dung dịch sau khi pha và pha loãng phải sử dụng
ngay. Nếu chưa sử dụng ngay, phái bảo quản dung dịch ở điếu kiện thích hợp và thông thường không
nên bảo quản trong thời gỉan hơn 24 giờ ở nhiệt độ phòng, trừ khi việc pha chế dung dich (vả pha
loãng thêm) được tiến hảnh trong điếu kiện vô khuẩn và môi trường pha chế được kiểm soát chặt chẽ.
Những luu ý đặc biệt về việc pha chế và xử lý loại bỏ
Lưu ỵ' khi sử dung: Cần tuân thủ những ]ưu' y về an toản đối với cảc thuốc gây độc tế bảo khi chuẩn bị
pha chế vả loại bỏ dịch truyền. Việc xử lý dịch truyến phải được tiển hảnh trong hộp an toản với quần
áo và gãng tay bảo hộ. Nếu không có hộp an toản, cân sử dụng thêm mặt nạ và kính bảo hộ. Nếu để
chế phấm tiếp xủc với mắt, thuốc có thể gây kích' ưng mạnh. Phâi rứa kỹ mắt ngay lập túc bằng nước
sạch. Nếu măt vẫn còn bị kích ứng, cần tham vấn ý kiến bảc sĩ. Nếu dung dịch bị rây vâo da, phải rứ
kỳ với nước sạch.
Hưởng dẫn pha chế (vả tiếp tuc pha loãng): Dung môi duy nhất được phép sử dụng để hòa tan bột vô
khuẩn gemcitabine lả dung dịch natri clorid 9 mng (0, 9%) dùng để pha tiêm (không có chất bảo
quản). Do giới hạn về độ tan, nổng độ dung dịch gemcitabine tối đa có thể đạt được sau khi pha là 40
mglml. Cẩn trảnh pha dung dịch có nồng độ cao hơn 40 mng vi có thề thuốc không tan hoản toản.
1. Sử dụng kỹ thuật vô trùng trong quá trình pha vả pha loãng dung dịch gemcitabine truyền tĩnh
mạch.
2. Để pha dung dịch, thêm 5 ml dung dịch natri clorid 9 mg/ml (0, 9%) vô khuẩn dùng để pha tiêm,
không có chất bảo quản vảo lọ 200 mg hoặc thêm 25 ml dung dịch natri clorid 9 mg/ml (0, 9%) vô
khuẩn vảo lọ ] g hoặc thêm 50 ml dung dịch natri clorid 9 mglml (0, 9%) vảo lo 2 g. Tổng thể tích
dung dịch sau khi pha lần lượt là 5, 26 ml (lọ 200 mg), 26, 3 ml (lọ 1 g) vả 52 ,6 ml (lọ 2 g). Dung dịch
gemcitabine sau khi pha có nông độ 38 mg/mi. Lắc đế bột tan hoản toản. Tiếp tục pha loãng bằng
dung dịch natri clorid 9 mg/ml (0. 9%) không chứa chất bảo quản. Dung dịch sau khi pha phải trong,
không mảu hoặc có mảu vảng nhạt.
3. Phải kiểm tra cảc chế phẩm tiêm truyền bằng mắt thường để phảt hiện bất kỳ tiểu phân nảo không
tan hoặc hiện tượng biến mảu trước khi sử dụng. Nếu quan sảt thấy tiếu phân không tan thì không
được sử dụng.
Bắt kỳ phần thuốc nảo không sử dụng cần phải loại bỏ theo đứng quy trình chuẩn tại cơ sở điếu trị.
Bảo quân: Bảo quản dưới 30°C
Đóng gói : Hộp 01 lọ
Sản xuất bởi :
Pharmachemie BV
Swensweg 5, 2031 GA Haarlev ›' *
cố PHÂN
ouợc PHẢM
PHÓ cục muòne
10
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng