









7_ _
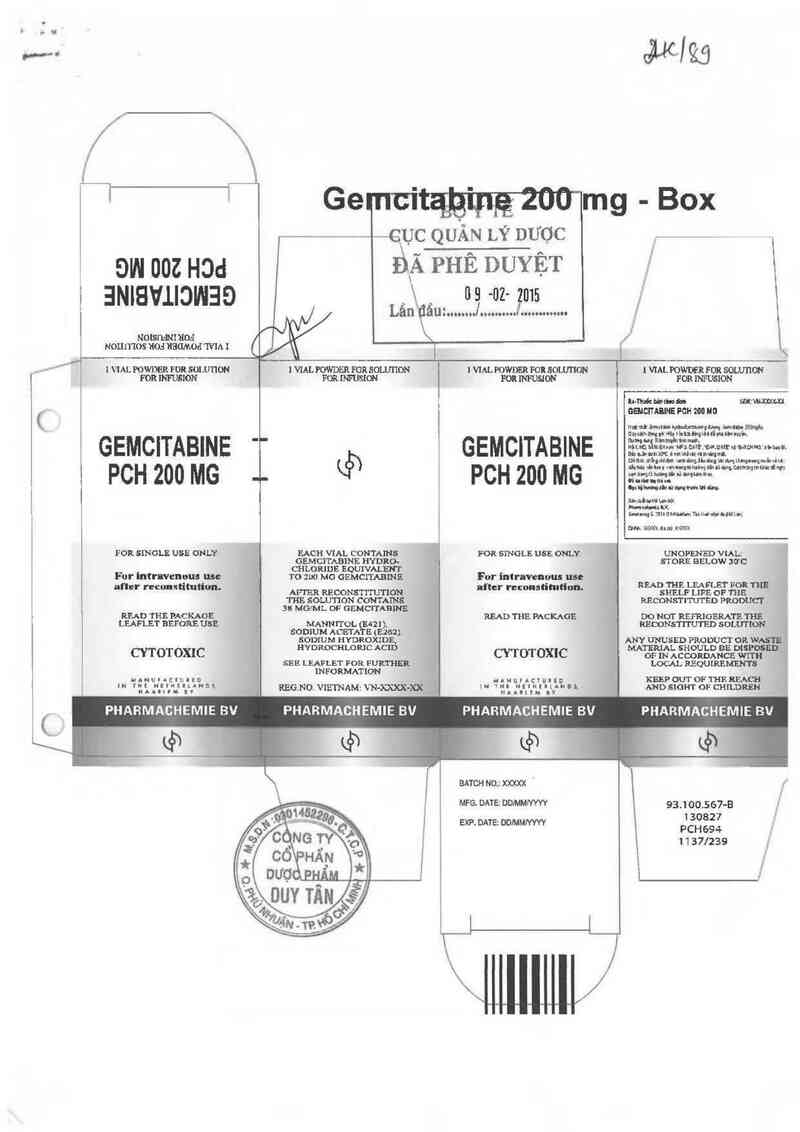
1
ĐW 002 HOd
i EINIEVlIOWEĐ
1
NOlsn:lNììlffl
NOHD'IOS ìI0:I ÌÌS(IMOđ WIA I
Gemcit
\
—GỤC QUẦN LÝ DƯỌC
fiẬ PHÊ DUYỆT
Lân nỉâuzũllOìlOJlìllltìllơ
BH -02- /2U15
OODIOOIOIOIOO
~~’ 1vw… POWDER FOR. sot.ưnou
FOR INFUSION
GEMCITABINE "
PCH 200 MG ~-
FOR SINGLE USE ONLY.
Fur Intrnvemms use
after recunstitutỉon.
READ THE PACKAGE
LEAFLET BEFORE USE ,
CYTOTOXIC
1VlALPOWDERFOR sownou 1vm POWDER FOR aoumoN 1vm. POWDER FDR soumon
mu1m1s1m Fonmrusmt FOR1NFUSION
lI—Tlllk ffllhe In am VN—XXXLKX
mcrranms PGH … uo
®
EAOH Vth CONTAINS
GEMCITABINE HYDRO-
CHLORIDE EQUIVALENT
T0 200 MG GEMCITABINE
AFJ'ER RECONS'I'ITUTIỜN
THE SOLU'I'ION CONTAINS
38 MOIML DF GEMCITABINE
MANNITOL (13421),
SODÌUM ACETATE (E262 ).
SDDIUM HYDROXJDE.
HYDROCHLORJC ACID
SEE LEAFLET FOR FURTHER
INFORMATION
REG.N o. vmm AM: w-m-m
GEMCITABINE
PCH 200 MG
Halnkìmllmụùdalunm m
OnứùMlửltlnluưbntùưlùlhm'n.
mau m… m…ư.
NỈUO. llũvn'ưlũủưftũủũlìlil'lálũlủ'Ihkll
Đkummm lnluỏmutmlngưl.
mumatụau mm.ihùgùtảưg mmmgnhtm:
ÚlMtủuluỵrnmlhmngủlìdtnpmvútjtnlhklwm
…tqilmnúúnqnnnn
dmkqnnm
Olelũhủnthirffltuùctlủb
W mua x…
FOR SYNGLE USE ONLY.
For intravenuus uu
al’ter reconstitutiun.
READ THE PACKAÔE
BATCH uo.: XXXXX
MFG. DATE: DDMNYW
EXP. DATE: DD/MMIV YVY
UNOPENED V IAL:
STORE BELOW :ơc
READ THE LMỂLET FOR THE
SHELF LIFE OF THE
RECDNSTITUTED PRODUCT
DO Hơr REfflGERATE THE
RECONSTITUTED SOLUTIDN
ANY ƯNUSED PROIJUCT OR W - ,-
MATERIAL SHOULD BE DISPOS ; .
OF IN ACCORDANCE WITH
LOCAL REQUIREMEN lầ
KEEP OUT DF THE RFACH
A'ND SICIHT OF CHILDREN
PHARMAGHEMIE BV
93.100.567-B ,'
130827 .
PCH694 ;
1 1 37l239
Nhãn phụ - Gemcitabine 200 mg
AM
Rx-Tlmốc bán theo đơn (/\ị’ SĐK: VN-XXXX-XX
GEMCITABINE PCH 200 MG
Hoạt chất: Gemcitabin hydroclorỉd tương đương Gemcitabin '
200mg/lọ.
Quy cảoh đóng gói: Hộp 1 lọ bột đông khô để pha tiêm
truyền.
Đường dùng: Tiêm truyền tĩnh mạch.
NSX, HD, Số lô SX xem “MFG. DATE”, “EXP. DATE” vả
“BATCH NO.” trên bao bì.
Bảo quản dưới 30°C, ở nơi khô ráo vả thoảng mảt.
Chỉ định, chống chỉ định, cảoh dùng, lỉều dùng, tác dụng
không mong muốn và các dắu hiệu cần lưu ỷ: xem trong tờ
hưởng dẫn sử dụng. Cảo thông tỉn khảo đề nghị xem trong tờ
hưởng dẫn sử dụng kèm theo.
Để xa tầm tay trẻ em.
Đọc kỹ hướng dẫn sử dụng trưởc khi dùng.
Sản xuất tại Hà Lan bởi:
Pharmachemie B.V.
Swenswcg 5, 2031 GA Haarlem, The Netherla _
.c'ảỌị i'Ểắớ,
@ . o
fọ%JNG TẦ'Ề,
Ì PỔ PHẨbỂ' '”
DNNK: XXXXX, địa chỉ: XXXXX
v
oUợc PHẨM
0
47,,
Ýn
1_ll MU 0%
gụ'di-N
Wde oòno
ẩ~
;.
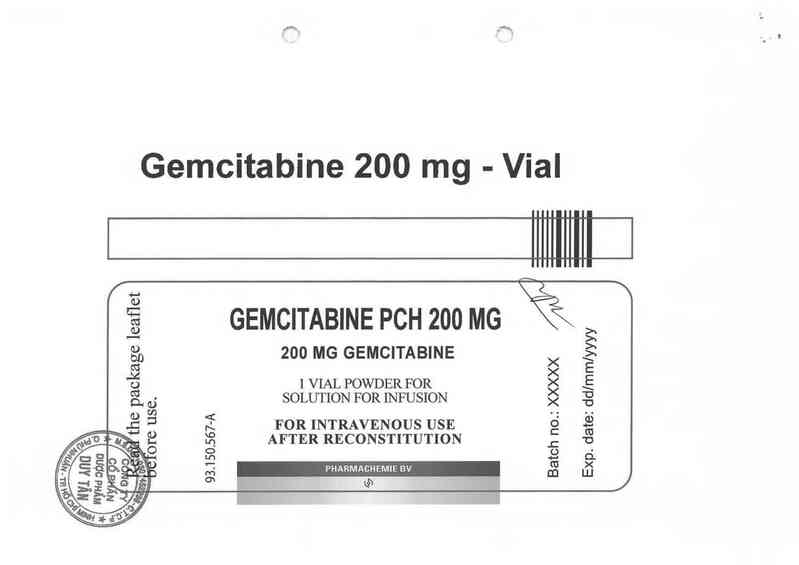
Gemcitabine 200 mg - Vial
II[IIE
[\
KE \\Ề \
Ễ GEMCITABINE PCH 200 MG
ỂD 200 MG GEMCITABINE >< Ệ
.ẻầ >< E
0 1 VIAL POWDER FOR >< Ẹ
ả_ ,,— SOLUTION FOR INFUSION ặ g
ẳ Ẻ Í FOR INTRAVENOUS USE g“ …Ệẳ
ẺỆ Ế AFTER RECONSTITUTION g u_
0 o ĩ’—`. *ỏ %
Ềa o . ò Ệ "— PHARMACHEMIE BV m LLỈ j
n-
0
Đọc kỹ hưởng dẫn sử dụng truớc khi dùng Nếu cần thêm thông tỉn xỉn hỏi ý kiến bảo sỹ. Để thuốc
ngoảỉ tẩm tay trẻ em. Thuốc nảy chỉ dùng theo đơn của bác sỹ
GEMCITABINE PCH 200 MG
GEMCITABINE PCH 1000 MG
GEMCITABINE PCH 2000 MG
Bột đông khô để pha tiêm truyền
Thânh phần:
Mỗi lọ có chứa:
- Họat chất:
+ Gemcitabin 200 mg: Gemcitabin hydrocloric! tương đương gemcitabin 200 mg.
+ Gemcitabin 1000 mg: Gemcitabin hydroclorid tương đương gemcitabin 1 g.
+ Gemcitabin 2000 mg: Gemcitabin hydroclorid tương đương gemcitabỉn 2g.
- Tá dược: Manitol, natri acetat trihydrat, natri hydroxid (IN), acid hydrocloric (IN).
Các đặc tính dược lực học:
Nhóm điếu trị: các dẫn chất cùa pyrimidin.
Mã ATC: LOIBCOS.
Hoat tính gâv đôc tế bảo trên cảc tế bảo nuôi cậỵ: bin có tác dụng gây độc tế bảo mạnh trên
nhiều dòng tế băo khối u người và chuột được nuôi cấy. Tảo dụng của gemcitabin đặc hiệu theo pha, vì
vặy, gemcitabin chủ yếu tiêu diệt cảc tế bảo đang trải qua giai đoạn tống hợp ADN (pha S) vả trong một
số trường hợp, thuốc' ưc chế quả t1inh phảt triến của cảc tế bảo tại ranh giới pha GilS. In vitro, tảo dụng
gây độc tế bảo của gemcitabin phụ thuộc cả nồng độ và thời gian.
Hoat tính khảng khôi u trên cảc mô hình tỉền lâm sảng: Trong cảc mô hình khối 11 trên động vật, hoạt tinh
khảng khối u của gemcitabin phụ thuộc chế độ trị liệu. Khi sử dụng hảng ngảy, tỷ lệ tử vong ở động vật
cao, nhưng hoạt tính khảng khối u lại tồi thiếu. Tuy nhiến, nếu sử đụng gemcitabin sau mỗi 3 hoặc 4
ngảy, có thể sử dụng liều không gây tử vong cho động vật nhưng lại thu được hoạt tinh kháng khối u rõ
rệt trên nhiều dòng tế bặo khối ư ở chuột. ’ 0
Cơ chê tảo dung: Chuyên hóa tê bảo và cơ chế tảo dụng: Gemcitabin (dFdC) lả thuôo kháng chuyên hóa
thuộc nhóm dẫn chắt pyrimidin, được chuyến hóa nội bảo bởi nucleosid kinase thảnh dạng nucleosid
diphosphat (dFdCDP) vả triphosphat (dFdCTP) có hoạt tính. Tảo dụng gây độc tế bảo cùa gemcitabin lả
do thuốc ức chế quả trinh tổng hợp ADN qua 2 cơ chế tác dụng cứa dFdCDP vả dFdCTP. Trước tiên,
dFdCDP ức chế ribonucleotid reductase, lả enzym duy nhất xúc tác cho phản’ ưng tạo ra deoxynucleosid
triphosphat (dCTP) cần cho quá trình tổng hợp ADN. Tác dụng' ưc chế enzym nảy của dFdCDP lảm gỉảm
nồng độ deoxynucleosid và đặc biệt là dCT P Sau đó, dFdCTP cạnh tranh với dCT P trong quả tnnh kết
hợp với ADN.
Tưong tự, một lượng nhỏ gemcitabỉn có thế kết hợp với ARN. Do đó, việc giảm nồng độ dCT P nội bảo
1ảm tăng gắn kết của dFdCTP với ADN. ADN polymerase epsỉlon không có khả năng loại bỏ gemcitabin
vả sừa chữa các chuỗi ADN đang hoản thiện Sau khi gemcitabỉn kểt hợp với ADN, chỉ có một nucleotid
nữa được thêm vảo chuỗi ADN đang hoản thiện Tiếp đỏ, quá trình tổng hợp ADN bị ức chế hoản toản
(che đầu tận cùng cùa chuỗi ADN) Sau khi gắn kết với ADN, gemcitabin gây chết tế bảo theo chưong
trình.
Dữ liêu lâm sang:
Ung thư bảng guang: Một nghiên cứu ngẫu nhiên pha III được tiến hảnh trên 405 bệnh nhân mắc ung thư
tế bảo chuyển tiểp niêm mạc tiết niệu tiển triến hoặc di căn cho thẩy không có sự khác biệt giữa 2 nhóm
nghiên cứu là nhỏrn sử dụng gemcitabỉn/ cisplatin so với nhóm sử dụng methotrexat/ vinblastỉn/
adriamycinl cìsplatỉn (MVAC) khi so sảnh tỷ lệ sông trung binh (lần lượt lả 12,8 và 14,8 thảng, p =
0 ,,547) thời gỉan tiến triển bệnh (iần lượt là 7, 4 và 7, 6 thảng, p= 0,842) và tỷ lệ đảp ứng đỉều trị (tương
ứng là 49,4% và 45,7%, p= 0 ,.512) Tuy nhíên, nhóm sử dụng phối hợp gemcitabin vả cisplatin it độc
tĩnh hơn so với nhóm MVAC.
Ung thư luv: Trong một nghiên cửu ngẫu nhiên pha III được tỉến hảnh trên 126 bệnh nhân rnắc ung thư
tụy tiến triến hoặc di căn, gemcitabin cho thẫy tỷ lệ đảp ứng lâm sảng cao hơn đảng k "
kê) so với 5-fiuorouracil (lần lượt là 23, 8% và 4,8%, p= 0 ,0022) Ngoài ra, bệnh ,uíể
fiuorouracil. _
Ung thư phối không phái tế bảo nhỏ Trong một nghiên cứu ngẫu nhiến pha III t .— —`ớ
gemcitabin cùng với cisplatin cho tỷ lệ đảng ứng cao hơn rõ rệt so vởỉ đỉều trị bằng cisplatin đon độc (lần
lượt là 31,0% và 12,0%, p < 0 ,.0001) Thời gian tiến triến kéo dải hơn đáng kể, từ 3 ,7 đến 5,6 thảng (p <
0 ,0012) và thời gian sống trung binh cũng dải hơn, từ 7, 6 tháng đến 9,1 thảng (p < 0 ,004) đã được ghi
nhận ở nhũng bệnh nhân điều trị bằng gemcitabin/cisplatin so với nhóm bệnh nhân điếu trị bằng
cisplatin.Trong một thử nghíệm lâm sảng ngẫu nhiên pha III khảo được tiến hảnh trên 135 bệnh nhân
mắc ung thư phổi không phải tế băo nhỏ giai đoạn IIIB hoặc IV, phối hợp gemcitabin vả cisplatin cho tỷ
lệ đảp' ưng cao hơn rõ rệt so với sư dụng phổi hợp cisplatin vả etoposìd (lần lượt là 40, 6% và 21,2%, p— =
0,025). Thời gian tiến triến ở nhỏm bệnh nhân điếu trị bằng gemcitabin/cisplatin cũng kéo dải hon đáng
kể so với nhóm bệnh nhân sử dụng etoposid/cisplatin, từ 4 ,3 đến 6, 9 thảng (p— 0,014). Trong cả hai
nghiên cứu, mức độ dung nạp thuốc lá tương tự nhau giữa 2 nhóm điếu trị.
Um,7 thư buồng tan: T rong một nghiên cứu ngẫu nhiên pha 111,356 bệnh nhân ung thư bìếu mô huống
trứng tiến triển có tải phát ít nhất 6 tháng sau khi hoản tắt hóa trị với dẫn chất cùa platin được cho dùng
ngân nhiên cả gemcitabin vả carboplatin hoặc chỉ dùng carboplatin. Thời gian tiến triến bệnh kéo dải rõ
rệt, từ 5, 8 đến 8, 6 tháng (p= 0 ,0038) được ghi nhận ơ nhóm bệnh nhân được điếu trị bằng gemcitabin vả
carboplatin so với nhóm bệnh nhân chỉ được sử dụng carboplatin. Sự khác biệt về tỷ lệ đảp ứng lả 47,2%
ở nhóm dùng gemcitabin vả carboplatin so với 30,9% ở nhóm điều trị bằng carboplatin (p = 0,0016) vả
thời gian sống trung bình là 18 thảng (gemcitabin vả carb0piatin) so với 17,3 tháng (carboplatin) (p =
0,73) cho thấy hiệu quả tốt hơn được ghi nhận ở nhóm sử dụng gemcitabin vả carboplatin.
Ung lhư vú: Trong một nghiên cứu ngẫu nhiên pha 111 trên 529 bệnh nhân mắc ung thư vú tải phảt tại ohỗ
hoặc di căn không thế phẫu thuật có tái phảt sau khi được điếu trị bằng hóa trị líệu, gemcitabin phối hợp
với paclitaxcl giúp kéo dải đáng kế thời gian tiến trỉến bệnh từ 3,98 tháng đến 6,14 thảng (p = 0,0002) so
với khi sử dụng paclitaxel. Sau khi 377 bệnh nhân từ vong, thời gian sống tồng cộng ở nhóm đíều trị
bằng gemcitabin/paclitaxel là 18,6 thảng so với 15,8 tháng ` nhóm sử dụng paciitaxel (p = 0,0489, HR
0,82) và tỷ lệ đảp ứng toản bộ lần lượt là 41,4% và 26,2% — 0,0002).
Các đặc tính dược động học:
Dược động hoc của gemcitabin đã được nghiến c' ren 353 bệnh nhân trong 7 nghiến cứu khảo nhau,
bao gôm 121 nữ và 232 nam tuổi từ 29 đến 79. Trong số bệnh nhảm nảy, khoảng 45% bệnh nhân mắc ung
thư phồi không phải tế bảo nhỏ vả 35% được chẩn đoản ung thư tụy. Cảo thông số dược động học sau
dây được ghi nhận khi sử dụng liều từ 500 đểu 2.592 mglm2 theo đường truyền tĩnh mạch trong thời gian
từ 0,4 đến 1,2 giờ.
Hấp thu: Nồng độ đỉnh cùa thuốc trong huyết tương (đạt được trong vòng 5 phút sau khi ngừng truyền) là
từ 3,2 đến 45,5 ụg/m1. Khi sử dụng liếu gemcitabin 1.000 mg/m2 truyền tĩnh mạch trong 30 phút, nồng
độ thuốc cao hơn 5 ụg/rnl trong khoảng 30 phút sau khi kết thủc truyền tĩnh mạch vả oao hơn 0,4 pg/m]
trong thêm một giờ
Phân _bố: Thế tich phân bố ở ngăn trung tâm là 12,4 le2 đối với nữ và 17, 5 Um² đối với nam (biến thiên
giữa cảc cả thế là 91,9%) Thể tích phân bố 0 ngăn ngoại vi là 47, 4 le². Thể tích ngăn ngoại vi không
biến thiên theo giới tính. Tỷ lệ thuốc gắn protein huyết tương không đảng kế. Thời gian bản thải năm
trong khoảng từ 42 đến 94 phủt tùy thuộc tuối và giới tính. Khi sử dụng liếu đề nghị, gemcitabin được
đảo thải gân như hoản toản trong khoảng thời gian từ 5 đến 11 gỉờ tính từ lúc bắt đầu truyền tĩnh mạch.
Gemcitabin không bị tích lũy khi sử đụng chế độ liếu một lần môi tuần.
Chuvến hóa sinh hoc: Gemcitabin được chuyến hóa nhanh bới cytìdin deaminase ơ gan, thận, máu và cảc
mô khảo Quá trình chuyến hóa nội bảo cùa gemcitabin tạo ra gemcitabin mono, di vả triphosphat
(dFdCMP, dFdCDP vả dFdCTP), trong đó dFdCDP vả dFdCT P là cảc chất có hoạt tính. Các chất chuyển
hóa nội bảo nảy không được tìm thấy trong huyết tương hoặc nước tiểu. Dạng chuyển hóa chính là 2’-
deoxy-2’, 2’-difiuorouridin (dFdU) không có hoạt tính và được tỉm thấy cả trong huyết tương và nước
tiếu
T_h_ải trừ: Tốc độ thanh thải toản thân cùa thuốc là từ 29 ,2 ngiờ/m2 đến 92 ,2 L/giờ/m2 tùy thuộc giới tính
và tuối (biến thiếu giữa các cả thế lẻ 52 ,.2%) Độ thanh thải ở nữ giới thấp hơn— khoảng 25% so với ở
nam giới Mặc dù thuốc dược đảo thải nhanh nhưng tốc độ thanh thải ở cả nam và nữ « ”'
sử dụng liều gemcitabin đề nghị là 1000 mglm2 truyền tĩnh mạoh trong 30 phút "đìiẵic
gemcitabin nêu độ thanh thải 0 nam giới hoặc nữ giới giảm Dưới 10% thuốc đượ đẳốfflặNtịìlđủớề, 'ểư
ở dạng không chuyến hóa. Tốc độ thanh thải qua thận là 2 đến 7 ngiờlm².
Trong tuần sử dụng thuốc, 92 đến 98% liều gemcitabín được đảo thải, 99% qu
dạng dFdU và 1% được thải trừ qua phân \…,,\ DU "
Dươc đông hoc của dFdCTP: Chẫt chuyến hóa nảy có thể tìm thấy ở các tế bảìzẵẫÌợn` nhã hà ảu
ngoại vi và cảc yếu tế liên quan tế bảo nảy Với liếư gemcitabine từ 35— 350 mgĨmẵấỉĨ Ĩ " g độ
dFdCTP nội bảo tãng tỷ lệ tương ứng và đạt nồng độ on định là 0, 4— 5 11ng Khi nồng ` gemcitabin
2
cao hơn 5 pg/ml, nổng độ dFdCTP không tăng do các 1é bảo đã bão hòa. Thòi gian bán thải của dFdCTP
là từ 0, 7— 12 giờ
Dươc đông hoc của dFdU: Nồng độ đinh của dFdU trong huyết tương (3 15 phủt sau khi kết thúc truyền
tĩnh mạch liếu 1000 mglm² trong 30 phút) là 2852 ụg/ml. Nồng độ đáy sau khi sử dụng thuốc một lần
mỗi tuần là 0,07 — 1,12 ụglml vả thuốc không bị tích lũy. Đường cong nông độ dFdU theo thời gìan chia
lâm 3 pha, thời gian bán thải trung bình ở pha cuối iả 65 giờ (trong khoảng 33— 84 giờ). Tỷ lệ dFdU hình
thảnh từ gerncitabin là 91 — 98%. Thể tich phân bố trung bình ơ ngăn trung tâm là 18 le2 (trong khoảng
11 — 22 Ll'm ).
Thế tich phân bố trung bình cùa dFdU ở trạng thải €… định là 150 le² (trong khoảng 96-228 le²).
Loại mô phân bố: rộng rãi
Tốc độ thanh thải biễu kiến trung bình: 2, 5 Lfgiòf/m2 (trong khoảng 1 — 4 L/giờ/m2 ).
Đảo thải qua nước tiếu: 100%.
Phối hơn gemcitabin vả naclitaxelz Sử dụng phối hợp gemcitabìn vả paclitaxel không ânh hưởng đến
dược động học cùa mỗi thuốc
Phối hơp gemcitabin vả carbonlatin: Khi sử dụng phối hợp với carboplatin, dược động học của
gemcitabỉn không thay đỗi.
Suv thân: Suy thận nhẹ đến vừa (độ lọc cầu thận từ 30 mllphủt đến 80 mllphút) không ảnh hưởng đảng
kế đến dược động học cùa gemcitabin. /
Chỉ định:
Gemcitabin được chỉ định phối hợp vởi cisplatin trong điếu trựnẳắaảng quang tiểu triền tại chỗ hoặc
di căn. Gemcitabin được chỉ định điếu trị cho những bệnh nhân ưng thư bìếu mô tuyển tụy tiến triến tại
chỗ hcặc di căn. Gemcitabin được chỉ định phối hợp với cisplatin như liệu phảp điếu trị ban đầu cho
những bệnh nhân ung thư phổi không phải tế bảo nhỏ tiến tnên tại chỗ hoặc di căn. Có thể cân nhắc sử
dụng gemcitabin đơn trị liệu cho bệnh nhân cao tuổi hoặc bệnh nhân ung thư phổi không phải tế bảo nhỏ
giai đoạn 2. Gemcitabin được chỉ định phối hợp với carboplatin để điều trị cho những bệnh nhân ung thư
biếu mô buồng trứng tiến triến tại chỗ hoặc di oăn, bệnh nhân ung thư tải phảt sau khoảng thời gian tối
thiếu 6 thảng sau hóa trị ban đầu với dẫn chất của platin.
Gemcitabin được chỉ định phối hợp với paclitaxel đế điếu trị cho nhũng bệnh nhân mắc ung thư vú tải
phảt tại chỗ hoặc di cãn không thế phẫu thuật sau khi được điều trị bằng một thuốc chống ung thư thuộc
nhóm dẫn chất anthracyclin
Liều lượng và cách dùng:
Chỉ những bác sĩ đã có kinh nghiệm dùng thuốc chống ung thư mới được phép sử dụng gemcitabin.
Liều đế nghi:
Ung thư bring auanz:
- Phối họp !huốc. Liều gemcitabin đề nghị là 1000 mg/m2 bề mặt cơ thế, truyền tĩnh mạch trong 30 phút.
Nên sử dụng thuốc vảo ngảy thứ 1,8 và 15 của đợt điều trị 28 ngảy, phối họp với císplatin Liều císplatỉn
đề nghị là 70 mg/m2 vảo ngảy thứ 1 sau khi sử dụng gemcitabin hoặc vảo ngảy thứ 2 cùa đợt điểu trị 28
ngảy. Sau đó lặp lại chu kì điếu trị 4 tuần như trên. Có thế giảm liếu sau mỗi đợt điều trị hoặc trong một
đọt đíếu trị tùy theo mức độ độc tinh cùa thuốc đối với bệnh nhân.
Ung thư tuỵ:
Liều gemcitabìn đề nghị là 1000 mg/mz, truyền tĩnh mạoh trong 30 phút. Sử dụng lặp lại một lần mỗi
tuần trong thòi gian tới 7 tuần, sau đó nghỉ 1 tuần Trong cảc đợt điếu trị tiếp theo, sử dụng thuốc một lần
mỗi tuần trong 3 tuần liên tiếp cứa đợt đỉếu trị 4 tuẫn. Có thế giảm liếu sau mỗi đợt điếu trị hoặc trong
một đợt đỉếu trị tùy theo mức độ độc tính cùa thuốc đối với bệnh nhân.
Ung thư ghối khỏng ghảz' tế bảo nhỏ:
- Đơn 1rị liệu. Liều gemcitabin đề nghị là 1000 mg/m², truyền tĩnh mạch trong 30 phút Sử dụng lặp lại
một lần môi tuần trong thời gỉan 3 tuần, sau đó nghỉ 1 tuần. Sau đó lặp lại chu kì đíếu trị 4 tuần Có thế
giảm liều sau mỗi đọt điếu trị hoặc trong một đợt điếu trị tùy theo mức độ độc tính của thuốc đối với
bệnh nhân.
! A A ! o A
điều trị tùy theo mưc đọ đọc tinh cua thuốc đối với bệnh nhân. Sử dụng cisp1ati
một lần sau mỗi 3 tuần.
Ung thư vú _
- Phổỉ họp thuốc: Gemcitabin được khuyến cáo sử dụng phối họp với paclỉtaxel ] ,— …
tĩnh mạch trong 3 giờ vảo ngảy thứ 1 của đợt điểu trị, sau đó sử dụng gemcitabìn li
trị hoặc trong một đợt điều trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân. Số lượng bạch cầu
hạt cùa bệnh nhân 161 thiếu phải là 1500 x 10“ tế bảo/L trước khi bắt đầu đìều trị bằng gemcitabin phối
hợp với paclitaxel.
Uma thư buồng trứng:
- Phối hợp thuốc: Gemcitabin được khuyến cảo sử dụng phối hợp với earboplatin trong điều trị ung thư
buồng trứng. Liều gemcitabin là 1000 mglm², truyền tĩnh mạch trong 30 phủt, sử dụng vảo ngảy thứ 1 và
8 cùa đợt điếu trị 21 ngảy. Sau khi sử dụng gemcitabin, tiếp tục dùng carboplatin vảo ngảy thứ 1 đề đạt
trị số điện tích đười đường cong (AUC) mục tiêu của carbOplatin là 4,0 mg/mlophút. Có thế gỉảm liền sau
mỗi đợt đỉếu trị hoặc trong một đọt điều trị tùy theo mức độ độc tinh của thuốc đối với bệnh nhân.
Theo dõi đôc tính của thuốc và hiêu chinh liều:
Híẻu chình lỉều do đôc tính ngoải hê tao máu:
Cần kiểm tra sức khỏe dịnh kì và đánh giá chức năng thận và gan đế phảt hiện độc tinh của thuốc ngoải
hệ tạo mảu Có thể giảm liếu sau mỗi đợt đỉếu trị hoặc trong một đợt điếu trị tùy theo mức độ độc tính
của thuốc đối với bệnh nhân. Thông thường, đối với trường hợp độc đinh ngoải hệ tạo máu nặng (độ 3
hoặc 4), trừ buồn nõn/nôn, nên ngừng sử dụng gemcitabin hoặc giảm liều tùy theo chỉ định của bảo 51
Nên ngừng dùng thuốc cho đến khi độc tính cùa thuốc đã được khẳc phục.
Đế hiệu chinh liếu cisplatín, carboplatin vả paclitaxel khi sử dụng ph01 th với gemcitabin, cần tham
khảo tóm tắt đặc tính sân phấm của mỗi thuốc.
Hiên chinh liều do đôc tính trẽn hệ tao máu. › . ửè :,
Bắt đầu đọt điều trị: Với tẩt cả cảc chỉ định, cân kỉêm tra số 1 tiêu cau và bạch câu hạt của bệnh
nhân trước mỗi lần sử dụng thuốc Bệnh nhân phải có số iượng bạch cầu hạt tối thiếu là 1.500 x 106 tế
bảo/L và ít nhất 100. 000 x 106 tiếu cầulL trước mỗi đợt điếu trị.
Trong đợt điều trị: Nên hiệu chỉnh Iiếu gemcitabin trong một đợt điếu trị theo bảng dưới đây:
Hiệu chĩnh !iều gemcitahin trong một đợt điếu trị ung thư bâng quang, ung thư phổi không phải
tế bao nhỏ và ung thư tụy, sử dung đơn độc hoặc phối hợp với cỉsplatin
Số lượng bạch cầu hạt Số lượng tiễu cầu (x 106/L) Phần trăm Ẩso với liều
(x 10 |L) gemcitabin chuan (%)
> 1.000 và > 100.000 100
500 —— 1000 hoặc 50.000 — 100.000 75
< 500 hoặc < 50. 000 Ngừng sử dụng*
* Không nến sử dụng thuỗc trở lại trong cùng một đợt điếu trị cho đến khi số lượng bạch cẩu hạt đạt tối
thiếu 500 x 10% và số lượng tiếu câu ít nhất là 50.000 x 10°/L.
* Không nên sử dụng thuốc trở lại trong cùng một đợt điếu trị Bắt đầu dùng thuốc vảo ngảy thứ 1 của
đợt điếu trị tiếp theo nếu số lượng bạch cầu hạt đạt 1.500 x 106 tế bâolL vả sô lượng tiếu câu là 100 00 x
106 |L.
Hiệu chĩnh liếu gemcitabin trong một đọt điếu trị ung thư vú, phối hợp với paclỉtaxel
Số lượng bạch cầu hạt Số lượng tiếu cầu (x 10°|L) Phần trăm so với lỉếu
(x 106/L) gemcitabin chuẩn (%)
> 1 200 và > 75.000 100
1.000 — < 1.200 hoặc 50.000 — 75.000 75
700 ~ < 1.000 và 2 50.000 50
< 700 hoặc < 50.000 Ngừng sử dụng*
Hiệu chỉnh liều gemcitabỉn trong một đọt đỉếu trị ung thư buồng trứng, phối hợp với carboplatỉn
Số lượng bạch cầu hạt Số lượng tiễu cầu Phần trăm so với liều
(x 10°JL) (x 10“JL) gemcitabin chuẩn (%)
> 1.500 và > 100.000 100
1.000 — 1.500 hoặc 75.000 - 100.000 50
< 1.000 hoặc < 75.000 Ngừng sử dụng*
Hiệu chính liều gemcitabin do độc tính trẽn huyễr học trong các đợt đíều tri tiểp theo cho ẵit ca" các chỉ
định.
Nên giảm liếu gemcitabin xuống còn 75% so với liều khởi đầu trong cảc trườn '
học sau:
0 Số lượng bạch cầu hạt < 500 x lOÓÍL kéo dải quả 5 ngảy.
0 Số lượng bạch cầu hạt < 100 x 106/L kéo dải quả 3 ngảy.
0 Giảm bạch cầu trung tỉnh có sốt.
o Sô lượng tiêu cầu < 25.000 x 10°1L.
o Tri hoãn đợt điều trị trêni tuần do độc tinh.
Cảch dùng: Gemcitabin được dung nạp tốt khi truyền tĩnh mạch và có thế sử dụng trong khi di chuyến
Nếu xảy ra tình trạng thoảt mạch, cần ngưng truyền ngay lập tức và chuyến sang truyền vảo một tĩnh
mạch khác. Cần theo dõi chặt chẽ tình trạng bệnh nhân sau khi truyền.
Về hướng dẫn cách pha chế, xem mục Những lưu ý đặc biệt về việc pha chế vả xử lý loại bò.
Cảo nhóm bênh nhân đăc biêt:
Bẻnh nhân suv thân hoãc suv gan: Cần thận trọng khi sử dụng gemcitabin cho bệnh nhân suy thận hoặc
suy gan do chưa có đủ thông tin từ cảc nghiên cứu lâm sảng cho phép đưa ra khuyến cảo líều chinh xác
cho những bệnh nhân nảy (xem mục Những cảnh báo đặc biệt và thận trọng khi sử dụng và Các đặc tính
dược động học).
Bênlz nhán cao tuối (> 65 tuổi): Gemcitabin được dung nạp tổt ở những bệnh nhân trên 65 tuổi. Chưa có
bằng chửng thấy cần phải hiệu chỉnh liều khi sử dụng cho bệnh nhân cao tuổi (xem mục Cảo đặc tính
dược động học).
Trẻ em (<18 tuối): Gemcitabin không được khuyến cảo dùng cho trẻ dưới 18 tuối do không đủ dữ liệu về
an toản vả hiệu quả.
Chốngă chỉ định.
Quả mân với gemcitabin hoặc bất kì thảnh phần nảo cùa thuốc.
Phụ nữ oho con bú (xem mục Sử dụng cho phụ nữ có thai và cho con b ’).
Những cãnh báo đặc biệt và thận trọng khi sử dụng:
Sử dụng thuốc theo đường truyền tĩnh mạch trong thời gian dải và tăng số liếc dùng có thế lảm tăng độc
tính
Đôc tính trên hê tao mảu: Gemcitabin có thế ức chế chức nãng của tủy xương, biếu hỉện bằng giảm bạch
cầu, giảm tỉếu cẩu và thiểu mảu. Bệnh nhân được điếu trị bằng gemcitabin cần được kiếm tra số lượng
tiếu cầu, bạch cầu và bạch cầu hạt trước mỗi liếu sử đụng. Nên cần nhắc ngừng thuốc hoặc hiệu chinh
liều khi phảt hiện tình trạng ức Chế tùy xương do thuốc (xem mục Liều lượng vả cách dùng). Tuy nhiên,
tình trạng ức chế tủy xương chỉ kéo dải trong thòi gian ngắn vả thường không cần phải giảm liếu và hiếm
khi phải ngừng thuốc. Số lượng tế băo máu ngoại vi có thể tiếp tục giảm sau khi đã ngừng sử dụng
gemcitabin. Ở bệnh nhân bị gìảm chức năng tùy xương, cần thận trọng khi bắt đẩu điếu trị bằng
gemcitabin. Giống như cảc thuốc gây độc tế bảo khác, cân iưu ý nguy cơ ửc chế tủy xương tich iũy khi
Gemcitabin được sử dụng cùng vởi cảc thuốc hóa trị liệu khảo.
Suỵ gan và suy thân: Cần thận trợng khi sử dụng gemcitabin cho bệnh nhân Suy thận hoặc suy gan do
chưa có đủ thông tín từ các nghiên cứu lâm sảng cho phép đưa ra khuyến cảo liều chính xảo cho những
bệnh nhân nây (xem mục Liều lượng và cảoh dùng).
Sử dụng gemcitabin cho bệnh nhân mang khối u gan di căn hoặc có tiến sứ viếm gan, nghiện rượu hoặc
xơ gan có thế lảm nặng thêm tinh trạng suy giảm chức năng gan sẵn có.
Cần định kỳ kiếm tra chức năng gan vả thận (bao gồm cả cảc xét nghiệm vi sinh vật).
Xa tri đồng thời: Xạ trị (sử dụng đồng thời hoặc oách xa < 7 ngảy): Độc tính đã được ghi nhận (xem mục
Tương tác với cảc thuốc khảo vả cảc dạng tương tảc khảo đê biễt thông tin chi tiết và khuyến cảo sử
dụng)
Các vacin chứa vi sinh vât sống: Không khuyến cảo sử dụng vacin sốt vảng hoặc các chế phẩm vacin có
chứa vi sinh vật sống đã được lảm yêu cho bệnh nhân đang điều trị bằng gemcitabin (xem mục Tương tác
với cảc thuốc khảo và cảc Idạng tương tác khảo).
Tim mach: Do nguy cơ rối loạn tim vả/hoặc mạch máu khi sử dụng gemcitabin, phải đặc biệt thận trọng
khi sử dụng thuốc cho bệnh nhân có tiến sứ gặp cảc biến cố tim mạch.
Hôi chứng rò rỉ mao mạch: Hội chứng rò rỉ mao mạch đã được ghi nhận ở bệnh nhân sử dụng
gemcitabine đơn độc hoặc phối hợp với cảc thuốc hóa trị liệu khảo. Tình trạng nảy thường có thể đíều trị
được nếu phảt hiện sớm vả xử lý thích hợp, tuy nhiên, đã ghi nhận những ca tử vong. Tinh trạng rò rỉ
mao mạch có liên quan đến hiện tượng tảng tính thấm mao mạch toản thân khi dịch vả các protein từ
khoảng nội mạch rò rỉ ra mô kẽ. Các biếu hiện lâm sảng cùa rò rỉ mao mạch bao gôm phù toản thân, tăng
cân, gìảm albumin mảu, hạ huyết áp nặng, suy thận câp và phù phối. Cần ngừng sử dụng gemcitabin và
tiến hảnh các biện phảp đỉếu trị hỗ trợ nếu hội chứng rò rỉ mao mạch tiến triến tron . .:.
~z
.›/
văn lả có lìên quan đến hội chứng nguy kịch hô hẩp cấp
P__hổiz Tác dụng bất lợi của thuốc trên phổi, đôi khi ở mức độ nghiêm trọng (như
kẻ hoặc hội chứng suy hô hắp cấp) đã được ghi nhận khi sử dụng gemcitabin. C
xác của cảc tình trạng nảy. Nếu phảt hiện cảc tinh trạng như vậy, eân c
gemcitabin Ảp dụng cảc biện phảp điều trị hỗ trợ sởm có thể giúp cải thiện cảc tì
Thân:
Hôi chửng tản huvết urê huvết cao:
Nhũng biểu hỉện lâm sảng cùa hội chứng tán huyết urê huyết cao (HUS) đã được ghi nhận với tần suất
híếm gặp ở bệnh nhân sử dụng gemcitabin (xem mục Tác đụng không mong muốn) HUS lả tình trạng
rối loạn có khả nảng đe dọa tinh mạng. Cần ngùng sử dụng gemcitabin khi có những dấu hiệu đẩu tiên
của thỉếu mảu tản huyết vi mạch như giảm nhanh hcmoglobin cùng với giảm tiếu cầu, tăng bilirubỉn
huyết thanh, creatinỉn huyết thanh, nitơ urê mảu hoặc LDH. Tình trạng suy thận có thế không hồi phục
dù ngừng đỉếu trị và bệnh nhân có thể cần phải thẩm phân máu.
Chức năng sinh sản: Trong cảc nghiên cứu vê sinh sản, gemcitabin gây giảm sinh tinh ở chuột đực. Vì
vậy, nam gỉới đang được điều trị bằng gemcitabin không nên có con trong khi dùng thuốc và tới 6 thảng
sau khi ngừng điều trị và nên bản quản lạnh tinh trùng trước khi điều trị bằng gemcitabỉn do nguy cơ vô
sỉnh sau khi dùng thuốc (xem muc Sử dụng cho phụ nữ có thai và cho con bủ).
@: Gemcitabin 200 mg có chứa 3,5 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho bệnh
nhân đang ảp dụng chế độ ăn giảm natri.
Gemcitabin 1000 mg có chứa 17,5 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho bệnh
nhân đang áp dụng chế độ an giảm natri.
Gemcitabin 2000 mg có chứa 35 mg (1,5 mmol) natri trong mỗi lọ Cần lưwỷ khi sử dụng cho bệnh nhân
đang' ap dụng chế độ an giảm natri A /\1/
Tương tảc với các thuốc khác và các dạng tương tác khảc: (N
Chưa tỉển hảnh nghỉên cứu đặc hiệu nảo về tương tảo thưốc (xem ` ục Các đặc tính dược động học).
X_a tri: Sử dụng đồng thời (sử dụng cùng lúc hoặc cảch xa < 7 ngảy): Độc tính đã được ghi nhận khi sử
dụng phối hợp hóa trị và xạ trị phụ thuộc vảo nhiều yếu tố khác nhau bao gồm liều gemcitabín, tần suất
sử dụng, líều xạ trị, kỹ thuật xạ trị, mô đích và thể tích xạ trị Cảo thử nghiệm tỉền lâm sảng vả lãm sảng
cho thấy gemcitabín có hoạt tính nhạy cảm xạ trị. Trong một thử nghiệm lâm sảng, khi sử dụng
gemcitabin liều 1.000 mg/m² trong 6 tuần liên tiếp cùng với xạ trị vùng ngực cho bệnh nhân mắc ung thư
phổi không phải tế bảo nhỏ, tình trạng độc tính 0 mức độ nghiêm trọng và viêm niêm mạc có thể đe dọa
tính mạng, đặc biệt là viêm thực quản và viêm phối đã được ghi nhặn, nhất là ở bệnh nhân sử đụng thể
tích xạ trị lớn [thể tích xạ trị trung bình là 4.795 cm ]. Cảo nghiên cứu tỉếp sau cho thấy có thể sử đụng
gemcitabin liều thấp hơn cùng vởi xạ trị do có thề kỉểm soát được độc tính, chắng hạn như trong một
nghiên cứu pha 11 trên bệnh nhân ung thư phổi không phải tế bảo nhỏ sử dụng liếu xạ trị là 66 Gy cùng
vởi gemcitabin (600 mglm², 4 lần) và cisplatín (80 mglm², 2 lần) trong 6 tuần. Chế độ trị lỉệu tối ưu an
toản khi sử dụng gemcitabin cùng với xạ trị chưa được xác định trong điều trị tất cả các loại khối u.
Không sử dụng đồng thời (cảoh > '] ngảy): Phân tích dữ líệu nghiên cứu không phảt hiện thấy bẩt kỳ
nguy cơ tăng độc tính nảo khi sử dụng gemcitabin tại thời điểm cảoh hơn 7 ngảy trước hoặc sau xạ trị so
với khi tiến hảnh xạ trị nhắc lại. Dữ liệu nghiên cứu cho thắy có thể bắt đầu sử dụng gemcitabin sau khi
cảc tảc dụng bất lợi cấp tính của xạ trị đã được ldtắc phục hoặc ít nhắt ] tuần sau xạ trị
Tồn thương do xạ trị đã được ghi nhận tại các mô đích (như viêm thực quản, viêm kết trảng vả viêm
phổi) cả khi sử dụng đồng thời vả không sử dụng đồng thời cùng vởi gemcitabỉn.
Cảc chế nhẩm khảo: Không khuyến cảo sử dụng vacin sổt vảng da cũng như cảc chế phẫm vacin có chứa
vi sinh vật sống giảm độc lục do nguy cơ gây ra tảo dụng bẩt lọi toản thân, thậm chí iả cảc tỉnh trạng hết
sức nghiêm trọng có thể dẫn đến tử vong, đặc biệt là 0 bệnh nhân bị ức chế miễn dịch.
Sinh sản, có thai và cho con bú:
Phu nữ có thai: Chưa có đủ đữ iíệu về việc sử dụng gemcitabin cho phụ nữ có thai Cảc nghíên cứu trên
động vật cho thấy độc tinh của gemcitabỉn đối vói sinh sản. Dựa trên kểt quả từ các nghiên cứu trên động
vật và cơ chế tảo dụng của gemcitabin, không nên sử đụng gemcitabin trong thai kì trừ khi thực sự cân
thiết. Phụ nữ không nên có thai trong khi đang điều trị bằng gemcitabin và phải thông bảo ngay cho bảo
sĩ nểu có thai trong quá trình dùng thuốc.
Phu nữ cho con bú: Chưa rõ gemcitabin có được tiết vảo sữa mẹ hay không vả không thể loại trừ tảo
dụng bắt lợi của thuốc trên trẻ bú mẹ. Người mẹ phải ngừng cho con bú trong khi đang dùng thuốc.
Ành hưởng đến sinh sản: Trong cảc nghiên cứu về sỉnh sản, gemcitabín gây gỉảm sinh tinh ở chuột đực.
Vì vậy, nam giởi đang được đìều trị bằng gemcitabin không nên có con trong khi « — .;
thảng sau khi ngừng diều trị và nên bảo quản lạnh tính trùng trước khi điều trị b
cơ vô sinh sau khi dùng thuốc.
Ẩnh hưởng đến khả năng lái xe và vận hânh máy móc: '
Chưa tiến hảnh cảc nghiên cửu về ảnh. hưởng cùa thuốc đểu khả năng lái xe và \
rượu.`Bệnh nhân cần thận trọng không nên lái xe và vận hảnh máy móc cho đến khi chắc chắn không còn
bị buôn ngủ.
Tác dụng không mong mưốn:
Cảc tảc dụng bẩt lợi hay gặp nhắt khi sử dụng gemcitabin bao gồm: buồn nôn có hoảc không kèm theo
nôn, tăng transaminase gan (AST/ALT ) vả phosphatase kiềm đã được ghi nhận ở khoảng 60% bệnh
nhân; protein nỉệu và tiểu mảu được ghi nhận ở gân 50% bệnh nhân; khó thờ ở 10- 40% bệnh nhân (tỷ lệ
cao nhắt ở bệnh nhân ưng thư phối); phát ban kỉềư dị ứng ở 25% bệnh nhân và ngứa ở 10% bệnh
nhân. Tần suất vả mức độ nghiêm trọng cùa cảc phản’ ưng bất lọi tùy thuộc vảo liều dùng, tốc độ truyền
tĩnh mạch và khoảng cách giũa cảc liều (xem mục Những cảnh bảo đặc biệt vả thận trọng khi sử dụng).
Các tảo dụng bẩt lợi do liều là giảm số lượng tỉếu câu, bạch cầu và bạch cầu hạt (xem mục Liều lượng và
cảoh dùng).
Dữ liếu từ cảc thủ nghiêm lâm sâng: Tần suất phản ứng bất lợi được quy ước như sau: Rất hay gặp (>
1/10), Hay gặp (> 1f100 đển < 1/10), Ít gặp (> 1/1000 đến < 1/100), Hiếm gặp (> 1/10 000 đến <
111000), Rất hiếm gặp (< 1/10. 000)
Bảng dưới đây liệt kê các tác dụng bất lợi vả tần suất xuất hiện đựa trên các thử nghíệm lâm sảng. Trong
mỗi nhỏm tần suất, cảc tảo dụng bắt lợi được sắp xếp theo thứ tự độ nặng giảm dần.
Hệ cơ quan Cặc nhóm tần suất
Rối loạn hệ tạo máu và hệ bạch huyết Rât hay gặp:
0 Giảm bạch cẩu (Giảm bạch cầu trung tỉnh
// Độ 3: 19 3%, Độ 4: 6%). Tinh trạng ức
\/ chế tủy xương thường ở mức độ nhẹ đến
tmng bình và ảnh hưởng chủ yếu đến số
lượng bạch cầu hạt (xem mục Liễu lượng
và cảch dùng và mục Những cảnh báo đặc
biệt và thận trọng khi sử dụng)
0 Giảm tiếu câu
o Thiếu mảu
Hay gặpz
o Giảm bạch cẳu trung tính có sốt
Rất hiếm gặp:
o Tăng tìếu cầu
Rối loạn hệ mỉễn dịch Rất hỉếm gặp:
0 Phán ửng kiến phản vệ
Rối loạn chuyền hóa và dinh dưỡng Hay gặp
0 Chản ăn
Rối loạn hệ thần kinh Hay gặp:
0 Đau đầu
o Mất ngủ
0 Ngủ gả
Ít gặp:
0 Tai bỉến mạch não
Rối loạn tim Ít gặp:
. Rối loạn nhịp tỉm, chủ yếu là nhịp nhanh
trên thắt
. Suy tỉm
Hiếm gặp:
0 Nhồi máu cơ tỉm
Rối loạn mạch mảu Hiếm gặp:
0 Cảo dẳu hiệu lâm sâng của viêm mạch
ngoại vi và hoại thư.
0 Hạ huyêtảp
Rất hiếm gặp: o_PÝ "
. Hội chứng rò rỉ lĩ/Jưz * ffl nau
Những cảnh bảo đ in ệtờễổẵềạạLifflảlg khi
sử dụng) PR /I
Rối Ioạn hô hấp, vùng ngực và trung thất Rất thường gặp: \ỂỄỒ\UUY lẩ /ẻyỵ
M 7
~ Khó thở - thường ở mức độ nhẹ và khỏi
nhanh mã không cần điều trị
Hay gặpr
o Ho
o Viêm mũi
Ít gặp:
0 Víêm phổi mô kẽ (xem mục Những cảnh
báo đặc biệt vả thận trọng khi sử dụng)
0 Co thẳt phế quản — thường ở mức độ nhẹ
và thoảng qua nhưng có thế cần phải điều
trị theo đường tĩnh mạch
Hiếm gặp:
. Phù phối
o Hội chứng suy hô hẳp cấp (xem mục
Những cânh bảo đặc biệt và thận trọng khi
sử dụng) /
Rối loạn tiêu hóa Rất hay gặp: , ' /
o Nôn
o Buồn nôn
Hay gặpr
o Tiêu chảy
o Viêm vả loét miệng
o Tảo bón
Rất hiếm gặp:
. Viêm đại trảng do thiếu mảu cục bộ
Rối loạn gan mật
Rẳt hay gặp:
0 Tăng transamínase (AST vả ALT) vả
phosphatase kỉềm ở gan
Hay gặp:
0 T ăng bỉlirubín
Ít gặpz
0 Ngộ độc gan nặng, kể cả suy gan vả. tử
vong
Hiểm gặp:
' Tăng gamma-glutamyl transferase (GGT)
Rối Ioạn da và mô dưới da
Rất hay gặp:
0 Ban dị ửng da thường kèm theo ngứa
o Rụng tóc
Hay gặp=
o Ngứa
. Đồ mồ hôi
Hiếm gặp:
0 Cảo phản ứng nghiêm trọng trên da, kể cả
tróc vảy và ban da bòng rộp
e Loét
0 Tạo mụn nước đau
o Tróc vảy
Rẳt hiếm gặp:
0 Hoại từ thượng bì nhiễm độc
0 Hội chứng Stevens-Johnson
Rối loạn cơ xương và mô liên kểt
Hay gặpz w*°°²²ơẹ
o Đau lưn Ý" `Q
g ,,p còne 1jY 4“
o Đau cơ ;, CỔ ,.…ÀM
Rối loạn thận và tiêt niệu
Rất hay gặp: * ' '"Ẩả
o Tíếu máu 0 DƯỢC Pl'ì .
f Protein niệu mức độ nhẹ IỂz,-
It gặp: ’h,
o Suy thận (xem mục Những cảnh báo đặc
biệt và thận trọng khi sử dụng)
0 Hội chứng tản huyết urê huyết cao (xem
mục Những cảnh bảo đặc biệt và thận
trọng khi sử dụng)
Rối loạn toản thân và phản ứng tại vị trí sử dụng Rât hay gặp:
0 Triệu chủng gỉổng cúm — cảc triệu chửng
hay gặp nhất là sốt, đau đầu, ởn lạnh, đau
cơ, suy nhược vả chản ăn.
0 Ho, víêm mũi, khó chịu, đổ mồ hôi và khó
ngủ đă được ghi nhận.
0 Phùlphù ngoại vỉ, kể cả phù mặt. Phù
thường có thể hồi phục sau khi ngừng
đỉều trị. /
Hay gặp:
o Sốt ý
0 Suy nhược
. Ớn lạnh
Hiếm gặp:
0 Cảo phản ứng tại vị trí truyền, chỉ yếu ở
mức độ nhẹ.
Tồn thương, ngộ độc và cảc biến chứng do thủ thuật Hiếm gặp:
0 Nhiễm độc xạ trị (xem mục Tương tác vởi
cảc thuốc khác và các dạng tương tảc
khảo).
0 Tổn thương do xạ trị củng cố
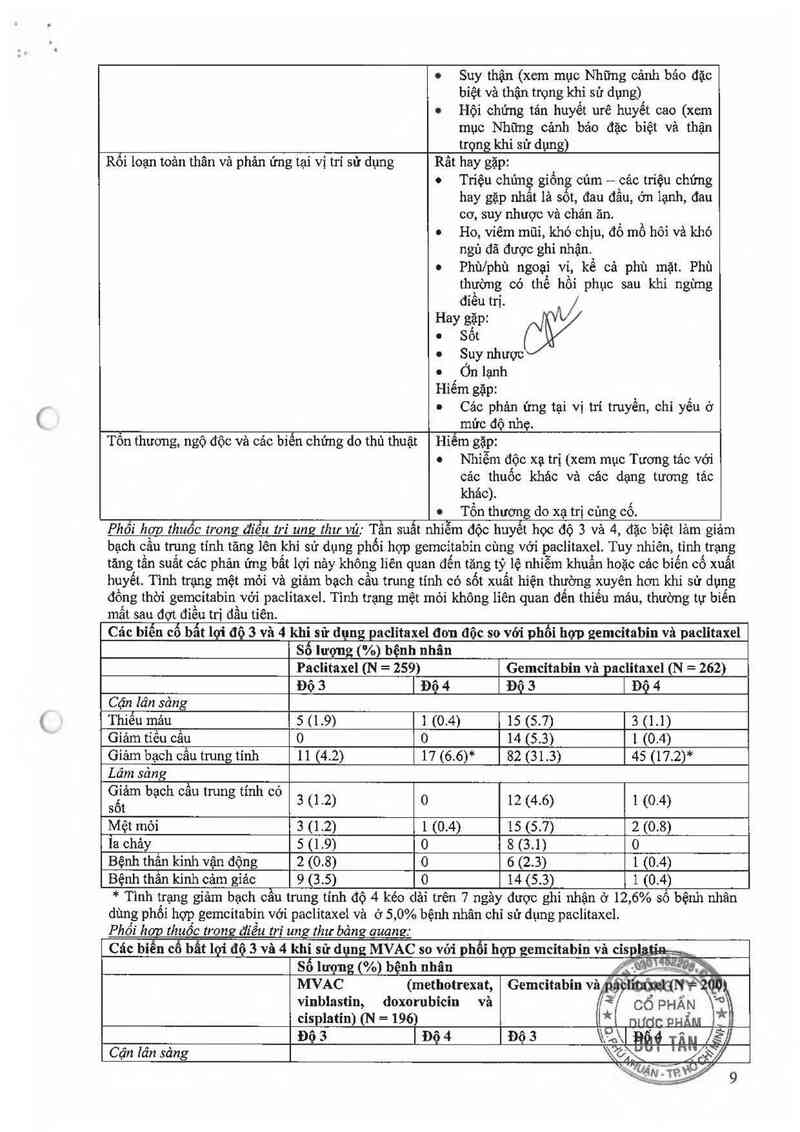
Phồi hợp thuốc trong điều tri ung thư vú: Tần suất nhiễm độc huyết học độ 3 vả 4, đặc biệt lảm giảm
bạch cẩu trung tinh tăng lên khi sử dụng phối hợp gemcitabin cùng với paclitaxel. Tuy nhiên, tình trạng
tăng tần suãt các phản ứng bất lợi nảy không liên quan đến tăng tỷ lệ nhiễm khuấn hoặc các biến cố xuất
huyết. Tình trạng mệt mỏi và giảm bạch cãu trung tính có sốt xuất hiện thường xuyên hơn khi sử dụng
đồng thời gemcitabin vởi paclỉtaxel. Tình trạng mệt mói không liên quan đến thiếu mảu, thường tự biến
mất sau đợt điếu trị đầu tỉên.
Các bỉến cố bẫt lợi độ 3 và 4 khi sử dụng paclítaxel đơn độc so vởí phối hợp gemcitabin vả paclitaxel
Số lượng (%) bệnh nhân
Paclitaxel (N = 259) Gemeỉtabin vả paclitaxel (N = 262)
Độ 3 | Độ 4 Độ 3 l Độ 4
Cận lân sảng
Thiếu máu 5 (1.9) 1 (0.4) 15 (5.7) 3 (1.1)
Giảm tỉều cẩu o o 14 (5.3) 1 (0.4)
Giảm bạch cầu trung tính 11 (4.2) 17 (6.6)* 82 (31.3) 45 (17.2)*
Lám sảng
. 4 A I ,
Ẹẵam bạch cau trung tinh co 3 (la) 0 12 (4.6) 1 (0.4)
Mệt mỏi 3 (1.2) 1 (0.4) 15 (5.7) 2 (0.8)
la chảy 5 (1.9) 0 8 (3.1) 0
Bệnh thần kinh vận động 2 (0.8) 0 6 (2.3) 1 (0.4)
Bệnh thần kinh cảm giảc 9 (3 5) 0 14 (5 3) 1.(0 4)
* Tình trạng gíảm bạch cầu trung tinh độ 4 kéo dải trên 7 ngảy dược ghi nhận ở 12, 6% số bệnh nhân
dùng phổi hợp gemcitabin với paclitaxel và ở 5,0% bệnh nhân chỉ sử dụng paclitaxel.
Phối hơn thuốc trong điều tri ung thư bảng auanz
Các biểu cố bất lợi độ 3 và 4 khi sử dụng MVAC so vói phối hợp gemcitabin vã cispl_a '
Số lượng (%) bệnh nhân / z°,~ -r›—_
MVAC (methotrexat, Gemcitabin vả WMV
vỉnblastỉn, doxorubicin và Cổ PHẦN °°
cỉsplatin) (N = 196) ( mfdp QHỂM l*iị
Độ3 lĐộ4 Đô3 \\Ảl a' fẻỆ
Cận lân sảng \\ớ\
ĨIUẢN TP.
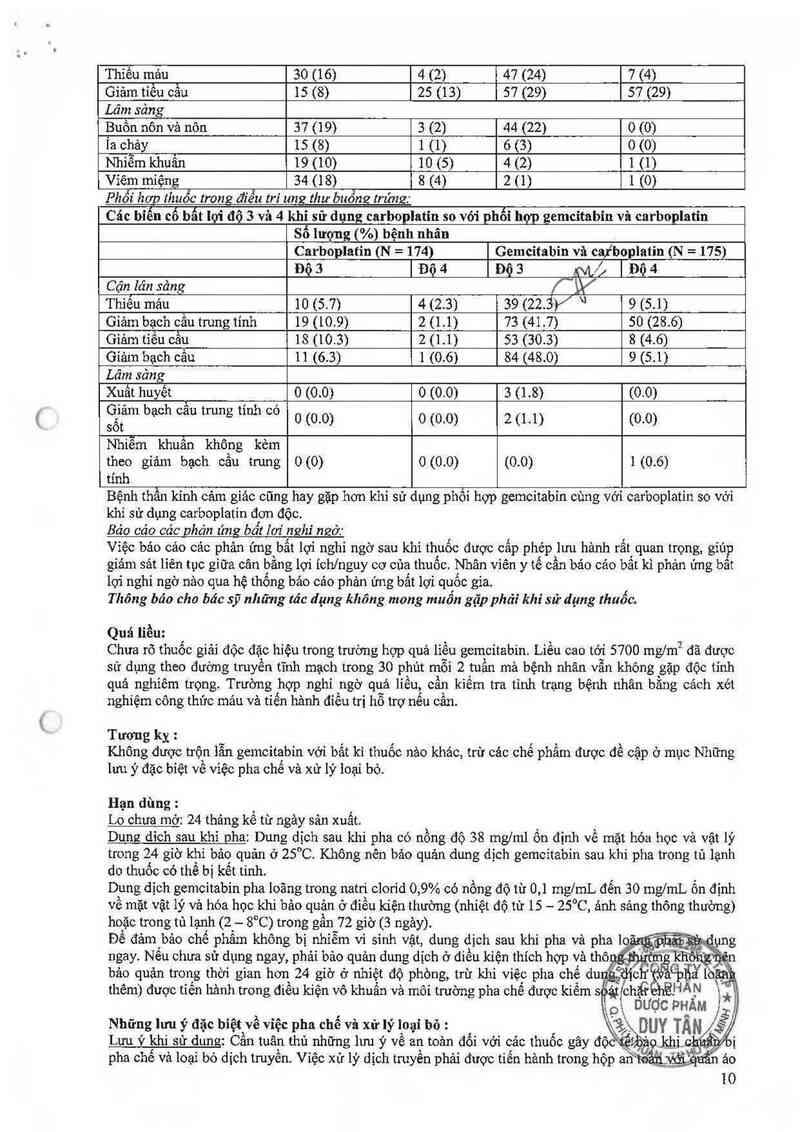
Thiểu mảu 30 (16) 4 (2) 47 (24) 7 (4)
Giảm tiếu cằu 15 (8) 25 (13) 57 (29) 57 (29)
Lâm sảng
Bưồn nôn vả nôn 37 (19) 3 (2) 44 (22) 0 (O)
Ỉa chảy 15 (8) 1 (1) 6 (3) o (0)
Nhiễm khuân 19 (10) 10 (S) 4 (2) 1 (1)
Viêm miệng 34 (18) 8 (4) 2 (1) 1 (0)
Phỗi hơp thuốc trong điểu tri ung thư buồng trúng:
Các bíến cố bẫt lợi độ 3 và 4 khi sử dụng carboplatin so với phối hơp zemcitabin vả carboplatin
Số lượng (%) bệnh nhân
Carboplatin (N = 174) Gemcitabin vã caiboplatin (N = 175)
Độ3 IĐộ4 Độ3 m/jĩĐộa
Cận lán sảng
Thiểu mảu 10 (5.7) 4 (2.3) 39 (22.3)/ " 9 (5.1)
Giảm bạch cầu trung tính 19 (10.9) 2 (1.1) 73 (41.7) 50 (28.6)
Giảm tiếu cầu 18 (10.3) 2 (1 .1) 53 (30.3) 8 (4.6)
Gíảm bạch cầu 11 (6.3) 1 (0.6) 84 (48.0) 9 (5.1)
Lâm sảng
Xuất huyết ` 0 (0.0) 0 (0.0) 3 (1.8) (0.0)
sGẳỄm bạCh °²“ trung ““h “0 0 (0.0) 0 (0.0) 2 (1.1) (0.0)
Nhiễm khuân không kèm
theo giảm bạch cầu tnmg 0 (0) 0 (0.0) (0.0) 1 (0.6)
tính
Bệnh thẫn kinh cảm giáo cũng hay gặp hơn khi sử dụng phối hợp gemcitabin cùng vởi carboplatin so với
khi sử dụng carboplatin đơn độc.
Báo cáo các phản úng bẩ1lơi nghi mzờ.
Việc báo cáo cảc phản ứng bất lợi nghi ngờ sau khi thuốc được cấp phép lưu hảnh rẳt quan trọng, giúp
giảm sảt lỉên tục giữa cân bằng lợi ich/nguy cơ của thuốc. Nhân viên y tế cần bảo cảo bất kì phản ứng bất
lợi nghi ngờ nảo qua hệ thống bảo các phản ửng bất lợi quốc gia.
Thông báo cho bác sỹ nhũng tác dạng không mong muốn gặp phăt' khi sử dụng thuốc.
Quá liều:
Chưa rõ thuốc giải độc đặc hiệu trong trường họp quá liếu gemcitabin. Liều cao tới 5700 rng/m2 đã được
sử dụng theo đường truyền tĩnh mạch trong 30 phút mỗi 2 tuần mả bệnh nhân vẫn không gặp độc tính
quá nghiêm trọng. Trưòng họp nghi ngờ quả lỉếu, cần kiếm tra tinh trạng bệnh nhân bằng cảoh xét
nghiệm công thức mảu vả tỉến hảnh điều trị hỗ trợ nêu cằn
Tương kỵ:
Không được trộn lẫn gemcitabỉn vởỉ bất kì thuốc nảo khác, trừ cảc chế phầm được đề cập ở mục Những
lưu' y đặc bíệt về việc pha chế và xứ lý loại bò.
Hạn dùng:
Lo chưa mở: 24 tháng kế từ ngảy sản xuất
Dung dich sau khi Dha: Dung dịch sau khi pha có nồng độ 38 mglml ốn định về mặt hóa học và vật lý
trong 24 giờ khi bảo quân ở 25°C. Không nên bảo quản dung dịch gemcitabin sau khi pha trong tủ lạnh
do thuốc có thế bị kết tinh.
Dung dịch gemcitabin pha loãng trong natri clorid 0, 9% có nồng độ từ 0,1 mgme đến 30 mg/mL f… định
về mặt vặt iý và hóa học khi bảo quản ở điều kiện thường (nhiệt độ từ 15— 25°C, ánh sảng thông thuờng)
hoặc trong tủ lạnh (2— 8°C) trong gần 72 giờ (3 ngảy).
Để đảm bảo chế phẩm không bị nhiễm vi sinh vật, dung dịch sau khi pha và pha lo "
ngay Nếu chưa sử dụng ngay, phâỉ bảo quản dung dịch 0 điếu kiện thích hợp vả thô : ~ "
bảo quản trong thời gìan hơn 24 giờ ở nhiệt độ phòng, trừ khi việc pha chế du "’đich' Gp
thêm) được tỉến hảnh trong điếu lciện vô khuấn và môi trường pha chế được kiếm s ậ,t chẩề ỄJ 1ẨN
DƯỢC PHẨM
Những lưu ý đặc biệt về việc pha chế và xử lý loại bỏ: 'ẵ _ DUY TÂN ,ễr
Lưu Ý khi sử dung: Cần tuân thủ những lưu ý về an toản đối với cảc thuốc gây độc`fệ `QJẺÌ- «1 Ệ
pha chế và loại bỏ dịch truyền. Việc xử lý dịch truyền phải được tiến hảnh trong hộp afi*`teấịổ,q .'
vả găng tay bảo hộ. Nếu không có hộp an toản, cần sử dt,mg thêm mặt nạ và kính bảo hộ. Nếu để chế
phẳm tiểp xúc vởi mắt, thuốc có thể gây kich ứng mạnh. Phải rừa kỹ mắt ngay lập tức bằng nước sạch.
Nếu mắt vẫn còn bị kích ứng, cần tham vẩn ỷ kiềm bảo sĩ. Nếu dung dịch bị rây vảo da, phải rừa kỹ với
nước sạch
Hưởng dẫn nha chế (và tìển tuc nha loãngìz Dung môi duy nhắt được phép sử dụng để hòa tan hột vô
khuẩn gemcitabỉn là dung dịch natri clorid 9 mglml (0, 9%) dùng để pha tiêm (không có chất bảo quản).
Do giởi hạn vê độ tan, nông độ dung dịch gemcitabìn tối đa có thể đạt được sau khi pha là 40 mglml. Cẩn
tránh pha dung dịch có nồng độ cao hơn 40 111ng vì có thế thuốc không tan hoần toản.
1. Sử dụng kỹ thuật vô trùng trong quá trình pha và pha loãng dung dịch gemcitabỉn truyền tĩnh mạch
2. Đề pha dung dịch, thêm 5 ml dung dịch natri clorid 9 mglml (0, 9%) vô khuẩn không có chất bảo quản
vảo lọ 200 mg hoặc thêm 25 ml dung dịch natri clorid 9 mglml (0, 9%) vô khuẩn không có chất bảo quản
vảo lọ 1 g hoặc thêm 50 ml dung dịch natri clorid 9 mg/ml (0, 9%) vô khuẩn không có chất bảo quản vảo
lọ 2 g. Tống thể tích dung dịch sau khi pha iần lượt 11) 5 ,26 ml (lọ 200 mg), 26, 3 ml (lọ ] g) và 52, 6 ml
(lọ 2 g). Dưng dịch gemcitabin sau khi pha có nồng độ 38 mglml. Lắc đế bột tan hoản toản. Tiếp tục pha
loãng bằng dung dịch natri clorid 9 mglml (0.9%) không chứa chẳt bảo quản. Dung dịch sau khi pha phải
trong, không mảu hoặc có mảu vảng nhạt.
3. Phải kiểm tra các chế phẫm tiêm truyền bằng mắt thường để phát hiện bắt kỳ tiểu phân nâo không tan
hoặc hiện tượng biến mảu trước khi sử dụng Nếu quan sảt thấy tiểu phân không tan thì không được sử
dụng.
Thuốc nảy chỉ dùng một lần sau khi pha chế.
Bất kỳ phần thuốc nảo không sử dụng cần phải loại bỏ theo đủng quy trình chuẩn tại cơ sở điều trị.
Bâo quãn:
Bảo quản dưới 30"C, ở nơi khô rảo vả thoảng mảt.
Đóng gói:
Hộp ] lọ.
Sân xuất tại Hà Lan bởi:
Pharmachemie B.V.
chnswcg 5, 2031 GA Haarlcm, The Netherlands (Hả Lan)
TUQ. cục T RUỞNG
P.TRUỞNG PHÒNG
Jiịauấễn Jẳty ấẩmy
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng