










ÁK/eg
' z…,mihma
BỘYTỂ *
cục QUẢN LÝ DƯỢC "
“ĐỂ RHÊ DUYỆT
…LanJaauẹ...ễẵiịẵẫlimẵ
ucnunuuo
ĐW 000l HOd
3NIHVLIOWES
Gemcitabine 1000 mg - Box
.
8013le 8% [ .' i
NdLO'OS um ìlẵũMDd 'MA \ í / |
| 4
1 VIAL POWDER FOũ SOLUYION 1 VW. POWER FOR SOLUĩION 1 VIAL POWDER FcR 90me 1 WL POWìER FOR SOLUTION
FOR INFUGION FOR IrFUSON FORINFUSIDN FOR INFUGIDN
GEMCITABINE
PCH 1000 MG
FOR SINOLE USE ONLY.
For lnưavenoun une
oIter recunutIthou.
READ THBPACKAGE
LEAPI.ET BEFORE USE
CYTOTOXIC
GEMCITABINE
'” @ PCH 1000 MG
NulhlỤhcnb
om»
m…humunm
…
… H
IIV'DImNJC @
III … I'ffl mm
1an
IEG.NO. VW \“NJM
CYTOTOXIC
IIIlI lĩĩl Ill' nllc IlDl
lơlll o
PHARMACHEMIE BV PHARMACHEMIE BV
BATCH No.: XXXXX
MFG. DATE: DDNWYYYY
EXP. DATE: DDiMWYWY
iWỷ
IJ—Thuh Mn lùn M
GEMCITABINE PCH 1 Hũh IIG
mu um Gợuinnlvnndunuu Gnu-
nwmu auỉrm nu uuumm mmmnyếuếd'
Ihlfẩl …
u,uo,brl ua um mư', mnnru -_uvmue
EF galii nmưc IImIcAMnVAI lan
ượllu.uumgu u.…mnun …
=lieuucx Aldnbui um…uomcudn
uu1uummnnulnmmnnq wmgnùuùngl
W OUT
AND IIOHT OYCIW
PHARMACHEMIE EV
93.
m: vn-xxxx—ư
mnhủduuwhmm
Wẩ aulununnm 1Mumouun
mun uchqn … …
EACH vua. com…s Fox SINGLE USE. ONLY. wowxm YIM.
uumnsamn unancmm nm mow wc
zquan to 1… uo ơmc'rM For mưnvenouc un
Arant uuansrrrưnoN uner ưcon ctitutiuu. u… mc LÉAFLÊI' Fon 1115
n uomằlglỉẹluaam AAẳENSI IENNSTITIHEỄFMM
… … …“Wiễif'ằả'aca’ảiiầ ………i…n…
mumnmn mm… nm.ưnm
\“UN'ƯSED PRDDUL'I OI WAẺT'E
' MATỦIAI SHI'J'UI-D BE D!sPDSÊIDF
IN ACCORDANCB WITH LOCAL
4,
DUYIIIIỈAÚI
100.572-13
130827
PCHSBS ,'
1 176/359 ,1
Nhãn phụ - Gemcitabine 1000 mg
Rx—Thuốc bán theo đơn SĐK: VN-XXXX-XX
GEMCITABINE PCH 1000 MG
Hoạt chất: Gemcitabin hydroclorỉde/tiẵẳg đương Gemcitabin
lg/lọ.
Quy cảch đóng gói: Hộp 1 lọ bột đông khô để pha tỉêm truyền.
Đường dùng: Tiếm truyền tĩnh mạch.
NSX, HD, Số lô SX xem “MFG. DATE”, “EXP. DATE” vả
“BATCH NO. ” trên bao bì.
Bảo quản dưới 300 C, ở nơi khô rảo vả thoảng mảt.
Chỉ định, chống chỉ định, cảoh dùng, lỉều dùng, tác dụng
không mong muốn và cảc dắu hỉệu cân lưu ý: xem trong tờ
hướng dẫn sử dụng. Cảc thông tỉl'i khảo đề nghị xem trong tờ
hướng dẫn sử dụng kèm theo.
Đế xa tầm tay trẻ em.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Sản xuất tại Hà Lan bởi:
Pharmachemie B. V.
Swensweg 5, 2031 GA Haarlcm, The Netherlan
,, Ổgoi BPaaói_
DNNK: XXXXX, địa chỉ: XXXXX
Gemcitabine 1000 mg - Vial
f go lllllllllll `
fỉ…ả GEMCITABINE PCH 1000 MG
ãẽỄ 1000 MG GEMCITABINEỀ ẳ
. Q 0
Ễ`ĨỄ Ế 1VIAL POWDER FOR ẫ Ễ`
gồ g SOLUTION FOR INFUSION ẾỄ ễ
mũ
Ễ›. Ế Ề ổ FOR INTRAVENOUS USE Ệ Ĩ,-
.ễ” ằo ả _ị ẵ AFTER RECONSTITUTION Ê Ế
ỂỄ Ế PHARMACHEMIE BV A 8 d.
. “3 n - : &“ u’ỉ
Đoc kỹ hướng dẫn sử dụng truớc khi dùng Nếu cẩn thêm !hông tín xin hỏi ý kiểu bác sỹ. Để thuốc
ngoảỉ tẩm tay tre em. T haoc nảy chỉ dùng theo đơn của bảc sỹ.
GEMCITABINE PCH 200 MG
GEMCITABÍNE PCH 1000 MG
GEMCITABINE PCH 2000 MG
Bột đông khô đểpha tiêm truyền
Thảnh phẫn:
Mỗi lọ có chứat
- Họat chẩt:
+ Gemcitabin 200 mg: Gemcitabin hydroclorid tương đương gemcitabỉn 200 mg.
+ Gemcitabin 1000 mg: Gemcitabin hydroclorỉd tương đương gemcitabỉn lg.
+ Gemcitabin 2000 mg: Gemcitabin hydroclorid tương đương gemcitabin 2g.
- Tá dược: Manitol, natri acetat trihydrat, natri hydroxid (IN), acid hydrocloric (IN).
Các đặc tính dược lực học:
Nhóm điểu trị: các dẫn chẩt của pyrimidin.
/
Mã ATC: LOIBCOS , Cỷ 2
Hoat tính gây đôc tế bảo trên cảc tê bâo nuôi cấv: Gemcỉta 11 có tảc dụng gây độc tế bảo mạnh trên
nhiều dòng tế bảo khối u người và chuột được nuôi cấy. Tảc dụng của gemcitabin đặc hiệu theo pha, vì
vậy, gemcitabin chủ yếu tiêu diệt cảc tế bảo đang trải qua giai đoạn tồng hợp ADN (pha S) vả trong một
số trường hợp, thuốc ức chế quá trình phảt triến của cảc tế bảo tại ranh giởi pha Gi/S. In vz'tro, tác dụng
gây độc tế bảo của gemcitabin phụ thuộc cả nồng độ và thời gian.
Hoat tính kháng khối 11 trên cảc mô hinh tiến lâm sảng: Trong các mô hình khối u trên động vật, hoạt tính
khảng khối u của gemcitabin phụ thuộc chế độ trị liệu. Khi sử dụng hảng ngảy, tỷ lệ tử vong ở động vật
cao, nhưng hoạt tính kháng khối 11 lại tối thiếu Tuy nhiên, nêu sử dụng gemcitabin sau môi 3 hoặc 4
ngảy, có thể sử dụng liều không gây tử vong cho động vật nhưng lại thu được hoạt tính kháng khối u rõ
rệt trên nhiếư dòng tế bảo khối u ở chuột.
Cơ chế tảc dung: Chuyến hỏa tế bảo và cơ chế tảo dụng: Gemcitabin (dFdC) lá thuốc khảng chuyến hóa
thuộc nhóm dẫn chất pyrimidin, đuợc chuyến hóa nội bảo bởi nucleosid kìnase thảnh đạng nucleosid
diphosphat (dFdCDP) vả triphosphat (dFdCTP) có hoạt tính. Tảo dụng gây độc tế bảo của gemcitabin là
do thuốc ức chế quá trình tống hợp ADN qua 2 cơ chế tác dụng của dFdCDP vả dFdCTP. Trước tiên,
dFdCDP ức chế ribonucleotiđ reductasc, lả cnzym duy nhất xúc tảc cho phản’ ưng tạo ra deoxynuclcosid
triphosphat (dCTP) cần cho quá trình tổng hợp ADN. Tác dụng' ưc chế enzym nảy của dFdCDP lảm giảm
nông độ đeoxynuclcosid và đặc bỉệt lả dCTP Sau đó, dFdCTP cạnh tranh vơi dCTP trong quả trinh kết
hợp với ADN.
Tương tự, một lượng nhỏ gemcitabin có thể kết hợp vởi ARN. Do đó, việc giảm nồng độ dCTP nội bảo
lảm tăng gắn kết của dFdCTP với ADN. ADN polymcrasc cpsilon không có khả năng loại bỏ gemcitabin
vả sừa chữa các chuỗi ADN đang hoản thiện Sau khi gemcitabin kết hợp vởỉ ADN, chi có một nucleotid
nữa được thêm vảo chuỗi ADN đang hoản thiện. Tiếp đó, quá trình tổng hợp ADN bị ức chế hoản toản
(che đầu tận cùng của chuỗi ADN). Sau khi gắn kết với ADN, gemcitabin gây chết tế bảo theo chương
trình
Dữ liêu lâm s_____anqz
Ung thư bâng guang Một nghiến cứu ngẫu nhiên pha III được tỉến hảnh trên 405 bệnh nhân mắc ung thư
tế bảo chuyển tiếp niêm mạc tìết niệu tiến triển hoặc di cản cho thấy không có sự khảc biệt gỉữa 2 nhóm
nghiên cứu iả nhỏm sử dụng gemcitabin/ cispiatin so vởi nhóm sử dụng mcthotrexat/ vinblastin/
adríamycinl cisplatin (MVAC) khi so sảnh tỷ lệ sông trung bình (1ần lượt lả 12,8 và 14,8 thảng, p =
0,547), thời gian tiển triến bệnh (lần lượt là 7, 4 và 7, 6 thảng, p= 0,842) và tỷ lệ đảp ứng đỉều trị (tương
ứng là 49,4% và 45,7%, p= 0 ,.512) Tuy nhiến, nhóm sử dụng phối hợp gemcitabin vả cisplatin ít độc
tinh hơn so với nhóm MVAC
Um,7 thư tuy. Trong một nghiên cứu ngẫu nhiên pha III đuợc tiến hảnh trên 126 bệnh nhân mắc ung thư
tụy tiến tríến hoặc di cãn, gemcitabin cho thắy tỷ lệ đáp ửng lâm sảng cao hơn đảng kế (có ý n - ..... =. ,_
kê) so vởỉ 5— fluorouracil (lần lượt là 23, 8% vả 4,8%, p= 0 ,0022) Ngoài ra, bệnh nhân đư./ỳ " `
gemcitabin cũng có thòi gian tiến tríền bệnh kéo dăi hơn đảng kể, từ 0,9 đến 2, 3 thảng/ _
thời gian sống trung bình dải hơn, từ 4,4 đến 5,7 tháng (p < 0,0024) so vởi nhóm .
fiuorouracil. [
Uma thư ohổi khõng Qhải tế băo nhỏ: Trong một nghiên cửu ngẫu nhiên pha 111 trên 5 `1’ _
thư phổi không phải tế bảo nhỏ tiến triến tại chỗ hoặc đi cản không thế phẫu thuật, sử \ …
gemcitabin cùng với cisplatin cho tỷ lệ đảng ửng cao hơn rõ rệt so với điều trị bằng cỉspiatin đơn độc (lần
luọt lả 31,0% và 12,0%, p < 0,0001). Thời gian tiến triến kéo dải hơn đáng kể, từ 3,7 đến 5,6 thảng (p <
0,0012) và thời gian sống trung bình cũng dăi hơn, từ 7,6 thảng đến 9,1 tháng (p < 0,004) đã được ghi
nhận ở những bệnh nhân điều trị bắng gemcitabinlcisplatỉn so với nhóm bệnh nhân điếu trị bằng
cisplatin.Trong một thử nghiệm lâm sảng ngẫu nhiên pha III khác được tiến hảnh trên 135 bệnh nhân
mắc ung thư phổi không phải tế bảo nhỏ gỉai đoạn IIIB hoặc IV, phối hợp gemcitabin vả cisplatin cho tỷ
lệ đảp ứng cao hơn rõ rệt so với sử dụng phối hợp cisplatin vả etoposid (lần lượt là 40,6% và 21,2%, p =
0,025). Thời gian tiến tríển ở nhóm bệnh nhân điều trị bầng gemcitabin/cisplatin cũng kéo dải hơn đảng
kể so với nhóm hệnh nhân sử dụng etoposid/cisplatin, từ 4,3 đển 6,9 thảng (p = 0,014). Trong cả hai
nghiên cứu, mức độ dung nạp thuốc là tương tự nhau giữa 2 nhóm điều trị.
Ung thư buồng trứng: Trong một nghiên cứu ngẫu nhiên pha III, 356 bệnh nhân ung thư biểu mô buồng
trứng tỉến triển có tải phảt ít nhẩt 6 thảng sau khi hoản tất hóa trị vởi dẫn chất của platin được cho dùng
ngâu nhiên cả gemcitabín vả carboplatin hoặc chỉ dùng carboplatỉn Thời gian tiển triển bệnh kéo dải rõ
rệt, từ 5 ,8 đến 8, 6 thảng (p= 0 ,0038) được ghi nhận ở nhóm bệnh nhãn được điếu trị bằng gemcitabin vả
carboplatin so với nhóm bệnh nhân chi dược sử dụng carboplatin. Sự khác biệt về tỷ lệ đáp ứng là 47,2%
ở nhóm dùng gemcitabin vả carboplatin so với 30,9% ở nhóm điếu trị bằng carbopiatin (p= 0 ,0016) vả
thơi gian sống trung binh là 18 thảng (gemcitabin vả carboplatin) so vởi 17,3 tháng (carboplatin) (p— =
0,73) cho thẳy hiệu quả tốt hơn được ghi nhận ở nhỏm sử dụng gemcitabin vả carboplatin.
Ung thưvú. Trong một nghiên cứu ngân nhiên pha 111 trên 529 bệnh nhân mắc ung thư vú tải phảt tại chỗ
hoặc di căn không thế phẫu thuật có tái phảt sau khi được điều trị bằng hóa trị liệu, gemcitabin phối hợp
với paclítaxel giúp kéo dải đáng kể thơi gian tiến triền bệnh từ 3, 98 thảng đến 6,14 tháng (p= 0 ,0002) so
với khi sử dụng paclitaxei Sau khi 377 bệnh nhân tử vong, thời gian sống tồng cộng ở nhóm điều trị
bằng gemcitabin/paclitaxcl là 18,6 thảng so vởi 15, 8 thảng ở nhóm sử dụng paclitaxel (p= 0, 0489, HR
0,82) và tỷ lệ đảp ứng toản bộ lần lượt là 41,4% và 26,2% (p = 0,0002).
Cảc đặc tính được động học:
Dược động học của gemcitabin đã được nghiên cứu trên 353 bệnh nhân trong 7 nghiên cứu khảo nhau,
bao gồm 121 nữ và 232 nam tuổi từ 29 đến 79. Trong số bệnh nhân nảy, khoảng 45% bệnh nhân mắc ung
thư phổi không phải tế bâo nhỏ và 35% được chẩn đoản uzng thư tụy. Cảc thông số dược động học sau
đây được ghi nhặn khi sử dụng liền từ 500 đến 2.592 mg/m2 theo đường truyền tĩnh mạch trong thời gian
tử0,4đến 1,2 giờ.
Hấp thu: Nồng độ đinh của thuốc trong` huyết tương (đạt được trong vòng 5 phút sau khi ngừng truyền) là
từ 3, 2 đến 45,5 ụg/rnl. Khi sử dụng liều gemcitabin 1.000 mg/m2 truyền tĩnh mạch trong 30 phút, nồng
độ thuốc cao hơn 5 ụg/ml trong khoảng 30 phút sau khi kết thủc trưyến tĩnh mạch và cao hơn 0, 4 ug/ml
trong thêm một giờ.
Phân bố: Thể tich phân bố“ 0 ngãn trung tâm lả 12,4 le2 đối với nữ và 17, 5 Lỉm2 đối với nam (biến thiên
giữa các cá thế là 91 ,.9%) Thế tỉch phân bố ơ ngăn ngoại vi là 47, 4 le². Thể tích ngăn ngoại vi không
biến thíên theo giời tính. Tỷ lệ thuốc gắn protein huyết tương không đáng kế. Thời gian bản thải nảm
trong khoảng từ 42 đến 94 phút tùy thuộc tuối và giới tính. Khi sử dụng liều đề nghị, gemcitabin được
đảo thải gần như hoản toản trong khoảng thời gian từ 5 đến 11 giờ tỉnh từ lúc bắt đằu truyền tĩnh mạch.
Gemcitabin không bị tích lũy khi sử dụng chế độ liều một lằn mỗi tuần.
Chuyển hóa sinh hoc: Gemcitabin được chuyến hóa nhanh bới cytìdin deaminase ở gan, thận, máu và cảc
mô khảo. Quá trình chuyến hóa nội bảo cùa gemcitabỉn tạo ra gemcitabin mono, di vả triphosphat
(dFdCMP, dFdCDP vả dFdCTP), trong đó dFdCDP vả dFdCT P là cảc chất có hoạt tính. Các chất chưyến
hóa nội bảo nảy không được tìm thấy trong huyết tương hoặc nước tiếu. Dạng chuyền hóa chính là 2’-
đcoxy—Z’, 2’-difiuorouridỉn (dFdU) không có hoạt tính và được tim thấy cả trong huyết tương và nước
tỉêu.
Thải trừ: Tốc độ thanh thải toản thân của thuốc lá từ 29,2 ngiờlm² đến 92,2 Lfgiờ/m² tùy thuộc giới tỉnh
và tuốỉ (bìển thiến giữa các cá thể là 52,2%). Độ thanh thải ở nữ gíới thẳp hơn— khoảng 25% so với ở
nam giỏi Mặc dù thuốc được đảo thải nhanh nhưng tốc độ thanh thải ơ cả nam và nữ giảm theo tuổi. Khi
sử dụng liều gemcitabin đề nghị là 1000 mg/m2 truyền tĩnh mạch trong 30 phút, không cần giảm liều
gemcitabin nên độ thanh thải ơ nam giới hoặc nữ giới giảm. Dưới 10% thuốc được đảo thải qua nước tiểu
ở dạng không chuyến hóa. Tốc độ thanh thải qua thận là 2 đến 7 ngiờlm². _ f\_ -
Trong tuần sử dụng thuốc, 92 đến 98% liếu gemcitabin được đảo thải, 99% qua nước ' ~
dạng dFdU và 1% được thải trừ qua phân. .
Dươc đông hoc của dFdCTP: Chất chuyến hóa nảy có thể tìm thẳy ở cảc tế bảo đo «, âan
ngoại vi và cảc yếu 16 liên quan tế bảo năy. Với liều gemcitabine từ 35 - 350 mg/m² . n, hutịcifỏhầẵiờ
dFdCTP nội bảo tăng tỷ lệ tương ứng và đạt nồng độ ồn dinh là 0,4 — 5 ụg/ml. Khi nô \
cao hon 5 ụg/ml, nồng độ dFdCTP không tăng do cảc tế bảo đã bão hòa. Thời gian bản thải của dFdCTP
lảtừO,7—l2 giờ.
Dươc đông hoc của dFdU: 2Nồng độ đinh cùa dFdU trong huyết tương (3 15 phút sau khi kết thúc truyền
tĩnh mạch liều 1000 mg/m2 trong 30 phủt) là 2852 ụg/ml. Nồng độ đảy sau khi sử dụng thuốc một lần
mỗi tuần là 0,07 — 1,12 ụglml và thuốc không bị tĩch lũy. Đường cong nông độ dFdU theo thời gian chia
lảm 3 pha, thòi gian bản thải trung bình ơ pha cuối là 65 giờ (trong khoảng 33— 84 giờ) Tỷ lệ dFdU hinh
thảnh từ gemcitabin là 91 — 98%. Thể tích phân bố trung bình 0 ngăn trung tâm là 18 L/m2 (trong khoảng
11 - 22 L/m2 )
Thể tích phân bố trung bình cùa dFdU ở trạng thái ổn định là 150 le² (trong khoảng 96-228 er²).
Loại mô phân bố: rộng rãi
Tốc độ thanh thải biến kiến trung binh: 2, S ngiờ/m2 (trong khoảng 1 — 4 L/gỉờ/m2)
Đảo thải qua nước tiều: 100%.
Phối hơn gemcitabin vả naclitaxel: Sử đụng phối hợp gemcitabin vả paclitaxel không ảnh hưởng đến
dược động học của mỗi thuốc
Phối hợp gemcitabin vả carbonlatin: Khi sử dụng phối hợp vởi carboplatin, dược động học của
gemcitabỉn không thay đối
Suy thân: Suy thận nhẹ đến vừa (độ lọc cầu thận từ 30 ml/phủt đến 80 ml/phút) không ảnh hưởng đảng
kế đến dược dộng học cũa gemcitabỉn.
Chỉ định:
Gemcitabin được chỉ định phối hợp với cispiatin trong điểu trị ung thư bản tiến triến tại chỗ hoặc
di căn. Gemcitabin được chỉ định điều trị cho nhũng bệnh nhân ung thư biếu mô tuyến tụy tíến triến tại
chỗ hoặc di căn. Gemcitabin được chỉ định phối hợp với cisplatin như liệu pháp điều trị ban đầu cho
những bệnh nhân ung thư phổi không phải tế bảo nhỏ tiểu triến tại chỗ hoặc di căn. Có thể cân nhắc sử
dụng gemcitabin đơn trị liệu cho bệnh nhân cao tuổi hoặc bệnh nhân ung thư phồi không phâi tế bảo nhỏ
giai đoạn 2. Gemcitabin được chỉ định phối hợp vói carboplatin đế điểu trị cho những bệnh nhân ung thư
biểu mô buồng trứng tiến triến tại chỗ hoặc di căn, bệnh nhân ung thư tải phảt sau khoảng thời gian tối
thiểu 6 tháng sau hóa trị ban đầu với dẫn chất của platin.
Gemcitabin được chỉ định phối hợp vởi paclitaxei để điều trị cho những bệnh nhân mắc ung thư vú tái
phảt tại chỗ hoặc di căn không thế phẫu thuật sau khi được điếu trị bằng một thuốc chống ung thư thuộc
nhóm dẫn chẳt anthracyclin.
Liều lượng và cách dùng.
Chỉ những bác s1 đã có kinh nghiệm dùng thuốc chống ung thư mởi được phép sử dụng gemcitabin
Liều đề nghi:
…
- Phối họp thuốc. Liều gemcitabin đề nghị là 1000 mg/m2 bề mặt cơ thế, truyền tĩnh mạch trong 30 phút
Nên sử dụng thuốc vảo ngăy thứ 1, 8 và 15 của đợt đíếu trị 28 ngảy, phối hợp với cisplatin. Liều cisplatin
đề nghị là 70 mg/m2 vảo ngảy thứ 1 sau khi sử dụng gemcitabin hoặc vảo ngảy thứ 2 cùa đợt điếu trị 28
ngảy. Sau đó lặp lại chu kì điếu trị 4 tuần như trên. Có thể giảm liếu sau môi đợt điều trị hoặc trong một
đợt điếu trị tùy theo mửc độ độc tính của thuốc đối với bệnh nhân.
Ung thưtuv:
Liều gemcitabin đề nghị là 1000 mg/mz, truyền tĩnh mạch trong 30 phút. Sử dụng lặp lại một lần mỗi
tuần trong thời gian tới 7 tuần, sau đó nghỉ 1 tuần. Trong các đợt điếu trị tíếp theo, sử dụng thuốc một lần
mỗi tuần trong 3 tuần liên tiếp của đợt đíều trị 4 tuần Có thế giảm iiểu sau mỗi đợt điều trị hoặc trong
một đợt điếu trị tùy theo mức độ độc tính cùa thuốc đối với bệnh nhân.
Ung thư nhồi không nhảz' tế bảo nhó.
— Đơn trị liệu: Líếu gemcitabín đề nghị là 1000 mglm2, truyền tĩnh mạch trong 30 phút. Sử dụng lặp lại
một lần mỗi tưần trong thời gian 3 tuần, sau đó nghỉ 1 tuần. Sau đó lặp lại chu kì điều trị 4 tuần Có thể
gỉảm liếu sau mỗi đợt điều trị hoặc trong một đợt đỉếu trị tùy theo mửc độ độc tinh của thuốc đối với
bệnh nhân.
- Phối hợp thuốc: Liều gemcitabín đề nghị là 1250 mg/m2 bề mặt cơ thể, truyền tĩnh mạch hút
vảo ngảy thứ ] và 8 của đợt điếu trị 21 ngảy. Có thế giảm liếu sau mỗi đọt điều trị h_ ẩềầể ậf
điếu trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân. Sử dụng cisplatin li^
một lần sau mỗi 3 tuần.
Ung thư vú.
- Phối họp thuốc: Gemcitabin được khuyến cảo sử dụng phối hợp với paclitaxel 1ièủ
tĩnh mạch trong 3 giờ v`ao ngảy thứ 1 của đợt điều trị, sau đó sử dụng gemcitabin liều
tĩnh mạch trong 30 phủt vảo ngảy thử 1 và 8 cùa đợt đìếu trị 21 ngảy. Có thế gìãm liều s`
trị hoặc trong một đợt điều trị tùy theo mức độ6 độc tính cùa thuốc đối với bệnh nhân Số lượng bạch cầu
hạt của bệnh nhân tối thiếu phải là 1500 x 106 tế bảo/L trước khi bắt đầu điểu trị bằng gemcitabín phối
họp với paclitaxel.
Umz thư buồng trúng:
- Phối hợp thuốc: Gemcitabin được khuyến2 cảo sử dụng phổi họp với carboplatin trong đỉều trị ung thư
buồng trứng.A Liễu gemcitabin là 1000 mg/mz, truyền tĩnh mạch trong 30 phút, sử dụng vảo ngảy thứ 1 và
8 của đợt đỉều trị 21 ngảy Sau khi sử dụng gemcitabin, tiếp tục dùng carboplatỉn vảo ngảy thứ ] để đạt
trị số diện tích dưới đường cong (AUC) mục tiêu cùa carboplatin là 4 ,0 mglmlophút. Có thể giảm liều sau
mỗi đợt diễu trị hoặc trong một đợt điều trị tùy theo mức độ độc tính của thuốc đối với bệnh nhân
Theo dõi đôc tính của thuốc và hiệu chỉnh liếu:
Hiẻu chinh liều do đóc tính ngoảí hé tao máu.
Cần kiếm tra sức khỏe định kì vả đảnh giá chửc năng thận và gan để phát hỉện độc tính của thuốc ngoải
hệ tạo máu Có thể giảm liều sau mỗi đợt điều trị hoặc trong một đợt điều trị tùy theo mức độ độc tính
của thuốc đối với bệnh nhân. Thông thường, đối với trường hợp độc đính ngoải hệ tạo máu nặng (độ 3
hoặc 4), trừ huồn nôn/nôn, nên ngùng sử dụng gemcitabin hoặc giảm liều tùy theo chỉ định cùa bác sĩ.
Nện ngừng dùng thuốc cho đến khi độc tính của thuốc đã được khắc phục.
Đế hiệu ohinh líều cisplatin, carboplatin vả paclitaxel khi sử dụng phối hợp với gẹmcitabỉn, cần tham
khảo tóm tắt đặc tinh sản phẩm cùa mỗi thuốc /"
Hỉêu chình liều do đôc tính trên hê tao mâu. ẫIV
Bắt đẳu đọt điều trị: Với tắt cả cảc chỉ định, cằn kiếm tra số lượng tiểu cầu” bạch cầu hạt của bệnh
nhân trước mỗi lần sử dụng thuốc. Bệnh nhân phâi có số lượng bạch cẩu hạt tối thiểu là 1.500 x 106 tế
bảolL và ít nhất 100.000 x 106 tíếu cầulL trưởo môi đợt đíểu trị
T rong đợt điều zrị. Nên hiệu chinh liều gemcitabin trong một đợt điều trị theo bâng dưới đây:
Hỉệu chỉnh lỉều gemcitabỉn trong một đợt điều trị ung thư bâng quang, ung thư phổi không phải
tế hâo nhỏ và ung thư tụy, sử dung đơn độc hoặc phổi hợp với cisplatầm A
Số lư bạch cầu hạt 6 Ph n trăm so vói lieu
(x lOếIẾỂ Số lượng tỉếu cầu (x 10 ÍL) gemcitabín chuẩn (%)
> 1.000 và > 100.000 100
500 - 1000 hoặc 50.000 — 100.000 75
< 500 hoặc < 50.000 Ngừng sử dụng*
* Không nên sử dụng thuốc trở lại trong cùng một dợt điểu trị cho đểu khi số lượng bạch cẳu hạt đạt tối
thỉếu 500 x 10 lL và số lượng tiễu cầu ít nhắt là 50.000 x 106/L.
* Không nên sử dụng thuốc trở lại trong cùng một đợt điều trị. Bắt đầu dùng thuốc vảo ngảy thứ 1 của
đợt điều trị tiếp theo nếu số lượng bạch câu hạt đạt 1 5.00 x 106 tế bâo/L và số lượng tiểu câu là 100.00 x
10 6/L.
Hỉệu chỉnh liều gemcitabỉn trong một đợt điều trị ung thư vú, phôi hợp với paclítaxel
Số lượng hạch cầu hạt
Số lượng tìễu cầu (x IOGIL)
Phần trăm so với liều
(x lOỔIL) gemcitabỉn chuẩn (%)
> 1.200 và > 75.000 100
1.000 - < 1.200 hoặc 50.000 — 75.000 75
700 - < 1.000 và 2 50.000 50
< 700 hoặc < 50.000 Ngừng sử dụng*
Hiệu chỉnh liều gemcitabin trong một đợt đỉều trị ung thư buồn
trứng, phổi hợp với carboplatín
Số lượng bạch cầu hạt
Số lư g tỉễu cẫu
ằỀ
Phần trăm so với Iỉều
(x IOGIL) (x 10 ) gemcitabỉn chuẩn ("/o)
> 1.500 vả › 100 000 100
1.000 — 1.500 hoặc 75.000 — 100.000 50
< 1.000 hoặc < 75.000 Ngừng sử dụng*
Hiệu chính líẽĨ gemcitabin do độc tính trên huyết học Irong các đợt điếu tri Iiềp theo cho tầt cả các chi
đinh.
Nên gíảm liều gemcitabin xuống còn 75% so vởỉ líều khời đẳu trong cảc trường hợp nhiễ gfaz=…
học sau:
0 Số lượng bạch cầu hạt < 500 x IOỐIL kéo dải quả 5 ngảy
0 Số lượng bạch cầu hạt < 100 x 106lL kẻo dải quả 3 ngảy
O Gíảm bạch cầu trung tính có sốt.
0 Số lượng tiểu cầu < 25 000 x 106/L.
O Trì hoãn đợt điều trị trênl tuần do độc tính.
/g'50 ' ’
Cảch dùng: Gemcitabin được dung nạp tốt khi truyền tĩnh mạch và có thế sử dụng tron khi di chuyến.
Nếu xảy ra tình trạng thoảt mạch, cân ngimg truyền ngay iập tức vả chuyển sang truyen vảo một tĩnh
mạch khảo. Cần theo dõi chặt chẽ tình trạng bệnh nhân sau khi truyền.
Về hướng dẫn cảoh pha chế, xem mục Những lưu ý đặc biệt về việc pha ohế vả xử lý loại bỏ.
Cảo nhóm bênh nhân đăc biêt:
Bênh nhân suv thân hoãc suv 2an: Cần thận trọng khi sử dụng gemcitabin cho bệnh nhân suy thận hoặc
suy gan do chưa có đủ thông tin từ các nghiên cứu lâm sảng cho phép đưa ra khuyến cáo liều chính xảo
cho những bệnh nhân nây (xem mục Những cảnh bảo đặc biệt vả thận trọng khi sử dụng và Các đặc tính
dược động học).
Bênh nhân cao tuốt“ (> 65 luốz'). Gemcitabin được dung nạp tốt ở nhĩmg bệnh nhân trên 65 tuối. Chưa có
bằng chứng thấy cẩn phải hiệu chỉnh iiều khi sử dụng cho bệnh nhãn cao tuổi (xem mục Cảo đặc tính
dược động học).
Trẻ em f<18 tuồi): Gemcitabin không được khuyến cáo dùng cho trẻ dưới 18 tuổi do không đủ đữ liệu về
an toản và hiệu quả.
Chống_clni định: ' ` ,
Quá mân với gemcitabin hoặc bât kì thảnh phân nảo của thuôo.
Phụ nữ cho con bú (xem mục Sử dụng cho phụ nữ có thai và cho con bú).
Những cânh báo đặc biệt và thận trọng khi sử dụng.
Sử dụng thuốc theo đường truyền tĩnh mạch trong thơi gian dải và tăng số líều dùng có thề lảm tãng độc
tính
Đôc tính trên hè tao máu: Gemcitabin có thế ức chế chức năng của tùy xương, biền hiện bằng giảm bạch
cầu, giảm tiếu cầu và thiếu mảu. Bệnh nhân được điều trị bằng gemcitabin cần được kiếm tra số lượng
tiểu cầu, bạch cầu và bạch cẩu hạt trước mỗi liếu sử dụng Nên cân nhắc ngừng thuốc hoặc hiệu chinh
lìều khi phảt hiện tình trạng ức chế tùy xương do thuốc (xem mục Liều lượng vả cảoh dùng). Tuy nhiên,
tình trạng ức chế tủy xương chỉ kéo dải trong thời gỉan ngăn và thường không cần phải giảm iiều và hiếm
khi phải ngừng thuốc. Số lượng tế bảo máu ngoại vi có thể tiếp tục giảm sau khi đã ngừng sử dụng
gemcitabin. Ở Ibệnh nhân bị giảm chức năng tùy xương, cân thận trọng khi bắt đẳu điều trị bằng
gemcitabỉn. Giống như các thuốc gây độc tế bảo khác, cần lưu ý nguy cơ ức chế tủy xương tích lũy khi
Gemcitabin được sử dụng cùng với cảc thuốc hóa trị lỉệu khảo.
Suv gan và suv thân: Cẩn thận trọng khi sử dụng gemcitabin cho bệnh nhân suy thận hoặc Suy gan do
chưa có đủ thông tin từ cảc nghiên cứu lâm sảng cho phép đua ra khuyến cảo líểu chính xảo cho những
bệnh nhân nảy (xem mục Liều lượng và cách dùng).
Sử dụng gemcitabin cho bệnh nhân mang khối u gan dí căn hoặc có tiến sứ viêm gan, nghiện rượu hoặc
xơ gan có thế lảm nặng thêm tình trạng suy giảm chức năng gan sẵn có.
Cần định kỳ kìềm tra chức nảng gan và thận (bao gồm cả các xét nghiệm vi sinh vật)
Xa tri đổmz thời: Xạ trị (sử dụng đồng thời hoặc cảch xa < 7 ngảy): Độc tính đã được ghi nhận (xem mục
Tương tảo với cảc thuốc khác vả cảc dạng tương tảo khác đê biết thông tin chi tiết và khuyến cảo sử
dung)-
Cảc vacin chửa vi sinh vât sống: Không khuyến cáo sử dụng vacin sốt vảng hoặc cảc chế phẳm vacin có
chứa vi sinh vật sống đã được lảm yếu cho bệnh nhân đang điều trị bằng gemcitabỉn (xem mục Tưong tảo
vởi các thuốc khác và cảc dạng tương tảc khảo).
Tim mach: Do nguy cơ rối loạn tim vả/hoặc mạch mảu khi sử dụng gemcitabìn, phải đặc biệt thận trọng
khi sử dụng thuốc cho bệnh nhãn có tiền sử gặp cảc biến cố tim mạch
Hôi chưng rò rỉ mao mach: Hội chứng rò rỉ mao mạch đã được ghi nhận ở bệnh nhân sử dụng
gemcitabine đơn độc hoặc phối hợp vởi cảc thuốc hóa trị liệu khảo. Tình trạng nảy thường có thế dìều trị
được nêu phảt hiện sớm và xử lý thich hợp, tuy nhiên, đã ghi nhận những ca tử vong Tình trạng rò rỉ
mao mạch có liên quan đến hiện tượng tăng tính thắm mao mạch toản thân khi dịch và cảc protein từ
khoảng nội mạch rò rỉ ra mô kẽ. Cảo biểu hiện lâm sảng của rò rỉ mao mạch bao gồm phù toản thân, tăng
cân, gíảm albumin mảu, hạ huyết ảp nặng, suy thận câp vả phù phối. Cần ngừng sử dụng gemcitabin và
tiến hảnh cảc biện phảp đíều trị hỗ trợ nêu hội chứng rò rỉ mao mạch tỉến triền trong quá trình điểu trị
Hội chứng rò rỉ mao mạch có thể xuất hiện trong những chu kì điểu trị sau và đã được , —' .
văn là có lỉên quan đến hội chứng nguy kịch hô hẫp cấp '
P_hồiz Tảo dụng bất lợi của thuốc trên phối, đôi khi ở mức độ nghiêm trọng (như phù Í…
kẽ hoặc hội chứng suy hô hấp cấp) đã được ghi nhận khi sử dụng gemcitabin. Chưa rõn .
xác của các tình trạng nảy Nếu phảt hiện cảc tỉnh trạng như vậy, cần cân
gemcitabin. Áp dụng cảc bỉện phảp điều trị hỗ trợ sởm có thể giúp cải thiện các tình tr; ,“- _`
Thân:
Hôi chứng tản huyết urê huvểt cao:
Những biến hỉện lâm sảng của hội chứng tản huyết urê huyết cao (HUS) đã được ghi nhận với tẩn suất
hiếm gặp ở bệnh nhân sử dụng gemcitabin (xem mục Tảo dụng không mong muốn) HUS là tình trạng
rối loạn có khả năng đe dọa tinh mạng. Cần ngùng sử dụng gemcitabin khi có những dấu hiệu đầu tiên
của thiếu mảu tán huyết vi mạch như giảm nhanh hcmoglobin cùng với giảm tiếu cầu, tãng bỉlirubin
huyết thanh, creatinỉn huyết thanh, nitơ urê máu hoặc LDH. Tình trạng suy thận có thể không hồi phục
dù ngừng điều trị và bệnh nhân có thế cần phải thấm phân máu.
Chức năng sinh sản: Trong cảc nghỉên cứu về sinh sản, gemcitabin gây giảm sinh tinh ở chuột đực. Vì
vậy, nam giới đang được điều trị bằng gemcitabin không nên có con trong khi dùng thuốc và tới 6 tháng
sau khi ngừng điếu trị và nên bảo quản lạnh tinh trùng trước khi điếu trị bẳng gemcitabin do nguy cơ vô
sinh sau khi dùng thuốc (xem mục Sử dụng cho phụ nữ có thai vả cho con bú).
N_atriz Gemcitabin 200 mg có chứa 3,5 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu’ y khi sử dụng cho bệnh
nhân đang áp dụng chế độ an giảm natri.
Gemcitabin 1000 mg có chứa 17,5 mg (< 1 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho bệnh
nhân đang áp dụng chế độ ăn giâm natri.
Gemcitabin 2000 mg có chứa 35 mg (1,5 mmol) natri trong mỗi lọ. Cần lưu ý khi sử dụng cho bệnh nhân
đang ảp dụng chế độ ãn gỉảm natri.
Tương tác với các thuốc khác vã các dạng tương tâc khác:
Chưa tiến hảnh nghiên cửu đặc hiệu nảo về tương tảo thuốc (xem mục Các đặc tínhldược động học).
Xa trí: Sử dụng đổng thơi (sử dụng cùng lủc hoặc cách xa S 7 ngảy): Độc tính đã được ghi nhận khi sử
dụng phổi hợp hóa trị và xạ trị phụ thuộc vâo nhiều yếu tố khảo nhau bao gồm lìều gemcitabỉn, tần suất
sử dụng, liều xạ trị, kỹ thuật xạ trị, mô đĩch và thể tích xạ trị. Cảo thử nghiệm tiến lâm sảng và lâm sảng
cho thây gemcitabin có hoạt tính nhạy cảm xạ trị. Trong một thử nghiệm lâm sảng, khi sử dụng
gemcitabin liều 1.000 mg/m2 trong 6 tuần lỉên tiếp cùng với xạ trị vùng ngực cho bệnh nhân mắc ung thư
phổi không phải tế bèo nhò, tình trạng độc tính ở mức độ nghiếm trọng và viêm niêm mạc có thể đe dọa
tính mạng, đặc biệt là viêm thực quản và viêm phổi đã được ghi nhận, nhất 1ả ở bệnh nhân sử dụng thế
tich xạ trị lớn [thể tích xạ trị trung bình là 4.795 cm ] Các nghiên cứu tiếp sau cho thấy có thế sử dụng
gemcitabin liều thấp hơn cùng với xạ trị do có thể kiểm soát được độc tính, chằng hạn như trong một
nghìẽn cứu pha 11 trên bệnh nhân ung thư phổi không phải tế bảo nhỏ sử dụng liều xạ trị là 66 Gy cùng
vởi gemcitabin (600 mglm², 4 lần) và cisplatin (80 ngm², 2 lần) trong 6 tuần. Chế độ trị líệu tối ưu an
toản khi sử dụng gemcitabin cùng với xạ trị chưa được xảo định trong điều trị tất cả cảc loại khối u.
Không sử dụng đồng thời (cảoh > 7 ngảy): Phân tich dữ iiệu nghiên cứu không phảt hỉện thấy bất kỳ
nguy cơ tãng độc tính nảo khi sử dụng gemcitabin tại thòi điểm cách hơn 7 ngảy trước hoặc sau xạ trị so
với khi tiến hảnh xạ trị nhắc iại. Dữ liệu nghiến cứu cho thẳy có thể bắt đầu sử dụng gemcitabin sau khi
cảc tảo dụng bất lợi cấp tính của xạ trị đã được khẳc phục hoặc ít nhất 1 tuần sau xạ trị.
Tổn thương do xạ trị đã được ghi nhận tại cảc mô đích (như viêm thực quản, viêm kết trảng vả viêm
phối) cả khi sử dụng đồng thời và không sử dụng đồng thời cùng vởi gemcitabin.
Các chế Dhẩm khảo: Không khuyến cáo sử dụng vacin sổt vảng da cũng như cảc chế phẳm vacin có chứa
vi sinh vật sống giảm độc lực do nguy cơ gây ra tác dụng bắt lợi toản thân, thậm chí [ả cảc tinh trạng hết
sức nghiêm trọng có thể dẫn dến tử vong, đặc biệt là ở bệnh nhân bị ức chế mỉễn dịch.
Sinh sản, có thai và cho con hủ:
Phu nữ có thai: Chưa có đủ dữ liệu về việc sử dụng gemcitabỉn cho phụ nữ có thai. Các nghiên cứu trên
động vật cho thấy độc tính của gemcitabin đối vởí sinh sản. Dựa trên kết quả từ cảc nghiến cửu trên động
vật và cơ chế tác dụng cùa gemcitabỉn, không nên sử dụng gemcitabin trong thai ki trừ khi thực sự cần
thiết. Phụ nữ không nên có thai trong khi đang điếu trị bằng gemcitabìn và phải thông báo ngay cho bảo
sĩ nếu có thai trong quá trình dùng thuốc. _
Phụ nữ cho con bú: Chưa rõ gemcitabin có được tiết vảo sữa mẹ hay không và không thế loại trừ tảc
dụng bất lợi của thuốc trên trẻ bú mẹ Người mẹ phải ngừng cho con bú trong khi đang dùng thuốc
Ành hưởng đển sinh sản: Trong các nghiên cứu về sinh sản, gemcitabin gây giảm sinh tinh ở chuột đực.
Vì vậy, nam giới đang được đỉều trị bằng gemcitabin không nên có con trong khi dùng thuốc và tới 6
cơ vô sinh sau khi dùng thuốc.
Ẩnh hưởng đến khả năng lái xe và vận hânh máy móc:
Chưa tiến hảnh cảc nghiên cứu về ảnh hưởng cùa thuốc đến khả năng lải xe và vận h` …
nhiên, đã ghi nhận gemcitabin có thể gây buồn ngủ mức độ nhẹ đển vừa, đặc biệt là khi ~
rượu. Bệnh nhân cần thận trọng không nên lái xe và vận hảnh máy móc cho đến khi chắc chắn không còn
bị buồn ngù.
Tác dụng không mong muốn:
Các tác dụng bẫt lợi hay gặp nhẩt khi sử dụng gemcitabin bao gồm: buồn nôn có hoặc không kèm theo
nôn, tăng transaminase gan (ASTJALT) vả phosphatase kiếm đã được ghi nhận ở khoảng 60% bệnh
nhân; protein niệu và tiến mảu được ghi nhận ở gần 50% bệnh nhãn; khó thờ ở 10- 40% bệnh nhân (tỷ lệ
cao nhẩt ở bệnh nhân ung thư phổi); phảt ban kìếu dị úng ở 25% bệnh nhân và ngứa ở 10% hệnh
nhân. Tần suất và mức độ nghiêm trọng của cảc phản ứng bẩt lợi tùy thuộc vảo 1íếu dùng, tốc độ truyền
tĩnh mạch vả khoảng cảoh giữa các liếu (xem mục Những cảnh bảo đặc biệt và thận trọng khi sử dụng).
Cảo tảc dụng bất lợi do liếu là giảm số lượng tiến câu, bạch cầu và bạch cầu hạt (xem mục Liều lượng vả
cách dùng)
Dữ liêu từ các thứ nghiêm lâm săng: Tần suất phân ứng bắt lợi được quy ước như sau: Rất hay gặ (z
1/10), Hay gặp (2 l/100 đến < 1/10), Ỉt gặp (2 1l1.000 đễn < 11100), Hiếm gặp (2 1/10 000 đ n <
111000), Rẳt hiểm gặp (< 1/10.000)
Bảng dưới đây liệt kê cảc tác dụng bất lợi và tận suất xuất hiện dựa trên cảc thử nghiệm lâm sảng. Trong
mỗi nhóm tần suất, các tác dụng bất lợi được sắp xếp theo thứ tự độ Ầnặng_giảm dần. /,
Hệ cơ quan Căc nhóm tần suat ,,W
Rối loạn hệ tạo mã… và hệ bạch huyết Rất hay gặp: /
. Giảm bạch cầu (Gíảm bạch cầu trung tỉnh
Độ 3: 19,3%; Độ 4: 6%) Tinh trạng ức
chế tủy xương thường ở mức độ nhẹ đến
trung bình và ảnh hưởng chủ yêu đến số
lượng bạch cầu hạt (xem mục Liều lượng
và cảoh dùng vả mục Những cảnh báo đặc
biệt vả thận trọng khi sử dụng)
0 Giảm tiếu cầu
0 Thỉếu mảu
Hay gặp=
0 Giảm bạch cầu trung tính có sốt
Rắt hiếm gặp:
0 Tăng tíểu cầu
Rối loạn hệ miễn dịch Rât hiêm gặp:
. Phản ứng kiểu phản vệ
Rối loạn chuyển hóa và đinh dưỡng Hay gặp
0 Chán ăn
Rối loạn hệ thần kinh Hay gặp:
0 Đau đầu
' Mất ngủ
o Ngủ gả
Ít gặp:
0 Tai bỉến mạch não
Rối loạn tỉm Ỉt gặp:
0 Rối loạn nhịp tim, chủ yếu là nhịp nhanh
trên thẩt
o Suy tỉm
Hiếm gặp:
o Nhồỉ mảu cơ tim
Rối loạn mạch máu Hiếm gặp:
0 Cảo dẳu hiện lâm sảng của viêm mạch
ngoại vi và hoại thư.
0 Hạ huyết áp
Rẫt hiếm gặp:
0 Hội chứng rò rỉ mao
sử dụng)
Rỗi loạn hô hấp, vùng ngực và trung thẩt Rất thường gặp:
o Khó thở — thường ở mức độ nhẹ vả khỏi
nhanh mà không cần đíều trị
Hay gặp:
0 Ho
f Viêm mũi
It gặpr _
o Viêm phôi mô kẽ (xem mục Những cảnh
báo đặc biệt và thận trọng khi sử dụng)
o Co thẳt phế quản — thường ở mức độ nhẹ
và thoảng qua nhưng có thế cần phải đỉều
trị theo đường tĩnh mạch
Hỉếm gặp:
. Phù phồi
o Hội chứng suy hô hẩp cấp (xem mục
Những cảnh bảo đặc biệt vả thặn trọng khi
sử dụng) |
Rối loạn tiêu hóa
Rất hay gặpz n /
. Nôn pi Vi
O Buồn nôn '.
Hay gặpz
n Tiêu chảy
o Viêm vả loét miệng
o Tảo bón
Rất híếm gặp:
. Vìêm đại trảng do thiếu mảu cục bộ
Rối loạn gan mật
Rất hay gặp:
0 Tăng transaminase (AST vả ALT) vả
phosphatase kiềm ở gan
Hay gặp:
0 Tăng bilirubin
Ít gặp:
0 Ngộ độc gan nặng, kể cả suy gan và tử
vong
Hiếm gặp:
0 Tăng gamma-glutamyl transferase (GGT)
Rối loạn da và mô dưới da
Rât hay gặp:
0 Ban dị ứng da thường kèm theo ngứa
o Rụng tóc
Hay gặp:
0 Ngứa
. Đố mồ hôi
Hiếm gặp:
0 Cảo phản ứng nghỉêm trọng trên da, kể cả
tróc vảy và ban da bòng rộp
o Loẻt
0 Tạo mụn nước đau
» Tróc vảy
Rất hiếm gặp:
0 Hoạt từ thượng bì nhiễm độc
0 Hội chứng Stevens-Johnson
Rối loạn cơ xương và mô lỉên kết Hay gặp:
0 Đau lưng
o Đau cơ g.
Rối loạn thận vả tìết niệu Rất hay gặp: /ề'/ cổ PHẦN
› Tiểu mảu DƯỢC PHẨM
" Protein nỉệu mức độ nhẹ
ẵ\ "
Ít gặp: ÝẶDUY TẠ/Ế' i
_ _Jn \Ắ’
\VAN.TP/I
Suy thận (xem mục Những cảnh bảo đặc
biệt và thận trọng khi sử dụng)
Hội chứng tản huyết urê huyết cao (xem
mục Những cảnh bảo đặc biệt và thận
trọng khi sử dụng)
Rồi loạn toản thân và phản ứng tại vị trí sử dụng
Rất hay gặp:
Hay gặp=
Hiếm gặp:
Triệu chứng giống cúm — các triệu chúng
hay gặp nhất là sốt, đau đầu, ởn lạnh, đau
cơ, suy nhược vả chản ãn.
Ho, viêm mũi, khó chịu, đổ mồ hôi và khó
ngủ đã được ghi nhận.
Phù/phù ngoại vi, kể cả phù mặt. Phù
thường có thể hồi phục sau khi ngừng
đi ếu trị.
Ý
Cảo phân ứng tại vị trí truyền, chỉ yếu ở
mức độ nhẹ.
Sốt
Suy nhược
Ớn lạnh
Tổn thưong, ngộ độc và cảc biến chứng do thủ thuật
Hiếm gặp:
Nhiễm độc xạ trị (xem mục Tương tảo vởi
cảc thuốc khác và cảc dạng tương tác
khảo).
o Tổn thương do xạ trị cùng cố.
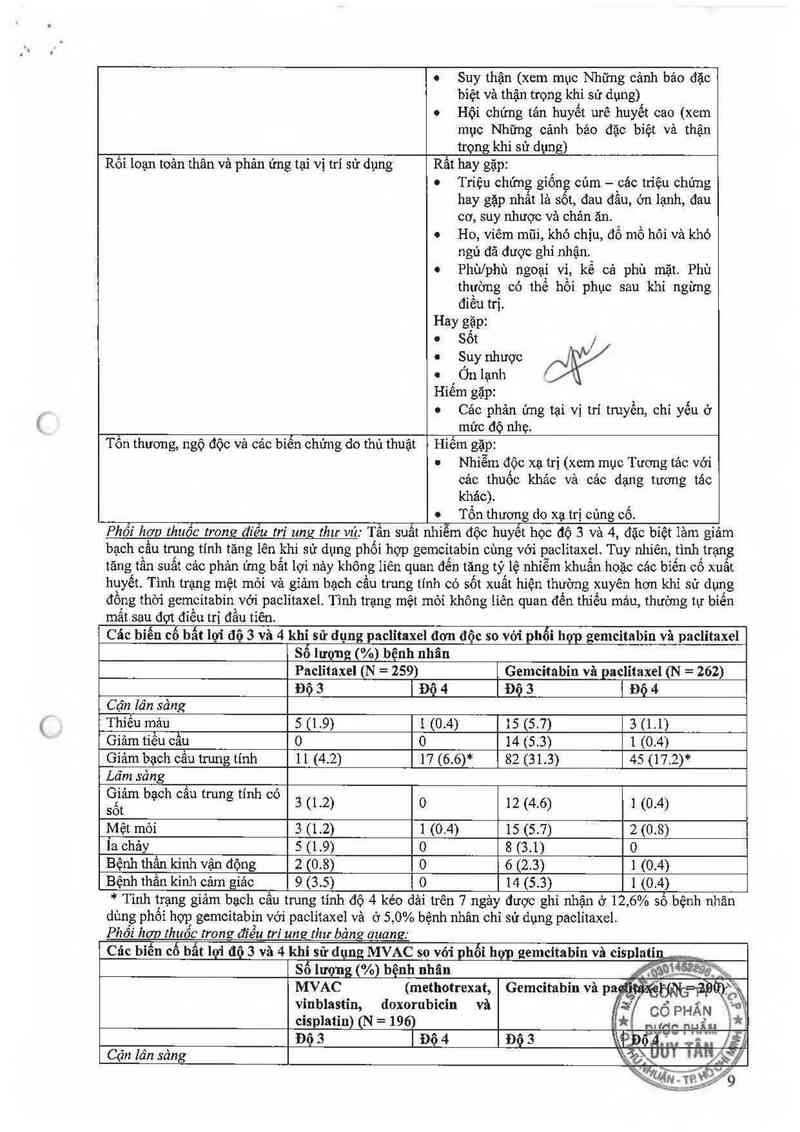
Phối hơp thuốc trong điều tri ung thư vú .Tần suât nhiem độc huyết học độ 3 và 4, đặc bỉệt lăm gỉảm
bạch cầu trung tính tăng lên khi sử dụng phối hợp gemcitabin cùng với paclitaxel. Tuy nhiên, tình trạng
tăng tần suất cảc phản' ưng bắt lợi nảy không Iiên quan đến tăng tỷ lệ nhiễm khuẩn hoặc các biến cố xuất
huyết. Tình trạng mệt mỏi và giảm bạch cầu trung tính có sốt xuất hiện thường xuyến hơn khi sử dụng
đồng thời gemcitabin với paclitaxel. Tình trạng mệt mỏi không [iên quan đến thiếu mảư, thường tự biến
mắt sau đợt đíếu trị đầu tiên
Các biến cố bất lợi độ 3 và 4 khi sử dụng paclỉtaxel đơn độc so vởi phối hợp gemcitabin vả paclitaxel
Số lượng (%) bệnh nhân
Paclítaxel (N = 259) Gemcitabin vè paclỉtaxel (N = 262)
Độ 3 | Độ 4 Độ 3 1 Độ 4
Cận lân sảng
Thiếu mảu 5 (1.9) 1 (0.4) 15 (5.7) 3 (11)
Giảm tiếu cầu 0 o 14 cs.s) 1 (0.4)
Gíâm bạch cẩu trung tính 11 (4.2) 17 (6.6)* 82 (31.3) 45 (17.2)*
Lâm sảng
ẸỀ'Ểm bạCh cau trung tính “° 3 (1.2) 0 12 (4.6) 1 (0.4)
Mệt mói 3 (1.2) 1 (0.4) 15 (5.7) 2 (0.8)
Ỉa chây 511.9) o 8 (3.1) 0
Bệnh thần kinh vận động 2 (0.8) 0 6 (2.3) 1 (0.4)
Bệnh thần kinh cảm giác 9 (3. 5) o 14 (5 3) 1 (0.4)
* Tinh trạng giảm bạch cẳu trung tính độ 4 kéo dải trên 7 ngảy được ghi nhận ở 12 ,6% số bệnh nhân
dùng phối hợp gemcitabin với paclitaxel và ở 5,0% bệnh nhân chỉ sử dụng paclỉtaxel
_ Phối hơp thuốc trong điều m“ umz thư bảng auanz:
Các bìến cố hất lợi độ 3 và 4 khi sử dụng MVAC so vỏi phối hợp gemcitabin vâ cỉsplatỉ
Số lượng (%) bệnh nhân
MVAC (methotrexat,
vinblastin, doxorubicin vả
cisplatỉn) (N = 1961
Độ 3 Độ 4
Cận lán sảng
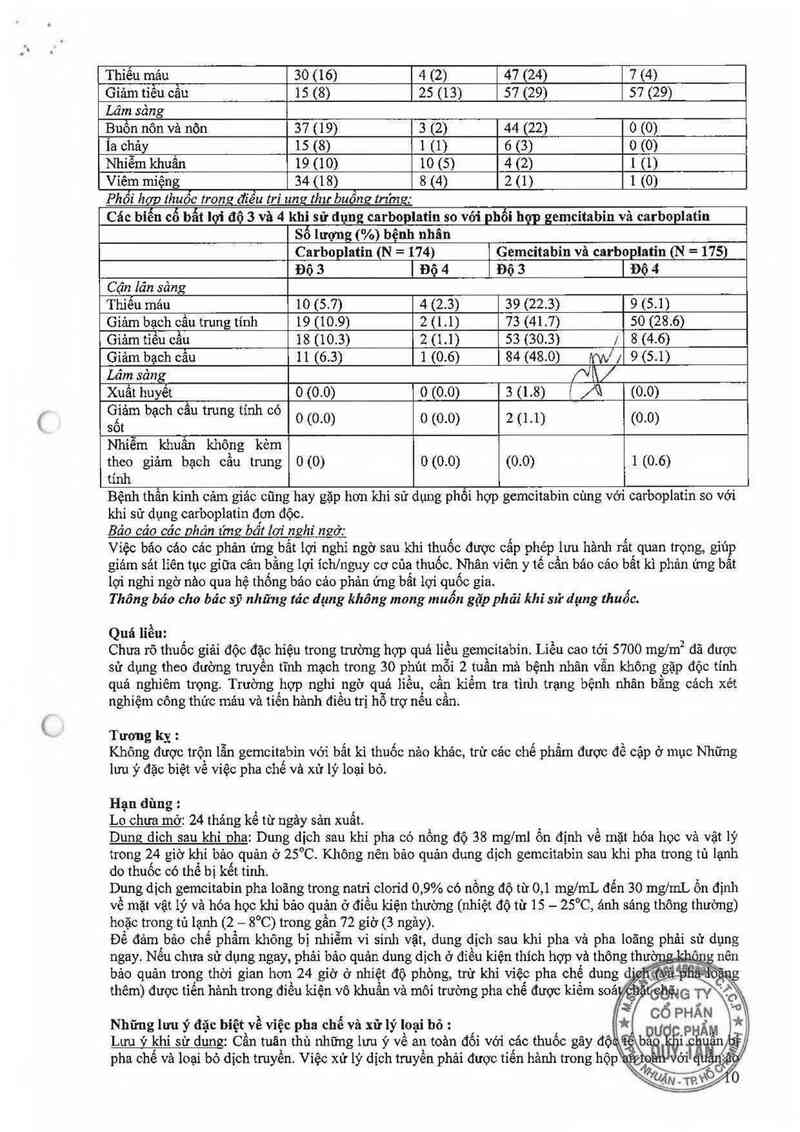
Thiếu mảu 30 (16) 4 (2) 47 (24) 7 (4)
Giảm tiếu cầu 15 (8) 25 (15) 57 (29) 57 (29)
Lâm sảng
Buồn nôn vả nôn 37 (19) 3 (2) 44 (22) 0 (0)
18 chảy 15 (8) 1 (1) 6 (3) o (0)
Nhiễm khưần 19 (10) 10 (5) 4 (2) 1(1)
Viêm miệng 54 (18) 8 (4) 2 (1) 1 (0)
Phối hgg thuốc trong đíều tri ung thư buồng trímz:
Các bíến cố bất lợi độ 3 và 4
khi sử dụng carboplatin so với phối hợp gemcitabín vả carboplatin
Số lượng (%) bệnh nhân
Carboplatin (N = 174) Gemcitabin vã carboplatin (N = 175)
Độ 3 1 Độ 4 Độ 3 | Độ 4
Cận lán sảng
Thiểu mảu 10 (5.7) 4 (2.3) 39 (22.3) 9 (5.1)
Giảm bạch cầu trung tính 19 (10.9) 2 (1.1) 73 (41.7) 50 (28.6)
Giảm tiều cầu 18 (10.3) 2 (1.1) 53 (30.3) 7 8 (4.6)
Giâm bạch cầu 11 (6.3) 1 (0.6) 84 (48.0) Ni ; 9 (5.1)
Lâm săng ị\/
Xuất huyết 0 (0.0) 0 (0.0) 3 (1.8) ( A (0.0)
Ệẵ'm bạ°h °ầ“ trung tmh “3 0 (0.0) 0 (0.0) 2 (1.1) (0.0)
Nhiễm khuẩn không kèm
theo giảm bạch cầu trung 0 (0) 0 (0.0) (0.0) 1 (0.6)
tính
Bệnh thần kinh cảm giảc cũng hay gặp hơn khi sử dụng phối hợp gemcitabin cùng với carboplatìn so với
khi sử dụng carboplatin đơn độc.
Báo cáo các nhán ung bất lơi nghi ngờ:
Việc báo cáo các phản ứng bất lọi nghi ngờ sau khi thuốc được cẳp phép lưu hânh rất quan trọng, giúp
giảm sát liên tục gỉữa cân bằng lợi ích/nguy cơ của thuốc Nhân vỉên y tế cần báo cảo bất kì phản ứng bất
lợi nghi ngờ nảo qua hệ thống bảo cảo phản' ưng bất lợi quốc gia
Tbông báo cho bác sỹ những tảc dụng không mong muốn gặp phải khi sử dụng thuốc.
Quá lỉếuz
Chưa rõ thuốc giải độc đặc hiệu trong trương hợp quá liếu gemcitabin Liều cao tới 5700 mglm2 đă được
sử đụng theo đường truyền tĩnh mạch trong 30 phút mỗi 2 tuần mả bệnh nhân vẫn không gặp độc tinh
quả nghiêm trọng. Trường hợp nghi ngờ quả liếu, cần kỉểm tra tinh trạng bệnh nhân bằng cảoh xét
nghiệm công thức mảu vả tiến hảnh điếu trị hỗ trợ nếu cần
Tương kỵ :
Không được trộn lân gemcitabin vói bât ki thuốc nảo khác, trừ cảc chê phâm được đề cập ở mục Những
lưu ý đặc biệt vẽ việc pha chế vả xử lý loại bỏ.
Hạn dùng .
Lo chưa _mở: 24 thảng kế từ ngảy sản xuất
Dung dich sau khi pha: Dung dich sau khi pha có nồng độ 38 mg/ml ốn định về mặt hóa học và vật lý
trong 24 giờ khi bảo quản ở 25°C. Không nên bảo quản dung dịch gemcitabỉn sau khi pha trong tủ lạnh
do thuốc có thể bị kết tinh.
Dung dịch gemcitabin pha loãng trong natri clorid 0,9% có nồng độ từ 0,1 mg/mL đến 30 mg/mL ồn định
về mặt vật lý và hóa học khi bảo quân ở điều kiện thường (nhiệt độ từ 15 - 25°C, ánh sảng thông thường)
hoặc trong tủ lạnh (2- 800) trong gần 72 giờ (3 ngảy).
Để đảm bảo chế phẩm không bị nhìễm vi sinh vật, dung dịch sau khi pha và pha loãng phải sử dụng
vả găng tay bảo hộ Nếu không có hộp an toản, cần sử dụng thêm mặt nạ vả kính bảo hộ Nếu để chế
phẩm tiếp xúc vởi mắt, thuốc có thể gây kích ửng mạnh. Phải rứa kỹ mắt ngay lập tức bằng nước sạch
Nếu mắt vẫn còn bị kich' ưng, cần tham vắn ý kiến bảo sĩ Nếu dung dịch bị rây văo da, phải rừa kỹ với
nước sach.
Hướng dẫn pha chế (vả tiến tuc pha loãng): Dung môi duy nhất được phép sử dụng để hòa tan bột vô
khuẩn gemcitabin 1ả dung dịch natri ciorid 9 mg/ml (0, 9%) dùng để pha tiêm (không có chất bảo quản).
Do giới hạn về độ tan, nông độ đung dịch gemcitabin tối đa có thể đạt được sau khi pha là 40 mglml. Cần
tránh pha dung dịch có nông độ cao hơn 40 mg/ml vì oó thế thuốc không tan hoản toản
1. Sứ dụng kỹ thuật vô trùng trong quả trinh pha và pha loãng dung dịch gcmcitabin truyền tĩnh mạch.
2 Để pha dung dịch, thêm 5 ml dung dịch natri clorid 9 mglm] (0, 9%) vô khuẩn không có chẩt bảo quản
vảo lọ 200 mg hoặc thêm 25 ml đung dịch natri clorid 9 mg/ml (0, 9%) vô khuẳn không có chất bảo quản
vâo lo 1 g hoặc thêm 50 ml dung dịch natri clorid 9 mg/ml (0, 9%) vô khuẩn không có chất bảo quản vảo
lọ 2 g. Tổng thể tích dung dịch sau khi pha lẩn iượt lẻ 5 ,26 ml (lọ 200 mg), 26, 3 ml (lọ ] g) và 52, 6 ml
(lọ 2 g) Dung dịch gemcitabỉn sau khi pha có nồng độ 38 mg/ml Lắc đế bột tan hoản toân. Tiếp tục pha
loãng bằng dung dịch natri clorid 9 mglml (0. 9%) không chứa chất bảo quản Dung dịch sau khi pha phải
trong, không mảu hoặc có mảu vảng nhạt.
3 Phải kiểm tra cảc chế phẩm tiêm truyền bằng mắt thường để phát hiện bất kỳ tiểu phân nảo không tan
hoặc hiện tượng biến mảu trưởc khi sử dụng. Nếu quan sảt thấy tìếu phân không tan thì
dụng.
Thuốc nảy chỉ dùng một lần sau khi pha chế.
Bắt kỳ phần thuốc nảo không sử dụng cần phải loại bỏ theo đúng quy trình chuẩn tại c ở điều trị.
Bão quản:
Bảo quân dưới 30°C, ở nơi khô rảo vả thoáng mảt.
Đóng gói:
Hộp 1 lọ.
Săn xuất tại Hè Lan bởi:
Pharmachemie B.V.
Swensweg 5, 2031 GA Haarlcm, The Netherlands (Hà Lan)
TUQ CỤC TRUỜNG
p TRUỞNG PHÒNG
.Ảỷuyễn Jf'uy J(Ểìng
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng