












J .
\
BỐYTẾ
Lẩu đẩU! '… ~»…llơơ Duuu
Ệgfflơợc
_FììDWWFC
ĐÃ PIIE DUYỆT
/. Ồẫể.i Ấ.…
ẮHUTỸỮ
Gemcitabin onlwvis 1000 mg
Covuofbox
WD: Illustrator
BNID_ON KOVIS | 28-04-2014
Con… m.:
Ồélùcỉ_tìabin ' '
onkov1s
~.< 1m. -.namna ’ĩísr.
Gemcitabin
onkovis
Ttịuộjẹbõtpha
%???“ …
bdu’n1'llũ ỉn
Worldtmgưmũ
mquuđhhu
Tídm m…
NủlnuhtWM.
Mdủhìlứihyúuid
mm,dủmđnmủm
mm…zư…
sừMalùnlẵẫomăỡW
Ồ3Q31 1
o_qÌ
g cône TY "`
…“ mtcu 11111E1111ũ1111111
*
ủGỔVHTR
gmwm
TỔNG GIÁM ĐỐC
Ngô Đức Bình
Gemcitabin onkovis 1000 mg
Label in vial
Color: I PantoneM1
...-
I Ẻì²9²….………-_WW…
Size:
Sơltwaf0: lllusùamr
BNID_ONKOVIS l28-0b2014 Cu… Nf.:
Ẹfflị’Ẹffl "Gemcijahin ỀỀỄỄỄJỄỄỄỦỂW " Gemcitabin
mon m_gsemđgatin onkov1s momumwn. onanis
Euủmdwftdũmg lIU mg '! ẫẫ Eam_vidbiỉnhmsu_zlễdmans 1mm ị ẵi
1ngemdlabina. _ bfflll'm ỊỄỂỊÍ 1ottomgendlabine- _ Thuôcbộiphl ỊỄẨỊỊ
c*..a~amr…m …… mạ zaamưaa …… g…:1u
Một tụ chứa 1140 mg gemcitabin Rt - -
hydrocloric! tương đương với 6 em C l_tfi b ' “
mon mg gemcitabin. onkov1s
Each via! oontains 1140 mg _.
gemcitabine hydrochlorid as 1… mg Ế ỄỄ
1000 mg gemcitabine. Thuốc bột pha ẵẵ ẽẵẵ
NhảsảnxuâttActavisltalyS.pA.-Ý - ìsẫ`~
sa … GPLH tại Đức: oakovis GmbH uẽm truyền ẫ8 & Ễ Ế
` PỔNG GIÁM ĐỐC
Ngô Đức Bình
«l
li'~ 1v.k. *
R, Thuốc bản theo đơn
Hướng dẫn sử dung
Đọc kỹ hướng dẫn sử dụng trước_ khi dùng
Nếu cẩn thông tín, xỉn hỏi ý kiên bác sỹ
THUỐC BỘT PHA TIÊM TRUYỀN
GEMCITABIN ONKOVIS 1000 mg
TÊN DƯỢC PHẨM _
Gemcitabin onkovis 1000 mg thuốc bột pha tiêm truyền.
THÀNH PHẨN CHẤT vÀ LƯỢNG
Một lọ chứa 1 140 mg gemcitabin hydrochlorid tương đương với 1000 mg gemcitabin.
Sau khi tải phân tán thảnh dung dịch chứa 38 mng gemcitabin.
Tá dược:
Mỗi lọ 1000 mg chứa 20,3 mg natri.
Danh mục tá dược đầy đủ, xem phần Danh mục tá dược.
DẠle BÀO CHẾ _
Thuỏc bột pha tíệm tt_uyên (bột đông khô)
Bột mảu trăng đên trăng nhạt Ỹ/
ĐẶC ĐIÊM LÂM SÀNG
Các chỉ định điều trị
Gemcitabin được chỉ định đề đíều trị ung thư bảng quang tiến triến tại chỗ hoặc di căn kết hợp
với thuốc cisplatin.
Gemcitabin được chỉ định cho bệnh nhân ung thư tuyến tụy tiến triển tại chỗ hoặc di căn.
Gemcitabin được chỉ định kết hợp với cisplatin điếu trị đầu tay cho bệnh nhân ung thư phổi
không phải tế bảo nhỏ di căn hoặc tiến triến tại chỗ. Gemcitabin có thể dùng đơn độc cho bệnh
nhân lớn tuổi hoặc ung thư giai đoạn 2
Gemcitabin chỉ định kết hợp với carboplatín díều trị cho bệnh nhân ung thư biếu mô buồng trứng
tiến triển tại chỗ hoặc di căn, cho cảc bệnh nhân ung thư buồng trứng trước dó đã điếu trị đầu tay
bằng cảc phác để chứa platin nhưng đã bị tải phát trong khoảng thời gían ít nhất 6 tháng.
Gemcitabin kết hợp với paclítaxel được chỉ định điều trị cho các bệnh nhân ung thư vú tiến tríển
tại chỗ không thể cắt bỏ hoặc di cãn - những người bị tái phát sau khi dùng líệu pháp hóa học.
Liệu pháp hóa học ưu tiên nên có một anthracyclin ngoại trừ về phương diện lâm sảng cắm dùng.
Liều luợng và cách sử dụng
Liều đề nghị:
Ung thư bảng guanz:
Dùng kết hợp
Liều đề nghị của gemcitabin là 1000 mg/m2 truyền tĩnh mạch trong 30 phút Gemcitabin nên
truyền vảo các ngảy !, 8 và 15 của đợt điều trị 28 ngảy kết hợp với cisplatỉn Cisplatin được tỉêm
tmh mạch với liểu đề nghị 70 mg/m2 vảo ngảy ] sau khi truyền gemcitabín hoặc ngảy 2 của đợt
điếu trị 28 ngảy. Cứ như thế lặp lại chu kỳ 4 tuần nảy. Giảm liếu thuốc trong đợt điều trị dựa vảo
mức độ độc tính xảy ra trên bệnh nhân
Ung thư tỵỵến tuy;
Liều đề nghị cùa gemcitabin là 1000 mg/m2 truyền tĩnh mạch trong 30 phủt. Lặp lại liều nảy cứ
mỗi tuần 1 lần tro_ng 7 tuần liên_ tục, sau dó ngưng 1 tuần. Đợt kế tíếp là truyền 1 tuần ] lần trong
3 tuần lìên tiếp rôi ngưng ở tuần thứ 4. Giảm liếu thuốc trong đọt điều trị dựa vảo mức độ độc
tính xảy ra trên bệnh nhân
Ung thư Dhốỉ khỏmz Dhải tế bảo nhó:
Đơn độc
Liều đề nghị của gemcitabin là 1000 mg/m2 truyền tĩnh mạch trong 30 phủt. Truyền nhắc lại ]
tuần 1 lần trong 3 tuần líên tiếp, sau đó ngưng ở tuần thứ 4. Cứ như thế lặp lại chu kỳ 4 tuần nảy
Giảm liếu thuốc trong đợt đỉều trị dựa vảo mức độ độc tính xảy ra trên bệnh nhân.
Dùng kết hợp
Líều đề nghị cùa gemcitabỉn là ]250 mg/m2 bề mặt cơ thế, truyền tĩnh mạch trong 30 phút vảo
ngảy ] và 8 của đợt điếu trị 21 ngảy. Giâm liều thuốc trong đợt đỉều trị dựa vảo mức độ độc tính
xảy ra trên bệnh nhân.
Cisplatin được tiêm tĩnh mạch ớ lỉều khoảng 75-100 mg/m2 1 lần sau 3 tuần truyền gemcitabin.
Ung thư vú.
Dùng kết hợp
Gemcitabin kết hợp với paclỉtaxcl, dùng paclitaxel (175 mg/m2 2) truyền tĩnh mạch trong 3 giờ vảo
ngảy ! trước khi truyền gemcitabin, gemcitabin (1250 mg/m2 ) truyền tĩnh mạch trong 30 phút
vảo ngảy l vả 8 của môi đợt điều trị 21 ngảy. Giảm lỉều thuốc trong đợt điếu trị dựa vảo mức độ
độc tính xảy ra trên bệnh nhân. Trước khi dùng kết họp gemcitabin vởi paciitaxel cần xác định
lượng bạch cầu hạt của bệnh nhân ít nhất là 1.500 (x106/1).
Um-7 thư buồngr trứng:
Dùng kết hợp
Gemcitabin dược chỉ định kết hợp với carboplatỉn, dùng gemcitabin 1000 mg/m2 truyền tĩnh
mạch trong vòng 30 phút vảo ngảy 1 và 8 của môi đợt điếu trị 21 ngảy. Carboplatin được truyền
tĩnh mạch với AUC 4, O mglml phút vảo ngảy thứ 1 sau khi truyền gemcitabín. Giảm liều thuốc
trong đợt điếu trị dựa vảo mức độ độc tính xảy ra trên bệnh nhân. -
Hiên chinh liều theo đỏc lính không thuôo mảu
Định kỳ khám sức khỏe và nên kỉểm tra chức nặng của gan và thận để phát hiện ra các độc tính
không thuộc máu. Giảm liều thuốc trong đợt điều trị dựa vảo mức độ độc tinh xảy ra trên bệnh
nhân. Nói chung khi cảc biếu hỉện độc tinh không thuộc máu nặng (độ 3 hoặc 4}, ngoại trừ buồn
nôn/nôn, việc ng_ưng dùng gemcitabin hoặc giảm liều nê_n tuân theo quyết định của bảo sĩ đíếu
trị. Ngưng_ các liếu cho đến khi độc tinh đã được giải quyết.
Đ_ốỉ với vỉệc điếu chinh liếu cỉsplatin, ca_rboplatin vả paclitaxel trong liệu phảp điều trị phối hợp
cần tuân theo cảc tóm tắt đặc tính sân phẳm tương đương
Hiẽu chỉnh liều theo đôc tính máu
Trưởc mỗi đợt điều trị
D_ảnh cho tất cả các chỉ định, trước khi dùng mỗi liều cẳn phải kiếm tra số lượng bạch cầu hạt và
tiếu cầu Trước m_ỗi đợt điều trị cần đảm bảo bệnh nhân có lượng bạch cầu hạt it nhất lả 1.500 (x
10 611) và lượng tiến cần ít nhất là 100. 000 (xloóll)
Trong đợt điều trị _
Hiệu chĩnh liêu gemcitabin trong đọt điêu trị nên diên ra theo bảng dưới đây:
Hiệu chỉnh liếu ge_mcitabỉn trong mỗi đợt điều trị cho bệnh nhân ung thư bảng quang, ung thừ
phổi không phải tế bảo nhỏ (N SCLC )vả ung thư tuyến tụy, điều trị đơn độc hoặc phối hợp vởi
cisplatin
Phần trăm liếu đầy đủ
Ă À 6 A - Â À 6
So lượng bạch cau hạt (xlO Il) So lượng t1eu cau {xlO /l) gemcitabỉn (%)
>1.000 vả > 100.000 100
500—1.000 hoặc 50.000-100.000 75 _
<500 hoặc <50.000 Ngừng thuôo
Việc ngưng điếu trị sẽ khônẵ được phục hồi truớc khi lượng bạch cầu hạt 2 500 (x 106I1) vả
lượng tiếu cầu 2 50.000 (x10 fl).
Hiệu chỉnh liều gemcitabin trong mỗi đợt đỉếu trị cho bệnh nhân ung thư vú, điều trị phối hợp
với paclitaxel
Số lượng bạch cầu hạt (xl 0611) Số lượng tiến cầu (x106/1) Phâẫeẫăcflfịaịỉẳ Ể,ỆỂ đ"
21.200 và › 75.000 100
1.000 - <1.2oo hoặc so.ooo - 75.000 75
700 - < 1.ooo vả zso.ooo so
<7oo hoặc 1. 500 (x 106/1) và lượng tiến cầu
2 100.000 (x10611).
Hiệu chỉnh liều gemcitabin trong mỗi đợt diều trị cho bệnh nhân ung thư buồng trứng, điều trị
phôi hợp với carboplatin
Số lượng bạch cầu hạt (xi 0611) Số lượng tiếu cầu (xlofvt) Phag“ẹẫỉrẵalểỉẵ ẾỆỂ đ“
› 1.500 và >1oo.ooo 100
1.000 … 1.soo hoặc 75.000 … 100.000 so
<1ooo hoặc <7s.ooo Ngừng thuốc
Việc ngưng đìều trị sẽ không được phục hồi trong đợt điều trị Việc điếu trị sẽ được bắt đầu vảo
ngảy thứ nhất của đợt điều trị tiếp theo khi lượng bạch cầu hạt > 1.500 (x 106l1) và lượng tiếu cầu
>1oo. 000 (xl_Oó/l)
Hiệu chinh liều trong cảc đợt điều trị phụ thuộc vảo độc tính máu, đối với tất cả cảc chỉ định
Liều gemcitabin nên được gíảm xuống còn 75% liều điếu trị binh thường trong các trường hợp
độc tính máu như sau:
Lượng Bạch cẳu hạt < 500 x lOóll khoảng hơn 5 ngảy
Lượng Bạch cầu hạt < 100 x 106/1 khoảng hon 3 ngảy
Sốt do giảm bạch cầu trung tính
Tỉếu cầu < 25.000 x 10611
Trì hoãn đợt diếu trị hơn 1 tuần theo độc tính
Phương phảp sứ duna:
Gemcitabin bột pha tiêm dung nạp qua đường truyền tốt vả có thế đi lại trong lúc truyền. Nếu
thoát mạch xây ra phải ngừng truyền ngay và bắt đầu truyền lại ở mạch máu khác. Bệnh nhân
nên được kiểm tra cẩn th ận sau khi truyền.
Chỉ dẫn cho việc pha loãng xem mục Thận trọng đặc biệt khi loại bỏ và xử lý thuốc.
Cảo nhóm bếnh nhân đăc biêt
Bênh nhân suv ean hoãc suv thân
Phải cẩn trọng khi dùng gemcitabin cho bệnh nhân suy gan hoặc suy thận, chưa có đằy đủ thông
tỉn nghiên cửu lâm sảng về liều chỉ định cho phép đối với nhóm bệnh nhân nảy (xem mục Cảnh
báo đặc biệt và thận trọng trong sử dụng vả Các đặc điếm dược động học).
Nhóm bênh nhân lớn tuồi ( > 65 tuối)
Gemcitabin dung nạp tốt ở bệnh nhân_ trên 65 tuổi. Không có bằng chứng cho thấy cần thiết phải
hiện chinh liếu cho bệnh nhân lớn tuổi, trừ khi có chỉ định (xem mục Các đặc điếm dược động
học).
Trẻ cm < 18 tuổi)
Gemcitabin không được khuyến cáo sử dụng cho trẻ em dưới 18 tuổi vì chưa có đầy đủ dữ liệu
chứng minh sự an toản và hiệu quả đối với nhóm bệnh nhân nảy.
Chổng chỉ định
Chống chỉ định 0 bệnh nhân nhạy cảm với gemcitabin hay với bất cứ thảnh phần nảo của thuốc.
Chống chỉ định phụ nữ đang cho con bú (xem mục Phụ nữ có thai và cho con bủ)
Cảnh báo đặc biệt và thận trọng trong sử dụng
Cần thận trọng cho phụ nữ có thai và cho con bú (xem mục Phụ nữ có thai và cho con bú).
Thời gian truyền dải và số lần dùng thuốc tăng lảm tăng độc tính
Đôc tính máu
Gemcitabin có thế ức chế tùy xương với bíểu hiện gỉảm bạch cầu, tiều cầu và thiếu mảu.
Bệnh nhân trước khi dùng mỗi liều gemcitabin cần kiếm tra số lượng tiểu cầu và bạch cầu. Việc
đình chỉ hay hiệu chĩnh liệu pháp đíếu trị cần xem xét cẩn thận khi việc suy gỉảm chức năng của
tùy xương do thuốc gây ra đã được phảt híện (xem mục Liều lượng_ và cách sử dụng). Tuy
nhíên, hiện tuợng ức chế tủy xương chi là ngắn hạn, thường không cân giảm liều vả hiếm khi
phải ngưng thuốc.
Số lượng tế bảo mảu ngoại vi có thể tiếp tục giảm sau khi đã ngừng sử dụng gemcitabin. Ở các
bệnh nhân chức năng tùy xương bị suy giảm, việc bắt đầu điếu trị lại phải hết sức cân thận.
Giống như các thuốc điếu trị ung thư khảo, khi điều trị phối hợp gemcitabìn với các thuốc khác
phải lưu tâm tới việc suy tủy tăng dần.
Su an
Việc sử dụng gemcitabin ở bệnh nhân di căn gan, hoặc có tiền sử viêm gan, nghiện rượu hoặc xơ
gan có thế lảm trầm trọng thêm tinh trạng suy gan
Nên định kỳ đảnh giá chức năng thận và gan (gồm cả xét nghiệm virus).
Nên chú ý khi dùng gemcitabín cho các bệnh nhân sưy gan hoặc suy thận, chưa có đầy đủ thông
tin nghiên cửu lâm sảng vê liếu chỉ định cho phép đối với nhóm bệnh nhân nảy (xem mục Liễu
lqu và cách sử dụng).
Kết hơn xa tri _]
Kết hợp xạ trị (sử dụng đồng thời hoặc cảch nhau 5 7 ngảy): có bảo cảo vế độc tính (xem mục
Tương tảo với các thuốc khác và các dạng tương tác khác về chỉ định dùng)
Tiêm chủng
Vắc xin điều trị sốt vảng da vả các vắc xỉn khác không được chỉ định cho bệnh nhân điều trị
gemcitabin (xem mục Tương tác với các thuốc khác và các dạng tương tác khác)
Tim mach
Gemcitabin gây ra các bệnh về tim mạch nặng vả/hoặc rối loạn tim mạch, nguyên nhân thường
liên quan đến các bệnh nhân có tiền sử bệnh tim mạch.
Phôi
Có bảo cảo gemcitabỉn ảnh hưởng tới phổi, đôi khi rất nặng (như phù phổi, viêm phối kẽ hoặc
hội chứng suy hô hẳp cấp) Nguyên nhân của các ảnh hưởng nảy chưa rõ. Nếu xảo định nguyên
nhân do gemcitabin, cân xem xét việc ngừng sử dụng thuốc Sử dụng sớm phương pháp điều trị
hỗ trợ có thể giúp cải thiện tình trạng.
T_hân
cn báo cảo hiếm gặp các triệu chứng lâm sảng của hội chứng urê mảu tan huyết (HUS) ở cảc
bệnh nhân dùng gemcitabin (xem mục Các tác dụng không mong muốn). Nên ngừng dùng
gemcitabin ngay khi có dẩu hiệu đầu tiên của thiếu máu do tan huyết ở mao mạch như giảm
hemoglobin đồng thời giảm tiều cầu, tăng bỉlỉrubin, tăng creatinin, tăng urea nitrogen hoặc
LDH. Suy thận có thế không hồi phục khi ngừng liệu pháp và có thế cần đến phương pháp thẳm
tách.
S_inh sản
Tr_ong các nghiên cứu về sinh sản, gemcitabin gây chứng giảm tinh trùng ở chuột đực (xem mục
Số liệu an toân tiền lãm sảng) Vì vậy, bệnh nhãn nam đang điếu trị với gemcitabin không nên
có con trong quá trình đỉều trị và 6 thảng sau khi điều trị, và có lời khuyên líến quan đến việc
bảo quản lạnh tinh trùng trước khi điều trị vì gemcitabin có khả năng gây vô sinh (xem mục Phụ
nữ có thai vả cho con bú)
Mưối natri
1 lọ gemcitabin 200 mg chứa 4,1 mg natri. Vì vậy nên cẩn trọng đối với các bệnh nhân có chế độ
ăn kiêng muối.
] lọ gemcitabin 1000 mg chứa 20, 3 mg natri Vì vậy nên cẩn trọng đối với cảc bệnh nhân có chế
độ ăn kiêng muối.
Tương tác vởi các thuốc khác và các dạng tương tác khác
Chưa có nghiên ct’m tương tác thuốc đặc biệt được báo cáo (xem mục Các đặc điểm duợc động
học)
Xa tri
Đồng thời (sử dụng đồng thời hoặc cảch nhau.. < 7 ngảy)— việc tăng độc tính trong liệu pháp kết
hợp nảy phụ thuộc vảo rất nhiều yếu tố, gồm ]iếu gemcitabin, tần số truyền gemcitabỉn, liêu xạ
trị, kĩ thuật xạ trị mô đích, và thể tích đích. Nghiên cứu tiến lâm sảng và lâm sảng chỉ ra
gcr_ncitabin có hoạt tính nhạy cảm tia xạ. Trong một thử nghiệm riêng lẻ ở bệnh nhân ung thư
phồi không phải tế bảo nhỏ dùng gemcitabin với liếu 1000 mg/m2 truyền trong 6 tuần lỉên tìểp
kèm với xạ trị ngực có dấu hiệu độc tinh nặng, đe dọa tinh mạng do viêm níêm mạc, đặc biệt
viêm thực quản và viêm phối xảy ra trên các bệnh nhân nhận liều xạ trị lớn (thế tich điều trị
trung bỉnh 4.795 cm ) Các nghiên cừu sau đó được tiến hảnh trên pha 11 bệnh _nhân ung thư phổi
không phải tế bâo nhỏ chỉ ra rằng có thể thực hiện truyền gemcitabin ở liếu thẩp hơn kết hợp với
xạ trị và độc tính dự bảo trước, liều xạ trị ngục được đề nghị 66 Gy kết hợp truyền gemcitabin
(600 mg|m_, 4 lần) vả ciSplatin (80 mglm², 2 lần) trong 6 tuần. Chưa xảc dịnh được chế độ điều
trị tối ưu dế an toản sử dụng gemcitabin kết hợp với lìệu pháp xạ trị ở tất cãt_ các loại ung thư
Không đồng thời (sử dụng cách nhau >7 ngảy)— phân tích dữ iỉệu cho thắy không có bắt kỳ sự
gia tăng độc tính nảo khi sử dụng gemcitabin trước hoảc sau khi xạ trị hơn 7 ngảy,_ trừ phản ứng
viêm câp tính do xạ trị Vì vậy gemcitabin có thể khởi đẩu sau khi phản ứng vỉêm cấp tinh của xạ
trị đã hêt hoặc ít nhất 1 tuần sau khi xạ trị
Có báo cảo vế tổn thương do xạ trị trên mô đích (như viêm thực quản, viêm ruột kết và viêm
phổi) liên quan đến việc dùng đồng thời và không đồng thời với gemcitabin.
Các tương tác khác
Vẳc xin điều trị sốt vảng da và các vắc xin phòng bệnh khác không được chỉ định vì ảnh hưởng
nặng tới cơ thế, có thể chết người, bệnh tật, ức chế miễn dịch rõ rảng ở bệnh nhân.
Phụ nữ có thai và cho con bú
Mang thai
Chưa có thông tỉn đầy đủ về vỉệc dùng gemcitabin cho phụ nữ có thai. Nghiên cứu trên động vật
chỉ ra có sự gia tăng độc tinh (xem mục Số liệu an toần tiến lãm sảng). Dựa trên kết quả nghiên
cứu trên động vật và cơ chế tác dụng của gemcitabin, gemcitabin không nên sử dụng trong lủc
mang thai trừ khi thật cần thiết. Phụ nữ không nên mang thai khi sử dụng gemcitabin và nên bảo
ngay cho bảo sỹ điếu trị khi có dẳu hiệu độc tính xảy ra.
Cho con bú
Việc bảì tìết gemcitabin vảo sữa chưa được phát hiện và ảnh hưởng bất lợi đối trẻ đang bú không
thể bảo bỏ. Việc cho con bú phải ngừng khi dùng gemcitabỉn.
S_inh sản
Trong các nghiên cứu về sinh sản, gemcitabín gây chứng giảm tính trùng ở chuột đực (xem mục
Số liệu an toản tiền lâm sảng). Vì vậy, bệnh nhân nam đang điều trị với gemcitabin không nên
có con trong quá trinh điếu trị và 6 tháng sau khi điếu trị, có lời khuyên iỉên quan đến việc bảo
quản lạnh tinh trùng trước khi điếu trị vì gemcitabin có khả năng gây vô sinh
Ảnh hướng của thuốc đến khả năng lái xe và vận hânh máy móc
Chưa có nghiên cứu về ảnh hưởng cùa gemcitabin lên khả năng vận hảnh mảy móc và tảu xe
được tiến hảnh. Tuy nhìến gemcitabin đã được bảo cáo là gây chứng ngủ gả từ nhẹ đến trung
binh, đặc biệt lả khi uống cùng với rượu Trước khi bệnh nhân hết tình trạng ngũ gả không nến
lái xe, điều khiển máy móc
Các tác dụng không mong muốn
Cảc bảo cáo phô biên nhất về tác dụng bất lợi cùa thuốc liên quan đến việc dùng gemcitabin bột
pha tiêm gổm: khoảng 60% bệnh nhân có triệu chứng buồn nôn vả/ hoặc không nôn, tăng
transaminase gan (AST/ALT) vả alkalin phosphatase, khoảng 50% bệnh nhân bị protein niệu và
chứng huyết niệu, triệu chửng khó thở báo cảo ở 10 40% bệnh nhân (ảnh hưởng lớn nhất ở bệnh
nhân ung thư phổi), dị ứng đa phát ban xảy ra ở khoảng 25% bệnh nhân và ngứa ở 10% bệnh
nhân.
Tần số và mức độ nghiếm trọng của tác dụng bắt lợi của thuốc phụ thuộc vảo liếu, tốc độ truyền
vả khoảng cách thời gian gìữa các liếu (xem mục Cảnh báo đặ_c biệt và thận trọng trong sử
dụng). Liều giới hạn tảo dụng bất lợi được giảm theo số lượng tiếu câu bạch câu (xem mục Liều
lượng và cách sử dụng)
-._o
Kết gụả thứ nahiêm lâm sảng
Tân sô được xác định nhu sau:
Rất thường gặp (2 1 ! 10)
Thường gặp(ầ 1 /100 tới < 1 | 10)
Ít gặp (2 1 / 1000 tới < 1 | 100)
Hiếm gặp (2 1 | 10,000 tới < 1 | 1000)
Rất ít gặp (< 1 ! 10,000)
Báng tác dụng không mong muốn và tần số dưới đây dựa trên kết quả nghiên cứu lâm sảng.
Với mỗi nhóm tần số, tác dụng không mong muốn giảm dần mức độ nghiêm trọng.
Hệ thống, cơ quan, tổ chức
Nhóm tần số
Rối loạn máu và hệ bạch huyết
Rắt thường gặp
+ giảm bạch cầu (giảm bạch cầu trung tính
mức 3 là 19,3%, mức 4 la 6%). Ức chế tủy
xương mức nhẹ đến trung bình và hầu như ảnh
hưởng đến số lượng bạch cầu hạt (xem mục
Liều lượng và cách sử dụng)
+ giảm tiếu cầu
+ thiếu mảu
Thường gặp
+ sốt giảm bạch cẩu trung tính
Rất ít gặp
+ tăng tiếu cầu thứ phát
Rối loạn hệ thống miễn dịch
Rất _ít gặp
+ Sôc phản vệ
Rối loạn chuyển hóa dinh dưỡng
Thượng gặp
+ biêng ăn
Rối loạn hệ thần kinh
Thường gặp
+ đau dầu
+ chứng mất ngủ
+ ngủ gả
Rối loạn tìm
Hiểm gặp
+ nhôi máu cơ tim
Rối loạn mạch
Hiếm gặp
+ hạ huyêt áp
Rối loạn hô hấp, ngực và trung thất
Rẵthuòng gặp
+ khó thở (thường nhẹ vả qua nhanh không
cần điều trị)
Thường gặp
+ ho
+ viêm mũi
Ỉt gặp
+ viêm phổi kẽ (xem mục Cảnh báo đặc bỉệt
và thận trọng trong sử dụng)
+ co thẳt phế quản thường nhẹ vả ngắn hạn
nhưng có thế cần đìều trị bằng đường tiêm
Rối loạn dạ dảy — ruột
Rắt thường gặp
+ nôn
+ buổn nôn
Thường gặp
+ ia chảy
+ viêm miệng và loét miệng
+ táo bón
Rối loạn gan
Rất thường gặp
+ tăng transaminase gan (AST vả ALT) vả
alkalin phosphatase
Thường gặp
+ tăng bilirubin
Hiếm gặp
+ tăng gamma — glutamy] transferase (GGT)
Rất thường gặp
+ dị ửng da ban đỏ kèm ngừa
+ rụng tóc
Thường gặp
+ ngứa
+ đổ mồ hôi
Rối loạn da và các mô dưới da Hiếm gặp
+ loét
+ mụn nước và triệu chửng mệt mỏi /
+ đóng vảy W"
Rất it gặp V)
+ dị ứng da nặng gồm tróc vảy và nối bọng
nước
, , Thường gặp
Rôi loạn cơ xương vả các mô liên kêt + đau lưng
+ đau cơ
' , Rất thựờng gặp
Rôì loạn thận và đường tỉêt niệu + huyêt nỉệu
+ protein niệu nhẹ
Rất thường gặp
+ hội chứng giống củm, cảc triệu chứng phố
biển là sốt, đau đẩu, (m lạnh, đau cơ, suy nhược
và chán ăn. Ho, viêm mũi, khó chịu, ra mồ hôi
và khó ngủ cũng được báo cảo.
+ phùÍ phù ngoại biên gổm phù mặt. Phù
Rối loạn toản thân và vị trí tiêm thường hết sau khi ngừng thuốc.
Thường gặp
+ sốt
+ suy nhược
+ ớn lạnh
Hiếm gặp
+ dị ứng ở vị trí tiêm - phần lớn nhẹ
' , Rất thường gặp
Tôn thương, ngộ độc và các biên chửng + độc tinh do xạ trị (xem mục Tương tác với
các thuốc khác và các dạng tương tảc khảc)
Giảm sát thuốc sau khi đưa ra thì trường ( các báo cảo tư Dhát): chưa rõ tẩn suất_gặn nhải (khôna
thể ước tính đươc từ dữ liêu hiên cỏ).
Rối loan hê thần kinh
Tai biến mạch máu não.
Rối loan tỉrn
Loạn nhịp tim, chủ yếu là loạn nhịp nhanh.
Suy tim.
Rối loan mach
Dấu hiệu lâm sảng của viêm mạch ngoại vi và hoại tù.
Rối loan hô hấp. nzưc. trung thất
Phù phổi
Hội chứng suy hô hắp cấp (xem mục Cảnh báo đặc biệt và thận trọng trong sử dụng).
Rối loan da dảv ruôt
Viêm đại trảng do thiếu mảu cục bộ.
Rối loan zan
Độc tính gan mức độ nặng gồm suy gan và từ vong
Rối loan da và các mô dưới da
Phản ửng da ở mức độ nghiêm trọng gồm tróc vảy và nối bọng nước, hội chứng Lyell, hội chứng
Steven-Johnson.
Rối loan thân và đường tiểt niên
Suy thận (xem mục Cảnh báo đặc biệt và thận trọng trong sử dụng).
Hội chứng urê máu tan huyết (xem mục Cãnh báo đặc hiệt và thận trọng trong sử dụng)
Tổn thương nzô đôc vả cảc biến chứng
Cảo phản ứng với tia xạ.
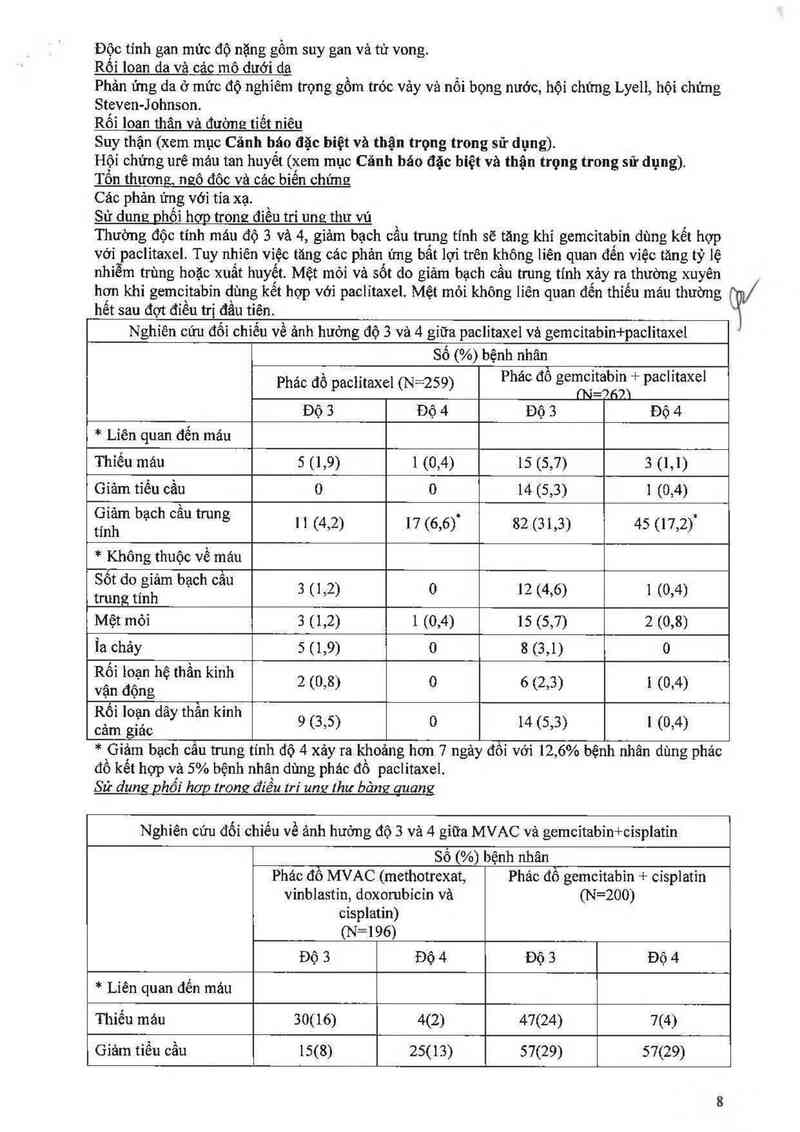
Sứ dung phối hơn trong đìều tri ung thư vú
Thường độc tính máu độ 3 và 4, giảm bạch cầu trung tính sẽ tăng khi gemcitabin dùng kết hợp
Với paclitaxel. Tuy nhiên việc tăng các phản, ửng bất lợi trên không liên quan đển việc tăng tỷ lệ
nhìễm trùng hoặc xuất huyết Mệt mỏi vả sốt do giảm bạch câu trung tính xảy ra thường xuyên
hết sau đợt điều trị đầu tiên.
hơn khi gemcitabín dùng kết hợp với paclỉtaxel Mệt mỏi không líên quan đến thiếu máu thường ql/
Nghiên cứu đối chìếu về ảnh hưởng độ 3 và 4 gíữa paclỉtaxel vả gemcitabin+paclitaxel
sỏ (%) bệnh nhân
' 1 ' : Phác đố gemcitabin + paclítaxel
Phac đô pachtaxel (N 259) (N=f›fflì
Độ 3 Độ 4 Độ 3 Độ 4
* Liên quan đến máu
Thỉếu mảu 5 (1,9) 1 (0,4) 15 (5,7) 3 (1,1)
Gíảm tiểu cầu 0 0 14 (5,3) 1 (0,4)
ỂẶỀ'“ bạ°h °“ trung 11 (4,2) 17 (6,6)` 82 (31,3) 45 (17,2)“
* Không thuộc về máu
Sốt đo giảm bạch cầu
trung tính 3 (1,2) 0 12 (4,6) 1 (0,4)
Mệt mỏi 3 (1,2) 1 (0,4) 15 (5,7) 2 (0,8)
Ìa chảy 5 (1,9) 0 8 (3,1) 0
Rối loạn hệ thẩn kinh
vận động 2 (0,8) 0 6 (2,3) 1 (0,4)
Rôl loụn day than kmh 9 (3 5) 0 14 (5 3) l (0 4)
cảm glac
* Giảm bạch cẩu trung tính độ 4 xảy ra khoảng hơn 7 ngảy đối vởì 12, 6% bệnh nhân dùng phảc
đồ kết hợp vả 5% bệnh nhân dùng phác đồ paclitaxel.
Sử dumz Dhối hơn trong điều tri um,r thư bảng auamz
Nghiên cứu đối chìếu về ảnh hưởng độ 3 và 4 giữa MVAC vả gemcitabìn+cisplatín
Số (%) bệnh nhân
Phác đồ MVAC (methotrexat, Phảc đồ gemcitabỉn + cisplatin
vinblastin, doxorubỉcỉn vả (N=200)
cisplatin)
(N=196)
Độ 3 Độ 4 Độ 3 Độ 4
* Liên quan đến máu
Thiếu máu 30(16) 4(2) 47(24) 7(4)
Giảm tiểu cẩu 15(8) 25(13) 57(29) 57(29)
Không thuộc về mảu
Buồn nôn vả nôn 37(19) 3(2) 44(22) 0(0)
Ỉa chảy 15(3) 1(1) 6(3) 0(0)
Nhiễm trùng 19(10) 10(5) 4(2) 1(1)
Viêm miệng 34(18) 8(4) 2(1) 0(0)
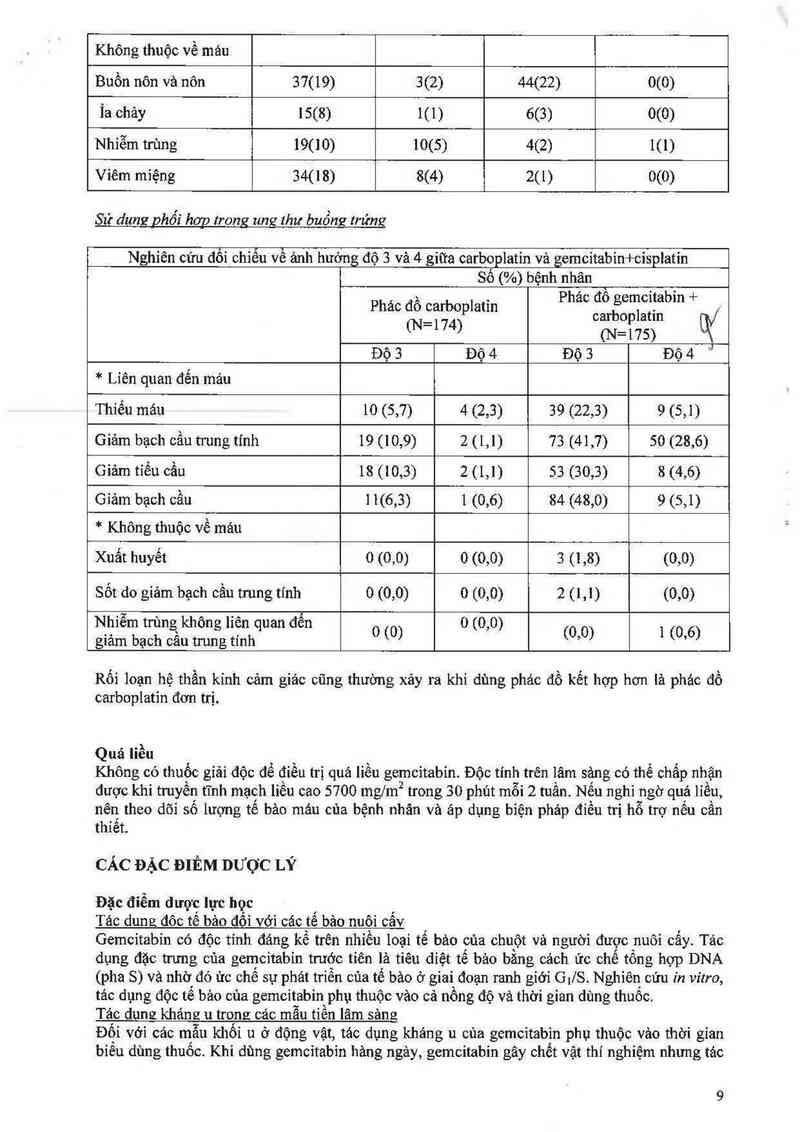
Sử dung Qhối hggg trong ung lhư buồng trứng
Nghiên cứu đổi chiếu về ảnh hưởng độ 3 và 4 giữa carboplatin vả gemcitabin+cisplatin
sỏ (%) bệnh nhân `
Phác ỄỆẸĨr7tỉẳplatin Phác Ểẵẳẳẵẵẵẳbin + W
(N=175)
Độ 3 Độ 4 Độ 3 Độ 4 “'
* Liên quan đến máu
Thiếu máu 10 (5,7) 4 (2,3) 39 (22,3) 9 (3,1)
Giảm bạch cầu trung tính 19 (10,9) 2 (1,1) 73 (41,7) 50 (28,6)
Giảm tiếu cầu 18 (10,3) 2 (1,1) 53 (30,3) 3 (4,6)
Giảm bạch cầu 11(6,3) 1 (0,6) 84 (48,0) 9 (5,1)
* Không thuộc về mảu
Xuất huyết 0 (0,0) 0 (0,0) 3 (1,8) (0,0)
Sốt do gỉảm bạch cầu trung tính 0 (0,0) 0 (0,0) 2 (l,l) (0,0)
…kỉ… … … …» ……
Rối loạn hệ thần kinh cảm giảc cũng thường xảy ra khi dùng phác đồ kết hợp hơn là phác đồ
carboplatin đơn trị.
Quá liều `
Không có thuôo gỉải độc đê điêu trị quá liêu gemcitabin. Độc tính trên lâm sảng có thế châp nhận
được khi truyền tĩnh mạch liều cao 5700 mg/m2 trong 30 phút mỗi 2 tuần. Nếu nghi ngờ quá liều,
nên theo dõi sô lượng tế bảo máu cùa bệnh nhân và áp dụng biện phảp điều trị hỗ trợ nêu cần
thỉết
CÁC ĐẶC ĐIÊM DƯỢC LÝ
Đặc đỉếm dược lực học
Tảo duntz đôc tế bảo đối với các tế bảo nuôi cẳv
Gemcitabin có độc tính đáng kể trên nhỉều loại tế bảo của chuột vả người được nuôi cẳy. Tác
dụng đặc trưng cùa gemcitabin trước tiên là tiêu diệt tế bảo bằng cách ức chế tổng hợp DNA
(pha S) vả nhờ đó ức chế sự phát triển của tế bảo ơ giai đoạn ranh giới GưS. Nghiên cứu in vitro,
tác dụng độc tế bảo cùa gemcitabin phụ thuộc vảo cả nồng độ vả thời gian dùng thuốc.
Tảc dung kháng 11 trong các mẫu tiến lâm sảng
Đối với cảc mẫu khối u ở động vật, tác dụng khảng n của gemcitabin phụ thuộc vảo thời gỉan
biếu dùng thuốc. Khi dùng gemcitabin hảng ngảy, gemcitabin gây chết vật thí nghiệm nhưng tác
dụng khảng u rất it. Tuy nhiên, khi dùng liều cách 3 hoặc 4 ngảy ] lần, gemcitabin ở liều không
gây chết lại có tảc dụng khảng 11 đảng kê trên nhiều loại 11 chuột.
Cơ chế chuvến hỏa tế bảo và tác dung.
Chuyển hóa tế bảo và cơ chế tảo dụng: gemcitabin (dFdC) lá thuốc chống chuyến hóa pyrimidin,
dược chuyển hóa trong tế bảo bởi men nucleosid kinase thảnh điphosphat (dFdCDP) vả
trỉphosphat (dFdCTP) nucleosid hoạt tính. Tảc dụng độc tế bảo của gemcitabin lả ức chế tổng
hợp ADN nhờ cơ chế tác dụng của dFdCDP vả dFdCTP. Đầu tiên, dFdCDP ức chế men
ribonucleotỉd reductasc, lả men duy nhắt xúc tác các phản ứng tạo ra deoxynưcleosỉd triphosphat
(dCTP) để tổng hợp ADN. dFdCDP ức chế men nảy lảm giảm nông độ deoxynucleosid nói
chưng, đậc biệt là nồng độ dCTP nói riêng. Thứ hai lá dFdCTP cạnh tranh với dCTP để gắn vảo
ADN (self-potentiation)
Tương tự, một lượng nhỏ gemcitabin cũng có thể gắn vảo ARN. Như vậy, giảm nồng độ dCTP
trong tế bảo khiến cho việc gắn dFdCT P vảo ADN dễ dảng hơn. ADN polymerase epsỉlon không
có khả năng loại trừ gemcitabin và sửa lại chuỗi ADN đang phát triến Sau đó gemcitabin gắn
vảo ADN, 1 nucleotid nữa gắn thêm vảo chuỗi ADN đang phát trỉến. Sau khi gắn thêm nucleotid
nây sự tổng hợp ADN sẽ bị ức chế hoản toản. Sau khi gắn vảo ADN, gemcitabin thúc đẩy quá
trinh hủy diệt tế bảo theo chương trình định trước gọi lả ”tự hủy diệt“ (apoptosỉs).
Nghiên cứu lâm sản ỦỀ/
Ung thư bâng guang
Một nghiên cứu ngẫu nhiên trên giai đoạn 111 đối vởi 405 bệnh nhân ung thư tế bảo tiến triến
hoặc di căn cho thấy không có sự khác nhau giữa hai phác đồ điếu trị, gemcitabin/cisplatin vả
methotrexatfvinblastinladriamycin/cisplatin (MVAC), thời gỉan trung binh (12,8 và 14,8 tháng
theo thứ tự,p =0 ,547), thời gian bệnh phát triến (7, 4 vả 7, 6 thảng theo thứ tụ, p=O, 842) và tỷ lệ
đáp ứng (49, 4% và 45,7% theo thứ tự, p=0, 512). Tuy nhiên víệc phối hợp gemcitabin với
císplatin có độc tính tốt hơn MVAC.
Ung thư tuv
Trong một nghiên cứu ngẫu nhiên trên giai đoạn 111 của 126 bệnh nhân bị ung thư tụy tiến triến
hoặc di căn, cho thấy gemcitabín có tỷ lệ đáp ứng mang ý nghĩa thống kê về lâm sảng cao hơn 5-
fiourouracil (23, 8% và 4, 8% theo thứ tự, p=O, 0022). Bên cạnh đó khả năng kéo dải một cảoh
đáng kể sự tiến triển cùa bệnh từ 0,9 đến 2, 3 thảng (mức ý nghĩa p<0, 0022) và khả năng kéo dâi
một cách đáng kể thời gỉan sống sót trung bình từ 4,4 đến 5,7 tháng (mức ý nghĩa p
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng