






WAJmmịppzeịnpdưa
Wlmmmp ramuũw
XXXX'-°Nm
uo|snlul 10] 1101111105 10} mpmod
_ 1…16w 88
sepeu1 auịqeuouiag
iõmo uonduosmd XH
BỘYTỂ
1'1 ỡỉuz.ỬẳlzÚ,
|
Rx Prescription Drug!
( Gemcitabine medac
38 mglml
powder for solution for infusion
Rx Preooription Dmg!
Gemcitabine medac
38 mglml -
powder Ior solution for inluelon
Ru P…ptton Drug1
Gemcitabine medac
38 mglml _
powder for solution Ior lnfusion
_ 751( / 112 945 6 /Mĩ/ ;;
CỤC QUẢN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
J....WẾJl
Rx Pmuspuon DNg!
Gemcitabine medac
38 mglml _
powder for solution for lnfusion
Ccmpouidonu
Each via! cnntains
equivalent to 1000 mg Gemcitabine.
Exprhnts:
Mannitol, sodium aoetate tnhydrate.
hydmchloric acid and sodium hydmxide
cmmuc lgont
AclM Ingmdlmt : Gemcitabìne hydrochloride
Mnnưllctunr:
Oncobc Phun: Froduktlon Gth
Am Pharmapark
06861 nasau-Romau. Germany
Product - Ucem hoidu:
Modlc Goulhclutì fũt kllnlưhl
Spulllpriplffl th
Fehlandtstlasse 3. 20354 Hamburg. Germany
For intnunou: uu only
lndication, Conừairdication. Usage and Other
nfcrmations: see the enclosed leaflei
Read the insiructiun Ieallal careluily before use
KEEP OUT OF THE REACH OF CHILDRENI
Slored at Iemperalum below 30°C.
Do not freeze.
Specifìcationz In-house
),,1
Nhap khAu bỏi:
sô Visa VN- ...
Nểucẫníhêm Mngtínaínhỏiỷkz'ếnbócsỹ
Ten thuốc: Gemeiublne medac
Hoạt chẩt : Gemcitabine IOOOmg
Đỏng gói : Hop [ lo bôt dông khô pha liêm
Bùo quân ở nhiệt dô dưới 30°C.
ĐỂ XATÂM TAY TRẺ EM!
Sân xuất bởi: Oncotee Plurmn Pmdnkion GmbH - Đức
Sở Ilũu giíy phép: Mum Geuiluintl m: umun
Spezlslprlpnuíe th - Đức
Lô sx: xxxxxnsẩc dđlmmlyyyy HSD: ddlmm/yyyy
"Chi đinh, Chẩng chi đinh, Cách dùng vè các lhârịg tín khác
xínnem hưởng đỗn súdung kèm llưo "
o .
9 , .
4ẸMA1 —iọ
1 Vial 1vial
\ 1 /
, l
1 _ |
` - 5\ 4072 "
9`0 ÔZ
ợ cỏmẩ w ~;
; 1111'c1+ 11111Ẻ11111'11111111 -ị
* DƯỢC PHÂM *
Tlmảchhỡuodơn BẢCH VIET èõ
ĐọcẸhumquaẫunìdmgfflcớckhidùng 2’ ' \ử
Rx Prascn'ption Drugl
WM: a:chviaơmtúls:
M SlơoutlnmúnbduaửC
,ỂỆ
ặẳẳ
Mmưacmd by
01… Ph… Proúulnhn GmbH
Gemcitabine medac 38 mglml
Powder for nolutlon for infuulon
Am Pharmmai WM n……usw Gummỵ
* " '» 1NOlm
ExỄbhnuz Mmmtoí. sod'um mu mmỈdui. Whric sẫd and …… nmm q 5
Em… InI-oun
m… Cmudnõưim UsueưnOtmhfmndiơm mledusodluh
Rand IM mm… Iuhl mM>ỵ hbu uu KEEF OUT OF TNE RFACH OF CHILDRENI
Pmdu:l Lioemn …
IIdI OOIIhGIỦ lũI Illlliưho SợuIij:w M
Fer _2034 HMMm Geunsw
T huoc bán theo đơn. '
Đọc kỹ hướng dẫn sư dụng trước khi dung
Nếu cẩn thêm thõng tm xin hỏi ý kíển bác sỹ
GEMCITABIN MEDAC
Gemcitabin 1000mg - Bột đông khô pha truyền mm mạch
THÀNH PHÀN
Mỗi [ọ Gemcitabin mcdac ]OOOmg bao gổm:
Hoạt chất: Gemcitabin Hydmchloride tương đương Gemcitabin lOOOmg.
Tả dược: Manitol 1000mg; Sodium Acetate Lrihydrat 103, 5 mg; Sodium hyđroxid vả
Ilydrochloric acid vừa dù dể diều chinh pH.
DƯỢC LỰC
Nhỏm dược lý dỉều trị: nhóm pyrimidine, A ! 'C code: LOIBCOS.
Tác đụng độc lể bâo đổi với các mâu tê bờo nuoi cấy:
Gcmcitabin có độc tỉnh đáng kể đối với nhiếư loại tế bảo khối u cúa người và chuột được nuôi
cấy. Tảo dụng độc tế bảo chnyên hiệt theo pha, ví dụ như (remcitabin chủ yếu tiêu diệt cảc tế
bảo trải qua quá trình tổng hợp ADN (pha-S) vả ở những điều kỉện nhất định, ức chế sự phảt
[riến cùa tế bảo ở ranh giới giữa cảc pha GII'S. Trên in virro, tác dụng gây độc tế bảo cùa
Gcmcitabin phụ thuộc vảo nông độ và thời gian dùng thuốc.
Tác dụng kháng u !rong ca'c mău tiền lảm săng:
Đôi vởi các mẫu khối u động vật, tảo dụng kháng u của Gcmcilabin phụ thuộc phác đồ dùng
thuốc. Khi dùng iiều mỗi ngảy, tỉ lệ lú' vong cùa động vật cao nhưng tác dụng kháng u tối thiếu
củng dược quan sát thắy. 'l'uy nhiện, khi dùng liều mỗi 3 hoặc 4 ngảy, Gemcitabin o liều không
gây chết lại có tảc dụng kháng 11 rất tốt trên nhiều loại u ở chuột. Ấ' Ểt/
Chuyển hóa lế bản vì: cơ chế Iác động: ’L
(` 0 chế hên trong tế háo vả cơ chế tác động: Gemcitabin (dFdC) là một chẳt chong chuyên hóa
pyrimidine, dược chuyền hóa trong nội bảo bởi nucleosidc kinase thảnh nucleoside diphosphate
(dFdCDP) vả triphosphatc (dde IP) Tảc dụng găy độc ct“… Gemcitabin la do sự ức chế quá
trinh tồng hợp ADN thông qua hai cơ chế tảo động nhờ dFd(` DP vả ddeTP Đẩu 1iẽn,dl`dCDP
ức chế ribonuclcotidc rcductasc, yếu tố duy nhẩt xúc tác cho các phản ('mg sân sinh ra
deoxynuclcoửde triphosp_hare (dC TP) cho quá trinh tống hợp ADN Việc ức chế cnzymc nảy
bởi dFdCDP lảm giảm nông dộ cùa deoxynucieoside nói chung vả dC' IP nới riêng I'hứ hai
dFdCTP cạnh tranh với dCTP để gắn vảo ADN
Tương tự, một lượng nhỏ Gemcitabin cũng có thể gắn vảo ARN. Như vậy, giảm nồng đó nội
hảo cùa dCI I’ khiến cho việc gắn dFdCTP vảo ADN dễ dảng hơn Thực chất ADN polymerase
epsiion không thế loại bỏ Gemcitabin vả sừa lại chuỗi ADN dang phải 11~ iêu Sau khi
G_cmcitabin gắn vảo ADN, l nucleotid nữa gản thêm vảo chuỗi ADN dung phát triến. Sau khi
gắn thêm nucleotid nảy, sự tổng hợp ADN thục sự bị ức chế hoản toán. Sau khi gắn vảo ADN,
Gemcitabin thủc đẩy quá trình hùy diệt tế bảo thco chương trinh đinh trước, được gọi lả' 'chết
theo chương trinh".
o`
DUỢC ĐỘNG HỌC
Dược động học của Gcmcìtabin đă được nghien cứu trên 353 bệnh nhân, gổm 121 nữ vả 232
nam tuôi tư 29 dến 79 Trong sơ các bệnh nhân nảy, khoang 45% bị ung thư phoi khõng phải 1ế
bâo nhỏ vè 35% bị ung thư tụy
Khi truyền Ocmcitabin, liều tử 500 2592 mg- ’m2 trong 0 4 — 1.2 giờ, các chỉ số dược động học
ghi nhặn được như sau:
Nồng độ đỉnh trong huyết tương (đạt được khoảng 5 phủt sau khi truyền xong): 3. 2- 45 S
mcglml.
Nống dộ trong huyết lương của thuốc gôc sau khi dùng liếu ] 000 mg/m lớn hơn 5mcgíml
trong xâp xỉ 30 phủt sau khi kết thủc tiếm trưyến, vả > 4 _mcg/ml trong khoảng 1 giờ nữa.
Phân bỏ: Thể tích phân bỏ của kliozmg chính I2 4 L/m đối với nữ vả ]7, 5 L/m2 dõi với nam
(tý iệ khảo biệt giữa người nảy và người khác iả 91 ,.9%) Thế tich phân bố cùa khoang ngoại vi:
47, 4 _1 .Ễfm chí số nảy không thay đồi theo giới tỉnh.
Sự gắn kết protcin huyết tương lá không dáng kế.
'[1iời gian hán hủy: từ 42- 94 phút tùy theo độ tuồi vả giới lính. Với phác đo
khuyên cẩu.) Gemcitabin hầu như được thải trứ hoẻm Loản (rong vòng 5- 1 1 giờ kế từn
truyền. Không có tich 1ũy thuốc khi đùng thuôc moi tuần 1 lần.
Umvến huu.
Gemcitabin được chuyến hóa nhanh chóng tại gan, thận, máu vả các mô khác do 1
dcaminase.
Chuyến hóa nội bảo của (ìcmcitahin (ụo ra Gemcitabin mono, di vả ưiphosphatc (dFđ
đFdCDP dl (1C"1 l’) tmng đó (11` (ICDP vả dFdCTP đuợc xem lá có hoạt tính. Cảc sản phẩm cúa
chuyến hỏa nội bảo nảy không lim thắy trong huyết tucmg hay nước tiếu
Sán phâm chuyền hóa ban đầu 2' -dcoxy-2', 2' dif1uoroưdine (dFdU ) không có hoạt tinh vả tìm
thắy u~_ong huyếl tuong và nước tiểu.
Bc'u' Iiếi.
Độ lhanh thải loản thân: từ 29. 2 L.-’giờlm2 -.92 2 ngiờ/m tùy theo tuối và giới tỉnh (tỷ lệ khác
bìệt gỉũa cảc bệnh nhân 1ả 52,2%) Đô thanh thải ở nữ thấp hơn ở nam khoảng 25%. Mặc dù
được thải nhanh, nhưng độ thanh thải ở nam lẫn nữ hinh như giảm dần theo tuồi. Với liều đề
nghị 1 000 mglml, truyền trong 30 phủt dù độ thanh thái có thắp nhưng cũng không cằn giám
]íếu (cả nam lẫn nữ)
Thải Irừ qua đường tiết niệu: Dưới 10% thuốc được thải trừ ở dạng không thay đồi. li ( /
Độ thanh lluìi ở lhặn: 2- 7 L…Jgỉờfmf. " *
Trong suốt tuần đằu sau khi 11uyên thuốc, 92- 911% iiểu (ìcmcitabìn được phải hiện, 99
trong nước liều, chu yếu ở dạng (114dU và 1% lượng thuốc duợc bải tiết qua phân
ạrơc đông hoc của dFdCTP
dĩ (ICTP có thề tim thấy [rong cảu bạch cẩu đơn nhân“ ơ máu ngoại biên. C’ ac [hong tin sau đây
dề cập đếzn những tế bâo nảy: Nổng dộ trong nội bảo Iảm tãng tỷ lệ với liếu Gemcitabin 35-
350ngn12 tluyền trong 30 phút. cho nổng độ on định từ 04-5mch'ml O nồng độ Gemcitabin >
mcg/ml (hi nông đô dFdC TP không tâng_ đỉễu nảy cho thấy sự hinh thảnh dFdC | P ở các tế bảo
nảy đã bão hòa
Thời gian hún hủy của pha thái trừ cuối củng: 0,7-12 gìờ.
Dum đóng học cu'a dFdU~
Nổng dộ đinh huyết tương (đạt duợc 3- 15 phút sau khi (ruyến 30 phút 1000111g!111Z ): 28-
521110g/1111.Nổ11g (lộ thẳp nhẩt sau liều duy nhât môi tuần 1ả 0 07— 1. 12 mcgiml và không có sự
tích lủy thuốc Đường cong nổng độ hưyết tương so vởi thời gian 1ê1 ba pha, thời gian bán hủy
trung bình pha cuối- 65 gỉờ (3.3- 84 giờ).
1“ y lệ dFdU dược hinh lhânh từ hợp chẩt han đầ11:91-98%
1 hề tich phân bố trung bình cún khoang tlung tâm: 18 L/m2 (11- 12ầ.
Thể tích phân bố ốn dịnh trung binh {V,,)r 151) L'21111 (96- 228 Lim ).
Phản bô tại mô: iất nhiều.
Dụ thunh thải trung bình: 2,5 I.!h/m2 (1-4 Uh/mz).
Thải trừ qua đường tiều: toân bõ
Liéuplụchịiền lr1' phối hơp Gemcilợbin + puclim~l.au~
Điếu trì phối hợp không Ia'1m [hay dối được đông học cùa Gemcitabin hoặc paclitaxei.
Li leu pháp điển lri uhổi hơn Gemcuubin + c~m honíalin
Khi dùng phối hợp với carb0p1atin, dược động học cùa (.ìemcitahin không thay dối.
Bẽnh nẶâf_t_Slgg Iịậr_r;
Suy thận nhẹ đển vừa (GFR từ 30mllphủt 80 mllphủt) không có ảnh hướng đáng kể vả lâu dải
tởi (Scmcitabin
% (rong
cni ĐỊNH
Gemcitabin được chỉ định diếu trị:
- Ung thư bảng quang iiến triến hoặc di cãn. kềt họp vởi cispiatin.
- Ung thư biền mô tuyến tụy tiếnt1iến tại cho hoặc di cẽm
-Kềl hợp vùi cisplnlin [rong điều Lrị dằn tay cho bệnh nhân Ung thư phôi không' phai (ế bản
nhỏ ('N3f '] (.') liến trìẻn tại chỗ hoặc di (:ăn. Gumcitabinc (km 111_ liệu (lược cân nliảc trong diếu
111 cho hệnh nhím lờn tuồi hoặc nh_ững hệnh nhản đzing (1 giai đoạn 2
- Ung llur hiêu nm huống tnhlg. kết hợp v('11 cm bnplatỉn (: nhũng người bệnh tải phải 81… 11 nhất
6 thnng sống khõng bệnh 1ậl sau trị iiệu đầu lay bởi platinum
- Kẻ! hựp với paclitnxcl (liếư trị ung thư vú (1i c~ĩm hoặc iái phả! mả khỏng (hề phẫu 11 ủfflẵõỗĩx_
sau khi (lã tiẽn himh hóa lrị liệu hỗ trợ! tân hỗ trợ Điều trị truớc dó 1|1ường —bu °›Ễmẵ
unthmcycline 11~ừkhi bị chống chỉ định. 1120 W ,
; tu ung … ’_
oi DW: PHÁM .(1
P nịn(nvlặ
”ỦĨ“
LIÊU LƯỢNG vÀ ci(cn DÙNG
Gemcitabine phải (.ược dùng duớí sự huớng dẫn cua bác sỹ có kinh nghíệm điếu (
Liều khuyến cản:
(' nu Ihư bâng guong;
Diêu n~ị phoi họp.
Líểu khuyên cao gemcitabine lả 1000111g7'1m diện tich hề mặt cơ thế, truyền trung 10 phía.
Dùng vản ngzảy thứ 1, 8 vả 15 cũa chu kỳ 28 ngảy kết hợp với cispiatìn. 1.’ lêu khuyến cáo của
Cisplatin lả. 7Di~ngỉm2 vúo ngảy thứ 1 sau khi dùng gemcitabine hoặc va'm ngảy (hử '7 cùa chu ky
28 ngảy 51… đó lặp lại chu kỳ nảy. Giảm liều cùa mồi chu kỳ hoặc trong chu kỳ dựa vảo uũp
dộ cùa dộc- tính ở từng hệnh nhân. Ẩ J /
(_imz Jhưlm: U "
Liều l(huyốn cáo gemcitabine 1000111g5111 diện tỉch bề mặt cơ thể .1~uy ền trong 30 phút. Lập lại
liều mỗi luân trong vùng ’] tuế… sau đó nghỉ ] tuẩn. Các chu kỳ diếu trị tiếp theo 111 1 1ẩm'tuằn
trong 3 tuần liên tiêp của trong chu l(ỳ 4 (uân. Giâm liều mồi chu kỳ hoặc trong chu kỳ ti`w
thuộc vân cấp dộ độc tinh (1 lừng hệnh nhân.
Un _Ihư thỂi thỏng phg'i @ bảo '!ỜQ.
Dưn trị I1'ệu~ Liều khuyến cảo gemcitabine lả 10130ng'111 dicn tich bề mật cơ .hẺ. truyền treng
30 phủt Lạp lại mỗi tuần tmng. 3 tuân, sau đó nghỉ ! tuấn Chu kỳ 4 tuần dược lặp lụi Giảm
líễu (“v rrỗi chu kỳ hoặc Irong chu kỳ tùy lhuộc vảo cấp độ dộc tính ở mỗi bệnh nhân.
Điều írị phối hợp.
Liều khuyến cáo gemcitabine [ả 1"50mg~111z điện tich bề mặt» cơ thể, truyền trong vòng 30 phùt
vác ngảv thư [ và 8 cún chu kỳ điểu trị (21 ngèy). Giâm liếu mỗi chu kỳ hoặc Lrong chu kỳ dụa
vảọ câp độ dộc tính & tfmg bệnh nhân Císplatin được chi đinh vói liếu từ 75 100111g1111 ] mẩn
1 lân.
Img thư v1.1:
Díẽu Iri phỗz' hụp:
Gemcitabine phối hợp vởi puclilaxcl (175111g7'1112 ) duợc ưuyến vảo ngùv thứ 1 (rong 3 giờ. sau
dó (ruyến gemcitahim (1250111ng )tmng 30 phủt vảo ngảy I1u'r 1 vả (hử 8 cùa chu kỳ 21 nơảy.
Giai… liều mỗi chu kỳ hoặc Irung chu kỳ tùy thuộc vảo câp độ độc tinh 0 [ửng bệnh nhân Đêm
hạch cằn hạt tuyệt (lõi it nhắt 1500 (x IDM! ) ưuởc khi bằt đầu diều t1ị gemcitabine 1pnclitaxel
_ Ugg Ihư hụống Irửnp.
Điêu rrị kêl ỈIỰpJ
Gemcitabine kết hợp vời carbnplatin được khuyến cảo như sau: gemcitabine lOOOmgim dùng
vảo ngảy 11111 1 vả lhư B cùa mỗi chu kỳ 21 ngảy , ~.niy(n .1~(111g 30 phủt. Sau gemcitabmc
carboplutìn được dùng vủo ngảy thủ 1 với AUC đich 11'1 4 Omg: ~'.ml ph…. Giám ltểu mồi chu .<ý
hoặc trong chu kỳ tủv thuộc vản cẳp độ dộc tinh của timg bệnh nhân.
Kiềm soát đâu: tính và điêu chinh liểu do đõc tính
Díêu chinh liêu (lo ưỏc Jínlv-khỏng líẽn (Juun đrẽn huyết học:
(`ẩu tiến liên… các xé1 nghiệm sinh 1ý vả kiềm tra chừc nặng gan- -thận dễ phát híện các dôc tính
khùng liên quan dền huyềi học. Giảm 1iều vỏi mồi chu kỳ hoặc trong chu kỳ có [hề (`1y 1111: ộc
vảo câp độ (161: tinh (1 từng bệnh nhân. Nói chung, dối vởi những dộc tinh nặng cắp độ 3-4 trù
buổn nôni',nỏn thi phái ngùng (1íều trị vủi gemcitabine hoặc giâm liếu tùv vảo su (111.111 giả của
cảu hác sỹ. Liều được giám cho đến khí (101: tinh bị loại bỏ theo đánh giá cùa háo sỹ.
Việc đỉễu chinh Iỉều (ùn cispintin. c11 huplalm vả pac1itaxel trong câu dìểu ưị phối hợp, xin
1ham vẩn các Hướng (ỉễưi sủ dụng c11a lhuổc nảy.
.\
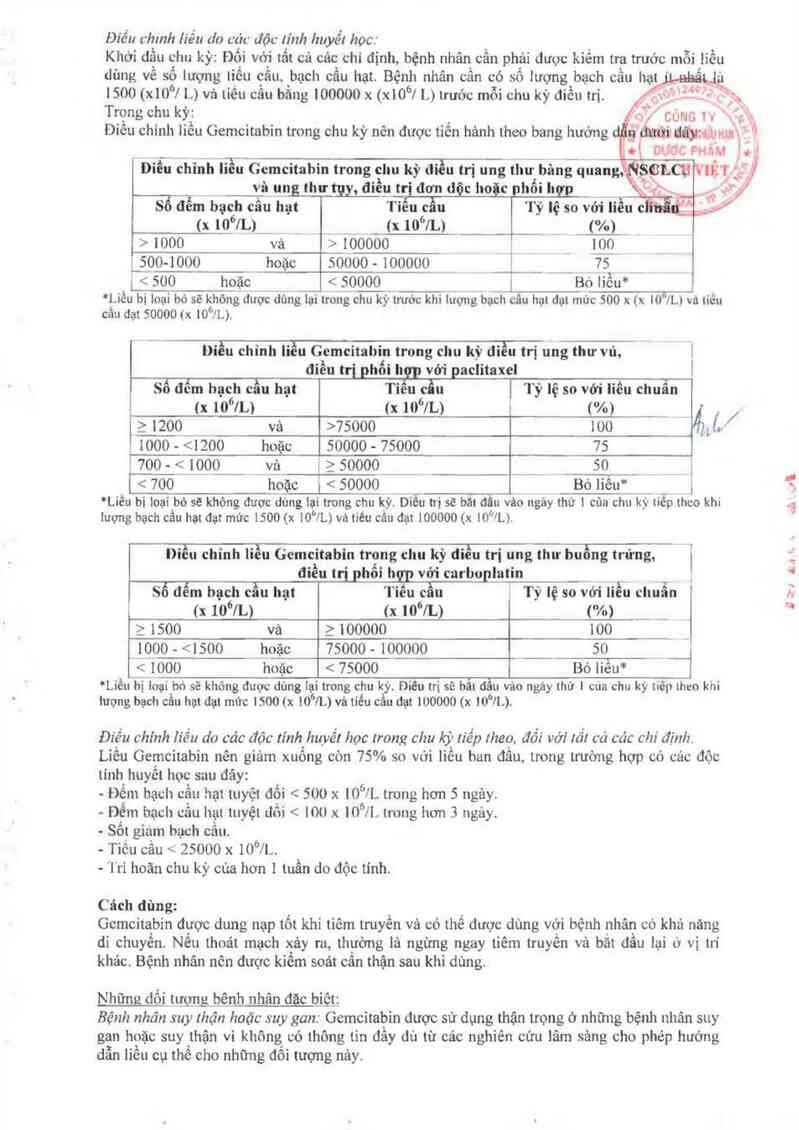
Điếu (rhmh liếu (In cúc đỌ1. lính huyết hoc.
Khớỉ dầu chu kỳ: Đôi vóỵì tất cả cảc chi đinh bệnh nhân_ cần ph_ải đươc kiểm tra truớc mỗi lìề(_1
dùng về số lượng lìếu cằu bạch cầu hạt. Bệnh nhân cần có sô lượng bạch cằu hạt '
1500 (x10°/ L) và tiều cẳu bằng 100000 x (x10°| L) Lruớc mỗi chu kỳ điểu trị
Trong chu kỳ
Điều chinh 1iều Gemcitabin trong chu kỳ nên được tỉến hảnh [heo bang hưởng
Điều chinh líễu Gemcitabin trong chu kỳll (ỉểư trị ung thư bảng quang.
vâ_ un lim tụy, điều trị đơn dộc hoặc phối lnợỵ
Sổ đểm bạch câu hạt Tieuẵu Tỷ lệ so vởiỉều c
(x 10 /L_)_ (x llf'lL) _ (%l
> 1000 và > 100000 _ _ 1_ffl1
_ỉ_00 ]000 hoặc 50000 - 100000 ___ __ 7_5 _
' 1 Am '.
Bệnh nhân lơn lurìi (>- 6 5 tuôi) (icmcitabin được dung nạp tốt ở bệnh nhân nên 65 tuối. Không
có bằno chủng đề kểt luận rằng việc điều chỉnh liều khảc vởi nhũng khuyến cảo chinh liều cho
LấL cả bệnh nhãn, là cằn thiết.
l'rẻ em. Gemcitabin được nghiên cứu trong các nghiên cứu pha I vả II còn hạn chế ở trẻ cm với
các loại khối u khác nhau. Những nghiên cứu nảy không cung cấp đẳy đủ các dù liệu d '
lập về tính hiệu quả vả an toản cùa Gemcitabin 0 trẻ em.
Ịề\\
CHỐNG CHỈ ĐỊNH _ , mm….mẫi H 'LIHL'J"Z
- Nhạy cảm vởi bât kỳ thảnh phản nảo cúa thuôc. p}.
- Phụ nữ đang cho con bủ. 0 BẤCH VIỆT /ỈẸ- i.///
CÁNH BÁO VÀ THẶN TRỌNG
Thời gian Liêm truyền kéo dải và số lấn dùng thuốc tảng được cho lả Iảm tăng độc lính.
Độc tính Ìfuyếl học: Gcmcilabỉn có thể gây ức chế tùy xương với biêu híện giam bạch cầu, [iêu
câu vả thỉêu máu.
Trước mỗi lần sử dụng Gemcitabin bệnh nhân cẳn phải được kiếm tra lượng tiếu cằn, bạch cấu
vả bạch cầu hạt. Ngừng diêu trị hoặc diều chĩnh liều khi xảy ra hiện tuợng ức chế lùy xuơng do
dùng thuốc Tuy nhiên ức chế lùy xương lhường xuất hiện trong thời gian ngắn và không cẳn
gìảm liếu và hiếm khi phải ngL'mg diều trị Đếm máu ngoại bỉên có thể tiếp tục bị gỉám sau khi
kết thúc điểu trị Cần thận uọng khi bắt dầu diều trị cho những bệnh nhân bị ức chế tủy xương
đìều trị. Cũng như các điều trị gây độc lề bảo khác, cần đánh giá nguy cơ ức chế túy do Lỉch lũy
thuốc khi sử dụng Gemcitabin cùng vởi cảc hỏa chất diều lrị khác.
Suy gan Dùng Gemcitabin cho những bệnh nhân bị di căn gan hoặc có tiến sư viêm gun,
nghiện rươu hoặc xơ gan có [hỗ dẫn dến bộ phát suy gan tỉềm ẩn. /
Các xét nghiệm chức năng gan lhận (hao gôm các lest virut) phải đuợc tiến hảnh định kỳ
Cần thận trọng khi dùng Gcmcitabin cho bệnh nhân suy. gan thận vi cảc nghiên cứu lâm sảng
chưa đưa ra được hưởng dẫn đẩy đủ về liều cho những dối tượng nảy.
I.’ :ệu phảp xa Irị đồng lhời. Xạ trị đồng thời (tiên hảnh đồng thời hoặc trong vòng 7 ngảy): độc
tính dã duợc bảo cảo
Tiém chúng ngùa. Vacxin chống sốt vảng da và các văc- xin sống khác không, dược khuy én cảo
cho nhĩmg bẹnh nhản dang diều trị vởi Gemcitabin
'1ím mạch: Do cảc nguy cq tim mạch do dùng Gemcitabin, vi vặy cằn hết sức thận trọng khi
điều trị cho bệnh nhân có tiển sư bệnh tim mạch
Ho hấp. (`ác biến chứng, hô hấp dôi khi nghiêm trọng (như phù phổi. viêm phối kẽ) hoặc hội
chứng suy gỉảm hô hap ở người trưởng thảnh (ARDS) đã được bảo cảo liên quan dến
Gemcitabin 'luy nhiên căn bệnh học của cảc tác dụng nảy vẫn chưa rõ rảng. Nếu những tảc
dụng nảy phảl tríền cần đánh giá vỉệc ngừng điều trị vởi Gemcitabin Tiến hảnh sớm các điều
trị hỗ trợ có thể giúp cải thiện tình hình
T han Cảo kểt quả lâm sảng gìổng vởi Hội chứng tãng urc huyềt dao lản huyết hiếm khi được
bảo cảo ở những bộnh nhân dùng Gemcitabin. Ngừng ngay Gemcitabin khi có nhửng dân hiện
đẩu tiên cùa chứng thiếu mảu tán huyết vi mạch như giảm nhanh haemoglobin cùng với giám
Liều cẩu, Lăng bilir ubin. creatìníne hưyết thanh, urc huyết hoặc I DH.
Su» thận có thể không hồi phục dược cùng với cần dừng điều trị và lọc mảu
Sinh sán: I`mng các nghiên cửu về khả năng sính sản. (ìcmcitabin có thể gây suv giảm khả
năng sinh tinh ở chuột đực Do đó bệnh nhân nam điếu trị với Gemcitabin không nên có con
Irong thời ginn diêu ni bệnh vả 6 tháng sau khi diều trị và nên tìm kiêm sự Lrợ giúp cùa kỹ thuật
bảo quản tinh trùng trước khi diều trị vì khả năng vo sinh du diển trị với Gcmcỉtabin
Bệnh nhân nên hạn chế lượng muối nong chế dộ ăn vì hảm lượng naui có chứa uung mỗi lo
Gemcitabin medac 200mg là 3. 5mg (0.2 mmol).
I úc mang thai và nuôi con bú:
] ủc mang Ihcu'. Không có dữ liệu dẫy dù từ việc sử dụng Gemcitabin ở phụ nữ mang thai. Các
nghiên cứu trên dộng vật đã chi ra độc tính gây suy giảm khả năng sinh sản. Dựa vảo cảc kết
quả từ nghiên cứu trôn dộng vật và cơ chế hoạt động cùa Gemcitabin thì khỏng dược sử dụng
thuốc trong thai kỳ trừ khi thực sự cần lhìết.
Bệnh nhân nữ khỏng nên có con trong Lhởi gian diều trị với ( rcmcưabm vả cằn phái Lhong háo
ngay với bác sĩ nếu diều nảy xảy ra.
Lúc nuôi con bú. Hiện vân chưa rõ Gemcitabin có được bải tiết qua sưa mẹ hay
không thể loại trừ khả năng Lác dụng không mong muốn xảy ra đối với trẻ đang bú
phải ngừng cho con bú trong quá trình điểu trị với Gemcitabin
Ánh huỏng lên khá nãng lái xe vả vận hùnh mãy mỏc: `
Không có nghiên cứu nảo dánh giả về nhũng ảnh hưởng cùa (remcitabin lên khL'L ná Ị_._fflồcỦổẵ ]! TỈ
Lận hảnh máy móc. Tuy nhỉên, (Jancitabin được bảo các lá gây buồn ngủ vả tình ll' ' 4iạmơ, … ` '
dặc biệt khi dùng đồ LLông có chủ cồn. Vì vậy, bệnh nhân cân thận trọng khi lái xe h o `exạw
hảnh mảv móc tơi khi xảc dịnh được là không bị bnồn ngu.
Các dữ liệu an toản tiền lâm săng
Trong các nghiên cửu Iìều iặp lại nong (› tháng ở chuột và cho các kõt quả chủ yếu iâ sụ ức chế
quả ninh tạo huyết phụ thuộc liều vả phảc đồ vả có thể hồi phục được.
Clcmtỉtabill có thể gây đột biến gen trong cảc lcsl dọL biên lrên in vilro vả Lcsl nhầm sinh sản ở
tùy xương trên in vivo. Các nghiên cửu dải hạn dánh gỉả khả năng gây ung thư chưa duợc liển
hảnh. .
Các nghiên cứu sinh sản, Gemcitabin gây giảm khả năng sinh tinh có thẻ hổi phục 0 chuột đực.
Khõng quan sảL thấy bất ký ảnh hưêmg nảo lẽn khả nãng sinh sản cúa chuột cải.
Cảo đánh giá kêL quả Lhí nghỉệm trên động vật đã cho thấy tảc dụng đỌL Lính đối v Ới sinh sản. ví
dụ dị Lật hầm sinh vá cảc anh hưL'mg khác đối với phôi vả thai nhi quá hinh thai nghén hoặc sự
phảt triển Lrước vzì- sau khi sinh
LdỆỹ.
c"~" -L
TY \ề
ẫ,?
LLLLLL um » HUU HửểLF
mjơf; PHẢM o.
TƯỢNG TÁC THLJỔC _ ` , . )( LL
Không có nghiên cứu chi tiêt nảo về tương tác thuôc dược Liên hảnh. ` '
X___a trí:
Xạ trị đồng Ihời (nển hảnh đổng lhới hoặc lrong vờng | "ngziv)- Độc tính Iìên quan đến diều Irị
đa phương thức nảy phụ Lhuộc vảo nhiều yêu Lố. bao gốm liều lượng Gemcitabin Lân suất dùng
Lhuỏc, liLu xạ hị kỹ thuật xạ trị, mô đích và thể tích điêu nị dich.
Cảo nghiên cứu tiên lâm sảng và lâm sảng đã chứng minh rằng Gcmcitabin nhạy bức xạ. [rong
một nghiên cứu dưn, Gemcitabin vởi liều ]000mg/m2 được dùng đồng thời tronu thời gian 6
tuần líên Liếp kết hợp xạ Lrị vùng ngực ở bệnh nhân ung thư phồỉ không phái tế bảo nhỏ dộc
Lính dáng kê lả Liêm niêm mạc nghiêm trọng có khá nãng dc dọa tính mạng dặc biệt lả viêm
thực quản vả viêm mảng phồi được quan sát thấy, đặc biệt xáy ra 0 những bệnh nhân Liểp nhận
lượng bức xạ lớn (thể tích xạ trị tiung hinh là 4 705an J. Cảc nghiên cưu dược liến hủnh sau đó
đã cho thắy Lính khả thi khi dùng Gemcitabin ở liêu thắp hơn kết hợp vởi xạ trị dõng thời vởi
các độc tính có thể dự đoán dược, như ughiên cứu pha 1] trên hệnh nhân ung thư phồi không
phải tế bảo nhỏ liẻn hath xạ trị liều (iớGy cung với dùng Gemcitabin líều (ỏOOmg. m 4 izìn) va
cisplutin (SOmg/mẫ 2 lẩn) Lrong 6 Luần. Phảc đu tối ưu khi dùng Gemcitabin một cảch an Ioản
cùng với xạ trị vân chưa được xác định 0 Lất cả cảc lnại khối u.
Xạ rrị không đồng :hr`n' (dùng lrên 7 ngỏy)- Phân tich cảc dữ iiệu sẵn có không cho thấv bẳt kỳ
độc tinh tăng cường nản khi dùng Gemcitabin trưởc hoặc sau 7 ngảy kể từ ngáy xạ tLị. Cảo dữ
liệu cũng Lợi ý răng Gẹmcítabin có Lhề dược bắt dầu sau khi các độc tính câp do xạ trị dược
loại bỏ hoặc L't nhất 1 tuấn sau khi xạ trị.
Tôn [hương do xạ tri đã đươc báo cáo trên các mỏ dích (ví dụ: viêm thực quản viêm dại trảng
và viêm phoi) liên quan đến cả xạ trị đồng thời vả không dốưg thời với việc sủ dung
Gemcitabin.
Các tươan tác khảct
Không được dùng cảc vắc-xin ngừa sốt vảng da và vắc-xin sống khác trung quả trinh điều trị
với Gemcitabin do có nguy cơ cùa cảu bệnh lý toản thân, nguy hiếm đến tinh mạng đặc biệt ở
những bệnh nhãn suy giảm miễn dịch.
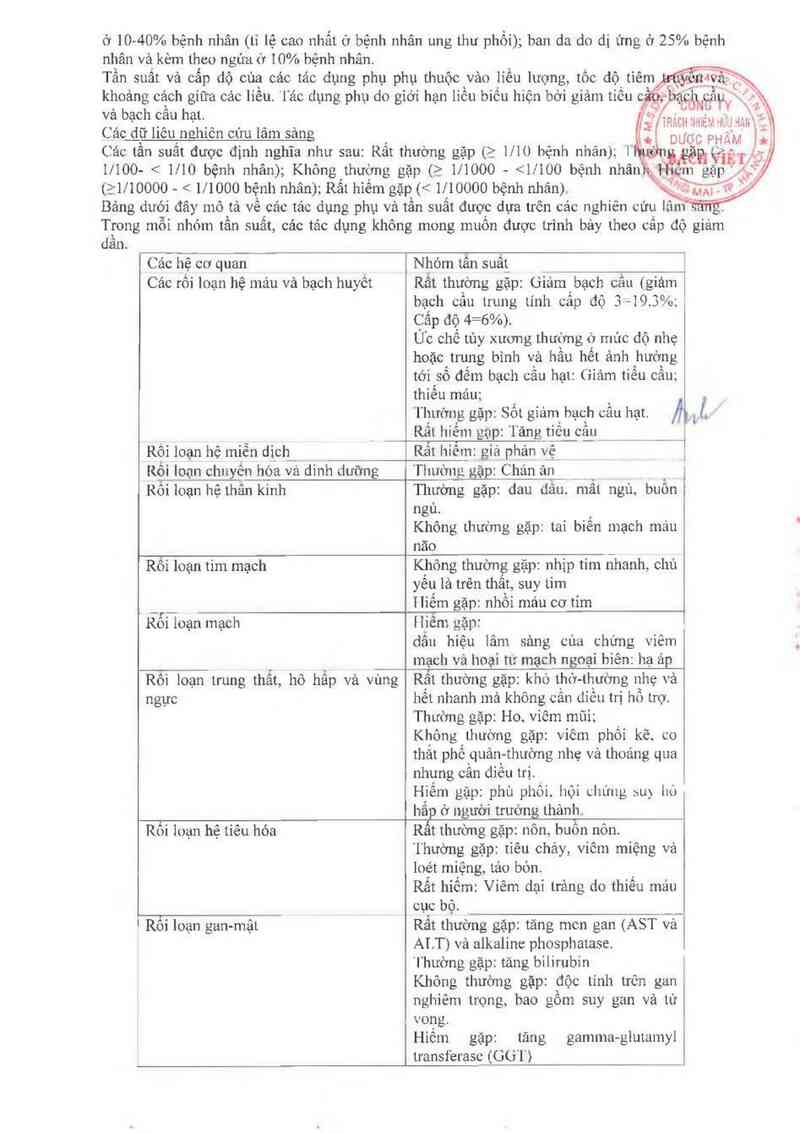
TÁC DỤNG KHÔNG MONG MUÔN _ `
Cảc Tác dụng phụ phổ biến nhắt liên quan tởi đỉổu trị vơi Gcmcitubin bao gôm: buôn nôn kèm
Lhco hoặc không kèm theo nôn tăng men gan (ASI` .'AL l') vả aikalinc phosphalusc. dược h …
cản ơ gần 60% bệnh nhân; protein niệu vả huyết nỉệu được báo cáo ở 50% bộnh nhân; khó thơ
61 10-40% bệnh nhân (tỉ lệ cao nhất ở bệnh nhân ung thư phổi); han da do dị ứng ở 25% bệnh
nhân và kèm theo ngứa U 10% bệnh nhân.
Tằn suất và cấp dộ cùa các tảo dụng phụ phụ thưôc vảo liều lượng, tôc dộ tiêm .
khoảng cảch giữa các liều “lác dụng phụ do giới hạn liều biếu hiện bời giảm tiêu
và bạch cầu hạt
Các _dữ liêu nehiên cún lâm sâng
Các tần suất được định nghĩa như sau: Rất thường gặp (2 1/ 10 bệnh nhân); 1 ; J
1/100- < 1110 bệnh nhân); Không thường gặp (2 111000 ~ <11'100 bệnh nhân , _
(>1/10000 < 1/1000 bệnh nhân); RắL hỉếm gặp (< 1/10000 bệnh nhân). '
Bảng dưới đây mô tả vẽ các tác dụng phụ và tần suất được dựa trên các nghiẽn cứu lâm . .
TL~ong mỗi nhóm tần suất, các tảc dụng không mong muốn duợc trình bảy theo cấp độ giảm
dân.
Cảc hệ cơ quan Nhóm Lân suất
Các rối loạn hệ mảu vả bạch huyết Rẳt thường gặp: Giảm bạch cầu (giảm
bạch câu Lrung Lính cắp độ .›-- -19. 3%;
Cắp độ 4= —6%).
Úc chế Lủy xương lhưởng ở mức dộ nhẹ
hoặc trung binh và hằu hết ảnh hưởng
tới sô đếm bạch cẳu hạt: (ìiâm Liều câu;
thiếu máu;
"thrfmg gặp: Sốt giảm hạch cầu hạt J.
Rẳl hiếm gạp: 'lãng tiêu cầ_u
Rối loạn hệ miễn dich Rất lLiêm: giả phản vệ [
Rối loạn chnyến hóa vá dinh dưỡng ]“huởnp gặp: Chém ản
Rôi loạn hệthân kinh Thường gặp: dau dâu. mẳl ngủ buổn
ngù.
Không thường gặp: Lai biến mạch máu
năo
Rôi loạn tim mạch Không thuùng gặp: nhịp tim nhanh, chủ
yêu là trên thất. suy Lim
_ _ Hiếm gặp' nhồi máu cơ tim
Rỗi loạn mạch I1iềm gặp:
dẩn hiệu lâm sảng cùa chứng viêm
mạch và hoại tư mạch ngoại bìên; hạ ảp
Rôi loạn trung thẩt, hô hấp vả vùng Rẩt thuờng gặp. kho Lhở-Lhường nhẹa vả
ngực hết nhanh mà không cãn diều trị ho trợ
Thưồmg gặp: Ho, viêm mũi;
Không thường gặp: viêm phối kẽ. co
thắt phếguảq-thường nhẹ vả thoảng qua
nhung cãn diêu trị.
Hiểm gặp; phù phỏi. họa du'…g …) L…
hắp ở người trưởng thảnh.
Rối loạn hệ Liên hóa Rất lhường gặp: nôn, buồn nôn.
Thường gặp: tiêu chảy, viêm miệng và
loét miệng lảo bón.
Rẩt hiêm. Viêm dại trảng do thiếu máu
cục bộ _
Rôi loạn gan-mậL Rất thường gặp: tăng mcn gan (AST vả
ALT) vả alkaline phosphalase.
Thường gặp: tăng bilirubin
Không thường gặp: độc Lính Lrẻn gan
nghiêm trọng, bao gồm suy gan và tử
vong.
Hiếm gặp: Lăng gamnm-ghnamyl
Lransferasc (GU'l`)
Rối loạn da và cắc mô dưới d_a Rất thường gặp: phán Ễmg ban da-du '-’_.`_-,
Lâm sèng __… _ _ ___ _____
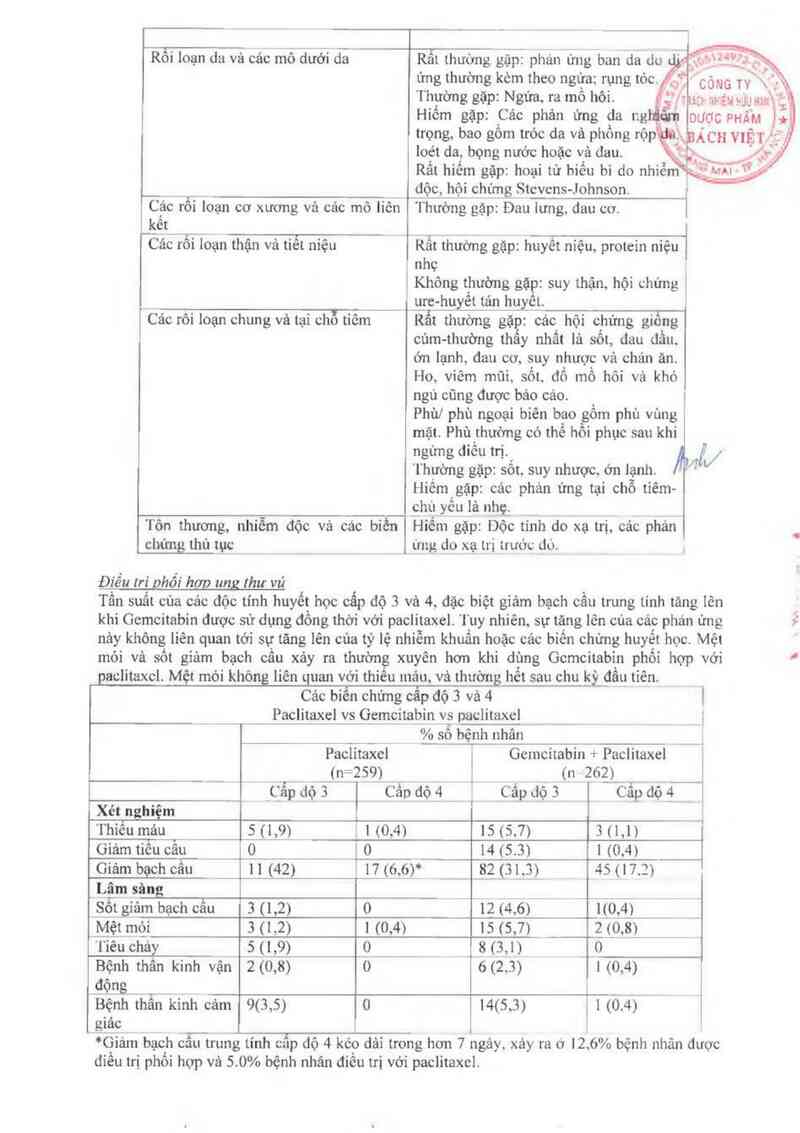
Sốt gỉảm bạch cầu 3 (1,2) 0 12 (4.6) 1(0,4>
Mệt mgi 3 <1,2) 1 (0,4) 15 (s 7) 2 (0,8)
'l`iêu cháy 5 ( 1,9) 0 _ 8 (3,1) ___0
Bộnh thẩn kinh vận 2 (0,8) 0 6 (2 3) I o I4(5,3) 1 38mg/ml vi có thế không cho kểt quả hòa tan hoản
toân.
Đế pha dung dich, từ từ cho một lượng dung dịch thích hợp natri chloride 0 9% lnhư Lrung
bảng duởỉ dây] và lắc dến khi hòa tan.
Dạng dóng gói The tích natri Thế tich sau khi Nông dộ cuồi
chloride (0.9%) pha cùng
200mg 5ml 5,26ml 38 mglml
.!O
\\4
ụ I»
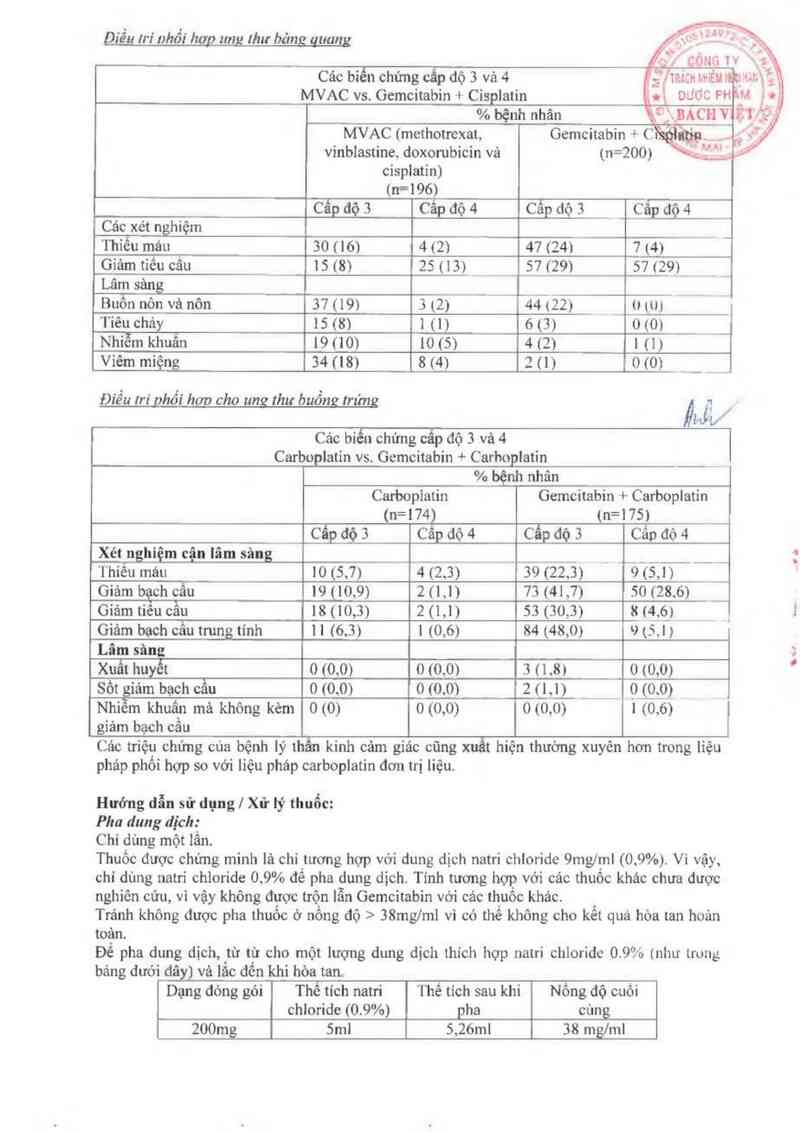
Dựa vảo tỉnh chất hòa tan cùa Gcmc1tabin pha Gemcitabin với nồng độ toi da l` `fng m1.l ,
lrảnh pha thuốc ở nống dộ lớn hơn 40 mglml vì có thể thuốc không được lu“… ta… ìEc _Ệga’ujĩỉỉỆ T f ) f =
Đế pha thuốc thêm it nhất lả 5 111] Natri chlọridc 0. 9% vảo lọ 200 mg vả ít nhất Míl' fflrÝ—u `”"Ề
chloride 0, 9% vảo l_ọ ] g. Lắc dế hòa tan thuốc ' ’, mgc’c M ^.“ _'
Thuốc đã p_ha có thể đuợc pha loãng thêm nữa bằ_ng dung dịch Naui chloride 0 9%. c_\ÙẤCB VIỆĨ'Ề
Kiêm tra bẵ_ìng mắ_t đung dịch trước khi tiêm truyền xem có bất thường nản không ' `\ " ~`Y
Loại bỏ phỈm thuũc còn du
Sử dụng bao tay cao su khi dùng thuốc. Nếu thuốc tiếp xúc với da hoặc mô ngay lập tức phải
1t'ra với rất nhỉều nước vả xả phòng. Nên cãn nhắc các phương pháp thích hợp dề xử lý và hủy
bỏ các thuốc chống ung thư.
QUẢ ] mu
Không có thuốc giải độc để đìểu trị quá liều Gemcitabin. Độc tính của thuốc trén lâm sảng chấp
nhận được khi dùng từng liều đến 5_ 7 g,]…2 truyền tĩnh mạch trong 30 phủt mui 2 tuấn. Khi nghi
ngờ quá liều. nên theo dõi số lượng tế bảo máu của bệnh nhân. '[iêu hảnh các hicn pháp đỉều trị
hỗ uợ cho bệnh 11hân khi cần thiết
TÍNH TU'O'NG sz ẨnẮ/
Không có tương kỵ gìũa cảc thảnh phần của thuốc.
ĐÓNG GÓI VÀ BẢO ỌUẢN
]Iộp ] lọ bột đông khô pha tiêm
Báo quản thuốc ở nhiệt dộ không quá 300C
Tính chất lý hóa của dung dich dược chưng minh có thể ổn dinh trong vòng 35 ngảy nếu bản
quản 41 ’25 C.
111y nhiên, dung dịch sau khi pha dược sử dụng tốt nhẫt trong vòng 24 giờ ở 25“C.
Để xa tẩm tay trò cm!
HẠN DÙNG: 3 năm kể từ ngảy sản xuất. Không dùng thuốc khi quá hạn sử dụng.
TÌỄU CHUẨN: NSX.
NHÀ SẢN XUẤT:
Oncotcc Pharma Produktion GmbH
Am Pharmapark, 06861 Dessau-Roblau, Germany
NHÀ sở HỮU GIẤY PHÉP:
Medac Gesellscha_ft fur klinische Speziatp1 aparatc mbH
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng