






—\
CỤC QUẢN LÝ DƯỌC
ĐÃ PHÊ DUYỆT
Lãn đâuzẵỡĨ… .Z/j/ờĨỄ.
BỘYTẾ
K…mm awo an
…Muw am°m
xxxx °N …
uqnnm m; uouugol m nợma
h/eWo/Uĩ/W—
cn Jj
l…le et:
aepeut au;qeuouseg
SOMJ uuođumzd xu /
Rx P…NonDnnt Ri Wnửw! Rx P…bttmữw! Rx Wũuot
Gemcitabine medac Gemcitabine medac Gemcitabine medac Gemcitabine medac
38 mglml 38 mglml
38 mglml
38 melml
powdnr tot lolution for infuuion pơwdor lot tolulion bt inlmion powder for solution íor intmion powder lot sotutlon for inludon
Oem `om Wm~ Forlntllms un W
Eađn …: mns OHW m… PMMM GmbH lndeainn c…umm UsmeơmOlhư
Actlu _ ." , MtỄ' infơnmonszsaelhemmodleđld
mun … zou mg Gemunm 0861 DmưRoũau. Gmw Resd im mm… Mu …… mm … _ ,
Exeipienư Mbqum_ xsenomonnenamoccmnmm 1 _/
Nammd sndưn aodats mhyửate, … Guouưhlt … utinhcm Stơedlt tmpơatua mm . V
nyơnơimc nơ mu sodum hyđonft WIlMPIMG mbH Do mt Im:
. 3, … Phrmưg , ~ Mm²
w…e qunt
1 vì:! 1 vhl
/ \ /
Thủ: Mn thm dơn
Đọc kỹ huư'vg dẫn sửdụng mưúc Uu’
Nh cdn rhbn thdng ưu xui hỏi ý bén
Ten llmấc : Gemthth Mth
Hoạt chất : Oemcitabine 200mg
Dớnggúì : Hôp ] lobôt asngkhsphnsan
Bia quin ở nhiệt mạ duỏi so~c.
ĐỆ XATAM TAYTRẺ EMI
Spnhlprlpznle nhH - Dứt
Nhập khẩu bời :
Số Visa: VN ~ .. ..............
Sin xuii bai: o…m n…… Pmduldm c…… . m:
Sở hửu giấy phép: Mcdnc Genelhdnh IIIr inniưhe
.ner
` hưụzìnllUiMnìhữC '
…lìy
m…n—h-m-w
lnmffltũmamu—ụ
e medac 38 mơml
uc |
W'WMSỦIÙWIAMHMỜI
nmu —* an. nn-
lỦúíl.Củlú_.khịdlủdn_í IuQn…bủ
BullnuunnhtduMldnnn IEDMƯYIGWƯW
bò SX: XXXXX NSX: ddlmmlyyyy HSD: ddlmm/yyyy
“Ch! dlnh Chóngch! dmh. Cách dừng M các … tm khác
xmwnủủngdẳuữdungluèmthm"
hủ_l : …
mu -um mm
— Mulfih MM WỤImIQ _M
M…: umn-nụG—n
Thuốc bán theo đon!
Đọc kỹ hưởng dẫn sử dụng trước khi dung
Nếu cân thêm thông tin xin hỏi ý kiến bác sỹ.
GEMCITABINE MEDAC
Gemcitabine 200mg — Bột đông khô pha tiêm
THÀNH PHÀN
Mỗi lọ Gemcitabin medac 200mg bao gồm:
Hoạt chất: Gemcitabin Hydrochloride tương đương gemcitabin 200mg.
Tả dược: Manitol 200mg; Sodium Acetate trihydrate 20, 73 mg; Sodium hydroxid vả
Hydrochloric acid vừa dù dể diều chinh pH.
DƯỢC LỰC
Nhóin dược 1ý điều trị: nhóm pyrimidine, ATC code: LOl BCOS.
Tác dụng độc tế bảo đối với các mâu tế bảo nuôi cầy:
Gemcitabin có độc tính đáng kể đối với nhiều loại tế bảo khối u cùa ngưòi và chuột được nuôi
cấy. Tảc dụng độc tể bảp chuyên biệt theo pha, ví dụ như gemcitabine chủ yếu tiêu diệt cảc tế
bảo trải qua quá trình tồng hợp ADN (pha- S) và ở những điều kiện nhất định, ức chế sự phát
triến của tế bảo ở ranh giởi giữa cảc pha Gl/S. Trên ín vitro, tảc dụng gây độc tế bảo cưa
gemcitabine phụ thuộc vảo nông độ và thời gian dùng thuốc. [
Tác dụng kháng u trong các mâu tiền lâm sảng. M ²/
Đối với các mẫu khối u động vật, tác dụng khảng u cùa gemcitabine phụ thuộc phác đồ dùng
thuốc. Khi dùng liều mỗi ngây, tỉ lệ tử vong của động vật cao nhưng tác dụng khảng u tối thiếu
cũng được quan sảt thấy Tuy nhiên, khi dùng liều mỗi 3 hoặc 4 ngảy, gemcitabine ở liếu
không gây chết lại có tảc dụng khảng u rất tốt trên nhiếư loại u ở chuột
C huyen hóa tế bảo và cơ chế tác động:
Cơ chế bên trong tế bảo và cơ chế tảc động: Gemcitabine (dFdC) lả một chât chống chưyên hóa
pyrimidine, được chuyển hòa trong nội bảo bởi nucleoside kinase thảnh nucleoside diphosphate
(dFdCDP) vả triphosphate (ddeTP). Tảc dụng gây độc cua gemcitabine la do sự ức chế quá
trình tông hợp ADN thông qua hai cơ chế tác động nhờ dFdCDP vả ddeTP. Đầu tiên, dtdCDP
ức chế ribonucleotide reductase, yểu tố duy nhất xúc tảc cho các phan ứng sán sinh ra
deoxynucleoside triphosphate (dCTP) cho quá trình tống hợp ADN. Việc ức chế enzyme nảy
bởi dFdCDP lảm giảm nồng độ cùa deoxynucleoside nói chung và dCTP nói riêng. Thứ hai,
dFdCTP cạnh tranh với dCTP để gắn vảo ADN.
Tương tự, một lượng nhỏ gemcitabine cũng có thể gắn vảo ARN. Như vậy, giám nồng đó nội
bảo cùa dCTP khiến cho việc găn dFdCTP vảo ADN dễ dảng hơn. Thực chẳt ADN polymerase
epsilon không thể loại bỏ gemcitabine và sửa lại chuỗi ADN đang phảt triền. Sau khi
gemcitabine gắn vảo ADN, ] nucleotide nữa gắn thêm vảo chuỗi ADN đang phảt triền. Sau khi
găn thêm nucleotide nảy, sự tồng hợp ADN thực sự bị ức chế hoản toản Sau khi gắn vảo ADN,
gemcitabine thủc đấy quá trình hủy diệt tế bảo theo chương trình dịnh trưởc, được gọi lả' 'chết
theo chương trinh".
DƯỢC ĐỌNG HỌC
Dược động học cùa gemcitabine đă được nghiên cứu trên 353 bệnh nhân, gồm 121 nữ và 232
nam tuôi từ 29 đến 79 Trong sô các bệnh nhân nảy khoảng 45% bị ung thư phối khỏng phải tế
bảo nhỏ và 35% bị ung thư tụy.
Khi truyền gemcitabine, liếu từ 500- 2, 592 mg/m2 trong 0, 4 1,2 giờ, các chi số dược dộng học
ghi nhận dược như sau:
Nồng độ dinh trong huyết tương (đạt được khoảng 5 phút sau khi truyền xong): 3, 2- 45,5
mcglml.
Nồng độ trong huyết tương cùa thuốc gốc sau khi dùng liều ] 000 mg/m2 Iởn hơn Smcg/ml
trong xâp xỉ 30 phủt sau khi kết thúc tiêm truyền, vả > 4 2mcg/ml trong khoáng ] giờ nữa.
P_h__ân bố: Thể tích phân bố cùa khoang chính: 12,4 L/m2 đối với nữ và 17, 5 U…2 đôi với nam
(tỷ lệ khảo biệt giữa người nảy vả người khác là 91 ,.9%) Thể tích phân bố của khoang ngoại vi:
'~ ửa`.
!f›j
47,4 L/mz, chí số nảy không thay đổi theo giới tính.
Sự găn kết protein huyết tương lá không dảng kế.
Thời Igian bán hùy: từ 42- 94 phút tùy theo độ tuối vả giới tính Với phác đồ
khuyến cảo, gemcitabine hầu như được thải trừ hoản toản trọng vòng 5-1 1 giờ kế t
truyền. Không có tích lũy thuốc khi dùng thuốc mỗi tuần ] lần.
Chuvẻn hóa:
Gemcitabine được chuyến hóa nhanh chóng tại gan, thận, mảu vả cảc mô khác do men c
deaminase
Chuyền hóa nội bảo của gemcitabine tạo ra gemcitabine mono, di, vả triphosphate (dFdCMP,
dFdCDP, dFdCTP) trong đó dFdCDP vả dFdCTP được xem là có hoạt tính. Cảc sản phẳm cùa
chuyên hóa nội bảo nảy không tìm thấy trong hưyết tương hay nước tiếu.
Sản phẩm chuyến hóa ban đầu 2'- deoxy- 2' 2' difiuoroudine (dFdU) không có hoạt tính vả tìm
thấy trong huyết tương và nước tiểu.
B__ải líết
Độ thanh thải toản thân: từ 29,2 L/giờ/m² - 92,2 LJgiờJm² tùy theo tuổi vả giới tinh (ty lệ khác
biệt giữa các bệnh nhân lả 52,2%). Độ thanh thải ở nữ thấp hơn ở nam khoảng 25%. Mặc dù
được thải nhanh, nhưng độ thanh thải ở nam lẫn nữ hinh như giảm dần theo tuồi. Với liều đề
nghị 1.ooo mglm², truyền trong 30 phủt dù độ thanh thải có thấp nhưng cũng không cần giảm
liếu tcá nam lẫn nữ).
Thải trừ qua đường tiểt niệu: Dưới 10% thuốc được thải trừ ở dạng không thay đổi. /ịWỤ/i
Độ thanhthải ở thận: 2-7 L/giờ/m².
Trong suôt tuấn đầu sau khi trưyền thuốc, 92-98% liếu gemcitabine được phát hiện, 99% trong
trong nước tiếu, chủ yếu ở dạng dFdU và 1% iượng thuốc được bải tiết qua phân.
Dươc đông hoc của dFdCTP.
dFdCTP có thể tìm thấy trong các bạch cằu đơn nhân ở máu ngoại biên. Các thông tin sau đây
đề cập đến những tế bảo nảy: Nồng độ trong nội bảo lảm tăng tỷ lệ với liếu gemcitabine 35-
350mg/m2 truyện trong 30 phút, cho nồng độ ổn định từ 04- -Smcg/ml. Ở nồng độ gemcitabine
> mcg/ml thì nông dộ dFdCTP không tăng, điếu nảy cho thấy sự hinh thảnh dFdCT P 0 các tế
bảo nảy đã bão hòa.
Thời gian bản hùy cùa pha thải trừ cuối cùng: 0,7—12 giờ.
Dươc đông hoc của dFdU.
Nồng độ đỉnh huyết tương (đạt được 3— 15 phút sau khi truyền 30 phút 1000mg … 2:) 28-
52mcg/ml Nồng độ thấp nhất sau 1iếu duy nhất mỗi tuần lả 0.07-1 12 mcg/ml và không có sự
tích lũy thưốc. Đường cong nồng độ huyết tương so với thời gỉan lả ba pha, thời gian bán hùy
trung bình pha cuôi- -65 giờ (33- 84 giờ).
Tỷ lệ dFdU được hinh thảnh từ hợp chất ban đầu: 91 -.98%
Thế tỉch phân bố trung bình của khoang trung tâm: 18 1 m2 (1 1 122).
Thể tích phân bố on định trung bình (Vss): 150 L/m2 (96- 228 le2 ).
Phân bố tại mô: rất nhiều
Độ thanh thải trung bình: 2, 5 L/h/m2 (1-4 L/h/mz).
Thải trừ qua đường tiếu: toản bộ.
Líêu pháp điều rri phối hơp Gemcitabine 4 paclitaxel:
Điếu trị phối hợp không lảm thay đồi được động học của gemcitabine hoặc paclitaxel.
Liêu pháp điều tri Dhốì hơn Gemcitabine + carboplatin:
Khi dùng phối hợp với carboplatin, dược động học của gemcitabine không thay đôi.
Bênh nhân suv thân: '
Suy thận nhẹ đến vưa (GFR từ 30m1/phút — 80 ml/phút) không có ảnh hưởng đáng kê vả 1âu dải
tới gemcitabine
cnỉ ĐỊNH
Gemcitabine được chỉ định điếu trị:
- Ung thư bảng quang tiến triến hoặc di cản, kết hợp với cisplatin.
- Ung thư biếu mô tuyến tụy tiến triển tại chỗ hoặc di căn
" CÔNG tvix.
. qugưiiihhihi
ợỡầẺH AAM .-
ỉ'G MAi- ẨỸ
“ Ìh,’ » ,'
— Kết hợp vởi cisplatin trong điếu trị đầu tay cho bệnh nhân Ung thư phồi không p}Ặ5 ễỂ C \
nhỏ (NSCLC) tiến triên tại chỗ hoặc di cản. Gemcitabine đơn trị liệu được cân nhắ ctấzìịzirtgcềfiỉỆtlTY \ L ,
trị cho bệnh nhân lởn tuổi hoặc những bệnh nhân đang Ở giai đoạn 2 EỊWCHVH1EWƯỰHỂN
- Ung thư biếu mô bưồng trứng, kết hợp vởi carboplatin ở nhũng người bệnh tái ph ỀhuW'iihzft' 1ẦM
6 thảng sống không bệnh tật sau trị liệu đầu tay bởi platinum. ` BACH VĨỂỆỊ ~Ổ
~ Kết hợp vởi paclitaxel điếu trị ung thư vú đi cản hoặc tải phảt mả không thế phẫu th CV Cgtùhợqọ / "
sau khi đã tiến hảnh hóa trị liệu hỗ trợ/ tân hỗ trợ Điếu trị trước đó thường đã ba "
anthracycline trừ khi bị chống chỉ định.
/
ỊW
LIÊU LƯỢNG VÀ CÁCH DÙNG
Gemcitabine phải được dùng dưới sự hướng dẫn của bảo sỹ có kình nghiệm điếu trị ung thư
Liều khuyến cáo:
Ung thư bảng auang:
Điêu tr _: phối hợp.
Liều khuyến cáo gemcitabine lả IOOOmg/m2 diện tích bề mặt cơ thế, truyền trong 30 phút
Dùng vảo ngây thứ 1, 8 vả 15 cùa chu kỳ 28 ngảy, kết hợp với ciSpiatin. Liều khuyến cáo cùa
Cìsplatìn lả 7Omg/m2 vảo ngảy thứ 1 sau khi dùng gemcitabine hoặc vảo ngảy thứ 2 cưa chu kỳ
28 ngảy. Sau đó lập lại chu kỳ nảy. Giảm liếu của mỗi chu kỳ hoặc trong chu kỳ dựa vảo cấp
độ của độc tính ở từng bệnh nhân. 41 )” /,
Ung ĩhư luỵ 1 l’
Liều khuyến cảo gemcitabine lOOOrng/m2 diện tích bề mặt cơ thế, truyền trong 30 phút. Lặp lại
liều môi tuân trong vòng 7 tuần, sau đó nghỉ 1 tuần Các chu kỳ điếu trị tiêp theo 1ả ] Iằtưtuần
trong 3 tuần 1ỉên tiếp cùa trong chu kỳ 4 tuần. Giảm liếu mỗi chu kỳ hoặc trong chu kỳ tùy
thuộc vảo cẳp độ độc tính ở từng bệnh nhân.
Ung thư phối không phải tế bảo nhỏ
Đơn trị liệu: Liều khuyến cáo gemcitabine lả 1000ngm diện tích bề mặt cơ thể truyền trong
30 phút. Lặp lại mỗi tuần trong 3 tuân, sau đó nghi 1 tuần Chu kỳ 4 tuần được lập lại Giảm
liếu ở môi chu kỳ hoặc trong chu kỳ tùy thuộc vảo câp độ độc tính ở mỗi bệnh nhân
Điều n _1 phối họp:
Liều khuyến cáo gemcitabine lả 12SOmg/m2 diện tích bề mặt cơ thế, truyền trong vòng 30 phủt
vảo ngảy thứ 1 vả. 8 cùa chu kỳ điếu trị (21 ngây) Giảm liếu mỗi chu kỳ hoặc trong chu 2ky dựa
vảo câp độ độc tính ơ từng bệnh nhân Cisplatin được chỉ định vởi liếu từ 75- —'2100ngm 3 tuần
1 lần.
Ung thư vú:
Đỉều trị phối họp.
Gemcitabine phối hợp với paclỉtax²el ( 175mgfm 2) được truyền vảo ngảy thứ 1 trong 3 giờ, sau
đó truyền gemcitabine (1 2SOmg/m2 ) trong 30 phút vảo ngảy thứ1vảthứ 8 cùa chu kỳ 21 ngảy
Giảm liếu môi chu kỳ hoặc trong chu kỳ tùy thuộc vảo câp độ độc tính ở từng bệnh nhân. Đẻm
bạch cầu hạttuyệt đối ít nhất ]500 (x ]06/L) trưởc khi bắt đầu điếu trị gemcitabine+paclitaxeL
Ung lhư buồng trứng:
Đỉếzz trị kết hợp.
Gemcitabine kết hợp vởi carboplatin được khuyến cảo như sau: gemcitabine 1000ngm dùng
vảo ngảy thứ 1 và thư 8 của môi chu kỳ 21 ngảy, truyền trong 30 phi'it. Sau gemcitabine,
carboplatin được dùng vảo ngảy thứ 1 vởi AUC đich là 4. Omngm1 phút Giảm liếu môi chu kỳ
hoặc trong chu kỳ tùy thuộc vảo cấp độ dộc tính của từng bệnh nhân
\'Ịvẵíỹêrc… J.rả%zl
Kiểm soát đôc tính vả điều chỉnh Iỉết_t do đôc tính
Đíểu chmh ]iểu do độc tí—nh —không liên quan đến huyết học
Cần tiến hảnh các xét nghiệm sinh lý và kiếm tra chức năng gan- t-hận đề phát hiện cảc độc tính
không liên quan đến hưyết học Giảm lìếu với mỗi chu kỳ hoặc trong chu kỳ có thể tùy thuộc
vảo câp độ dộc tính ở tưng bệnh nhân. Nói chung, đối vởi những độc tính nặng cắp độ 3 —,4 trừ
buồn nônlnôn, thì phải ngừng điếu trị với gemcitabine hoặc giảm liếu tùy vảo sự đánh giá của
các bác sỹ. Liều được giảm cho đến khi độc tính bị loại bỏ theo đảnh giả của bảc sỹ
Việc điều chỉnh liếu cùa cisplatin, carboplatin vả paclitaxel trong cảc điếu trị phối hợp xìn
tham vắn cảc llướng dẫn sử dụng cùa thuốc nảy
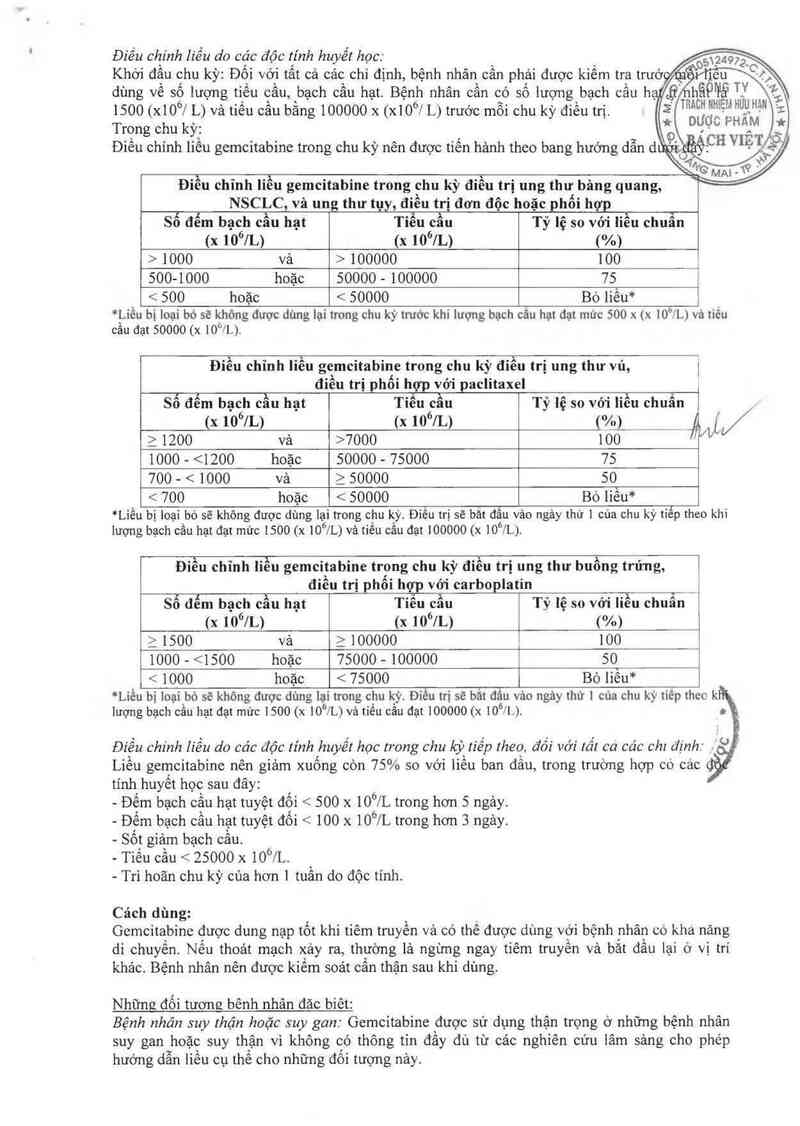
Điếu chinh liều do cậc độc tính huyết học: 05124ọ 72
Khởi đâu chu kỳ: Đôi với tât cả cảc chỉ định, bệnh nhân cần phải được kiếm tra trướ iC
dùng về số iượng tiếu cầu, bạch cầu hạt. Bệnh nhân cần có số lượng bạch cầu h_ ,Ẹ' hẫP’i'ẫ’ . .
1500 (x10°J L) vả tiếu cầu bằng 100000 x (xiofv L) trước mỗi chu kỳ điều trị. 5“ TR^°H NH1Ẹ'^HƯEHẬN “=
Trong chu kỳ: * DƯỢC PHAM *
Điếu chỉnh liếu gemcitabine trong chu kỳ nên được tiến hảnh theo bang hướng dẫn d
Điều chỉnh liều gemcitabine trong chu kỳ điếu trị ung thư bảng quang,
NSCLC,vả ung thư tụy, điều trị đơn độc hoặc phối hợp
Số đếm bạch cầu hạt Tiểu cầu Tỷ lệ so vởi lỉều chuẩn
(x 10°JL) (x 106/L) (%)
› 1000 vả › 100000 100
500-1000 hoặc 50000 - 100000 75 ĩ
< 500 hoặc < 50000 Bò liều* j
*_Liều bị loại bỏ sẽ không dược dùng lại trong chu kỳ trước khi lượng bạch câu hạt đạt mức 500 x (x lO'f’L) vả tiếu
câu đạt 50000 (x IO“JL).
Điều chỉnh liều gemcitabine trong chu kỳ điều trị ung thư vú, ]
đỉễu trị phối hợp với paclitaxel ,
Sổ đễm bạch cầu hạt Tiếu cầu Tỷ lệ so với liều chuẩn 1
(x 10°JL) (x 10°JL) 1`VeL _ M/
ì 1200 và >7000 100
1000 — <1200 hoặc 50000 - 75000 75
700 - < 1000 Và 2 50000 50
< 700 hoặc < 50000 Bỏ lỉếu*
“Liều bị ioạỉ bó sẽ không được dùng lại trong chu kỳ. Đỉếu trị sẽ bắt đầu vảo ngảy thứ 1 cùa chu kỳ tiếp theo khi
lượng bạch cầu hạt đạt mức 1500 (x iO°JL) vả tiêu câu đạt 100000 (x lOỐ/L).
Điều chĩnh liều gemcitabine trong chu kỳ điều trị ung thư buồng trứng, 1
điều trị phối hợp với carboplatin .
Sổ đểm bạch cầu hạt Tiểu cầu Tỷ iệ so với iỈêu chuẩn
(x 10°JL) (x 10°JL) «%>
2 1500 vả ì 100000 ; 100
1000 - <1500 hoặc 75000 — 100000 ị 50
< 1000 hoặc < 75000 | Bỏ liếu*
”Liều bị loại bỏ sẽ không được dùng lại trong chu kỳ. ĐỄu trị sẽ bảt đấu vảo ngảy thứ 1 của chu kỳ tiêp theo k
lượng bạch cầu hạt dạt mức 1500 (x io°/L> vả tiều cầu dạt 100000 (x i0°fi.›. .
Điều chỉnh liều do các độc tính huyết học trong chu kỳ tỉếp theo, đối với lất ca các Chi định:
Liều gemcitabine nên giảm xuống còn 750/o so với iiếu ban đầu, trong trường hợp có các
tính huyết học sau đây:
- Đếm bạch cầu hạt tuyệt đối < 500 x lOó/L trong hơn 5 ngảy.
- Đếm bạch cẩu hạt tuyệt đối < 100 x lOÔ/L trong hơn 3 ngảy.
— Sốt giảm bạch cầu.
- Tiểu cầu < 25000 x 10%.
- Trì hoãn chu kỳ của hơn 1 tuần do dộc tính.
Cảch dùng:
Gemcitabine được dung nạp tốt khi tiêm truyền và có thế được dùng với bệnh nhân có kha nảng
di chuyến. Nếu thoảt mạch xảy ra, thường lả ngừng ngay tiêm truyền và bắt đầu lại ở vị trí
khác. Bệnh nhân nên được kiếm soát cẩn thận sau khi dùng.
Những đối tương bênh nhân đăc biêt:
Bệnh nhân suy thận hoặc suy gan: Gemcitabine được sử dụng thận trọng ở những bệnh nhân
suy gan hoặc suy thận vì không có thông tin đằy đủ từ cảc nghiên cứu lâm sảng cho phép
hướng dẫn liếu cụ thể cho những đối tượng nảy.
Bệnh nhán lớn tuồi (> 65 tuối) Gemcitabine được dung nạp tốt ở bệnh nhân trên 65 tuồi.
Không có bằng chứng để kết luận rằng việc điếu chỉnh liếu, khảo với những khưyến cảo chinh
liều cho tất cả bệnh nhân, là cần thiết
Trẻ em: Gemcitabine được nghiên cứu trong cảc nghiên cứu pha ] và II còn hạn chế 0
thiết lập vế tính hiệu quả và an toản cùa gemcitabine ở trẻ em
CHỐNG CHỈ ĐỊ_NH \ .
- Nhạy cảm với bât kỳ thảnh phân nảo cùa thuôc.
- Phụ nữ đang cho con bú.
CẢNH BÁO vÀ THẶN TRỌNG
Thời gian tiêm truyền kéo dải vả số lần dùng thuốc tãng được cho lả lảm tăng độc tính.
Độc tính thyết học: Gemcitabine có thể gây ửc chế tủy xương với biếu hiện giảm bạch cầu, tiếu
câu và thiêu mảu.
Trước mỗi lần sử dụng gerncitabine bệnh nhân cần phải được kiếm tra iượng tiếu cằu, bạch câu
và bạch cầu hạt. Ngừng điếu trị hoặc điều chỉnh liếu khi xảy ra hiện tượng ức chế tủy xương do
dùng thuốc. Tuy nhiên ức chế tùy xương thướng xuất híện trong thời gian ngắn vả không cần
giảm liều và hiếm khi phải ngùng điếu trị. Đếm mảu ngoại biên có thể tiếp tục bị giảm sau khi
kết thúc điếu trị. Cần thận trọng khi bắt đầu điếu trị cho những bệnh nhân bị ức chế túy xương,
điếu trị. Cũng như cảc điều trị gây độc tế bảo khảo, cần đảnh giá nguy cơ ức chế tưy do tích lũy
thuôo khi sử dụng gemcitabine cùng với cảc hóa chất điếu trị khảo.
Suy gan Dùng gemcitabine cho những bệnh nhân bị di căn gan hoặc có tiền sử viêm gan.
nghiện rượu hoặc xơ gan có thể dẫn đến bộ phát suy gan tiếm ẩn. L/
Cảo xét nghiệm chức nãng gan thận (bao gồm các test virut) phải được tiến hảnh định kỳ. Íil7
Cần thận trọng khi dùng gemcitabine cho bệnh nhân suy gan, thận vì cảc nghiên cứu iâm sảng
chưa đưa ra được hướng dẫn đầy đủ về liếu cho những đối tượng nảy.
Liệu pháp xạ Ir_i đồng thời: Xạ trị đồng thời (tiến hảnh đồng thời hoặc trong vòng 7 ngảy): độc
tính đã được bảo cáo.
Tiêm chúng ngừa: Vacxin chống sốt vảng da vả cảc văc-xin sống khác không được khuyến cảo
cho những bệnh nhân đang đỉều trị với gemcitabine.
Tim mạch Do cảc nguy cơ tim mạch do dùng gemcitabine, vì vậy cần hết sức thận trọng khi
điếu trị cho bệnh nhân có tiến sứ bệnh tim mạch
Hô hấp: Các biến chứng hô hấp, đôi khi nghiêm trọng (như phù phồi, viếm phôi kẽ), hoặc hội
chứng suy giảm hô hấp ớ ngưới trướng thảnh (ARDS) đã được bảo cáo liên quan đến
gemcitabine Tuy nhiên, căn bệnh học cùa các tảc dụng nảy vẫn chưa rõ rảng. Nếu những tảc
dụng nảy phảt triến, cần đánh giá việc ngừng điếu trị với gemcitabine. Tiến hảnh sớm các điều
trị hỗ trợ có thể giúp cải thiện tình hinh.
Thận Các kết quả lâm sảng giống với Hội chứng tăng ure huyết dao tản huyết hiếm khi được
bậo cáo ở những bệnh nhân dùng gemcitabine N gưng ngay gemcitabine khi có những dấu hiệu
đầu tiên của chứng thiếu mảu tán huyết vi mạch, như giảm nhanh haemoglobin cùng với giảm
tiếu cẩu, tăng bilirubin, creatinine huyết thanh, ure huyết hoặc LDH.
Suy thận có thế không hồi phục được cùng với cằn dừng điếu trị và lọc mảu.
Sinh san Trong các nghiên cứu về khả năng sinh sán, gemcitabine có thể gây suy giảm khả
năng sinh tinh ở chuột đực. Do đó, bệnh nhân nam điếu trị với gemcitabine không nên có con
trong thới gian điếu trị bệnh vả 6 tháng sau khi điếu trị vả nên tim kiếm sự trợ giúp cưa kỹ thuật
bảo quản tinh trùng trước khi điếu trị vì khả năng vô sinh do điều trị với gemcitabine.
Bệnh nhân nên hạn chế lượng muối trong chế độ ản vì hảm lượng natri có chứa trong mỗi lọ
Gemcitabine medac 200mg là 3. 5mg (0.2 mmol).
Lúc mang thai và nuôi con bủ:
Lúc mang thai Không có dữ liệu đầy đủ từ việc sử dụng gemcitabine ở phụ nữ mang thai. Các
nghiên cứu trên động vật đã chỉ ra độc tính gây suy giảm khả năng sinh sản. Dựa vảo các kết
quả từ nghiên cứu trên động vật vã cơ chế hoạt động của gemcitabine thì không được sư dụng
thuốc trong thai kỳ trừ khi thực sự cần thiết.
Bệnh nhân nữ không nên có con trong thời gian điếu trị với gemcitabine và cần phái tiỹịgầ ’gáọ
ngay với bác sĩ nêu điếu nảy xáy ra.
Lúc nuôicon bú. Hiện vân chưa rõ gemcitabine có được bải tiết qua sữa mẹ h
không thế loại trừ khả năng tác dụng không mong muốn xảy ra đối với trẻ đang b'
ghải ngừng cho con bú trong quá trình điếu trị với gemcitabine.
Anh hưởng lên khá nãng lái xe và vận hảnh máy mỏc: ,
Không có nghiên cứu nảo đảnh giả về những ánh hướng cua gemcitabine lên khá nả
vận hảnh máy móc. Tuy nhỉên, gemcitabine được báo cáo lả gây buồn ngu và tinh trang
đặc biệt khi dùng đồ uông có chứa côn. Vì vậy, bệnh nhân cân thận trọng khi lải xe hoặc vận
hảnh mảy móc tới khi xác định được lá không bị buồn ngù.
Các dữ liệu an toân tiền lâm sâng
Trong cảc nghiên_cứu liếu lặp lại trong 6 tháng ở chuột và cho, cảc kết quá chủ yếu lả sự ức chế
quá trinh tạo huyêt phụ thuộc liếu vả phác đồ vả có thể hồi phục được.
Gemcitabine có thể gây đột biến gen trong các test đột biển trên in vilro vả test nhân sinh sản ở
tủy xương trên in vivo. Cảc nghiên cứu dải hạn đánh giá khả năng gây ung thư chưa được tiến
hảnh.
Các nghiên cứu sinh sản, gemcitabine gây giảm kha năng sinh tỉnh có thế hồi phục ở chuột đực.
Không quan sát thấy bất ký ảnh hướng nảo lên khá nãng sinh sản cùa chuột cải.
Cảc đánh giá kết quả thí nghiệm trên động vật đã cho thấy tảc dụng độc tính dối với sinh sản, ví
dụ dị tật bấm sỉnh và các ảnh hướng khác đối với phôi vả thai nhi, quá trình thai nghén hoặc sự
phát triền trước vả sau khi sinh.
TƯỚNG TÁC THUỐC Áxvéf/
Không có nghiên cứu chi tiết nảo về tương tác thuốc được tiến hảnh.
X_a tri:
Xạ trị đồng thời (Iiến hờnh đồng thời hoặc lrong vòng "ngảyj- Độc tính liên quan đến điếu trị
đa phương thức nảy phụ thuộc vảo nhiếư yêu tô, bao gộm liều lượng gemcitabine, tần suất dùng
thuốc, liếu xạ trị, kỹ thuật xạ trị, mô đích và thể tích điếu trị đích.
Cảc nghiên cứu tiên lâm sảng vả lâm sảng đã chứng minh rằng gemcitabine nhạy bức xạ. Trong
một nghiến cứu đơn, gemcitabine với Iiếu lOOOmg/m2 được dùng đồng thời trong thới gian 6
tuần liên tiếp kết hợp xạ trị vùng ngực ở bệnh nhân ung thư phổi không phải tế bảo nhò, độc
tính đáng kế là viêm niêm mạc nghiếm trọng có khả năng đe dọa tính mạng, đặc biệt là viêm
thực quản và viêm mảng phổi được quan sảt thấy, đặc biệt xảy ra ở những bệnh nhân tiếp nhận
lượng bức xạ lớn (thể tích xạ trị trung bình là 4 7950m ). Các nghiên cứu được tiến hảnh sau đó
đã cho thấy tính khả thi khi dùng gemcitabine ở liếu thắp hơn kết hợp với xạ trị đồng thời với
cảc độc tính có thế dự đoản được, như nghiên cứu pha II trên bệnh nhân ung thư phô2i không
phải tế bảo nhò, tiến hảnh xạ trị liều 66Gy cùng với dùng gemcitabine liếu (ôOOmg/mẵ 4 lần)
và cisplatin ( SOmg/m 2 lần) trong 6 tuần. Phảc đồ tôi ưu khi dùng gemcitabine một cách an
toản cùng với xạ trị vân chưa được xảc định ở tất cả cảc loại khối u.
Xạ trị không đồng thời (dùng trên 7 ngảy)— Phân tich các dữ liệu sẵn có không cho thẩy bầt kỳ
độc tính tăng cường nảo khi đùng gemcitabine trước hoặc sau 7 ngảy kế từ ngảy xạ trị. C ac dữ
liệu cũng gợi ý rằng gemcitabine có thế được bắt đầu sau khi cảc độc tính câp do xạ trị được
loại bỏ hoặc ít nhất 1 tuân sau khi xạ trị.
Tổn thương do xạ trị đã được báo cảo trên các mô đích (ví dụ: viêm thực quản, viêm đại trảng
và viêm phổi) liên quan đến cả xạ trị đồng thời và không đồng thời với việc sử dụng
gemcitabine.
Cảc tương tảc khác:
Không được dùng các vẳc- xin ngừa sốt vảng da vả vắc- xin sống khảc trong quá trình điếu trị
với gemcitabine do có nguy cơ cùa cảc bệnh lý toản thân nguy hiếm đến tính mạng, đặc biệt 0
những bệnh nhân suy giảm miễn dịch.
TÁC DỤNG KHÔNG MONG MUÔN
Cảo Tảo dụng phụ phổ biến nhất liên quan tới điều trị với gemcitabine bao gồm: buốn nôn kèm
theo hoặc không kèm theo nôn, tăng men gan (AST/ALT) vả alkaline phosphatase, dược bảo
cảo ở gần 60% bệnh nhân; protein niệu và huyết nìệu được bảo cảo ở 50% bệnh nhân; khó thơ
ủJịG MN \?
.…\
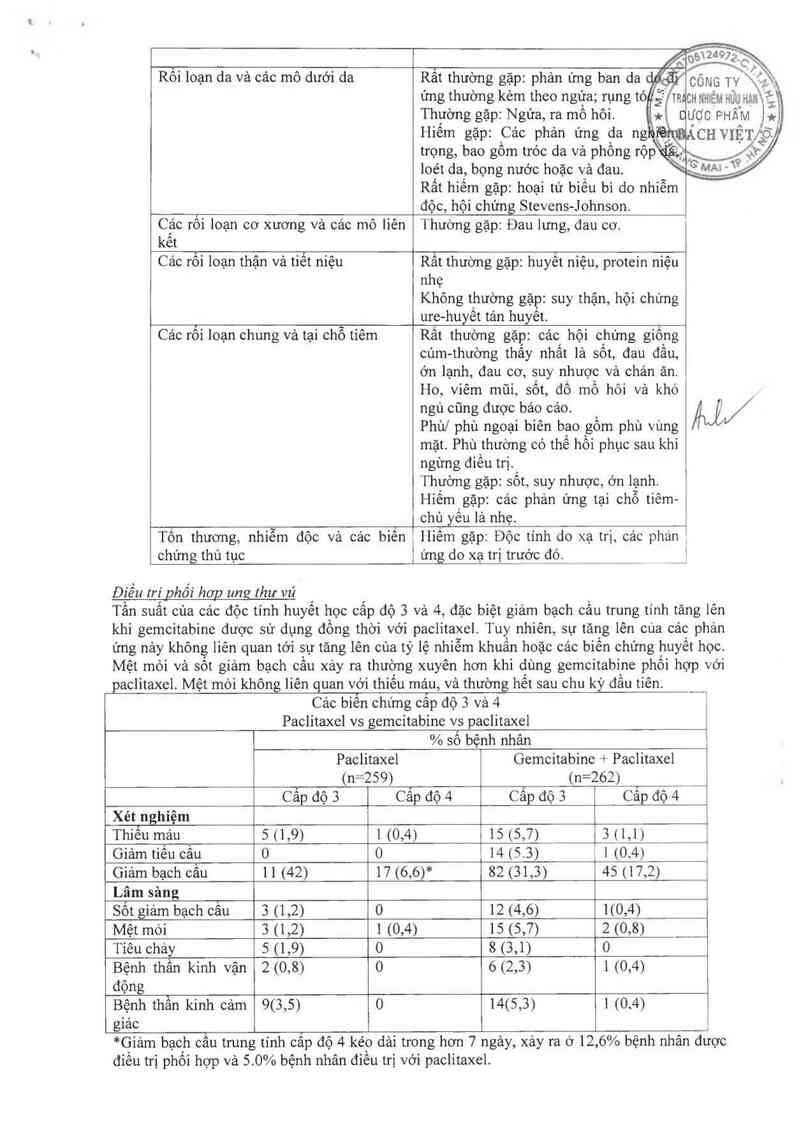
Rôi loạn da vả các mô dưới da
Rẵt thường gặp: phản ứng ban da
ứng thường kèm theo ngữa; rụng tó .Ệ
Thường gặp: Ngứa, ra mô hôi
Hiếm gặp: Cảc phản ứng da ng '
loét da, bọng nước hoặc và đau.
Rất hiêm gặp: hoại tử biêu bì do nhiễm
độc, hội chứng Stevens-Johnson.
/tíì\Ặ
|
Các rôi ioạn cơ xương và các mô liên
kêt
Thường gặp: Đau lưng, đau cơ.
Các rối loạn thận và tiết niệu
Rất thường gặp: huyết niệu, protein niệu
nhẹ
Không thường gặp: suy thận, hội chứng
ure-huyết tán huyết.
Cảc rổi loạn chung và tại chỗ tiêm
Rât thường gặp: cảc hội chứng giống
cúm—thường thấy nhất là sốt, đau đẩu,
ớn lạnh, đau cơ, suy nhược vả chán ăn.
Ho, viêm mũi, sốt, đổ mồ hôi vả khó
ngủ cũng dược báo cảo.
Phùl phù ngoại biên bao gồm phù vùng
mặt. Phù thường có thể hồi phục sau khi
ngừng điếu trị.
Thường gặp: sốt, suy nhược, ớn lạnh.
Hiếm gặp: các phản ứng tại chỗ tiêm-
| chủ yếu là nhẹ.
chứng thủ tục
Tôn thương, nhiễm độc vả cảc biến'.
1 ứng do xạ trị trước đg
Điều trì phối hơp ung thư vú
Hỉếm gặp: Độc tính do xạ trị, cảc phán 1
(
05124072
CONG TY
CH HHEM `~iỦU h'ặhtỀ
trọng, bao gồm tróc da vả phồng rộp ,
M/
Tần suất của các độc tính huyết học cấp độ 3 và 4, đặc biệt giảm bạch cầu trưng tính tăng lến
khi gemcitabine được sử dụng đồng thời với paciitaxei Tuy nhiên, sự tăng lên của các phản
ứng nảy không liên quan tới sự tãng lên của tỷ lệ nhiễm khuấn hoặc cảc biến chứng huyết học.
Mệt mỏi và sôt giảm bạch cầu xảy ra thường xuyên hơn khi dùng gemcitabine phối hợp với
paclitaxel Mệt mòỉ không iiên quan với thiếu máu, vả thường hết sau chu kỳ đầu tìên.
Cảo biến chứng cấp độ 3 và 4
Paclitaxel vs gemcitabine vs paclitaxel
% số bệnh nhân
Paclitaxel Gemcitabine + Paclitaxel
(n=259) (n=262) _
Cấp độ 3 Cấp độ 4 Cấp độ 3 Cấp độ 4
Xét nghiệm
Thiểu mảu 5 (1,9) 1(0,4) 15 <5,7) 311,1)
Giảm tiêu câu 0 0 14 <5.3) ] 104)
Giảm bạch cầu 11 (42) 17 (6,6)* 82 <31,3) 45 117,2) ’
Lâm sảng
s?» giảm bạch cẩu 3 (1,2) 0 12 (4,6) 110,4)
Mệt mòi 3 (1,2) 1 (0,4) 15 (5,7) 2 (0,8)
Tiêu chảy 5 (1,9) 0 8 <3,1) 0
Bệnh thân kình vận 2 (0,8) 0 6 <2,3) 1 <0,4)
động
Bệnh thần kinh cảm 90 5) 0 14(5, 3) 1 (0.4)
giác
điếu trị phối hợp và 5. 0% bệnh nhân điếu trị với paclitaxei
*Giảm bạch cấu trung tính câp độ 4 kéo dải trong hơn 7 ngảy, xảy ra ở 12, 6% bệnh nhân dược
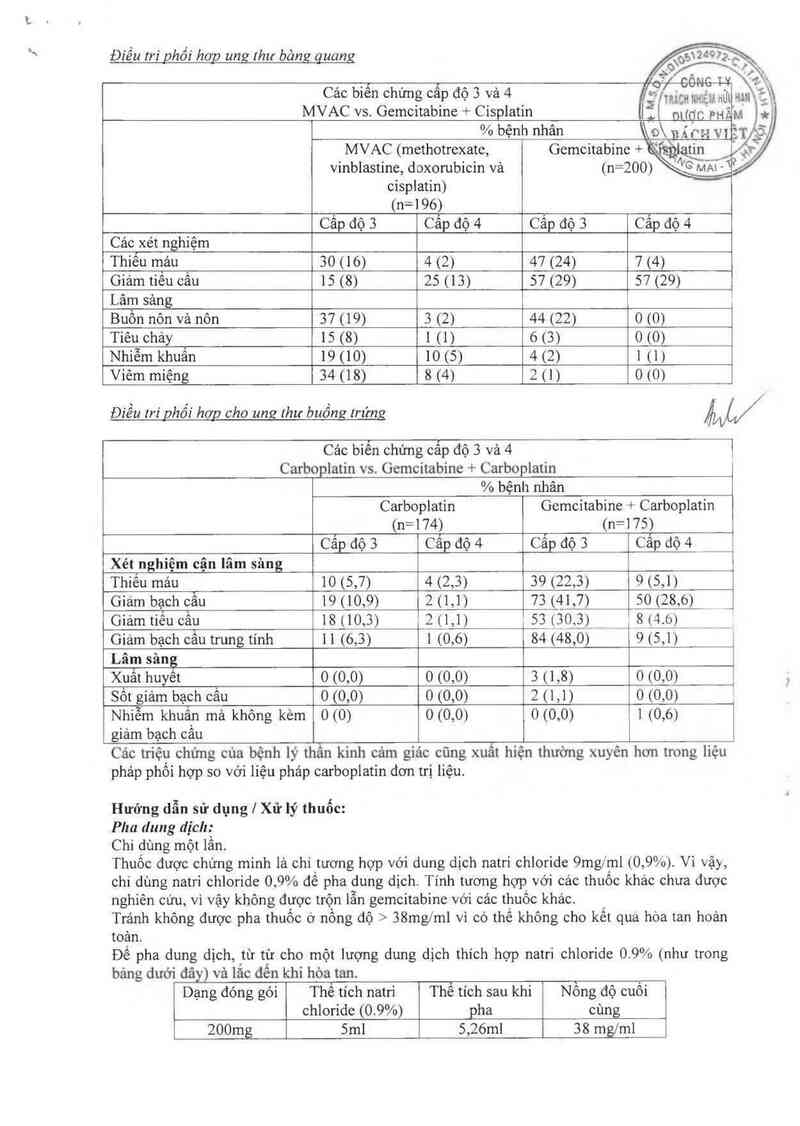
Điều trì phối hơp ung lhư bảng quang
ệ'.
. ] nnmr TV
Cảo biến chứng cấp độ 3 và 4 íợ’ _"ị,,fflg,Ịg, ẢũÌ
MVAC vs. Gemcitabine + Cispiatin IỂ( DƯỐC pHẮ
% bệnh nhân o\ ỵẨPH YLẸ
MVAC (methotrexate, Gemcitabine + " iin
vinblastine, doxorubicin vả (n=200) NG MAt Ỹ
cisplatin)
(n=196)
Cấp độ 3 Cẩp dộ 4 Cấp độ 3 Cấp độ 4
Các xét nghiệm
Thiếu máu 30 (16) 4 (2) 47 (24) 7 (4)
Giảm tiếu cầu 15 (8) 25 (13) 57 (29) 57 (29)
Lâm sảng
Buồn nôn vả nôn 37 (19) 3 (2) 44 (22) o (0)
Tiêu chảy 15 (8) 1 (1) 6 (3) o (0)
Nhiễm khuẳn 19 (10) 10 (5) 4 (2) 1 (1)
Viêm miệng 34 (18) 8 (4) 2 (1) o (0)
Điều tri phối hơn cho ung thư buồm,J IrứnH W
Cảo biễn chứng cấp độ 3 và 4 i
Carboplatin vs. Gemcitabine + Carboplatin
% bệnh nhân
Carboplatin Gemcitabine +- Carboplatin
(n=174) (n=175)
Cấp độ 3 Cấp độ 4 Cẫp độ 3 Cấp độ 4
Xét nghiệm cận lâm sâng
Thiếu mảu 10 (5,7) 4 (2,3) 39 (22,3) 9 (5,1)
Gìám bạch cầu 19 (10,9) 2 (1,1) 73 (41 ,7) 50 (28,6)
Giảmtiếu cầu 18 (10,3) 2 (1,1) 53( (_30_ 3)_ __8_14.6)
Giám bạch Ểâu trung tính 1 1 (6,3) 1 (0,6) 84 (48,0) 9 (5,1)
Lâr_n sâng
Xuât huyết 0 (0,0) 0 (0,0) 3 (1,8) 0 (0,0)
Sốt giảm bạch cầu 0 (0,0) 0 (0,0) 2 (1 ,1) 0 (0,0)
Nhiễm khuẩn mã không kèm 0 (0) 0 (0,0) 0 (0,0) 1 (0,6)
giảm bạch cầu
Cảo triệu chứng cúa bệnh lý thẫn kinh cảm giác cũng xuất hiện thường xuyên hơn trong liệu
pháp phối hợp so với liệu phảp carboplatìn đơn trị liệu.
Hướng dẫn sử dụng | Xử lý thuốc:
Pha dung dịch:
Chỉ dùng một lần.
Thuốc được chứng minh là chỉ tương hợp với dung dịch natri chloride 9mg/ml (0, 9%). Vì vậy,
chi dùng natri chloride 0, 9% để pha dung dịch Tính tương hợp với các thuốc khác chưa được
nghiên cứu, vì vậy không được trộn lẫn gemcitabine với cảc thuốc khác.
Tránh không được pha thuốc ở nồng độ > 38mg/ml vì có thế không cho kết qua hòa tan hoản
toản.
Đế pha dung dịch, từ từ cho một lượng dung dịch thích hợp natri chloride 0.9% (như trong
bảng dưới dâỵ) vả lẳc dển khi hòa tan.
Dạng đóng gói Thể tích natri Thể tích sau khi Nồng độ cuối
chloride (0.9%) pha cùng
200mg Sml 5,26m1 38 mglml
)
chloride 0, 9% vảo lọ ] g. Lắc để hòa tan thuốc.
Thuốc đã pha có thế được pha loãng thêm nữa bằng dung dịch Natri chloride 0,9%.
Kiếm tra bằng mắt dung dịch trước khi tiếm truyền xem có bất thường nảo không.
Loại bỏ phần thuốc còn dư.
Sử dụng bao tay cao su khi dùng thuốc. Nếu thuốc tiếp xúc vởi da hoặc mô ngay lập tưc p .
rửa với rất nhiều nước và xả phòng Nên cân nhắc các phương phảp thích hợp để xử iý vả huỵ
bỏ cảc thuốc chống ung thư.
QUÁ LIÊU
Không có thuốc giải độc để điều trị quá liều gezmcitabine. Độc tính cùa thuốc trên lâm sảng
chắp nhận được khi dùng từng iiều đên 5,7 g/m2 truyền tĩnh mạch trong 30 phút mỗi 2 tuần.
Khỉ nghi ngờ quả liếu, nến theo dõi số lượng tế bảo máu của bệnh nhân Tiến hảnh cảc biện
phảp điều trị hỗ trợ cho bệnh nhân khi cần thiết.
TỈNH TƯỜNG KY: _ '
Không có tương ky giữa cảc thảnh phân cưa thuôo. . ỉ/
ĐÓNG GÓI VÀ BẢO QUẢN
Hộp ] lọ bột đông khô pha tiếm.
Bảo quản thuốc ở nhiệt độ không quá 300C
Tính chắt Olý- hóa cùa dung dịch được chứng minh có thế ốn định trong vòng 35 ngảy nếu báo
quản ở 250 C.
Tuy nhiên, dung dịch sau khi pha được sử dụng tốt nhất trong vòng 24 giờ ở 250C
Để xa tầm tay trẻ em!
HẠN DÙNG: 3 năm kế từ ngảy sản xuất. Không dùng thuốc khi quá hạn sử dụng.
TIÊU CHUẨN: NSX.
NHÀ SẢN XUẤT:
Oncotec Pharma Produktion GmbH
Am Pharmapark, 06861 Dessau-RoBiau, Germany
NHÀ sở HỮU GIẤY PHÉP:
Medac Gesellschaft fur klinische Spezialpraparate mbH
Fehlandt _. 034 Hamburg, Germany
pHÒ cục TRUỞNG
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng