


















.—ộ›
1 BỘ Y TẾ __ r
i CỤC Qt'Ax’ 1.ÝD1"OC /fỨU
nà PHÊ DUYỆT
\
, Ổ .
' l.im dt…:.OẺ1.J...ỉ..J.……ffl. .
' 1 wa! ot 2ml : .u. \ i:vfa…n snmg ; E'
' . nucavmuna ơvospnale ễ ’-T
` F'udarabưÌ Sodmm nnospnme mm;ư g ị
sou…m nmmnoe … wain ?. ’
"Ebewe” songsz … …… ==
… Kmi uu' … m mach .… «ng…
Soluuon lu mpcmm! “' ®"“ỦM
…… ỊM mM|on …, Sluư ' .: ›p.» rw.nnr i. \… a \'.'›
tnhcùun - inhuvon Reg N-
For IV uu only …
Mum… …… ử Ẹ
… n…… o…nu mun ` ›. .. ế
…msse ~\ Ẹ
«
49Ẹ6 Umơxr .… ẩrĩe'ue A,,azu
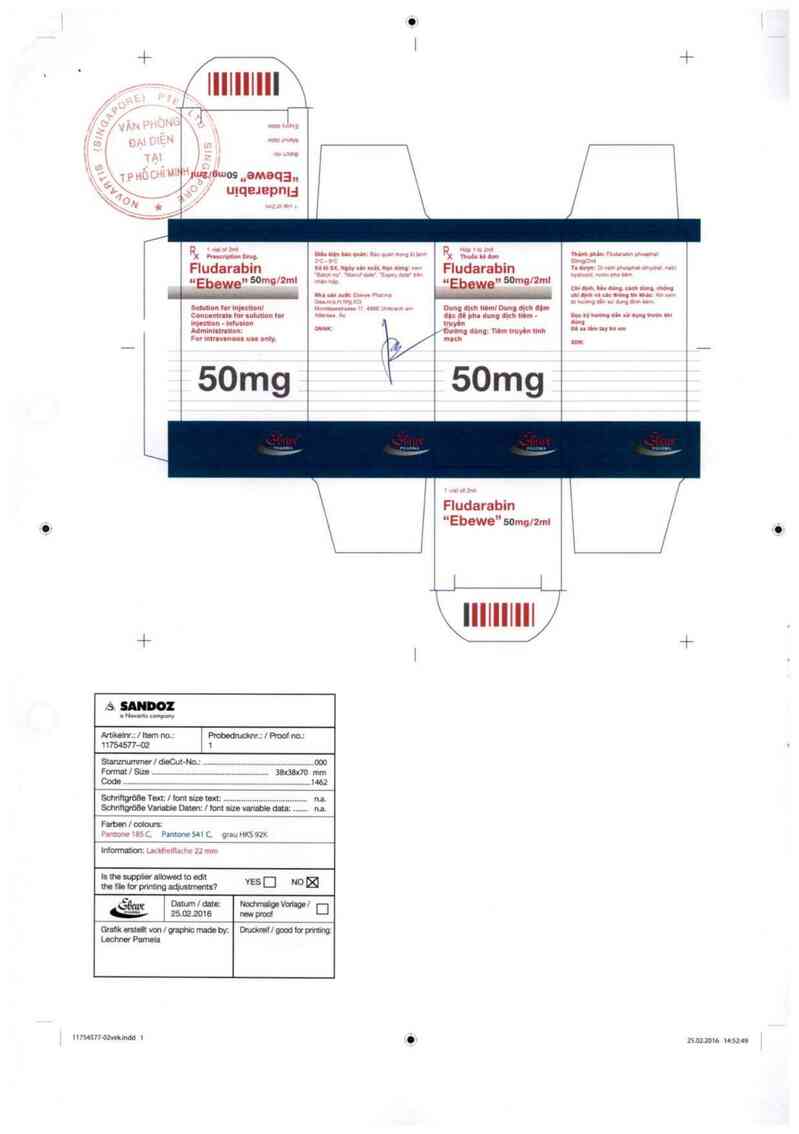
Itemnumber: 11734977-01
Size in mm: 62 x 21 mm
Colours: EanmniảsJịna—
EantnnsJôâìna._
.S.cbm.C_m._
Code: 3076
Label position: M4
Information: CARINI Digitaldruck Standard 2015
Is the supplier allowed to edit the file for
printing adjustments?
YES E] NO ffl
Designed by: 2ị11.15 10 | hrh
23.11.2015 11149'11
@
11734977—01ve1c1ndd 1
\ \“,nểémwos ..emeqa…
ugqe1epnu
,…
Fềg ụằmẳo'L, Dme› nm lun Iu: …… Hn; n..J~ n - J : …… Ịviẵkluẫ Ẹ… 'Ĩ'm' .nụ. r….m… …,… ..
Fludarabm “?tỊff'Ẹf“ ;\r;,ưgẹ_ \; Fludarabm , _ __ _ , -
n » | ' ' ' n n 50m /2ml
Ebewe 5°"'°’²'“ Ebege ° _ …… …………. ……
:… u… vn cu mon. un v…: … …
,…… . … w. - _. … …… ,- IẤ' … run; a…» .. …
Sohmon lnt tnpcltonl Dung dợch noml Dung aỳch dỊm
Cnncomnh Vol loln1tonlnr Ann… J- nụ 64 pha dung ma liem — Doc th…1 dn … aqu … …
mmmon —1ntumm lru ` °…l
Aammhlnuon "…“ Đương dung TM… iruyừn …… m " "'“ "Y " "'
FM lmnvunoun uu only. mach
…
50mg 50mg
.… … :vn,
Fludarabin
“Ebewe” 50mg/²ml
,ớ WM!
u ~…m conpunv
Amketrvs /ltem no,: Pmbedmoknr.z l Prooi no.:
11754577—02 1
Schuftgróũa Text: | lom sưe text:
Schnftglỏõa Vanabte Daten: | Iont size vanabte data
Farben | colours:
Panto-w 18511 Pnntoưc 541 C, grau HKS 92h
Intormanonz Lar,htwdz… › u 2.7 mm
Is tha supphar atlowed to edit
the íie for pnnting edgustmems? YES El NO E
@… Datum / om: Noơvndige Vonagel
ủa 25.0².2016 newpmd Ủ
Grafùustdltvm/gaphicmadebỵ: Dludưutlgoodtorpnnbng:
Lechner Pamela
1175457702vủmd5 ! . IS,DLZOÌG 14 51'19
\› JJ ,
__,\J/_Ắrg \
\e ,, , . . _ …. .
,, Ể’vAN …òưe Tơ HƯONG DAN su DỤNG THUOC
`_r' Lẽ DẠI DIỆN _ _ _ _
i, AưHA ONG DAN sư DỤNG THUOC CHO NGƯơi BỆNH
\` ỉ²_,_ { P HỒ CHÍ MINH
"ltịfio, ” UÓC: FLUDARABIN “EBEWE”
2. CÁC KHUYẾN CÁO
Thuốc nảy chỉ dùng theo đơn của bảc sỹ
Đọc kỹ hướng dẫn sử dụng trước khi dùng
Đề xa tầm tay trẻ em
Thông bảo ngay cho bác sỹ hoặc dược sỹ những tảc dụng không mong muốn gặp phải khi sử
dụng thuốc
3. THÀNH PHÀN
Mỗi ml chứa 25 mg fludarabin phosphat là hoạt chất.
Tả dược: di natri phosphat dihydrat, natri hydroxyd vả nước cất pha tỉêm
4. MÔ TẢ SẢN PHẨM
Dung dịch trong suốt, không mềm hoặc gần như không mảu
Dạng bảo chế: Dung dịch tiêml Dung dịch đậm đặc để pha dung dịch tiêm — truyền
5. QUY CÁCH ĐÓNG GÓI
Hộp ] lọ 2m1.
Lọ thuỷ tinh trong suốt loại I, kèm nút cao su.
6. THUỐC DÙNG CHO BỆNH GÌ
F ludarabin là một thuốc gây độc tế bảo (thuốc điều trị ung thư) có tác dụng gây ức chế sự
phảt triền cùa các tế bảo ung thư.
Thuốc Fludarabin “Ebewe” được sử dụng để điều trị bệnh bạch cẩu lympho mạn tính dòng
lympho B (B-CLL) trên bệnh nhân có khả năng sản xuất đầy đủ cảc tế bảo mảu bình thường.
Chi sử dụng fludarabin phosphat dễ điều trị ban dầu cho bệnh nhân bị bệnh bạch cầu lympho
mạn tính ở giai đoạn nặng tức là đã có cảc triệu chứng cùa bệnh hoặc đã có bằng chứng về sự
tiến triến bệnh.
CLL là một bệnh ung thư đòng bạch cầu (tế bảo mảu trắng).
Nếu bạn được chấn đoán lá CLL, số lượng bạch cầu được sản xuất nhiếu quá mức nhưng
chúng không hoạt động bình thường và chưa trướng thảnh đề thực hiện chức năng của bạch
cầu là chống lại bệnh tặt. Số lượng quá lớn tế bảo bất thường nảy chiếm chỗ của các tế bảo
máu khỏe mạnh trong tùy xương (lá nơi sản xuất hầu hết cảc tế bảo mảu). Chúng cũng chiếm
chỗ cảc tế bảo máu khỏe mạnh trong mảu vả tại các cơ quan. Tình trạng không có đủ cảc tế
cos v03_06_2016 - |
bảo mảu khỏe mạnh có thẻ dẫn đên nhiễm trùng. thiêu máu. bâm tím, chảy mảu quá mức và
thậm chí suy tạng.
7. NÊN DÙNG THUỐC NÀY NHƯ THẾ NÀO VÀ LIÊU LƯỢNG
Trẻ em và trẻ vị thânh niên
Không khuyến cảo sử dụng thuốc Fludarabin “Ebewe” cho trẻ em và trẻ vị thảnh niên.
Liều dùng
Liều khuyến cảo lả 25 ngm² diện tích bề mặt cơ thề.
Liều thuốc sử dụng cho bạn phụ thuộc vảo diện tích bề mặt cơ thể (m2), được tính toán dựa
trên chiều cao và cân nặng cùa bạn.
Nếu bạn gặp phải tác dụng không mong muốn gây ảnh hưởng đảng kế, bạn có thế được giảm
liều thuốc hoặc lặp lại khoảng nghỉ giữa các đợt điều trị. Nếu bạn có bệnh thận, bạn sẽ dược
giảm liều thuốc và thường xuyên lảm xét nghiệm mảu.
Đường dùng và cách dùng thuốc \
Thuốc nảy được sử dụng dưới dạng tiêm (vảo tĩnh mạch) hoặc truyền (qua ống nhỏ giọt) l
lầnlngảy trong vòng 5 ngảy.
Thời gian điều trị
Chu kỳ dùng thuốc trong 5 ngảy sẽ được lặp lại mỗi 28 ngảy cho dến khi bảc sỹ quyểt dịnh
rằng bạn đã đạt được hiệu quả điều trị tốt nhất. Thông thường điều nảy đạt dược sau 6 chu kỳ
điều trị (sau khoảng xấp xỉ 6 thảng).
8. KHI NÀO KHÔNG NÊN DÙNG THUỐC NÀY
— Nếu bạn bị dị ứng (quá mẫn) với fludarabin phosphat hoặc bất kỳ thânh phần khảc cùa
thuốc.
— Nếu bạn dang cho con bú.
~ Nếu chức năng thận cùa bạn bị suy giảm nghiêm trọng. Dựa trên chức năng thận cùa bạn,
bảc sỹ sẽ quyểt định xem bạn có thế sử dụng thuốc Fludarabin “Ebewe” hay không.
- Nếu bạn bị một loại thiếu mảu cụ thể (thiếu mảu tan mảu mất bù - một tình trạng thiếu
hổng cầu). Bác sỹ sẽ thông bảo cho bạn nếu bạn có tình trạng nảy.
9. TÁC DỤNG KHÔNG MONG MUÔN
Tương tự cảc thuốc khảc, thuốc Fludarabỉn “Ebewe” có thể gây ra các tảc dụng không mong
muốn, mặc dù không phải tất cả những người dùng thuốc đều gặp phải.
Thông bảo ngay cho bác sỹ
0 Nếu bạn có khó thở, ho hoặc đau ngực, kèm hoặc không kèm sốt
0 Nếu bạn phát hỉện bầm tím bất thường, chảy máu quá mức sau chấn thương hoặc nếu
bạn bị gỉa tăng nhỉễm trùng
0 Nếu bạn phát hiện đau bên sườn, tỉểu ra máu hoặc gỉảm lượng nước tìếu
cos v03_06_2016 - 2
A² ẵ /:fJÍ
Nếu bạn có phản ứng trên da vả/hoặc mảng nhảy vởi biêu hiện dò. viêm. mụn rộp và
tôn thương mô
Nêu bạn có hôi hộp, đảnh trông ngực hoặc đau ngực
Các tảo dụng không mong muốn dưới dây đã được ghi nhận:
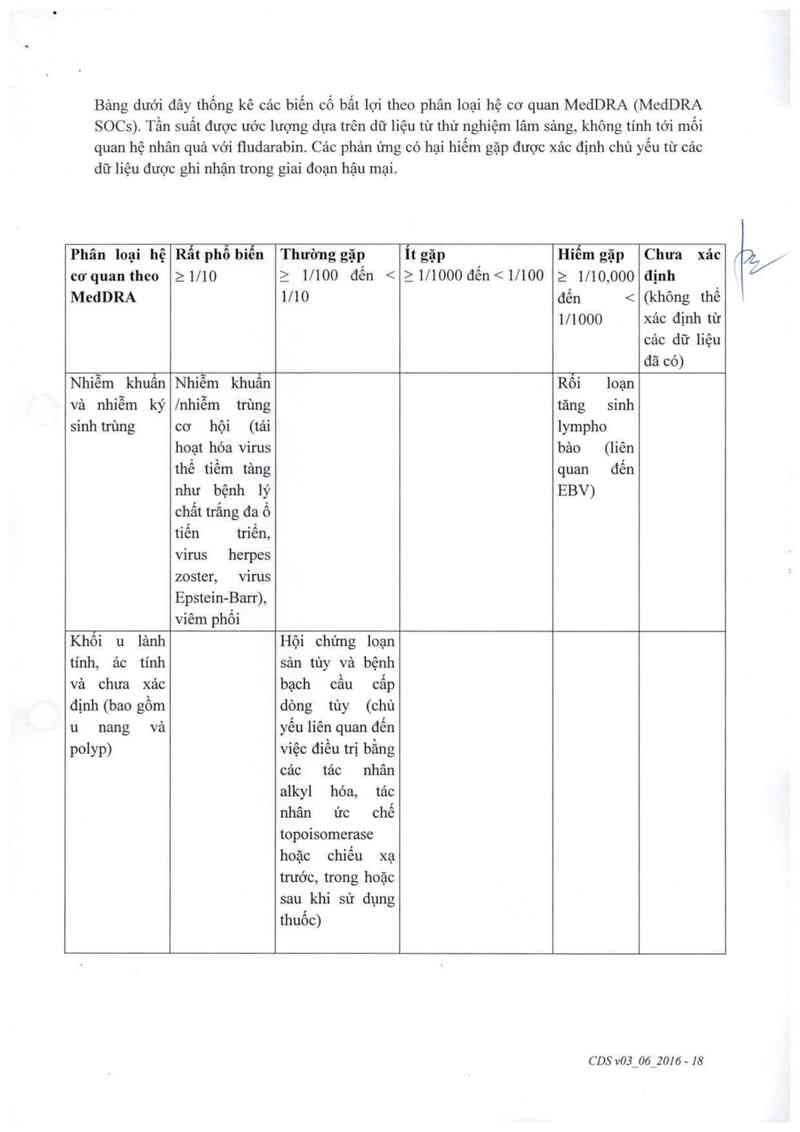
Rất thường gặp (tỷ lệ ghi nhận trên 1|10)
Nhiễm trùng (một số trường hợp ở mức độ nặng);
Nhìễm trùng do suy giảm hệ miễn dịch (nhiễm trùng cơ hội);
Nhiễm trùng tại phổi (viêm phối) vởi cảc triệu chứng như khó thở vả/hoặc ho, kèm
hoặc không kèm sốt;
Giảm tiều cầu dẫn dến nguy cơ bầm tím vả chảy mảu;
Giảm bạch cầu trung tính; .
Giảm hồng cầu (thiếu máu); [ /
Ho;
Nôn, tiêu chảy, buồn nôn;
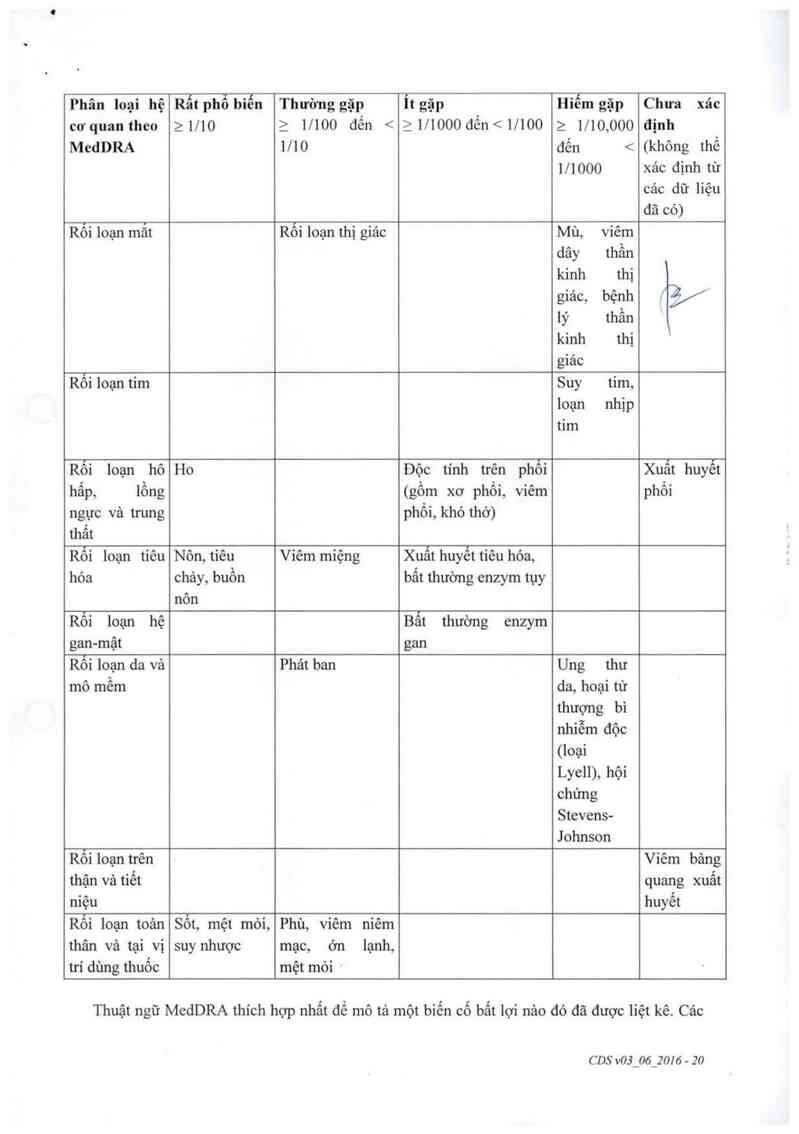
Sốt;
Mệt mỏi;
Yếu mệt
Thường gặp (tỷ lệ ghi nhận dưới 1|10)
Cảc dạng ung thư mảu khác (hội chứng rối loạn sinh tùy, bệnh bạch cầu tủy bảo cấp
tính). Hầu hết những bệnh nhân có cảc tình trạng nảy đều đã sử dụng cảc thuốc diều
trị ung thư khác (thuốc ạlkyl hóa, thuốc ức chế men topoisomerase) hoặc liệu phảp xạ
trị từ trước, đồng thời hoặc sau khi sử dụng fludarabin phosphat;
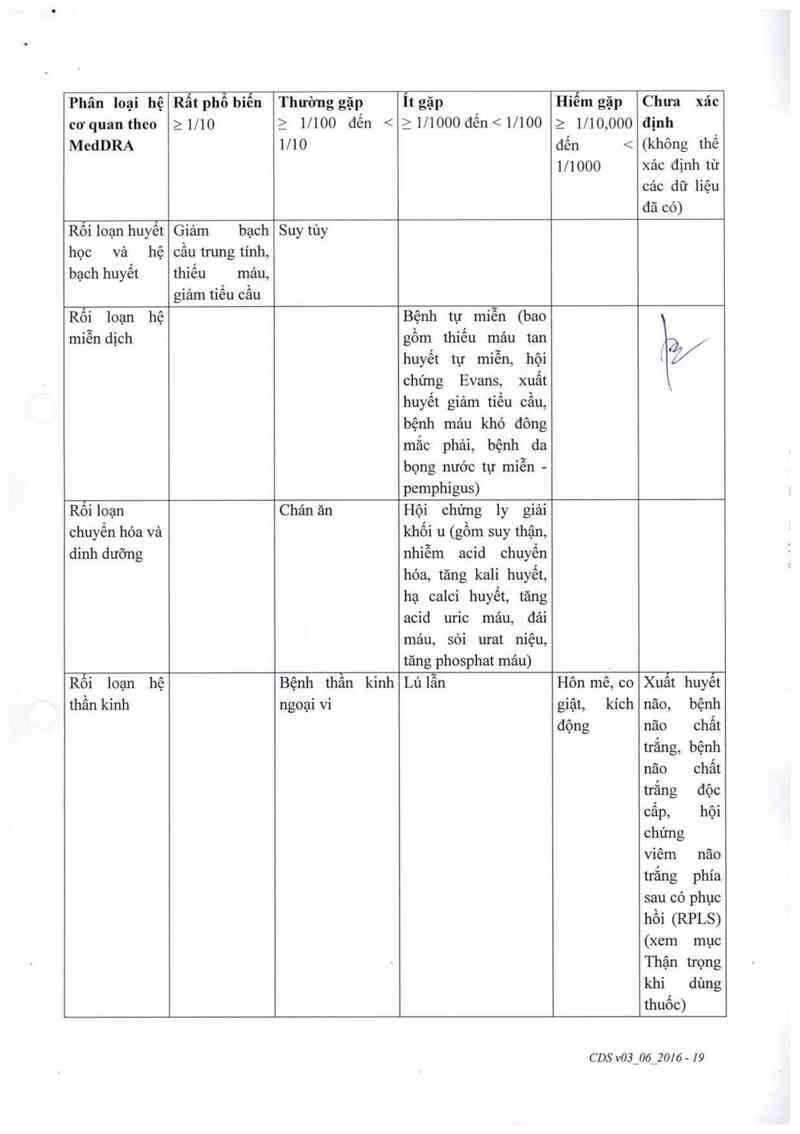
Suy tủy xương;
Mất cảm giác ngon miệng mức độ nghiêm trọng dẫn đến sút cân (chán ăn);
Cảm giác tê bì hoặc yểu tại cảc chi (bệnh thần kình ngoại biên);
Rối loạn thị giác;
Viêm miệng;
Nổi mẩn da;
Phù do giữ nước quá mức;
Viêm mảng nhây ở hệ tiêu hóa từ miệng đến hậu môn (viêm nỉêm mạc);
Ớn lạnh;
Cảm giác không khỏe
Ít gặp (tỷ lệ ghi nhận dưới mom
Bệnh tự miễn (bao gổm tình trạng cơ thể sinh kháng thể khảng hồng cầu [thiếu mảu
tan máu tự miễn], thiếu máu tan mảu qua trung gian miễn dịch đồng thời với giảm
tỉều cầu qua trung gian miễn dịch [hội chứng Evans], xuất huyết dưới da, niêm mạc
mảng nhảy và cảc bộ phận khảc do giảm dáng kể số lượng tiếu cầu [xuất huyết giảm
tiền cầu], một bệnh lý chảy máu được mô tả bởi kháng thể tự miễn trực tỉếp chống lại
CDS v03_06_2016 - 3
/
\
\
\_/
ta.… 0
`\ẳơ›. .
yểu tố đông máu [bệnh hemophilia mắc phải]. cảc bệnh trên da qua trung gian miễn
dịch được mô tả là nhóm những bệnh bọng nước gây ngứa [pemphigus]).
Hội chứng ly giải khối u (một nhóm biến chứng gây ra bởi cảc sản phấm phân hủy
cùa các tế bảo ung thư chết đi bao gổm tăng kali, phosphat vả acid uric máu, hạ calci
mảu và sự có mặt quá mức của acid uric trong nước tiều; có thể dẫn đến bệnh thận
acid uric cấp và suy thận). Nếu bạn phát hiện có đau bên sườn, giảm lượng nước tiều
hoặc tiều ra mảu, hãy thông báo ngay cho bác sỹ;
Độc tính trên phổi; sẹo tại phối (xơ hóa phổi); viêm phổi; khó thở;
Chảy mảu dạ dảy hoặc ruột;
Nồng dộ enzym gan hoặc tụy bất thường.
Hiếm gặp (tỷ lệ ghi nhận dưới mooo›
Bệnh hệ bạch huyết do nhiễm virus (rối loạn tăng sinh lympho do nhiễm EBV);
Hôn mê;
Co giật;
Kích thích;
Mù;
Viêm hoặc tổn thương dây thần kình tại mắt;
Suy tim;
Nhịp tim bất thường (loạn nhịp tim);
Ung thư da;
Phản ứng trên da vả/hoặc niêm mạc mảng nhảy với biền hỉện đỏ, vỉêm, mụn rộp và
tổn thương mô (hội chửng Lyell, hội chứng Stevens Johnson)
Không rõ tần suất (không thể ước tính tần suất dựa trên những dữ liệu hiện cỏ)
Viêm bảng quang có thể gây đau khi đi tiểu hoặc có thể gây tiểu ra máu (viêm bảng
quang xuất huyết)
Chảy mảu não
Bệnh lý thần kinh với biểu hiện đau đầu, buồn nôn vả nôn, co giật, rối loạn thị giảc
bao gồm mất thị giác, thay dối trạng thải tâm thần (ý nghĩ bất thường, lú lẫn, giảm
nhận thức) và đôi khi gặp rối loạn thần kinh cơ với biểu hiện yểu cơ tại cảc chi (bao
gồm liệt toản bộ hoặc một phần không hồi phục) (các dấu hiệu của bệnh lý chất trắng,
bệnh lý não chất trắng nhiễm độc cấp hoặc hội chứng chất !rắng não sau có hồi phục
(RPLs))
Chảy mảu trong phối
10. NÊN TRÁNH DÙNG NHỮNG THUỐC VÀ THỰC PHẤM GÌ KHI ĐANG SỬ
DỤNG THUỐC NÀY
Hãy thông bảo cho bác sỹ nếu bạn dang sử dụng, vừa mới sử dụng hoặc có thế đã sử dụng
các thuốc khảo.
Cần đặc biệt chú ý thông bảo cho bảo sỹ trong những trường hợp sau
cos vos_oơ_zom - 4
#
n
- Nếu bạn đã sử dụng thuốc pentostatin (= deoxycoformycin) (pentostatin là một thuốc hóa
trị liệu được sử dụng để điều trị một loại bệnh bạch cầu đặc biệt [bệnh bạch cầu tế bảo
nhung mao]). Trong trường hợp nảy, bạn không được sử dụng thuốc Fludarabin ““Ebewe".
- Một số thuốc chống đông mảu như dipyridamol (dipyridamol thuộc nhóm thuốc chống
kết tập tiếu cấu giúp ngăn ngừa hinh thảnh cục máu đông) có thế lảm giảm hiệu quả của
thuốc Fludarabin “Ebewe”.
— Tương tảc có thể xảy ra khi sử dụng đồng thời fiudarabin phosphat với cytarabin (Ara-C)
là một thuốc được sử dụng để điều trị bệnh bạch cầu bạch huyết mạn tính. Nếu hai thuốc
nảy được phối hợp, nồng độ dạng có hoạt tính cùa fludarabin phosphat trong tế bảo có thể
tăng lên. Tuy nhiên, nồng độ thuốc tổng cộng trong máu vả sự thải trừ thuốc ra khỏi mảu
không thay đối.
11. CẨN LÀM GÌ KHI MỘT LẨN QUÊN KHÔNG DÙNG THUỐC
Bảc sỹ của bạn sẽ đưa ra lịch trình sử dụng thuốc của bạn. Nếu bạn nghĩ rằng có thể bạn đã
quên sử dụng một liều thuốc, hãy thông bảo ngay vởi bảc sỹ cùa bạn.
12. CÂN BẢO QUẢN THUỐC NÀY NHƯ THẾ NÀO ' /
Đỉều kiện bảo quản: Bảo quản trong tủ lạnh 2 … s°c
Điều kiện bảo quản dung dịch thuốc pha loãng: xem mục Hạn dùng cùa thuốc.
13. NHỮNG DÁU HIỆU vÀ TRIỆU CHỨNG KHI DÙNG THUỐC QUÁ LIÊU
Liều cao của thuốc Fludarabin “Ebewe” có thể gây ra cảc tác dụng không mong muốn trên
thần kỉnh trung ương không hổi phục với bỉều hiện mù, hôn mê và tử vong xảy ra muộn.
Liều cao cùa thuốc cũng có thể gây gìảm đảng kể số lượng một số loại tế bảo mảu như gỉảm
tiếu cầu mức độ nặng (gây bầm tím và chảy mảu) và giảm bạch cầu trung tính (lảm tăng nguy
cơ nhiễm trùng) do giảm hoạt động cùa tùy xương (suy tủy).
14. CẨN PHÁ! LÀM GÌ KHI DÙNG THUỐC QUÁ LIÊU KHUYẾN CÁO
Không có thuốc giải độc đặc hiệu cho quá liều thuốc Fludarabin “Ebewe”. Nếu bạn sử dụng
quá liều thuốc Fludarabin “Ebcwe”, bảc sỹ sẽ cho bạn ngừng thuốc và diểu trị triệu chứng.
15. NHỮNG ĐIỀU CÀN THẬN TRỌNG KHI DÙNG THUỐC NÀY
- Do thảnh phần hoạt chất cùa thuốc lá fludarabin phosphat với nồng dộ 25 mglml có hoạt
tính rất mạnh.
Do đó, thuốc có thể gây độc và gây ra các tảc dụng không mong muốn rất nghiêm trọng.
Do những lý do nảy, trong trường hợp bạn được kê đơn fludarabin phosphat 25 mglml,
bảo sỹ sẽ theo dõi chặt chẽ tình trạng của bạn Bên cạnh đó, việc bạn thông báo cho bác
sỹ tất cả các tảc dụng không mong muốn xảy ra trong quá trình sử dụng fludarabin
phosphat 25 mng là rất quan trọng. Bạn cân chủ ý đến một số tác dụng không mong
muôn được mô tả dưới đây:
- Bạn cảm thấy không khỏe. Điểu nảy rất quan trọng vì có thề tủy xương của bạn không
hoạt động bình thường, hệ miễn dịch của bạn suy giảm và bạn dễ măc cảc loại nhiễm
trùng
- Sau khi bị chấn thương, bạn phảt hiện thấy bầm tím bất thường hoặc chảy mảu quá mức.
Hiện tượng nảy có thể cho thấy sự giảm các tế bảo máu khỏe mạnh.
cos v03_06_2016 - 5
|…
Thay đồi trên da như nối mẩn hoặc mụn rộp. Điều nảy rất quan trọng trong trường hợp
bạn có ung thư da.
Nếu bạn gặp phải một trong cảc tảc dụng khộng mong muốn được mô tả ở trên bác sỹ có
thể quyết định không cho bạn sử dụng thuốc fludarabin phosphat 25 mg/ml hoặc dùng
thuốc với thận trọng đặc biệt.
Bạn sẽ được xét nghiệm mảu thường xuyên trong quá trình điều trị.
Nếu bạn bị gia tăng nhiễm trùng (nếu bạn bị suy giảm miễn dịch hoặc có tiền sử bị nhiễm
trùng nặng).
Hệ miễn dịch của bạn có thể tấn công nhiều bộ phận khảc nhau trong cơ thể (gọi là “hiện
tượng tự miễn ) và trực tiếp chống lại cảc tế bảo hồng cần (gọi là tan mảu tự miễn ’.)
Tình trạng nảy có thể gây đe dọa tính mạng, thậm chí tử vong. Trong trường hợp nảy, bạn
sẽ được sử dụng thêm các liệu pháp điều trị khảo như truyền mảu (mảu đã được chiếu xạ,
xem thông tin bên dưới) và adrenocorticoid.
Khi bạn sử dụng thuốc lìều cao Khi fludarabỉn phosphat 25 mglml được sử dụng trên
bệnh nhân có bệnh bạch cầu cấp tinh với liều rất cao (cao tới gâp 4 lần so với liều khuyến
cáo cho bệnh bạch cầu lympho mạn tính), '/z số bệnh nhân gặp phải các tác dụng không
mong muốn trên hệ Ithần kinh trung ương mức độ nặng (bao gôm mù, hôn mê và tử vong).
Cảc triệu chứng xuất hiện từ 21 đến 60 ngảy kế từ liêu thuốc cuối cùng. Trên bệnh nhân
sử dụng liểu khuyến cảo sau khi đã điều trị bằng một số loại thuốc khảo hoặc cùng thời
điềm với các loại thuốc khảc, một số tảc dụng không mong muốn đã được ghi nhận bao
gồm: rối loạn thần kinh với biếu hiện đau dầu, buồn nôn vả nôn, co giật, rôi loạn thị giác
bao gồm mất thị giảc, thay đối trạng thải tâm thần (ý nghĩ bất thường, ]ủ lẫn, giảm nhận
thức) và đôi khi xảy ra rối loạn thần kinh cơ với biều hiện yếu cơ tại cảc chi (bao gổm liệt
toản bộ hoặc một phần không hổi phục) (cảc đấu hiệu của bệnh lý chất !rắng, bệnh lý não
chẩt trắng nhiễm độc cáp hoặc hội chứng chất lrắng não sau có hồi phục (RPLS))
Trên bệnh nhân sử dụng liều cao gấp 4 lần so với liều khuyến cáo, mù, hôn mê vả tử vong
đã được báo cáo. Một số triệu chứng xảy ra muộn trong vòng 60 ngảy hoặc hơn sau khi
đã ngừng thuốc. Trên một số bệnh nhân sử dụng thuốc Fludarabin “Ebewe” với liều cao
hơn liều khuyến cáo, bệnh lý chất trắng (LE), bệnh lý nảo chất trắng nhiễm dộc cấp
(ATL) hoặc hội chứng chất trắng nảo sau có hồi phục (RPLS) cũng dã được báo cảo. Cảc
triệu chứng tương tự của LE, ATL hoặc RPLS như đã được mô tả ở trên có thể xảy ra.
LE, ATL vả RPLS có thể không hồi phục, đe dọa tính mạng hoặc gây tử vong.
Bắt cứ khi nâo nghi ngờ LE, ATL hoặc RPLS, bạn cần ngừng thuốc Fludarabin “Ebewe”
và được đảnh giả thêm.
Nếu chấn đoản LE, ATL hoặc RPLS được khẳng định, bảc sỹ sẽ cho bạn ngừng vĩnh viễn
thuốc Fludarabin “Ebewe”.
Khi bạn sử dụng fludarabin trong một khoảng thời gian dải. Ảnh hưởng cùa fiudarabin
phosphat 25 mglml lên hệ thần kinh trung ương chưa được biết rõ. Tuy nhiên, một vải
bệnh nhân có thể dung nạp với liều khuyến cảo tới 26 chu kỳ điều tn_.
Nếu bạn cần được truyền mảu và bạn đang (hoặc vừa mởi) được điều trị bằng fludarabin
phosphat 25 mglml, bạn cần thông bảo diều nảy cho bảc sỹ. Bảc sỹ sẽ cần phải chẳc chắn
rãng mảu sử dụng để truyền cho bạn đã được xử lý qua một quy trình đặc biệt (mảu đã
được chiếu xạ). Đã có những biến chứng nghỉêm trọng, thậm chí tử vong được ghi nhận
khi truyền mảu không được chiếu xạ.
C DS v03_06_2016 — 6
- Nếu bạn cần lấy tế bảo gốc vả bạn đang (hoặc vữa mới) được điều trị bằng fiudarabin
phosphat 25 mglml, hãy thông báo với bác sỹ vê điêu nảy.
- Khi bạn cần tiêm vắc xin; hăy tham khảo ý kiến của bác sỹ do cảc loại vắc xin sống dược
khuyến cảo nên tránh sử dụng trong quá trình điều tu và sau khi điều trị bằng fludarabin
phosphat 25 mglml.
— Nếu bạn có bệnh bạch cầu lympho mạn tinh mức độ nặng; cơ thể cùa bạn có thể không có
khả năng loại bỏ cảc chất thải từ tế bảo bị phá hùy bởi fludarabin phosphat 25 mg/ml; dẫn
đến mất nước suy thận và các vấn đề về tim. Bảo sỹ cùa bạn nắm được vân đề nảy và có
thể sẽ cho bạn sử dụng các thêm cảc thuốc khảc để xử trí.
- Nếu bạn bị ung thư da, tổn thương da có thể trở nên nặng hơn khi bạn sử dụng thuốc nảy.
Hãy thông bảo vởi bác sỹ nên bạn phảt hiện bất kỳ thay đổi nảo trên da trong quá trình sử
dụng thuốc hoặc kể cả sau khi bạn đã ngưng thuốc.
~ Trẻ em và trẻ vị thảnh niên: Hiện không có dữ liệu liên quan đến việc sử dụng thuốc
fiudarabin phosphat 25 mglml trên trẻ em và trẻ vị thảnh niên.
— Nam giới và phụ nữ có khả nãng sinh sản cằn sử dụng biện phảp trảnh thai hỉệu quả trong
quá trình điều trị và ít nhất 6 thảng sau khi ngùng điểu trị. Xem thêm mục “Thời kỳ mang
thai, cho con bú và ảnh hưởng trên khả nảng sinh sản”
- Nếu bạn có bệnh thận hoặc trên 65 tuối, bạn cần dược kiếm tra chức năng thận thường
xuyên. Nếu chức năng thận cùa bạn suy giảm, bạn sẽ được sử dụng thuốc fiudarabin
phosphat 25 mng với mức liều thấp. Nếu chức nãng thận cùa bạn suy giảm nghiêm
trọng, bạn không được sử dụng thuốc nảy.
— Nếu bạn trên 75 tuổi, bạn sẽ được sử dụng thuốc fludarabin phosphat 25 mglml một cách
thận trọng.
Thuốc chứa ít hơn 1 mmol natri (23 mg) trên mỗi liều, nên được xem lá không chứa natri.
Hãy thông báo cho bác sỹ nêu bạn đang hoặc đã có một trong những tình trạng được mô tả ở
trên.
Thời kỳ mang thai, cho con bú vả ânh hưởng trên khả năng sinh sản
Thời g mang thai
Không sử dụng thuốc Fludarabin "Ebewe" nếu bạn đang mang thai trừ khi bác sỹ chỉ định
cho bạn dùng thuốc. Các nghiên cứu trên động vật và một số thông tin hạn chế trên người cho
thấy thuốc có nguy cơ gây dị tật trên thai nhi đang phảt triển.
Ảnh hưởng lên khả năng sinh sản
Nếu bạn là phụ nữ trong độ tuổi sinh sản, bạn cần tránh thai trong suốt quá trinh đìễu trị và
trong ít nhất 6 thảng sau khi ngừng điều trị. Tuy nhiên, trong trường hợp bạn có thai, hãy
thông báo ngay cho bác sỹ của bạn.
cos v03_06_2016 - 7
Ắ °/
Nam giới có khả nãng sinh sản điều trị bầng thuốc Fludarabin "Ebewe" cần sử dụng biện
phảp tránh thai hỉệu quả trong quá trinh điều trị và trong vòng ít nhất 6 thảng sau khi ngừng
điều trị.
Thời kỵ` cho con bú
Thuốc Fludarabin "Ebewe" có vảo sữa mẹ hay không chưa được biểt rõ. Tuy nhỉên, thử
nghiệm trên động vật cho thấy thuốc có mặt trong sữa. Do đó, bạn không dược cho con bú
trong quả trinh sử dụng thuốc nảy.
Nếu bạn đang mang thai hoặc cho con bủ, hoặc nghĩ rằng bạn có thể đang mang thai, hoặc
đang có kế hoạch mang thai, hãy tham khảo ý kiến tư vấn cùa bác sỹ trước khi sử dụng thuốc
nảy.
Ảnh hưởng của thuốc lên khả năng lái xe và vận hânh máy móc
Nếu bạn phảt hiện thấy thuốc Fludarabin “Ebewe” ảnh hưởng lên khả năng lải xe và vận hảnh
mảy móc, hãy thông bảo ngay cho bảc sỹ của bạn. Fludarabin phosphat có thể lảm giảm khả
năng lảỉ xe và vận hảnh mảy móc do một số tảc dụng không mong muốn như mệt mòi, yếu
mệt, rối loạn thị giảc, lú lẫn, kích động và co giật đã dược ghi nhận.
16. KHI NÀO CẨN THAM VẤN BÁC SỸ, DƯỢC SỸ
Nếu bạn có thắc mắc nằm ngoải tờ hưởng dẫn sử dụng nảy, hãy hỏi bác sỹ hoặc dược sỹ của
bạn.
Nếu bạn gặp phải bất kỳ tảc dụng không mong muốn nảo, bao gồm cả những tảc dụng không
mong muốn chưa dược liệt kê trong tờ hướng dẫn sử dụng nảy, hãy thông bảo cho bảo sỹ
hoặc dược sỹ cùa bạn
17. HẠN DÙNG CỦA THUỐC
- Hạn dùng: 36 thảng kế từ ngảy sản xuất.
- Hạn dùng sau khi pha loãng: Về phương diện vi sinh học, cần sử dụng chế phẩm đã pha
loãng ngay lập tức. Nếu chưa sử dụng ngay lập tức, thì người dùng phải chịu trảch nhiệm về
thời gian bảo quản vảo điều kiện bảo quản trước khi đem dùng, nhưng thông thường không
kéo dải quả 24 giờ ở 2 - 8°C, trừ khi sự pha loãng đã tiến hảnh trong cảc điều kiện vô khuẩn
dược kiềm soát kỹ lưỡng và đảng tin cậy.
18. TÊN VÀ ĐỊA CHỈ CỦA cơ sở SẢN XUẤT
Ebewe Pharma Ges.m.b.H.Nfg.KG
Mondseestrasse 11, 4866 Unterach am Attcrsee, Áo
19. NGÀY XEM XÉT SỬA ĐÓI, CẬP NHẬT LẠI NỘI DUNG HƯỚNG DẨN sử
DỤNG THUỐC
xx/xxlxxxx
C DS v03_06_2016 - 8
B. PHÀN HƯỚNG DẤN SỬ DỤNG THUỐC CHO CÁN BỘ Y TẾ
1. CÁC ĐẶC TÍNH DƯỢC HỌC
Các đặc tính dược lực học
Nhóm dược lý - Điều trị: Thuốc chống ung thư, chẩl chống chuyền hóa, chất tương tự purin
MãATC: L OIBB 05
Cơ chế
Fludarabỉn chứa fludarabin phosphat là một nucleotid fluor hòa tan trong nước, đồng đắng
với chắt chống virus vidarabin 9—[3—D—arabino- furamosyladenin (ara—A,) tương đối đề
khảng với sự mất amin qua xúc tác của adenosin — desaminase.
Fludarabin phosphat bị khử phosphoryl nhanh để cho ra 2F—ara—A, chất chuyển hoá nảy sẽ
được tế bảo thu nạp và sau đó lại được phosphoryl hoá trong tế bảo qua xúc tác cùa
desoxycitidin kinase để cho ra triphosphat có hoạt tính (tức 2F—ara—ATP). Chất chuyển hoá
2F—ara—ATP nảy sẽ ức chế cảc enzym ribonucleotid reductase, ADN — polymerase u/[3 và 8,
DNA primase vả DNA ligase, qua do ngăn ngừa được sự tống hợp DNA. Tiếp đó, sự ức chế
từng phần enzym RNA polymerase II và hệ quả lả lảm giảm sự tổng hợp protein.
Vì một số cơ chế tác dụng cùa 2F—ara—ATP còn chưa rõ rảng, cho nên người ta cho rằng tất
cả các tảo dụng trên sự tổng hợp DNA, RNA vả protein, sẽ góp phần ức chế quá trinh tăng
trướng cùa tế bâo, trong đó ức chế tổng hợp DNA đóng vai trò là yếu tố chính. Hơn nữa, cảc
nghiên cứu in vitro cho thấy sự phơi nhiễm của lymphô bảo CLL với 2F—ara—A gây khởi phát
đặc tính phân mảnh ADN và gây chết tế bảo diện rộng của quá trình tế bảo tự chết theo
chương trình (apoptosis).
Tính hiêu quả và độ ạn toản
Nghiên cứu pha … bao gồm các bệnh nhân trước đó bị CLL tế bảo B chưa được điểu trị, so
sảnh giữa 195 bệnh nhân dùng fiudarabin và 199 bệnh nhân dùng clorambucil (40 mglm²)
nhắc lại từng 4 tuần cho thấy kết quả như sau:.
Kết quả cho thấy tỷ lệ đảp ứng tổng thế và tỷ lệ đáp ứng hoản toản ở nhỏm sử dụng
fiudarabin oao hơn có ý nghĩa thống kê so với nhóm sử dụng clorambucil (61,1% so với
37,6% và 14,9% so với 3,4%, tương ứng). Ngoải ra, nhóm sử dụng fludarabin có thời gian
đảp ứng và thời gian duy trì tác dụng cũng dải hơn có ý nghĩa thống kê so với nhóm sử dụng
clorambucỉl (19 thảng so với 12,2 thảng và 17 tháng so vởi 13,2 tháng, tương ứng). Trung vị
thời gian sống thêm lả 56,1 thảng ở nhóm sử dụng fiudarabin và 55,1 tháng ở nhóm sử dụng
clorambucil vả không ghi nhận sự khác biệt có ý nghĩa thống kê về điểm tổng trạng gỉữa hai
nhóm. Tỷ lệ bệnh nhân có xuất hiện độc tính cùa thuốc tương tự giữa hai nhóm, 89,7% ở
nhóm dùng fiudarabin và 89,9% ở nhóm dùng clorambucil. Mặc dù tỷ lệ xuất hiện độc tính
trên huyết học nói chung giữa hai nhóm không có sự khảo biệt có ý nghĩa thống kê, tỷ lệ ghi
nhận dộc tính trên bạch cầu và bạch cầu lympho ở nhóm đùng 11udarabin cao hơn có ý nghĩa
thống kê so với nhóm dùng clorambucil (giá trị p tương ứng p=0,0054 vả p=0,0240). Tỷ lệ
C DS v03_06_2016 - 9
ghi nhận cảc phản ứng buồn nôn, nỏn, tiêu chảy vả dộc tính trên gan ở nhóm dùng fludarabin
thắp hơn có ý nghĩa thống kê so với nhóm dùng clorambucil (giá trị p tương ứng p<0,0001,
p<0,0001 , p=0.0489 vả p=0,0487).
Bệnh nhân đã oó đáp ứng tốt với fiudarabin trước đó sẽ có đảp ứng được với đơn trị liệu
fludarabin.
Một thử nghiệm ngẫu nhiên so sảnh fludarabin với phối hợp cyclophosphamid, adriamycin vả
prednìson (phảc dỗ CAP) được tỉến hảnh trên 208 bệnh nhân bị bệnh bạch cầu lympho mạn
tính giai đoạn B hoặc c theo thang phân loại Binet. Kết quả phân tích dưới nhóm gồm 103
bệnh nhân đã được điều trị trước dây cho thắy: tỷ lệ đảp ứng tổng thế và tỷ lệ đáp ứng hoản
toản cao hơn ở nhóm dùng fludarabin so với nhóm dùng phác đồ CAP (45% so với 26% và
13% so với 6%, tương ứng); thời gian duy trì tảo dụng và thời gian sống thêm toản bộ tương
đương giữa nhóm dùng fludarabin và nhóm dùng phác đồ CAP. Trong khoảng thời gian 6
tháng điều trị, số ca tử vong ở nhóm dùng fludarabin là 9 ca và ở nhóm dùng phảo đồ CAP là
4 ca.
Phân tích hậu kiểm chỉ sử dụng dữ liệu trong vòng 6 thảng từ khi bệnh nhân bắt đầu điều trị
cho thấy sự khảo biệt giữa đường cong sống sót fludarabin vả phảc đồ CAP; trong đó, phác
đồ CAP cho kết quả ưu thế hơn trong phân tích ở nhóm bao gồm những bệnh nhân giai ở giai
đoạn c theo thang phân loại Binet và đã được điều trị trưởc đó.
Các đặc tính dược động học
Dươc đông hoc cùa fludarabin (2F—ara-A) trong huvểt tương vả nước tiếu: Tinh chất dược
động học cùa t1ndarabin phosphat được nghiên cứu sau khi tỉêm tĩnh mạch và sau khi truyền
tĩnh mạch ngắn hạn và dải hạn fludarabin phosphat (2F—ara-AMP) cho bệnh nhân ung thư.
Không phảt hiện thấy sự tương quan rõ rảng giữa dược động học cùa 2F-ara—A và hiệu quả
điều trị trên bệnh nhân ung thư. Tuy nhiên, quá trình ghi nhận biến cố giảm bạch cầu trung
tính và thay đối hematocrit cho thấy độc tính ức chế tạo máu của fludarabin phosphat phụ
thuộc liều dùng.
Phân bố và chuỵến hóa
2F-ara-AMP là một tiền thuốc cùa fludarabin (21²-ara-A), tan trong nước. Trong cơ thế, chất
nảy được khử phospho một cách nhanh chóng và có thể định lượng được thảnh nucleosid
fludarabin (2F-ara-A).
Một chất chuyến hóa khác là 2F-ara-hypoxanthin. Đây là chất chuyền hóa chính ghi nhận trên
chó và chỉ một lượng nhỏ ohất nảy được phát hiện ở người.
Sau khi truyền liều đơn 25 mg/m² 2F-ara—AMP trong vòng 30 phút cho bệnh nhân mắc bệnh
bạch cầu lympho mạn tính, nổng độ tối đa trung bình trong huyết tương của 2F-ara-A là 3,5 —
3,7 ụM, đạt được sau khi truyền xong. Tương ứng với nồng độ cùa 2F—ara—A sau khi dùng
liều.thứ 5 cho thấy thuốc tích lũy ở mức độ vừa với nồng độ tối đa trung bình là 4,4 … 4,8
ụM, đạt được sau khi truyền xong. Trong liệu trình điều trị 5 ngảy, nồng độ đảy trong huyết
tương cùa 2F-ara—A tăng lên khoảng gấp đôi. Sự tich lũy 2F-ara-A sau một số chu kỳ điều trị
là không đảng kể và có thể bỏ qua. Sau khi đạt nồng độ tối đa, nồng độ thuốc giảm dần theo
cos v03_06_2016 - 10
ba pha phân bố với thời gian bản thải bạn đầu lả khoảng 5 phủt, thời gian bán thải trung gian
là 1-2 giờ và thời gian bản thải cuối cùng lả khoảng 20 giờ.
Một so sánh giữa các nghiên cứu về dược động học của 2F-ara—A cho thấy độ thanh thải
huyết tương (CL) tổng oộng trung bình lả 79 :1: 40 mllphủtlm² (2,2 :t 1,2 mllphútlkg) vả thể
tích phân bố trung bình (Vss) là 83 i 55 l/m² (2,4 t 1,6 l/kg). Cảo dữ liệu cho thấy có sự khác
biệt lớn giữa cảc cả thế. Sau khi dùng f1udarabin phosphat đường tĩnh mạch và đường uống,
nồng độ trong huyết tương cùa 2F-ara-A và diện tich dưới đường cong nổng độ huyết tương
theo thời gian tăng tuyến tính với liều dùng, trong khi thời gian bán thải, độ thanh thải huyết
tương vả thế tich phân bố duy tri không đối, độc lập với liều dùng.
Thải trừ
Một lượng lớn 2F-ara-A được thải trừ thông qua bải tiết qua thận. 40-60% liều dùng đường
tĩnh mạch được bải biết qua nước tiều. Cảo nghiên cứu trên động vật thực nghỉệm sử đụng
3H-2F—ara-AMP cho thấy cảc chất ghi dấu phóng xạ được thu hồi hoản toản trong nước tiều.
Đối tương đăc bỉêt
Bệnh nhân suy thận có giảm thanh thải thuốc ra khỏi cơ thể do đó cần giảm liều trên dối
tượng nảy. Thực nghiệm in vitro trên protein huyết tương người cho thấy 2F-ara-A xu hướng
lỉên kết thấp cùa thuốc với protein huyết tương.
Dược động học tế bảo của jludarabin phosphat.
2F-ara-A được vận chuyền chủ động vảo tế bảo ung thư dòng bạch cầu và sau đó nhanh
chóng được phosphoryl hóa lại thảnh dạng monophosphat và dạng di vả triphosphat. 2F—ara-
ATP triphosphat lả chất chuyển hóa nội bảo chính và là chất chuyến hóa duy nhất có tác dựng
gây độc tế bảo. Nồng độ tối đa của 2F—ara-ATP trong tế bảo lympho ở bệnh nhân bị bệnh
bạch cầu lympho mạn tính đạt được sau khoảng 4 giờ vả có sự dao động lớn với giá trị trung
vị cùa nồng độ đỉnh khoảng 20 ụM. Nồng độ trong tế bảo ung thư cùa 2F-ara-ATP thường
cao hơn rõ rệt so với nồng dộ tối đa trong huyết tương cho thấy sự tích lũy thuốc tại vị trí tảo
dụng. Nuôi cấy in vítro tế bảo ung thư dòng bạch cầu cho thẩy mối quan hệ tuyến tính giữa
mức độ phơi nhiễm 2F-ara-A ngoại bảo (nồng độ 2F-ara-A và thời gian nuôi cấy) và nồng độ
2F-ara—ATP nội bảo. Quá trình thải trừ 2F-ara-ATP khỏi tế bảo đích có trung vị thời gian bản
thải là 15-23 giờ.
2. CHỈ ĐỊNH:
Bệnh bạch cầu lymphô bảo mạn tính (CLL) thuộc tuýp tế bảo B ở bệnh nhân trường thảnh
còn đủ chức năng tuý xương.
Điều trị đầu tay fludarabin 25 mg/ml chỉ nên được bắt đầu ở những bệnh nhân có bệnh tiến
trỉến, giai đoạn Rai III/IV (Binet giai đoạn C), hoặc giai đoạn Rai IlII (Binet giai đoạn AÍB),
trong những trường hợp mà bệnh nhân có triệu chứng hoặc có bằng chứng liên quan đển bệnh
tiên triên.
s. LIÊU DÙNG VÀ CÁCH DÙNG:
CDS v03_06_20l6 - ]]
"Ể)A
Người lởm
Liều khởi dầu thông thường cùa F ludarabin “Ebewe” là mỗi ngảy 25 mg/m², dùng đường tĩnh
mạch trong 5 ngảy trong mỗi 28 ngảy.
Liều cần oó (tính toản dựa vảo diện tích cơ thể bệnh nhân) được lấy vảo một ống tiêm. Đề
tiêm tĩnh mạch, thì liều đó được pha loãng trong 10 m] dung dịch natri chlorỉd 0,9%. Liều cần
thiết có thể pha loãng trong 100 ml dung dịch natri chlorỉd 0,9% để truyền tĩnh mạch trong
khoảng thời gian khoảng 30 phủt.
Thời gian điều trị tuỳ thuộc vảo thảnh công của điều trị và sự dung nạp với thuốc.
Ở bệnh nhân có bệnh bạch cằn lympho bảo mạn tinh, khuyến oảo dùng Fludarabín “Ebewe”
cho đến khi có đảp ứng tốt (thuyên giảm hoản toản hoặc một phần, thường lả sau 6 chu kỳ)
và sau đó ngừng dùng thuốc.
Bệnh nhân suy chức năng gan:
Chưa có dữ liệu có giá trị về sử dụng Fludarabin “Ebewe” cho bệnh nhân suy gan. Với cảc
đối tượng nảy, cần dùng thận trọng Fludarabin “Ebewe”.
Bệnh nhân suy chức năng thận:
Cần giảm liều ở bệnh nhân suy thận. Nếu ch, trong khoảng 30-70 mllphủt, thì phải giảm liều
thuốc nảy tới 50% vả phải theo dõi chặt chẽ về huyết học để đảnh giả độc tính cùa thuốc.
Phải chống chỉ định dùng Fludarabin “Ebewe” khi độ thanh thải creatin Clor dưới 30 mllphủt.
T rẻ em và thiếu niên:
Không khuyến cảo sử dụng Fludarabỉn “Ebewe” ở trẻ em và thiểu niên dưới 18 tuổi do thiếu
dữ liệu về hiệu quả và độ an toản.
Người cao tuổi:
Dữ liệu cho sử dụng fiudarabin phosphat ở người cạo tuổi (>75 tuối) còn hạn chế, thận trọng
khi chỉ định f]udarabin cho cảc đối tượng bệnh nhân nảy.
ò bệnh nhân từ 65 tuổi trở lên, cần đo độ thanh thải creatinin trưởc khi bắt đẩu diều trị (Xem
mục “Bệnh nhân suy chức nãng thận” và mục “Thận trọng khi đùng thuốc”).
Cách dùng
Cần dùng Fludarabin “Ebewe” dưới sự giảm sảt cùa nhân viên y tế đã được đảo tạo vả có
kinh nghiệm trong việc sử dụng cảc thuốc điều trị ung thư.
Đặc biệt lưu ý fludarabin chi được khuyến cáo sử dụng đường tĩnh mạch. Chưa ghi nhận
trường hợp nảo xảy ra phản ứng tại chỗ nghiêm trọng liên quan đến việc sử dụng fludarabin
ngoải đường tĩnh mạch. Tuy nhiên, cần tránh xảy ra trường hợp vô tình tỉêm ngoải đường
tĩnh mạch fludarabin.
Thân trong cần lưu ý trước và trong` quá trình quản lý và sử dung thuốc
Hướng dẫn về cảch quản lý và hoản nguyên thuốc trước khi sử dụng.
4. CHỐNG CHỈ ĐỊNH:
Chống chỉ định Fludarabin “Ebewe” trong những trường hợp sau:
— Bệnh nhân quả mẫn oảm với hoạt chất và với các thảnh phần cùa ohế phấm.
- Bệnh nhân suy chức năng thận vả độ thanh thải creatinin Clcr dưới 30 ml/phủt;
— Bệnh nhân thiếu máu tan mảu mất bù.
- Thời kỳ cho con bú.
cos v03_06_2016 … n
s. THẬN TRỌNG KHI DÙNG THUỐC
Suy tủy
Suy tùy nặng, thiếu mảu rõ rệt, giảm tiều cầu và giảm bạch cầu trung tính đã được ghi nhận
trên cảc bệnh nhân sử dụng fiudarabin. Trong một nghiên cứu pha 1 sư dụng thuốc theo
đường tĩnh mạch trên người lớn có khối u rắn, trung vị thời gian bạch cầu hạt giảm tới
ngưỡng tối thiều là 13 ngảy (dao động từ 3—25 ngảy), giá trị nảy đối với tiểu cầu là 16 ngảy
(dao động từ 2-32 ngảy). Đa số cảc bệnh nhân đã có biều hiện suy giảm chức năng tạo mảu
trước khi dùng thuốc do diễn biến cùa bệnh hoặc do sử dụng phảc đồ ức chế tùy trước dó.
Suy tủy tích lũy có thể xảy ra. Mặc dù suy tùy do hóa trị liệu gây ra thường có khả nãng hồi
phục, cần giám sát chặt chẽ các thông số huyết học trong khi sử dụng fiudarabin phosphat.
Fludarabin là một tảo nhân ức chế khối u mạnh với khả năng gây độc tính không mong muốn
đảng kể. Cần giảm sát chặt chẽ các dắu hiệu độc tinh liên quan đến huyết học và cảc độc tính
khác trên bệnh nhân được điều trị bằng phảc đổ nảy. Khuyến cảo xét nghiệm định kì số lượng
tế bảo mảu ngoại vì để phảt hiện sự tiến triến cùa thiếu mảu, giảm bạch cầu trung tinh và
giảm tiếu cầu.
Một số trường hợp suy tùy hoặc bất sản tùy ảnh hướng đến cả 3 dòng tế bảo mảu lảm giảm
huyết cầu toản bộ, dôi khi dẫn đến tử vong đã được ghi nhận trên các bệnh nhân trưởng
thảnh. Khoảng thời gian xuất hiện giảm tế bảo mảu có ý nghĩa lâm sảng trong cảc trường hợp
đã được ghi nhận dao động từ 2 thảng đến 1 nảm. Bỉến cố nảy được ghi nhận trên cả bệnh
nhân đã được điều trị cũng như chưa được điều trị trước đó.
Tương tự các tảo nhân gây độc tế bảo khảo, cần thận trọng khi sử dụng fiudarabin phosphat
khi cân nhắc tiếp tục thu tế bảo gốc tạo máu.
Bênh tư miễn
Không phân biệt có hay không có tiền sử mắc bệnh tự miễn và kết quả cùa thử nghiệm
Coombs, những hiện tượng tự miễn (xem mục Tác dụng không mong muốn) đe dọa tính
mạng, đôi khi dẫn đến tử vong đã được ghi nhận trong vả sau khi sử dụng fiudarabin. Phần
lớn các bệnh nhân đã trải qua thiếu máu tan huyết sẽ tải phát biến cố nảy khi tải sữ dụng
fiudarabin. Cảo bệnh nhân đang diều trị bằng fludarabin cần được theo dõi chặt chẽ cảc dấu
hiệu tan huyết.
Khuyến cáo ngừng điều trị bằng fiudarabin khi xuất hiện dấu hiệu tan huyết. Truyền máu
(chiếu xạ, xem phần trên) vả cảc dạng bảo chế cùa corticoid thượng thận là những phương
pháp điều trị thiêu máu ta.n mảu tự miễn phổ biến nhất.
Đôc tính thần kinh
Ành hưởng của việc sử dụng dải ngảy fiudarabin trên hệ thần kinh trung ương chưa được xảo
định. Tuy nhiên, trong một số nghiên cứu, các bệnh nhân có khả năng dung nạp với mức lỉều
khuyến cảo trong thời gian tương đối dải (lên đến 26 đợt điều trị). Cần giảm sát ohặt chẽ
những dấu hỉệu bất thường trên thần kinh.
cos v03_06_2016 - 13
Trong các nghiên cứu dò liếu trên bệnh nhân mắc bệnh bạch cầu cấp, fludarabin liếu cao,
đường tĩnh mạoh có liên quan dến cảc tảo dụng không mong muốn nghiếm trọng trên thần
kinh như mù lòa, hôn mê và tử vong. Cảo triệu chứng xuất hiện sau 21 đến 60 ngảy kể từ liếu
cuối cùng. Độc tinh nghiếm trọng trên thần kinh trung uơng xuất hiện ở 36% bệnh nhân sử
dụng thuốc theo đường tĩnh mạch với mức liều cao gắp 4 lằn (96 mglm²/ngảy, trong 5-7
ngảy) mức liếu khuyến cáo. Trên cảc bệnh nhân sử dụng thuốc trong khoảng liều khuyến cảo
để điều trị bệnh bạch cầu lympho mạn, cảc độc tính trên hệ thần kinh trung ương thường
hiếm gặp (hôn mê, co giật và kích động), hoặc ít gặp (lú lẫn) (xem mục Tảo dụng không
mong muốn).
Trong giai đoạn hậu mại, độc tính thần kinh như trên có thể xuất hiện sớm hơn hoặc muộn
hơn so với cảc thử nghiệm lâm sâng.
Việc sử dụng fiudarabin có thể gây bệnh lý chất trắng (LE), bệnh lý não chất trắng nhiễm độc
cắp (ATL) hoặc hội chứng chất trắng não sau có hồi phục (RPLS).
Những biến cố bất lợi nảy nảy có thể xảy ra trong các trường hợp sau:
- Dùng thuốc ở liều khuyến cảo
o Thuốc được sử dụng sau hoặc sử dụng phối hợp cùng các thuốc khảo có khả năng gây
bệnh lý chất trắng, bệnh lý não chất trắng nhiễm độc oấp hoặc hội chứng chất
trắng não sau có hồi phục,
0 Hoặc thuốc được sử dụng trên bệnh nhân có các yểu tố nguy cơ khảo như thực hiện
chiếu xạ toản thân hoặc chiếu xạ hộp sọ, ghép tế bảo gốc tạo mảu, bệnh mảnh ghép
chống lại vật chủ, suy thận hoặc bệnh não gan.
Dùng thuôc với liêu cao hơn liêu được khuyên cao.
Các triệu chửng cùa bệnh lý chất trắng, bệnh lý não chẩt trắng nhiễm độc cắp hoặc hội chứng
chất trắng não sau có hồi phục bao gôm đau đầu, buồn nôn vả nôn, co giật, rối loạn thị giảc
như mất thị giảc, rối loạn bộ mảy cảm giảc, thiếu hụt thần kinh khu trú. Một số phản ứng
khảo có thể xảy ra bảo gồm viêm dây thần kinh thị giảc, viêm gai thị, 1ú lẫn, lơ mơ, kích
thích, liệt hai chi dướilliệt tứ chi, co cứng cơ và tiếu tỉện không tự chủ.
Bệnh lý chắt trắng, bệnh lý não chất trắng nhiễm dộc cấp hoặc hội chứng chất trắng não sau
có hôi phục có thế không hôi phục, gây đe dọa tính mạng, thậm chí tử vong.
Trong trường hợp nghi ngờ bệnh lý chắt trắng, bệnh lý não chất trắng nhiễm độc cấp hoặc hội
chứng chất trắng não sau có hồi phục, cần ngừng sử dụng fludarabin. Bệnh nhân cần được
theo dõi và thực hiện chụp chiếu não, tốt nhất nên sử dụng ohụp cộng hưởng từ hạt nhân
(MRI). Nếu chẩn đoản được xảo định, cần ngừng vĩnh viễn fludarabin.
Hôi chứng lỵ giải khôi u
Hội chứng ly giải khối u được ghi nhận trên những bệnh nhân bị bạch cầu lympho bảo mạn
tính có khối u kích thước lớn. Do fiudarabin có thế tạo ra đảp ứng sớm ngay trong tuần điều
CDS v03_06_20l6 - 14
trị đầu tiên, cần thận trọng khi sử dụng thuốc trên những bệnh nhân có nguy cơ gặp biến
chứng nảy, và những bệnh nhân trong đợt điêu trị đâu tiên nên được nhập viện
Bênh mảnh ghép chống lai vât chủ do truyền mảu
Bệnh mảnh ghép chống lại vật chủ do truyền máu (phản ứng gây ra bới CảC tế bảo lympho có
khả năng mỉễn dịch được truyền vảo vật chù) đã được ghi nhận sau khi truyền mảu không
được chiếu xạ trên cảc bệnh nhân sử dựng fludarabin. Tử vong do sự tiến triến của bệnh nảy
đã được ghi nhận với tần suất cao. Do đó, để giảm thỉếu tối đa nguy cơ bệnh mảnh ghép
chống lại vật chủ do truyền mảu, trong trường hợp cần phải truyền mảu, bệnh nhân đang điều
trị hoặc đã được điều trị bằng f1udarabin chỉ nên nhận máu đã được chiếu xạ.
ẺEM
Lâm trầm trọng thêm hoặc bùng phảt những tốn thương ung thư da trước đó cũng như khởi
phát ung thư da mới đã được ghi nhận trên một số bệnh nhân trong thời gian điều trị hoặc sau
khi điều trị bằng fludarabin.
Suy giảm thể trang
Trên những bệnh nhân suy giảm thể trạng, cần sử dụng fiudarabin một cảch thận trọng sau
khi đã cân nhăc kĩ nguy cơ/lợi ich. Đặc biệt là khi sử dụng thuốc trên cảc bệnh nhân suy giảm
chức năng tùy xương nặng (giảm tiếu cầu, thiếu mảu, vả/hoặc giảm bạch cầu hạt), bệnh nhân
. . -z - .. ' ~ Ă . L . ~ ? i . ~
suy giam mien dỊCh hoạc co tien sư mac bẹnh nhiem trung cơ họn.
ẵnyt_hâ_n
Độ thạnh thải toản phần cùa chất chuyến hóa chính trong huyết tương 2-F-ara—A có mối
tương qua… với độ thanh thải creatinin, chứng tỏ vai trò quan trọng cùa cơ chế bâi tiết qua
thận trong con đường thải trừ cùa chất nảy. Các bệnh nhân suy giảm chức năng thận có sự
tăng phơi nhiễm toản thân với chất nây (tăng AUC cùa 2—F-ara-A). Dữ liệu lâm sảng liên
quan đến sử dụng thuốc trên bệnh nhân suy giảm chức năng thận tương đối hạn chế (độ thanh
thải creatinin < 70 ml/phút).
Cần thận trọng khi sử dụng fludarabin trên bệnh nhân suy thận. Trên bệnh nhân suy giảm
chức nãng thận trung bình (độ thanh thải creatinin từ 30 - 70 mllphủt), cần giảm liếu lên tới
50% và giảm sảt bệnh nhân chặt chẽ (xem mục Lỉều lượng vả cảch sử dụng). Chống chỉ dịnh
fludarabin trên bệnh nhân có độ thanh thải creatinin dưới 30 mllphủt (xem mục Chống chỉ
định).
Người cao tuổi
Do chưa có đầy đủ dữ liệu về việc sử dụng fludarabin trên bệnh nhân cao tuổi (> 75 tuối), cần
thận trọng khi sử dụng thuốc trên đối tượng nảy.
Trên cảc bệnh nhân 2 65 tuổi, cần xảo định độ thanh thải creatinin trước khi bắt đầu điếu trị,
xem phần Suy thận vả mục Liều lượng và oảch sử dụng). ’
Thời kỵ` mang thai
CDS v03_06_2016 - 15
Khỏng nên sử dụng fludarabin trong thời kì mang thai trừ khi thực sự cần thiết (ví dụ, tình
huống đe dọa tinh mạng, không có lựa chon thay thế ạn toản hơn mà không lảm ảnh hưởng
đến lợi ích điều trị, bắt buộc phải dùng thuốc). Thuốc có nguy cơ gây bất lợi cho thai nhi
(xem mục Thời kỳ mang thai và cho con bủ). Bảo sĩ chỉ nên cân nhắc sử dụng fludarabin nếu
lợi ích vượt trội so với nguy cơ tiếm tảng đối với thai nhi.
Phụ nữ cần trảnh mạng thạị trong khi điếu trị bằng f]udarabin.
Phụ nữ có khả nảng mang thai cẩn được thông báo về cảc nguy cơ tiềm tảng đối với thai nhi.
Tránh thai
Phụ nữ có khả năng mang thai hoặc nam giới có khả năng sinh sản phải sử dụng cảc biện
phảp trảnh thai hữu hiệu trong thời gian điều trị và ít nhất 6 tháng sau khi ngừng điều trị (xem
mục Thời kỳ mang thai và cho con bủ).
Sử dung vaccin
Cần trảnh sử dụng vaccin sống trong quá trình điêu trị và sau khi điều trị bằng fludarabin.
Lưa chon tải điều tri sau khi điều tri khời đầu bằng fludarabin
Trên cảc bệnh nhân không đảp ứng với fiudarabin, cần trảnh chuyển từ phảc đồ fiudarabin
ban đầu sang phảc đồ clorambuci] do phần lớn các bệnh nhân đã khảng với fiudarabin cũng
khảng với clorambucil.
Thuốc chứa ít hơn 1 mmol natri (23 mg) trên mỗi liều, nên dược xem là không chứa natri
6. PHỤ NỮ có THAI VÀ CHO CON BÚ
- Mang Ihai:
Dữ liệu tiến lâm sảng trên chuột cống cho thấy có sự khuyếch tản f1udarabin vả/hoặc cảc chất
chuyền hóa của thuốc qua nhau thai. Cảo kết quả từ những nghiên cứu độc tính với phôi trên
chuột cống và thỏ cho thấy sử dụng thuốc theo đường tĩnh mạch có nguy cơ gây chết phôi và
dị tật bảo thai ở liều điều trị.
Có rất ít dữ liệu về việc sử dụng fiudarabin trên phụ nữ mang thai trong ba thảng đầu của thai
kỳ.
Không nến sữ dụng fiudarabin trong thời kì mang thai trừ khi thực sự cần thiết (ví dụ, tinh
huống đe dọa tính mạng, không có lựa chon thay thể an toản hơn mà không lảm ảnh hưởng
đến lợi ích điều trị, bắt buộc phải sử dụng thuốc). Thuốc có khả năng gây bất lợi đối với thai
nhi. Bảo sĩ chỉ nên cân nhắc sứ dựng t1ndarabin nếu lợi ích dự kiến thu được vượt trội so với
nguy cơ đối với bảo thai.
- T hời kỳ cho con bú:
Chưa xảo định được liệu thuốc nảy hoặc cảc chất chuyền hóa của nó có được bải tiết vảo sữa
người hay không. .
Tuy nhiên, bằng chứng từ cảc nghiên cứu tiền lâm sảng cho thẳy fludarabin phosphat vả/hoặc
các ohất chuyến hóa cùa thuốc nảy được vận chuyền từ mảu vảo sữa.
cos vos_oo_zmớ - l6
Do nguy cơ gặp phản ứng có hại nghiêm trọng cùa í]udarabin trên trẻ đang bú mẹ. chống ohi
định fludarabin trên phụ nữ đang oho con bú (xem mục Chống chỉ định).
Khả nãng sinh sản
Phụ nữ trong độ tuổi sinh dẻ cần được thông bảo về nguy cơ tiềm tảng đối với bảo thai.
Phụ nữ vả nam giới có khả năng sinh sản phải sử dụng cảc biện phảp trảnh thai hữu hiệu
trong thời gian điều trị và ít nhất 6 thảng sau khi ngừng điều trị (xem mục Thận trọng khi
dùng thuốc).
7. TÁC ĐỘNG LÊN NGƯỜI VẶN HÀNH MÁY MÓC, LÁ] TÀU XE, NGƯỜI LÀM
v1Ẹc TRÊN CAO VÀ CÁC TRƯỜNG HỢP KHÁC
Fludarabin có thế lảm giảm khả nảng lải xe và vận hảnh mảy móc do thuốc có thể gây cảc tảo
dụng không mong muốn như mệt mòi, suy nhược, rối loạn thị giảc, lú lẫn, ảo giảc, động kinh.
8. TƯO’NG TÁC THUỐC CỦA THUỐC VỚI CÁC THUỐC KHÁC VÀ CÁC LOẠI
TƯỢNG TÁC KHÁC
Nghiên cứu lâm sảng sử dụng fiudarabỉn phosphat phối hợp với pentostatin
(desoxycoformycin) để điều trị bệnh bạch cầu dòng lympho bảo đề khảng mạn tính (CCL), đã
gặp tỷ lệ cao không chấp nhận được về độc tính với phổi gây tử vong. Vì vậy, không khuyến
cảo sử dụng fludarabin phosphat phối hợp với pentostatin.
Hiệu lực điều trị cùa fiudarabin phosphat có thể bị giảm khi đùng chung với dipyridamol vả
cảc thuốc khác ức chế adenosin khảo.
Nghiên cửu in vitro và trong lâm sảng với cảc dòng tế bảo ung thư đã cho thấy có tãng nồng
độ đỉnh cùa ARA — CTP (dạng chuyền hóa hoạt động cùa cytarabin) trong tế bảo 6 tế bảo
bệnh bạch hầu cũng như sự phơi nhiễm toản thế trong tế bảo sau khi dùng fiudarabin
phosphat kết hợp với cytarabin. Nồng độ của ARA — C trong huyết tương và tốc độ đảo thải
cùa ARA — CTP thi không bị ảnh hưởng.
Tương kỵ
Thuốc nảy không được trộn lẫn với cảc sản phấm thuốc khác ngoại trừ cảc sản phầm được đề
cập trong mục 11. CÁC DẤU HIỆU CÀN LƯU Ý VÀ KHUYẾN CÁO - Thận trọng đặc
biệt khi thao tảc
9. TÁC DỤNG KHÔNG MONG MUÔN
Tóm tắt hồ sơ lâm sảng
Những tảo dụng phụ thường gặp nhất bảo gổm suy tuỳ (giảm bạch cầu trung tính, giảm tiều
cầu và thỉếu mảu), nhiễm khuấn bao gồm viêm phổi, sốt, buồn nôn, nôn và tiêu chảy. Những
tảo dụng phụ khảo thường gặp là mệt mòi, yếu ớt, viêm miệng, khó ờ, chảu ăn, phù, ớn lạnh,
bệnh thần kinh ngoại biên, rối loạn thị giảc vả phảt ban da. Nhiễm khuẩn cơ hội nghiêm trọng
cũng gặp ở bệnh nhân dùng fiudarabỉn phosphat. Cũng đã gặp tử vong lả hậu quả cùa cảc
hiện tượng có hại nghiêm trọng.
Danh muc tảo dung không mong muốn
cos v03_06_2016 - 17
Bảng dưới đây thống kê cảc biến oố bắt lợi theo phân loại hệ oơ quan MedDRA (MedDRA
SOCs). Tần suất được ước lượng dựa trên dữ liệu từ thử nghiệm lâm sảng, không tính tới mối
quan hệ nhân quả với fludarabin. Cảo phản ứng có hại hiếm gặp được xảo định chủ yếu từ cảc
dữ liệu được ghi nhận trong giai đoạn hậu mại.
Phân loại hệ Rẩt phổ biển Thường gặp Ỉt gặp Hiếm gặp Chưa xác
cơquan theo 21/10 ì IIIOO đển < ìl/IOOOđến
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng