





1
i
4 I
I
FIRMAGON 120mg Cidon 53-0-VN-02.04 (Prefilled Syringe);
' Prepored by MHT A (09-Mar-2015)
Aoịvrcmzoỳ ) %
Size: 108x62x120mm
il.` ẳ…
FIRMAIDN'UOmg ỉ i i Ễ
mmuouuưhndmtư… [
degarelix Ỉl .
lỈll #}
…an ` ỂIỄ'
BỘ Y TẾ
CỤC QUAN LÝ DUỢG~ ( < _iẾ'“ .x__`ủ
ĐA PHÊ DUYỆT hl. “fflẢ
Lãn dauỏ/(ffl'Ắ’Ể F_ mM_âfẸẸỊẸSP ẳ
\ degarelix _ _ _______
_ _. _ _,
1 i
1
i
FlRMAIDN' ] 20 mg
ủừM M lit WM tư W
degarelix
Ỉix ỉuồipiioìhmgliư… u…mn. “ " "
’ FIRMAGON'iZDmg
] degarelix 120mg
s…… ừlcnhlnhldnd- II ! h
ủmẹHdmuhlũf—hlfflúh— _— I
WlTìhlửb
ủúdụdu…nlltlngdqưdinunm
Ilummlmnumddxmmltđngđhouu.
lltưmimnmnndunnni
hutnnlnmimdùnụuụt
mưacnmmslumnũ ị
…nmnmmnúuu mu…nuzmnunuui _
…QIullumdmm lminam (
… 21. mun. ị
mu … ửrlim mui m 13… ị
mlf/Mfflú ICIIW *
lưu …… (… Mu hn…ull N! }
iiùhVưmnmư ankllil. a
HImhn…l u—zmcmlus …
imlmnunh
mủmum mm;m…
( munwmndz
ưnvuwzmmunmm
. tuoi…uundu mmlu
ỉ IuoHulhuilúdúul Ilulhthủldluqd
_ IMuh ud
VĂN PHÒNG
ĐẠI DIỆN
má W MD… M.B.A
Chief Represemative
Firmagon 120mg Powder Iabel 53-L-VN-01.02
Created by MHTA (9-Mar-2015)
FIRMAODN' !
degarelix “Illlnl ị
qudrinmtưanm' un… .,i
Bume dụm… &
m r …
Eẫ
ủlhz
… m Irznruunị
Sim um ưc. Da m um E
Mũ;
`
“?
___——
" ".k —__J/
fẮe ỂỒf'mú cỗtong Mb… M.B.A
C hief Representative
Rx Thuốc bán theo đơn
HRMAGON®
Degarelix 120 mg
THÀNH PHẢN
Mỗi lo bột chứa 120 mg degarelix (dưới dạng acetate). Sau khi pha. mỗi ml dung dịch chứa 40 mg degarelix.
Danh mục tả dược:
Bột: Mannitol
Dung môi: Nước pha tiêm.
DẠNG BÀO CHẾ
Bột đông khô pha dung dịch tiêm
CHỈ ĐỊNH
FIRMAGON”ID lá chât đồi kháng hormone phóng thich gonadotrophin (GgRH). được chỉ định đề điêu trị bệnh nhản
nam người lớn bị ung thư tuyên tiền |iệt phụ thuộc hormone đang tiên trien.
LIÊU LƯỢNG VÀ CÁCH DÙNG
Đường dùng: CHỈ DÙNG TIẺM DƯỚI DA.
Không được dùng đường tĩnh mach. Tiêm bắp khóng được khuyên các vi chưa được nghiên cứu.
LiêUẨrm
Liêu khởi đáu Liều duy tri - dùng mỏi tháng
240 mg được dùng chia Iảm 2 lần tiêm dưới 80 mg đươc dùng một lần tiêm dưới da
da. mỗi lần 120 mg ỌÌ/
Nên tiêm Iièu duy trí đầu tiên sau liêu khởi đầu một tháng.
Tảo dụng fflều trị của degarelix nèn được theo dõi bảng các thỏng sô lâm sáng vả nồng độ kháng nguyên đặc hiệu
của tuyên tiền iiệt (PSA) trong huyêt thanh. Các nghiên cứu lâm sảng đã cho thảy là sư ức chế testosterone (T)
xảy ra ngay sau khi tiêm liêu khởi đằu. ở 96% bệnh nhân có nồng độ testosterone trong huyêt tương tương ứng
với sư cảt bỏ tinh hoản trong y khoa (T 5 0.5 nglml) sau 3 ngáy vả 100% sau 1 thặng. Điều trị dải han với liều duy
tri đẽn 1 nảm cho thảy 97% bệnh nhân duy tri được nồng độ testosterone bị ức chè (T 5 0.5 nglml).
Trong trường hợp d_aìp ứng lâm sảng cùa bệnh nhản dưới mức tối ưu. nên xác định xem các nống độ testosterone
trong huyêt thanh vân còn được ức chế thich đáng hay khộng.
Vi degarelix không lảm tăng đột ngột nồng độ testosterone nên không cần thiết dùng thẻm một thuốc kháng
androgen để tránh sự tăng đột ngột khi khởi đâu đièu trị.
Cách dùno
FIRMAGON® phải được pha trước khi dùng. Về chỉ dẫn ca'ch pha vả tiêm, xin xem phần Chỉ dẫn sử dụng.
FIRMAGON® được dùng tiêm dưới da vùng bụng. Cũng như các thuốc khảc được dùng tiêm dưới da, nên thay
đôi chỗ tiêm định kỳ. Nên tiêm vảo những vùng mà bệnh nhản không bị đè ép. vi dự không tiêm gần lưng quản
hoảc dây thát lưng vả không gãn sát xương sướn.
Các nhóm bẻnh nhản đảo biêt
Bệnh nhãn cao tuổi. suy gan hoặc suy thận:
Khỏng cần điều chỉ_nh iiều đối với bệnh nhân cao tuồi hoặc bệnh nhân bị suy chức năng gan hoặc thận nhẹ hoặc
trung binh (xem phân Dược động học). Chưa có nghiên cứu ở bệnh nhân bị suy gan nặng hoặc suy thận nặng. vi
vậy cần phải thận trọng (xem phán Cảnh báo vả thặn trọng đặc biệt khi sử dụng).
Không có chỉ định liên quan về việc dùng FiRMAGON® cho phụ nữ, trẻ em và thiếu niên.
CHI DÁN sư DỤNG
Phải tuân theo chỉ dẳn cách pha một cách cản thận.
Việc sử dụng cảc nồng độ khác khỏng được khuyên các vi sư hinh thảnh gel depot chịu ảnh hướng bởi nống độ.
Dung dịch đã pha phải lả chải lòng trong suốt, không có chât không hòa tan.
LƯU Ý:
— KHONG ĐƯỢC LẢC LỌ THUỐC
Hộp thuốc gồm 2 lọ bột và 2 bơm tiêm động sẵn dung môi phải được chuản bị cho việc tiêm dưới da. Vi vậy quy
trinh được mô tả dưới đây cấn được lặp lại lản thứ hai.
1.Tháo vỏ bọc từ gói chưa bộ phận nối tiềp với iọ._ Gắn bộ phản nỏi tiếp vác lo bột t_iảng_cá_ch
nén bộ phận náy xuống cho đên khi đâu nhọn đảy xuyên qua nút cao su vá bộ phan nOI tiêp
đòng tách một cải vảo đúng vị trí.
Wo _ ./’ _ - .: … « - ~ ° ' “ '
'Ệfỵd .iị _ 3. Tháo năp bơm_tiêm đã đóng sản dung môi Gan bơm tiem vơi lo bot bang cach van no
Ặ ' ’ỔỀ vảo bộ phận nội tiẻp. Chuyển toản bộ dung môi vảo lọ bột
gỉ cư
4. Với ống tiêm vẫn còn gắn váo bộ phận nổi tiếp, xoay rải nhẹ cho đến khi nhin thấy dung
dịch trong suốt_vâ không có bột hoặc hạt khóng hòa _tan, Trong trượng hợp bột dinh vảo lọ
ft/ trên bề mật chải lỏng. có thế hơi nghiêng lọ. Trảnh lăc lọ thuôc đẻ ngăn ngừa tạo thảnh
ĩzJ _/ bọt.
« Một vòng bọt khi nhỏ trên bề mặt của dung dịch có thề chầp nhận được. Thao tảo pha
thường mất vải phút. nhưng có ihê đên 15 phút trong một số trường hợp.
5. Xoay ngược io xuông dưới vả đánh dắu đương trèn bơm tiêm để tiêm.
Luôn Iuôn đảm bảo rủt một thể tỉch chỉnh xảc vả điều chỉnh nếu có bọt khi qì/
6. Tháo ống tiêm ra khỏi bộ phận nối tiếp với iọ vá gắn kim vảo ống tiêm đế tiêm sâu dưới da .
"ĨJỞ _ Ếì'ậ \ 7. Tiến hảnh tiêm sâu dưới da Đế thưc hiệni véc da bụng, nảng mô dưới da vả
ớ`ể cf` _ đảm kim sâu ở một góc không dưới 45 độ.
ợỸỒ ~ _ Tiêm chậm 3 ml FIRMAGONỔ1ZO mg. ngay sau khi pha.’
B. Khòng nẻn tiêm ở cảc vùng mả bệnh nhân bị đè ép. như vùng xung quanh dây thắt lưng hoảc tung quần hoảc
gần sát xương sướn.
Không được tiêm trực tiẻp váo tĩnh mạch. Kéo lui nhẹ piston để Kiếm tra xem có hủt phải máu hay không. Nêu
cò mảu ở Ổng tiêm, không được dùng thuốc náy nữa. Ngưng thao tác. hùy ống tiêm vè kim (pha mặt lièu mới cho
bặnh nhán).
9. Lặp lại thao tảc pha cho liêu thứ hai. Chon một chỗ tiêm khác vả tiêm 3,0 ml.
" Khi đang sử dụng. đó ốn định về lý hóa đã gược chứng minh trong 2 giờ ở 25°Ọ Theo quan điêm vi sinh học, trừ
khi cảch pha thuôc loại bỏ được nguy cơ nhiêm vi sinh, nên dùng thuốc ngay. Nêu không dùng ngay. thới gian bảo
quản vả điêu kiện bảo quản khi đang sử đụng lả trách nhiệm của người sử dung
Khỏng có yêu cầu đặc biệt khi hủy bỏ
CHÓNG CHỈ ĐỊNH ' _
Quá mẫn với hoạt chắt hoặc bât kỳ thảnh phản nảo của tả dươc.
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIỆT KHI sư DỤNG
Đọc kỹ hướng dẳn sử dụng trước khi dùng. Nếu cằn thêm thóng tin. xin hỏi ý kiến bác sĩ
Thuốc nảy chi dùng theo đơn của bác sĩ.
Cảo dữ iiêu hiện có về độ an toản vả hiệu quả cùa degarelix giới hẹn trong khoảng thới gian điếu trị một năm.
Tác dung trèn khoảng QT/QTc
Điêu trị lam mât androgen dải hạn có thề1ám kéo dải khoảng QT Trong một nghiên cưu xác định so sánh
FIRMAGON® với Ieuprorelỉn. đo điên tảm đò (ECS) định kỷ (hảng tháng) đã được tiên hánh; cả hai điều trị cho
thây các khoảng QTJQTc vươt quá 450 miligiảy (msec) ở khoảng 20% bệnh nhản. vả vươi quá 500 miligiây ở 1%
bệnh nhân dùng degarelix vá 2% bệnh nhản dùng leuprorelin (xem phản Dược lực học).
FIRMAGON® chưa đươc_nghiên cưu ở những bệnh nhân có t_iên sử khoảng QT trên 450 miligiáy đã được điều trị,
ở những bênh nhản cộ tiên sử hoặc có yêu tố nguy cơ vê xoăn đỉnh (torsades de pointes) vá ở những bệnh nhản
đang dùng đồng thời các thuốc có thề lảm kèo dải khoảng QT. Vi vậy cần phải đảnh giả kỹ lưỡng giữa lợi ich vả
nguy cơ khi dùng FIRMAGON® ở những bệnh nhặn nảy (xem phần Tương tảc với các thuộc khác vả các dạng
tương tác khác và phần Tảc dụng không mong muốn)
Su an
Những bệnh nhân đã biết hoặc nghi ngờ bị rối ioạn về gan chưa được đưa vảo trong các thử nghiêm lảm sáng dải
hạn vơi degarelix Đã ghi nhận tảng nhẹ thoảng qua về men ALT vả AST những trường hợp náy không kèm theo
tăng bilirubin hoặc các triệu chứng lâm sảng Nên theo dõi chức năng gan ở những bệnh nhân đã biêt hoặc nghi
ngờ bị rối loạn về gan trong thới gian điều trị. Dược động học của degarelix đã được nghiên cứu sau khi tiêm tinh
mach liêu đơn cho những người bị suy gan nhẹ đền trung binh (xem phần Dược động học)
Su_vthâ_n _
Degarelix chưa được nghiên cứu ở bệnh nhân bị suy thận nặng. vì vảy cân phải thận trọng.
Quả mần
Degarelix chưa được nghiên cứu ở bệnh nhân có tiền sử hen nặng chưa được điều trị phản ứng phản vệ nổi mê
đay nặng hoảc phù mạch.
Thav đói mải đô _xươno
Đã có báo cáo về giảm mật độ xương trcng y vản ở nam giới đã cắt bỏ tinh hoán hoặc những người đã được điều
trị bằng chắt đồng vận GnRH Có thế dư đoán là sư ức chế testosterone trong thới gian dải ở nam giới sẽ có tác
dụng trên mật độ xương Mặt độ xương chưa được đo trong thời gian điếu trị bằng degarelix
Sư dung nao đlucose
Đã quạn sát thảy giảm dung nap giucose ở nam giới đã cắt bỏ tinh hoán hoặc những người đã đươc điêu trị bản
chất đống vận GnRH. Đái tháo đường có thế phát sinh hoặc nảng thẻm; vi vặ_y bệnh nhân đái tháo đường có the
cần theo dõi glucose huyềt thường xuyên hơn khi đang dùng liệu pháp lảm mẩt androgen Tảo dụng của degarelix
trên cảc nồng độ insulin vả glucose chưa được nghiên cứu
PHỤ NỮ CÓ THAI VÀ CHO CON BÙ .
Không có chỉ định liên quan về việc dùng FIRMAGONẺ cho phụ nữ. Ởl/
TÁC DỘNG TRẺN KHẢ NĂNG LÁ! XE _VÀ VẬN HÀNH MÁY Móc '
Chưa có nghiên cứu đươc tiên hảnh về tác động của degarelix trèn khả nảng lái xe vả vặn hanh máy móc. Tuy
nhiên mệt mỏi vả chóng mặt lá các phản ứng phụ hay gặp, có thể ảnh hưởng đến khả nảng iải xe vá vặn hảnh
máy móc
TƯỜNG TÁC VỚI cÁc THUỐC _KHÁC VẶ cÁc DẠNG TươN<; TÁC KHÁC
Chưa có cảc nghiên cứu được tiên hảnh về tương tác thuôc—thuôc.
Vi điều trị lám mắt androgen có thề Iảm kéo dải khoảng QTc, việc dùng đồng thởi degarelix với các thuốc đã biêt
lảm kéo dải khoảng QTc hoặc những thuỏc có thể gây ra xoắn đinh (torsades de pcintes) như các thuốc chống
loan nhip nhóm IA (vi du quinidine. disopyramide) hoặc nhóm Il! (ví dụ amiodarone` sotalol, dofetilide, ibutilide).
methadone, cisapride. moxifioxacine. thuốc chông loạn tâm thần, v.v... phải được đánh giá cần thận (xem phần
Cảnh báo vả thận trọng đặc biệt khi sử dụng).
Degarelix khộng phải là cơ chât đói với hệ CYPASO ở người vá chưa thây gáy cảm ứng hcặc ức chế CYP1A2
CYP2CB CYP2Cg CYP2019 CYPZDG. CYP2E1 hoặc CYP3A4/5 ở bắt kỳ mưc đô nao in vitro. Vi vặy không
chắc có tương tảo dược động hoc thuốc-thuốc trong quá trinh chuyên hộa liên quan đến những isoenzyme nay có
ỷnghĩa lảm sảng.
TƯỜNG KY _
Trong khi chưa có cảc nghiên cừu về sự tương hợp, không được pha trộn thuỏc nảy với các thuốc khảo.
TÁC DỤNG KHÓNG MONG MUỐN
Các phản ưng phụ đă đươc ghi nhặn hay gặp nhắt trong khi điêu trị bằng degarelix trong một nghiên cưu xảc định
phase ill (N=409) lả do các tác dụng dược lý có thế có cùa sự ưc chê testosterone bao gồm nóng bừng vá tảng
cân (được báo cáo ở 25% vá 7% bệnh nhân tương ứng đang điều trị 1 nảm) hoặc các phản ứng tai chỗ tiêm Rẻt
run thoáng qua sôt hoảc bệnh giống cúm đã được ghi nhận xảy ra vái giờ sau khi dùng thuốc (gặp ở 3% 2% vá
1% bệnh nhán tương ửng).
Cảo phản ứng phụ tại chỗ tiêm đã được báo các chủ yếu là đau gặp ở 28% bệnh nhân vả ban đó gặp ở 17% bênh
nhân các phản ứng phụ it gặp đã được báo cảo iả sưng (6%) cứng (4%)_ va nốt phồng nhỏ (3%) Những phản
ứng phụ náy chủ yêu gặp với Iiẽu khời đầu trong khi ở điều trị đuy tri VÓ'i liều 80 mg tỷ lệ các phản ứng phụ nảy
trèn 100 lân tiêm lả: 3 trương hợp đau vá <1 trường hợp ban đỏ sưng. nốt phồng nhỏ vá cứng Các phản ưng phụ
đã được báo cáo náy hầu hẻt đều thoáng qua ở mức độ nhẹ đến trung binh vả rắt it khi dẳn đền ngừng điều trị
(<1%)
Tần suất của các tác dụng không mong muôn liệt kê dưới đảy đă được xác định sử dụng quy ước sau:
Rât hay gặp (> 1/10) hay gặp (> 1/100- < 1/10); it gặp (> 111. 000- < 1l100) Trong mỗi nhóm tần suất, cảc tảc
dụng không mong muốn đươc trinh bảy theo thứ tự độ nặng giảm dần
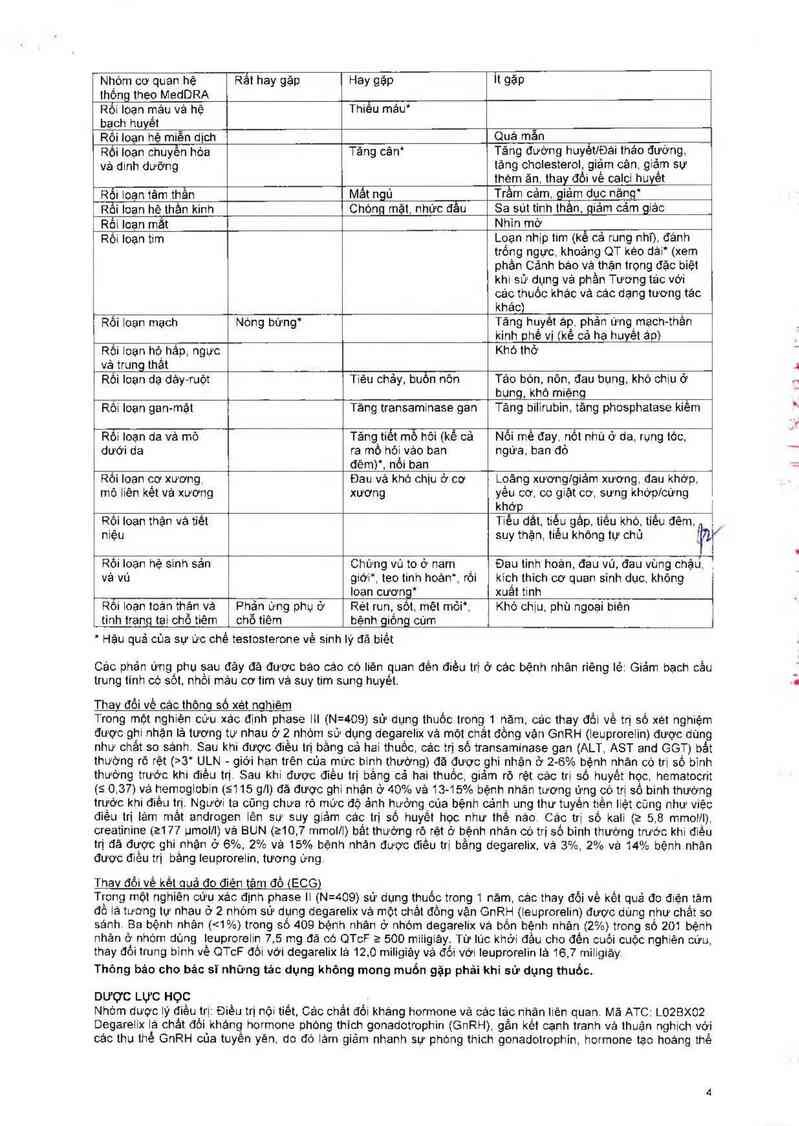
Bảng 1: Tần suất các phản ứng phụ đã đươc báo cảo ở 1259 bệnh nhản được điều trị trong tồng số 1781 bệnh
nhân theo năm (các nghiên cứu phase Il vá phase III).
Nhỏm cơ quan hệ Rất hay gặp Hay gặp It gặp
thống theo MedDRA
Rối loạn máu và hệ Thiếu máu’
bach huyêt _
Rối Ioạn hè miễn địch Quá mân _
Rối loạn chuyển hòa Tăng cân“ Tảng đương huyetíĐái tháo đường
và dinh dưỡng tăng cholesterol, giặm cân. giảm sự
ihèm ăn. thay đồi vè caici huyêt
Rối ioan tâm thằn Mắt ngủ Trầm cảm. giảm dục năng“
RToi loan hê thần kinh
Chộng mặt. nhức đầu
Sa sủi tinh thần, giảm cảm giác
Rối ioan mắt
Nhin mờ
Rõi loan tim
Loạn nhịp tim (kể cả rung nhĩ). đảnh
trỏng ngưc. khoảng QT kéo dái“ (xem
phần Cảnh báo vả thận trọng đặc biệt
khi sử dụng và phần Tương tác với
các thuốc khác vả các đạng tương tác
khảo)
Rối loan mạch
Nộng bưng'
Tảng hụyẻt ap` phản ưng_mạch-thần
kinh phê vị (kể cả ha huyêt ảp)
Rối Ioạn hộ hảp. ngưc
vả trung thât
Khó thở
Rối loạn dạ dảy—ruột
Tiẻu chảy, buồn nôn
Tảo bòn. nôn, đau bụng, khó chịu ở
bụng, khô miệng
Rồi Ioạn gan~mật
Tảng transaminase gan
Tảng bilirubin. tăng phosphatase kiêm
Rối loạn da và mỏ
dưới da
Tăng_tiết mồ hôi (kể cả
ra mô hói vảo ban
đẻm)’, nồi ban
Nổi mề đay. nốt nhú ở da. rụng tòc,
ngưa. ban đỏ
Rôi Ioạn cơ xương
mô liên kèt vá xương
Đau vẻ khó chịu ở cơ
xương
Lọãng xươnglgiảm xương. đau khớp.
yêu cơ. co giảt cơ. sưng khớpfcứng
khớp
Rồi Ioạn thặn vả tiẽt
niệu
i
1
Tiêu dắt. tiêu gảp, tiếu kho tiếu đêm, )
suy thặn. tiều không tự chủ fíar
Rôi ioạn hệ sinh sản
vả vú
Chứng vú to ở nam _
giới"… teo tinh hoản“, rôi
loan cương“
Đau tinh hoản, đau vú, đau vùng chậư. j
kich thich cơ quan sinh dục. khỏng
xuât tinh
Rối Ioan toán thản vả
Phản ưng phụ ở
Rét run, sốt, mệt mỏi”.
Khó chịu, phù ngoại biên
bệnh giống cúm
’ Hậu quả cùa sự ữc chế testosterone về sinh lý đã bìết
tinh trạng tại chỗ tiêm chỗ tiêm
Các phản ứng_ phụ sau đây đã được báo cáo có iiẽn quan đên điêu trị ở các bênh nhân riêng lẻ: Giảm bạch cầu
trung tính có sốt nhồi mảu cơ tim vá suy tim sung huyêt
Thav đổi về các thôno sô xét nqhiẻm
Trong một nghiên cừu xác định phase lil (N= 409) sư đụng thuốc trong 1 nảm, các thay đồi về trị số xet nghiệm
được ghi nhận lả tương tự nhau ở 2 nhóm sử dụng degarelix vả một chẳt đồng vặn GnRH (leuproreiin) được dùng
như chắt so sảnh. Sau khi được điều trị _bầng cả hai thuốc các trị số transaminase gan (ALT AST and GGT) bảt
thường rõ rêt (>3' U_-LN giới han trên cùa mưc binh thường) đã được _ghi nhận ở 2-6% bệnh nhân có trị số binh
thướng trước khi điêu trị. Sau khi được điều trị bằng cả hai thuốc giảm rõ rệt cảc trị sò huyết học hematocrit
(S 0 37) vả t_1emcglobin (st 15 gil) đă được ghi nhặn ở 40% vả 13- 15% bệnh nhãn tương ưng có trị số binh thương
trước khi điêu trị. Người ia cũng chưa rõ mưc độ ảnh hướng của bệnh cảnh ung thư tuyên tiền Iiẻt cũng như việc
điều trị lảrn mảt androgen iên sự suy giảm các trị số huyết hộc như thế náo Các trị số kali (2 5. 8 mmoil_l).
creatinine (2177 ụmolli) vả BUN (2_10 7 mmolll) bất thường rõ rệt ở bệnh nhân có trị số binh thường trước khi điều
trị đã được ghi nhận ở 6% 2% vả 15% bệnh nhân được đĩêu trị bằng degarelix vé 3% 2% vả 14% bệnh nhân
được điều trị bầng Ieuprorelỉn tương ưng
Thav đổi về kêt ouả đo điện tâm đồ (ECG)
Trong một nghiên cứu xác định phase II (N=409) sử dụng thuốc trong 1 năm các thay đồi về kết quả đo điện tâm
đồ lả tương tự nhau ở 2 nhóm sử dụng degarelix vả một chải đồng vận GnRH (ieuproreiin) được dùng như chắt so
sánh Ba bệnh nhân (<1%) trong sỏ 409 bệnh nhân ở nhóm degarelix va“ bốn bệnh nhân (2%)_ trong số 201 bệnh
nhản ở nhóm dùng leuprcrelin ? 5 mg đă có QTcF 2 500 miiig_iây_. Từ lúc khới đầu cho đên cuối cuộc nghiên cứu
thay đôi trung binh về OTcF đồi vơi degarelix la 12,0 miligiây và đối với Ieuprorelỉn là 16 7 miligiây
Thỏng báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuóo.
DƯỢC LỰC HỌỌ
Nhóm được lý điêu trị Điếu trị nội tiết. Cảo chất đối kháng hormone và các tác nhãn Iiẻn quan Mã ATC: LO2BXO2
Degarelix lả chât đối kháng hormone phóng thỉch gonadotrophin (GnRH) gắn kết cạnh tranh vá ihuận nghịch với
các thụ thể GnRH của tuyên yẻn. đo độ Iảm giảm nhanh sự phộng thich gonadotrophin hormone tạo hoáng thế
(LH) vá hormone kich thich nang noãn (FSH). nhờ đó Iảm giảm tiết testosterone (T) bời tinh hoả_n. Ung thư tuyè_n
tiền liệt được biêt iả nhạy với androgen vả đáp ứng với điều trị loai bó nguõn androgen. Khỏng giong như cao chạt
đồng vận GnRH. chắt đỏi kháng GnRH không gây tảng đột ngột LH. tránh được các hậu quả như tảng đột ngọt
testosterone, kich thich khối u vả bùng phải các triệu chứng sau khi khời đáu điêu trị.
Một liều đơn 240 mg degarelix tiếp theo với liều duy tri 80 mg mỗi thảng_lảm giảm nhanh chộng nồng độ LH, FS_H_
và sau đó lả testosterone Nồng độ dihydrctestosterone (DHT) trong huyet tương giảm theo cảch tương tự như vơi
testosterone.
Degarelix có hiệu quả trong việc đạt được vả duy trì sự ưc chê tốt testosterone_dưới nồng độ do cắt bỏ tinh hoán
trong y khoa ia 0.5 nglml. Liều đuy tri 80 mg mỗi thảng dẫn đên duy trị sự ức chẽ testosterone ở 97% bệnh nhân it
nhắt trong 1 năm. Nổng độ testosterone trung binh sau 1 năm điêu trị iả 0,087 nglml (khoảng từ phân vị —
interquartiie range - lè 0.06-015) N=167.
Kêt ouả của nohiên cưu xảo đinh Phase Il! _
Độ an toản và hiệu quả của degarelix đă được đánh giá trong một nghiên cưu mờ, đa trung tâm, ngâu nhiên. so
sánh với thuốc. nhóm song song. Nghiên oứu nảy điều tra độ an toán _vả hiệu quả của hai chẻ độ iiều dùng
degarelix mỗi tháng khảo nhau với liều khời đằu lẻ 240 mg (40 mglml). tiẽp theo tiêm dưới da mỗi thảng với iièu
160 mg (40 mglml) hoặc 80 mg (20 mglml). so sánh với tiêm bắp mỗi thặng 75 mg leuprorelin ở những bệnh nhán
bị ung thư tuyến tiên liệt cần iiệu pháp lám mảt androgen. Trong tổng sô 620 bệnh nhân được chon ngầu nhiên từ
một trong ba nhóm điều trị, trong đó 604 (81%) bệnh nhản đã hoản tât cuộc nghiên cưu. ờ nhóm điều trị băng
degarelix 240180 mg. có 41 bệnh nhân (20%) ngừng cuộc nghiên cứu, khi so vơi 32 bệnh nhân (16%) ở nhóm
leuprorelin.
Trong số 610 bệnh nhân được điều trị
~ 31% bị ung thư tuyên tiền liệt khu trú
~ 29% bị ung thư tuyến tiện liệt tiến triền khu trú
— 20% bị ung thư tuyên tiên liệt có di cản
~ 7% có tinh trạng di cản chưa rõ
. 13% đã được điều trị bằng phẫu thuật hoặc phóng xạ trước đây vả cộ tảng kháng nguyên đặc hiệu cùa tuyên tiền
liệt (PSA).
Các chỉ số vệ nhân khấu học tương tự nhau giữa hai nhòm ở mưc khởi đầu điều trị Tuổi trung binh lẻ 74 tuổi (ở
mức từ 47 đèn 98 tuồi). Mục tiêu chính để chứng minh lá đegarelix có hiệu quả trong việc đạt được và đuy tri sự
ức chế testosterone dưới 0.5 nglml trong thới gian 12 tháng điêu trị.
Liêu duy in thắp nhắt có hiệu quả lả 80 mg degarelix đã được chọn. [FV
Đat đươc teẵtosterone (T) huvêt thanh 5 0.5 nolml
FIRMAGON có hiêu quả trong việc đạt được sự ức ohế testosterone nhanh chóng, xem Bảng 2,
Bảng 2: Tỷ lệ phần trảm bệnh nhân đại được T 5 0,5 nglml sau khi khởi đầu điêu trị
Thới qian Degarelix 240180 mg Leuprorelin 7.5 mg
Ngảy thư nhẩt 52% 0%
Ngèy thứ 3 96% 0%
Ngảy thư 7 99% 1%
Nqảv thứ 14 100% 18%
Ngảy thứ 28 100% 100%
Trảnh tảng đôt nqôt testosterone
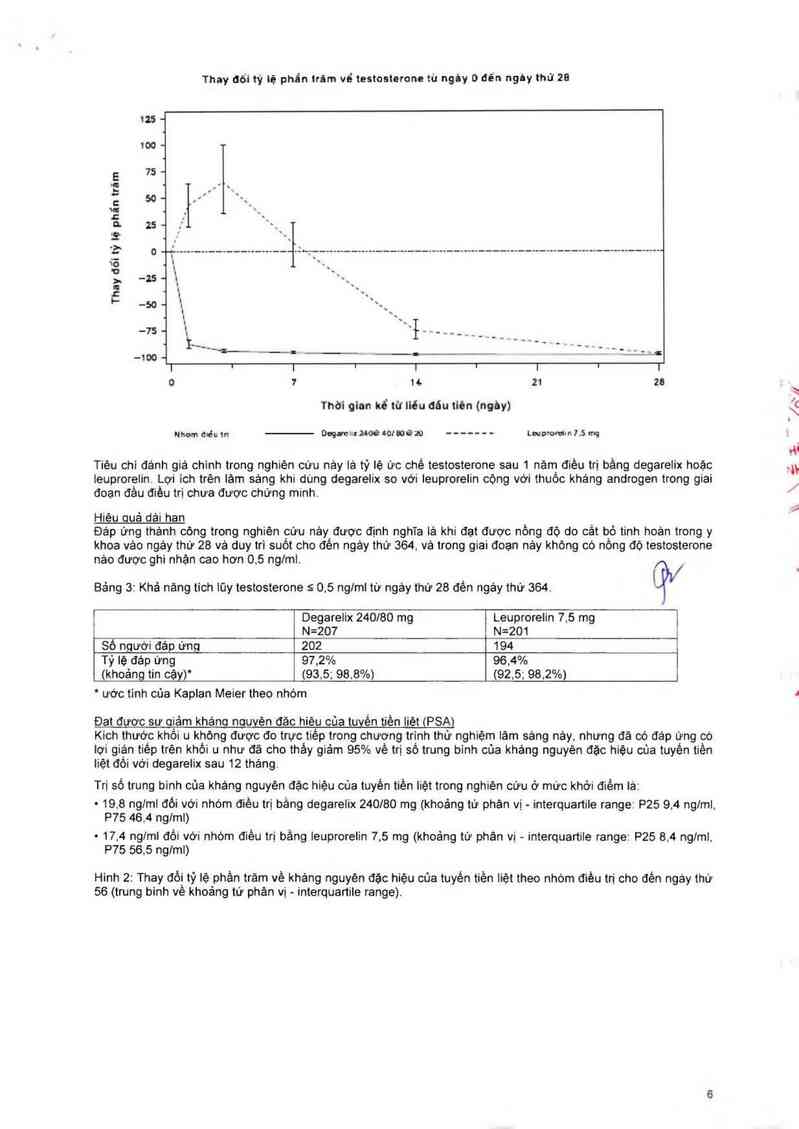
Tảng đột ngột được định nghĩa tả khi testosterone vượt quá mưc cơ bản 215% trong 2 tuần đầu tiên.
Khộng cò bẻnh nhản nảo được điệu trị_bảng degarelix có tảng đột ngột testosterone; đã có giảm trung bình 94%
vê testosterone vảc ngáy thư 3, Hảu hêt bênh nhân được điêu trị bằng Ieuprorelỉn có tăng đôt ngột testosterone;
đă có tăng trung binh 65% vé testosterone vảo ngảy thứ 3. Sự khảo nhau nảy có ý nghĩa thỏng kè (p < 0.001)
H_inh 1: Thay đồi tỷ lệ phần trảm vè testosterone so với mữc cơ bản ở nhóm điêu trị đến ngảy thứ 28 (trung binh
vê khoảng từ phân vị - interquartile range).
L À' "32 lCn
\\ ' `1
Thay đối ty lữ phấn Irủm vế testosterone tủ ngùy 0 đến ngèy thứ 28
115-<
Im-
75-
so - }
zs-
—ủ-l
Thay dõi tỷ lệ phía trảm
0
I——r—-4
_15 -
-ỵm ..
Thời glnn kể lử liõu đáu tibn (nqòy)
Nhom dìếuln _ Dugnv:âmẽlủlfflêzu --—---- LoumomhnLqu
Tiêu chi đánh giá chinh trong nghiên cứu nảy lả tỷ lệ ức chế testosterone sau 1 năm điêu trị bãng degarelix hoặc
leuprorẹlin. Lợi ich trên lảm sảng khi dùng degarelix so với Ieuptorelin cộng với thuốc khảng androgen trong giai
đoạn đâu điêu tri chưa được chứng minh.
Hiẻu guả dái han _
Đảp ưng thảnh công trong nghiên cứu nảy được định nghĩa lả khi đạt được nồng độ do căt bỏ tinh hoản trong y
khoa vảo ngảy thứ 28 vả duy tri suốt cho đên ngáy thứ 364. vả trong giai đoạn nảy khỏng có nồng độ testosterone
nảo được ghi nhặn cao hơn 0,5 nglml.
Bảng 3: Khả nảng tich lũy testosterone 5 0,5 nglml từ ngảy thứ 28 đên ngảy thứ 364. W
Degarelix 240/80 mg
N=207
Leuproreiin 7,5 mg
]
(khoảng tin cậy)“
(93.5; 98.8%)
N=201
sô nqưới đảp ứng 202 194
Tỷ lệ đảp ứng 01,2% 96,4%
(92,5: 98,2%)
' ước tinh của Kaplan Meier theo nhòm
Đai được sư qiảm kháng nouvèn đảo hiêu của tuvến tiền liêt (PSA)
Kich thước khối u khỏng được đo trực tiêp trong chương trinh thử nghiệm lâm sảng náy, nhưng đã có đáp ứng có
iợi gián tièp trên khôi u như đã cho thảy giảm 95% về trị số trung binh cùa kháng nguyên đặc hiệu của tuyến tiền
liệt đỏi với degarelix sau 12 thảng.
Trị số trung binh của kháng nguyên đặc hiệu cùa tuyên tiền liệt trong nghiên cứu ở mức khởi điêm lá:
' 19,8 nglml dôi với nhóm điều trị bằng degarelix 240/80 mg (khoảng từ phân vị - interquartile range: P²5 9,4 nglml,
P75 46.4 nglml)
. 17,4 nglml đối với nhòm điêu trị bằng leuprorelin 7,5 mg (khoảng từ phân vị - interquartile range: P25 8,4 nglml.
P75 56,5 nglml)
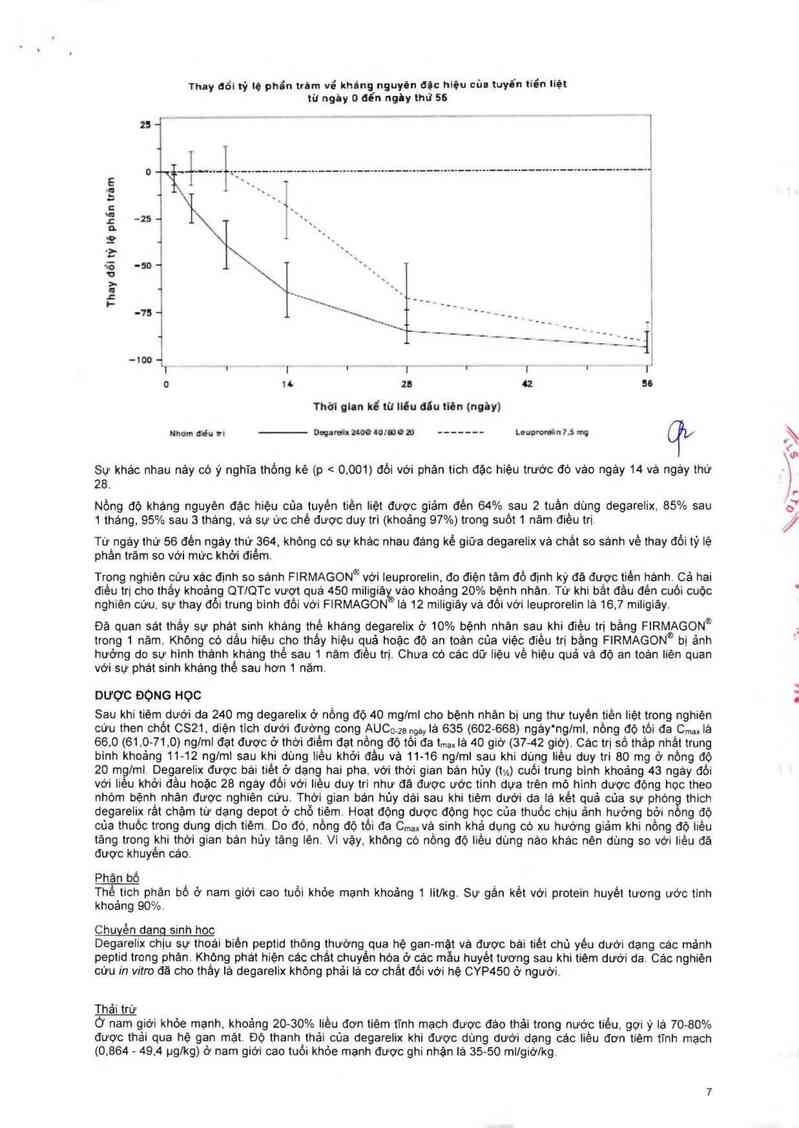
Hinh 2: Thay đỏị tỷ lệ phần trám vê khảng nguyên đặc hiệu của tuyên tiền liệt theo nhóm điều tii cho đến ngảy thứ
56 (trung binh vê khoảng từ phản vị - interquattile range).
Thay đổi tỷ lệ phỉn túm về khúng nguyên dặc hiộu cũa tuyển tiổn liệt
ti! ngìy 0 dển ngăy \hứ 55
zs~ ]
e i 1
12 < )
E i
`Ệ —zs— i
n.
² - i
?
.3 .50— c l
o |
: _ i
8 ~…_ --
›— '~—-..._ '
-1s- \\ |
" _____ ° -i
——————— i
“ ———————— —"’li
-100-1 }
Thời gi… kd tù iitu đlu tiũn (ngiy)
Nhom Mu … —— DegadlũbO oomozo ------- Leuwdnĩ.ã mg @
Sự khác nhau nảy có ý nghĩa thồng kẽ (p < 0.001) dối với phản tich đặc hiệu trước đó vảo ngảy 14 và ngảy thứ
28.
Nồng độ khảng nguyên đặc hiệu của tuyến tiền iiệt được giảm đẻn 64% sau 2 tuần dùng degarelix, 85% sau
1 tháng, 95% sau 3 tháng. vả sự ức chế được duy tri (khoảng 97%) trong suốt 1 nảm điêu trị
Tư_ngảy thứ 56 đến ngảy thứ 364, không có sự khảo nhau đảng kể giữa degarelix vả chẩt so sánh về thay đổi tỷ lệ
phản trảm so với mức khới điềm.
Trong nghiên cứu xảo định so sánh FIRMAGON® với ieuproreiin, đo điện tảm đồ định kỳ đã được tiên hảnh, Cả hai
điều trị cho thảy khoảng QTIQTc vươt quá 450 miligiãềvảo khoảng 20% bẻnh nhân. Từ khi bảt đầu đên cuối cuộc
nghiên cứu, sự thay đổi trung bình đôi với FIRMAGON là 12 miligiây vá đôi với Ieuprorelỉn lả 16,7 miligiây.
Đá quan sát thắy sư phát sinh khảng thể kháng degarelix ở 10% bệnh nhân sau khi điêu trị bằng FiRMAGON®
trong 1 nảm. Khỏng oò dắu hiệu cho thảy hiệu quả hoặc độ an toản cùa việc điêu trị bằng FIRMAGON“D bị ảnh
hưởng do sự hinh thảnh kháng thể sau 1 nảm đìều trị. Chưa có các dữ liệu về hiệu quả vả độ an toản liên quan
với sự phát sinh khảng thế sau hơn 1 nãm.
DƯỢC ĐỘNG HỌC
Sau khi tiêm dưới da 240 mg degarelix ở nồng độ 40 mg/ml cho bệnh nhản bị ung thư tuyên tiên iiệt trong nghiên
cưu then chõt CS21, diện tich dưới đường cong AUCo.ze ngáy lả 635 (602-668) ngảy'nglml, nồng độ tối đa C,… lả
66.0 (61 .0-71 ,0) nglml đạt đựợc ở thới điềm đạt nồng đó tôi đa t…ax lả 40 giờ (37-42 giờ). Các trị số thầp nhái trung
binh khoảng 11-12 nglml sau khi dùng iiều khởi đằu vả 11-16 nglml sau khi dùng liều duy trì 80 mg ở nỏng đó
20 mg/ml Degarelix được bâi tiết ở dạng hai pha, với thời gian bán hủy (tư) cuối trung binh khoảng 43 ngáy đối
với iiều khời đầu hoặc 28 ngảy đôi vởi lieu duy tri như đá được ước tinh dưa trèn mõ hinh dược động hoc theo
nhóm bệnh nhân được nghiên cứu. Thời gian bán hùy dải sau khi tiêm dưới da lả kết quả cùa sư phón thich
degarelix rắt chậm từ dạng depot ở chỗ tiêm. Hoạt động dược động học của thuốc chịu ảnh hưởng bời n ng độ
cùa thuỏc trong dung dịch tiêm. Do đò, nồng độ tối đa Cmaxvá sinh khả dụng có xu hướng giảm khi nồng dộ iiều
tảng trong khi thời gian bán hủy tảng lên. Vi vặy, không có nồng độ liêu dùng nảo khác nẻn dùng so với liều đă
được khuyên cảo.
Phản bộ
Thể tich phản bố ở nam giới oao tuối khỏe mạnh khoảng 1 iitlkg Sự gắn kềt với protein huyết tương ước tinh
khoảng 90%.
Chuyên dang sinh hgc
Degarelix chịu sự thoải biên peptid thỏng t_hường qua hệ gan-mặt vả đươc bải tiét chủ yếu dưới dang ca'c mảnh
peptid trong phân. Không phát hiên các ohât chuyền hóa ở các mẫu huyết tương sau khi tiêm dưới da. Các nghiên
cứu ìn vitro đã cho thây iả degarelix khỏng phải lá cơ chất đôi với hệ CYP45O ở người.
Thải trứ
ơ nam giới khỏe mạnh, khoảng 20-30% liêu đơn tiêm tĩnh mach được đảo thải trong nựớ_c tiều, gợi ý iả 7000%
được thải qua hệ gan mặt. Độ thanh thải cùa degarelix khi được dùng dưới dạng các liêu đơn tiêm tĩnh mạch
(0,864 - 49,4 ụg/kg) ở nam giới cao tuổi khỏe mạnh được ghi nhặn lả 35-50 milgiờlkg.
_"//
s~/s
\\OJ
hCl
L'~Ỉ
0
»-
gạc nhóm bẽnh nhân đặc biệt
Bệnh nhân bị suy thặn
Chưa oó các nghiên cửu được tiên hánh về dược động học ở bệnh nhân bị suy thặn. Chi vảo khoảng 20—30% iiều
degarelix đã dùng được thải trừ dưới dạng không đổi qua thận, Phân tỉch cảc dữ liệu dược động học theo nhóm
bệnh nhán từ một nghiên cứu xảo định Phase III đã chứng minh lả độ thanh thải degarelix ở bệnh nhân bị suy thận
nhẹ đén trung binh giảm khoảng 23%; vì vậy không khuyên các điêu chinh iiều ở bệnh nhân bị suy thận nhẹ hoặc
trung binh. Cảo dữ liệu trèn bệnh nhân bị suy thận nặng cộn rât it, vi vậy oần phải thán trọng ở nhóm bẻnh nhán
náy.
Bệnh nhân bị suy gan
Degarelix đă được đánh giá trong một nghiên cứu về dược động học ở bệnh nhản bị suy gan nhẹ đên trung binh.
Khộng quan sảt thẩy các dắu hiệu tảng lẽn ở bệnh nhân bị suy gan so với người khỏe manh. Không cần điêu
chinh liều ở bệnh nhản bị suy gan nhẹ hoặc trung binh. Chưa có nghiên cứu ở bệnh nhân bị rối loạn chức nảng
gan nặng, vì vặy cần phải thặn trọng ở nhóm bệnh nhãn nảy.
QUÁ LIỂU
Chưa có kinh nghiệm lâm sáng về các tác dụng do quá liêu degarelix câp tinh. Trong trường hợp quá liêu, phái
theo dỏi bệnh nhân vá cân tiến hảnh điều 111 hỗ trợ thich hợp nêu xem xét thảy cần thiết.
HẬN DÙNG
36 tháng kế từ ngảy sản xuất.
Sau khi oha
Khi đang sử dụng, đó ỏn định về iy' hỏa đă được chứng minh trong 2_giớ ở 25°C_. Theo quan điêm vi sinh hoc, trừ
khi cách pha thuoc loai bò được nguy cơ nhièm vi sinh, nên dùng thuỏc ngay. Nẻu khỏng dùng ngay, thời gian bảo
quản vả điều kiện bảo quản khi đang sử dụng lá trảch nhiệm của người sử dụng.
BẢO QUẢN
Bảo quản dưới 30°C. Không để đông lạnh.
Đế thuốc xa tằm tay cùa trẻ em.
Khỏng dùng thuốc quá hạn sử dụng đã ghi trên bao bì.
QUY CÁCH ĐÓNG GÓI
Hộp 2 iọ bột, 2 bơm tiêm đóng sẵn3 mi dung mõi. 2 pittông. 2 bộ phận nội tiêp lọ bột, 2 kim dùng để tiêm.
SÁN XUẤT BỜI:
Nhã sản xuất lọ bột:
Rentschler Biotechnoiogie GmbH
Erwin-Rentschler-Str. 21
D—88471 Laupheim
Germany
Nhã sản xuất lọ dung môi: ’—
Fening GmbH i
Winland 11.
²4103 Kiel- 'õmấ Cỗtoaiỵ Mb… MBA
Germany '
C hief chresentatwe
CHO:
Ferring Phannaceuticais A/S
Kay Fiskers Plads 11,
DK-ZBOO Copenhagen S.
Denmark
ĐÓNG GÓI BỜI:
Ferring international Center SA
Chemin de la Vergognausaz 50,
1162 Saint-Prex,
Switzerland
Ngáy cặp nhật thông tin: Tháng 4l2013
TUQ. c_ục TRU_ỔNG
p.TRUONG PHONG
…“iỷuắaẫn Ựlfaấ Jlibg
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng