






FIRM’ĂGON 80mg Canon 52…C- VN-O2 04 (Pmfiliod Syringe);
Ci v; QUÁN LÝ DƯỌC V
___,J
ĐÁ PHÊ DUYỆT
Lân đãuz.ỔỄJ.ẢQJ…WỔ \4
FIRMABDN' BOmg
mctdmbdmbhnin
…J'ìf
`o
`1.
a
FlRMAGDN' 80 mg
FIUIII~dHÌÚ pMư tư mui… tcr inicuâm
degar~el 1x
…hmuly
ffl 'Eẵj": Ế" —t'=
FlHMABDN’BOmg
ị`iììẻuipiiumm mnmm`ui
FIRMAỤOMBOmg
` degafeitx BOrnu
, WIHnlmnh/N—l—
, CW/ IMủủ
,mưldmucmilinig đeợelxusnmi.
Illenunmlm.uù
` ỦIUđúlhnMủMM—Ù
' ……pưuủlffldnnủiợhự
,HHIlỰI
im
mmlnhhuùlnhđmưhllùl—ỤD
nldtdilclcutnc lđluddụủ.
ni
hnmnninquũutnuuủ
WMII/W mtvú
lmđtb Imntnủg'e W lưliq W
Erli›iuibclriLlL mun.
DINH mu, I'Alltny 2410ỉ lld. CUIIIW
: mm…cớlơ ỈIIIW
Fenilghtunlimi M SA Fmiug li…uủù Aõ
DuinủhticmmW. Ianu
liilsinha. SIIuM DtIMCWỤMSMIIk
lmultunùui
' MMEXM ũqllnlOtffl
Ú1ILHVSFI,ch
muwnmmz. WfflffllùlmMu
MI1vHI-í: %! Igffl
lptũldvffllụdủtlddln I—úlhÙuI—d
ldunpnl tm
uwuuunuzmmúưmnt
M…Mnlluhlúndn:
#—
ỤUUÚWIÌÚÚIUVK
ảãĩ:
ủuÚh
ĐAI DIÊN
TẬI THÀNH PHỐ
HỒ CHI MIN
77- tfflfif/
ềM
ÍẫJ ẫỔoh/z
M.D., M.B.A
Ch1ef Represeniatíve
F irmagon 80mg Powder label 52-L-VN-01.02
Created by MHTA (1 O-Mar-201 5)
FIRMAGON' Ế
degar~elix llnl Ễ
Ffmdrni Mr tư … iu inpmn _p
Chief Represemative
Rx Thuốc bán theo đơn
HRMAGON®
Degareiix 80 mg
THÀNH PHAN
Mỗi lọ bột chứa 80 mg degarelix (dưới dạng acetate) Sau khi pha, mỗi ml dung dich chứa 20 mg degarelix.
Danh mục tá dược:
Bột: Mannitol
Dung mói: Nước pha tiêm.
DẠNG BẢO CHẾ
Bột đòng khô pha dung dich tiêm
CHỈ Đ|NH
FIRMAGON® lả chảt đỏi kháng hormone phóng thich gonadotrophin (GnRH) được chỉ định để điều trị bệnh nhân
nam người lờn bị ung thư tuyến tiên liệt phụ thuộc hormone đang tiên triên.
LIÊU LƯỢNG VÀ cAct-1 DÙNG
Đường dùng: CHỈ DÙNG TIỂM DƯỚI DA.
Không được dùng đường tĩnh mạch. Tiêm bảp không được khuyến cáo vì chưa được nghiên cứu.
Liêu lương
Liêu khới đẳu Liêu duy trì — dùng mòi tháng
240 mg được dùng chia Iảm 2 lản tiêm dưới 80 mg được dùng một iản tiêm dưới da
da. mỗi lản 120 mg_ Ọ/
Nèn tiêm lièu duy tri đầu tiên sau iiều khởi đầu một tháng
Tác dụng đệu trị cùa degarelix nên được theo dõi bằng các thòng sỏ lảm sảng vả nồng độ kháng nguyên đặc hiệu
của tuyên tiền liệt (PSA) trong huyết thanh Các nghiên cứu lâm sảng đã cho thảy là sự ức chế testosterone (T )
xảy ra ngay sau khi tiêm liêu khời đầu ở 96% bệnh nhân có nồng độ testosterone trong huyêt tương tương ứng
với sự cảt bò tinh hoán trong y khoa (T 5 0 5 ng/ml) sau 3 ngảy vả 100% sau 1 thặng Điều trị dải han với Iièu duy
tri đên 1 nảm cho thảy 97% bệnh nhản duy trì được nồng độ testosterone bị ưc chế (T 5 0 5 ng/ml)
Trong trường hợp đáp ứng iảm sảng của bệnh nhản dưới mừc tỏi ưu nên xác định xem cac nồng dộ testosterone
trong huyêt thanh vẳn còn được ức chế thich đáng hay không.
Vì degarelix không lám tảng đột ngột nồng độ tẹstosterone nên không cần thiềt dùng thêm một thuốc kháng
androgen để tránh sự tảng đột ngột khi khởi đảu điêu tn.
Cách dùng
FIRMAGONỂl> phải được pha trước khi dùng. Về chỉ dần cách pha vả tiêm. xin xem phần Chỉ dẫn sử dụng.
FIRMAGON® được dùng tiêm dưới da vùng bụng. Cũng như các thuốc khác được dùng tiêm dưới da. nẻn thay
đồi chỗ tiêm định kỳ. Nẻn tiêm vảo những vùng mả bệnh nhân không bị đè ép. ví dụ không tiêm gần lưng quần
hoặc dảy thảt lưng vá không gần sa't xương sườn.
Các nhòm bẽnh nhản đăc biẽt
Bệnh nhân cao tuối, suy gan hoặc suy thận:
Khỏng cần điều chĩnh liêu đối vói bệnh nhản cao tuối hoặc bệnh nhản bị suy chức nảng gan hoặc thận nhẹ hoặc
trung bình (xem phản Dược đòng học). Chưa có nghiên cứu ở bệnh nhân bị suy gan nặng hoặc suy thận nặng, vi
vậy cần phải thận trọng (xem phản Cảnh báo vả thặn trọng đặc biệt khi sử dụng).
Không có chỉ định liên quan về việc dùng FIRMAGON“D cho phụ nữ, trẻ em vả thiêu niên.
CHỈ DẢN sư DỤNG
Phải tuân theo chi dân cách pha một cách cần thận.
Việc sử dụng các nồng độ khác khõng được khuyên cáo vị sự hinh thảnh gel depot chịu ảnh hưởng bởi nống độ.
Dung dich đã pha phải la` chầt lòng trong suốt, không có chải không hòa tan.
LưU_Ý:
. KHONG oược LẢC LỌ THUỐC
Hộp thuốc gồm 1 lọ bột và 1 bơm tiêm đóng sẵn dung mỏi phải được chuẩn bị cho việc tiêm dưới da.
1\
"L
L…. <:
1.Tháo vỏ boc từ gói chứa bộ phận nối tiêp với lo. Gắn bộ phận nối tiếp vảo lo bột bằng cách
nén bộ phận nảy xuông cho đên khi đằu nhọn đảy xuyên qua nút cao su vả bộ phận nòi tiẻp ,
đóng tảch một cái vảo đùng vi tri.
z. Gắn pittông để chuản bị bơm tiêm đã đóng sẵn dung môi.
"_”ìxợ Ẩn _ 3. Tháo nắp bơm tiêm đã đóng sẵn dung môi. Găn bơm tiêm với lo bột bảng cách vản nó vảo
' ,. gỡ bộ phận nội tiếp. Chuyển toản bộ dung môi vảo lọ bột.
, f__\Ạ_
4. Với ống tiêm vẳn còn gắn vảo bò phản nối tiên, xoay rắt nhẹ cho đến khi nhin thảy dung dịch
trong suôt và không có bột hoặc hat khỏng hòa tan. 1_'ronẵ trường hợp bột dinh vảo lọ trèn bê
ẸJ mặt chất lòng. có thế hơi nghiêng lọ. Tránh lác lọ thuộc 6 ngãn ngừa tạo thảnh bọt.
. Một vòng bọt khi nhỏ trên bề mặt của dung dịch có thẻ_chảp nhặn được. Thao tảc pha
thường mầt vái phút, nhưng có thề đên 15 phút trong một sỏ trường hợp,
' Ệịi 5. Xoay ngươc lọ xuống dưới vả đảnh dấu đường trên bơm tiêm đề tiêm.
1: | '" Luôn luôn đảm bảo rút một thế tich chinh xác vả điêu chinh nêu có bọt khi.
' ”ế \ >
6. Tháo ống tiêm ra khỏi bộ phận nối tiếp với lo về gắn kim vảo ỏng tiêm đề tiêm sâu dưới da.
úĨỳjỊ, _ "r_› ;, 7.Tiến hanh tiêm sảu dưới da, Để thực hiện véc da bụng, nâng mỏ dưới da và đâm kim
)» ư , f sảu ở một góc không dưới 45 độ.
gfr'c: , Tiêm chặm 4 ml FiRMAGON®8O mg, ngay sau khi pha.“
sát xương sườn.
i 8. Không nện tiêm ơ cảc vùng mả bệnh nhân bị đè ep. như vùng xung quanh dảy thảt lưng hoặc lung quần hoặc gần
Không được tiêm trưc tiếp vác tĩnh mach. Kéo lui nhẹ piston để kiếm tra xem có hút phải máu hay không. Nếu có
máu ở ông tiêm, khòng được dùng thuốc nảy nữa. Ngừng thao tác. hùy ổng tiêm và kim (pha một liêu mới cho
bệnh nhăn).
' Khi đang sử dung. độ Ổn định về iỷ hóa đã đươc chứng minh trong 2 giờ ở 25°C. Theo quan điếm vi sinh hoc, trừ
khi cách pha thuôc loai bò được nguy cơ nhiễm vi sinh, nẻn dùng thuôc ngay. Nêu không dùng ngay, thới gian bảo
quản vả điều kiện bảo quản khi đang sử dụng lá trảch nhiệm của người sử dụng.
Khòng có yêu cảu đặc biệt khi hùy bò
CHỐNG CHỈ ĐỊNH
Quá mẫn với hoạt chât hoặc bât kỳ thánh phần nảo cùa tả dược
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIỆT KHI sư DỤNG
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cằn thẻm thỏng tin. xin hòi ý kiến bác sĩ.
Thuốc nảy chỉ dùng theo đơn cùa bác sĩ.
Cảc dữ liệu hiện có về độ an toản vả hiệu quả của degarelix giởi hạn trong khoảng thời gian điều trị một nảm.
Tác dung trên khoảng QTIQTc
Điêu trị lám mât androgen dải hạn có thẻ lảm kéo dải khoảng QT. Trong một nghiên cứu xác định so sánh
FiRMAGON® với leuprorelin. đo điện tâm đồ (ECG) định kỳ (hảng thảng) đă được tiên hảnh; cả hai điêu trị cho
thảy cảc khoảng QTIQTc vượt quá 450 milìgiây (msec) ở khoảng 20% bệnh nhân. và vượt quá 500 miiigiây ở 1%
bệnh nhản dùng degarelix và 2% bệnh nhân dùng Ieuprorelỉn (xem phân Dược lưc học).
FIRMAGONỘ chưa được nghiên cừu ở những bệnh nhản có tiền sử khoảng QT trên 450 miligiảy đã được điêu tri.
ở những bẻnh nhản có tiền sử hoặc có yếu tố nguy cơ về xoắn đỉnh (torsades de pointes) và ở những bệnh nhản
đang dùng đồng thời các thuôc có thế Iám kéo dải khoảng QT, Vi vặy cần phải đánh giá kỹ lưỡng giữa lợi ich vả
nguy cơ khi dùng FIRMAGONỦỞ những bệnh nhân nảy (xem phân Tương tác với các thuổc khác vá các dạng
tương tảc khác vả phần Tác dụng không mong muôn).
Su an
Những bệnh nhân đã biêt hoặc nghi ngờ bị rối Ioạn vê gan chưa được đưa váo trong cảc thử nghiệm Iảm sảng dải
hạn với degarelix Đã ghi nhận tăng nhẹ thoáng qua v men ALT vả AST những trường hợp náy không kèm theo
tảng bilirubin hoặc các triệu chứng iảm sảng Nèn theo dõi chức nảng gan ở những bệnh nhân đã biềt hoặc nghi
ngờ bị rối loạn về gan trong thời gian điều trị. Dược động học cùa degarelix đă được nghiên cừu sau khi tiêm tinh
mach iiều đơn cho những người bị suy gan nhẹ đên trung binh (xem phần Dược động hoc).
Su thân
Degareiix chưa được nghiên cứu ở bệnh nhân bị suy thặn nặng, vì vảy cần phải thận trọng.
Quá mẫn _
Degareiix chưa được nghiên cứu ở bệnh nhân có tiền sử hen nặng chưa được điều trị. phản ửng phản vệ. nối mê
đay nặng hoặc phủ mạch.
Tha đối mãi đô xươn
Đã có báo cáo ve giảm mật độ xương trong y vản ở nam giới đã cảt bỏ tinh hoán hoặc những người đã được điều
trị bằng chẳt đông vặn GnRH Có th dự đoán lá sư ức chế testosterone trong thời gian dải ở nam giời sẽ có tác
dụng trẻn mặt đỏ xương. Mặt độ xương chưa được đo trong thời gian điêu trị bằng degarelix
Sư dung nag glucose
Đã quan sải thảy giảm dung nạp glucose ở nam giới đã cắt bỏ tinh hoán hoặc những người đã được điếu trị bằnẳ
chât đòng vặn GnRH Đái tháo đường 00 thế phát sinh hoặc nặng thêm; vì vậy bệnh nhân đái thảo đường có th
cằn theo dõi glucose huyêt thường xuyên hơn khi đang dùng liệu pháp lam mảt androgen Tác dụng của degarelix
trên các nống độ insulin vả glucose chưa được nghiên cứu.
PHỤ NỮ CÓ THAI VÀ CHO CON BỦ
Không có chỉ định lỉẽn quan về việc dùng FIRMAGON® cho phụ nữ
TÁC ĐỘNG TRẺN KHẢ NĂNG LÁ! xe VÀ VẬN HÀNH MÁY MÓC
Chưa có nghiên cứu được tiến hảnh về tác động của degarelix trèn khả nảng lái xe vả vận hảnh máy móc Tuy
nhiên mệt mỏi vả chóng mặt lá các phản ứng phụ hay gặp có thể ảnh hưởng đến khả nãng lái xe vả vận hánh
máy móc.
TƯỜNG TÁC vờ: cÁc THUỐC _KHÁC VẬ cAc DẠNG T_U’ơNG TÁC KHÁC
Chưa có cảc nghiên cứu được tiên hảnh vé tương tác thuôc-thuốc.
Vi điều trị iảm mất androgen có thẻ lám kéo dải khoảng QTc. việc dùng đồng thời degarelix với các thuốc đã biết
Iảm kéo dải khoảng QTc hoặc những thuốc có thể gây ra xoắn đĩnh (torsades de pointes) như các thuốc chông
ioan nhịp nhòm IA (vi dụ quinidine disopyramide) hoặc nhóm Iil (vi dụ amiodarone, sotaioi dofetilide ibutiiide)
methadone cisapride moxifloxacine. thuốc chống ioan tảm thân v. v. phải được đánh giá cần thận (xem phần
Cảnh báo vá thặn trọng đặc biệt khi sử dụng)
Degareiix không phải lả cơ chắt đôi với hệ CYP4SO ở người vả chưa thây gây cảm ứng hoặc ức chế CYP1A2,
CYP2C8, CYP2C9. CYP2C19, CYP2D6, CYP2E1, hoặc CYP3A4IỔ ở bât kỳ mức độ náo in vitro. Vì vậy, không
chắc có tương tác dược động học thuôc—thuốc trong quá trinh chuyên hộa iiẻn quan đên những isoenzyme náy có
ýnghĩa lảm sáng.
TƯỚNG KY qầ
Trong khi chưa có các nghiên cứu về sự tương hợp, khỏng được pha trộn thuốc nảy với các thuốc khác.
TẢC DỤNG KHÔNG MONG MUỐN
Cảo phản ứng phụ đã được ghi nhận hay gặp nhất trong khi điều trị bằng degarelix trong một nghiên cứu xảc định
phase III (N=409) lả do các tác dụng dược ly' có thẻ có cùa sư ức chế testosterone, bao gồm nộng bừng vả tảng
cản (được bảo cáo ở 25% vả 7% bệnh nhân tương ứng đang điều trị 1 nảm). hoặc các phản ứng tại chỗ tiêm Rét
run thoảng qua, sốt hoặc bệnh giống củm đã được ghi nhặn xảy ra vải giờ sau khi dùng thuốc (gặp ở 3%. 2% vé
1% bệnh nhân tương ứng).
Các phản ứng phụ tại chỗ tiêm đă được báo các chủ yêu iả đau gặp ở 28% bệnh nhản vả ban đó gặp ở 17% bệnh
nhán các phản ứng phụ it gặp đã được báo các lá sưng (6%), cứng (4%) và nỏt phông nhỏ (3%) Những phản
ứng phụ nảy chủ yêu gặp với liêu khởi đầu trong khi ở điều trị duy trí với liều 80 mg tỷ lệ các phản ửng phụ nảy
trẻn 100 lần tiêm lá: 3 trường hợp đau vá <1 trường hợp ban đỏ sưng nốt phồng nhỏ vả cứng Các phản ứng phụ
đã được báo cáo nảy hầu hết đều thoáng qua. ở mức đó nhe đên trung binh vá rât 11 khi dẳn đên ngừng điều trị
(<1%)
Tần suất cùa các tác dụng khòng mong muốn liệt kê dưới đây đã được xác định. sử dụng quy ước sau
Rầt hay gặp (2 1/10); hay gặp (2 11100 < 1/10); it gặp (z M 000- < 17100) Trong mỗi nhóm tần suất các tác
dụng khòng mong muôn được trinh báy theo thứ tự độ nặng giảm dần
Bảng 1: Tần suất các phản ứng phụ đă được báo cáo ở 1259 bệnh nhân được điều trị trong tồng số 1781 bệnh
nhản theo năm (các nghiên cứu phase II vá phase III).
Nhóm cơ quan hệ Ểẩt hay gặp Hay 9ồp it gặp
thống theo MedDRA q
Rối ioan máu vả hệ Thiếu máu“ “
bach huyêt
`1P11
Z“
Di
' `
| Ổn
11
Rồi loan hệ miễn dịch
Quá mẫn
Rỏi loan chuyến hóa Tăng cản“ Tảng đường huyếtlĐải tháo đường,
vá dinh dưỡng tảng cholesterol. giảm cân, giảm sự
thèm ăn. thay đồi vẻ calci huyêt
Rõi loạn tảm thần Mầt ngủ Trầm cảm, giảm dục nảing’k
Rối ioan hê thần kinh
Chóng_mặt. nhức đầu
Sa sút tinh thân, giảm cảm giảc
Rồi Ioạn mắt
Nhin mờ
Rối loạn tim
Loạn nhip tim (kể cả rung nhĩ) đánh
trỔng ngực khoảng QT kéo dải* (xem
phần Cảnh bảo vả 1hận trọng đặc biệt
khi sử dụng vả phần Tương tảc vời
các thuốc khác và các dạng tương tác
khác)
Rôi loạn mạch
Nòng bừng*
Tảng huyễt áp, phản ứng mach-thần
kinh phê vị (kể cả hạ huyêt áp)
Rối loạn hô hấp ngực
và trung thất
Khó thở
Rối loạn dạ dảy-ruột
Tiêu chảy, buồn nôn
Táo bón. nôn, đau bụng. khó chịu ở
bụng. khô miệng
Rối loạn gan-mặt
Tảng transaminase gan
Tăng bilirubin, tăng phosphatase kiêm
Rồi ioạn da vá mó
dưới da
Tảng tiết mồ hôi (kể cả
ra mồ hỏi vác ban
đém)“, nối ban
Nổi mề đay, nốt nhi] ở da, rụng tóc,
ngưa, ban đỏ
Rỗi Ioạn cơ xương,
mô liên kẻt vả xương
Đau vá khó chịu ở cơ
xương
Lọăng xương/giảm xương. đau khởp.
yêu cơ. co giật cơ. sưng khờp/cứng
khớp
Rối ioạn thán vá tiềt
niệu
Tiếu dải, tiêu gấp, tiếu Khó. tiêu đêm,
suy thận. tiêu khỏng tự chủ
Rối ioạn hệ sinh sản
vả vú
Chứng vú to ở nam _
giởi'. teo tinh hoảnĩ rỏi
ioạn cương’
Đau tinh hoản, đau vú. đau vùng chậu,
kich thích cơ quan sinh duc, không
xuât tinh
Rối Ioan toản thản vá
Phản ứng phụ ở
Rẻt run. sốt, mêt mỏi“.
bệnh gióng cùm
Khó chịu, phi] ngoại biên ỦV
.:
tinh trạng tại chỗ tiêm chỗ tiêm
* Hâu quả của sư ức chế testosterone về sinh lý đã biêt
Cảo phản ứng phụ sau đây đã được bảo cảo có liên quan đến điêu trị ở các bệnh nhản riêng lẻ: Giảm bạch cầu
tiung tinh có sốt nhồi máu cơ tim vả suy tim sung huyết
Thav đồi về các thôn:: sổ xét nnhièm
Trong một nghiên cứu xảo định phase III (N =409) sử dụng thuốc trong 1 năm cảc thay đối về trị số xét nghiệm
được ghi nhận lả tương tự nhau ở 2 nhớm sử dụng degarelix vả một chất đồng vặn GnRH (leuprorelin) được dùng
như chầt so sánh. Sau khi được điều trị bảng cả hai thuốc, các tri số transaminase gan (ALT AST and GGT) bất
thường rõ rệt (>3" Uth— giới hạn trèn của mưc binh thường) đã được ghi nhặn ở 2- 6%b bệnh nhân có trị số binh
thường trước khi điều trị Sau khi được điều trị bằng cả hai thuốc giảm rõ rệt các trị sò huyết học hematocrit
(5 0.37) vả hemoglobin (s115 gll) đã được ghi nhận ở 40% vé 13- 15% bệnh nhản tương ứng có tri số bình thường
trước khi điều trị, Người ta cũng chưa rõ mưc độ ảnh hưởng cùa bệnh cảnh ung thư tuyến tiên iiệt cũng như việc
điêu trị lảm mât androgen iẽn sự suy giảm cảc trị số huyết hoc như thế nản Các trị số kali (a 5 8 mmol/l)
creatinine (zi 77 ụmol/i) vá BUN (210 7 mmoill) bắt thường rõ rệt ở bệnh nhân có trị số binh thường trước khi điều
trị đã được ghi nhận ở 6% 2% vả 15% bênh nhản được điều trị bằng degarelix vả 3% 2% vá 14% bệnh nhân
được điêu trị bằng Ieuprorelin tương ứng
Thaỵ đồi về kết guả đo điên tâm đồ (ECG)
Trong một nghiên cứu xảo đinh phase [1 (N=409) sư dụng thuốc trong 1 năm cảc thay đối về kêt quả đo điện tảm
đồ lả tương tự nhau ở 2 nhóm sử dụng degarelix vả một chắt đồng vặn GnRH (leuprorelin) được dùng như chât so
sánh. Ba bệnh nhân (<1%) trong số 409 bênh nhân ở nhóm degarelix va bốn bệnh nhân (2%) trong số 201 bệnh
nhân ở nhộm dùng leuproreiin 7 5 mg đã có QTcF > 500 miligiây. Từ lúc khởi đầu cho đến cuối cuộc nghiên cứu
thay đôi trung binh vê QTcF đối vời degarelix lá 12 0 miiigiây vả đổi với leuprorelin lẻ 16 7 miligiảy
Thông bảo cho bảc sỉ những iác dụng không mong muốn gặp phải khi sử dụng thuốc.
DƯỢC LỰC HỌC
Nhóm dược iý điêu _tn: Điêu trị nội tiêt, Cảo chắt đối kháng hormone và các tả_c nhân liên quan Mã ATC: LO²BXO2
Degarelix lả chất đôi kháng hormone phóng thich gonadotrophin (GnRH) gản kêt cạnh tranh và thuận nghịch với
các thụ thể GnRH cùa tuyến yên, do đó lảm giảm nhanh sự phóng thich gonadotrophin hormone tạo hoảng thể
(LH) vả hormone kĩch thich nang noãn (FSH) nhờ đó lảm giảm tiết testosterone CT) bới tinh hoan Ung thư tuyền
tiên liêt được biết là nhay với androgen và đáp ứng với điêu trị loai bỏ nguồn androgen Không giống như các chải
đỏng vận GnRH chắt đồi kháng GnRH không gây táng đột ngột LH tránh được các hậu quả như tăng đột ngột
testosteronelkich thich khôi u vá bùng phát các triệu chưng sau khi khởi đầu điều trị
Một Iiẽu đơn 240 mg degarelix. tiếp theo với liều duy tri 80 mg mỗi thảng Iảm giảm nhanh chớng nồng độ LH, FSH
vả sau đó là testosterone. Nồng độ dihydrotestosterone (DHT) trong huyêt tương giảm theo cảch tương tự như vởi
testosterone.
Degarelix có hiệu quả trong việc đat được vá duy trì sự ức chế tôt testosterone dưới nồng độ do cẳt bò tinh hoản
trong y khoa iả 0.5 nglml. Liều duy trì 80 mg mỗi thảng dẫn đên duy trì sự ức chế testosterone ở 97% bệnh nhân it
nhât trong 1 năm. Nồng độ testosterone trung binh sau 1 năm điều tri là 0.087 nglml (khoảng từ phân vị -
interquartile range - lả 0.06-015) N=167.
Kết guả của nghiên cứu xác fflnh Phase III
Độ an toán vả hiệu quả của degarelix đã được đánh giá trong một nghiên cứu mở. đa irung tảm. ngảu nhiên. so
sánh vởi thuốc. nhóm song song. Nghiên cứu nảy điêu tra độ an toán vả hiệu quả của hai chê độ liêu dùng
degarelix mỗi tháng khác nhau vởi liều khởi đầu lả 240 mg <4o mglml), tiêp theo tiêm dưới da mỗi thảng với Iiếu
160 mg (40 mg/mi) hoặc 80 mg (20 mglml). so sảnh với tiêm bắp mỗi tháng 7.5 mg Ieuprorelỉn ở nhửng bệnh nhân
bị ung thư tuyến tiên liệt cần liệu pháp Iảm mắt androgen. Trong tống số 620 bệnh nhân được chọn ngẫu nhiên từ
một trong ba nhóm điều trị. trong đó 504 (81%) bệnh nhân đã hoản tắt cuộc nghiên cứu. Ở nhóm điều trị băng
degarelix 240/80 mg, có 41 bệnh nhản (20%) ngừng cuộc nghiên cứu, khi so vởi 32 bệnh nhân (16%) ở nhóm
leuprorelin.
Trong số 610 bệnh nhân được điêu trị
- 31% bị ung thư tuyên tiền liệt khu trú
' 29% bị ung thư tuyến tiên liệt tiến triền khu trú
' 20% bị ung thư tuyến tiên liệt có di căn
— 7% có tinh trạng di căn chưa rõ _ _
— 13% đã được điều trị bằng phẫu thuật hoặc phóng xạ trước đảy và có tảng kháng nguyên đặc hiệu của tuyên tiên
liệt (PSA).
Cảc chỉ số về nhản khảu học tương tự nhau giữa hai nhóm ở mức khời đầu điều trị. Tuổi trung binh lá 74 tuồi (ở
mức từ 47 đên 98 tuồi). Mục tiêu chinh để chứng minh lả degarelix có hiệu quả trong việc đat được vả duy trì sự
ức chế testosterone dưới 0.5 ng/ml trong thời gian 12 tháng điêu trị.
Liều duy tri thảp nhắt có hiệu quả lẻ 80 mg degarelix đã dược chọn.
Đat đươc tesiosterone (T) huvêt thanh s 0.5 nolml
FIRMAGOĨxĨỏ có hiệu quả trong việc đạt được sự ức chế testosterone nhanh chóng. xem Bảng 2. Ý
Bảng 2: Tỷ lệ phân trăm bệnh nhăn đạt được T 5 0.5 ng/ml sau khi khởi đâu điêu trị.
Thời 240/80 ? 5
thứ 52% 0%
thứ 3 96% 0%
thứ 7 99% 1%
thứ 14 100% 18%
thứ 28 100% 100%
Tránh tảnq đôt ngôi testosterone
Tảng đột ngột được định nghĩa lá khi testosterone vượt quá mức cơ bản 215% trong 2 tuần đầu tiên.
Không có bệnh nhân náo được điều trị bằng degarelix có tăng đột ngột tesiosterone; đã có giảm trung binh 94%
vé testosterone vảo ngảy thứ 3. Hầu hết bệnh nhản được fflếu trị bằng leuprorelin có tăng đột ngột testosterone;
đă có tăng trung binh 65% về testosterone váo ngáy thứ 3. Sư khảo nhau náy có ý nghĩa thống kê (p < 0,001).
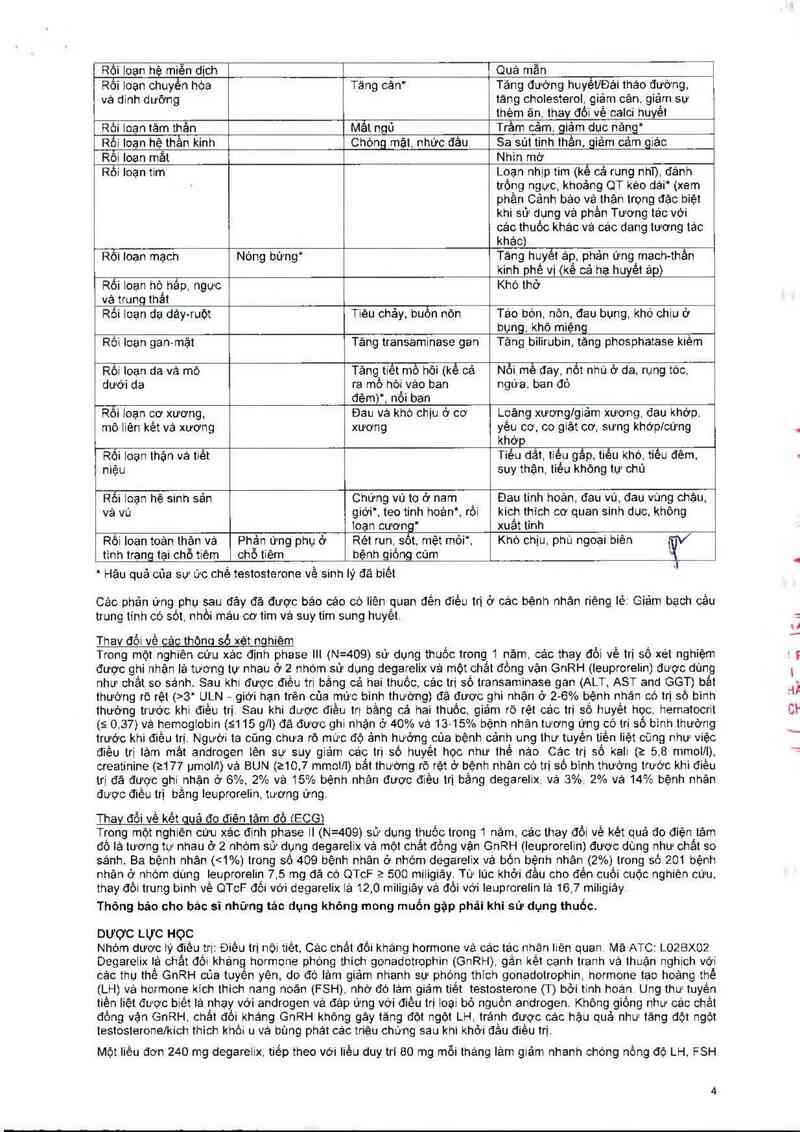
Hỉnh 1: Thay đồi tỷ lệ phân trăm về testosterone so vởi mức cơ bản ở nhóm điều trị đến ngảy thứ 28 (trung binh
về khoảng từ phán vị - interquariile range),
Thay dối tỷ lệ phản tri… về testosternne tủ ngảy 0 đển ngảy thứ 28
125-
100-
e ”’“
'. .'x
= .' ~.
… < _
.: .
°- 15- .' `
'3 Y. l
ưa D J
iõ '~. 1 ~
\! ị `
› -15* '.
n . x
1 ` i \
" —so— '. ` \
'. ~.
| "
—15~ '. - I ……………… __
-'oo.. ". _ ""“-w…
l ' l ' l ’ | ' l
0 7
Thờ! glnn kí lữ Ilõu dlu tlin (ngùy)
Mhỏm điõu …“ _ Degơekl 2109 IOIUJGN ——————— Lmomrounĩ.ã mq
Tiêu chỉ đảnh giá chinh trong nghiên cứu náy lả tỷ lệ ức chế testosterone sau 1 nảm điều trị bằng degarelix hoặc
leuprorelin. I_.ợi lch trẻn lâm sảng khi dùng degarelix so với leuprorelin cộng vởi thuốc khảng androgen trong giai
đoan đằu điêu trị chưa được chứng minh.
Hiẻu guá dái han _
Đảp ứng thảnh còng trong nghiên cứu nảy được định nghĩa là khi đạt được nòng độ do căt bò tinh hoản trong y
khoa vảo ngảy thứ 28 vả duy tri suốt cho đén ngảy thứ 364. vá trong giai đoan nảy không có nòng độ testosterone
nảo được ghi nhặn cao hơn 0.5 nglml.
Bảng 3: Khả năng tich lũy testosterone 5 0,5 nglmt từ ngáy thứ 28 đên ngảy thứ 364. W
Degarelix 240/80 mg
N=207
Leuprorelin 7.5 mg
N=201
Số người đáp ứng 202 194
Tỷ lệ đáp ứng 97,2% 96.4%
(khoảng tin cảy)’ (93.5; 98.8%) (92,5; 98.2%)
' ước tinh của Kaplan Meier theo nhóm
gạt được sư qia'm khám: ncuvên đảo hiêu của tuvến tiền Iiẻt (PSAì
Kich thước khối u khỏng được đo trực tìêp trong chượng trinh thử nghiệm lảm sảng nảy. nhưng đã có đáp ứng có
lợi gián tiêp trên khói u như đã cho thắy giảm 95% vé trị số trung binh của kháng nguyên đặc hìệu cúa tuyên tiên
liệt đôi với degarelix sau 12 tháng.
Trị số trung binh của kháng nguyên đặc hiệu của tuyến tiên liệt trong nghiên cừu ớ mức khởi điếm lả:
~ 19.8 nglml đôi với nhỏm crièu trị bằng degarelix 240/80 mg (khoảng từ phân vị … interquartile range: st 9.4 nglml
P75 46.4 nglml)
— 17.4 nglml đổi với nhóm điều trị bằng leuprorelin 7,5 mg (khoảng từ phân vị - interquartile range: st 8,4 nglml,
P75 56.5 nglml)
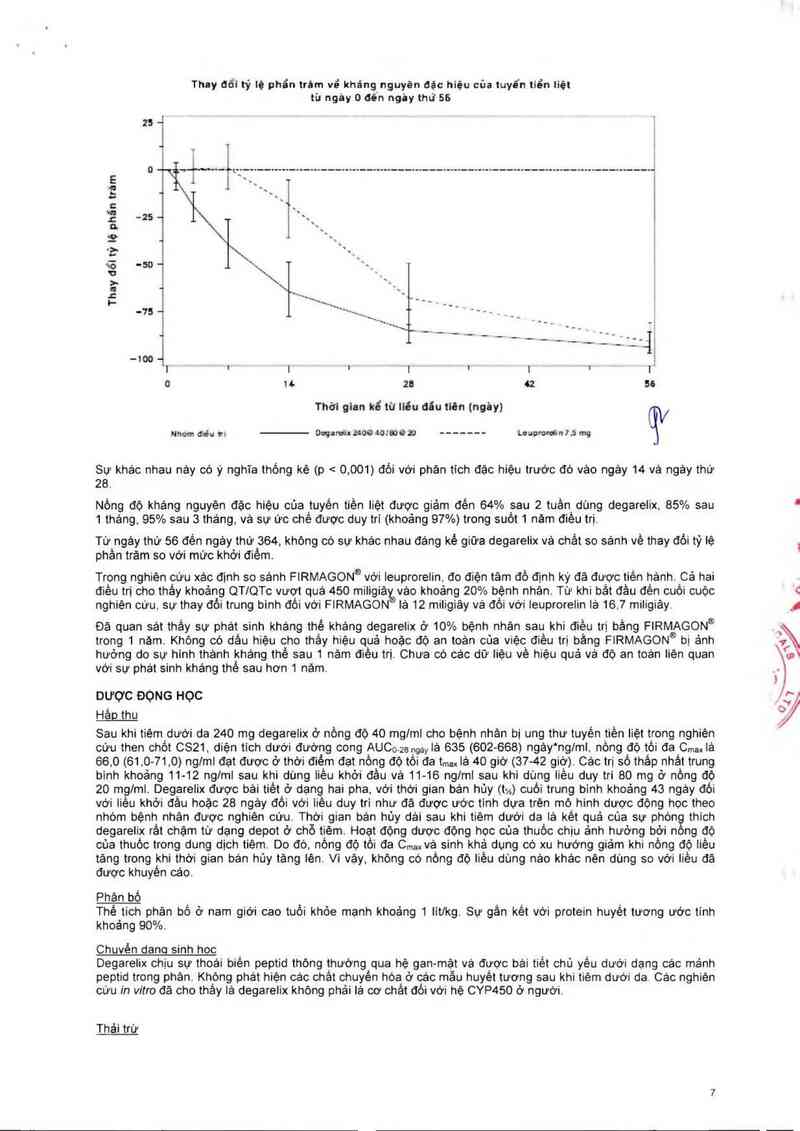
Hình 2: Thay đối tỷ lệ phần trăm về kháng nguyên đặc hiệu cùa tuyên tiên liệt theo nhóm điêu trị cho đên ngảy thứ
56 (trung binh về khoảng từ phản vị - interquartile range).
Thay đổi tỷ lệ phẩn trò… về kháng nguyên dặc hiệu của tuyển tiểu iiệt
tù ngảy 0 đốn ngây thứ 55
2: ~ \
\
~ i
* ì 1
T 1
o `
E ] ị
›. `
g -
S
2 —zs — ~ `
1 `
² i
'2' ` '
.z .” .. `
u i
›_ `
I ' \ i
.I: ' '~` - i
›— ~~—-.` ' ' …- .
—1s - _ -- .. _
. "' ..... ` - . _ ịi
-ioo -
| I | 1 | | | 1 l
0 14 zu & u
Thờl glan kể từ nau dlu tlũn (ngèy)
N… đéo ư: — Dqu uoa 40:QO ------- Leuwdmĩã mg qv
Sư khảo nhau nảy có ý nghĩa thổng kè (p < 0,001) dối với phân tich đặc hiệu trước đó vảo ngảy 14 vả ngảy thứ
28.
Nồng độ kháng nguyên đặc hiệu của tuyến tiền liệt được giảm đên 64% sau 2 tuần dùng degarelix. 85% sau
1 tháng, 95% sau 3 thảng. và sư ức chế được duy trí (khoảng 97%) trong suốt 1 năm điều trị.
Từ ngảy thứ 56 đên ngáy thứ 364. khỏng có sự khác nhau đáng kể giữa degarelix vả chât so sánh về thay đối tỷ lệ
phần trám so với mức khởi điẻm
Trong nghiên cứu xác định so sánh FIRMAGONo với leuproreiỉn đo điện tâm đồ định kỳ đã được tiên hảnh. Cả hai
điều trị cho thấy khoảng QTIQTc vượt quá 450 mitigiâềvảo khoảng 20% bènh nhản. Từ khi bảt đầu đến cuỏi cuộc
nghiên cứu sự thay đổi trung binh đối với FIRMAGON là 12 miligiây vả đối với leuproreiin lả 16. 7 miligiây
Đã quan sát thây sự phảt sinh kháng thể kháng degarelix ở 10% bệnh nhân sau khi đĩèu trị bằng FIRMỌAGONỘ
trong 1 nám. Không có dâu hiệu cho thắy hiệu quả hoặc độ an toản cùa việc điều trị bằng FIRMAGONQ bị ảnh
hướng do sự hinh thảnh kháng thể sau 1 nảm điều tri Chưa có các dữ liệu về hiệu quả vả độ an toản Iièn quan
với sự phát sinh kháng thể sau hơn 1 nảm.
DƯỢ C ĐỘNG HỌC
Hâg thu
Sau khi tiêm dưới da 240 mg degarelix ở nồng độ 40 mglml cho bệnh nhản bị ung thư tuyến tiên Iiẻt trong nghiên
cứu then chốt CSZ1 diện tich dưới đường cong AUCo.zs ngáy iè 635 (602- -668) ngảy nglml nồng độ tỏi đa C…;u lẻ
66 o (61 o 71 0) nglml đạt được ở thời điểm đat nòng ơo tối đa 1… la 40 giớ (3742 giờ) Các tri số tháp nhât trung
binh khoảng 11- 12 nglml sau khi dùng liếu khới đầu và 11- 16 nglml sau khi dùng iiều duy trì 80 mg ở nồng độ
20 mglml. Degarelix được bải tiêt ở dạng hai pha. vởi thời gian bán hủy (t'A) cuối trung binh khoảng 43 ngảy đối
với iiều khởi đảu hoặc 28 ngảy đối với liều duy trì như đá được ước tinh dựa trẻn mõ hinh dược đòng học theo
nhòm bệnh nhân được nghiên cứu Thời gian bản hùy dải sau khi tiêm dưới da lả kết quả cùa sự phòn thich
degarelix rầt chậm từ dang depot ở chỗ tiêm. Hoạt động dược động học của thuôc chịu ảnh hưởng bới nẵng độ
cùa thuôc trong dung dịch tiêm Do đó nống độ tổi đa Cmaxvả sinh khả dụng có xu hướng giảm khi nồng độ liều
tảng trong khi thời gian bán hủy tăng lẽn Vi vặy, không có nòng độ liêu dùng nảo khảc nẻn dùng so với liêu đã
được khuyến cáo.
Phân bố
Thê tich phân bố ở nam giới cao tuồi khỏe mạnh khoảng 1 lỉtlkg. Sự gắn kêt với protein huyết tương ước tính
khoảng 90%.
……
Degarelix chiu sự thoái biên peptid thỏng thường qua hệ gan-mật vả dược bải tiết chủ yếu dưới dạng các mảnh
peptid trong phản. Khòng phát hiện cảc chât chuyến hóa ở các mẫu huyêt tương sau khi tiêm dưới da Các nghiên
cưu in vitro đã cho thảy lả degarelix không phải lả oơ chắt đối với hệ CYP450 ở ngưới.
Thải trư
c/'—
— '
Ở nam giới khỏe mạnh. khoảng 20-30% liều đơn tiêm tĩnh mạch được dảo thải trong nước tiêu. gợi ý lả 70—80%
được thải qua hệ gan mặt. Đỏ thanh thải của degarelix khi dược dùng dưới dạng các Iièu đơn tiêm tĩnh mach
(0.864 - 49.4 ụg/kg) ở nam giới cao tuồi khỏe mạnh được ghi nhặn là 35—50 mllgiờ/kg.
Các nhóm bênh nhân đãc biẻt
Bênh nhân bị suy thận
Chưa có các nghiên cứu được tiên hảnh về dược động học ở bệnh nhân bị suy thận. Chỉ vảo khoảng 2c30% liêu
degarelix đã dùng được thải trừ dưới dang khỏng đồi qua thận. Phân tich các dữ liệu dược động học theo nhóm
bệnh nhân từ một nghiên cừu xảc định Phase III đã chứng minh tả độ thanh thải degarelix ở bệnh nhân bị suy thặn
nhẹ đên trung bình giảm khoảng 23%; vi vặy khòng khuyến cáo ớêu chinh liêu ở bệnh nhản bị suy thận nhẹ hoặc
trung binh. Các dữ liệu trẻn bệnh nhân bị suy thận nặng còn rảt ỉt, vi vậy cần phải thặn trọng ở nhóm bệnh nhân
nay.
Bệnh nhân bị suy gan
Degarelix đã được đánh giá_trong mòt nghiên cứu về dược động hoc ở bệnh nhân bị suy gan nhe đên trung binh
Không guan sát thây các dâu hiệu tảng lẽn ở bệnh nhán bị suy gan so với người khỏe manh. Không cân điêu
chỉnh liêu ở bệnh nhản bị suy gan nhẹ hoặc trung binh. Chưa có nghiên cừu ở bệnh nhân bị rối Ioạn chức nảng
gan nặng. vì vây cần phải thặn trọng ở nhóm bệnh nhân nảy.
QUÁ LIỂU
Chưa có kinh nghiệm lảm sáng về các tác dụng do quá liều degarelix cảp tinh. Trong trường hợp quá liều. phải
theo dôi bẻnh nhân vả cần tiên hảnh điều trị hỗ trợ thích hợp nẽu xem xét thấy cân thiêt.
HẬN DÙNG
36 tháng kế từ ngảy sản xuắt. C3\/
Sau khi gha
Khi đang sử dụng. đó ồn định về lý hóa đã được chứng minh trong 2 giờ ở 25°C. Theo quan điêm vi sinh học. trừ
khi ca’ch pha thuốc Ioại bò được nguy cơ nhiễm vi sinh. nên dùng thuôc ngay. Nếu khỏng dùng ngay. thời gian bảo
quản vả điều kiện bảo quản khi đang sử dụng lá trách nhiệm cùa người sử dụng.
BẢO QUÁN
Bảo quản dưới 30°C. Không đề đông Ianh.
Đề thuốc xa tầm tay của trẻ em.
Khỏng dùng thuốc quá hạn sử dụng đã ghi trẻn bao bi.
QUY cAcn ĐÓNG GÓI _ _
Hòp 1 lọ bột, 1 bơm tiêm đòng sẵn 4.2 ml dung môi. 1 pittông, 1 bộ phận tiẻp nôi iọ bòt. 1 kim dùng để tiêm.
SÁN XUẤT BỜI:
Nha` sản xuất lọ bột:
Rentschler Biotechnologie GmbH
EMin-Rentschler—Str. 21
D-88471 Laupheim
Germany VĂN PHÒNG
ịo ĐẠI DIỆN _ ’
Nha` sản xuất lọ dung mõi: 13 [ TAI THẢNH PHÓ
Ferring GmbH Ề ' “` '
Wittland 11. \\Ề, HO CHI M
0
24103 Kiel. ; "
Germany \lị mà ổ0ư/ý M.D..M.B.A
CHO: C hicf Reprecemmive
Ferring Pharmaceuticals AIS
Kay Fiskers Plads 11.
DK-23OO Copenhagen S,
Denmark
ĐỎNG GÓI BỞI:
Ferring International Center SA
Chemin de la Vergognausaz 50.
1162 Saint-Prex.
Switzerland
Ngảy cập nhật thõng tin: Tháng 4/2013
TUQ. C_ỤC TRUỘNG
P.TRLỒNG PHONG
Jiỷuzỵển inij/ ẩfânỵ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng