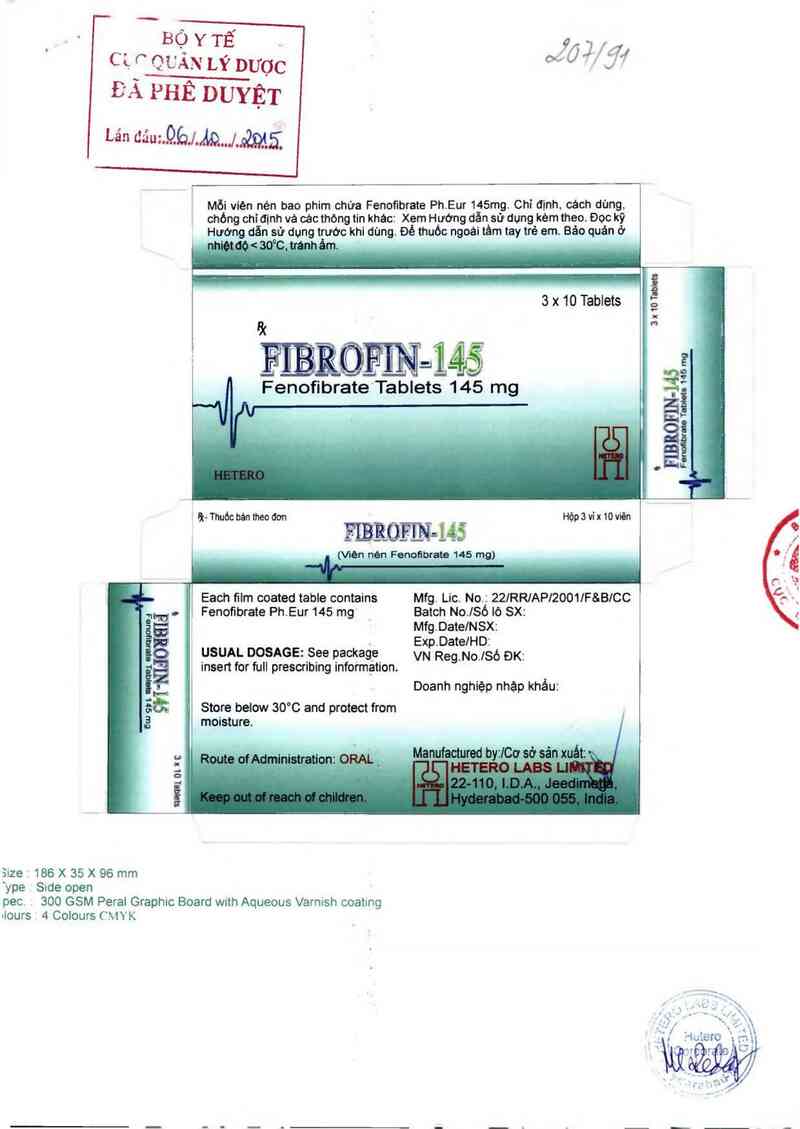







BỘ Y TẾ
C 1. f` QL'AN LÝ DƯơc
.…_____ .
ĐÃ PHÊ DUYỆT
Lán dáuz.QbJ.ẢâJfflỉ
ojỒJ/ỔỈẮ
…… … —~…J
ẳ
E
0…m
ầize11BõX 35X 96 mm
'ype Side open
l Each tĩlm coated table contains Mfg. Lic. No:: 22lRR/AP/ZOO1IFSB/CC
MLDƯĐ
Mỗi viện nén bao phim chứa Fenofibrate Ph.Eur 145mg. Chỉ đmh, cách dùng.
chóng chỉơgnh vá các thòng tin khác: Xem Hướng dẫn sử dung kèm theo. Đoc kỹ
Hướng dăn sử dụng trước khi dùng. Đế thuóo ngoái tâm tay trẻ em. Bảo quán ở
3 x 10 Tablets
31\0TM
ẾIỀRỦẺffl=Mẳ
t Fenofibrate Tablets 145 mg
: :
__ : ›, -,J _
: : ` ~f .,4u :
² ù- Thuỏc bản theo dơn Hộp 3 vỉ ›: 10 vìén
FfflầOffl.N= 145
~Tn— .n inerỵẹ 14
| Fenofibrate Ph.Eur145 mg Batch No.]Só lò SX:
Mfg.Date/NSX:
Exp.DatelHDz
USUAL DOSAGE: See package VN Reg_No_Jsô ĐK:
insert for full prescribing infotm_ảtion.
Doanh nghiệp nhập khảu:
Store below 30°C and protect from
moisture.
pec. . 300 GSM Peral Graphic Board with Aqueous Varnish coatmg
:lours 4 Colours CMYK
_ , :x\
' '. ụ,. - \ "\
:_ : ;“1ơLUỈU \fTaì
' ..l
"“I’Ễxg …
6!13m
FBRƯIIHỒS FlBRfflN-MG
FIBRUIOMJB FHRNlN-MS
Foil W:dth
Bluster Sư.e
Repeated Length 61 33 mm
No of Colours 1
I Green
'*FlBROFlN-1 45
Fenofibrate Tablets 145 mg
Each f:lm coated table contains
Fenofibrate Ph.Eur 145 mg
USUAL DOSAGE: See package insert
for full prescribing information.
Mfg. Lic. No. 221RR/AP/2001/F8:8/C0
Store below 30°C and protect from
moisture Manufactured by
Route ofAdmin:stration. ORAL IỀỄIHẸTERO LABS LIMlTED
Umt III. 22-11o. | DA . Jeed:metla.
Keep out of reach Of children. Hyderabad-5OO 055. Andhra Pradesh,An-dd
*FlBROFlN-1 45
Fenofibrate Tablets 145 mg
Each film coated table contains
Fenofibrate Ph.Eur 145 mg
USUAL DOSAGE: See package insert
for fuIl prescribìng information.
Mfg. Lic No 22IRRIAP/2001/FSBICC
Stohre below 30°C and protect from
mo:sture Manufactured by
Rou dministrationr ORAL HETERO LABS UMlTED
Um! III. 22-110, ID.A_ Jeedtmetla.
Keep ach Of children. Hyderabad-500 055. Andhra Pradesh.An-dơ
180 mm
186 mm
186 mm
'180 mm
I›`J tiúf' Í ì'x' \
I
HETERO HETERO HETERO
HETERO
Batch No.lSỏ lò SX
Mngate/NSX
ExpDate/HD
92 mm
FIBROFlN-I4S
(Viên nén bao phim Fenofibrat 145mg)
HƯỚNG DĂN SỬ DỤNG
Đọc kỹ hướng dẫn sử dụng truớc khi dùng. Nếu cần thêm thông tin, xin hỏi ý kiến bác sỹ.
Thuốc bán theo đơn.
Thảnh phần: Mỗi viên nén bao phỉm chứa fenofìbrat Ph.Eur. l4Smg.
Tả dược: Hypromellose, sucrose, lactose monohydrat, microcrystaliine cellulose, sodỉum lauryl
sulphate, croscarmellose sodium, magnesium stearat, Opadry AMB white 80W68912
Dược lực học:
Vhómđiềutrịdượclý Chốngtăng lipid …… Mã ATC. ClOABOS
Cơ chế hoạt động. Phân nửa hoạt tinh cùa fenofibrat !ả acid fenofibric. Tảc dụng dược lý học cùa
fenofìbric acid trên người và động vật đã đuợc nghiên cứu rộng rãi vởi liều uống fenoíìbrat. Tác dụng
cùa acid fenofibric đã được quan sát trong thưc tỉễn lâm sảng được giải thích trên in- vivo trên chuột
cái chuyến gien và trên in- -vilro trong nuôi cấy tế bảo gan ở người bằng việc kích hoạt thụ thể PPAR
kiếu a (PPARa). Bằng cơ chế nảy, fcnofìbrat lảm tăng tiêu giải lỉpid và đảo thải các cảc tiểu phân
gièu triglycerid trong huyết tương bằng cách hoặt hóa lipoprotein lipase vả giảm sản xuất apoprotein
C- III (một chất ức chế hoạt dộng lipOprotein lỉpase). \
Víệc giảm triglycerid (TG) dẫn tới việc thay đổi kích thước và thảnh phân của LDL từ cảc tiều phản
nhò, đậm đặc (cảc tiếu phân nảy được cho lá nguyên nhãn gảy vưa động mạch do tính nhạy cảm với
quá trình 0 xy hóa), thảnh cảc tiều phân có kích thước lởn Cảo tíếu phân lớn hơn có ái lực cao đối
với cảc thụ thể cholesterol vả đuợc dị hóa nhanh chóng Sự kỉch hoạt PPARa Iảm tăng tổng hợp
aplipooprotcins A- [, A- II và HDL—cholestetol. Fenofibrat cũng lâm giảm mức acid uric trong huyết
thanh trên nhũng người tãng uric acid trong mảu vả cảc cá thế binh [hưởng bằng việc tảng đảo thải
acid uric trong nuớc tieu.
Các nghiên cứu lâm sảng khác nhau đã cho thấy nồng dộ choiesterol toảr: phẳn LDL- C, và apo B,
một phức họp mảng LDL, Iiên quan đến bệnh xơ vữa động mạch ở người. Tương tự gỉảm HDL- C và
phức hợp vận chuyến của nó, apolỉpoprotein A (apo AI vả apo All) líên quan dến sự tiến triến của
bệnh xơ vũa động mạch. Cảc điểu tra dịch tễ học cho thấy tỷ lệ bệnh tim mạch và tỷ lệ tử vong thay
đối khảo nhau liên quan trực tỉếp đến nồng độ cholesterol toản phần, LDL- C, và TG, và tỷ lệ nghịch
với mức HDL- C. Chưa xảo định đuợc tảo động độc lập cùa vỉệc tãng HDL- C hoặc gỉảm triglycerid
([G) đối với nguy cơ mắc bệnh tim mạch vả tỷ lệ tử vong. Acid fenofibric, chất chuyển hóa chủ yêu
cùa fenofibrat, lảm giảm choicsterol toản phần, LDL cholesteỹol, apolipoprotein B, triglycerid toản
phần vả lỉpoprotein tỷ trọng rất thấp (VLDL) trên các b^ .\ l’án được điều trị. Ngoài ra, điều trị với
fenofìbrat lảm tăng lipoprotein tỷ trọng cao (HDL) vả apolipợprotein apoAl vả apoAll
Dược động học:
Nồng độ cùa acid fenofibrỉc trong huyết tương sau khi uống 3 vỉẽn 48mg hoặc một viên ]45111g
mong đương vởi một viên nang fenofibrat 200mg dưới dạng micron hóa ở trạng thải no. Fenofibrat lả
một dẫn chất của phân nủa hoạt tính hóa học acid fenoíìbric. Fenofibrat được thủy phân ester chuyền
hóa thảnh acid fenoũbrìc, một thảnh phần hoạt tính có thể đo được trong hệ tuần hoản.
Hốp thu. Chưa xảo định nồng độ khả dụng sinh học cùa fenofibrat do hợp chẩt gần như không tan
ương mõi trường thủy dịch phù hợp để tiêm. Tuy nhiên, tenot:brat hấp thu tốt theo đuờng dạ dảy
ruột Sau khi sủ dụng liều uỏng trên nguời tình nguyện khỏe mạnh, khoảng 60°’ :› liều đơn fenoíibrat
đuợc đánh dấu phóng xạ có trong nước tiếu chủ yêu dưới dạng acid fenofìbric và dẫn xuất liên hợp
glucuronate cùa chất nảy, và 25°/ 0 được đảo thải trong phân. Nổng dộ acid fenotìbric trong huyết
tuơng đạt đỉnh trong khoảng từ 6 đến 8 gỉờ sau khi uỏng Mức biểu hiện acid fenofibric trong huyết
tuơng, được đo bằng Cmax vả AUC, không khảo biệt đảng kể khi sử dụng iiều đon 145mg fcnofib:at
trong trạng thái đói hoặc khỏng đói.
Phân bố. Sau khi sử dụng đa lìều fenofibrat, acid fenofibric ở trạng thái on định đạt được trong vòng
9 ngảy. Nồng độ acid fcnofibric trong huyết tương ở trạng thái ôn định gần gắp hai lần nếu so với sử
, <|
nI-
':l
dụng liều đơn. Độ gắn kết với protein trong huyết thanh vảo khoảng 99% trên bệnh nhân bình thường
vả bệnh nhân tãng lipid máu
Chuyển hóa: Sau khi uống, fenofibrat nhanh chóng được thủy phân bởi enzym esterasc thảnh chắt
chuyền hóa hoạt động, acid fenofibric; không phát hỉện thắy fcnofĩbrat nguyên vẹn trong huyết
tương. Acid fenofibric chủ yếu kết hợp với glucuronic acid và đảo thải trong nuớc tiểu. Một lượng
nhỏ của acid fcnofibric bị giảm ở một nua chất carbonila thảnh chất chuyến hóa benzhydrol, chắt nảy
đến lượt nó kết họp với acid glucuronic vả dảo thải trong nuớc tiếu. Cảo dũ liệu chuyến hớa trong cơ
thể cho thấy cả fenofĩbrat vả acid fcnofibric đều không trải qua việc chuyền hóa oxy hóa (_ví dụ như
cytochrome P450) với mức độ đảng kể.
Thai trừ: Sau khi hấp thu, fenofibrat chủ yếu thải trong nước tiểu dưới đạng cảc chất chuyển hóa, chu
yểu lả acid fenotìbric vả acid fenofibric glucuronid. Sau khi sử dụng liều fenofibrat đánh dấu phóng
xạ, khoảng 60° /o ]iồu có trong nước tỉếu và 25% được đảo thải trong phân. Acid fenofibric được lhái
trừ với thời gìan bản hùy lả 20 giờ, do đó chỉ cho phép sử dụng ngảy một lần trong chỉ định lâm sảng,
Quần thể đặc biệt:
Sử dụng ở trẻ em: Chưa xảo định được độ an toản vả hiệu quả trên bệnh nhân trẻ em
Người cao tuồi. Acid fenofibrỉc được thải trừ đáng kể qua thận và nguy cơ có cảc phản ứng ngoại x'
dối với thuốc nảy có thế còn lớn hơn trên bệnh nhân suy chức năng thận. Mức biều hiện cùa acid
fenofibric không bị ảnh hướng bời lứa tuổi. Do bệnh nhân cao tuổi có tỷ lệ suy thận cao hơn, việc
chọn liều cho nguời cao tuổi phải dụa trên chức nãng thặn của họ. Không cần điều chinh liều ưên
bệnh nhân cao tuôi có chửc năng thận bình thuờng. Cần giám sảt chức năng thận trên bệnh nhân
người cao tuồi sư dụng fenofìbrat.
Suy lhận: Cần trảnh sử dụng fcnofibral trên bệnh nhân suy thận nặng. Cẩn giảm liều trên bệnh nhân
sưy thận nhẹ đển vừa phải. Cần theo dõi chức năng thận trên bệnh nhân suy thận.
Suy gan: Chưa dánh gỉả vỉệc sử dụng fenofibrat trên cảc đối lượng suy gan.
cn: định điều trị:
Tảng cholesterol mảu nguyên phát hoặc rối loạn lípíd máu hỗn họp: Fenofibrat dược chỉ định như
liệu phảp điều trị bổ sung cho chế độ ăn kiêng để giảm việc tăng Iipoproteỉn cholesterol (LDL-Cì tỷ
trọng thấp, cholesterol toản phần (Total-C), tríglycerid vả apolìpoprotein B (Apo B), vả lảm :ăng
]ipoprotcin cholesterol (HDL—C) tỷ trọng cao trên các bệnh nhản người [ớn có hiện tượng tăng
cholesterol mảu nguyên phảt hoặc rôi loạn lipid mảu hỗn hợp.
Tăng iriglycerzd mảu nghzêm lrọng Fcnofibrat được chỉ định nhu lả liệu pháp dỉều trị bổ sung cho
chế độ ãn kiêng dễ diều trị trên bệnh nhân nèười lớn có hiện tuợng tăng trìglycerid máu nghiêm
trọng. Cải thiện khả năng kiềm soát đuờng mải: trên bệnh nhân đải thảo đường cho thấy vi thề nhũ
trấp huyết ở trạng thải đói thường ngăn ngừa :: :: cầu can thiệp dược. Việc tãng đảng kế triglycerid
trong huyết thanh (ví dụ như > 2,000 m_ thề lảm tăng nguy cơ tiến triến viêm tụy Chua có
nghiên cúu đầy đủ về tảc dụng của liệu p : ' iu trị bằng fenolzbrat nhằm giảm ngưy cơ nảy
Các g:ới hạn quan t:ọng Irong sử dụng Fenofibrat với liều tương đương với l45mg fenofibrat chua
cho thắy giảm tỷ lệ măc bệnh động mạch vảnh vả tỷ lệ tu vong trong một lhử nghiệm ngẫu nhỉên cớ
kỉếm soát trên cảc bệnh nhân mắc bệnh đả: tháo đường tuýp 2.
Liều khuyến cảo & Đuờng dùng:
Khuyến cáo chung.
Bệnh nhân cân theo chế độ ăn kiêng nhằm giảm lipid lhích hợp trưởc khi sử dụng fcnofibrat, và cần
tiếp lục chế độ ãn kiêng trong, khi điều trị với fcnofibrat Sử dụng fcnof:brat không liên quan đến bũa
ăn Khởi đằu điều trị bộnh rõi loạn lỉpid mảu lả liệu phảp điều trị ăn kiêng cụ thể đối với các bắt
thường lỉpoprotein. Hiện tượng thừa cân và uống quá nhiều ruợu có thế là một yếu tố quan trọng lảm
tăng triglycerid máu và cần lưu ý trưởc khi sử dụng bất kỳ liệu phảp điểu trị bằng loại thuốc nảo. Tập
luyện thể lục cũng có thể là một biện phảp hỗ trợ quan trọng. Các bệnh lảm tăng nguy cơ lipid mảu ví
dụ như bộnh giảm chủc năng tuyến giảp hoảc đái tháo đuờng cần đuợc điều trị đầy đù. Liệu pháp
điều trị bằng cstrogen, cảc thuốc lợi tìếu thiazid và các chất chẹn beta đôi khi lỉên quan đến sự tăng
mạnh triglycerid trong huyết tương đặc bỉệt trên cảc đối tượng tăng triglycerid máu có tính chất gìa
đinh. Trong trường hợp như vậy, việc ngưng các tảc nhân nguyên nhảm bệnh cụ thế có thể ngăn ngừa
nhu câu liệu pháp điều trị tăng triglycerid mảu. Cần giảm sảt định kỳ lipid mã… và xem xét giảm lỉêu
fenohbrat nếu lipid máu giảm đáng kể xuống dưới mức giới hạn để ra. Cần ngưng điều trị trên bệnh
nhân không có dáp ứng đầy đủ sau hai tháng điều trị với liều khuyến cảo tối đa l45mg ngảy một lần
Tăng cholesterol mảu nguyên phát hoặc rối Ioạn lipid máu hỗn họp. Liều ban dầu của thuốc
icnoiìbrat lả l45mg ngảy một lẳn.
Tăng trigbzcerz'd máu nặng. Liều khởi đầu là từ 48mg đến l45mglngây. Liều tùy theo tùng cả nhân
và đảp ứng cùa bệnh nhân và cần điều chỉnh nểu thấy cằn thiết sau khi xảo định ]ipỉd một cảch định
kỳ khoảng 4 đển 8 tuần một lằn. Liều tối đa lả 145mg ngảy một lần.
Suy giảm chức năng thận: Cần bắt đầu điểu trị với thuốc viên fenofibrat với liều 48 mg/ngảy trên
bệnh nhân suy thận nhẹ đển vừa phải, và tăng lỉều sau khi đảnh giả tảc dụng trên chửc năng thận và
mức lipid tại iiều nảy Cần tránh sử dụng fenofibrat trên bệnh nhân suy thận nặng.
Bệnh nhân cao tuối. Lựa chọn liều vởi người cao tuổi cần dựa trên chức năng thận cơ bản
Chống chỉ định:
Fenofibrat chống chỉ định trên bệnh nhân
— Cảo bệnh nhân suy thận nặng bao gổm cảc bệnh nhân đang thẳm tách mảu;
- Cảc bệnh nhân măc bệnh gan bao gòm bệnh nhân mắc xơ gan ú mật nguyên phát và có chức
năng gan bất thường kẻo dải không rõ nguyên nhân;
- Các bệnh nhân măc bệnh túi mật đã có từ trước;
— Các bệnh nhân có hiện tượng quá mẫn với thuốc fenofibrat hoặc acid fenofìbric;
Phụ nữ đang cho con bủ;
- Trẻ em dưới ]0 tuồi.
Cảnh bảo đặc biệt và thận trọng:
T y lệ tử vong vả bệnh động mạch vảnh.
Chua xác định được tảo dụng của fenofìbrat trên tỷ lệ mắc bệnh và tỷ lệ từ vong cùa bệnh động mạch
vảnh và tỷ lệ tử vong cùa cảc bệnh không liên quan dến tỉm mạch. Nghiên cửu can thỉệp về khả năng
cùa fenofìbrat vả giảm nhẹ các bỉến cô do đái tháo đường (FIELD) lả một cuộc nghỉẽn cứu ngâu
nhiên, có kiếm chứng là giả dược tỉến hảnh trong 5 năm trên 9795 bệnh nhân mắc đái thảo đường
ìúyp 2 được điều trị bằng fenotìbrat. Fenofibrat chứng tỏ gỉảm khỏng đảng kế l 1% so với kểt quả ban
đẩu vế cảc biến cố cùa bệnh động mạch vảnh (tỷ lệ nguy cơ [HR] 0, 89, 95% CI 0,75-1,,05 p= 0, 16) và
giảm đảng kế 11% trên kết quả thứ hai cưa tống sô các biến cố tỉm mạch (HR 0,89 [0, 80- 0 ,99],
p= 004). Tăng khỏng đảng kế 11% (HR 1,11 [0,,95 1,29], p= —0, 18) and 19% (HR ], 19 [0, 90, I,,S7]
p= —0 ,22) ở tât cả các bỉến cố và lệ từ vong do bệnh động mạch vảnh trên cảc bệnh nhân sử dụng
fenofibrat so với dùng giả dược. Do tính tương đương về hóa học, duợc lý và lâm sảng gỉữa
fcnofibrat, clofibrat, vả gemiìbrozil, cảc tác dụng ngoại ý trong 4 nghỉên cùu thử nghiệm lâm sảng
lớn, ngẫu nhiên, có kỉếm chủng là giả dược vởí cảc loại thuốc fibrat khảo có thể ảp dụng với
fenofìbrat.
'l'rong dụ án về bệnh động mạch vảnh, một nghiên cứu lởn trên bệnh nhân sau nhồi mafu cơ tim đuợc
điếu trị trong 5 năm với clofibrat, không có sự khác nhau về tỷ lệ tử vong gỉữa nhóm diểu trị bằng
clofibrat và nhóm điều trị bằng giá dược. Tuy nhỉên, có sự khác nhau giữa tỷ V›ệnh sỏi mật và
bệnh viêm tủi mật đòi hỏi cân phẫu thuật gỉữa hai nhóm nảy (3, 0% và 1 ,.8%) TrồỔgv một nghìên cứu
do tô chức y tế thế giới (WHO) thực hiện, 5000 đối tượng măc bệnh dộng mạch vảnh điều trị bằng
giá dược hoặc clofibrat trong 5 năm và tiếp theo được đỉều trị bổ sung thêm một nảm. Các con sô
thống kê cho thấy tỷ lệ tử vong do mọi nguyên nhân đã thay đổi theo độ tuối cao hơn, trong nhóm
clof'zbrat nếu so với nhóm diều trị bằng giá dược (5,70% nêu so với 3, 96%,p = <0 ,01). Tỷ lệ tử vong
cao là do việc tăng 33% cảc nguyên nhãn khong do tim mạch, kể cả các biến chứng' ac tính, sau phẫu
ihuặt cắt bỏ túi mật và vìêm tụy. Điểu nảy khắng định nguy cơ bệnh túi mật cao hơn trong nhóm điều
trị bằng ciofibrat trong cuộc nghiên cứu ở dự an Về bệnh động mạch vảnh.
Nghiên cứu tim Helsinki lả một cuộc nghiên cứu lớn (n=4081) trên cảc nam gỉởi trung niên không có
tiền sử bệnh động mạch vảnh. Các đối tượng sử dụng hoặc giả dược hoặc gemiibrozil trong 5 nảm, vả
. Ổ L.A’J A"l
A'.
,
kéo dải thêm 3,5 năm sau đó. Tổng số tử vong cao hơn về mặt số lưọng ở nhóm gemtìbrozỉl ngẫu
nhiên nhung chưa đạt tởi mức có ý nghĩa thống kê (p= 0, 19,95% khoảng tin cậy đối với các nguy cơ
liên quan G:P= O,91-1,64). Mặc dù sô lượng tử vong do ung thư ở nhóm gemfìbrozii có xu hưởng
cao hơn (p= 0,1 1), bệnh ung thư (ngoại trừ ung thu tế bảo đáy) đă được chẩn đoản với tần suất như
nhau ở cả 2 nhóm nghiên cứu Do cỡ mẫu hạn chế cùa cuộc nghiên cứu, nguy cơ tử vong lìên quan
do bẩt kỷ nguyên nhân nảo đến không khảo nhau như dã quan sát thấy trên cảc dữ liệu theo dõi trcmg
9 năm từ nghiên cứu cùa Tổ chức y tế Thế giới (RR=l, 29).
Một nghiên cứu phòng ngừa thứ hai cùa nghiên cứu tỉm mạch Helsinki dã tuyến chọn cảc nam gỉới
trung niên đã bị loại khói nghỉên cứu phòng ngừa ban đầu do mắc bệnh hoặc nghi ngờ bệnh động
mạch vảnh. Các đối tuợng Sử dụng gemhbrozil hoặc giả duợc trong vòng 5 năm Mặc dù tử vong do
bệnh tim mạch có xu hướng cao hơn trong nhóm gemftbrozil nhưng tỷ lệ nảy không có ý nghĩa thống
kế(tỷ lệ nguy cơ 2,2, 95% khoảng tỉn cậy: 0,94-5,05). Tỷ lệ phẫu thuật tủi mật không có ý nghĩa
thông kê giữa cảc nhóm nghỉên cứu nhưng dã có xu hướng cao hơn ở nhóm gemfibrozii (1,9% so với
0,3%, p = 0,07).
Cơ xương: Fibrat lảm tăng nguy cơ bệnh cơ tim và dã có Iiên quan tới bệnh globin cơ niệu kịch phảt.
Nguy cơ xuất hiện nhìễm độc cơ nghiêm trọng tăng cao ở bệnh nhân cao tuổi và bệnh nhân mắc bệnh
đải thảo dường, suy thận hoặc gìảm chức năng tuyến giáp. Cần xem xét bệnh cơ tim trên bất kỳ bệnh
nhân nảo măc bệnh đau cơ 1an tỏa, mềm cơ hoặc yêu cơ hoặc có chỉ số creatỉnc phosphokinase (C PK)
tăng mạnh. Nến khuyên các bệnh nhân báo cáo ngay các cơn đau cơ khộng giải thỉch được, mêm cơ
hoặc yếu cơ dặc biệt có kèm theo mệt mòi hoặc sốt Cần đảnh giá chi sô CPK trên cảc bệnh nhân có
bảo cáo các triệu chứng trên vả cần ngung liệu phảp điều trị bằng thuốc fenofibrat nếu xuất hiện tãng
chỉ số CPK hoặc nghi ngờ hoặc dã chẩn đoán bệnh cơ tim/viêm cơ Các dữ lỉộu tư cảc nghiên cúu
đảnh gỉá cho thắy nguy cơ bệnh globin cơ niệu kịch phảt tăng khi Íĩbrat, đặc bìệt lả gemfibrozil sử
dụng dồng thời vởi chắt ức chế HMG- CoA reductase (statin). Cần trảnh vỉệc sử dụng kết hợp cho tới
khi lợi ích khi thay đối chỉ số lỉpid máu có khả năng nhiếu hơn nguy cơ tăng của vỉệc kết hợp thuốc
nảy.
Chửc năng gan: Fenofibrat với cảc 1ỉếu tuơng đương 96mg đến 145mg fenofibrat/ngảy liệu quạn dến
việc tãng transaminases trong huyết thanh [AST (SGỌT) hoặc AI T (SGPT)J. Trong quần thể được
phân tích từ 10 cuộc thử nghiệm trên giả dược có kiềm chứng, tăng >3 Iẳn mức giới hạn trên bình
thường xảy ra trên 5. 3% bệnh nhân sử dụng thuốc fenofibrat so vởi 1,1% bệnh nhân diều trị bằng giá
dược. Khi tiếp tục đảnh giả transaminase sau khi ngưng điều trị hoặc trong khi tiểp tục điều trị, dã
quan sảt thắy chỉ số đã trở về giởì hạn bình thường. Tỷ lệ tãng transaminases có Iiên quan đến liệu
pháp fenofibrat dường như liên quan tới liều. Trong một nghiên cứu khoảng liều trOng vòng 8 tuần, tỷ
lệ tăng ALT hoặc AS ]“ ít nhất gâp 4 lần mửc giới hạnt1èn binh thường là 13% cảc bệnh nhân sử dụng
liều tương đương với 96mg dến 145mg fenòfibrat hảng ngảy và 0% trong số cảc bệnh nhân sử dụng
liều tương duong hoặc thấp hơn 4Smg fenofĩiọrat hảng ngây '1oặc sử dụng giá dư.ợc Đã có bảo cáo về
hiện tuợng viêm tế bảo gan mãn tính và viê gan ứ mật đi kèm với việc sử dụng liệu pháp điếu trị
bằng thuốc fenofibrat sau khi có biểu hiện từ \" 1 tuần đến vải năm. Trong các trường hợp hiểm gặp,
đã có báo cảo về bệnh xơ gan đi kèm vởỉ EẸũhỉcơ gan mãn tính. Cần thực hiện vỉệc giảm sảt thường
xuyên và theo dõi định kỳ chức nãng gan kê cá ALT (SGPT) trong huyết thanh trong khi sử dụng liệu
phảp diều trị bằng fenofibrat, và ngưng sử dụng lỉệu phảp điều trị nêu mức enzym vẫn ở trên múc
giới hạn bình thuờng ba lẩn
(` reau'nin trong huyết thanh: Đã có báo cáo về việc tăng creatinin trong huyết thanh trên bệnh nhân
sử dụng fenoiìbrat. Sau khi ngưng fenohbrat, các chi sô nảy có dấu hiệu trở lại chỉ số ở giai đoạn cơ
bản. Chưa rõ ý nghĩa 1ãm sảng vê cảc phảt hiện nảy. Cần theo dõi chức năng thận trên cảc bệnh nhân
suy thận sử dụng fenoũbrat. Cũng cần theo dõi chức năng thặn trên bệnh nhân sử dụng fenofìbrat có
nguy cơ suy thận ví dụ như bệnh nhân cao tuổi và bệnh nhân mắc bệnh đải tháo dươn g
Sói mật: Fenofibrat, cũng giống như clofibrat vả gemfibrozil, có thế [ảm tăng vìệc thải trừ cholesterol
trong túi mật dẫn tới bệnh sòi mật Nếu nghi ngờ sòi mật, cẩn chỉ định cảc nghiên cứu tùỉ mật. Cẩn
ngưng liệu phảp điều trị sử dụng thuốc fenofibrat nếu tìm thấy sòi mật.
Thuốc chống đông Coumarz'n: Cần sử dụng thận trọng khi sử dụng thuốc chống đông coumarin kết
hợp với fenofibrat do tiềm năng tác dụng chống đông dạng coumarin trong việc kéo dải thời gian
prothrombin/ tỷ lệ binh thường hóa quôc tế (PT/INR). Nhằm hạn chế biến chứng chảy máu, cần theo
dõi thường xuyên chi sô PTJlNR và khuyến cảo điều chỉnh liếu thuốc Chống đông cho tới khi chỉ số
PTJINR on dịnh.
Viêm zụy. Đã có bảo cáo hiện tượng viêm tuy trên cảc bệnh nhân sử dụng fenoiibrat, gemfibrozil, vặ
cloíibrat. Nếu hiện tượng nảy xảy ra, có nghĩa là thuốc không có hiệu quả trên bệnh nhân có chỉ số
tăng triglycerid mảu nặng do tảo dụng trực tiếp của thuốc hoặc hiện tượng thứ hai của thuốc qua hiện
tượng sòi mật hoặc hình thảnh bùn lảm tắc túi mật. `
Các lhay đói huyếl học. Đã có ghi nhận thấy chỉ số hemoglobin, hematocrit, và tế bảo bạch câu giảm
ở mức nhẹ đến vừa phải trên bệnh nhân bắt đầu sử dụng liệu pháp điếu trị bằng fenofibrat. Tuy nhiên,
cảc chỉ số nảy ốn định khi sử dụng thuốc lâu dải. Đã có bảo cáo về hiện tượng giảm tiếu câu và mắt
bạch cằu hạt trên cảc bệnh nhân điếu trị bằng fenofibrat. Khuyến cảo theo dõi định kỳ tế bảo hồng
cằu vả bạch cầu trong 12 thảng đẩu tiên sư dụng fenofibrat.
Phản ứng quá mân: Đã có bảo các về hiện tượng quá mẫn cắp tính ví dụ như hội chứng Stevens-
Johnson và nhiễm độc hoại tử biếu bì đòi hòỉ bệnh nhân cẳn phải nhập viện vả điếu trị bằng steroids
trên các bệnh nhân điếu trị bằng fenofibrat Ghi nhận bệnh mảy đay trên 1,1 so với 0%, và nối ban ở
da trên 1,4% so với 0,8% bệnh nhân sử dụng fenofibrat vả giả dược trong các cuộc thử nghỉệm có
kiềm chứng.
Bệnh tắc mạch do huyết khối. Trong thử nghiệm F IELD đã ghi nhận thắy tỷ lệ mắc bệnh nghẽn
mạch phổi (PE) và huyết khối tĩnh mạch sâu (DVT) cao hơn ở bệnh nhân sử dụng thuốc fenofibrat
nếu so vởi nhóm điếu trị bằng giả dược. Trong số 9. 795 bệnh nhân thu nhận trong cuộc nghiên cứu
FIEI D, có 4. 900 bệnh nhân ở nhóm giả duợc và 4. 895 bệnh nhân ở nhóm fenofibrat. Đối với bệnh
nhãn mắc bệnh huyết khối tỉnh mạch sâu DVT, 48 bệnh nhân có hỉện tượng (1%) trong nhóm giả
duoc vả 67 (1, 3%) trong nhóm fenoiibrat (p =0 ,;074) và đối Với bệnh nhân măc bệnh nghẽn mạch
huyết khối PE, 32 bệnh nhân (0,7%) mắc trong nhóm gỉả dược và 53 (1,1%) trong nhóm fenofibrat
(p= 0 ,.022) Trong dự an thuốc điều trị bệnh động mạch vảnh, bệnh nhân trong nhóm clofibrat có tỷ
lệ tử vong chắc chắn hoặc nghi ngờ hoặc mắc bệnh phổi hoặc viêm tĩnh mạch huyết khối không gãy
tư vong cao hơn so với nhóm giả dược (5, 2% so với 3, 3% sau 5 năm; p < 0,01).
1 uong tảc thuốc:
Các nghiên cửu trong ống nghiệm sử dụng các tiếu thế gan ở người cho thấy fenofibrat vả acid
fenofibric không phải là các chẳt úc chế của "cytochrờm (CYP) P450 đồng phân CYP3A4, CYP2D6,
CYP2E], hoặc CYPIAZ. Chúng lá các chẳt ưc chế yếu cùa CYP2CS, CYP2C19 vả CYP2A6, và chất
ức chế nhẹ đến vừa phải của CYP2C9 ở nống độ điều trị.
Dùng kết hợp cảc thuốc ức chế HMG CoA reductase (ví dụ pravastatin, simbastatìh, fiuvastatin) vả
fibrat sẽ lảm tăng đáng kể nguy cơ tồn thương cơ và viêm cơ. Kết hợp fibrat với ciơiosporin lảm tăng
nguy cơ tồn thương cơ Fenofibrat 1ảm tăng tảo dụng cùa cảc thuốc uống chổ vỏng và do đó lảm
tảng nguy cơ xuất huyết do đẩy các thuốc nảy ra khỏi vị trí gắn với protein huyếj tương Cần theo dõi
Iuợng prothrombin thường xuyên hơn và điếu chinh liều thuốc uống ohốn gđông trong suốt thời gian
điều trị bằng fenofibrat và sau khi ngừng thuốc 8 ngảy.
Tác dụng không mong muốn:
Cảo tác dụng không mong muốn phổ biến nhẩt 1ảtiếu chảy, chuột rút (VỌp bè) ở cơ, mệt mỏi, nôn vả
buồn nôn. Mất ngù, đau bụng, đau lưng, nhức đầu, các xét nghiệm chúc nãng gan bắt thường, tăng
ALT, tăng CPK, tãng AST, rôỉ loạn hô hấp. viêm mủỉ cũng đã được bảo cảo.
Cảo tảo dụng không mong muốn sau đã phát hiện sau khi việc sử dụng thuốc fenofibrat được phê
chuẩn: đau cơ, globin cơ niệu kịch phảt, viêm tụy, suy thận cẩp tính, co thắt cơ, xơ gan, viếm gan,
thiếu máu, đau khớp, gỉảm hồng cẩu, giảm tích huyết cầu, giảm tế bảo bạch cẳu và suy nhược thần
kình Do các phản ứng trên được báo cảo một cách tự nguyện, từ cảc quần thể với kích cỡ không xác
định, không thể dự đoản chính xác tẳn số xảy ra hoặc xảo định mối liên hệ tương quan với mức biếu
hiện cùa thuốc
Mang thai:
Chưa xác dịnh dược độ an toản trên phụ nữ mang thai Chưa có nghiên cứu đầy dù về fenoiibrat trên
phụ nữ mang thai. Nếu cần sử dụng thuốc fenofibrat trong thời kỳ mang thai chỉ khi lợi ích tiềm năng
nhiếu hơn với cảc n guy cơ tiềm nãng với bảo thai.
Cho con bú: Phụ nữ cho con bú không được sử dụng fenofibrat. Cần quyết định xem có nên ngưng
cho con bú bằng sữa mẹ hoặc ngưng sử dụng thuốc khi tinh tới tầm quan trọng của thuốc đối với
người mẹ.
Ẩnh hưởng của thuốc đến khả nãng lái xe và vận hảnh máy mỏc:
Dựa trên đặc tính cùa thuốc finofibrat không ảnh hưởng đến khả năng lải xe hay vận hảnh mảy móc
Quá liều:
Hiện chưa có việc điều trị đặc thù đối với quả 1iếu fenofibrat. Chỉ định các biện phảp hỗ trợ chăm sóc
toản thân bao gồm theo dõi các dấu hiệu sinh tồn và quan sảt tình trạng trên 1âm sảng nếu hiện tuọng
quá Iiếu xảy ra. Nếu được chỉ định, vỉệc thải trừ các thuốc chưa hấp thụ có thế thục hỉện bằng việc
gây nôn hoặc rứa dạ dảy; giám sát cảc biện pháp phòng ngừa thường xuyên để duy trì dưòng thở. Do
acid fenofibric gắn kết mạ h vởi protein trong huyết tương, nên thấm tảch máu không được tinh đến.
Hạn dùng: 24 thạlẵ` e t ngảy sản xuất. Không dùng thuốc sau ngảy hết hạn được ghi trên bao bi.
Bão quăn: BảOỄỄ c ở nhiệt độ dưới 300C, tránh ảm. Đế thuốc xa tầm tay trẻ em.
Đỏng gói:W vi x 10 viên.
Tiêu chuẩn thânh phẩm: Tiêu chuẩn nhà sản xuất.
Tên và địa chỉ nhà sản xuất: Hetero Labs Limited, Unit-ill, 22-110, 1DA, Jeedimetla, Hyderabad —
500 055, Andhra Pradesh, Án-độ.
TUQ. cục TRUỜNG
P.TRUỜNG PHÒNG
-.Ảỷưấễ% Jẳlấ cijẩìớ'lỵ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng