














mms:
WTURE:ISOLPI vosmonsm
%. mmwsou: COOEWEL
_ogze
65 x 33 x 95 mm Febunc 80 mg 30 tablets , . . ,
' lilb J 'n
~ ' ’ Q ỵ’x
~ … … zo
BO Y TE …- ao
CL'C OUAN LÝ DUơC
ĐA PHE DL'YẸT
.. . 1 7 -12— mm
Lan dảuz... ..... J/
. . ã
Rx Prescnptnon drug Ê TI
g m
; F'eburíc" ° :—
: 80 m = _
. 9 2. _
fllm—coated tablets ". =
3.3
febuxostat 80mg gì
.5
Ì,-² Jx'it'iids
Box of 3 blisters x 10 film—coated tablets
Sản xult bởi: Patheon France. 40 Boulevard de
Champaret, 38300 Bourgoin Jallieu, France.
Dóng gói bởi: Interthaí Pharmaceutìcal
Manufacturing Ltd., 1899 Phaholyothin Road,
Ladyao, Chatuchak, Bangkok 10900, Thailand.
Nhập khãu bởi: VIMEDtMEX BÌNH oưcme, số 18 Resistered trademark ot
u—z VSIP u, Đường số 3, KCN Viêt Nam . Teìjìn Limited.
Singapore 2, Thủ Dầu Mỏt. Tinh Binh Dương Tokyo. Japan
s ả ã
Ề e ã ẳ
? ỉ ỉ ` … .
ả s= ề Rx Thuoc ban theo đơn
.>.< Ẹ 0
2 G F b ’
- , e unc 80mg
_ a .
—— Vien nén bao phim
febuxostat 80mg
ỹdxlưiids
Hộp 3 vi x 10 viên nén bao phim
Thènh phần: Mõi viên nén bao phim chửa 80 mg febuxostat
Chl đinh, chõng dii định, liều dùng, ca'ch dùng,
thận trọng vì cát: thóng tin khác: xin đọc trong từ
hướng dẫn sử dung kèm theo.
Đế xa tầm tay trẻ em. Dọc kỷ hưởng dẩn sử dụng trưởc khi dùng.
BảD quản dưới 30°C SĐKZ XX-XXXX-XX
Blister label
/
\
ỉ
xMtcl lan ẵ ’.nxrlLu
FEBURIC' 90mg ã; FEBURIC' 80mg
Febuxostat 80mg ễr Febumstat 80mg
xa 6 mg/dL (357 ụmol/I-) sau 2-4 tuần, có thể xem xét
dùng liều 120 mg, ] lầnlngảy.
FEBURIC tác dụng đủ nhanh để cho phép xét nghiệm iại nồng độ acid uric huyết thanh sau
2 tuần. Mục tiêu điều trị lả lảm giảm vả duy trì nồng độ acid uric huyết thanh dưới 6 mg/dL
(357 ụmol/L).
Khuyến cảo nên điều trị dự phòng đợt bùng phảt bệnh gút trong ít nhất 6 thảng (xem phần
4.4).
Người cao tuốt“
Không cân thiêt điêu chỉnh liêu ở người cao tuồỉ (xem phẳn 5.2).
Suy thận
Hiệu quả và độ an toản chưa đuợc đánh giá dầy đủ ở bệnh nhân suy thận nặng (độ thanh thải
creatinin < 30 mL/phủt, xem phần 5.2). Vì vậy, cần thặn trọng khi dùng thuốc ở những bệnh
nhãn nảy.
Không cần thiết điếu chính liễu ở bệnh nhãn suy thận nhẹ hoặc trung bình.
Suy gan
Hiệu quả vả độ an toản của FEBURIC chưa được nghiên cứu ở bệnh nhân suy gan nặng
(Chìld Pugh loại C).
Liếu khuyến Cảo ở bệnh nhân suy gan nhẹ là 80 mg. Thông tin hiện có còn hạn chế ở bệnh
nhân suy gan trung binh.
Nhóm bệnh nhân trẻ em
Độ an toản và hiệu quả của FEBURIC ở trẻ em dưới 18 tuôi chưa được xảo định. Hiện chưa
có dữ lỉệu.
Cảch dùna '
Dùng đưòng uông. `
Nên uõng FEBURIC băng miệng và có thề uõng cùng hoặc không cùng với thức ăn.
4.3 Chổng chỉ định
Qưả mẫn với hoạt chẳt hoặc vởi bất kỳ tá dược nảo dược liệt kê trong phần 6.1 (xem thêm
phân 4.8).
4.4 Cãnh báo và thận trọng dặc biệt khi sử dụng
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hỏi ý kiến bảc sĩ.
Thuốc nây chỉ dùng theo đơn của bác sĩ.
Rối loạn tim mạch
Không khuyến cáo điều trị bằng febuxostat ở những bệnh nhân bị bệnh tim thiểu mảu cục bộ
hoặc suy tim sung huyết.
Đã quan sát thấy một tỷ lệ iởn hơn về mặt số iượng các biển cố tim mạch theo APTC được
bảo cảo bời nhà nghiên cứu (cảc tiêu chí dược xác định bởi nhóm cộng tác thử nghiệm chống
tiếu cầu (APTC) bao gồm tử vong tim mạch, nhồi mảư cơ tim không gây tử vong, đột quỵ
không gây từ vong) trong tổng số nhóm dùng febuxostat so với nhóm dùng alopurinol ở các
nghiên cứu APEX vả FACT (] 3 biến cố/lOO bệnh nhân- năm (PYs) so với 0,3 bỉến cố/IOỌ
bệnh nhân- -năm), nhưng không quan sát thấy trong nghìên cứu CONFIRMS (xermphần 5.1 về
đặc diếm chi tiết của nghỉên cứu) Tỷ lệ cảc biễn eô tim mạch theo APTC t 0 ảc nghiên
cứu pha 3 kểt hợp được bảo cảo bời nhà nghiên cứu (cảc nghiên cứu APE ACT vả
CONFIRMS) lả 0, 7 biến cổ/IOO bệnh nhân- -năm so với 0 6 biến co/ 100 bệnh gn`hăn- năm.
Trong cảc nghiên cửu mở rộng dải hạn, tỷ lệ eác biến cổ theo APTC được báo cảo bởi nhà
nghiên cứu iâ 1,2 biến co] 100 bệnh nhân- -năm dối với febuxostat vả 0, 6 biến cố/IOO bệnh
nhân- -năm đồi với aiopurinol. Không tìm thấy sự khác biệt có ý nghĩa thống kê vả không có
mồi quan hệ nhân quả nảo với febuxostat được xảo lập. Cảo yêu tố nguy cơ được xác định ở
những bệnh nhân nảy là tiền sử y khoa về bệnh xơ vữa dộng mạch vâ/hoặc nhồi mảư cơ tim
hoặc suy tim sung huyết.
Dị ứng / quá mẫn vớz Ihuốc
Cảo bảo cảo hiếm gặp về phản ứng dị ửng/quá mẫn nghiêm trỌng, bao gồm hội chửng
Stevens-Johnson, hoại tủ thuợng bì nhiễm độc và phản ứng phản vệ/sốc cẳp tính đe dọa tính
mạng, đã được thu thập trong kinh nghiệm hậu mãi. Trong hầu hết truờng hợp, các phản ứng
trên xảy ra trong tháng đầu tiên diều trị bằng febuxostat. Một số nhưng không phái tắt cả các
bệnh nhân nảy đã bảo cáo về suy thận vảfhoặc quả mẫn trước đó vởi alopurinol. Phản úng
quá mẫn nặng, bao gồm phản úng thuốc có kèm tãng bạch cẩu ưa acid vả cảc triệu chứng
toản thân (hội chứng DRESS) có iiẽn quan vởi sốt, huyết học, thận hoặc gan trong một sô
trường họp.
Phải thông bảo cho bệnh nhân về cảc dấu hiệu và triệu chứng và cần theo dõi chặt chẽ cảc
triệu chúng cùa phản ứng dị ửng/quá mẫn (xem phần 4. 8). Phải ngừng diều trị bằng
fcbuxostat ngay lặp tửc nếu xảy ra phản úng dị ửng/quả mẫn nghiêm trỌng, bao gồm hội
chửng Stevens- Johnson, vỉ vỉệc ngừng thuốc sóm liên quan với một tiên lượng tổt hơn. Nếu
bệnh nhân xuất hiện phản úng dị ứnglquá mẫn bao gổm hội chứng Stevens- Johnson và phản
ứng vả phản vệ/sốc cấp tính, không được bắt đầu sử dụng lại FEBURIC ở bệnh nhân nảy bẩt
cứ lúc nâo.
(Cơn gút cấp tính _(đợt bùng phát bệnh gút)
Cơn gút cốp tính (đợt bùng phát bệnh gút)
Không nên bắt đẫu đĩều trị bằng fcbuxoslat cho đến khi con gủt cẩp tính đã giảm xuống hoản
toản. Cảo đợt bùng phảt bệnh gút có thể xảy ra trong thời gian bắt đằu điều trị do sự thay đổi
nồng độ acid uric huyễt thanh dẫn đến huy động urat tù sự lắng đọng ớ cảc mô (xem phần 4.8
vả 5.1). Lủc bắt đầu điều trị bằng tcbuxostat, khuyến cáo nên điểu trị dự phòng các đợt bùng
phát bằng thuốc chống viêm không steroid (NSAID) hoặc colchicin trong ít nhắt 6 thảng
(xem phần 4. 2).
the urinary excretion, approximately 45% of the dose was recoveer … the facccs as the
g thuốc. Nên xử trí đợt bùng phát bệnh gút đồng thời một cách thích hợp đối với từng bệnh
nhân. Việc điều trị liên tục bằng febuxostat iảm giảm tần suất và cường độ cùa các đọt bùng
phát bệnh gủt.
Lắng đọng xanihin
Ở những bệnh nhân có tỷ lệ hình thảnh urat tăng cao (ví dụ bộnh ảo tính và điều trị của nó,
hội chứng Lesch-Nyhan), trong những trường hợp hiếm gặp, nồng độ tuyệt đối cùa xanthin
trong nước tỉểu có thể tăng đủ dễ cho phép sự lắng đọng trong đường tiết niệu Do chưa có
kỉnh nghỉệm vởi febuxostat, khỏng khuyến cáo sử dụng febuxostat ở nhóm bệnh nhân nảy
Mercaptopurirv'azathìoprin
Không khuyến cảo sử dụng FEBURIC ở những bệnh nhân dược điều trị đổng thời bằng
mercaptopurinlazathioprin. T rong truờng hợp không thể tránh được sụ phối hợp nây, cần theo
dõi bệnh nhân chặt chẽ. Khuyến cáo giảm lỉều mercaptopurin hoặc azathioprin để tránh
những tảo dụng về huyết học có thế có (xem phần 4. 5).
Bệnh nhân được ghẻp lạng ' \ K .
Do chưa có kinh nghỉệm ớ bệnh`nhân được ghép tạng, không khuyên cáo sử dụng PẸỀ—J RIC
ở những bệnh nhân nảy (xem phân 5.1). \
Theophylin
Sử dụng đồng thời Febuxostat 80mg và liều đơn theophyliine 400n1g cho đối tượng khòe
mạnh không cho thấy bất kỳ sự tương tác nảo vẻ mặt dược động học (xem mục 4. 5)
Febuxostat 80mg có thể sử dụng cho nhưng bệnh nhân đuợc điều trị đồng thòi với
theophylline mả không có nguy cơ lảm tăng nông dộ huyêt thanh của theophylline. Không có
đữ [ỉệu nghiên cứu cho febuxostat 120mg.
AWI
Rối loạn gan
Tlong các nghiên cứu lâm sảng pha 3 lcết hợp, đã quan sảt thẳy bất thuờng về xét nghiệm
chức năng gan nhẹ ở những bệnh nhân dược đỉểu trị bằng febuxostat (5%). Khuyến cáo xét
nghiệm chức năng gan trước khi bắt đầu điều trị bằng febuxostat và định kỳ sau dó dựa trên
đảnh giá lâm sảng (xem phần 5.1).
Rối loạn Iuyến gỉáp
Dã quan sát thấy tãng cảc trị số hormon kích thích tuyến giảp ('I`SH (> S, 5 ụIU/mL) ở những
bộnh nhân điều trị lâu dải bằng fcbuxostat (S, 5%) trong các nghiên cứu mở rộng nhãn mở dải
hạn Cần thặn trọng khi sử dụng febuxostat ở bệnh nhân có thay đối chức năng tuyến giáp
(xem phẩn 5.1)
Lactose
Viên nén FEBURIC có chửa lạctose. Những bệnh nhân có cảc vấn để di truyền hiếm gặp về
không dung nạp galactosc, thiêu hụt Lapp lactase hoặc kém hâp thu glucose-galactose không
nên dùng thuốc nảy.
4.5 Tương tác vói các thuốc khảc và các dạng tương tác khác
MercapIOpurin/azalhioprin
Trên cơ sở co chế tác dụng cùa fcbuxostat đối vói sự ức chế xanthin oxidase (XO), không
khuyến cáo sử dụng đồng thời. Sự ức chế xanthin oxidase bởi febuxostat có thể lảm tăng
nông độ của các thuốc nây trong huyết tương, dẫn đến độc tính (xem phần 4. 4). Cảo nghiên
củu về tương tác thuốc giữa febuxostat vởi các thuốc được chuyến hóa bới xanthin oxidase
chưa dược thực hiện.
Cảo nghiên cứu về tuơng tác thuốc gỉữa febuxostat và hóa trị liệu gây độc tế bâo chưa đuợc
tiến hảnh Chưa có dữ liệu về độ an toản của febuxostat trong đỉều trị gây dộc tế bảo.
Rosigiitazon vả cơ chất CYP2C8
Fcbuxostat được thấy là chẳt ức chế yểu cùa trên in vitro. Trong một nghien cứu trên đổi tượng khỏe
mạnh, dùng đồng thời 120 mg febuxostat QD với uống một lỉều dơn 4mg rosigiitazone không có ảnh
hướng nảo trên dược động học của rosiglitazone và chất chuyến hớa mctabolite N-desmcthyl
rosiglitazon điều nảy chi ra rằng fcbuxostat không phải là chất ức chế enzy mc CYP2C8 trẻn in vivo.
Bởi vậy, sử dụng đồng thời fcbuxostat vởi rosigiitazone vả các cơ chẳt CYP2C8 được cho lá không
cần phải đỉều chinh iiều cho những chế phầm nảy.
Theophylin
Một nghiên cứu về tương tảc thuốc thực hiện trên những ngưòi khòe mạnh dùng febuxostat
để đánh giả xem liệu sự ức chế XO có thể gây ra sư tăng nông độ theophylline trong tuần
hoản hay không như các chẩt úc chế XO khác đã được báo cáo trước đây. Kết quả nghiên cúu
cho thấy răng dùng đồng thời febuxostat 80mg QD cùng với liều đon theophylline 400mg
không gây ảnh huớng đến dược động học hoặc tính an toản cùa theophylline. Bời vậy, không
có thận trọng đặc biệt nảo đuợc đưa ra khi dùng đồng thời febuxostat 80mg vả theophylline.
Không có dữ liệu cho febuxostat 120mg.
Naproxen và các chất ức chế sự glucaronid hóa khác
Sự chuyến hóa cùa febuxostat phụ thuộc vảo enzym Uridine Glucuronosyl transfcrasc
(UGT) Các thuốc ức chế sụ glucuronid hóa như thuốc chống viêm không steroid (NSt )
vả probenecid, trên lý thuyết có thể ảnh huờng đến sự thải trừ tebuxostat. Ở các đ' J|.
khỏe mạnh, sử dụng dồng thời febuxostat vả naproxcn 250 mg, 2 ]ần/ngảy có liên quan vớ_ijsự
tăng mức tiếp xúc với tebuxostat (nồng độ tối đa trong huyết tưong (Cmax) 28 Ấ), diện tích
dưới đuờng cong nồng dộ trong huyết tương theo thời gian (AUC) 41% và thòi gian bán thải
(tưa 26%). Trong các nghiên cứu lâm sâng, việc sử dụng naproxcn hoặc các thuốc úc chế
NSAiD/Cox- 2 khảc không liên quan với bắt kỳ sự tảng nảo vẽ các phản ứng phụ có ý nghỉa
lâm sảng.
Febuxostat có thế được sử dụng đồng thời với naproxen mả không cẩn điều chỉnh liều
febuxostat hoặc naproxen.
Thuốc gây cảm ửng sự glucuronic! hóa
Các thuốc gây cảm ứng mạnh enzym UGT có thể dẫn đến tăng chuyến hóa và gỉảm hiệu quả
cùa fcbuxostat. Vì vậy khuyến cảo nên theo dõi nồng độ acid uric huyết thanh 1- 2 tuần sau
khi bắt đẩu điều trị bằng một thuốc gây cảm ứng mạnh sự glucuronid hóa. Ngược lại, việc
ngừng điều trị bằng một thuốc gây cảm ứng có thể dẫn đến tãng nông độ của febuxostat trong
huyết tương.
Colchicin/indomethacin/hydroclorolhiazidhvarfarin
Fcbuxostat có thể đuợc sử dụng đồng thời vởi coichicin hoặc indomethacin mã không cần
điếu chỉnh lỉều febuxostat hoặc hoạt chẳt dùng kết hợp
Không cần thiết điều chỉnh liếư febuxostat khi dùng với hydroclorothiazid
Không cần thiểt điều chỉnh iiều warfarin khi dùng vởi febuxostat. Việc sử dụng febuxostat
(80 mg hoặc 120 mg, ! lầnlngảy) với warfarin không ảnh hưởng đến dược động hợc của
warfarin ở các đôi tượng khỏe mạnh. Chỉ số chuẩn hóa quốc tế (INR) vả hoạt tính yểu tố VII
cũng không bị ảnh hưởng bới việc dùng dồng thời vởi febuxostat.
Deszpramín/cơ chất C YP2DỐ
I cbuxostat đã cho thấy là một chất ức chế yếu CYP2D6 in vitro Trong một nghiên cứu ở các
đối tưọng khỏe mạnh, febuxostat 120 mg, ] iần/ngảy (QD) dẫn đến tãng trung bình 22% về
AUC cùa desipramin- một cơ chẳt của CYPZDÓ cho thắy tác đụng ức chế yêu có thể có cùa
i`ebuxostat trên enzym CYP2D6 in vívo. Vì vậy, việc dùng đồng thời febuxostat với các cơ
chất cùa CYP2Dó khác không được cho lả sẽ cân bắt kỳ sự điếu chinh liếư nảo đối với những
hợp chất nảy.
Thuốc kháng acid
Việc uống đồng thòi với thuốc kháng acid chứa magnesi hyđroxỉd vả. hydroxid nhôm đã được
chưng minh là lảm chậm sự hấp thu cùa febuxostat (khoảng ] giờ) và lảm giảm C.… 32%
nhưng không quan sảt thấy sự thay đồi có ý nghĩa về AUC. Vì vậy, febuxostat có thể được ,
dùng không liên quan đến việc sư dụng thuốc kháng acid.
4.6 Khả năng sinh sản, phụ nữ có thai và cho con bú
Phụ nư có thai
Dữ liệu trên một số lượng rất hạn chế cảc phụ nữ mang thai sử dụng febuxostat đã không cho
thấy bất kỳ tác dụng bất lợi nảo cùa febuxostat đối vói sự mang thai hoặc đối với sức khỏe
của thai/trẻ sơ sinh. Các nghiên cứu trên động vặt không cho thẳy tác dụng có hại trục tiếp
hoặc giản tiếp đến việc mang thai, sự phát triền của phôi/thai hoặc sự sỉnh đẻ (xem phần 5 3).
Chưa rõ cảc nguy cơ có thể xảy ra đối vởi người. Không nên sử dụng fcbuxostat trong thời kỳ
mang thai.
Phụ mt cho con bu \
Chưa rõ liệu febuxostat có được bải tiết vảo sữa mẹ hay không Cảc nghiên cứu tr8hỀ'ngyật
đã cho thấy sự bải tiết của hoạt chắt nảy vảo sữa mẹ và giảm sự phảt triến của con v ' me
Khỏng thể loại trừ nguy cơ đối vởi trẻ bú mẹ. Không nên sử dụng febuxostat trong khi cho
con bú
Khả năng sinh sản
Ở động vật, các nghiên củu về sinh sản lên đến 48 mglkglngảy cho thấy không có tác dụng
bất lợi nâo phụ thuộc iiều đối với khả năng sinh sản (xem phần 5 3). Chưa rõ ảnh huòng cùa
febuxostat đến khả nãng sinh sản ở người.
4.7 Tảc động trên khả năng lải xe và vận hảnh mảy mỏc
Buồn ngù, chớng mặt, dị cảm và nhin mờ dã đuợc bảo cáo với việc sử dụng febuxostat Bệnh
nhân cân thận trọng truớc khi 1ải xe, vận hảnh máy móc hoặc tham gia vâo cảc hoạt động
nguy hiềm cho đến khi họ chắc chắn một cách họp lý rằng FEBURIC không ảnh hướng bất
iợi đến hiệu nảng hoạt động
4.8 Tác dụng không mong muốn
Tóm tẳt về hồ sơ an roản
Cảo phản ứng phụ được báo cáo thường gập nhất trong cảc thử nghiệm lãm sảng (4. 072 đối
tưỌng được điều trị ít nhất lả với liếư từ 10 mg đến 300 mg) vả trong` kinh nghiệm hậu mãi 1ả
cảc đợt bùng phảt bệnh gủt, bất thuờng chức năng gan, tiêu chảy, buồn nôn, nhức đầu, ban và
phù. Những phản ứng phụ nảy hầu hết có mức độ nhẹ hoặc trung bình. Các phản ứng quá
mẫn nghìêm trọng hiếm gặp với febuxostat, một số phản ứng có iiên quan vởi triệu chửng
toản thân đã xảy ra trong kinh nghiệm hậu mãi.
Báng liệt kê cảc phản ứng phụ
Các phản ứng phụ thường gặp (> 1/100 đến < 1l10), ít gặp (> 1fl. 000 đến < 1/100) vả hỉếm
gặp (2 1/1 0. 000 đến < 1/1. 000) xảy ra ở bệnh nhân đỉều trị bằng febuxostat được iiệt kê dưới
đây
Trong mỗi nhóm tần suất, các phản ứng phụ được trinh bảy theo thứ tự mưc độ nghiêm trọng
giảm dân.
Báng I: Phán ứng phụ lrong các nghiên cửu mở rộng, dòi hạn, pha 3 kết họp và trong kinh
nghiệm hậu mãi
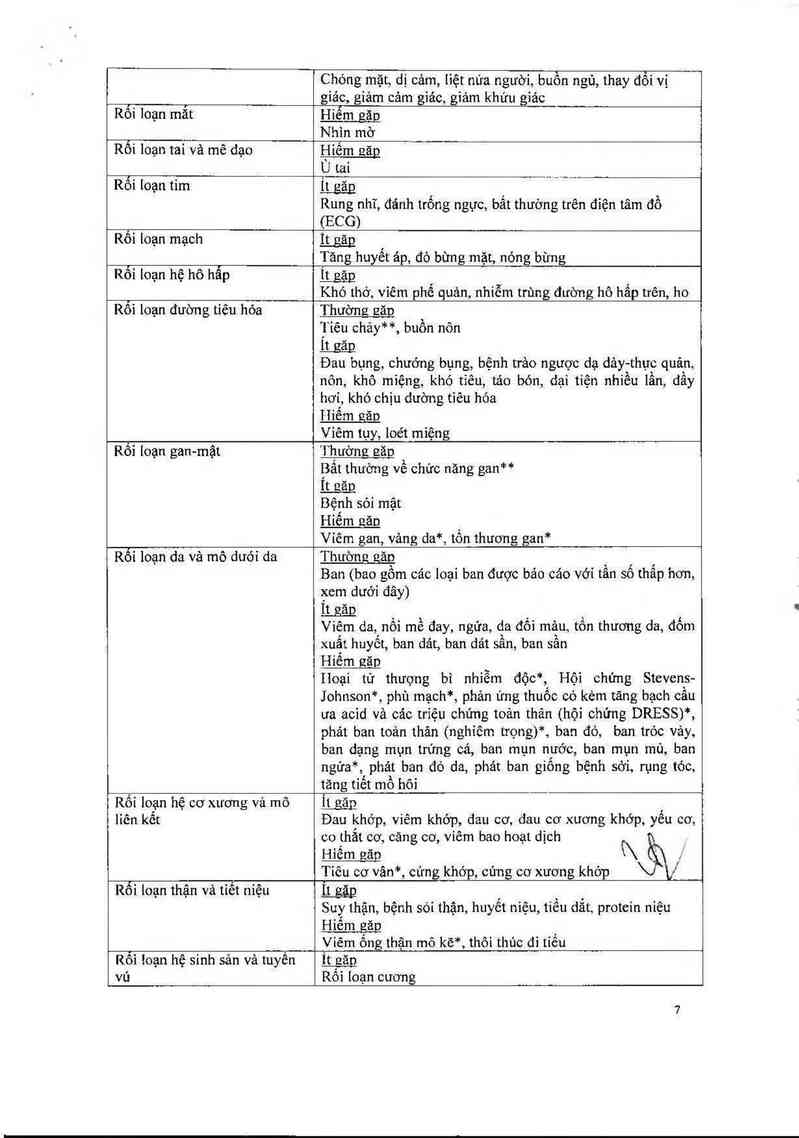
Rối loạn mảư vả hệ bạch huyết Hỉếm găg ' , ` . `
Gỉảm toản thê huyêt câu, giảm tiêu câu
Rối loạn hệ miễn dịch Hiểm găo ,
Phản ửng phản vệ*, quá mẫn với thuôc*
Rối loạn nội tiêt n găn
Tăng hormon kích thích tuyến giáp trong mảư
Rỗi ioạn chuyến hóa và dinh Thường eăn***
dưỡng Đọt bùng phát bệnh gút
It gag _ `-
Bộnh đái tháo đuờng, tăng lipid huyết, giảm sự ng ỀYệgyg,
tăng cân ,
1-Iiếm găn
Giảm cản, tăng sự ngon miệng, chán ãn
Rối loạn tâm thần Íịgặg
Gỉảm dục năng, mất ngủ
Bồn chồn
Rôi loạn hệ thẫn kinh Thường izãq
Nhức đầu
it găg
Chỏng mặt, dị cảm, liệt nứa người, buồn ngú, thay đối vị
giảc, giảm cảm giác, giảm khứu giác
Rối ioạn mắt Hiếm găn
Nhin mờ
Rối loạn tai và mê dạo Hiếm eăg
Ù tai _
Rối loạn tim Ít găg ỷ
Rung nhĩ, đánh trống ngực, bất thường trên điện tâm đồ
(ECG)
Rối loạn mạch Ít gãg
Tăng hưyết ảp, đỏ bừng mặt, nóng bừng
Rối loạn hệ hô hẫp Ít găp
Khó thở, vỉêm phế quản, nhiễm trùng đưòng hô hắp trên, ho
Rối loạn đường tiêu hỏa
Thường EăD
Tiêu chảy**, buồn nôn
Ít gap
Đau bụng, chướng bụng, bệnh trảo ngược dạ dảy-thục quản,
nôn, khô miệng, khó tỉêu, táo bón, dại tiện nhiều lần, đấy
hơi, khó chịu dường tiêu hớa
Hiếm gão
Viêm tụy, loét miệng
Rối loạn gan-mật
'i`hường EăD
Bất thường về chức năng gan“
Ít não
Bệnh sói mật
Hỉếm eăn
Viêm gan, vảng da*, tổn thương gan*
Rối loạn da và mô dưới da
Thường eăn ` ' ’
Ban (bao gồm các loại ban được bảo cáo với tân sô thâp hơn,
xem dưới đây)
Ít găg
Viêm da, nối mề đay, ngứa, da đối mảư, tổn thương da, đốm
xuất huyết, ban dát, ban dát sần, ban sần
Hiếm găp
Hoại tử thưọng bi nhiễm độc““, Hội chứng Stevens-
J ohnson*, phù mạch*, phản ứng thuốc có kèm tãng bạch câu
ưa acid và các triệu chúng toản thân (hội chứng DRESS)*,
phảt ban toi… thân (nghiêm trọng)*, ban đò, ban tróc vảy,
ban dạng mụn trứng cá, ban mụn nước, ban mụn mủ, ban
ngứa*, phảt ban đỏ da, phảt ban giống bệnh sời, rụng tỏc,
Rối loạn hệ cơ xương vả mô
liên kêt
Rối loạn thận và tiết niệu
tăng tiết mồ hôi
co thắt cơ, cãng cơ, viêm bao hoạt dịch r
i\ ' J"`
\J V
IịgểD
Viêm ống thận mô kẽ*, thôi thủc đi tiếu
Rối loạn hệ sinh sản vả tuyến
vú
It găp '
Đau khớp, viêm khớp, dau cơ, đau cơ xương khớp, yêu cơ,
Hiếm găo
Tiêu cơ vân*, cứng khớp, cứng cơ xương khóp
Suy thận, bệnh sỏi thận, huyết niệu, tiếu dẳt, protein niệu
Hiêm găn
Ít găn
Rôi ioạn cương
Rối loạn toản thân và tình Thường găg
trạng tại chỗ dùng thuốc Phù
ỈịgấE
Mệt mói, đau ngực, khó chịu ở ngực
H_iêmgịe
Khát nước
Xét nghiệm Ỉt găg
Tăng amylase huyết, giảm số lượng tiểu cấu, giảm số lượng
bạch cẩu, giảm số lượng tế bảo 1ympho, tăng creatin huyết,
tăng creatinin huyết, giảm haemogiobin, tăng urê huyết, tăng
trỉglycerid huyết, tăng cholesterol huyềt, giảm haematocrit,
tãng lactate dehydrogenase trong máu, tăng kali huyết
H iêm găg
Tăng glucose huyết, thời gian thromboplastin từng phần hoạt
hóa kéo dải, giảm số lượng hồng cầu, tăng phosphatase kiềm
trong máu
* Các phản ứng phụ từ kinh nghiệm hậu mãi
** Tiệu chảy không do nhiễm trùng xảy ra trpng khi điều trị và xét nghỉệm chức năng
gan bât thường trong cảc nghiên cứu pha 3 kêt hợp thường gặp hơn ở những bệnh nhân
được điêu trị đông thòi với colchicine.
*** Xem phần 5.1 vế tỷ lệ các đợt bùng phát bệnh gủt trong các nghiên cứu pha 3 riêng
biệt ngẫu nhiên có đôi chứng.
Mô tả các phản ửng phụ chọn lọc
Phản ứng quá mẫn nghiêm trọng hiếm gặp với febuxostat, bao gồm hội chứng Stevens-
Johnson, hoại từ thượng bì nhiễm độc và phản ứng phản vệ/sốc, đã xảy ra trong kinh nghiệm
hậu mãi. Hội chứng Stevens- Johnson và hoại từ thượng bì nhiễm độc được đặc trưng bời phảt
ban da tiến triến đi kèm với bóng nước hoặc tổn thương niêm mạc và kich ứng mắt. Phản ứng
quá mẫn với febuxostat có thể liên quan với nhũng triệu chứng sau đây: phản ứng da đặc
trưng bời ban dát sần thâm nhiễm, phảt ban toản thân hoặc tróc vảy, ngoải ra còn có tốn
thương da, phù mặt, sốt, bất thường về huyết học như giảm tiểu cầu và bạch cầu ưa acid vả
Iỉên quan đến một hoặc nhiều cơ quan (gan và thận bao gồm viêm ống thận mô kẽ) (xem
phần 4 4).
Các đọt bùng phát bệnh gút thường được quan sảt thắy ngay sau khi bắt đầu điều trị và trong
những thản đầu tiên. Sau đó, tần suất các đợt bùng phát bệnh gủt theo cách phụ thuộc thời
gian Khuyen cáo điểu trị dự phòng bùng phát bệnh gủt (xem phần 4. 2 và 4 ..4)
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
4.9 Quá liều
Bệnh nhân bị quá liều cằn được xử trí bằng điều trị triệu chứng và điều trị hỗ trợ.
5. CÁC ĐẶC TỈNH DƯỢC LÝ
5.1 Các đặc tính dược lực học
, . , , .’
Nhóm dược lý trị iiệu: Chế phâm điều trị bệnh gủt, chê phấm ức chế sản xuât afhèic mã
ATC: MO4AA03
›.
Cơ chế tác dung
Acid uric là sản phấm cuối cùng cùa sự chuyển hóa purin ở người và được tạo thảnh trong
các đợt hypoxanthin —› xanthin —> acid uric. Cả hai bước trong sự chuyển dạng trên được xúc
tảo bời xanthỉn oxidase (XO) Febuxostat là một dẫn xuất 2-arylthìazol đạt được hiệu quả
điều trị iảm giảm nổng độ acid uric huyết thanh bằng cách ức chế chọn iọc xanthin oxidase.
Febuxostat 1ả một chất ức chế chọn lọc xanthin oxidase không purin (NP-SIXO) mạnh với
một giá trị Ki ức chế in vỉtro dưới 1 nanomol. Febuxostat đã được chứng minh lả ức chế
mạnh cả dạn oxy hóa và dạng khử cứa xanthin oxidase. Ó nổng độ đìều trị, febuxostat
không ức chế các enzym khảo tham gia vảo sự chuyển hóa purin hoặc pyrimidin, tức 111
guanin deaminase, hypoxanthin guanin phosphoribosyltransferase, orotat
phosphoribosyltransferase, orotidin monophosphat decarboxylase hoặc purin nucleosid
phosphorylase.
Hiêu quả và đô an toản vê 1âm sảng
Hiệu quả của febuxostat đã được chứng minh trong 3 nghiên cửu then chốt pha 3
(2 nghiên cứu then chôt APEX vả FACT và nghiên cứu CONFIRMS bổ sung được mô tả
dưới đây) đã được thực hiện ở 4101 bệnh nhân bị tãng acid uric huyết và bệnh gút. Trong mỗi
nghiên cứu then chốt pha 3, febuxostat đã cho thấy khả năng trội hơn trong việc lảm giảm và
duy trì nổng độ acid uric huyết thanh so với alopurinoi. Tiêu chí đánh giá chính về hiệu quả
trong cảc nghiên cứu APEX vả FACT là tỷ lệ bệnh nhân có 3 trị số nồng độ acid uric huyết
thanh hảng tháng cuối cùng < 6, 0 mgldL (357 ụmol/L). T rong nghiên cứu CONFIRMS pha 3
bổ sưng, với kết quả có sau khi giấy phép lưu hảnh cho febuxostat được cấp lần đầu tiên, tiêu
chí chính đánh giá hiệu quả là tỷ lệ bệnh nhân có nồng độ urat huyết thanh < 6, 0 mg/dL ở lần
thăm khảm cuối cùng. Không có bệnh nhân được ghép tạng nảo đã được bao gồm trong cảc
nghiên cứu nảy (xem phần 4.2).
Nghiên cứu APEX: Nghiên cứu về hiệu quả của febuxostat có đối chứng với alopurinol và giả
dược (A10purinol and Placebo- Controlled Efficacy Study of Febuxostat - APEX) là một
nghiên cúu 28 tuần, pha 3, ngẫu nhiên, mù đôi, đa trung tâm. Một ngản bảy mươi hai (1.072)
bệnh nhân được chọn ngẫu nhiên: giả dược (n = 134), febuxostat 80 mg, ] lần/ngảy (n =
267), febuxostat 120 mg, 1 lầnlngảy (n— = 269), febuxostat 240 mg, 1 lần/ngảy (n— = 134) hoặc
alopurínoi (300 mg, l lầnlngảy [n— = 258] đối với những bệnh nhân có nông độ creatinin huyết
thanh ban đầu 5 1, 5 mg/dL hoặc 100 mg, 1 Iần/ngảy [n=lO] đối với những bệnh nhân có
nồng độ creatinin huyết thanh ban đầu > 1 ,5 mg/dL vả s 2, 0 mg/dL). Febuxostat 240 mg (gấp
2 lần liều cao nhất được khuyến cáo) đã được sử dụng như một liếư đảnh giả độ an toản.
Nghiên cứu APEX cho thấy sự trội hon có ý nghĩa thống kê ở cả hai nhóm điều trị bậng
febuxostat 80 mg, 1 lầnlngảy vả febuxostat 120 mg, l lầnlngảy so với nhóm điếu trị bằng
alopurinol iiểu thông thường 300 mg (n —— 258) /100 mg (n — 10) trong việc lảm giảm nổng độ
acid uric huyết thanh (sUA) dưới 6 mg/dL (357 ụmollL) (xem Bảng 2 và Hình 1).
Nghiên cứu FACT: Nghiên cứu thử nghiệm về febuxostat có đối chứng với alopurinol
(Febuxostat AIOpurinol Controlled Trial - FACT) là một nghiên cứu 52 tuần, pha 3, ngẫu
nhiên, mù đôi, đa trung tâm. Bảy trăm sảu mươi (760) bệnh nhân được chọn ngân hiên:
febuxostat 80 mg, l lầnlngảy (n = 256), febuxostat 120 mg, 1 lẫn/ngảy (n = 1 ặc
alopurinol 300 mg, 1 lần/ngảy (n= 253).
Nghiên cứu FACT cho thấy sự trội hơn có ý nghĩa thống kê của cả hai nhóm điều trị bậng
febuxostat 80 mg 1 lầnlngảy vả febuxostat 120 mg, ] lần/ngảy so với nhóm đỉều trị bằng
9
alopurinol liếư thông thường 300 mg trong việc lảm giám và duy tri nồng độ acid uric huyết
thanh (sUA) dưới 6 mg/dL (357 ụmoi/L).
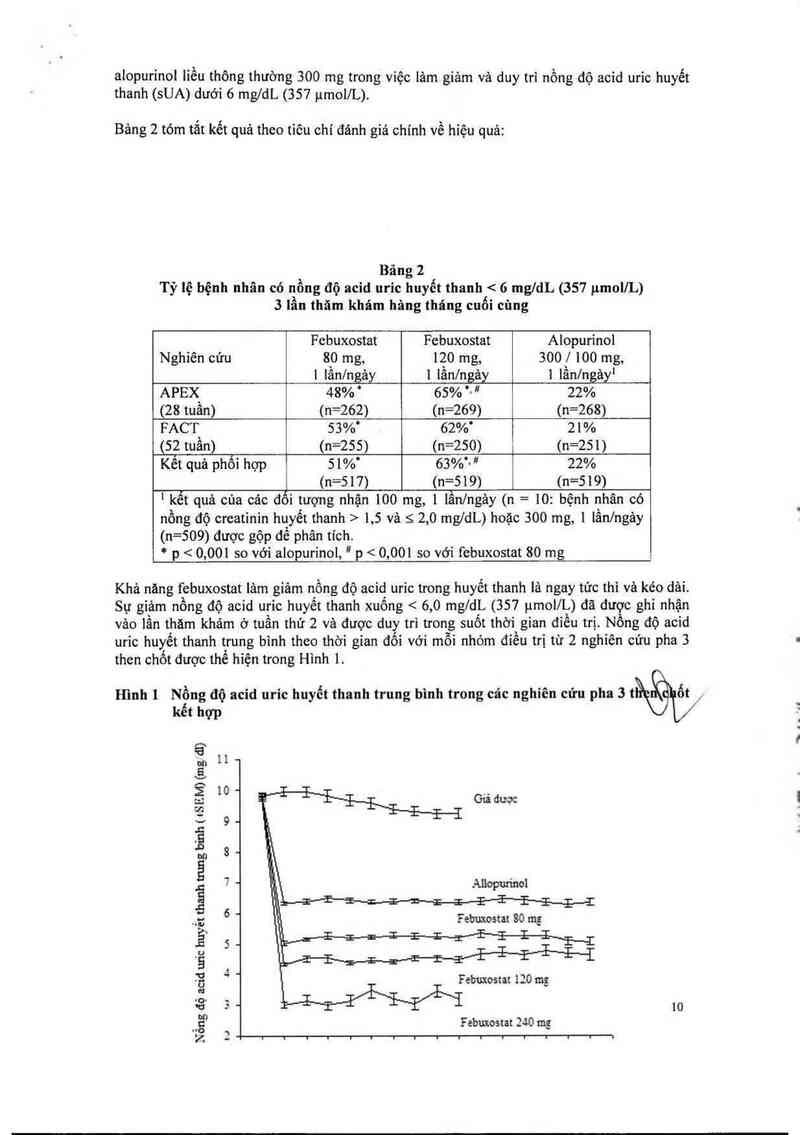
Bảng 2 tóm tắt kết quả theo tiêu chí đánh giá chính về hiệu quả:
Bảng 2
Tỷ lệ bệnh nhân có nồng độ acid uric huyết thanh < 6 mgldL (351 pmol/L)
3 lần thăm khám hâng tháng cuối cùng
Febuxostat Fcbuxostat Alopurinol
Nghiên cứu 80 mg, 120 mg, 300/ 100 mg,
| lần/ngảy 1 1ầnlngảy 1 lần/ngảyl
APEX 48% ' 65% '— ” 22%
(28 tuần) (n=262) (n=269) (n=268)
FACT 53%' 62%“ 21%
(52 tuần) (n=255) (n=250) (n=251)
Kết quả phối hợp 51% 63%'~ ~ 22%
1 (n=517) (n=519) (n=519)
' kết quả của các đối tượng nhận 100 mg, [ lần/ngảy (n = 10: bệnh nhân có
nổng độ creatinin huyết thanh > 1,5 và s 2,0 mg/dL) hoặc 300 mg, 1 lần/ngảy
(n=509) được gộp đề phân tích.
* p < 0,001 so với alopurinol, “ p < 0,001 so với febuxostat 80 mg
Khả năng febuxostat lảm giảm nồng độ acid uric trong huyết thanh 1ả ngay tức thì vả kéo dải.
Sự giảm nồng độ acid uric huyết thanh xuống < 6, 0 mg/dL (357 ụmoI/L) đã đưgc ghi nhận
vảo lần thăm khám ờ tuần thứ 2 và được duy trì trong suốt thời gian điều trị N ng độ acid
uric huyết thanh trung bình theo thời gian đối với môi nhóm điều trị từ 2 nghiên cứu pha 3
then chốt được thế hiện trong Hình 1.
Hình ] Nồng độ acid uric huyết thanh trung bình trong các nghỉên cứu pha 3 tầổốỹ,
kểt hợp
11-
10 ` Giả dược
9 _ .l
8 - i
li.
|.
7 ~ 1’, Ailopudnol
Febuxostat 80 mg
Febuxostat 120 mg
Febuxostat 240 mg
Nổng dộ acid un'c huyết thanh mmg binh ( us EM) (mg dĩ)
O
fs
Lưu ý: 509 bệnh nhân được điều trị bằng alopurinoi 300 mg, 1 lần/ngảy, 10 bệnh nhân có
nổng độ creatinin huyết thanh > 1 ,5 và < 2, 0 mg/dL được cho đùng liều 100 mg,
1 lần/ngảy. (10 bệnh nhân trong số 268 trong nghiên cứu APEX). Febuxostat 240 mg
đã được sử dụng để đánh giá độ an toản của febuxostat o liếư gâp hai lẩn liều cao nhất
được khuyến cáo.
Nghiên cứu CONFIRMS: Nghiên cúu CONFIRMS iâ một nghiên cún 26 tuần, pha 3, ngẫu
nhiên, có đối chứng để đánh giá dộ an toản và hiệu quả của febuxostat 40 mg vả 80 mg so với
alopurinol 300 mg hoặc 200 mg ở những bệnh nhân bị bệnh gút và tăng acid ưrỉc huyễt.
Hai ngãn hai trăm sảu mươi chín (2269) bệnh nhân được chọn ngân nhiến: febuxostat 40 mg,
1 iãnlngảy (n — 757), febuxostat 80 mg, l Iầnlngảy (n — 756), hoặc alopurỉno] 300/200 mg, ]
lầnlngảy (n = 756). Ít nhất 65% bệnh nhân có suy thận nhẹ- -trung bỉnh (có độ thanh thải
creatinin 30 89 mL/phứt). Điều trị dự phòng cảc đợt bùng phát bệnh gút là bắt buộc trong
thời gian 26 tuần.
Tỷ lệ bệnh nhân có nồng độ urat huyết thanh < 6,0 m'g/dL (35? ụmol/L) trong lần thăm khám
cuối cùng là 45% đôi với febuxostat 40 mg, 67% đôi với febuxostat 80 mg vả 42% đối với
alopurinoi 300/200 mg, tương ứng.
Tiêu chỉ đánh giá chỉnh đối với“ phân nhỏm bệnh nhân suy thận
Nghiên cứu APEX đã đảnh giả hỉệu quả ở 40 bệnh nhân suy thận (ví đụ nổng độ creatinin
huyết thanh ban đầu > 1,5 mg/dL vả < 2, 0 mg/dL). Đối vởỉ các đối tượng suy thận được chọn
ngẫu nhiên vảo nhóm điều trị bằng aiopurinol, liều được giới hạn ở mức 100 mg, ] lẩnlngảy.
Febuxostat đã đạt được tiêu chỉ đánh giá chính về hiệu quả ở 44% bệnh nhãn (80 mg,
l lần/ngảy), 45% bệnh nhân (120 mg, l lẳn/ngảy) và 60% bệnh nhân (240 mg, ] lằnlngảy) so
với 0% ở nhớm dùng alopurinol 100 mg, ] lẳnlngảy và nhóm dùng giả dược.
Không có sự khác bỉệt có ý nghĩa iâm sảng về mức giảm phẩn trăm đối với nồng độ acid uric
huyểt thanh ở các đối tượng khỏe mạnh bất kể chức năng thận (58% ở nhóm chức năng thận
bỉnh thường và 55% ở nhóm rối loạn chức năng thận nặng).
Phân tích ở những bệnh nhân bị bệnh gút vả suy thận được xảo dịnh theo thời gian trong
nghiên cứu CONFIRMS vả cho thấy febuxostat hiệu quả hon có ý nghĩa trong việc 1 giảm
nông độ urat huyết thanh < 6 mgldL so với alopurinol 300 mg/2OO mg ở những bệnhv n bị
bệnh gút kèm suy thận nhẹ đến trung binh (65% bệnh nhân dược nghiên cứu).
Tiêu chí đánh gíá chính đối với phăn nhóm bệnh nhân có nồng độ acid huyết thanh (sUA)
> 10 mg/a'L
Khoảng 40% bệnh nhân (nghiên cứu APEX vả FACT kết hợp) có nồng độ acid uric ban dầu
>10 mg/dL. Trong phân nhóm nảy febuxostat đã đạt được tiêu chí đảnh giả chính về hiệu
quả (nồng độ acid uric huyết thanh (sUA) < 6, 0 mg/đL trong 3 lần thăm khám cuối cùng) ở
41% bệnh nhân (80 mg, 1 lần/ngảy), 48% bệnh nhân (120 mg, l lầnfngây) và 66% bệnh
nhân (240 mg, 1 Iần/ngảy) so với 9% ở nhóm dùng alopurỉnol 300 mgllOO mg, l lầnlngảy và
0% ở nhóm dùng giả dược.
Trong nghiến cứu CONFIRMS, tỷ 1ệ bệnh nhân đạt được tiêu chí chính đánh giá về hiệu quả
(nồng độ acid uric huyết thanh (sUA) < 6, 0 mgde trong lần thăm khảm cuối cùng) đối với
những bệnh nhãn có nông độ urat huyết thanh ban đầu > 10 mg/dL được điều trị với
febuxostat 40 mg, ] lần/ngảy lả 27% (66/249), vởi i’ebuxostat 80 mg, l lần/ngảy lả 49%
(125/254) vả vởi alopurinol 300 mg/2OO mg, ] lẩnfngảy lả 31% (72/230), tương ứng.
Kết quả lâm sảng: tỷ lệ bệnh nhân cần phái điểu trị đợt bùng phát bệnh gút
Nghiên cứu APEX: 'Ilrong thời gian diếu trị dự phòng 8 tuần, một tỷ lệ lớn hơn cùa các đối
tượng trong nhóm điếu trị bằng Febuxostat 120 mg (36%) cần phải điếu trị đợt bùng phát
bệnh gủt so với các nhóm điều trị bằng fcbuxostat 80 mg (28%), alopurinol 300 mg (23%) vả
giả dược (20%). Các đợt bùng phát bệnh gút tăng iên sau thời gian điếu trị dự phòng vả giảm
dần theo thời gian 46% đến 55% đối tượng đã được điếu trị các đợt bùng phát bệnh gứt từ
tuần thứr 8 đến tuần thứ 28. Các đợt bùng phảt bệnh gút trong 4 tuần cuỏi cùng của nghiên
cứu (tuần thứ 24- 28) đã được quan sảt thấy ở 15% đối tuợng (febuxostat 80 mg, 120 mg),
14% đối tượng (alopurinol 300 mg) và 20% đối tượng (giả dược).
Nghiên cứu FACT: Trong thời gian điếu trị dự phòng 8 tuần, một tỷ lệ lớn hon của các đối
tượng trong nhóm điều trị bằng fcbuxostat 120 mg (36%) cần phải điều trị đợt bùng phát
bệnh gủt so với cả hai nhóm diếu trị bằng febuxostat 80 mg (22%) vả alopurinol 300 mg (21
%). Sau thời gian điếu trị dự phòng 8 tuần, tỷ lệ cảc đợt bùng phải tăng vả giảm dần lheo thời
gian (64% và 70% đối tượng được điều trị các đợt bùng phát bệnh gút từ tuần thứ 8- -52) Cảc
đợt bùng phát bệnh gút trong 4 tuần cuối cùng cùa nghiến cứu (tuần thủ 49 52) đã được quan
sát thẳy ở 6- 8% đối tượng (fcbuxostat 80 mg, 120 mg) và 11% đối tượng (alopurinol 300
mg).
Tỷ lệ các đối tượng cần phải điều trị dọt bùng phảt bệnh gủt (nghiên cứu APEX vả FACT)
giảm về mặt sô lượng ờ cảc nhóm đã đạt đuợc nông dộ urat huyết thanh trung binh sau mức
ban đầu < 6, 0 mg/dL, < 5, 0 mgldL hoặc < 4, 0 mgde so với nhóm dạt được nổng độ urat
huyết thanh trung bình sau múc ban đầu > 6, 0 mgldL trong 321uần cuối cùa thời gian điều trị
(cảc khoảng thời gian tuần thứ 20- 24 đễn tuần thứ 49- -52).
Trong nghiên cứu CONFIRMS, tỷ lệ bệnh nhân cần phải điếu trị cảc đợt bùng phát bệnh gút
(ngảy thứ 1 đến thảng thứ 6) lả 31% đối với nhóm fcbuxostat 80 mg và 25% đối vởi nhớm
aloỵợurỉnol. Không quan sát thấy sự khác biệt về tỷ lệ bệnh nhân cân phải đỉễu trị các dợt
bùng phát bệnh gủt giua nhóm dùng febuxostat 80 mg và nhóm đùng i`cbuxostat 40 mg.
Các nghiên cửu mở rộng nhãn mờ, dải hạn
Nghiên cứu EXCEL (C02- 021): Nghiên cúu Excel lả một nghiến cứu mở rộng 3 nảm về độ
an toản, pha 3, nhãn mờ, đa trung tâm, ngẫu nhiên, đối chửng vởi alopurinol ớ nhũng bệnh
nhân đã hoản thânh các nghiên cứu pha 3 then chốt (APEX hoặc FACT) Tổng cộng có 1 086
bệnh nhân được đưa vảo nghiên cứu: febuxostat 80 mg, l lầnlngảy (n— = 649), febuxoệtat 120
mg, ] lần/ngảy (n = 292) vả alopurinoỉ 300/100 mg, 1 lẳn/ngảy (n — 145). Khoảng %.bếxíh
nhân không cân thay đổi điểu trị để đạt duợc điểu trị ổn định cuỏi cùng. Những bệnh hiýârt có
3 trị sô nông độ acid uric hưyết thanh (sUA) lỉên tiếp > 6 mgldL được rút khỏi nghiên cứu.
Nồng độ urat đuợc duy trì tth thời gỉan (tức là 91% bệnh nhân điếu trị ban đầu bằng
febuxostat 80 mg và 93% bệnh nhân điếu trị ban đầu bằng febuxostat 120 mg có nồng độ acid
uric huyết thanh < 6 mg/dL ở tháng thứ 36).
12
Dữ liệu 3 năm cho thẳy sự giảm về tỷ lệ cảc đọt bùng phát bệnh gút với dưới 4% bệnh nhân
cấn phải điều trị đọt bùng phát (tức là hơn 96% bệnh nhân không cần điếu trị đợt bùng phát)
ở thángthứ 16- 24 vả tháng thứ 30- 36
46% bệnh nhận điếu trị ồn định cuối cùng bằng febuxostat 80 mg, 1 1ẩnlngảy và 38% bệnh
nhân điếu trị ồn định cuối cùng bằng fcbuxostat 120 mg, l lẩn/ngảy có sự gỉảm hoản toản các
sạn urat nguyên phát sờ thấy đuợc từ lúc ban đầu cho đến lằn thăm khảm cuỏi cùng.
Nghiên cứu FOCUS (TMX-Oi-OOS) lả một nghiên cứu mở rộng 5 năm về độ an toản, pha 2,
nhãn mớ, đa trung tâm, đôi với những bệnh nhân đã hoản thảnh 4 tuần dùng febuxostat theo
phương phảp mù đôi trong nghiên cứu TMX 00- 004.116 bệnh nhân đã được đưa vảo nghiện
cứu và được điếu trị ban đầụ bằng febuxostat 80 mg, 1 lần/ngảy 62% bệnh nhân không cận
điếu chỉnh lỉểu để duy tri nồng độ acid uric huyết thanh < 6 mg/dL và 38% bệnh nhân cần
phải điếu chinh liếư để đạt được liếư on định cuỏi cùng.
'1`ỳJệbệnh nhân có nồng độ urat huyết thanh < 6,0 mg/dL (357 ụmoi/L) trong lần thăm khám
cuỏi cùng lả lớn hơn 80% (81-100%) ở mỗi liếư febuxostat.
Trong cảc nghiến cứu lâm sảng pha 3, đã quan sát thẳy các bắt thường về xót nghiệm chức
năng gan nhẹ ở những bệnh nhân được điếu trị bằng febưxostat (5, 0%) Tỷ lệ nảy tương tự
như tỷ lệ đuợc bảo cảo khi dùng alopưrinol (4,2%) (xem phần 4. 4). Cảo trị số TSH tăng (>
5, 5 ụlU/mL) đã được quan sát thấy ở những bệnh nhân đỉều trị lâu dải bằng febuxostat
(S, 5%) và những bệnh nhân điếu trị bằng alopurinol (5, 8%) trong cảc nghiên cứu mở rộng
nhãn mở dải hạn (xem phẩn 4.4).
5.2 Cảc đặc tính dược động học
Ở các đối tượng khỏe mạnh, nồng độ tối đa trong huyết tương (Cmax) và diện tĩch dưới dường
cong nồng độ trong huyết tượng theo thời gian (AUC) cùa febuxostat tăng tỷ lệ với liếư dùng
sau khi dùng liếư đcm vả nhỉều liều 10 mg đến 120 mg Đối với cảc liều từ 120 mg đến 300
mg, đã quan sát thẫy một mức tăng lón hơn sự tăng tỷ lệ với liếu dùng về AUC đối vởỉ
fcbuxostat. Không có sự tích lũy đảng kể khi dùng iiếu 10 mg đến 240 mg mỗi 24 giờ.
Fcbuxostat có thời gỉan bản thải (tua) pha cuối trung binh biểu kiến khoảng 5— 8 giờ.
Phân tích dược động học/dược iực học quẩn thế đã được tiến hảnh ở 211 bệnh nhân bị tăng
acid uric huyết và bệnh gủi, được đỉều trị bằng febuxostat 40- 240 mg, ] lẩn/ngảy. Nói chung,
cảc thông sộ dược động học của fcbuxostat được ước tinh bới cảc phân tich nảy phù họp vởi
cảc thông số dược động học đạt được từ các đối tượng khỏe mạnh chí ra rẳng các đối tượng
khờe mạnh là đại diện cho sự đảnh giá dược dộng học/dược lực học ở nhớm bệnh nhân bị
bệnh gút.
Hấp thu
Febuxostat được hấp thu nhanh (tmax 1,0-1,5 gìờ) và được hẩp thu tốt (ít nhất là 84%). Sau khi
uống một liếư đơn vả nhiếu liều 80 mg vả 120 mg, l lần/ngảy, Cmax khoảng 2, 8- 3, mL
đối với liếư 80 mg, 1 lần/ngảy vả 5, 0 5,3 pg/mL đối với liễu 120 mg, 1 lấn/ngảy. Ễờ\lk ảJ’
dụng tuyệt đồi của công thức viến nén febuxostat chưa dược nghỉến cúu. 1 |
Sau khi uống nhiều iiều 80 mg, 1 1ầnlngảy hoặc một liếư dơn 120 mg với bũa ăn có nhiếu
chất béo, có sự giảm 49% vệ Cmax đối với liếư 80 mg vả giảm 38% về C.… đối với liếư
120 mg, giảm 18% Vẻ AUC đối với liều 80 mg và giảm 16% về AUC dối với iiều 120 mg.
1uy nhiên, không quan sát thấy sự thay đồi có ý nghĩa lâm sảng vế múc giảm phần trăm đối
với nổng độ acid uric huyết thanh khi xét nghiệm (nhiếu liếư 80 mg). Vì vậy febuxostat có
thể được dùng không liên quan đến thức ăn.
Phân bố
Thể tích phân bố biểu kiến ở trạng thái ổn định (Vss/F) cùa febuxostat khoảng 29- 75 1ít sau
khi dùng các iiều uống 10- 300 mg. Sự gắn kết cùa febuxostat với protein huyết tương khoảng
99, 2% (chủ yếu là với albumin) và không thay đổi trên phạm vi nông độ đạt được với liều
80 mg và 120 mg. Sự gắn kết cùa cảc chất chuyến hóa có hoạt tính với protein huyết tương từ
khoảng 82% đến 91%
Biến đối sinh học
Febuxostat được chuyền hóa mạnh do sự liên hợp thông qua hệ thống enzym uridỉn
diphosphat glucuronosyltransferasc (UDPGT) và sự oxy hóa thông qua hệ thống cytochrom
P450 (CYP). 4 chất chuyến hóa hydroxyl có hoạt tính dược lý đã được xác định, trong đó 3
chất có trong huyết tương người. Các nghiến cửu ín vitro với microsom gan người cho thấy
những chất chuyền hóa oxy hóa trên được hinh thânh chủ yếu bời CYPIAI, CYP1A2,
CYP2C8 hoặc CYP2C9 vả febuxostat giucuronid được hinh thânh chủ yếu bời UGT 1A1,
1A8 vả 1A9.
Thải trừ
Febuxostat được thải trừ qua cả hai đường gan vả thận. Sau khi uống một liều 80 mg
febuxostat có đánh dấu MC, khoảng 49% liều dùng được tìm thắy trong nước tiếu dưới dạng
febuxostat không thay đối (3%), acyl acglucuronid cùa hoạt chất (30%), cảc chất chuyến hóa
ox hóa đã biết cùa nó và các chẳt liên hợp (13%) vả các chất chuyển hóa khảo chưa được
bi t (3%). Ngoài sự bải tiết qua nước tiếu, khoảng 45% liều dùng được tim thẳy trong phân
dưới dạng febuxostat không thay đồi (12%), acyl glucuronid cùa hoạt chất (1%), cảc chất
chuyến hóa oxy hóa đã biết cùa nó và cảc chẳt liên hợp (25%) và cảc chất chuyền hóa khác
chưa được biết (7%).
Suy zhận
Sau khi dùng nhiều liều febuxostat 80 mg ở những bệnh nhân suy thận nhẹ, trung bình hoặc
nặng, Cmax của febuxostat không thay đổi so với các đối tượng có chức nãng thận bình
thường. Tổng AUC trung bình cùa febuxostat tăng khoảng 1, 8 lần từ 7, 5 ụg- gỉờ/mL ở nhóm
có chức năng thận bình thường dến 13, 2 ).tg. giờ/mL ở nhóm rối ioạn chức năng thận nặng.
Cmax cùa cảc chất chuyến hóa tăng 2 lần và AUC cùa cảc chẳt chuyến hỏa tăng 4 1ần. Tuy
nhiên, không cần thiết điều chinh lỉều ở bệnh nhân suy thận nhẹ hoặc trung binh
Suy gan
Sau khi dùng nhiều liều febuxostat 80 mg ở những bệnh nhân suy gan nhẹ (Chiid— —Pugh Ioại
A) hoặc trung bình (Child- -Pugh loại B), C.… và AUC cùa febuxostat vả các chất chuyến hóa
của nó không thay đổi có ý nghĩa so với các đối tượng có chức năng gan bình thường. Chưa
có nghiên cứu nảo được thực hiện ở bệnh nhân suy gan nặng (ChiId-Pugh loại C).
Tuổi
Không quan sát thấy sự thay đổi đáng kể về AUC cứa febuxostat hoặc các ch at c ớ
cùa nó sau nhiều liều uõng febuxostat ờ cảc đối tượng cao tuổi so với các đối tượnge r 1
khòe mạnh.
Giới tính
Sau khi dùng nhìều liếư uống febuxostat, @… cao hơn 24% ở nữ so với ở nam và AUC cao
hơn 12% ở nữ so với ở nam. Tuy nhiên, C.… và AUC được diều chỉnh trọng số tưong tư giữa
cảc giới tinh. Không cần thiết điếu chỉnh liếư dựa theo giới tinh.
14
5.3 Cảc dữ iiệu an toản tiền lâm sãng
Cảc tác dụng trong nhũng nghiên cứu tiền iâm sảng thường được quan sảt thắy ớ cảc múc
tiếp xúc vượt quá mức tiêp xúc tối đa ở người.
Tính gây ung Ihư. gây đột biến suy giảm khả năng sinh sân
Ó chuột công dực, sự tăng có ý nghĩa thống kê về cảc khối u bảng quang (u nhú tế bảo
chuyến tiếp và ung thư biểu mô) đuợc tim thắy chí liên quan vói sỏi xanthin ở nhóm dùng
iiều cao, với mức tiếp xúc gắp khoảng 11 lẩn mức tiểp xúc ở người. Không có sự tăng có ý
nghĩa về bắt kỳ loại khối u nảo khác ở chuột nhắt đực hoặc cái hay chuột cống đực hoặc cái.
Những phát hiện nây được xem là hậu quả cùa sự chuyền hóa purin đặc hiệu loảì vả thảnh
phần nước tiểu và không có ý nghĩa đối với việc sử dụng trên lâm sảng.
Một loạt thử nghiệm tiêu chuẩn về độc tinh gen không cho thẳy bất kỳ tác dụng gây độc gen
nảo có ý nghĩa vế mặt sinh học đối với febuxostat.
Febuxostat ở các iiếu uống lến đến 48 mg/kglngảy dã đuợc tim thấy không có tác dụng trên
khả năng sinh sản và hiệu suất sinh sản của chuột công đực vả cái.
Không có bằng chứng về sự suy giảm khả năng sinh sản, tảo dụng gây quải thai hoặc gây tổn
hại cho thai do febuxostat Đã thẳy có độc tinh đối với chuột mẹ ở iiếu cao đi kèm với giảm
chỉ số cai sữa và gỉảm sự phát triến cùa con trên chuột cống ở mức tiểp xúc vởi thuốc gâp
khoảng 4,3 lẩn mức tiếp xức ở người. Các nghiến cứu vê quái thai được thực hiện ở chuột
cống ớ mức tiếp xúc gâp khoảng 4, 3 iần mửc tiêp xúc ở ngưòi vả thờ mang thai ở mức tiếp
xúc gấp khoảng 13 lần mửc tiếp xúc ớ nguời không cho thấy bất kỳ tảc dụng gây quải thai
nao.
6. CÁC ĐẶC TÍNH CỦA THUỐC
6.1 Danh mục tá dượt
Viên nhân _
Lactose monohydrat, Cellulose vi tinh thê, Magnesi stearat, Hydroxypropylceilulose,
Croscarmcliose natri, Silica ngậm nước dạng keo.
Lớp bao
Opadry Il mảư vảng, 85F42129 chứa:
Cồn polyvinyl, Titan dioxid (E171), Macrogol 3350,Ta1c,0x1d sẳt mảư vảnề((Eil2),
6.2 Tường kỵ
Chưa được ghi nhận.
6.3 Hạn dùng
2 năm kế từ ngảy sản xuất.
6.4 Những lưu ý đặc biệt khi bão quản
Bảo quản dưới 30 °C.
Đế xa tầm tay trẻ cm.
15
Không dùng thuốc quá hạn sử dụng đã ghi trên bao bì.
6.5 Tính chẩt và dung lượng của bao bì đỏng gỏi
Vi PVClNhôm trong, vi chứa 10 viên.
Hộp 3 vì x 10 viên.
6.6 Những lưu ý đặc biệt khi hủy bỏ
Không có yêu cầu đặc biệt.
Sản xuất bởi:
Patheon France
40 Boulevard de Champaret, 38300 Bourgoin Jallieu, France.
Đỏng gỏi bởi:
interthai Pharmaceutical Manufacturing Ltd.
1899 Phaholyothin Road, Ladyao, Chatuchak, Bangkok iogoW
Ngảy ban hảnh: Tháng 5 năm 2015
TUQ. cth TRUỞNG
P.TRUỜNG PHÒNG
Jiỷayễn Jẳ’ấ ẩẳìợ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng