








MÃU NHÂN HỘP CARTON DỰ KIÊN LƯU HÀNH TẠI VIỆT NAM
®—
|
ỬOO
THUỐC_BÀN THEO pơN._
eọc KV HƯỚNG DAN sư DỤNG TRƯỚC KHI DÙNG.
Cần phải tiêm cả 2 bơm tlèm để có được đủ liều 500 mg]
Dung dịch tiém bảp.
Mỗi bơm t›ẻm có chưa sẵn 250 mg tuivestrant trong 5 ml dung dich.
Hòp cnưa 2 bơm tièm có chứa sắn 5 ml dung dịch thuốc và 2 kim tiêm an
ioan (Satety Glide’”)
Chỉ dinh. cách dùng. chõng chi dinh và những thông tin khác: xin xem Tờ
Huớng Dản Sử Dung Thuốc
Bảo quản ở nhiệt dộ 2-8°C (trong tủ lạnh).
` Dế thuốc xa tảm tay trẻ em.
SỔ ló SX. NSX. HD: xin xem "LOT". 'MADE". “EXP" trẻn bao bi. O
SĐK: VN-XXXXX-XX
Cơ sở sán xuăt va dóng gòi cáp 11 Manufactured and primary packed by
\
Iulvestram
fAsLonex° %
Solution for injection
Read the package ieaiiet betore use.
For tull instructions on the adm»mstration ot Faslodex and lhe use
of the sater needie see enclosed Instructions tor Administration
zuensazqn;
i/Ẩbẻ) ồỄ/
IHII]HHII
Vetter Pharma-Fertigung GmbH & Co. KG
Schũtzenstrasse 87. D-88212 Ravensburg, Dửc.
Cơ sở do'ng gÓI căp 21 Secondary packed by
AstraZeneca UK Limited
Silk Road Business Park. Macclesheid, Cheshire SK10 2NA, Anh.
A
^J
BỌYTE
A
:
cục QUAN LY mmc
~
ĐA PHE DUYỆT
-rẹm dán: ....J..2Q…J.…ZQJả
]
AstraZenecẩỄ
fASLODEXỌ ỄẵỡỀ
fulvestrant
Solution tor injection
\
\\.
Store at 2²6 - 8°C (in a refrigerator)
Store the pre—iilled syringes in me original package … order to
protect from light.
Keep out of the reach and Sight ot children.
Medicmal product sub)th to medical preseriptxon
g r-
ẵẻ² `Đ R ~
0 m …
O
Ễ ọ P
3 ẫ _ °
íu gũ fulvestrant
ẮỂ | .: ỮL
_ " '
o
ẫặ , Solution for inịection f———
= ỏ. : I Solution tor injection … a pre-htled synnge I
=— ỉ ẫ , lntramuscular use.
s ; l For Singìe use onty I
=. “ % 2 pre-tilled synnges (5ml).
: ;~ % 2 satetv needies
_ Ễ ẫ, 3 ỡm m Both syringes must be administered to receive '
f» Ẹ, ẵ $ 95 ẵ the 500 mg recommended montth dose. L _ _ _
30 m ²
, ẳẵ’ềẵ
_ ~ 3 Ể
ẵẫỂ ị
: 8ẳ ẫ
, // 3 _
_-\_ ẵẫ
a ẵ
/1._ \\ ẫẫ Ổ
\ ã `
, ' ²8 AstraZeneca Ề 2 x 5m|
'\
Xuãi xứ: Anh
mm… cùng " có Inll nuocugu nu
u sumen In ~c.;u m- vn ne: ., um
asop Ắiuiuoun
pepu-aunucoa E… ooc aux
uouooin mg uonos
3108001 ® pfflâ)SUUIUJOE
aq isnm WAs upg
ỉ
' H—f— —-+
Faslodex is a trademark ot the AstraZeneca group of companies.
Manutactured and pnmary packed by Vetter Pharma-Fenigung
GmbH & Co. KG, Schutzenstrasse 87. D-88212 Ravensburg,
Germany. secondary packed by AstraZeneca UK Limited.
Silk Road Business Park, Macclesfield. Cheshire SK1O 2NA,
United Kingdom. @ AstraZeneca 20062010
One pre-tiiled syringe contains 250 mg tulvestrant in 5 ml solution.
Ethanol (96%), benzyl alcohol, benzyl benzoate and castor oil,
See the package Ieattet tor tunher intormation.
a
“ 1
\ Tamper I |
Evudent Tampei Evucenl l
Vamiẹh-Frềe Rsserved Area Security | sech Labe' may ! perịoraỵed Area i
\ - Label not be apphed to all I |
\, 1 Posmon ` W“ | |
_ _ ' , _____ _i
uas _… mu 243,40 Printale tnlnm: tlou Print: Braille Heads:
> uas An… im: NIA . . El E
g tlusion Mn.: ] Effl Wm VW pm… 3 ễ
ffl nm: 19-Apr—2012 . El g ỉ
ủn: Ciimpnlut Iane: P033485 í f,—
Dmunu Rct mzzwun … P " ,Ễ 3"
lem cm: 6529 El [Il [Il E '3 TEXT SIZE
neminlion: Faslodex 250 mg 2 x 5 ml PFS Cancn p p p ; ả Tho BODY m,
@ Mum: vietnam Ế J nn this AM is :1:
cm… lv: AP 9 _ 0 pt
Bar print: 100mm @ 100% |
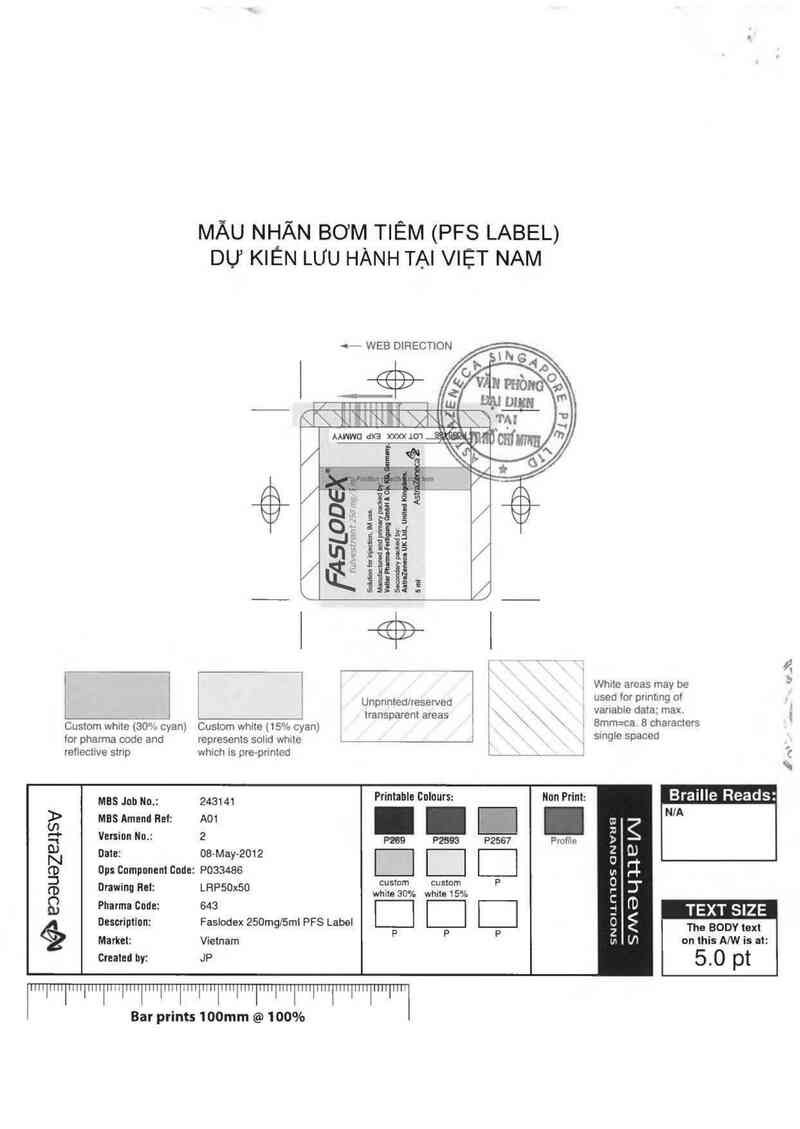
MÃU NHÂN BỚM TIÊM (PFS LABEL)
DỰ KIEN LƯU HÀNH TAI VIỆT NAM
WEB DIRECTION
®
,
Y
.'ẫi ( Jm,i
SLOD
fA
iJ/vrsaĩíz’in.’
A IW"À .
Munulacimod und pnmuy pcdud
VW Mno-Fưlgm W |
Asmlomcu UK Ltd,, Unthd DGn _ …
Soconduypackodby.
Solution tot inioctinn. IM uu.
5ml
Custom white ỈCĨO% cyan)
ior pharma code and
retiective stnp
Custom white (15% cyan)
represents sotid white
which is pre-printed
@
Unpnnted/reserved
transparent areas !
White areas may be
used for pnnting of
variabte data; max.
Bmm=ca. 8 characters
single spacde
MBS Job No.:
MBS Ameml Ret:
Veninn Nu.z
Date:
Drzwing Ret:
Pharma Cnde:
Description:
Market:
Created hy:
ọậ> eaauazeusv
243141
A01
2
OE—May—201 2
Ops Compunent Code: P033486
LRPSOXSO
643
Faslodex 250mg/5m! PFS Label
Vietnam
JP
Printable Culours:
Í_"i
t… _…
P289 P2593 P2567
cu stom custom P
white 30% white 1 5%
P P F
Non Print:
Profi“e
TEXT SIZE
The BODY text
on this ANV is at:
5.0 pt
ẳ
m
Si
3"
fD
<
<
…
@
z
›
2
c
m
0
,
c
:*
0
2
…
i:` ii
Bar prints 100mm @ 100%
Braille Reads.
c....t…
Faslodex 250 mg
Fulvestrant
Dung dịch tiêm bắp
THÀNH PHẦN ĐỊNH TỈNH vÀ ĐỊNH LƯỢNG
Một bớm tiêm chứa sẵn 250 mg fulvestrant trong 5 ml dung dịch.
Tá dược: xem Danh mục tá dược.
DẠNG BÀO CHÉ
Dung dịch tiêm.
Dung dịch có độ nhởt, trong suốt, khỏng máu đến vảng.
CHỈ ĐỊNH ĐIỀU TRỊ
Faslodex được chỉ định điều trị cho phụ nữ sau măn kinh bị ung thư vú tiến triền tại chỗ
họặc di cản cộ thụ thể estrogen đương tinh, tái phát trong hoặc sau điều trị kháng estrogen
bộ trợ, hoặc tiên triên khi đang điêu trị kháng estrogen.
LIÊU DÙNG VÀ CÁCH DÙNG
Liều dùng
Người lớn (kể cả nguời cao tuối)
Liều khuyến cáo là 500 mgliằn/tháng, bổ sung thêm 500 mg sau 2 tuần điều trị vởi lièu khởi
đâu.
Đối tương đăc biêt
Suy thận `
Khỏng cân chĩnh liêu cho bệnh nhân suy thận nhẹ vả vừa (độ thanh thải creatinin 2 30
mllphút). An toản và hiệu quả chưa được đánh giá ở bệnh nhân suy thặn nặng (độ thanh
thải creatinin < 30 ml] phút), do đó cần thận trọng đối với các bệnh nhân nảy (xem mục Lưu
ý vả thận trọng đặc biệt khi dùng).
Suy gan
Không cần chỉnh liều cho bệnh nhản suy gan nhẹ và vừa. Tuy nhiên, vì nồng độ vả thời gian
tièp xúc fulvestrant có thề tảng, nên dùng Faslodex thận trọng cho những bệnh nhản nảy.
Chưa có dữ liệu báo cáo đối với bệnh nhân suy gan nặng (xem mục Chổng chỉ định, Lưu ý
vá thận trọng đặc biệt khi" dùng vả Đặc tính dược động học).
Trẻ em
An toản vè hiệu quả cùa Faslodex ở trẻ em từ sơ sinh đến 18 tuồi chưa được xác định. Dữ
liệu hiện có được trình bảy ở mục Đặc tính dược iực học và Dược động học nhưng khỏng
khuyến cáo liều dùng
Cách dùng
Faslodex được chỉ định với 2 mủi tiêm 5 mi liên tục, tiêm bắp chặm (1-2 phútllần tiêm), 1
mũi tiêm ở môi mông.
Chi tiết hướng dẫn ca'ch dùng, xem mục Thận trọng đặc biệt trong việc vứt bỏ vai các xứ Iỷ
khác.
CHỐNG CHỈ ĐỊNH
Quả mẫn cảm với hoạt chắt hoặc bắt cứ tá dược nảo khác
Phụ nữ có thai và cho con bú (xem mục Phụ nữ có thai vai cho con bú)
Suy gan nặng (xem mục Lưu ý vá thận trong đặc biệt khi dùng vá Đặc tính dược đóng học).
r.
'/
LƯU Ý vÀ THẬN TRỌNG ĐẶC BIỆT KHI DÙNG
Thận trọng khi dùng Faslodegc ở những bệnh nhản suy gan nhẹ đến trung bình (xem mục
Liều lượng vá cách ơùng, Chông chỉ định Về Đặc tính dược động học).
Thận trọng khi dùng Faslodex ở những bệnh nhân suy thận nặng (độ thanh thải creatinin <
30 mi/phút).
Do dùng qua đường tiêm bắp, thận t`rọng khi dùng Fastodex cho bệnh nhân có cơ địa dễ
chảy mảu, giảm tiểu cầu hoặc đang điêu trị cảc thuôo chòng đông.
Nghẽn mạch do huyết khối thường được ghi nhận trên phụ nữ ung thư vú tiến triển và củng
được ghi nhận trong cảc nghiên cứu Iảm_sảng với Faslodex (xem mục Tác dụng không
mong muôn). Điều nảy nèn được cân nhảc khi chỉ định Faslodex cho các bệnh nhân có
nguy cơ.
Chưa có dữ liệu nghiên cứu dải hạn về tác động của fuivestrant trên xương. Do cơ chế tác
động cùa fulvestrant, có nguy cơ gây Ioảng xương khi dùng.
Trẻ em
Fastodex khỏng khuyến cáo dùng cho trẻ em vả trẻ vị thảnh niên vi tinh an toản và hiệu quả
chưa được xảo định ở nhóm bệnh nhân nảy (xem mục Đặc tinh dượclục học).
TƯỜNG TÁC với cÁc THUỐC KHÁC vÀ cÁc DẠNG TƯỜNG TÁC KHÁC
Một nghiên cứu lâm sảng về tương tác vởi midazolam (chất nền cùa CYP3A4) cho thấy
fulvestrant không ức chê CYP3A4. Các nghiên cữu lám sảng tương tác với rifampicin (chặt
cảm ứng CYP3A4) vả ketoconazole (chât ức chẻ CYP3A4) cho thây không có các thay đỏi
trèn iâm sảng liên quan đến `độ thanh thải fulvestrant. Do đó, khóng cần điều chinh liều ở
bệnh nhân dùng fulvestrant động thời với các thuôo ức chê hay cảm ứng CYP3A4.
PHỤ NỮ cộ THAI VÀ CHO con BÚ
Phu nữ có khả năng mang thai
Những bệnh nhản có khả nảng mang thai nên dùng các biện pháp tránh thai hiệu quả trong
khi điêu trị.
Phu nữ có thai
Fasiodex chống chỉ định_dùng cho phụ nữ có thai (xem mục Chổng chỉ định). Nghiên cứu
trẻn chuột và thỏ cho thảy Fulvẹstrant qua được nhau thai sau khi tiêm bặp đơn liêu. Cảo
nghiên cứu trên động vặt cho thây có độc tĩnh trèn khả năng `sinh sản bao gôm tăng tần suất
bât thường thai nhi và tử vong (xem mục Dữ liệu an toán tiện !âm sáng). Nếu có thại trong
khi đang dùng Faslodex, bệnh nhán nèn được thòng báo vẻ khả năng gây nguy hiêm cho
thai nhi vả nguy cơ sầy thai.
Phu nữ cho con bú
Phải ngưng cho con bú khi điều trị với Faslodex. fulvestrant được bải tiềt vảo sữa ở chuột
đang cho con bú. Chưa rõ liệu fulvestrant có bải tiêt vảo sữa mẹ hay không.
Chồng chỉ định sử dụng thuốc trong thời gian cho con bú do nguy cơIgây các tác dụng
ngoại ý nghiêm trọng do fulvestrant trên trẻ nhỏ bú sữa mẹ (xem mục Chông chỉ đinh).
Khả nảnu sinh sản
Tác động cùa Fastodex Ièn khả năng sinh sản ở người chưa được nghiên cứu.
ẢNH HƯỞNG KHẢ NĂNG LÁI XE VÀ VẬN HÀNH MÁY MÓC
Faslodex khỏng ảnh hưởng hoặc ảnh hưởng không đáng kể lèn khả năng lải xe hoặc vận
hảnh mảy móc. Tuy nhiên, vì suy nhược thường được ghi nhặn khi dùng Faslodex, những
bệnh nhân bị tảc dụng ngoại ý nảy nên thận trọng khi lải xe hoặc vặn hảnh máy mỏc.
/Z
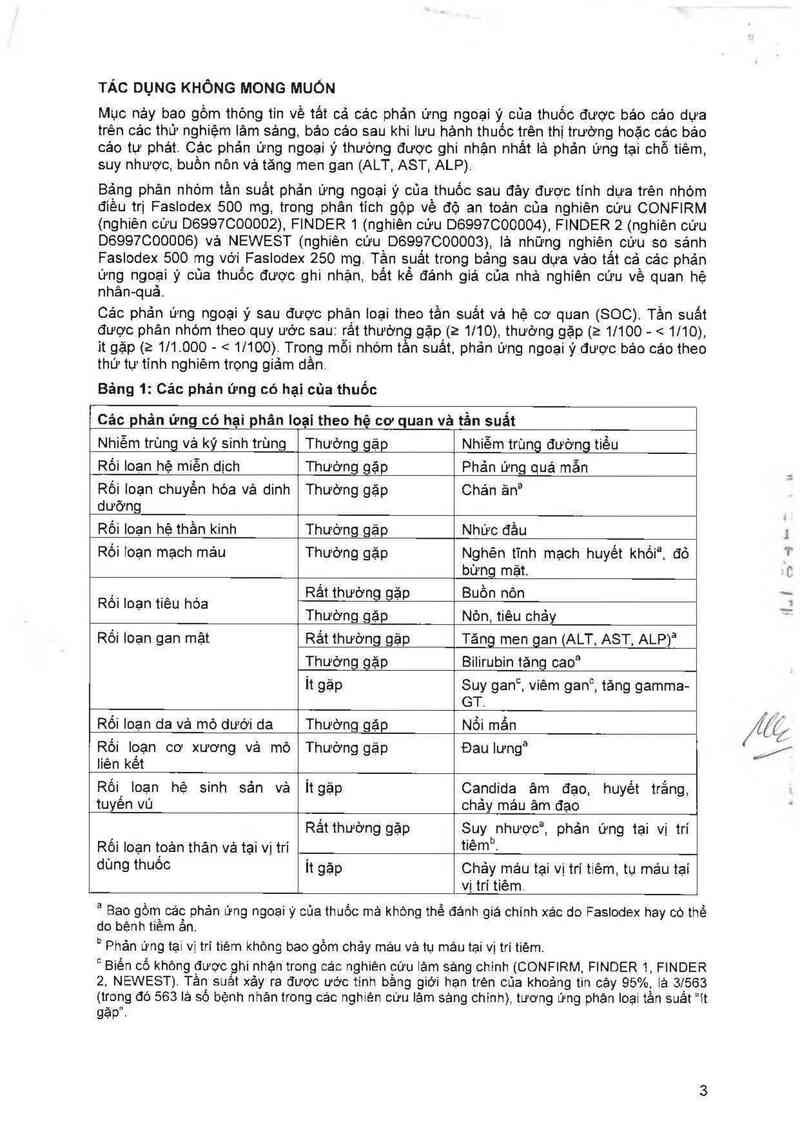
TÁC DỤNG KHÔNG MONG MUỐN
Mục nảy bao gồm thông tin về tầt cả cảc phản ứng ngoại ý của thuốc được bảo các dựa
trèn cảc thử nghiệm lâm sảng, bảo cảo sau khi lưu hảnh thuốc trên thị trường hoặc các báo
các tự phát. Cảo phản ứng ngoại ỷ thường được ghi nhận nhất lả phản ứng tại chỗ tiêm,
suy nhược, buồn nôn vả tăng men gan (ALT, AST ALP)
Bặng phân nhóm tần suất phản ứng ngoại ý của thuốc sau đây được tinh dưa trèn nhóm
điều trị Faslodex 500 mg, trong phân tich gộp về độ an toản cùa nghiên cứu CONFIRM
(nghiên cứu D6997C00002), FINDER 1 (nghiên cứu D6997000004), FINDER 2 (nghiên cứu
D6997000006) vả NEWEST (nghiên cứu D6997000003), là những nghiên cừu so sảnh
Faslodex 500 mg với Faslodex 250 mg Tần suất trong bảng sau dựa vảo tắt cả cảc phản
ứng ngoại y của thuốc được ghi nhận, bắt kế đánh giá của nhả nghiên cứu về quan hệ
nhân-quả
Các phản ứng ngoại ý sau được phân loại theo tần suất vả hệ cơ quan (SOC) Tần suất
được phân nhóm theo quy ước sau rất thường gặp (2 1/10) thường gặp (2 1/100- < 1/10),
it gặp (2 1l1. 000- < 11100) Trong mỗi nhóm tần suất, phản ứng ngoại ý được bản cáo theo
thứ tự tính nghiêm trọng giảm dần
Bảng 1: Cảc phản ứng có hại của thuốc
Các phản ứng có hại phân Ioại theo hệ cơ quan vả tần suất
Nhiễm trùng vả ký sinh trùng Thường_gặp Nhiễm trùng đường tiểu
Rối Ioạn hệ miễn dịch Thường gặp Phản ứng quả mẫn
Rối loạn chuyến hóa Vả dinh Thường 9ảP Chản ảna
dưỡng
Rối loạn hệ thần kinh Thường gặp Nhức đầu
Rối ioạn mạch máu Thường gặp Nghẽn tĩnh mạch huyết khốia, đỏ
bừng mặt.
,_ __ , Rắt thường gặp Buồn nón
Rm loạn tieu hoa , _ _ … ,
Thương 93D Non, tieu chay
Rồi loạn gan mật Rất thường gặp Tảng men gan (ALT, AST, ALP)a
Thường gặp Bilirubin tăng cao²
it gặp Suy gan°, viêm gan°, tăng gamma-
GT.
Rối loạn da vả mô dưới da Thường gặp Nổi mấn
Rối iọạn cơ xương vả mò Thường gặp Đau lưnga
liên kêt
Rối, loạn hệ sinh sản vả it gặp Candida âm đạo, huyết trắng,
tuyên vú chảy mảu âm đạo
Rất thường gặp Suy nhược², phản ứng tại vị trí
Rối Ioạn t_oản thân vả tại vị trí tiêmb.
dùng ỈhUÔC it gặp Chảy mảu tại vị trí tiêm, tụ mảu tại
vị trí tiêm
² Bao gồm các phản ứng ngoai y của thuốc mà không thế đánh giá chính xác do Faslodex hay có thế
do bệnh tiềm ắn.
" Phản ứng tại vị trí tiêm không bao gồm chảy máu và tụ máu tại vị trí tiêm.
Biến cố không được ghi nhận trong các nghiên cứu lám sáng chinh (CONFIRM FINDER 1 FINDER
2 NEWEST) Tần suất xảy ra được ước tinh bằng gìới hạn trèn cùa khoảng tin cậy 95% la 3/563
(trong đó 563 lá số bệnh nhản trong các nghiên cứu Iám sang chinh), tương ứng phản loại tản suất "it
gặp"-
/ -
ỉ/ỉỨl
~3i-ỉb`
Li
QUÁ LIÊU
Chưa có bảo cảo vẻ quá liều ở người. Cảc nghiên cứu trèn động vật chưa chứng tỏ tác
động nảo khác ngoải các tác động liên quan trực tiêp hoặc gián tièp đèn hoạt tinh kháng
estrogen với liêu cao fulvestrant (xem mục Dữh'ệu an toản tr'én lâm sáng). Nêu có quả liêu
xảy ra, nèn điều trị triệu chứng vả hỗ trợ.
ĐẶC TỈNH Dược LỰC HỌC
Nhóm trị liệu: Nội tiết, khảng estrogen, mả ATCz LO2BAO3.
Cơ chế tác động vả tác động dược lực học
Fulvestrant lả chắt đối vặn cạnh tranh với thụ thể estrogen (ER), có ải iực tương đương với
estradiol. Fulvestrant ngản chặn hoạt động sinh dưỡng của estrogen mã không có tảc động
đồng vận một phần (tương tự estrogen) Cơ chế tảo động có liên quan với việc điều hòa
giảm nồng độ ER- protein. Cảc thử nghiệm lảm sảng ở phụ nữ sau măn kinh bị ung thư vú
tiên phảt cho thắy fulvestrant Iảm điều hòa giảm đảng kế ER— —protein trong cảc khối u có thụ
thể estrogen dương tinh so với giả dược Độ biếu hiện thụ thể progesterone cũng bị giảm
đáng kề, tương ưng với việc thiếu tác động chủ vận estrogen nội tại Fulvestrant 500 mg
củng được chứng minh là giảm bải xuất ER vả chắt đảnh dắu khả năng sinh sản
(proliferation marker) Ki67 ở mức độ lớn hơn fulvestrant 250 mg trong cảc khối u vú trèn
phụ nữ sau măn kinh trong bối cảnh tản bổ trợ
An toản vả hiệu quả lâm sảng ở ung thư vú tiến triến.
Một thử nghiệm lảm sảng pha III đã được tiên hảnh trèn 736 bệnh nhân măn kinh bị ung thư
vú tiến triền tái phát trong hoặc sau điếu trị nội tiết hỗ trợ hoặc tiến triền sau khi điều trị nội
tiết cho ung thư tiến xa. Nghiên cứu gồm 423 bệnh nhân tải phảt hoặc tiên triền trong khi
điểu trị bằng tiện phảp kháng estrogen (phân nhóm AE) vả 313 bệnh nhán tái phảt hoặc tiến
triển trong khi điều trị bằng chắt ức chế aromatase (phản nhóm AI). Thử nghiệm nảy so
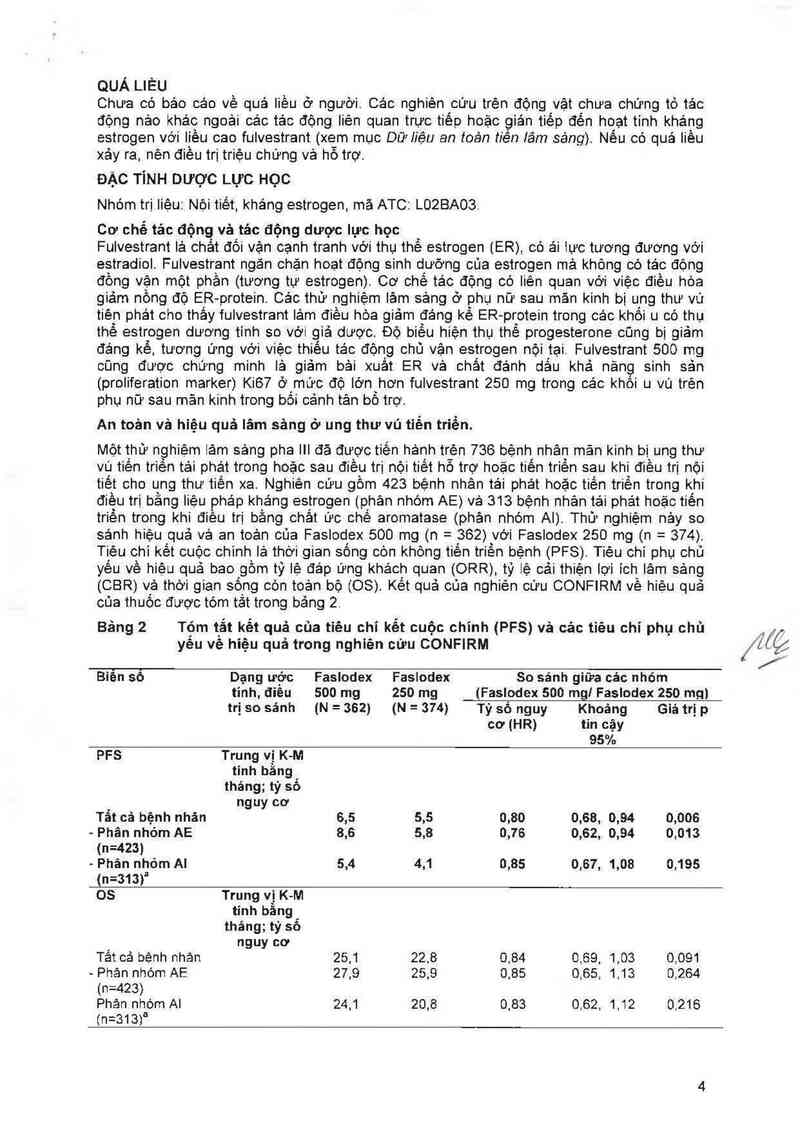
sảnh hiệu quả vả an toản của Faslodex 500 mg (n— = 362) với Faslodex 250 mg (n- = 374)
Tiệu chỉ kết cuộc chinh lả thời gian sổng còn không tiến triển bệnh (PFS) Tiêu chỉ phụ chủ
yếu về hiệu quả bao Igồm tỷ lệ đảp ứng khảch quan (,ORR) tỷ lệ cải thiện lợi ich` lâm sảng
(CBR) vả thời gian sống còn toản bộ (08). Kết quả cùa nghiên cữu CONFIRM vê hiệu quả
của thuốc được tóm tắt trong bảng 2.
Bảng 2 Tóm tắt kểt quả của tiêu chỉ kết cuộc chính (PFS) vả các tiêu chỉ phụ chủ
yếu về hiệu quả trong nghiên cứu CONFIRM
Biên sô Dạng ước Faslodex Faslodex So sánh giữa các nhóm
tinh, điêu 500 mg 250 mg (Faslodex 500 mg! Faslodex 250 mg)
trị so sánh (N = 362) (N = 374) Tỷ số nguy Khoảng Giá trị p
cơ (HR) tin cậy
95%
PFS Trung vị K-M
tinh bằng
tháng; tỷ số
nguy cơ
Tắt cả bệnh nhân 6,5 5,5 0,80 0,88, 0,94 0,006
- Phân nhóm AE 8,6 5,8 0,76 0,82, 0,94 0,013
(n=423)
- Phán nhóm AI 5,4 4,1 0,85 0,67, 1,08 0,195
(n=313fI
05 Trung vị K- M
tinh bằng
tháng; tỷ số
nguy cơ
Tất cả bệnh nhản 25,1 22,8 0,84 0,69, 1,03 0,091
- Phản nhóm AE 27,9 25,9 0,85 0,65, 1,13 0,264
(n=423)
Phản nhòm Al 24,1 20,8 0,83 0.62, 1,12 0,216
(n=313)a
i'f'Ị
/ j
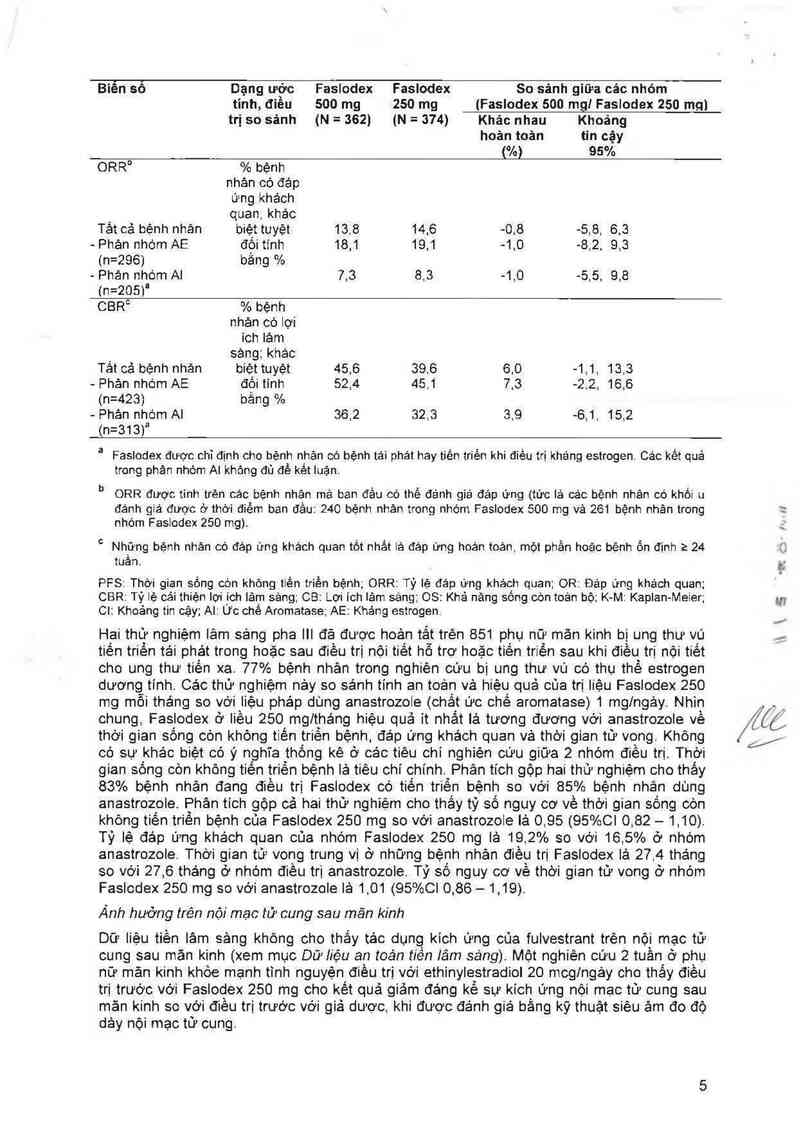
Biên sô Dạng ước Faslodex Faslodex So sánh giữa các nhóm
tinh, điêu 500 mg 250 mg (Faslodex 500 mg! Faslodex 250 mg)
trị so sảnh (N = 362) (N = 374) Khác nhau Khoảng
hoản toản tin cậy
(%) 95%
ORRn % bệnh
nhản có đảp
ưng khách
quan,khác
Tảt ca“ bệnh nhân biệt tuyệt 13.8 14.6 -0 8 -5,8, 6,3
- Phản nhộm AE đối tinh 18,1 19,1 -1 0 -8,2. 9,3
(n=296) bằng %
- Phản nhóm Al 7,3 8,3 -1,0 -5,5, 9,8
(n=205)a
CBR° % bệnh
nhản có iợi
ich lảm
sángzkhác
Tất cả bệnh nhản biệt tuyệt 45,6 39,6 6,0 -1,1, 13,3
- Phản nhóm AE đối tính 52,4 45,1 7,3 —2,2, 16,6
(n=423) bằng %
- Phản nhóm AI 36,2 32,3 3,9 —6,1, 15,2
(n=313)a
a Faslodex được chỉ định cho bệnh nhân có bệnh tái phát hay tiên triền khi điêu trị kháng estrogen. Các kềt quả
trong phân nhóm AI khc'mg đủ để kết luận.
b ORR được tinh trèn các bệnh nhân mả ban đẩu có thế đánh giá đáp ứng (tức lả cảc bệnh nhân có khối u
đánh giá được ở thời điếm ban đầu: 240 bệnh nhân trong nhóm Faslodex 500 mg và 261 bệnh nhân trong :
nhỏm Faslodex 250 mg).
° Những bệnh nhản có đảp ứng khách quan tốt nhất lả đáp ứng hoán toản, một phần hoặc bệnh Ổn định z 24 1;
tuần.
PFS: Thời gian sống còn không tiến triến bệnh; ORR: Tỷ lệ đáp ửng khách quan; OR: Đáp ứng khảch quan;
CBR: Tỷ lệ cải thiện iợi ích lâm sảng; CB: Lợi ich tâm sảng, OS: Khả nảng sống còn toản bộ; K M: Kaptan- -Meier; …
CI: Khoảng tin cặy; Al: Ừc chê Aromatase; AE: Khảng estrogen
Hai thử nghiệm lâm sảng pha III đã được hoản tắt trên 851 phụ nữ mản kinh bị ung thư vú …
tiến triền tải phảt trong hoặc sau điều trị nội tiết hỗ trợ hoặc tiến triển sau khi điều trị nội tiết
cho ung thư tiến xa 77% bệnh nhản trong nghiên cứu bị ung thư vú có thụ thể estrogen
dương tính. Cảc thử nghiệm nảy so sảnh tinh an toản và hiệu quả của trị liệu Faslodex 250
mg mỗi tháng so vời liệu pháp dùng anastrozole (chắt ức chế aromatase) 1 mglngảy. Nhin _
chung, Fas_lodex ở liều 250 mgltháng hiệu quả it nhắt lả tương đương với anastrozole về JỸẶỐ
thời gian sông còn không tiến triền bệnh, đáp ứng khảch quan vả thời gian tử vong. Không
có sự khác biệt có ý nghĩa thống kê ở các tiêu chỉ nghiên cừu giữa 2 nhóm điếu trị. Thời
gian sống còn không tiến triển bệnh lả tiêu chí chính Phân tích gộp hai thử nghiệm cho thầy
83% bệnh nhân đang điệu trị Faslodex có tiến triển bệnh so với 85% bệnh nhân dùng
anastrozole. Phân tích gộp cả hai thử nghiệm cho thấy tỷ số nguy cơ về thời gian sống còn
không tiến triển bệnh của Faslodex 250 mg so với anastrozole lả 0, 95 (95%C! 0,82 — 1,10)
Tỷ lệ đáp ưng khách quan của nhóm Faslodex 250 mg lả 19 2% so với 16 5% ở nhóm
anastrozole Thời gian tử vong trung vị ở những bệnh nhân điều trị Faslodex lả 27.4 tháng
so với 27,6 tháng ở nhóm điều trị anastrozole. Tỷ số nguy cơ về thời gian tử vong ở nhóm
Faslodex 250 mg so với anastrozoie lả 1,01 (95%Cl 0,86 —1,19).
Ảnh hưởng trẻn nội mạc tử cung sau mãn kinh
Dữ liệu tiền tâm sảng không cho thắy tảc dụng kỉch ứng của fulvestrant trên nội mạc tử
cung sau măn kinh (xem mục Dửliệu an toán tiên !ám sâng). Một nghiên cứu 2 tuần ở phụ
nữ mãn kinh khỏe mạnh tỉnh nguyện điều trị với ethinyiestradìol 20 mcglngảy cho thắy điều
trị trước với Fasiodex 250 mg cho kềt quả giảm đảng kể sự kích ưng nội mạc tử cung sau
măn kinh so với điều trị trước với giả dược, khi được đảnh giá bằng kỹ thuật siêu âm đo độ
dảy nội mạc tử cung
Điều trị tân bổ trợ cho bệnh nhản ung thư vú s 16 tuân với Faslodex 500 mg hay Faslodex
250 mg không Iảm thay đồi Iảm sảng đảng kế trẻn độ dảy nội mạc tử cung, cho thắy thuốc
không có tảo động chủ vận. Chưa có bằng chứng về tảc dụng ngoại ỷ trèn nội mạc tử cung
ở bệnh nhản ung thư vú được nghiên cứu. Chưa có dữ liệu về hình thái học nội mạc tử
cung
Trong 2 nghiên cứu ngắn hạn (1 vả 12 tuần) trên bệnh nhân măn kinh bị bệnh phụ khoa
Iảnh tính, siêu ảm không thắy có sự khảo biệt đảng kể vẻ độ dảy nội mạc tử cung giữa
nhóm dùng fulvestrant vả giả dược.
Ảnh hưởng irên xuợng
Không có dữ liệu nghiên cữu dải hạn về ảnh hưởng của fulvestrant trện xương. Điêu trị tân
bổ trợ cho bệnh nhân bị ung thư vú s 16 tuần với Faslodex 500 mg hay Faslodex 250 mg
khỏng cho kết quả Iảm thay đối lâm sảng đảng kể về nồng độ chẳt đảnh dắu chu chuyển
xương trong huyết thanh
Trẻ em
Faslodex khỏng được chỉ định cho trẻ em.
Một nghiên cứu pha II, nhãn mở, đánh giá tính an toản, hiệu quả vả dược động học của
fulvestrant ở 30 bé gái từ 1 — 8 tuối bị dậy thì sớm tiến triến (Progressive Precocious
Puberty) có liên quan tới hội chững McCune Albright (MAS). Các bệnh nhi nảy đươc dùng
fulvestrant tiêm bắp với liều 4 mglkg hảng tháng Nghiên cứu 12 tháng nảy đã đảnh giá một
nhóm tiêu chí vẻ MAS vả cho thắy có sự giảm tằn suất chảy máu âm đạo vả giảm tỷ lệ
trưởng thảnh xương sớm. Nồng độ đáy ở giai đoạn ôn định (steady-state trough
concentration) của fulvestrant ở trẻ em trong nghiên cứu nảy tương thích với nồng độ nảy ở
người lớn (xem mục Dược động học). Chưa có những quan ngại mới về tính an toản phát
sinh từ nghiên cừu mức độ nhỏ nảy, mặc dù hiện chưa có đủ dữ liệu 5 năm.
ĐẶC TỈNH Dược ĐỌNG HỌC
Hẩp thu
Sau khi tiêm bắp Faslodex tác dụng kéo dải, fulvestrant được hắp thu chậm vả nồng độ tối
đa trong huyết tương (C ma,,) đạt được sau khoặng 5 ngảy. Dùng Faslodex tiều 500 mg đạt
được nông độ tiép xúc ở mức hoặc gần mức liều ở trang thải ôn định trong vòng tháng đầu
([CV] bình quân— = AUC 475 [33,4%] ng ngảy/ml, ©…ax — 25,1 [35,1%] ng/mj, C…In - 16, 3
[25, 9%] nglml tương ứng). Ở trạng thải ôn định, nông độ fulvestrant trong huyềt tương được
duy tri chi trong khoảng dao động hẹp, với khoảng nồng độ đinh cao hơn nỏng độ đáy tối đa
3 lần. Sau khi tiêm bắp, nống đó tiếp xúc tỉ lệ với liều dùng trong khoảng liều 50 — 500 mg.
Phân bổ
Fulvestrant phân bố nhanh vả rộng. Thế tich phản bố biều kiến lớn ở trạng thái ồn định
(Vdss) khoảng 3- 5 Ilkg cho thắy sự phân bố ngoải mạch lớn Fulvestrant gắn kết cao với
protein huyết tương (99%) Các phản tứ lipoprotein tỷ trọng rắt thẩp (VLDL), lipoprotein tỷ
trọng thảp (LDL) vả lipoprotein tỷ trọng cao (HDL) lả cảc thảnh phần gản kết chinh Chưa có
nghiên cứu vệ tương tác cạnh tranh gắn kết protein Vai trò của globulin gắn kết hormone
sinh dục (SHBG) chưa được xảc định
Chuyển hóa
Sự chuyến hóa của fulvestrant chưa được đảnh giá đầy đủ, nhưng có liên quan đến sự kết
hợp của một số tiến trinh biến đổi sinh học tương tự như cảc steroid nội sinh. Cảc chất
chuyến hóa được xác định (bao gồm chất chuyến hóa 17- ketone, sulphone, 3- sulphate, 3- -vả
17-glucuronide) lá các chắt có ít hoạt tính hoặc có hoạt tính tương tư fulvestrant vẻ tảo dụng
kháng ẹstrogen. Cảo nghiên cứu sử dụng chế phẩm từ gan vả ca'c men tái tổ hợp ở người
cho thắy CYP3A4 lả isoenzyme P450 duy nhất liên quan đến quá trinh oxy hóa của
fulvestrant; tuy nhiên, trện in vivo, ca'c đường chuyến hóa không qua P450 chiếm ưu thế
hợn. Dữ liệu ín-viiro cho thắy fulvestrant không ức chế isoenzyme CYP450.
@
Thải' trư
Fulvestrant được thải trừ chủ yếu ở dạng chuyền hóa. Đường thải trừ chính qua phân, với ít
hơn 1% được đảo thải qua nước tiểu Fulvestrant có độ thanh thải cao, 11t1, 7 ml/phútlkg,
cho thắy tỷ lệ bải tiết qua gan cao. Thời gian bản hủy sau khi tiêm bắp được chi phối bởi tỷ
lệ hấp thu vá ước tinh lả 50 ngảy
Các đối“ tươno đăc biêt
Dữ liệu phản tich dược động học từ cảc nghiên cữu phạ III cho thắy khỏng có sự khảo biệt
vê đặc tính dược động học của fuivestrant ở các độ tuỏi (từ 33-89 tuôi), cân nặng (40-127
kg) hoặc chủng tộc.
Suy thận
Suy giảm chức nảng thận nhẹ vả vừa không ảnh hướng tới dược động học của fulvestrant
ở mức độ có ý nghĩa lâm sảng.
Suy gan
Một thử nghiệm lâm sảng đơn liều đã được tiến hảnh nhằm đảnh giá đặc tính dược động
học của fulvestrant ở bệnh nhân suy gan nhẹ vả vừa (Child- Pugh đó A vả B) Tiêm bắp vởi
liều cao trong thới gian ngắn. Diện tich dưới đường cong (AUC) ở các bệnh nhân suy gan
tảng tối đa 2 5 lần so vời người tình nguyện khỏe mạnh. Ở những bệnh nhân dùng
Faslodex, việc tăng nống độ vả thời gian tiếp xúc với thuốc ở mức độ nảy được dư kiên lả
dung nạp tốt Những bệnh nhân bị suy gan nặng (Child- -Pugh độ C) chưa được đảnh giá
Bệnh nhi
Dược động học của fulvestrant đã được đánh giá trong 1 thử nghiệm lám sảng trên 30 bé
gái bị dậy thì sớm tiến triền có liên quan đến hội chứng McCune Albright (xem mục Đặc tính
dược iực học). Những bệnh nhi từ 1 — 8 tuồi được dùng fulvestrant tiêm bắp với liều 4
mglkg/thảng Trung binh nhản (độ lệch chuẩn - SD) của nộng độ đáy ở trạng thải ồn định
(C…, ss) vả diện tích dưới đường cong (AUCss) ước tinh tươngứng là 4, 2 (0,9) ng/ml vả
3680 (1020) ng*giờlml. Mặc dù_các dữ iiệu thu thặp bị giới hạn, nộng độ đảy ở trạng thái ôn
định cùa fulvestrant ở trẻ em thê hiện tương thich với nông độ nảy ở người lớn`
TẢ DƯỢC
Ethanol (96%)
Benzyl alcohol
Benzyl benzoate
Castor oil
TƯỜNG KY
Do khỏng có nghiên cứu trèn tính tương ky, thuốc nảy không được trộn lẫn với các thuốc
khảo.
HẬN DÙNG: 4 năm kế từ ngảy sản xuất.
THẬN TRỌNG ĐẶC BIỆT KHI BÀO QUÁN:
Bảo quản ở nhiệt độ 2°C — 800 (trong tủ lạnh).
Bảo quản bơm tiêm chứa sẳn thuốc trong bao bì gốc để trảnh ảnh sáng
ĐỎNG GÓI: Hộp chứa 2 bơm tiêm chứa sẵn thuốc (5 ml) vả 2 kim tiêm an toản.
/
1
4
/
\ồ
THẬN TRỌNG ĐẶC BIỆT TRONG vnẸc vứr BÒ VÀ cÁc xử LÝ KHÁC.
Hướng dẫn sử dung thuốc
Cảnh bảo — không được hắp tiệt trùng kim tiêm an toản (kim tiêm dưới da BD SafetyGlide
Shielding) trước khi dùng. Phải luôn Iuôn đẻ tay phía sau kim tiêm trong khi tiêm vả vứt bỏ.
Đối với mỗi 2 bơm tiêm:
Thảo bơm tiêm thủy tinh hinh trụ ra khỏi khay vả
kiếm tra không bị hỏng.
Thảo bỏ miếng dán niêm phong ở nắp nhựa mảu
trắng phủ lên bơm tiêm Luer nối với dụng cụ Luer-
Lok đề mở nắp cao su phủ trên đầu bơm tiêm. (xem
Hinh 1).
Bóc mở bao bì bên ngoải kim tiêm an toản (BD
SafetyGlide). Gắn kim tiêm an toản vảo Luer-Lok.
(xem Hình 2).
Vặn khóa kim tiêm để gắn chặt vảo đầu nối Luer.
Kéo thằng nắp đặy kim ra khỏi kim để tránh hư đầu
kim.
Chuyền bơm tiêm chứa sẵn thuốc đến vị trí cần tiêm.
Tháo vỏ kim tiêm.
Dung dịch tiêm nên được kiểm tra bằng mắt thường
để phát hiện các phần tử lạ vả sự biến đồi máu sắc
dung dịch trước khi dùng.
Đuôi khi trong bơm tiêm.
Tiêm bắp chậm (1—2 phútliần) vảo mông. Đế thuận_
tiện, vị trí góc xiên kim tiêm nên hướng theo đòn bây
cảnh tay. (xem Hình 3).
Sau khi tiêm, ngay lặp tức ản đầu ngỏn tay vảo bộ
phận kich hoạt theo hướng đòn bầy cánh tay để kich
hoạt bộ phận bao phủ kim tiêm (xem Hình 4).
Lưu ý: Tránh va chạm bản thản và người khác khi
kích hoạt. Nghe tiếng 'click’ vả quan sát thấy đầu kim
đă được đậy kỉn.
Hinh 1
:ĩ~fi”““ "`R_~l
Hình 2
\
Hinh 3
a
/ /
Hưởng dẫn vứt bỏ
Bơm tiêm chứa sẵn thuốc chỉ được dùng một lần.
Bắt kỳ sản phầm nảo không sử dụng hoặc phế thải nên được vứt bỏ theo quy định tại cơ
sớ.
ĐọckỸ HƯỞNG DẬN s_ứ DỤNG TRƯỚC KHI DÙNG. NẺU CẦN THÊM THÔNG TIN, XIN
HỎI Y KIÉN CUA BAO sv.
THUỐC CHỈ DÙNG THEO TOA BÁC SỸ.
Ti-jÓNG BÁO CHO BÁC SỸ NHỮNG TÁC DỤNG KHÔNG MONG MUỐN GẶP PHẢI KHI
DUNG THUỐC.
oE XA TẦM TAY TRẺ EM.
Ngảy hiệu đinh toa thuốc: Thảng 2/2012.
Faslodex is a trademark of the AstraZeneca group of companies.
© AstraZeneca 2006—2012. (0
ề\
..A’Y
/
4
(../|
Cơ sở sản xuất vả đóng gói cắp 1:
Vetter Pharma-Fertigung GmbH & Co. KG \)
Schũtzenstrasse 87, D-88212 Ravensburg, Đức.
Cơ sở đóng gói cảp 2:
AstraZeneca UK Limited
Silk Road Business Park, Macclesfield, Cheshire SK1O 2NA, Anh. ẢỊ/ể
Ởo cuc TRƯỞNG
Jiỳfiỷfỗt nVảỉn ỂỔ/Ểanẩ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng