






FASLODEX
Solution for injection, 250 mg/5 ml
PFS LABEL
SCALE: 100%
Ế , a .
, Ổ ỂỂ ễz
Q aẵẫ ẳ
' 8 ỄỄỄSỄ
Ư1 ỄẵỄ ẫẫ ’ ZỦ
’_ỮẦ ẫẵẵẳễỉ //
zíÌtĨì' Cyíưl; Ct;sttựh .ntvitrJ 11'
MBS Job No.: 243,4, Printable Colours: Non Print: Braille Reads:
,, n n n =
ã" Vm'°n N°-² ² me P2593 pzssy r _rxạ Ê
. _ _ 2
N Date. 08 May 2012 0
(3D Ops ComponentCode: P033486 …
q, Drawlng … ansoxso wggị*gg,_ wggjẹg,ụ P 9
Ô Pharma Coda- 643 C
m ~ :* TEXT SIZE
Description. Faslodex 250mg/5m1 PFS Label P P P 3 The BODY text
Market: Vietnam J“ on this AIW Is at:
Created by: JP 50 pt
' ll \ l ' i \
Bar prints 100mm @ 100%
Rx- Thuốc bán theo đơn
Faslodex® 250 mg
Fulvestrant
Dung dịch tiêm bắp
THÀNH PHẢN ĐỊNH TÍNH VÀ ĐlNH LƯỢNG
Một bơm tiêm chứa sẵn 250 mg fulvestrant trong 5 ml dung dịch.
Tá dược: xem Danh mục tá dược.
DẠNG BÀO CHẾ
Dung dịch tiêm. v 7
Dung dịch có độ nhót, trong suốt. không mảư đến vảng. W
CHỈ ĐỊNH ĐIỀU TRỊ /
Faslodex được chỉ định điều trị cho phụ nữ sau mản kinh bị ung thư vú tiến triển tại chỗ
hoặc di căn có thụ thể estrogen dương tính tái phát trong hoặc sau điều trị kháng estrogen
bổ trợ. hoặc tiên triền khi đang điều trị kháng estrogen
uEu DÙNG VÀ CÁCH DÙNG
Liều dùng
Người lớn (kể cả người cao tuổi)
Li_èu khuyên các là 500 mgllầnltháng. bổ sung thêm 500 mg sau 2 tuần fflèu trị vởi Iièu khởi
đâu.
Đối tươnq đăc biêt
Suy thận
Không cần chỉnh liều cho bệnh nhân suy thận nhẹ vả vừa (độ thanh thải creatinin 2 30
ml/phút). An toán và hiệu quả chưa được đánh giá ở bệnh nhân suy thận nặng (độ thanh
thải creatinin < 30 mll phút), do đó cần thân trọng đối với ca'c bệnh nhân nảy (xem mục Lưu
ý và thận trọng đặc biệt khi dùng).
Suy gan
Không cần chỉnh liều cho bệnh nhân suy gan nhẹ vả vừa. Tuy nhiên vì nòng độ và thời gian
tiếp xúc fulvestrant có thể tăng, nên dùng Faslodex thận trọng cho những bệnh nhân nảy.
Chưa có dữ liệu bảo cáo đối vởi bệnh nhân suy gan nặng (xem mục Chổng chỉ định Lưu ý
và thận trọng đặc biệt khi dùng và Đặc tính dược động học).
Trẻ em
An toản và hiệu quả của Faslodex ở trẻ em từ sơ sinh đến 18 tuối chưa được xảc định. Dữ
liệu hiện có được trình bảy ở mục Đặc tính dược lưc học vả Dược động học nhưng không
khuyến cáo liều dùng.
Cách dùng
Faslodex đượ_c chỉ định vởi 2 mũi tiêm 5 ml lièn tục. tiêm bắp chậm (1-2 phútllần tiêm). 1
mủi tiêm ở môi mông.
Chi tiết hưởng dẫn cách dùng. xem mục Thận trọng đặc biệt trong việc vứt bỏ và các xử lý
khác.
CHỐNG CHỈ ĐỊNH
Quả mẫn cảm với hoat chắt hoặc bắt cứ tá dược nảo khác.
Phụ nữ có thai và cho con bú (xem mục Phụ nữ có thai và cho con bú)
Suy gan nặng (xem mục Lưu ý vá thận trọng đặc biệt khi dùng vá Đậc tính dược động học).
LƯU Ý vA THẬN TRỌNG ĐẶC BIỆT KHI DÙNG
Thận trọng khi dùng Faslodex ở những bệnh nhản suy gan nhẹ đến trung bình (xem mục
Liều lượng vả cách dùng, Chống chỉ định vá Đặc tính dược động học).
Thận trọng khi dùng Faslodex ở những bệnh nhân suy thặn nặng (độ thanh thải creatinin <
30 mllphủt)
Do dùng qua đường tiêm bắp. thận trọng khi dùng Faslodex cho bệnh nhân có cơ địa dễ
chảy máu giảm tiểu cầu hoặc đang điều trị các thu c chống đông.
Nghẽn mạch do huyết khối thường được ghi nhận trên phụ nữ ung thư vú tiến triển vả cũng
được ghi nhận ttong các nghiên cứu Iâm_sảng với Faslodex (xem mục Tác dung không
mong muốn). Điêu nảy nên được cân nhăc khi chỉ định Faslodex cho các bệnh nhân có
nguy cơ.
Chưa có dữ liệu nghiên cứu dải hạn về tác động của fulvestrant trèn xương. Do cơ chế tác
động của fulvestrant, có nguy cơ gãy loãng xương khi dùng.
Trẻ em
Faslodex không khuyến cáo dùng cho trẻ em vả trẻ vị thảnh niên vì tính an toản và hiệu quả
chưa đươc xác định ở nhóm bệnh nhản nảy (xem mục Đặc tính dược lực hoc).
TƯỢNG TÁC VỚI cÁc THUỐC KHÁC vÀ cÁc DẠNG TƯỜNG TÁC KHÁC
Một nghiên cứu lâm sảng về tương tảo vởi midazolam (chắt nền của CYP3A4) cho thấy
fulvestrant khỏng ức chế CYP3A4 Cảo nghiên cứu lâm sảng tương tảc với rifampicỉn (chát
cảm ứng CYP3A4) vả ketoconazole (chảt ức chế CYP3A4) cho thấy khỏng có các tha đối
trên lâm sảng liên quan đền độ thanh thải fulvestrant. Do đó, không cần điều chỉnh lieu ở
bệnh nhân dùng fulvestrant đồng thời với các thuốc ức chế hay cảm ứng CYP3A4.
PHỤ NỮ có THAI VÀ CHO con BÚ /Ị/éá
Phu nữ có khả nảnq mang thai /
Những bệnh nhân có khả nảng mang thai nên dùng các biện pháp trảnh thai hiệu quả trong
khi điều trị
Phu nữ có thai
Faslodex chống chỉ định dùng cho phụ nữ có thai (xem mục Chống chỉ định). Nghiên cứu
trèn chuột vả thỏ cho thẩy Fulvestrant qua được nhau thai sau khi tiêm bắp đơn liều Các
nghiên cứu trên động vật cho thảy có độc tỉnh trên khả nảng sinh sản bao gôm tăng tần suất
bắt thường thai nhi vả tử vong (xem mục Dữliệu an toản tiền lâm sảng). Nếu có thai trong
khi đang dùng Faslodex bệnh nhản nên được thông bảo về khả năng gây nguy hiềm cho
thai nhi vả nguy cơ sấy thai.
Phu nữ cho con bú
Phải ngưng cho con bú khi điều trị với Faslodex. Fulvestrant được bải tiết vảo sữa ở chuột
đang cho con bú, Chưa rõ liệu fulvestrant có bải tiêt vảo sữa mẹ hay không.
Chống chỉ định sử dụng thuốc trong thời gian cho con bú do nguy cơ gây cảc tảc dụng
ngoại ý nghiêm trọng do fulvestrant trên trẻ nhỏ bú sữa mẹ (xem mục Chống chỉ đinh).
Khả náng sinh sản
Tảc động của Faslodex lên khả năng sinh sản ở người chưa được nghiên cứu.
ẢNH HƯỚNG KHẢ NĂNG LÁI xe vA VẬN HÀNH MÁY MÓC
Faslodex khỏng ảnh hưởng hoặc ảnh hưởng không đáng kể lèn khả năng lái xe hoặc vận
hảnh máy móc. Tuy nhiên, vì suy nhược thường được ghi nhận khi dùng Faslodex, những
bệnh nhân bị tác dụng ngoại ý nảy nẻn thận trọng khi lái xe hoặc vận hảnh máy móc.
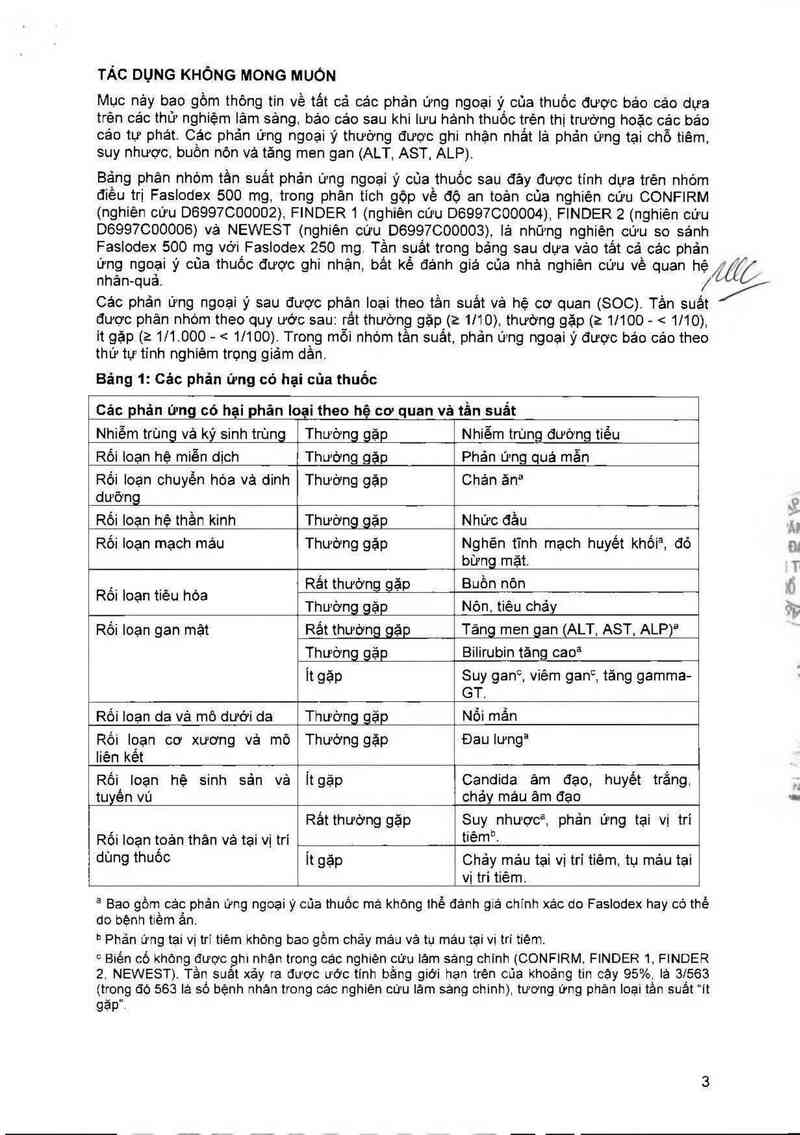
TÁC DỤNG KHÔNG MONG MUỐN
Mục nảy bao gồm thông tin về tất cả các phản ửng ngoại ý của thuốc được báo cáo dưa
trên các thử nghiệm lâm sảng báo cáo sau khi lưu hảnh thuốc trẻn thị trướng hoặc cảc báo
các tự phát. Cảo phản ưng ngoại ý thường được ghi nhận nhắt lả phản ứng tại chỗ tiêm
suy nhược, buồn nỏn vá tăng men gan (ALT AST ALP).
Bặng phân nhòm tần suất phản ứng ngoại ý cùa thuốc sau đây được tính dựa trẻn nhóm
điều trị Faslodex 500 mg trong phân tích gộp về độ an toèn của nghiên cứu CONFIRM
(nghiên cứu D6997000002) FINDER 1 (nghiên cứu D6997C00004), FINDER 2 (nghiên cứu
06997600006) vả NEWEST (nghiên cứu D6997000003) lả những nghiên cứu so sánh
Faslodex 500 mg vởi Faslodex 250 mg Tần suất trong bảng sau dựa vảo tảt cả các phản
ứng ngoại ý của thuốc được ghi nhận bắt kế đánh giá của nhà nghiên cứu về quan hệ
nhân- -quả.
Cảo phản ứng ngoại ý sau được phân loại theo tần suất vả hệ cơ quan (SOC) Tần suất
được phản nhớm theo quy ước sau: rất thường gặp (2 1110) thường gặp (ì 11100— < 1110)
ít gặp (2 1/1. 000- < 1/100). Trong mỗi nhóm tần suất phản ưng ngoại ý được bảo cảo theo
thứ tự tính nghiêm trọng giảm dần.
Bảng 1: Các phản ứng có hại của thuốc
Cảc phản ứng có hại phân Ioại theo hệ cơ quan vả tần suất
Nhiễm trùng và ký sinh trùng Thườnggặp Nhiễm trùng đường tiểu
Rối Ioạn hệ miễn dịch Thường gặp Phản ứng quả mẫn
Rối Ioạn chuyền hóa và dinh Thường gặp Chán ảna
dưỡng
Rối loạn hệ thần kinh Thường_gặp Nhức đầu
Rối loạn mạch máu Thường gặp Nghẽn tĩnh mạch huyết khối², đỏ
bừng mặt.
,—. .- . Rẩt thướng gặp Buồn nôn
Ron Ioạn t1eu hoa _ _ . .- ,
Thương_gạp Non, tieu chay
Rồi loạn gan mặt Rắt thường gặp Tảng men gan (ALT, AST, ALP)a
Thướng gặp Bilirubin tăng caoa
Ỉt gặp Suy gan°, viêm gan“, tăng gamma-
GT.
Rối Ioạn de vả mô dưới da Thường_gặp Nỗi mẩn
Rối lọạn cơ xương và mô Thường gặp Đau lưnga
liên kêt
Rối loạn hệ sinh sản vả Ỉt gặp Candida âm đạo, huyết trắng.
tuyên vú chảy máu âm đạo
Rắt thường gặp Suy nhượcễ, phản ửng tại vị trí
Rối loạn tpản thân vả tại vị trí tiêm“.
dùng thUỒC Ỉt gặp Chảy máu tại vị trí tiêm` tụ mảư tại
vị trí tiêm.
3 Bao gồrn các phản ứng ngoại ý của thuốc mã không thể đảnh giá chính xác do Faslodex hay có thế
do bệnh tiêm ản.
° Phản ứng tại vị trí tiêm khòng bao gồm chảy máu và tu mảư tại vị trí tiêm.
° Biên có Không được ghi nhện trong các nghiện cứu Iảm sáng chỉnh (CONFIRM FINDER 1 FINDER
2. NEWEST). Tần suảt xảy ra được ước tính bằng giới han trèn cúa khoảng tin cây 95% là 31563
(trong đó 563 lá số bệnh nhản trong các nghiên cưu lâm sảng chinh) tương ứng phản loại tần suất ít
găp".
ZéZé
QUÁ uEu
Chưa có báo cáo về quá Iièu ở ngưới. Các nghiên Icứu trên độnngật chưa chứng tỏ tác
động nảo khác ngoải các tác động liên quan trực tièp hoặc gián tiep đến hợạt tinh kháng
estrogen với liều cao fulvestrant (xem mục Dữ/iệu an toán tiên lâm sáng). Neu có quá liêu
xảy ra. nèn điều trị triệu chứng vả hỗ trợ.
ĐẶC TÍNH DƯỢC LỰC HỌC
Nhóm trị liệu: Nội tiết. kháng estrogen, mã ATC: LOZBAO3
Cơ chế tác độnẵ
Fulvestrant lả ch
vả tác động dược lực học
t đối vặn cạnh tranh vời thụ thể estrogen (ER), có ái lực tương đương với
estradiol. Fulvestrant ngăn chặn hoạt động sinh dưỡng của estrogen mã không có tác động
đồng vận một phần (tương tự estrogen). Cơ chế tảc động có iiên quan với việc củẻu hòa
giảm nồng độ ER-protein. Cảo thử nghiệm lâm sáng ở phụ nữ sau mản kinh bị ung thư vú
tiên phát cho thắy fulvestrant lảm điêu hòa giảm đáng kê ER-protein trong các khối u có thụ
thể estrogen dương tính so vời giả dược. Độ biểu hiện thụ thể progesterone cũng bị giảm
đáng kế, tương ứng với việc thiếu tác động chủ vận estrogen nội tại. Fulvestrant 500 mg
cũng được chứng minh lả giảm bải xuắt ER vả chảt đánh dấu khả năng sinh sản
(proiiferation marker) Ki67 ở mức độ lởn hơn fulvestrant 250 mg trong cảc khối u vú trẻn
phụ nữ sau măn kinh trong bối cảnh tân bổ trợ.
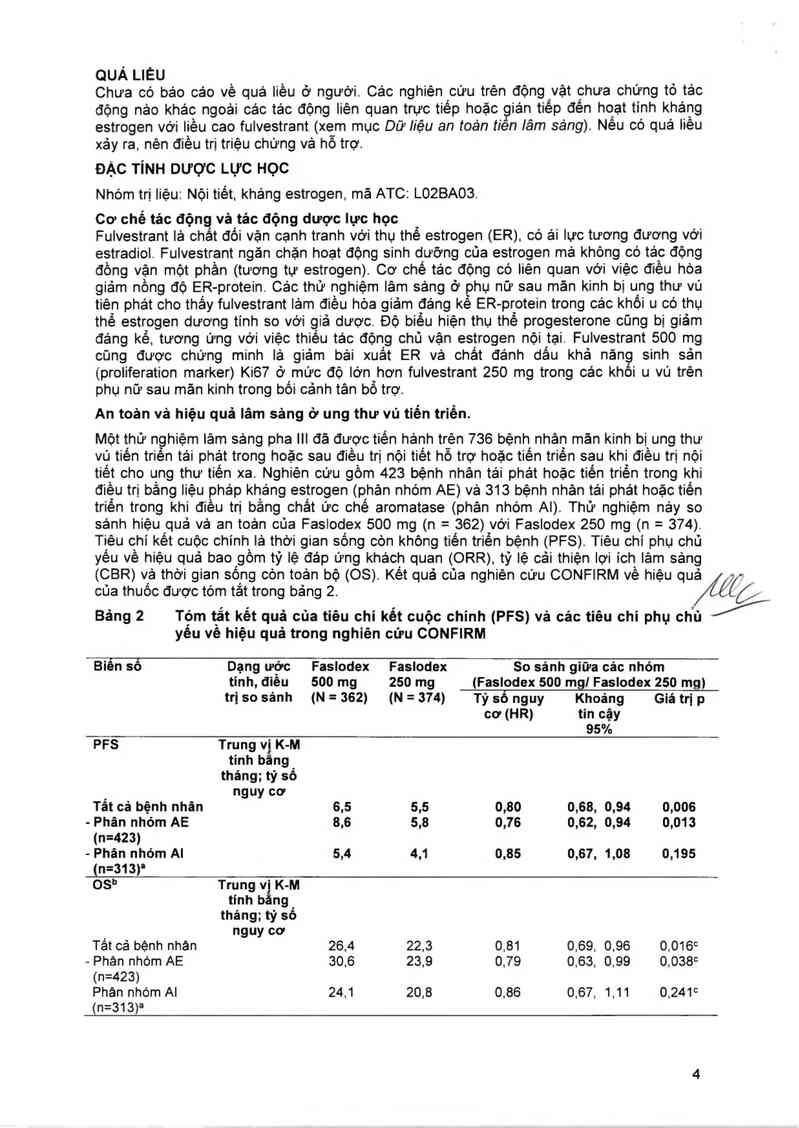
An toản vả hiệu quả lâm sảng ở ung thư vú tiến triển.
Một thử nghiệm iâm sảng pha III đã được tiến hảnh trèn 736 bệnh nhân mản kinh bị ung thư
vú tiên triến tái phát trong hoặc sau điều trị nội tiêt hỗ trợ hoặc tiên triền sau khi điều trị nội
tiềt cho ung thư tiến xa. Nghiên cứu gồm 423 bệnh nhân tái phảt hoặc tiến triễn trong khi
điều trị bằng liệu pháp kháng estrogen (phân nhóm AE) vả 313 bệnh nhân tải phát hoặc tiên
triền trong khi điều trị bằng chất ức chế aromatase (phân nhóm Al). Thử nghiệm nảy so
sảnh hiệu quả và an toản của Faslodex 500 mg (n = 362) vởi Faslodex 250 mg (n = 374).
Tiêu chí két cuộc chính lả thời gian sống còn không tiến triến bệnh (PFS). Tiêu chỉ phụ chủ
yếu về hiệu quả bao gồm tỷ lệ đáp ứng khách quan (ORR). tỷ lệ cải thiện lợi ích lâm sảng
(CBR) vả thời gian sống còn toản bộ (08). Kết quả cũa nghiên cứu CONFIRM về hiệu quả
cùa thuốc được tóm tắt trong bảng 2.
Bảng 2 Tộm t_ắt kết quả cùa tiêu chỉ kết cuộc chinh (PFS) và các tiêu chỉ phụ chỉ:
yêu vê hiệu quả trong nghiên cứu CONFIRM
%
Biển sỏ Dạng ước Faslodex Faslodex So sánh giữa các nhỏm
tính, điêu 500 mg 250 mg (Faslodex 500 mg! Faslodex 250 mg)
tri so sánh (N = 362) (N = 374) Tỷ số nguy Khoáng Giá trị p
cơ (HR) tin cậy
95%
PFS Trung vị K-M
tính băng
tháng; tỷ số
_ nguy cơ
Tát cả bệnh nhân 6,5 5,5 0,80 0,68, 0,94 0,006
- Phân nhóm AE 8,6 5,8 0,76 0,62, 0,94 0,013
(n=423)
— Phán nhóm Al 5,4 4,1 0,85 0,67, 1,08 0,195
(n=313)'
OSh Trung v“ K-M
tính b ng
tháng; tỷ số
nguy cơ
Tât cả bệnh nhan 26.4 22.3 0,81 0.69, 0,96 0.016c
- Phán nhớm AE 30.6 23.9 0.79 0,63, 0.99 0.038c
(n=423)
Phân nhóm Al 241 20,8 0.86 0,67, 1,11 0,241c
(n=313)a
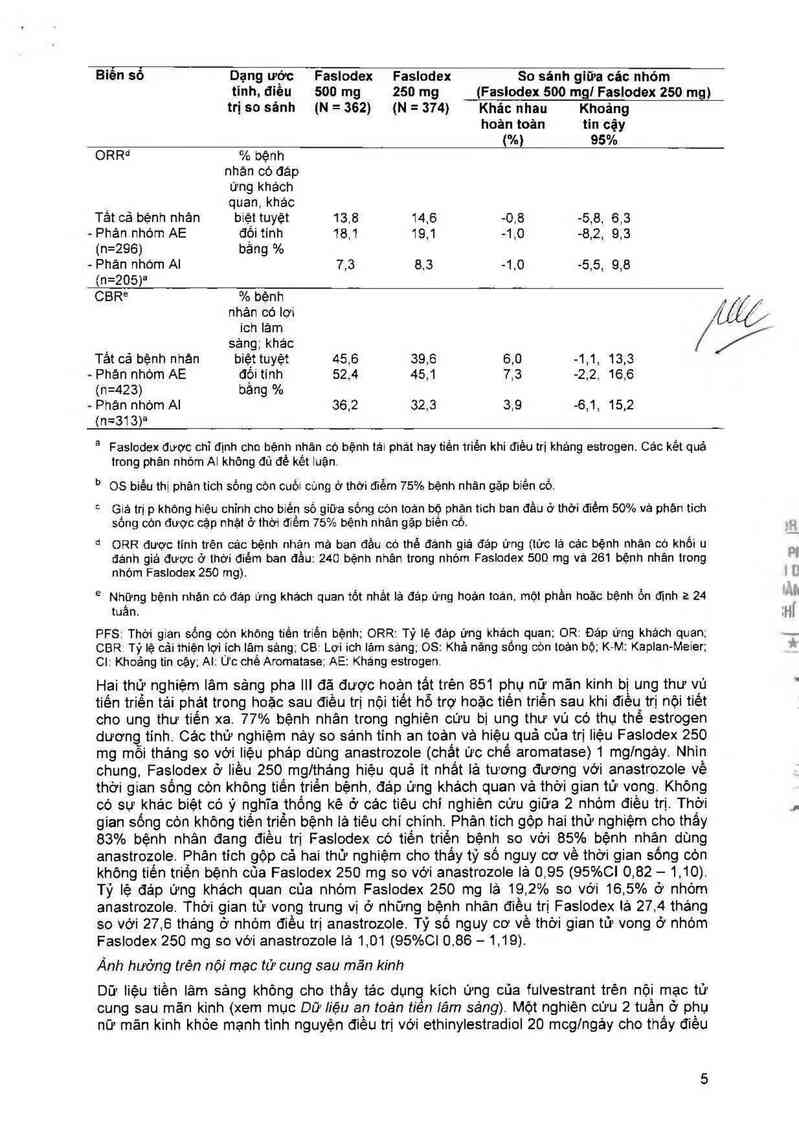
/J…Z
//
Biên so Dạng ước Faslodex Faslodex So sánh giữa các nhỏm
tinh, điêu 500 mg 250 mg (Faslodex 500 mg] Faslodex 250 mg)
trị so sánh {N = 362) (N = 374) Khác nhau Khoảng
hoản toản tin cậy
(%) 95%
ORRd % bệnh
nhán có đáp
ứng khách
quan,khác
Tât cả bệnh nhán biệt tuyệt 13,8 14,6 -0.8 -5,8, 63
— Phản nhóm AE đối tính 181 19,1 -1,0 -8,2, 9,3
(n=296) bằng %
- Phản nhộm Al 7,3 8.3 -1,0 -5,5, 9,8
(n=205)²
CBR° % bệnh
nhản có lợi
ich lâm
sảng;khác
Tảt cả bệnh nhản biệttuyệt 45,6 39,6 6,0 -1,1, 13,3
— Phản nhòm AE đối tính 52,4 45,1 7,3 -2,2. 16.6
(n=423) bầng %
- Phân nhộm Al 36,2 32.3 3.9 -6,1, 15.2
(n=313)²
² Faslodex được chỉ định cho bệnh nhân có bệnh tái phát hay tiến triến khi điều trị khảng estrogen. Các kêt quả
trong phân nhóm Al không đủ để kềt luận
h
05 biểu thị phân tich sõng còn cuối củng ở thời điềm 75% bệnh nhản gặp biên có
° Giá trị p khỏng hiệu chỉnh cho biến số giữa sống cỏn toan bộ phận tich ban đầu ở thời điếm 50% và phán tich
sồng còn được cặp nhật ở thời điềm 75% bệnh nhân gặp biến cỏ.
d ORR được tính trên cảc bệnh nhận mà ban đầu có thẻ đảnh giả đáp ứng (tức lá các bệnh nhân có khổi u
đánh giá được ở thời điếm ban đâu: 240 bệnh nhân trong nhóm Faslodex 500 mg vả 261 bệnh nhân trong
nhóm Faslodex 250 mg).
tuần.
Những bệnh nhân có đáp ứng khách quan tốt nhắt là đáp ứng hoản toản, một phần hoặc bệnh ổn định 2 24
PFS: Thời gian sống còn không tiến triến bệnh; ORR: Tỷ lệ đáp ứng khách quan; OR: Đáp ứng khách quan;
CBR Tỷ lệ cải thiện 1ợi ich lâm sảng; CB: Lợi ich lảm sang; OS: Khả năng sống c0n toán bộ; K- M: Kaplan- -Meier;
01 Khoảng tin cậy; Al: Ưc chê Aromatase; AE: Kháng estrogen.
Hai thử nghiệm lâm sảng pha III đã được hoản tắt trèn 851 phụ nữ măn kinh bị ung thư vú
tiến triển tải phảt trong hoặc sau điều trị nội tiết hỗ trợ hoặc tiến triến sau khi điêu trị nội tiết
cho ung thư tiến xa. 77% bệnh nhân trong nghiên cứu bị ung thư vú có thụ thể estrogen
dương tinh. Các thử nghiệm nảy so sảnh tinh an toản và hiệu quả của trị liệu Faslodex 250
mg môi tháng so với liệu pháp dùng anastrozole (chất ức chế aromatase) 1 mglngảy Nhin
chung Faslodex ở Iièu 250 mg/tháng hiệu quả it nhắt iả tương đương Vởi anastrozole về
thời gian sống còn không tiến triến bệnh đáp ứng khảch quan và thời gian tử vong. Không
có sự khác biệt có ý nghĩa thống kê ở cảc tiêu chỉ nghiên cứu giữa 2 nhóm điều trị. Thời
gian sống còn không tiến triển bệnh là tiêu chí chính Phân tích gộp hai thử nghiệm cho thấy
83% bệnh nhản đang điều trị Faslodex có tiến triển bệnh so vời 85% bệnh nhân dùng
anastrozole. Phân tich gộp cả hai thử nghiệm cho thắy tỷ số nguy cơ về thời gian sống còn
không tiến triển bệnh của Faslodex 250 mg so vời anastrozole lẻ 0 95 (95%C! 0,82 — 1 10)
Tỷ lệ đáp ứng khảch quan của nhóm Faslodex 250 mg lả 19 2% so với 16,5% ở nhóm
anastrozole. Thời gian tử vong trung vị ở những bệnh nhân điều trị Faslodex là 27 4 thảng
so vởi 27, 6 tháng ở nhóm điều trị anastrozole. Tỷ số nguy cơ về thời gian tử vong ở nhóm
Faslodex 250 mg so với anastrozole lá 1,01 (95%CI 0,86 — 1,19).
Ảnh hưởng trên nội mạc tử cung sau mãn kinh
Dữ liệu tiền lâm sảng không cho thấy tảc dụng kỉch ứng của fulvestrant trẻn nội mạc tử
cung sau măn kinh (xem mục Dữ iiệu ah toán tiền iâm sáng). Một nghiên cứu 2 tuần ở phụ
nữ mãn kinh khỏe mạnh tình nguyện điêu trị với ethinylestradiol 20 mcglngảy cho thây điêu
trị trưởc vởi Faslociex 250 mg cho kết quả giảm đáng kể sự kich ứng nội mạc tử cung sau
mản kinh so vởi điêu trị trưởc vởi giả dược, khi được đánh giá bang kỹ thuật siêu âm đo độ
dáy nội mạc tử cung.
Điều trị tản bổ trợ cho bệnh nhản ung thư vú s 16 tuần vởi Faslodex 500 mg hay F_aslodẹx
250 mg không Iảm thay đồi lâm sảng đáng kể trẻn độ dảy nội mạc tử cung, cho thây thuôc
không có tác động chủ vận. Chưa có bằng chứng vẻ tác dụng ngoại ý trên nội mac tử cung
ở bệnh nhân ung thư vú được nghiên cứu. Chưa có dữ liệu ve hinh thái học nội mạc tử
cung.
Trong 2 nghiên cứu ngắn hạn (1 vé 12 tuần) trên bệnh nhân măn kinh bị bệnh phụ khoa
lảnh tính, siêu âm không thấy có sự khác biệt đáng kể về độ dảy nội mạc tử cung giữa
nhóm dùng fulvestrant và giả dược.
Ảnh hưởng trên xuong
Không có dữ liệu nghiên cứu dải han về ảnh hưởng của fulvestrant trên xương. Điều trị tân
bổ trợ cho bệnh nhân bị ung thư vú s 16 tuần vởi Faslodex 500 mg hay Faslodex 250 mg
không cho kết quả lảm thay đổi lâm sảng đáng kể về nồng độ chắt đảnh dắu chu chuyền
xương trong huyết thanh
Trẻ em
Faslodex không được chỉ định cho trẻ em.
Một nghiên cứu pha II, nhản mở, đánh giá tính an toản, hiệu quả vả dược động học của
fulvestrant ở 30 bé gái từ 1 — 8 tuối bị dậy thì sởm tiên triẻn (Progressive Precocious
Puberty) có liên quan tới hội chứng McCune Albright (MAS). Các bệnh nhi nảy được dùng
fulvestrant tiêm bắp vởi liều 4 mglkg hảng thảng. Nghiên cứu 12 tháng nảy đã đánh giá một
nhóm tiêu chỉ về MAS vả cho thắy có sự giảm tần suất chảy máu ãm đạo vả giảm tỷ lệ
trưởng thảnh xương sởm. Nông độ đáy ở giai đoạn ồn định (steady—state trough
concentration) của fulvestrant ở trẻ em trong nghiên cứu nảy tương thich với nồng độ nảy ở
người lớn (xem mục Dược động học). Chưa có những quan ngại mởi về tinh an toản phát
sinh từ nghiên cứu mức độ nhỏ nảy, mặc dù hiện chưa có đủ dữ liệu 5 năm.
ĐẶC TỈNH DƯỢC ĐỘNG HỌC /@
Hẩp thu ./
Sau khi tiêm bắp Faslodex tảo dụng kéo dải, fulvestrant được hảp thu chậm vả nồng độ tối
đa trong huyết tương (Cmax) đạt được sau khoảng 5 ngảy. Dùng Faslodex lièu 500 mg đạt
được nồng đó tiếp xúc ở mức hoặc gản mức liều ở trang thái ổn đinh trong vòng tháng đầu
acv1 bình quán = AUC 475 [33,4%] ng.ngảylml, c:max = 25,1 [35,3%] ng/ml, c…… = 16,3
[25,9%] ng/ml tương ứng). Ở trạng thải Ổn định, nồng độ fulvestrant trong huyết tương được
duy tri chỉ trong khoảng dao động hẹp, vởi khoảng nòng độ đỉnh cao hơn nồng độ đáy tói đa
3 lân. Sau khi tiêm bắp, nồng độ tiép xúc tỉ lệ vởi liều dùng trong khoảng liều 50 — 500 mg.
Phân bố
Fulvestrant phân bố nhanh vả rộng. Thể tích phân bố biếu kiến Iởn ở trạng thái ốn định
(Vdss) khoảng 3-5 l/kg cho thảy sự phân bố ngoải mạch Iởn. Fulvestrant gắn kết cao vởi
protein huyêt tương (99%). Các phân tử lipoprotein tỷ trọng rảt thảp (VLDL), lipoprotein tỷ
trọng thắp (LDL) vả lipoprotein tỷ trọng cao SHDL) lả cảc thảnh phần gắn kết chính. Chưa có
nghiên cứu vè tương tác cạnh tranh găn ket protein. Vai trò của globulin găn két hormone
sinh dục (SHBG) chưa được xác định.
Chuyển hóa
Sự chuyển hóa của fulvestrant chưa được đánh giá đầy đủ, nhưng có Iièn quan đến sự két
hợp của một số tiến trình biến đối sinh học tương tự như các steroid nội sinh. Các chắt
chuyển hóa được xác định (bao gồm chắt chuyển hóa 17-ketone, sulphone, 3-sulphate, 3-vả
17-glucuronide) lá các chất có ít hoat tĩnh hoặc có hoạt tinh tương tự fulvestrant về tác dụng
kháng estrogen. Các nghiên cứu sử dụng chế phẩm từ gan vả cảc men tái tổ hợp ở người
cho thấy CYP3A4 lả isoenzyme P450 duy nhắt liên quan đến quá trình oxy hóa của
fulvestrant; tuy nhiên, trên_in vivo, các đường chuyển hóa không qua P450 chiêm ưu thế
hợn. Dữ liệu in-vitro cho thảy fulvestrant không ức chế isoenzyme CYP450.
Thái trứ
Fulvestrant được thái trừ chủ yêu ở dang chuyền hóa Đường thải trữ chính qua phân, với it
hơn 1% được đảo thải qua nước tiểu. Fulvestrant có độ thanh thải cao,11t1,7 mllphút/kg,
cho thầy tỷ lệ bải tiêt qua gan cao. Thời gian bán hủy sau khi tiêm bắp được chi phối bởi tỷ
lệ hảp thu và ước tính là 50 ngảy
Cảc đối tuơng đăc biẻt
Dữ liệu phản tich dược động học từ các nghiên cứu phạ III cho thắy không có sự khác biệt
vê đảo tính dược động học của fulvestrant ở các độ tuôi (từ 33-89 tuỗi), cân nặng (40-127
kg) hoặc chủng tộc.
Suy thận
Suy giảm chức nảng thận nhẹ và vừa không ảnh hưởng tới dược động học của fulvestrant , _
ở mức độ có ý nghĩa iâm sảng. ẨỨẶ
Suy gan //
Một thử nghiệm lâm sảng đơn liều đă được tiến hảnh nhằm đánh giá đặc tính dược động
học của fulvestrant ở bệnhphán suy gan nhẹ vả vừa (ChiId-Pugh đó A và B). Tiêm bắp với
liêu cao trong thời gian ngăn. Diện tich dưới đường cong (AUC) ở các bệnh nhãn suy gan
tăng tổi đa 2,5 lần so với người tình nguyện khỏe mạnh. Ở những bệnh nhân dùng
Faslodex, việc tảng nồng độ vả thời gian tiếp xúc vởi thuốc ở mức độ nảy được dự kiến lả
dung nạp tốt. Những bệnh nhân bị suy gan nặng (Child-Pugh độ C) chưa được đảnh giá.
Bệnh nhi
Dược động học củagfulve_strant đă được đánh giá trong 1 thử nghiệm lâm sảng trên 30 bé
gái bị dặy thì sớm tiên triên có liên quan đèn hội chứng McCune Albright (xem iịnục Đặctính .
dược iực học). Những bệnh nhi từ 1 - 8 tuòi được dùng` fulvestrant tiêm băp với liêu 4
mglkg/tháng. Trung bình nhân (độ lệch chuẩn - SD) của nộng độ đáy ở trạng thái ôn định _,',l
(Cm-m. ss) vả diện tich dưới đường cong (AUCSS) ước tinh tương_ứng là 4,2 (0.9) ngfml vả _ ,
3680 (1020) ng'giờlml. Mặc dù_cảc dữ liệu thu thập bị giới hạn, nông độ đáy ở trạng thải ỏn
định của fulvestrant ở trẻ em thế hiện tương thich vời nông độ nảy ở người lớn.
TẢ Dược
Ethanol (96%)
Benzyl alcohol
Benzyl benzoate
Castor oil
TƯỜNG KY ,
Do không có nghiên cứu trên tính tương kỵ, thuốc nảy không được trộn lẫn với các thuốc
khảo.
HẠN DÙNG: 4 nảm kế từ ngảy sản xuất.
THẬN TRỌNG ĐẬC BIỆT KHI BẢO QUÀN:
Bảo quản ở nhiệt độ 2°C — 8°C (trong tủ lạnh).
Bảo quản bơm tiêm chứa sẳn thuốc trong bao bì gốc để tránh ánh sáng.
ĐÓNG GÓI: Hộp chữa 2 bơm tiêm chứa sẵn thuốc (5 ml) vả 2 kim tiêm an toản.
THẬN TRỌNG ĐẶC BIỆT TRONG wẸc vưr BÒ VÀ cÁc xử LÝ KHÁC.
Hưởng dẫn sử dung thuốc
Cảnh báo — không được hấp tiệt trùng kin1 tiêm an toản (kim tiêm dưới da BD SafetyGlide
Shielding) trước khi dùng. Phải Iuôn Iuôn đê tay phia sau kim tiêm trong khi tiêm vả vứt bỏ.
Đối với mỗi 2 bơm tiêm:
Tháo bơm tiêm thủy tinh hinh trụ ra khỏi khay vả Hinh1
kiểm tra khộng bị hỏng. .
o Tháo bỏ mièng dản niêm phong ở năp nhựa mảu ]
trăng phủ Iênbơm tiêm Luer nối với dụng cụ Luer- -——f}~r— ,J …
Lok để mở năp cao su phủ trên đâu bơm tiêm. (xem ~ "
Hình 1).
o Bóc mở bao bì bên ngoải kim tiêm an toản (BD Hình 2
SafetyGlide). Găn kim tiêm an toản vảo Luer-Lok.
(xem Hình 2).
Vặn khóa kim tiêm để gắn chặt vảo đằu nói Luer.
Kéo thẳng nắp đậy kim ra khỏi kim để tránh hư đầu
kim.
o Chuyến bơm tiêm chứa sẵn thuốc đên vị trí cần tiêm.
Thảo vỏ kim tiêm.
o Dung dịch tìèm nên được kiềm tra bằng mắt thường
để phát hiện các phần tử lạ vả sự biên đỗi mảu sắc
dung dịch trước khi dùng… /
o Đuôi khi trong bơm tiêm. /aứ
o Tiêm bắp chậm (1-2 phútllần) vác mông. Để thuận Hinh 3
tiện, vị trí góc xiên kim tiêm nên hướng theo đòn bấy
cánh tay. (xem Hinh 3).
o Sau khi tiêm, ngay lập tức ản đầu ngón tay vảo bộ
phận kich hoạt theo hưởng đòn bẩy cánh tay để kích
hoạt bộ phận bao phủ kim tiêm (xem Hinh 4).
Lưu ý: Trảnh va chạm bản thân và người khác khi
kich hoạt. Nghe tiếng 'click’ vả quan sảt thấy đằu kim
đã được đậy kin.
Hưởng dẫn vứt bỏ
Bơm tiêm chứa sẵn thuốc chỉ được dùng một lần.
Bảt kỳ sản phẩm nảo không sử dụng hoặc phế thải nên được vứt bỏ theo quy định tai cơ
sơ.
ĐOC KỸ HƯỞNG DẢN SỬ DỤNG TRƯỞC KHI DÙNG. NỂU CẦN THÊM THÔNG TIN, XIN
HỎI Ý KIỂN CÙA BÁC sÝ.
THUỐC CHỈ DÙNG THEO TOA BÁC sÝ.
THÔNG BÁO CHO BÁC sÝ, DƯỢC SỸ NHỮNG TÁC DỤNG KHỎNG MONG MUỐN GẶP
PHẢI KHI SỬ DỤNG THUỐC.
ĐỂ XA TÀM TAY TRẺ EM.
Ngảy hiệu đinh toa thuốc: Tháng 12|2013.
Faslodex is a trademark of the AstraZeneca group of companies.
@ AstraZeneca 2006—2013
Cơ sở sản xuất vả đóng gói cẩp 1:
Vetter Pharma-Fertigung GmbH & Co. KG
Schũtzenstrasse 87, D-88212 Ravensburg, Đức.
Cơ sở đóng gói cắp 2:
AstraZeneca UK Limited
Silk Road BusineSS Park, Macclesfield, Cheshire SK1O 2NA, Anh.
ONC.OOO-õô2—409.BD
TUQ. cục TRUỜNG
P.TRUỜNG PHÒNG
/Ỉỷayễn quy Jẳìng
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng