















'm/xsk)
Ế
]
C QUANĨ LY DƯỢC
~
ĐA PHÊ DUYÊT
«
BỘYT
CỤ
Lẩn đẩuz..oit…/.de.…/sểỷAẵ…
lO
Og`ĩT/s
1²
Noèy
|
(› roAn1S ụ—I
Ó ẸXJADE ,
deferasirox —ởẦ
ỏ NOV.ARTIS
Ồị EXJADE
deferasirox
ứ IIMWMHIII
v …… am
umgm inniln
Í à__._
Rx-Thuỏc bAn tỔoo don.
Exlade ® sm Mỏi vuân phản lán chửa 500mg deterasnrox
íx 7 wên SĐK' XX—XXXX-XX
đlng chóng chỉ dịnh xin đoc lb hưởng dân sử dung
›ể. 0 Xem 'LOT MFD EXP tiênbaob
bi góc dẻ ttảnhá m
Đọc kỹ huơng dán sử dụng trươc kni dùng.
' Pharma Stein AG Sot-iafthausefsưasse CH- 4332 Stein Switzerland
^EẺRỂJủ
Bì h Dương
SẸNNLMZL [ ' ùng sò 3 KCN Việt Nam- Singapore 2, Thủ Dâu Một linh Binh Duong
HCác thòng
ý xem lrong tờ hương dãn sử dung kèm lheo
“'"Ồ NOVAỄRTIS
ún, ' …rum
… nùlluhd—AutI—nuuvllmmluh
nmpmta…mrmnmpnmntrumn
ửA um…
unlnụmumm nmumnnmnum
mhwmil'ụulùhilh Ilụnmbulmhtihlủt
ĩơnu Mhmụuummm
muldtmrdưudmdclhn lllulijlúffllqlW
hinthnhhlnM. Dodnilllbinúu.
WIII manm
IIamM…yohỂdnnzlh I.Ih…mhmnmmơm
lbmnmlnnúnS'chunumdnnnrịtndựnuuuvưhùhhnùú
… Mnợmuuhdntn Tmm…md u…on
llwhtnh—MỤI—Ủllw hmluld—Ihulluwm
1mmlluhlm- mun…
…IWIJwIn m…. m
mmu.w.…
t.J Í …_
ay 01 oủa mảng hét han … trân bao bi Xuảt xứ Thuy Sỹ Không báo quản trên #0
(mo U! sv saa.wes equeud s_ruenoN
6AỊ)EỊUGẺSJỚGH ;eịqc)
AHẵNNOSSV1 SElĐHOBS~SIHO1
2
;-
d
4
>
0
8
»“
eu-
Nhãn phụ
(được dán sau khi nhập khẩu)
* 'lO'd -…....-nuợ .
…… im
Ế
…
us… 8…
6…
oc…
00. E \\B
.….uũ
K
…H…W a.
. er.
oz
_
Services AG in HCMC
%
Ìê(
Eã
… oom
Ểe
4
so
w…….…JE ,.
ảẫ
eo
m com
mĩ…
cuum…xu
…hd<>OZ
\.ằcâ &… ồ… Ế Ễ
mẽ 8… uc. 8… m 8…
….Ễẵ ầaẵ .…. %…
…Hdấcẳ …HdOZ E.d<>OZ …Hd<>OZ …hd< 02
\
’.lìZDZ
Ú› NOVARTIS
Exjade®
Thuốc lảm chelat hóa sắt
THÀNH PHAN VÀ DẠNG BÀO CHẾ
Mỗi viên nén phản tán chừa 125 mg | 250 mg | 500 mg deferasirox iả hoạt chắt.
Tá dược: Lactose monohydrate; Crospovidone; Microcrystalline cellulose; Povidone
(K30); Sodium iauryl sulphate; Silicon dioxide; Magnesium stearate
CHỈ ĐỊNH
Exjade được chỉ địnhđế điều trị quá thừa sắt mản tính do truyền máu (chứng nhiễm
haemosiderin do truyện mảu) ở bệnh nhân người lớn vả trẻ em (từ 2 tuối trở Ièn).
LIỂU LƯỢNG VÀ CÁCH DÙNG
Khuyên cáo khởi đềm điều trị bằng~Exjado sau khi truyền khoảng 20-đờn vị hồng cầu …
khối (khoảng 100 mL/kg) h0ặc khi có dảu hiệu qua theo dõi trên lâm sảng là quá sắt
mản tinh (ví dụ ferritin huyết thanh >1.000 microgramlL). Liều dùng (tính băng
mglkg) phải được tính và lảm tròn thảnh trọn viên có hảm lượng gần nhat.
Mục tiêu của liệu pháp chelat hóa sắt iả đế Ioai bỏ lượng sắt đã được đưa vảo cơ
thể qua truyền máu, và khi cần, đề Iảm giảm gánh nặng sắt hiện có. Việc quyết định
loại bỏ lượng sắt tich iũy phải tùy thuộc vảo từng cá thể dựa trèn lợi ích lâm sảng
được mong đợi vả nguy cơ của liệu pháp cheiat. 4L
Liều khới đằu ẵ
Liều Exjade khởi đầu hảng ngảy được khuyên cảo lả 20 mg/kg thể trọng.
Có thể xem xét dùng Iiẻu khởi đầu hảng ngảy là 30 mg/kg cho những bệnh nhân
dùng trên 14 mL/kg/thảng hồng cầu khối (khoảng > 4 đơn vị/tháng cho một người
lớn) vả đỏi với những ngưới mả mục tiêu là lảm giảm sự quá thừa săt.
Có thể xem xét dùng Iièu khởi đầu hảng ngảy lả 10 mg/kg cho những bệnh nhân
dùng dưới 7 mL/kg/tháng hòng cầu khối (khoảng f 2 đơn vịltháng cho một người
lớn) và đôi với những người mà mục tiêu là duy trì nỏng độ săt trong cơ thè.
Đối với những bệnh nhân đáp ứng tốt khi điều trị bằng deferoxamine, có thể xem xét
dùng liều Exjade khởi đằu bằng một nửa Iièu deferoxamine (ví dụ một bệnh nhân
đang dùng 40 mglkglngảy deferoxamine, 5 ngảy mỗi tuần (hoặc tương đương) có
thề chuyến sang liều Exjade khởi đầu là 20 mg/kg/ngảy).
Liều duy tri
Khuyên cáo theo dõi nồng độ ferritin trong huyết thanh mỗi tháng và nếu cần thi điều
chinh _lièu_ Exjade mỗi 3-6 tháng dựa trèn các biến chuyên cùa ferritin huyết thanh.
Có thê điêu chỉnh liều từng bước 5—10 mg/kg, phù hợp với đáp ứng của từng bệnh
nhân vả mụcỹtièu đièu trị (điều trị duy trì hoặc iám giảm gánh nặng về sắt). vợt bệnh
nhân dùng liêu 30 mg/kg mả khỏng đủ kiếm soát tinh trạng bệnh (ví dụ nồng độ
ferritin trong huyết thanh vẫn lớn hờn 2.500 microgam/L và không thảy có chiều
hướng giảm nồng độ theo thời gian thì tiêu dùng đên 40mg/kg có thế được xem xét.
Không khuyến cáo ơùng các liều trèn 40 mglkg vì chưa có nhiều kinh nghiệm với
cảc liêu trên mức nảy
Ở bệnh nhản có nỏng độ ferritin huyêt thanh đạt tới mục tìèu điều trị (thường khoảng
từ 500 đến 1 000 microgamlL. sự giảm liêu từng bước từ 5 đến 10rnglkg cản được
xem xét để duy tri nông độ ferritin huyết thanh trong khoảng mục tièu. Nếu ferritin
huyết thanh ha ồn định dưới 500 microgramlL, cản xem xét ngừng điều trị Cũng
như các thuốc chelat hóa sẳt khảc, nguy cơ độc tinh của Exjade có thể tăng Ièn khi
dùng lièu cao một cách không phù hơp cho bệnh nhản có mức gánh nặng về sắt
thắp hoặc có nòng độ ferritin huyết thanh tăng không đáng kể (xem phần CÁNH
BÁO VÀ THẬN TRỌNG ĐAC BIẸT KHI SỬ DỤNG)
Cách dùng
Exjade phải dùng một lần/ngảy khi đói ít nhảt 30 phút trước khi ăn, tốt nhắt lả dùng
vảo cùng một thời đìẻm mỗi ngảy. Viên nén được phản tán bằng ca'ch khuắy trong
một ly nước hoặc nước tác hay nước cam (100-200 mL) cho đên khi đạt được hỗn
dịch mịn. Sau khi uõng hỗn dịch, bắt kỳ lượng cặn nảo cũng đẻu phải được pha lại
thảnh hỗn dịch với một it nước hoặc nước trái cáy vả uống Không được nhai viên
thuốc hoặc nuốt nguyên cả viên. Không khuyến cảo phân tản trong nước có chứa
carbonate (nước soda) hoặc sữa bới sự tạo bọt và phân tản chặm. Xem phần
TƯỜNG KY.
Bệnh nhân cao tuồi
Liều khuyến cảo cho bệnh nhản cao tuồi tương tư như đã mô tả trèn. Trong các thử
nghiệm Iả_m sảng, bệnh nhản cao tuối có tần suất phản ứng bât lợi cao hơn ngườì
lớn trẻ tuôi vả họ cân được theo đõi sảt vẽ các phản ứng bắt iợi vốn có thế cần phải
điêu chỉnh Iièu. 21;
Bệnh nhi Ý/
Liệu khuyến cậo cho bệnh nhi tượng tự như đối với bệnh nhân người tợn. Phải tinh
đên sự thay đòi về cân nặng của bệnh nhi theo thời gian khi tính Iiẻu dùng.
Bệnh nhân bị suy thận
Cần thặn trọng khi dùng Exjade đề điêu trị cho bệnh nhân có nồng độ creatinine
huyết thanh cao hợn giới hạn trên của mức binh thường theo lứa tuồi. Đặc biệt cần
thận trọng với bệnh nhân có độ thanh thải creatinine trong khoảng 40 đến dưới 60
mL/phút nhắt lá trong các trường hợp có kèm theo cảc yêu tố nguy cơ có khả năng
lám suy giảm chức năng thận như cảc thuốc dùng động thời, sự mắt nước, hoặc các
nhiễm khuẩn nặng. Liều khởi đầu khuyến cáo cho bệnh nhản bị suy thận tương tự
như lièu đã mô tả trên. Cần theo dỏi nồng độ creatinine huyết thanh hảng tháng ở
tất cả bệnh nhản và nếu cần có thế giảm lièu hảng ngảy còn 10 mglkg (xem phần
CÁNH BÁO VÀ THẶN TRỌNG ĐAC BIẸT KHI SỬ DỤNG).
Bệnh nhân bị suy gan
Exjade đã được nghiên cứu trong một thử nghiệm Iảm sảng trẻn bệnh nhản suy
giảm chức náng gan Với bệnh nhân có suy gan ở mức độ trung binh (ChiId-Pugh
B), iièu khởi đầu cằn nên được giảm khoảng 50%. Khỏng khuyến cáo dùng Exjade
cho bệnh nhản suy gan nặng (Child — Pugh C) (xem phần CẢNH BÁO VÀ THẶN
TRỌNG ĐẶC BIẸT KHI SỬ DỤNG). Hằu hết các bệnh nhân cần được theo dõi chức
năng gan trước khi bắt đầu điều tri, mỗi 2 tuần trong tháng đằu tiên và mỗi thảng sau
đó (xem phần CÁNH BÁO VÀ THAM TRỌNG ĐẶC BIẸT KHI SỬ DỤNG).
CHỐNG CHỈ ĐỊNH
Quá mẫn cảm với hoạt chắt hoặc với bắt kỳ thảnh phần nảo của tá dược.
Những bệnh nhản hội_chứng loạn sản tủy (MDS) nguy cơ cao và những bệnh nhân
bị các bệnh ác tính vê huyêt học và ngoải huyêt học sẽ không có lợi khi dùng Iỉệu
phảp tạo chelat do sự tiên triến nhanh của bệnh.
Bệnh nhản có độ thanh thải creatine < 40lephút hoặc nồng độ creatine huyết thanh
> 2 lần mức giới hạn trên của mức bình thường phù hợp theo tuôi.
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI sữ DỤNG
Đọc kỹ hưởng dẳn sữ dụng trưởc khi dùng. Nếu cần thêm thông tin, xin hỏi ý
kiến bác sĩ.
Thuốc nảy chỉ dùng theo sự kê đơn của bác sĩ.
Quyết định thải trừ sắt tich tụ cằn được cản nhắc cho từng cá thể bệnh nhân dưa
trèn lợi ích vả nguy cơ Iâmcảng của liệu phảp chelat hóa theo dự đoán (xem phân
LIEU LƯỢNG VA CÁCH DUNG).
Cần thặn trọng với bệnh nhân cao tuồi do có tần suất cao hơn về các phản ứng bảt
lợi. ặ
vè thặn
Dã ghi nhận creatinine huyết thanh tảng không lièn tục ở những bệnh nhân được
điều trị bằng Exjade, thường thì trong khoảng bình thường. Cảc trường hợp suy
thận câp đã được bảo cáo khi sử dụng Exjade trong giai đoạn hậu tiêp thị (xem
phản PHÀN ỪNG BÀT LỢI CÙA THUOC). Hiếm trường hợp suy thện cắp cần thầm
tảch máu.
Khuyên cáo đậnh giá creatinine huyết thanh vả/hoặc độ thanh thải creatinine 2 lằn
trước khi băt đâu điều trị và sau đó theo dõi hảng tháng.
Bệnh nhản có sẳn bệnh thận, hoặc bệnh nhân đang dùng những thuốc có khả náng
lám suy giảm chức nảng thận có thẻ có nguy cơ bị biên chứng nhiều hơn. Ở những
bệnh nhân nảy việc kiêm tra creatinin huyết thanh vảlhoặc độ thanh thải creatinine
được khuyến cáo thực hiện mỗi tuần trong tháng đầu tiên sau khi bắt đầu trị liệu
hoặc sau khi thay đồi trị liệu, và mỗi tháng sau đó. Cần thận trọng ở bệnh nhân có
độ thanh thải creatinine từ 40 đên dưới 60 mL/phút, đặc biệt trong trường hợp có
kèm theo các yêu tô nguy cơ có khả nảng lảm suy giảm chức năng thận như các
thuốc đùng đồng thời, sự mắt nước, hoặc các nhiễm khuản nặng.
Bệnh iý ống thận đã được báo cáo trèn bệnh nhản điều trị bằng Exjade. Phần lớn
bệnh nhản nảy lá trẻ em vả trẻ vị thảnh niên có bệnh Beta- thaiassemia và nồng độ
ferritin huyêt thanh < 1.500 microgamlL.
Xét nghiệm protein niệu phải được tiên hảnh hảng tháng.
Cần chú ý bỏi phụ nước đầy đủ cho những bệnh nhản đang bị tiêu chảy hoặc nôn.
Đối với bệnh nhân người lớn, tiều Exjade hảng ngảy có thế giảm còn 10 mg/kg nếu
có tăng không tiến triến nồng độ creatinine huyết thanh hơn 33% trên nộng độ trung
bình từ cảc xét nghiệm trước khi điều trị trong 2 iần kiếm tra liên tiếp và không thể
quy cho nguyên nhản nảo khác (xem phần LIỆU LƯỢNG VÀ CÁCH DÙNG). Đối với
bệnh nhi có thể giảm lièu còn 10 mglkg nếu nồng độ creatinine huyềt thanh tảng
cao hợn giới hạn trên cùa mưc binh thướng theo tuồi ở 2 tần kiềm tra liên tiếp
Nếu creatinine huyết thanh tăng tiền triền vượt hợn giới hạn trên của mức binh
thường thì phải ngừng Exjade Có thể khởi đầu điêu trị Exjade trở lại tùy theo tình
trạng lảm sáng cùa bệnh nhân
Về gan
Exjade không được khuyên cáo cho bệnh nhản bị suy gan nặng (ChiId-Pugh C)
(xem phần LIỆU LƯỢNG VÀ CÁCH DÙNG vả DƯỢC LÂM SANG) Trị liệu Exjade
chi được bảt đầu với bệnh nhản có mưc men transaminase gan lúc ban đầu đến 5
lần giới hạn trẻn của mữc binh thường. Dược động học của Deferasirox khỏng bị
ảnh hướng bởi những nồng độ transaminase như vậy. Deferasirox chủ yếu thải trư
bằng phản ứng glucuronic hóa và một lượng nhỏ (khoảng 8% ] chuyến hóa bởi sự
oxi hóa qua cytochrorne P450 (xem phần DƯỢC LÀM SÀNG)
Mặc ưù it gặp (0,3%), tảng các men transaminase hơn 10 lần mức trẻn của giội hẹn
bình thường, gợi ý tình trạng viêm gan, đă được quan sát thấy trong các thử nghiệm
iảm sảng. Có nhửng bảo cáo hậu măi về suy gan ở những bệnh nhân được điều trị
bầng Exjade. Hầu hêt những báo cảo về suy gan đêu liên quan đến những bệnh
nhân bị mảc phối hợp nhiều bệnh nặng bao gồm cả xơ gan và suy đa cơ quan, tử
vong đă được bảo cáo ở một vải trong số những bệnh nhản nảy (xem phần PHÁN
ỨNG BÁT LỢI CÙA THUOC). Nồng độ transaminase huyêt thanh, bilirubin,
phOSphatase kiềm cản được theo dõi trước khi bắt đầu điều trị, mỗi 2 tuần trong
tháng đằu tiên và mỗi thảng sau đó, Phải ngừng dùng Exjade nều nồng độ
transaminase trong huyết thanh tảng iiẻn tục vả tiền triến mà không thể quy cho
nguyên nhân nảo khác Một khi đã xác định rõ nguyên nhản của các bất thường về
xét nghiệm chức năng gan hoặc sau khi xét nghiệm chức náng gan đã trở về binh
thường, có thể cản nhắc bắt đâu điệu trị Exjade trở lại một cách thận trọng với một
lièu thâp hơn, sau đó tảng liều dần dân.
Về tiêu hóa
Kích ưng đường tiêu hóa có thề xẩy ra trong quá trinh điều trị với EXJADE. Loét vả
xuảt huyêt đường tiêu hóa trên đã được báo cáo ở các bệnh nhán, bao gồm cả trẻ
em vả thiêu niên dùng EXJADE. Rầt hiếm trường hợp tử vong do xuất huyết đường
tiêu hóa được báo cảo, đặc biệt ở người lớn tuồi bị bệnh máu éc tính giai đoạn nặng
vả/hoặc bị giảm tiều cầu Nhiều ố Ioét đă được quan sát thấy ở một số bệnh nhản
(xem phần PHẢN ỪNG BÀT LỢI CÙA THUOC). Bác sĩ và bệnh nhân phải cảnh giác
với các đầu hiệu vả triệu chứng của loét vả xuất huyết tiêu hóa trong khi điều trị
bằng EXJADE vả phải bắt đầu ngay lập tức việc kiểm tra vả điều trị thêm nếu nghi
ngờ có một biến có bất lợi nghiêm trọng của đường tiêu hóa.
Thận trọng với những bệnh nhân đang dùng EXJADE kết hợp với những thuốc
được biết là có khả năng gảy Ioét như các thuộc kháng viêm không steroid (NSAID),
corticosteroid hoặc bisphosphonate đường uống, vả cảc bệnh nhản đang dùng
thuộc chống động (xem phần TƯỜNG TÁC) và các bệnh nhân có số lượng tiểu câu
dưới 50 x 10%
Các rổi Ioạn về da
Có thế có nối ban ở da trong khi điều trị bằng Exjade. Đối với ban mức đó nhe đên
trung bình, có thể tiếp tục dùng Exjade mã không cần điều chỉnh liều, vì ban thường
tự mắt đi. Đối với ban nặng hơn, có thế cần phải ngừng điêu trị, có thể dùng Exjade
trớ iại sau khi đã hết ban, với một Iièu thấp hơn, sau đó tăng liều dần dần. Trong
tmtờng hợp nghiêm trọng có thể tiến hảnh điều trị trở lại phối hợp với một thuốc
steroid đường uống dùng trong thời gian ngắn. Hiếm trường hợp báo cáo vẻ hông
ban đa dạng trong thời gian trị iiệu Exjade.
Các phản ứng quả mẫn
Các trường hợp hiếm gặp bị các phản ứng quả mẫn nghiêm trọng (như phản ứng
phản vệ, phù mạch) đã được báo cáo ở những bệnh nhán dùng Exjade với khởi
phát phản ứng xảy ra ngay trong tháng đầu điều trị ở phần lớn các trường hợp (xem
phần PHÁN ỨNG BÁT LỢI CUA THUOC). Nếu các phản ứng xảy ra nặng, phải
ngừng dùng Exjade và phải tiến hảnh can thiệp y khoa thích hợp.
Thị giác và thinh giác
Rối Ioạn thinh giảc (nghe giảm) vả rối toạnở mắt (đuc thủy tinh thè) đá được ghi
nhặn trong khi điều trị băng Exjade (xem phận P_HAN ƯNG BÁT LỢI CỤA THUOC).
Khuyên các xét nghiệm vê thính giác và vẻ măt (bao gòm soi đáy măt) trước khi
~khởi đèu điều trị bằng Exjade vù ở những khoảng cóoh đồu đặn eau đó (mỗi 12
tháng). Nếu thấy có rối Ioạn, có thể cân nhăc giảm liêu hoặc ngừng dùng thuôc.
Các rối loạn về máu
Có những báo cảo hậu mâi (cả tư phảt vả từ những thử nghiệm lâm sáng) về giảm
tế bảo mảu ở bệnh nhản điều trị với Exjade. Hầu hét cả bệnh nhân nảy đều có
những rối loạn về máu từ trưởc thường liên quan đến suy tủy xương (xem phân
PHÀN ỨNG BẢT LỢI CÙA THUOC). Mối iiẻn hệ giữa những triệu chứng nảy Với
việc dùng thuốc Exjade lá không chắc chản. Để đảm bảo việc quản lý lâm sảng
chuẩn đối với những rối loạn về máu nảy, phải kiểm tra công thức mảu thường
xuyên. Ngừng điều trị với Exjade phải được xem xét ở những bệnh nhân bị giảm tế
bảo mảu không giải thích được. Điều trị lại với Exjade có thế được xem xét một khi
nguyên nhản lảm giảm tế bảo máu đã được sáng tò.
Các lưu ý khác
Khuyên các xét nghiệm territin huyết thanh mỗi tháng để đánh giá đáp ứng của bệnh
nhân với điều trị (xem phần LIÊU LƯỢNG VÀ CÁCH DÙNG). Với bệnh nhân có
nộng độ ferritin huyêt thanh đạt đèn mục tiêu điêu trị (thường trong khoản từ 500
đên 1.000 microgam/L). Việc giảm liều Itữ từ từng bước 5 đến 10 mg/kg cẵn được
xem, xét để duy trì nông độ ferritin huyêt thanh trong khoảng mục tiêu. Nếu ferritin
huyêt thanh hạ ồn định dưới 500 microgram/L, cần xem xét ngững điều trị. Cũng
như với điêu trị chelat hóa sắt khác, nguy cơ nhiễm độc Exjade có thẻ tảng lèn khi
dùng liều cao không thích hợp cho những bệnh nhản bị gánh nặng về sắt không
nhiều hoặc mức ferritin huyết thanh chỉ tảng nhẹ.
Exjade không Iièn quan với chặm tăng trưởng ở trẻ em được theo dõi đến 5 nảm
trong các thử nghiệm lảm sảng. Tuy nhiên như iả biện pháp thận trọng chung, có thế
theo dỏi thể trọng về sự tảng trưởng chiều cao cùa bệnh nhì ở các khoảng cách đèu
đặn (mỗi 12 tháng).
Không được phối hợp Exjade với liệu pháp dùng chất chelat hóa sắt khảc vi tinh an
toản của sự phối hợp nảy chưa được xảo định.
Viên nén có chứa Iactose (1,1 mg Iactose đói với mỗi mg dẹterasirox). Thuốc nảy
không khuyến cáo dùng cho bệnh nhân bị các rối Ioạn di truyền hiếm gặp về không
dung nạp galactose, thiếu hụt Iactase trầm trọng hoặc kém hấp thu glucose-
galactose.
Đối với người điều khiến phương tiện vả vận hảnh máy
Chưa có nghiên cứu nảo về ảnh hướng của Exjade đến khả năng lải xe và vận hảnh
mảy móc được thực hiện. Bệnh nhản có thế có tác dụng bắt lợi không thường gặp
như chộng mặt hoa mắt cần thận trọng khi lái xe hay vận hảnh máy
TƯỜNG TÁC THUỐC
Thuốc lảm giảm tiếp xúc toản thân Exjade
Trong một nghiên cứu trèn người tinh nguyện khỏe mạnh, việc dùng động thời (đờn
liều 30mg/kg) với rifampicỉn lẻ một chắt cảm ưng mạnh UDP-
gtucuronosyltransfẹrase (UGT) (Iièu lặp lại 600 mg/ngảy) dần đến sự giảm mức tiếp
xúc deferasirox xuông 44% Do đó, việc sử dụng đồng thời Exjade với cảc thuộc gảy
cảm ứng mạnh với UGT (ritampicin, phenytoin, phenobarbital… ) có thế lảm giảm
hiệu quả của Exjade. Nếu dùng đồng thới Exjade vả chắt cảm ứng mạnh UGT, việc
tăng liều Exjade cần được xem xét trèn cơ sở đảp ứng điều trị Iảm sảng.
Tương tác với thức ăn
Sinh khả dụng của deferasirox tăng đến một khoặng thay đồi khi được dững c_ùng
với thức ãn. Vi vặy phải dộng Exjade khi đói it nhât 30 phút tỊước khi ăn, tột nhảt lả
vảo cùng một thời đièm mõi ngảy (xem phản LIỆU LƯỢNG VA CÁCH DUNG).
Tương tảc với Miđazolam vả cảc chẳt chuyển hóa bới CYP3A4
Trong một nghiên cứu trèn người tình nguyện khỏe mạnh việc dùng đồng thời
EXJADE vả midazolam (lả một chắt nèn CYP3A4) lảm giảm mưc tiếp xúc
midazolam xuống 17%. Trong thực tế lảm sảng, tảo dụng nảy thảy rõ rảng hơn. Do
tình trạng giảm tác dụng có thể xảy ra, phải thận trọng khi dùng deferasirox cùng với
cảc thuốc được chuyên hòa qua CYP3A4 (vi dụ như ciclosporin, simvastatin, các
thuốc tránh thai nhộm nội tiết tố).
Tương tác với Repaglinide vả cảc tác nhân chuyền hóa qua CYPZCB
Theo mộtnghiộn cữu trèn ngưới tình nguyện khỏe mạnh, việc sử dụng động thời
Exjade (liêu nhăc lại 30mglkg/ngảy) vả Repaglinide — cơ chảt CYP2C8 (đớn liêu
0,5mg) dần đến sự táng diện tỉch dưới đường cong AUC vả C,… của repaglinide Ièn
131% (90% CI: 103% to 164%) vả 62% (90% Cl_: 42% to 84%) theo thứ tự. Khi dùng
động thời Exjade vả repaglinide, cân theo dội cản thận nồng độ glucose. Khộng thể
Ioại trữ tương tảc giữa Exjade vả các cơ chảt CYP2CB khác như paclitaxel.
Tương tác với theophylline và các tác nhân chuyền hóa bới CYP1A2
Theo một nghiên cưu trèn người tình nguyện khỏe mạnh, việc sử dụng động thời
Exjade (liều lặp lại 30mglkg/ngảy) vả Theophyline — cơ chắt của CYP1A2 (Iièu đơn
120mg) dẫn đến sự tảng diện tich dưới đường cong AUC của theOphyiíne lên 84%
(90% CI: 73% to 95%). Nộng độ thuộc tối đa C,… khi dùng một Iièu đơn không bị
ảnh hướng nhưng khi dùng với liêu lặp đi lặp lại, nộng độ tối đa Cmax của
theophylline tảng Ièn Khi dùng động thời Exjade vả theophylline, cần thưc hiện theo
dõi nỏng độ theophylline vả có thể xem xét giảm liều theophylline nếu cần thiết Sự
tượng tảo giữa Exjade vá cảc cơ chảt khác cùa CYP1A2 có thể xảy ra.
Các thòng tin khác
Chưa thắy tương tác nảo giữa Exjade vả digoxin ở người tình nguyện khoẻ mạnh
Chưa có nghiên cứu chinh thức về việc dùng đòng thời Ẹxjade vả vitamin C. Liều
vitamin C đên 200 mglngảy không kèm theo cảc hậu quả bât lợi.
KHỘNG KHUYÉN CÁO I_JÙNG ĐÔNG THỜI VỚI CÁC THUỐC ĐÃ ĐƯỢC DỰ
ĐOAN có sự TƯỜNG TAC
Chưa có nghiên cứu chính thức về việc dùng đồng thời Exjade vả các chế phầm
khảng acid chứa nhòm. Khòng được dùng viên nén Exjade vởi cảc chế phẩm kháng
acid chứa nhỏm mặc dù đeterasirox có ái lực đỏi với nhôm thấp hơn so với sắt.
Dùng đồng thời Exjade vởi cảc thuốc được biét có khả nảng gáy loét như các thuốc
chống viêm không steroid NSAID, corticosteroiđ, hoặc bisphosphonat đường uõng,
vả dùng Exjade cho bệnh nhân đang điều trị thuôc chống động có thề iảm tảng nguy
cơ gây kich thích đường tiêu hóa (xem phần CÀNH BAO VÀ THẶN TRỌNG ĐẶC
BIẸT KHI SỬ DỤNG)
PHỤ NỮ có THAI VÀ cnc con BÚ
Có thai
Chưa có dữ liệu lâm sảng về việc dùng đeferasirox khi mang thai. Các nghiện cứườ
động vật đã cho thây một số độc tỉnh vệ sinh sản ở tièu độc cho vật mẹ (xem phản
CAC DưLtt-ỊU ~AN TOÀN TtỂN LÂM SÀNG). criưa ro khả nảng vènguy … đói với
người.
Để thận trọng, khuyến cáo khỏng dùng Exjade trong thai kỳ trừ khi thật sự cần thiét.
Cho con bú
Trong các nghiên cứu ở động vật, độ ghi nhặn deferasirox được bải tiết nhanh và
mạnh vảo sữa cùa vặt mẹ. Chưa thây tác dụng trèn con. Chưa rõ deferasirox có
được bải tiêt vảo sữa người hay khộng. Không khuyên cáo cho con bộ trong khi
đang dùng Exjade. %
LÁ! XE VÀ VẬN HÀNH MÁY MÓC
Chưa có nghiên cứu được thực hiện về tác dụng của Exjade trẻn khả năng lái xe
hoặc vận hânh máy móc. Những bệnh nhân thỉnh thoảng gặp tác dung phụ chóng
mặt cả_n thặn trọng khi lái xe hoặc vận hảnh máy móc (xem phần PHẢN ỪNG BẢT
LỢI CUA THUỐC).
PHÀN ỪNG BÁT LỢI CÙA THUỐC
Những phản ứng bảt lợi thường gặp nhất đã được ghi nhặn trong khi điều trị kéo dải
với Exjade ở bệnh nhân người lớn và trẻ em bao gồm các rối loạn tiêu hóa trong
khoảng 26% bệnh nhân (chủ yếu iả buồn nôn, nòn, tiệu chảy hoặc đau bụn ) vả nối
ban dạ khoảng 7% bệnh nhản. Những phản ứng nảy phụ thuộc iièu dùng, hẳu hết là
nhẹ đện trung binh, nỏi chung chỉ thoáng qua và hầu hét mất đi ngay cả khi tiếp tục
điều trị. Tăng creatinine huyêt thanh nhẹ, không tiến triền, hầu hết lá trong mức bình
thường, xảy ra trong khoảng 34% bệnh nhản. Tinh trạng tảng cretinin nảy phụ thuộc
liều dùng, thường tự thoái lui và đôi khi có thế giảm đi bằng cảch giảm liều (xem
phần CÀNH BÁO VÀ THẬN TRỌNG ĐẬC BIẸT KHI SỬ DỤNG).
Đã có báo cáo về các trường hợp tăng transaminase gan trong khoảng 2% bệnh
nhản. Những trường hợp nảy không phụ thuộc Iièu vả phần iớn số bệnh nhân náy
đá có nông độ men tảng trước khi dùng Exjade. Tảng transaminase cao hơn gâp 10
lần giới hạn trèn cùa mức bình thướng- gợi ý viêm gan— lả trường hợp ít gặp (0,3%)
Có những báo các hậu mải về suy gan ở những bệnh nhản được điều trị bằng
Exjade Hầu hết những báo cảo vê suy gan liên quan đến những bệnh nhản mảc
động thời nhiều bệnh nặng bao gổm cả xơ gan vả suy đa cơ quan; tử vong đá được
bảo cáo ở một vải trong số những bệnh nhân nảy.
Cũng như điều trị bằng chảt chelat hóa sắt khảc, mảt thinh tưc đối với tần số cao và
đục thùy tinh thẻ (đục thủy tinh thể sớm) thỉnh thoảng đã quan sát thấy ở bệnh nhản
được điêu trị bằng Exjade (xem phần CÁNH BÁO VÀ THẶN TRỌNG ĐẶC BIẸT KH)
SỬ DỤNG)
Các phản ứng bảt lợi của thuốc, được liệt kê trong Bảng 1, được bảo các trong các
thử nghiệm lảm sảng theo sau điều trị bằng Exjade Các phản ứng bầt lợi được xếp
dưới đảy sử dụng quy ước sau: rảt hay gặp (> 1/10) hay gặp (_ 1l100, < 1710); it
gặp (> 111. 000, < 1l100), hiếm gặp (> 1/10 000, < 111. 000); rất hiếm gặp (<
1/10 000). Trong mỗi nhộm xếp theo tần suất, các phản ứng bắt iợi được trình bảy
theo thứ tự nghiêm trọng giảm dần
Bảng 1 Các phản ứng bắt tợì của thuốc được báo cáo trong cảc thử
nghiệm Iám sảng
Rối loạn tâm thần
ít gặp: Lo ảu, rối loạn giầc ngủ
Rỏt loạn hệ thản itlnh
Hay gặp: Nhức đầu
it gặp: Chóng mặt
Rối loạn về mắt
Ỉt gặp: Đụcthủy tinh thể giet đoạn đầu, bệnh hoáng điềm
Hiếm gặp: Viêm đảy thần kinh thị giác
Rối loạn tai vả mê đạo
ìt gặp: Mất thinh lực À;
Rối loạn hô hắp. ngực vả trung thắt ý
Ít gặp: Đau họng và thanh quản
Rối loạn tiêu hóa
Hay gặp: Tiêu chảy, tảo bộn, nôn, buồn nộn, đau bụng, chướng bung,
khó tiêu
it gặpz Xuảt huyết tiêu hộa, loét dạ dảy (bao gồm cả loét đa ồ), Ioét
tá trèng, viêm dạ dảy.
Hiếm gặp: Viêm thực quản
Rối Ioạn gan mật
Hay gặp: Tăng transaminase
Ỉt gặp: Viêm gan, sỏi mật
Rối loạn da vả mô dưới da
Hay gặp: Ban, ngứa
it gặp: Rối loạn sắc tố
Hiếm gặp Hồng ban đa dạng
Rối Ioạn thận và tiết niệu
Rắt hay gặp; Tăng creatinine mảu
Hay gặp: Protein hiệu
Ít gặp: Bệnh lý ổng thận (hội chứng Fanconi)
Rối Ioạn toản thán và tinh trạng tại chỗ dùng thuốc
ít gặp: Sốt, phù, mệt mỏi
Danh sách các phản ứng bắt lợi của thuốc từ những báo cáo tự phát hậu mải
Cảc phản ứng bất iợi được báo các tư phát được trinh bảy trong Bặng 2, lá những
báo các tự nguyện và thường khộng thể xác lập tần suất hoặc mội quan hệ nhản
quả với việc dùng thuốc.
Báng 2 Cảo phản ứng bất iợi cùa thuốc nhận được từ những báo cáo tự
phát
Rối loạn thặn và tiết niệu
Suy thặn cảp (chủ yêu lả creatinin huyết thanh tăng 2 2 lần giới hạn trẻn của
mức bình thường và thường hồi phục sau khi ngừng điêu trị), bệnh lý ống
thặn-mô kẽ.
Rối Ioạn gan mật
Suy gan
Rối loạn da vả mô dưới da
Vịẻm mao mach quá mắn(leukocvtọclastic vasculitis), máy đay, rụng tóc.
Rối loạn hệ miễn dịch
Các phản ứng quá mẫn (bao gồm phản ứng phản vệ vả phù mạch)
Có các báo cáo hậu mãi (cả báo cáo tự phảt vả báo cảo từ thử nghiệm lảm sảng) về
các chững giảm tế bảo mảu bao gồm giảm bạch cầu trung tinh, giảm tiếu cầu vả iảm
trầm trọng thêm tinh trạng thiếu mảu ở bệnh nhân điều trị với Exjade. Hầu hét cảc
bệnh nhân nảy đều đã có sẵn các rối ioạn vê máu có thường kết hợp với suy tủy
xương (xem phần CẢNH BÁO VÀ THẶN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG). Chưa
rõ mối quan hệ của các tinh trạng nảy với trị liệu Exjade.
Với bệnh nhi: 'Ề
Bệnh lý ống thận đá được bảo cáo trèn bệnh nhản điều trị bằng Exjade. Phận lớn
bệnh nhân nảy lả trẻ em vả thiêu niên có bệnh Beta—thaiassemia và nông đô ferritin
máu thảp < 1.500 microgram/L
Thòng báo cho bác sĩ những PHÁN ỨNG BÁT LỢI CÙA THUỐC gặp phải khi
sử dụng thuôo.
QUÁ LIEU
Các trường hợp quá liều (gâp 2 đến 3 lần Iièu được kê trong nhiều tuần) đã được
báo cáo. Trong một trường hợp, điêu náy gây viêm gan cận lâm sảng (không có
biẻu hiện lâm sảng) nhưng tự khỏi mã không gây hậu quả lâu dải sau khi ngững
thuốc. Các liêu đơn 80 mglkg ở bệnh nhân thalassaemia bị quá tải sắt đã được
dung nạp, chỉ ghi nhận có buổn nôn nhẹ vá tiêu chảy. Liều đơn đên 40 mglkg ở
người binh thường được dung nạp tốt.
Các đắu hiệu quệ liều cấp tinh bao gồm buồn nôn, nôn, nhưc đầu vả tiêu chảy. Có
thế điêu trị quá liêu băng cách gảy nòn hoặc rửa dạ dảy và điêu trị triệu chứng.
DƯỢC LỰC HỌC
Cơ chế tác dụng
Deferasirox là một thuốc iâm chelat hóa có hoạt tính dùng đường uống có tính chọn
iọc cao đói với sắt ili. Phân tử deferasirox gòm ba nhánh gắn vảo sắt với ái lực cao
theo tỷ lệ 2:1. Deferasirox Iảm tảng cường bải tiêt sắt, chủ yếu qua phân.
Deferasirox có ải tực thảp đối với kẻm vả đồng, khộng gảy ra nồng độ thắp liên tục
trong huyết thanh của những kim loại nảy.
Dược tực học
Trong một nghiên cứu về chuyên hóa đối với cân bằng sắt trên những bệnh nhân bị
bệnh thiêu máu Địa Trung Hải (Thalassaemia) bị quá tải sắt, Exjade với các Iiẻu
hảng ngảy 10, 20 vả 40 mg/k đã tạo ra bèi tiết sắt thực trung binh lả 0,119 mg
sắng thế trọnglngảy đối với ịi U 10 mglkg, 0,329 mg săng thề trọng/ngảy đối với
liều 20 mglkg và 0,445 mg sắng thế trọnglngảy đối với liều 40 mglkg.
Exjade đă được nghiện cứu trên bệnh nhản người iớn và trẻ em (từ 2 tuối trở Ièn) bị
quá tải sắt mản tính do truyền máu. Tình trạng bệnh chính cần truyền máu bao gòm
bệnh thalassemia beta, bệnh hồng cảu hinh liềm vả cảc bệnh thiếu máu bâm sinh v_ảt
mắc phải khác (hội chứng Ioạn sản tủy, hội chứng Diamond-Blackfan, thiếu máu bât
sản và các thiêu mảu hiếm gặp khác).
_ Điều trị hảng ngảy bảng Exjade với các liều 20 và 30 mglkg trong một năm cho
những bệnh nhản người iớn vả trẻ em được truyền máu thường xuyến do bệnh
thalassemia beta đã dẫn đến giảm cảc chỉ số sắt toản phần trong cơ thề; nồng độ
sắt ở gan giảm trung bình khoảng -0,4 mg sắtlg gan (trọng lượng khó khi sinh thiết)
ở liều 20 mglkg và -8,9 mg sắt/g gan ở liều so mglkg, vả ferritin huyêt thanh giảm
trung bình khoảng -36 ngL ở iièu 20 mg/kg vả —926 uglL ở liều 30 mglkg. Khi dùng
cưng những iièu nảy tỷ lệ giữa bải tiết sắt trện thu nhận sắt te 1,02 (bỉếu thị cân bằng
săt thực) vả 1,67 (biều thị Ioại bò sắt thực) tương ứng. Exjade tạo ra đáp ứng tương
tự ở bệnh nhản bị các bệnh thiêu mảu khác có quá tải sắt. Liều dùng hảng ngảy 10
mglkg trong một nảm có thể duy tri nồng độ sắt ở gan vả nồng độ ferritin trong huyết
thanh, vả tạo ra cân bảng sắt thực sự ở những bệnh nhân truyền máu không thường
xuyên hoặc truyền thay mảu. Ferritin huyệt thanh được đánh giá bảng cách theo dõi
háng tháng đã phản ánh các thay đồi nông độ sắt trong gan cho thắy iả cảc biên
chuyền của ferritin huyết thanh có thế được dùng để theo dõi đáp ứng với điều trị.
Đối vởi bệnh nhân có iắng đọng săt ờ tim (MR! T2*<20ms) được điêu trị với Exjade
đèu cho thảy sự thải trư sắt lắng đọng được chững minh bởi quá trinh cải thiện giá
trị T2' trong hơn ba năm theo dõi. 0 bệnh nhản không có lắng đọng sắt ở tim,
Exjade đã cho thấy có tác dụng ngăn ngừa về lâm sảng sự lắng đọng sảt trong tim
có liên quan (duy tri T2* > 20ms) trong hơn 1 nảm quan sát, mặc dù vần tiêp tục
được truyền máu đáng kề.
DƯỢC ĐỘNG HỌC
Hấp thu
10
Deferasirox được hấp thu sau khi dùng đường uống với thời gian trung bình đạt
được nông độ cao nhảt trong huyêt tương (tmax) khoảng 1,5 — 4 giờ. Sinh khả dụng
tuyệt đối (diện tích dưới đường cong nồng độ - AUC) của deferasiroxộ viên nén
Exjade khoảng 70% so Với một liều tiêm tĩnh mach Tống lượng thuốc tòn lưu (diện
tich dưới đường cong) xắp xỉ gấp đôi khi dùng cùng với bữa ăn sảng nhiều chảt béo
(hảm lượng chât béo > 50% calo) vả khoảng 50% khi dùng cùng với bữa ăn sáng
chuẩn. Sinh khả dụng (diện tích dưới đường cong nồng độ) của deferasirox táng lên
vừa phải (khoảng 13—25%), khi được dùng trưởc bữa ăn 30 phút vởi hảm lượng chất
béo binh thường hoặc cao. Tổng iượng thuộc tồn lưu (diện tich dưới đường cong
nồng độ) đối với deterasirox sau khi uống viên nén được phản tán trong nước cam
hoặc nước táo tương đương với sau khi phân tán trong nước (tỷ lệ AUC tương đôi
là 103% khi dùng nước cam vả 90% khi dùng nước táo).
Phản bố
Deferasirox liên kết mạnh với protein huyết tương (99%). hầu như duy nhảt iả
albumin huyêt thanh, vả có thẻ tich phản bô nhỏ vảo khoảng 14 L ở người lớn.
Biến đối sinh học
Glucuronide hóa iả đường chuyển hóa chinh đổi với deferasirox, sau đó bái tiết qua
mật. Sự khử Iièn hợp các glucuronide ờ ruột vá tái hảp thu sau đó (chu trinh gan-
ruột) có thể xảy ra. Deferasirox chủ yếu được glucuronide hóa bởi UGT1A1 vẻ với
một mức độ it hơn bới UGT'IA3. Sự chuyển hóa deferasiifox qua sự dị hóa CYP450
(oxy hóa) dường như rảt ít ở người (khoảng 8%). Chưa thảy sự ức chế chuyền hóa
deferasirox do hydroxyurea in vitro. Deferasirox trải qua chu trình gan ruột. Trong
một nghiên cứu trẻn người tinh nguyện khỏe mạnh, dùng choiestyramine sau một
Iièu đơn deferasirox dẫn đên giảm 45% mức tồn lưu của deferasirox (AUC)
Thải trừ
Deferasirox và các chảt chuyền hộa cùa nó chủ yếu được bải tiết qua phân (84%
liệu dùng). Bải tiẻt deferasirox vả các chảt chuyến hộa của nó qua thận rât ít (8%
liệu dùng). Thời gian bán thải (t1)2)trung bình từ 8 đên 16 giờ.
sư tuyển tinh] khỏng tuyến tỉnh
Nồng độ cao nhất trong huyết tương (Cmax) vả diện tich dưới đường cong nống độ
(AUCO 24 g.ờ) của deferasirox tảng gân tuyến tính với liều dùng ở trạng thái ốn định
Khi dùng đa liều, tồn lưu thuốc tăng lên từ 1, 3 đến 2, 3 lần. Ế
Bệnh nhân đặc biệt
Bệnh nhi
Tồn lưu thuốc toản bộ ở thiếu niên (12 đên s 17 tuổi) và trẻ em (2 đến < 12 tuồi) đối
với deferasirox sau khi dùng đơn liều và đa liều thì thảp hơn so với ở bệnh nhân
người lớn Ở trẻ em dưới 6 tuồi sự tồn lưu thuốc thâp hơn khoảng 50% so với người
lớn Vì liều dùng được điều chỉnh cho từng bệnh nhi tùy theo đáp ứng nẻn không có
khả năng có các hậu quả trên lâm sảng.
Giới tinh
Phụ nữ có độ thanh thải biền kiên của deferasirox thấp hơn một cách vừa phải
(17,5%) so với nam giới. Vì lièu dùng được điều chỉnh cho từng bệnh nhân tùy theo
đáp ứng nèn không có khả năng có các hậu quả trèn lâm sảng.
Bệnh nhân cao tuổi
11
Chưa có nghiên cứu về dược động học của deferasirox trèn bệnh nhân cao tuồi (từ
65 tuồi trờ lèn).
Suy thận hoặc suy gan
Chưa có nghiện cứu dược động hoc của deferasirox trên bệnh nhân suy thận.
Diện tich dưới đường cong trung bình của deferasirox ở 6 bệnh nhân bị suy gan nhẹ
(ChiId—Pugh A) tảng 16% so với giá trị có được của 6 bệnh nhân có chức năng gan
binh thường. Diện tich dưới đường cong trung binh của deferasirox ở 6 bệnh nhản
suy gan trung bình (Child-Pugh B) tăng lèn 76% so với giá trị có được cùa 6 bệnh
nhân có chức nảng gan binh thườngNồng độ tối đa Cmax trung binh cùa deferasirox
ở cả bệnh nhân suy gan nhẹ và trung binh đèu tăng 22% so với bệnh nhân có chức
năng gan bình thường Tảo động đối với bệnh nhân suy gan nặng (Child- Pugh C)
chỉ được đánh giá ở một bệnh nhân ( xem phần LIỆU LƯỢNG VÀ CACH DÙNG va
CẢNH BÁO VÀ THẶN TRỌNG ĐẶC BIỆT). Dược động học của deferasirox khỏng
bị ảnh hướng bời các nồng độ transaminase gan cao đen 5 iân so với giới hạn trên
của mức binh thường.
cÁc DỮ LIẸU AN TOÀN TIÊN LÂM SÀNG
Các dữ liệu an toản tiền Iảm sảng không phảt hiện nguy cơ đặc biệt nảo đói với
bệnh nhân bị quá tải sắt, dựa trẻn các nghiên cứu thộng thường về dược lý học an
toản, độc tinh liều lặp lại, độc tính gen hoặc khả năng gây ung thư. Phảt hiện chinh
là độc tính với thận và đục thùy tinh thế. Các phát hiện tương tư đã quan sa't thấy ở
động vặt mới sinh vả động vật chưa trưởng thảnh. Độc tinh với thặn chủ yêu được
cho iả đo sự cạn kiệt sắt ở động vật khỏng bị quá tải sắt từ trước.
Khả năng gảy độc đôi với sự sinh sản đã được đảnh giá trén chuột vả thò.
Deferasirox không gây quái thai nhưng Iảm tăng tần suất những thay đồi về bộ
xương và chuột con chết khi sinh khi dùng liều cao gây độc mạnh cho vật mẹ không
bị quá tải sắt. Deferasirox không gây cảc tác dụng khảo trện sự thụ thai hoặc sự sinh
san.
cÁc Dữ LIỆU AN TOÀN LÀM SÀNG Ế
THỬ NGHIẸM LÂM SÀNG
Mộtthừ nghiêm lâm sảng phase Iil, biêt tẻn thuốc, ngẫu nhiên có đối chứng với
thuộc có hoạt tính, so sánh giữa Exjade vả Desferal (deferoxamin) được tiến hảnh
với bệnh nhân beta-thalassemia và nhiễm hemosiderin do truyền máu. Bệnh nhân từ
2 tuồi trở iên được chia ngẫu nhiên với tỉ lệ 1: 1 đề nhặn hoặc Exjade dạng uống với
liều khởi đảu 5, 10, 20 hoặc 30mglkg ngảy một lần hoặc Desferal (deferoxamin) tiêm
dưới da với lièu khởi đầu từ 20 đến 60mglkg ít nhất 5 ngảy/tuần dựa trên nồng độ
sắt trong gan (UC) ở thời điếm bát đề… nghiên cứu (2 đên 3, >3 đến 7, >7 đến 14 vé
>14mg Felg trọng lượng khô (dw)). Bệnh nhân chọn ngẫu nhiên vảo nhóm
deferoxamine mả có giá trị LIC < 7mg/g dw được tiếp tục dùng liều deferoxamin đã
dùng trước đó, mặc dù liều dùng đó có thế cao hơn đề cương nghiện cứu
LIC được đánh giá vảo lúc bắt đầu và sau 12 tháng điều trị bằng sinh thiết gan hoặc
đo không xâm lân bằng thiết bị đo độ cảm ứng từ trường sinh học Tỷ iệ thảnh công,
mục tièu hiệu quả chính, được xảc định bởi sự giảm giá trị LIC 2.3 mg Felg dw cho
cảc trướng hợp có giá trị LIC lúc ban đầu 210 mg Felg dw, giảm xuống mức <7 mg
Felg dw cho các trướng hợp có giá trị LIC iúc ban đầu trong khoảng từ 7 đến <10
mg Fe/g dw, hoặc duy tri hoặc giảm LIC cho cảc trường hợp giá trị LIC lúc ban đảu
<7 mg Felg dw. Exjade đã được cỏng bố không kém hơn deferoxamine nếu giới hạn
12
thắp của khoảng tin cậy là 95% (hai phialtwo—sided) của sự khác biệt trong tỷ lệ
thảnh công là trên -15%.
Tồng số có 586 bệnh nhân được điều trị ngẫu nhiền. Thống kê nhân khảu học đã
được cân bằng tốt. 51% bệnh nhản dưới 16 tuồi. Tỷ lệ thảnh công chung iả 52.9%
cho Exjade và 66.4% cho deferoxamine với sự khảo biệt khoảng -13.5% về tỷ iệ
thảnh công và khoảng tin cậy (CI) 95% cùa [—21.6, -5.4]. Sự không kém hơn so với
deferoxamine không đạt được bời giới hạn thảp của khoảng tin cặy (CI) dưới —15%.
Điều nảy được cho là do sự mất cân bằng giữa iiều được được chỉ định theo đề
cương nghiên cứu với liều dùng thưc tế trong hai nhóm bệnh nhản dùng liều thảo
nhảt của nhảnh điều trị deferoxamine (bảng 3). Tuy nhiên, sự không kém hơn nảy lại
được biều thi ở một nhóm bệnh nhán với nòng độ sắtlgan LIC lúc ban đảu 27 mg
Felg dw mã được chia vảo các nhóm dùng liêu cao hơn (Exjade liều 20 hoặc 30
mglkg vả deferoxamine liều 235 mglkg). Tỷ lệ thánh cộng với Exjade vả
deferoxamine tương ứng là 58.6% và 58.9%, và giới hạn thảp của khoảng tin cậy CI
95% (~10.2%) đều trèn ngưỡng không kém hơn là -15%.
Với bệnh nhân có nồng độ sắt trong gan LIC 27 mg Felg dw mã được điều trị với
Exjade 20 đên 30 mglkg mỗi ngảy, sự giảm đáng kể có ý nghĩa thống kê nòng độ
sắt trong gan LIC so với nồng độ ban đầu đã được quan sát thắy (-5.3 :t 80 mg
Felg dw, p <0.001, t-test), trong khi không có sự khác biệt có ý nghĩa thóng kè so
với deferoxamine (-4.3 3: 5.8 mg Felg dw, p = 0.367). Sư phụ thuộc liều dùng ảnh
hưởng đến nòng độ ferritin huyêt thanh vả tỷ lệ bải tiết sắt/hảp thu sắt với liêu
Exjade từ 5 đên 30 mglkg củng đã được quan sát thắy (Bảng 3).
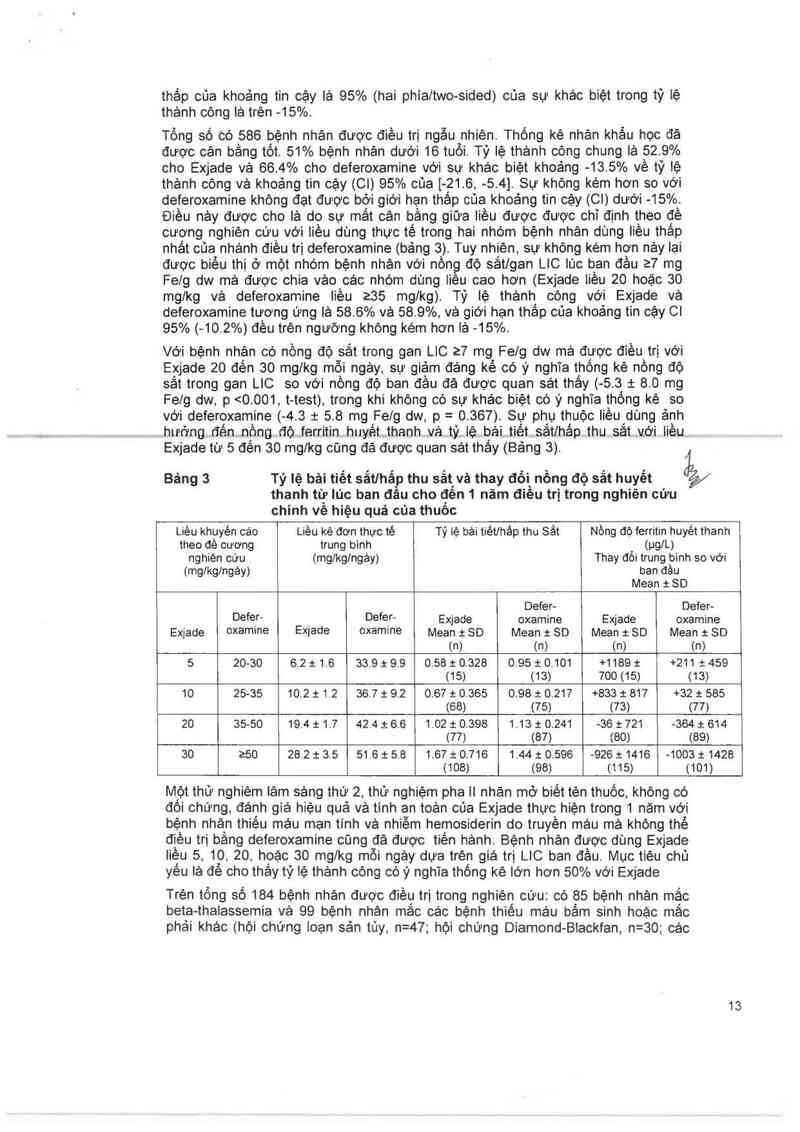
Bảng 3 Tỷ lệ bải tiết sắtlhẩ thu sẳt vè thay đổi nồng độ sắt huyết
thanh tữ lúc ban d 0 cho đến 1 năm điều trị trong nghiên cứu
chinh vê hiệu quả của thuôo
Liều khuyên cảo Liều kê đơn thưc té Tỷ iệ bải tiétlhâp thu Sắt Nòng đỏ ferritin huyêt thanh
theo đề cương trung bình (ug/L)
nghiên cứu (mglkg/ngáy) Thay dồi trung binh so với
(mglkg/ngảy) ban đầu
Mean : SD
Deter— Defer-
Defer— › Defer- Exjade oxamine Exjade oxamine
Exjade oxamme E›qade oxamine Mean i SD Mean t SD Mean 1 SO Mean : SD
tn) (n) (n) (n)
5 20-30 6.2 1 1.6 33.9 1 9.9 0,58 1: 0.328 0.95 2 0.101 +1189 t +211 1: 459
(15) (13) 700(15) (13)
10 25-35 10.2 1 12 36.7 2 9.2 0.67 & 0.365 0.98 :): 0.217 +833 1 817 +32 :1: 585
(68) (75) (73) (77)
20 35-50 19,4 1: 1.7 42.4 1 6.6 1.02 2 0.398 1.13 1 0,241 -36 2 721 —364 :t: 614
(77) (87) (80) 189)
30 250 28.2 t 3.5 51 ,6 i 5.8 1.67 i 0.716 1.44 1 0,596 —926 3:1416 —1003 1 1428
(108) (98) (115) (101)
Một thứ nghiêm iâm sảng thứ 2, thử nghiệm pha il nhãn mở biét tẻn thuốc, không có
đối chứng, đánh giá hiệu quả vả tỉnh an toản cùa Exjade thưc hiện trong 1 năm với
bệnh nhân thiệu máu mạn tính vả nhiễm hemosiderin do truyền máu mà khỏng thể
điều trị băng deferoxamine cũng đã được tiến hảnh. Bệnh nhân được dùng Exjade
liều 5, 10, 20, hoặc 30 mglkg mỗi ngảy dựa trèn giá trị LIC ban đầu. Muc tiêu chủ
yêu là đề cho thây tỷ iệ thảnh công có ý nghĩa thóng kè lớn hơn 50% với Exjade
Trẻn tồng số 184 bệnh nhân được điều trị trong nghiên cứu: có 85 bệnh nhản mắc
beta-thalassemia và 99 bệnh nhân mảc các bệnh thiêu máu bầm sinh hoặc mắc
phải khác (hội chứng Ioạn sản tủy, n=47; hội chứng Diamond-Blackfan, n=30; các
13
bệnh khác, n=22). 19% bệnh nhản <16 tuồi về 16% bệnh nhán 265 tuồi. 37 bệnh
nhản không được nhận liệu pháp chelat hóa sảt trước đó. Trèn toản bộ bènh nhân,
tỳ iệ thảnh cộng (505%) là cao hơn không có ý nghĩa thống kê so với 50%. Điệu nảy
được cho rằng là do tiêu dùn 5 Về 10 mglkg iè không đủ cho tốc độ tiến triên của
hấp thu sắt từ những lần truyỂn máu. Tuy nhiên, với bệnh nhản có LIC 27 mgFe/g
dw ở cả lủc bắt đầu vả Iủc kêt thúc nghiên cứu và những bệnh nhân được điêu trị
bằng Exjade với liều 20 đén 30 mg/kg mỗi ngảy, tỷ iệ thánh cộng lả 58.5% [p=0.022
(50.3, 66.6)] vẻ đã có một sự giảm có ý nghĩa thống kê của nòng độ sắt trong gan
LIC tuyệt đối từ lủc ban đầu cho đến khi kết thúc nghiên cứu (55 i 74 mg Felg dvv,
p <0.001, t—test). Cũng đã có sự phụ thuộc liều ảnh hướng đên nồng độ ferritin huyêt
thanh vả tỷ lệ bải tiết sắt/hấp thu sắt theo liều từ 5 đên 30 mglkg mỗi ngảy.
Một nghiên cứu thứ 3 được tiên hảnh ở bệnh nhân mắc bệnh hồng cảu hình liềm và
nhiễm hemosiderin do truyền máu. Đây iả một nghiên cứu pha ii, ngẫu nhiên, nhản
mở (biét tẻn thuôo), nghìẻn cứu tính an toản và hiệu quả cùa Exjade so sánh với
deferoxamine trong một nảm. Bệnh nhân được điều trị ngẫu nhiên với Exjade với
các iiều 5, 10, 20. hoặc 30 mg/kg mỗi ngảy hoặc deferoxamine tiêm dưới da_với liêu
từ 20 đẻn 60 mg/kg mỗi ngảy trong 5 ngảyltuần theo giá trị của LIC lúc ban đâu.
Tồng số 195 bệnh nhân được điều trị tron nghiên cữu nảy: 132 với Exjade và 63
với deferoxamine. 44 % bệnh nhân <16 tuôi vả 91% là người da đen. Khi kết thúc
nghiền cữu, mức thay đối LIC trung binh trong dân số nghiên cứu theo protocol-1
(PP-t), bao gồm các bệnh nhản có it nhảt 1 đánh giá về uc sau khi đièu trị, lả -10
mg Felg dw cho bệnh nhản dùng Exjade (n=113) và -0.7 mg Felg dw cho bệnh nhản
dùng deferoxamine (n=54).
Một nghiên cứu nhảnh về tim được tiên hảnh như iả một phần cùa nghiên cứu pha
N. Nghiên cữu nhảnh về tim nảy là một nghiên cứu tiên cữu nhản mờ, được tiến
hảnh trong một năm, bao gồm hai nhóm bệnh nhân beta-thalassemia bị quá tải sắt
nặng vởi giá trị phân suất tống máu thắt tréi LVEF 256%: 114 bệnh nhân có giá trị
72* lúc ban đầu iả ›5 cho đến <20 ms bièu hiện có nhiễm sắt cơ tim (nhóm bệnh
nhản có mục tiêu là điều trị) và 78 bệnh nhán có giá trị T2“ cơ tim 220 ms chỉ ra
khỏng bị lắng đọng sắt ở tim đáng kể trên lâm sảng (nhóm bệnh nhân có mục tiêu lá
phòng ngữa). Trong nhóm bệnh nhản có mục tiêu điều trị, liều khởi đầu deferasirox
15 so mg/kglngáy, với sự gia tăng đến iiều lớn nhắt 40 mglkglngảy. Mục tiêu nghiên
cứu chính của nghiên cứu nhánh về tim nảy là thay đồi cùa T2' vảo thời điẻm 1
năm. Trong nhóm bệnh nhản mục tiêu lả điều trị, T2* (trung binh nhản 1 hệ số biến
thiên) tảng lện một cách có ý nghĩa từ giá trị ban đầu lả 11.2 ms 1 40.5% lèn 12.9
ms 2 49.5%, thế hiện sự cải thiện đáng kể iả 16% (p <0.0001). Trong nhóm bệnh
nhân mục tiêu là điều trị, sự cải thiện T2' được quan sát thắy ở 69.5% bệnh nhân và
sự ồn định 72* tháy được ở 14.3% bệnh nhân. LVEF duy trì ốn định và trong giới
hạn binh thường: 67.4 & 5.7% đến 67.1 : 6.0%. Trong nhóm bệnh nhân mục tiêu lả
phòng ngừa, giá trị T2* cơ tim đã được duy trì trong giới hạn bình thường và không
thay đồi so với giá trị ban đầu, từ 32.0 ms 2 25.6% đẻn 32.5 ms :t: 25,1% (+2%; p =
0.565) cho thây rằng việc điều trị hằng ngảy với deferasirox có thể phòng ngữa quá
tải săt trong cơ tim trện bệnh nhân beta—thalassemia có bệnh sử truyền máu nhiều,
vả đương nhiên vẫn đang phải tiêp tục truyền máu.
Những bệnh nhản trong nhóm có mục tiêu iả điều trị của nghiên cứu chính 1 nảm đã
có sự lựa chọn để tham gia vác hai nghiên cứu 1 nảm mở rộng. Sau khoảng thời
gian ba nảm điều trị, đã có một sự gia tảng có iiên quan trẻn lâm sảng, tiến triền và
có ý nghĩa thống kê (p<0.0001) về giá trị trung bình nhân chung của T2* tim từ ban
đầu, tr_ong phân nhóm quá tải sắt ở tỉm nặng mà có nguy cơ cao về suy tim (T2* >5
cho đên <10 ms), vả với phán nhóm có quá tải sắt ở tim nhẹ và vừa (721 từ 10 đến
20 ms) (Bảng 4). Sử dụng tỷ số trung binh nhân, sự gia táng giá trị T2* là 43% so
14
với giá trị ban đầu ở tảt cả các bệnh nhân, tảng 37% so với ban đầu ở phản nhóm
bệnh nhân có T2* từ >5 đén <10 ms, và tăng 46% ở phân nhóm bệnh nhân có T2*
từ 10 đến <20 ms, Việc tiêp tục điều trị với Exjade cho đên 3 năm với liều ›so
mglkg/ngáy lảm giảm một cách hiệu quả lượng sắt trong tim ở bệnh nhản
thalassemia thể nặng có nhiễm sắt cơ tim như đã thắy ở số bệnh nhân đã binh
thường hóa được giá trị T2' hoặc cải thiện đén một tình trạng tương ứng với nguy
cơ thấp hơn về suy tim (Bảng 5).
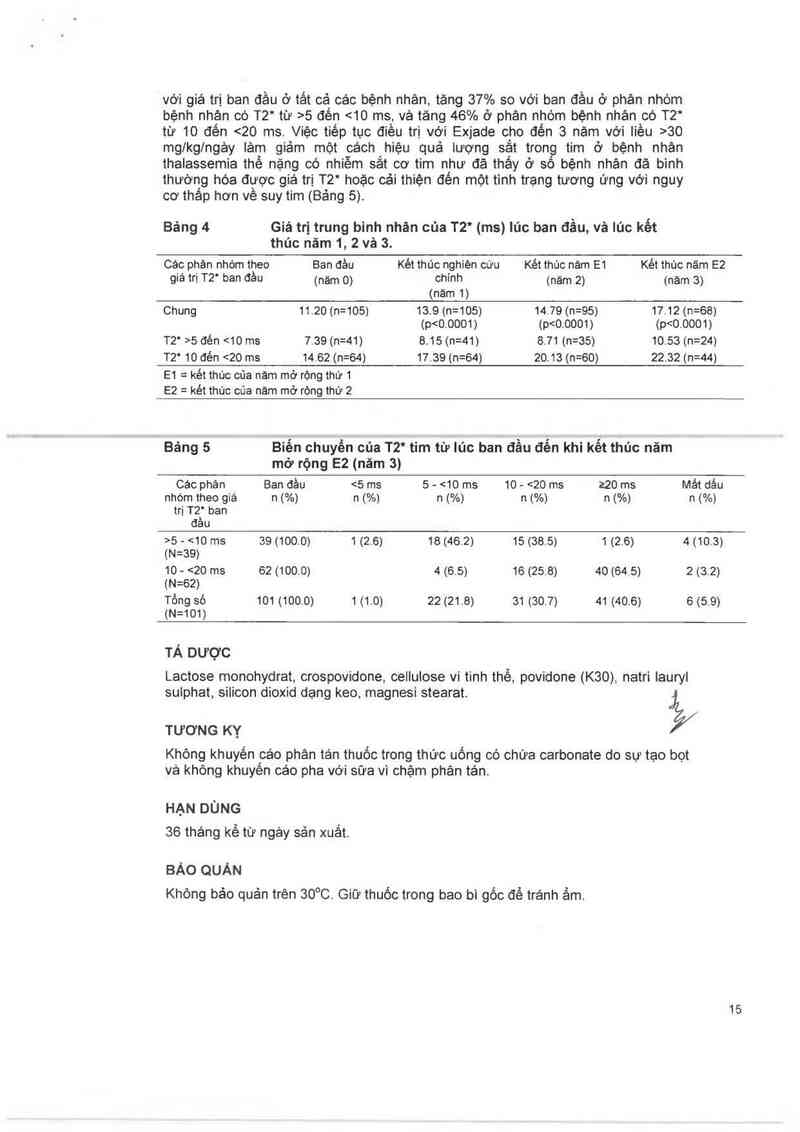
Bảng 4 Giá trị trung bình nhản của T2* (ms) lủc ban đẩu, vè lủc kết
thủc nãm 1, 2 và 3.
Các phân nhòm theo Ban đằu Kêt thúc nghiên cứu Két thúc nảm E1 Két thúc năm 82
giá trị T2' ban đảu (năm 0) chinh (nảm 2) (nảm g)
(nảm 1)
Chung 11.20 (n=105) 13.9 (n=105) 14.79 (n=95) 17.12 (n=68)
(p<0.0001) (p<0.0001) (p<00001)
72' ›5 đén <10 ms 7.39 (n=41) 8.15 (n=41) 8.71 (n=35) 10.53 (n=24)
72' 10 đén <20 ms 14.62 (n=64) 1739 (n=64) 20.13 (n=60) 22.32 (n=44)
E1 = két thúc của nảm mở rộng thứ 1
E2 = két thúc của nám mở rộng thứ 2
Bảng 5 Biến chuyển của T2* tim từ lúc ban đầu đến khi kết thủc năm
mở rộng E2 (năm 3)
cac phân Ban đầu <5 ms 5 - <10 ms 10 - <20 ms z20 ms Mảt dấu
nhóm theo giá n (%) n (%) n (%) n (%) n (%) n (%)
trị T2' ban
đầu
>5 - <10 ms 39 (100.0) 1 (2.6) 18 (462) 15 (38.5) 1 (2.6) 4 (10.3)
(N=39)
10 - <20 ms 62 (100.0) 4 (6.5) 16 (25.8) 40 (64.5) 2 (32)
(N=62)
Tổng sô 101 (100.0) 1 (1.0) 22 (21.8) 31 (30.7) 41 (406) 6 (5.9)
(N=101)
TÁ DƯỢC
Lactose monohydrat, crospovidone, cellulose vi tinh thế, povidone (K30), natri Iauryl
suiphat, silicon dioxid dạng keo, magnesi stearat. Ễ/
TƯỞNG KY
Không khuyên cáo phân tán thuốc trong thức uống có chứa carbonate do sự tạo bọt
vẻ không khuyên cáo pha với sữa vi chậm phân tản.
HẠN DÙNG
36 tháng kể từ ngảy sản xuất.
BẢO QUẢN
Khỏng bảo quản trên 30°C. Giữ thuốc trong bao bì gốc để tránh ảm.
15
Không dùng Exjade quá hạn sử dụng được ghi “EXP” trẻn bao bì.
HƯỞNG DẢN sữ DỤNG VÀ THAO TÁC
Note: Exjade phái để xa tẩm tay vả tẩm nhin của trẻ em.
QUY CÁCH ĐÓNG GÓI
Exjade 125, 250, 500 mg: Hộp 4 vi x 7 viên nén phân tản.
TIÊU CHUẨN
Nhà sản xuất
NHÀ SẢN XUẤT
Novartis Pharma Stein AG
Schaffhauserstrasse
CH-4332 Stein
Thụy Sĩ
'Clỉo NovảrtiS Phảrrủ ẢG,Ềaảlè, Thựy Sĩ
Tờ hướng dẫn sữ dụng cho quốc tế
Ngảy phát hánh thông tỉn: Tháng 7, 2012 /ỈỈĨẦ
6 = Nhản hiệu đã đảng kỷ /°ĨẮJẮIÌJf
| … ~ _
Dm i›ii_ỉN
', TNTHANHPHỮ
' `)HO CHI Mithi
LOUIS-GEOFIGES LASSONNERY
Chiet Representative
The Hepresentative Office of
Novartis Pharma Services AG in HCMC
PHÓ cục TRUỞNG
Jởưêii%vệi7ffli
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng