














Ilmulnunnmitnllnmiqu Ở
(0 NOVARTIS mmùnn °
Ó EXJADE' _
deferasirox 250 mg
" I I | _ …… .,
U) NOVARTIS
O EXJADE”
deferasirox
Chiet Representative
The Fiepresentative Office of
Novartis Pharma Services AG in HCMC
uuquuutunn1W
W
/
deierasưox
!
LOUlS-GEORGES LASSONNERY
Hđ tjđ
ĩW'i"'ti ")"i'õ-mẹp utn
1NYQỒJJD
iẦỌH
O EXJADE'
10
Ở NOVARTIS
c II ma… diumMu (
ỉ litpttilit um I
mnnim aumlu
ft
,A
I…ẸiĂi'lCi a
30-
n lhco đon.
Mỏ: vtẻn phản tản chua 250mg deierastmx
UI_SĐK XX-XXXX-XX '
aoha'm'g cnóng chi &… xin doc lờ hưđnq dản sử dung
NS (th x… `LOT` MFD 'EXF tren bao bì _,ầ Nhãn h
hgđy 01 của thảng hét nan … trên bao bì Xuát xứ Thuy Sỹ K bảo quán " p Ụ
› : A d
\ (được dan sau khi nhạp khau)
il
NUH'
Ỉlì
', 32101…
ppữaMmuòc trong bao bi góc đế ttảnh ấm
n um IIỊ lrt i'm. Đọc ttỹ hướng din lư đụng truớc khi dùng.
s Pharma Stein AG, Schatthauserstrassc Ct14332 Stoin, MtZBIIĐM
Binh Dương
II Đường số 3 KCN Vtél Nam Stngapore ? Thủ Dán Mới, tint Binh Duong
ác xin xem irong lờ hướng dân sử dung kèm theo
I' “.
) NOVARTIS
Van nc Lil! : nmin mi l’ullniltzc` I
Yu- | m a 1: nmé: I m 10 M đa tnhtư A ullm m.: mu mu trtttiaiu
A :cnnnư I uu unpbmul nu mm… lu « ƯL A :llnmi um luillllnụ I ’nmlm [ 1 lu « l' ủnilnt
Meunmm … : memum Mu Moon a nemcmnt : Iu
Nlacrsn tu 2me luu dc luu nnt n Iu niu In n- tniu u utlu li n…
Fuudm Rlanieùlhlbuư , `
uoc «.101 Il rem ưa :tcll M ailclen me mi; n dieztld tư | …
Du ml … nu: Jil’c. … In II: ungu um. In Illll tc mm m lidưum ) Q
…nnttat memci mNm ln mưu uuuuim hiu mu mưu ư I' mu :luuch
lhmm um ln um um miiuing Bo ml nudllu thc u … `
va m: uu u … am: n: ut [
Wnttendelbctyccbnxhduiuưa ummmrmam : 4đwưmẻdm
tu m…r | Inmu:m IIIIIM I ! 'c GIunll cn I unln lMd uu unnnuln dl II hun… `
IAcđlc…h mị… I Won mưu niu … mmmutu … el mừucc … l %
muưlul In nnunlnlol en uttl um II ut inuúin llo IMllrl Il ltluliụn In muililn lnIll '
lmnlillHllt/cmuM mm
i:mhchllcơtưultưlgt la:tuu um um
Mamiưiưld In
N… Ptgim: Shin Mi 5… Snlưuhitti Iu Nơtllh m… Mì, Ram m… Vm g ymmyg. ;
f…w
it…FiutnaSiư AG,SM ủnmtati…ìhxltaAũ,ũatita.ủzti R.S. ưt img
`) /
!
19 0! 12 lừlĩtỉ7
2101511 ul²IMd 1 Ô
\ J. /
z» zo<›ẵã .» zo<›ẫẩ ơ zo<›ỹ » zo<›wỉ 1%
m……… nmc mặ.mnoc mặẵoc
3…
mỡủ…ẵx
\
\J
N
Ưl
/í
tz m
<>» ÊỀo .u: 3, mỡĩ >Q.mấRẵmẵ Z.… o:bdmxm M m… N
G .. , i. 1 n… ,.nntÉ.
. . 21 130 c .\i 7 .!h D
…M P l.
ẵ ffl m. .
.» yo<›ẵã ..xt Fw r ,
_ mE. noc
Em N….ồ Em mua 3
Doỡầẫox DoỡEẫox DmỡE…ẵx
f -
\
Q
Lauttichtung Foiie
/ _
ư zo<›ỉẩ ư zo<›ẵẩ .» zo<›ẵã » zo<›ẵẽ _
/ mx.m ….mc .
\ N…O 3m _
mỡũễox .
i\ _
ẳoỀdmẫ _
_
_
ơ 1 o ›ẫã _
mả nmc _
N……Q 3m .
Dmỡồẫox Dmỡầễox Dmỡỡễox …
.
.
_
GEORGES LASSONNERY
Chiei Representative
The Representative Office of
Novartis Pharma Services AG in HCMC
LOUIS-
Ú› NOVARTIS
Exjađe®
Thuốc iảm chelat hóa sắt
THÀNH PHẢN VÀ DẠNG BÀO CHẾ
Mỗi viên nén phản tán chứa 125 mg | 250 mg | 500 mg deferasirox là hoạt chắt.
Tá dược: Lactose monohydrate; Crospovidone; Microcrystalline cellulose; Povidone
(K30); Sodium lauryl sulphate; Silicon dioxide; Magnesium stearate
CHỈ ĐỊNH
Exjade được chỉ định đê điều trị quá thừa sắt mản tinh do truyền mảư (_chứng nhiễm
haemosiderin do truyền máu) ở bệnh nhân người lớn vả trẻ em (từ 2 tuôi trở lên).
LIÊU LƯỢNG VÀ CÁCH DÙNG
Khuyến cáo khởi đầu điều trị bằng Exjade sau khi truyền khoảng 20 đơn vị hồng cầu
khối (khoảng 100 mng) hoặc khi có dảu hiệu qua theo dõi trèn lâm sáng là quá sảt
mãn tinh (vi dụ ferritin huyêt thanh >1.000 microgramlL). Liều dùng (tính bảng
mglkg) phải được tính vá Iảm tròn thảnh trọn viên có hảm lượng gần nhắt.
Mục tiêu của liệu pháp chelat hòa sắt lá để ioại bỏ lượng sắt đá được đưa váo cơ
thể qua truyền máu, và khi cần, đề iảm giảm gánh nặng sắt hiện có. Việc quyềt định
Ioại bỏ lượng sắt tich lũy phải tùy thuộc vảo từng cá thể dựa trên lợi ích lâm sảng
được mong đợi và nguy cơ của liệu pháp chelat. ệ/
Liều khởi đầu
Liều Exjade khới đầu hâng ngảy được khuyến cáo iả 20 mglkg thể trọng.
Có thể xem xét dùng Iièu khởi đầu háng ngảy lả 30 mg/kg cho những bệnh nhản
dùng tren 14 mL/kg/tháng hồng cầu khối (khoảng > 4 đơn vịltháng cho một người
iớn) vả đỏi với những người mả muc tiêu iả lảm giảm sự quá thừa sải.
CÓ thể xem xét dùng liều khởi đằu hảng ngảy lả 10 mglkg cho những bẻnh nhản
dùng dưới 7 mL/kg/tháng hòng cầu khói (khoảng < 2 đơn vi/tháng cho một người
lớn) vả đỏi vởi những người mà mục tiêu là duy tri nồng độ sảt trong cơ thề.
Đôi vờinhưng bệnh nhân đáp_ ứng tót khi đìèu trị bằng đeferoxamine, có thể xem xét
dùng liêu Exjade khởi đầu băng một nửa Iièu deferoxamine (vi dụ một bệnh nhản
đang dùng 40 mgịkglngảy deferoxamine, 5 ngảy mỗi tuần (hoặc tương đương) có
thẻ chuyến sang liêu Exjade khời đầu lẻ 20 mg/kg/ngảy).
Liều duy trì
Khuyến cáo theo dõi nồng độ territin trong huyết thanh mỗi thảng vả nếu cần thì điều
chĩnh iiêu Exjade mội 3-6 tháng dựa trẻn cảc biên chuyến của ferritin huyết thanh.
Có thể điều chỉnh liêu từng bước 5—10 mglkg, phù hợp với đáp ứng của từng bệnh
nhân vả mụctièu điều trị (điều trị duy trì hoặc lảm giảm gánh nặng về sảt). Với bệnh
nhản dùng liêu 30 mg/kg mã không đủ kiếm soát tinh trạng bệnh (ví dụ nòng độ
ferritin trong huyêt thanh vần lớn hơn 2.500 microgam/L và không thảy có chiều
. \
hướng gìảm nòng độ theo thới gian thì Iiẻu dùng đén 40mglkg có thể được xem xét.
Khôn khuyên cáo dùng các liệu trên 40 mg/kg vì chưa có nhiều kinh nghiệm với
các lieu trèn mức náy.
Ở bệnh nhân có nồng độ ferritin huyết thanh đạt tới mục tiêu điều trị (thường khoảng
từ 500 đên 1.000 microgam/L, sự giảm iièu tưng bước từ 5 đến 10mg/kg cần được
xem xét để duy tri nồng độ ferritin huyết thanh trong khoảng mục tiêu. Néu ferritin
huyết thanh ha ồn định dưới 500 microgramlL, cần xem xét ngừng điều trị. Cũng
như cảc thuốc chelat hóa sắt khác, nguy cơ độc tính cùa Exjade có thế tảng Ièn khi
dùng liều cao một cách không phù hơp cho bệnh nhân có mức gảnh nặng về sắt
thảp hoặc có nồng độ ferritin huyêt thanh tăng không đảng kế (xem phần CÀNH
BẢO VÀ THẶN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG).
Cách dùng
Exjade phải dùng một Iầnlngảy khi đói ít nhảt 30 phút trước khi ăn, tốt nhắtjả dùng
vảo cùng một thời điểm mỗi ngảy. Viên nén được phân tản bằng cảch khuây trong
một ly nước hoặc nước táo hay nước cam (100-200 mL) cho đên khi đạt được hỗn
dich mịn. Sau khi uống hỗn dịch, bất kỳ lượng cặn nảo củng đẻu phải được pha lại
thảnh hỗn dịch với một ít nước hoặc nước trái cây vả uống. Không được nhai viên
thuôc hoặc nuốt nguyện cả viện. Không khuyến cáo phân tán trong nước có chừa
carbonate (nước soda) hoặc sữa bởi sự tạo bọt và phân tán chậm. Xem phần
TƯỚNG KY. '
Bệnh nhân cao tuổi
Liêu khuyến cáo cho bệnh nhản cao tuồi tương tư như đã mô tả trên. Trong cảc thử
nghiệm lâm sảng, bệnh nhân cao tuồi cớ tần suất phản ứng bất lợi cao hơn người
lớn trẻ tuồi vả họ cần được theo dỏi sát vẽ các phản ứng bât iợi vôn có thể cần phải
điều chỉnh iièu.
Bệnh nhi Ế
Liều khuyến cậo cho bệnh nhi tương tự như đối với bệnh nhân người lớn. Phải tính
đến sự thay đôi vê cân nặng của bệnh nhi theo thời gian khi tinh Iièu dùng.
Bệnh nhân bị suy thận
Cần thận trọng khi dùng Exjade đê điều trị cho bệnh nhân có nồng độ creatinine
huyết thanh cao hơn giới hạn trên cùa mức binh thường theo lứa tuồi. Đặc biệt cần
thận trọng với bệnh nhân có độ thanh thải creatinine trong khoảng 40 đến dưới 60
lephút, nhảt lá trong các trường hợp có kèm theo các yêu tố nguy cơ có khả nảng
lảm suy giảm chức năng thận như các thuốc dùng đồng thới, sự mải nước, hoặc cảc
nhiễm khuấn nặng. Liều khởi đầu khuyến cáo cho bệnh nhân bị suy thận tương tự
như liều đã mô tả trèn. Cần theo dõi nòng độ creatinine huyết thanh hăng thảng ở
tảt cả bệnh nhản vả nếu cằn có thế giảm liều hảng ngảy còn 10 mg/kg (xem phần
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG).
Bệnh nhân bị sưy gan
Exjade đã được nghiên cữu trong một thử nghiệm lâm sảng trện bệnh nhân suy
giảm chữc nảng gan. Với bệnh nhân có suy gan ở mức độ trung binh (ChiId-Pugh
B), Iièu khởi đầu cần nên được giảm khoảng 50%. Không khuyên cáo dùn Exjade
cho bệnh nhân suy gan nặng (Child — Pu h C) (xem phần CẢNH BÁO V THẬN
TRỌNG ĐẶC BIẸT KHI SỬ DỤNG). Hầu h tcác bệnh nhân cằn được theo dõi chức
nảng gan trước khi bắt đầu điều trị, mỗi 2 tuần trong tháng đầu tiện và mỗi thảng sau
đó (xem phần CÀNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG).
CHỐNG CHỈ ĐỊNH
Quá mẫn cảm với hoat chất hoặc với bất kỳ thảnh phản nảo của tá dược.
Những bệnh nhán hội chứng Ioạn sản tùy (MDS) nguy cơ cao và những bệnh nhân
bị các bệnh ác tính về huyêt học vả ngoải huyêt học sẽ không có lợi khi dùng liệu
pháp tạo chelat do sự tiên trièn nhanh của bệnh.
Bệnh nhản có độ thanh thải creatine < 40lephút hoặc nồng độ creatine huyết thanh
> 2 lần mức giới hạn trên của mức binh thường phù hợp theo tuôi.
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIỆT KHI SỬ DỤNG
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tỉn, xin hòi ỷ
kion bảo oĩ. ~
Thuốc nảy chỉ dùng theo sự kê đơn của bác sĩ.
Quyết định thải trừ sắt tich tụ cần được cán nhắc cho từng cá thể bệnh nhân dựa
trên lợi ich vả nguy cơ Iâmsảng cùa liệu pháp chelat hóa theo dự đoán (xem phần
LIEU LƯỢNG VA CACH DUNG).
Cần thận trọng với bệnh nhân cao tuồi do có tần suất cao hơn về các phản ứng bắt
lợi.
vè thặn Ễ
Đã ghi nhận creatinine huyết thanh tảng khòng iiên tục ở những bệnh nhân được
điều trị bằng Exjade, thường thì trong khoảng bình thường. Các trường hợp suy
thận cấp đã được bảo cảo khi sử dụng Exjade trong giai đoạn hậu tiếp thị (xem
phần PHÀN ỪNG BÁT LỢI CÙA THUOC). Hiếm trường hợp suy thận cảp cản thảm
tách máu.
Khuyến cảọ đánh giá creatinine huyết thanh vảlhoặc độ thanh thải creatinine 2 Iản
trước khi bảt đảu điều tri và sau đó theo dõi hảng tháng.
Bệnh nhân có sẳn bệnh thận, hOặC bệnh nhản đang dùng những thuốc có khả náng
lảm suy giảm chữc náng thặn có thể có nguy cơ bị biến chứng nhiều hơn. Ở những
bệnh nhân nảy việc kiếm tra creatinin huyết thanh vả/hoặc độ thanh thải creatinine
được khuyến cảo thực hiện mỗi tuần trong tháng đầu tiên sau khi bắt đầu trị liệu
hoặc sau khi thay đồi trị liệu, và mỗi tháng sau đó. Cần thặn trọng ở bệnh nhân có
độ thanh thải creatinine từ 40 đến dưới 60 mL/phút, đặc biệt trong trướng hợp có
kèm theo các yếu tố nguy cơ có khả năng iảm suy giảm chức năng thận như các
thuốc dùng đông thời, sự mầt nước, hoặc các nhiễm khuẩn nặng.
Bệnh lý ống thặn đă được báo cáo trên bệnh nhân điều trị bằng Exjade. Phận lớn
bệnh nhản'nảy lả trẻ em vả trẻ vị thảnh niên có bệnh Beta— thaiassemia vả nông độ
ferritin huyêt thanh < 1.500 microgam/L.
Xét nghiệm protein niệu phải được tiến hảnh hảng tháng.
Cần chú ý bồi phụ nước đầy đủ cho những bệnh nhân đang bị tiêu chảy hoảc nòn.
Đối với bệnh nhân ngưới lớn, Iièu Exjade hảng ngảy có thể giảm còn 10 mgikg nền
có tăng không tiên triền nồng độ creatinine huyết thanh hơn 33% trẻn nồng độ trung
bình từ các xét nghiệm trước khi điếu trị trong 2 lần kiềm tra Iiẻn tiếp và không thể
quy cho nguyên nhản nản khác (xem phần LIEU LƯỢNG VÀ CÁCH DÙNG) Đối với
bệnh nhi, có thế giảm lièu còn 10 mglkg nếu nồng độ creatinine huyết thanh tãng
cao hơn giới hạn trèn của mức binh thường theo tuổi ở 2 lần kiếm tra liên tiếp.
Nếu creatinine huyết thanh tăng tiến_triển vượt hợn giới hạn trẻn của mưc bình
thường thì phải ngững Exjade. Có thê khới đâu đièu trị Exjade trở lại tùy theo tình
trạng lâm sảng của bệnh nhản.
Về gan
Exjade không được khuyến cáo cho bệnh nhân bị suy gan nặng (Child-Pugh 0)
(xem phần LIEU LƯỢNG VÀ CACH DÙNG vả DƯỢC LẢM SÀNG). Trị iìệu Exjạđe
chỉ được bắt đầu với bệnh nhản có mức men transaminase gan Iủc ban đảu đẻn 5
lần giới hạn trèn của mức bình thường… Dược động học của Deferasirox không bị
ảnh hướng bới những nồng độ transaminase như vậy. Deferasirox chủ yếu thải trữ
bằng phản ưng glucuronic hóa và một lượng nhỏ (khoảng 8% ) chuyền hóa bới sự
oxi hóa qua cytochrome P450 (xem phần DƯỢC LÁM SÀNG)
Mặc dù it gặp (0,3%), tảng các men transaminase hơn 10 lần mức trên của giới hạn
bình thướng gợi ý tình trạng viêm gan đã được quan sảtthắy trong các thứ nghìệm
lâm sảng. Có những báo các hậu mãi về suy gan ở những bệnh nhân được điều trị
bằng Exjade Hầu hết những bảo cáo về suy gan đèn lién quan đên những bệnh
nhản bị mảc phói hợp nhiều bệnh nặng bao gồm cả xơ gan vả suy đa cơ quan; tử
vong đã được báo cáo ở một vải trong số những bệnh nhản nảy (xem phần PHẢN
ỪNG BÀT LỢI CÙA THUOC) Nồng độ transaminase huyết thanh bilìrubin,
phosphatase kiềm cần được theo dội trước khi bắt đầu điều trị, mỗi 2 tuần trong
tháng đầu tiên vả mỗi tháng sau đó Phải ngừng dùng Exjade nẻu nồng độ
transaminase trong huyết thanh tảng liên tục vá tiến triền mã không thể quy cho
nguyên nhản nảo khác. Một khi đã xác định rõ nguyện nhán cùa các bất thường về
xét nghiệm chức náng gan hoặc sau khi xét nghiệm chức năng gan đã trở về bình
thường, có thế cân nhắc bắt đầu điều trị Exjade trở lại một cách thận trọng với một
iièu thắp hơn, sau đó tảng iièu dần dần.
Về tiêu hóa
Kích ứng đường tiêu hóa có thế xẩy ra trong quá trinh điều trị với EXJADE. Loét vả
xuất huyết đường tiêu hóa trên đã được báo cảo ở các bệnh nhản, bao gồm cả trẻ
em vá thiếu niên dùng EXJADE. Rắt hiếm trường hợp tử vong do xuất huyết đường
tiêu hóa được báo_cáo_ đặc biệt ớ người lớn tuồi bị bệnh máu ác tinh giai đoạn nặng
vảlhoặc bị giảm tiêu câu. Nhiệu ò loét đă được quan sảt thắy ở một số bệnh nhản
(xem phần PHÀN ỪNG BÁT LỢi CỦA THUOC). Bác sĩ vả bệnh nhản phải cảnh giác
với các dấu hiệu vả triệu chứng của loét và xuất huyết tiêu hớa trong khi điều trị
bảng EXJADE vả phải bảt đâu ngay lập tức việc kiếm tra vả điều trị thêm nếu nghi
ngờ có một biến cố bắt lợi nghiêm trọng cùa đường tiêu hóa.
Thận trọng với những bệnh nhản đang dùng EXJADE kêt hợp với những thuốc
được biêt lá có khả năng gây loét như các thuốc kháng viêm không steroid (NSAID),
corticosteroid hoặc bisphosphonate đường uống. và các bệnh nhản đang dùng
thuốc chống động (xem phần TƯỞNG TÁC) vả các bệnh nhản có số lượng tiếu câu
dưới 50 x 109/L
Các rổi loạn về da
Có thế có nối ban ở da trong khi điều trị bằng Exjade. Đối với ban mức đó nhe đến
trung bình, có thể tiếp tục dùng Exjade mã không cần đìèu chỉnh iiều, vi ban thường
tự mảt đi. Đối với ban nặng hơn, có thế cần phải ngừng điều trị, có thể dùng Exjade
trở lại sau khi đã hết ban, với một liều thâp hơn, sau đó tăng liều dần dần. Trong
trường hợp nghiêm trọng có thẻ tiên hảnh điều trị trở lại phối hợp với một thuốc
steroid đường uống dùng trong thời gian ngắn. Hiếm trường hợp báo cáo vê hồng
ban đa dạng trong thời gian trị liệu Exjade.
Các phản ứng quá mẫn
Cảo trường hợp hiém gặp bị các phản ứng quá mẫn nghiêm trọng (như phản ứng
phản vệ, phù mạch) đă được báo cáo ở những bệnh nhân dùng Exjade với khởi
phảt phản ứng xảy ra ngay trong tháng đầu điều trị ở phần lớn cảc trướng hợp (xem
phần PHÀN ƯNG BÁT LỢI CUA THUOC). Nêu các phản ứng xảy ra nặng, phải
ngững dùng Exjade vả phải tiến hảnh can thiệp y khoa thich hợp.
Thi giác vả thinh giác
Rối loạn thính giác (nghe giảm) và rỏi Ioạn_ở mắt (đục thủy tinh thề) đã được ghi
nhặn trong khi điều trị băng Exjade (xem phận PHAN ƯNG BAT LỢI CLiA THUOC).
Khuyên cáo xét nqhiệm vê thính giác và vẻ măt (bao gồm soi đáy mát) trước khi
khởi đầu điều trị bằng Exjade và ở những khoảng cách đều đặn sau đó (mỗi 12
tháng). Nêu thảy có rối ioạn, có thể cản nhăc giảm liều hoặc ngững dùng thuốc.
Các rối loạn về mảư
Có những báo cáo hậu mải (cả tư phát vả từ những thử nghiệm Iảm sảng) về giảm
tế bảo máu ở bệnh nhân điều trị với Exjade. Hầu hêt cả bệnh nhân nảy đèu có
những rối Ioạn vè máu từ trước thường Iièn quan đên suy tủy xương (xem phần
PHẢN ỨNG BÀT LỢI CÙA THUỐC). Mối iiện hệ giữa những triệu chứng nảy với
việc dùng thuốc Exjade iả không chắc chắn. Để đảm bảo việc quản lý lâm sảng
chuẩn đối với những rối Ioạn về máu nảy, phải kiềm tra công thức máu thườn
xuyên. Ngững điều trị với Exjade phải được xem xét ở những bệnh nhản bị giảm tễ
bảo máu không giải thích được. Điều trị iại với Exjade có thể được xem xét một khi
nguyên nhân Iảm giảm tế bảo máu đã được sáng tỏ. ả
Các lưu ý khảc
Khuyên các xét nghiệm ferritin huyêt thanh mỗi tháng để đánh giá đáp ứng của bệnh
nhân với điều trị (xem phần LIỆU LƯỢNG VÀ CÀCH DÙNG). Với bệnh nhân có
nòng độ ferritin huyêt thanh đạt đến mục tiêu điều trị (thường trong khoảng từ 500
đến 1.000 `microgam/L). Việc giảm liệu từ từ từng bước 5 đên 10 mglkg cần được
xem, xét đẻ duy tri nồng độ ferritin huyết thanh trong khoảng mục tiêu. Nêu ferritin
huyêt thanh ha Ồn định dưới 500 microgramlL, cần xem xét ngừng điều tri. Cũng
như với điêu trị chelat hóa sắt khác, nguy cơ nhiễm độc Exjade có thể tăng Ièn khi
dùng liêu cao khỏng thich hợp cho những bệnh nhân bị gánh nặng về sải không
nhiêu hoặc mức ferritin huyết thanh chỉ tảng nhẹ.
Exjade không Iién quan với chậm tăng trưởng ở trẻ em được theo dõi đến 5 năm
trong các thử nghiệm lâm sảng. Tuy nhiên như iả biện pháp thận trọng chung, có thể
theo dỏi thệ trọng vả sự tãng trưởng chiều cao của bệnh nhì ở các khoảng cách đèu
đặn (mỗi 12 tháng).
Không được phối hợp Exjade với liệu pháp dùng chắt chelat hóa sắt khác vì tính an
toản của sự phôi hợp nảy chưa được xác định.
Viên nén có chữa lactose (1,1 mg Iactose đối với mổi mg deferasirox). Thuốc nảy
không khuyến cáo dùng cho bệnh nhản bị các rối Ioạn di truyền hiếm gặp về không
dung nạp gaiactose, thiếu hụt lactase trầm trọng hoặc kém háp thu glucose-
galactose.
Đối với người điều khiến phương tiện và vận hảnh mảy
Chưa có nghiên cứu nảo về ảnh hưởng của Exjade đến khả năng iái xe vé vận hảnh
máy móc được thực hiện. Bệnh nhân có thế có tác dụng bất lợi không thướng gặp
như chóng mặt, hoa măt cần thặn trọng khi lái xe hay vận hảnh máy.
TƯỚNG TÁC THUỐC
Thuốc lảm giảm tiếp xúc toản thân Exjade
Trong một nghiên cứu trên người tinh nguyện khỏe mạnh, việc dùng đồng thời (đơn
liều 30mglkg) với rifampicỉn là một chắt cảm ưng mạnh UDỆ—
glucuronosyltransferase (UGT) (liệu lặp iai 600 mg/ngảy) dẫn đèn sự giảm mưc tiêp
xúc deferasirox xuống 44%. Do đó, việc sử dụng đồng thời Exjade với các thuỏc gây
cảm ứng mạnh với UGT (rifampicỉn, phenytoin, phenobarbital, ...) có thề lèm giảm
hiệu quả của Exjade. Néu dùng đòng thời Exjade vả chải cảm ứng mạnh UGT, việc
tảng lièu Exjade cần được xem xét trèn cơ sở đáp ứng điều trị lâm sảng.
Tương tác với thửc ăn
Sinh khả dung của deferasirox táng đến một khoảng thay đồi khi được dùng cùng
với thức ản. Vì vậy p_hải dgng Exjade khi đói ít nhất 30 phút trước khi ăn, tót nhất là
vệ… cùng một thời điẻm môi ngảy (xem phần LIEU LƯỢNG VÀ CÁCH DUNG).
Tương tác với Midazoiam vả các chắt chuyển hóa bời CYP3A4
Trong một nghiên cứu trện ngưới tình nguyện khỏe mạnh, việc dùng đồng thời
EXJADE vả mìdazolam (lả một chắt nen CYP3A4) iảm giảm mức tiếp xúc
midazolam xuống 17%. Trong thực tế lâm sảng, tảc dụng nảy thắy rõ rảng hơn. Do
tinh trạng giảm tác dụng có thể xảy ra, phải thận trọng khi dùng deferasirox cùng với
các thuốc được chuyền hóa ua CYP3A4 (vi dụ như ciclosporin, simvastatin, các
thuốc trảnh thai nhóm nội tiétt ). Ế
Tương tác với Repaglinide vả các tác nhân chuyền hóa qua CYP2CB
Theo một nghiện cứu trẻn người tình nguyện khỏe mạnh, việc sử dụng đòng thời
Exjade (iièu nhắc lại 30mglkg/ngảy) vả Repaglinide - cơ chất cvpzce (đơn iièu
0,5mg) dẳn đén sự tăng diện tich dưới đường cong AUC và C… của repaglinide lên
131% (90% Cl: 103% to 164%) Về 62% (90% 01: 42% to 84%) theo thứ tự. Khi dùng
đồng thời Exjade vả repaglinide, cần theo dõi cần thận nòng độ glucose. Không thể
loại trừ tương tác giữa Exjade vả cảc cơ chát CYP208 khác như paclitaxel.
Tương tảo với theophyiline vả các tác nhân chuyến hóa bời CYP1A2
Theo một nghiên cữu trèn người tinh nguyện khỏe mạnh, việc sử dụng đồng thới
Exjade (iiè_u iặp lại 30mglkg/ngảy) vả Theophyline — cơ chảt của CYP1A2 (liệu đơn
120mg) dân đên sự tăng diện tich dưới đường cong AUC của theophyline Iẽn 84%
(00% 01: 73% to 95%). Nồng độ thuốc tói đa cmax khi dùng một iiều đơn không bị
ảnh hướng nhưng khi dùng với lièu lặp đi lặp lại, nồng độ tối đa cmax của
theOphyiline tăng lèn. Khi dùng đồng thời Exjade vá theophylline, cần thưc hiện theo
dõi nồng độ theophylline vả có thể xem xét giảm liều theophyliine nếu cần thiết. Sự
tương tác giữa Exjade vả các cơ chát khác cùa CYP1A2 có thể xảy ra.
Các thông tin khác
Chưa thảy tương tác nảo giữa Exjade vả digoxin ở người tinh nguyện khoẻ manh.
Chưa có nghiên cứu chính thức về việc dùng đồng thời Exjade vả vitamin C. Liều
vitamin C đến 200 mg/ngảy không kèm theo các hậu quả bảt lợi.
KHÔNG KHUYẾN cAo ỌÙNG ĐONG THỜI VỚI cAc THUOC ĐÃ ĐƯỢC DỰ
ĐOÁN có sự TƯỞNG TAC
Chưa có nghìèn cứu chính thức về việc dùng đồng thời Exjade và các chế phẩm
kháng acid chưa nhòm. Khòng được dùng viênnén Exjade với các chế phảm khảng
acid chứa nhộm mặc dù deferasirox có ải lực đôi với nhôm thảp hơn so với săt.
Dùng đồng thời Exjade với các thuốc được biêt có khả năng gây Ioét như các thuốc
chống viêm không steroid NSAID, corticosteroid, hoặc bisphosphonat đường uổng,
và dùng Exjade cho bệnh nhản đang điều trị thuóc chống đôn có thế lảm tảng nguy
cơ gây kích thich đường tiêu hóa (xem phần CẢNH BÁO Vẵ THẬN TRỌNG ĐẶC
BIẸT KHI SỬ DỤNG)
PHỤ NỮ có THAI VÀ CHO CON eú
co thai
Chưa có dữ iiệu Iảm sảng về việc dùng deferasirox khi mang thai. Các nghiện cưu ở
động vệ_t đá cho thây một số độc tinh về sinh sản ờ lièu độc cho vât me (xem phản
CAC DƯ LIẸU AN TOÀN TIÊN LAM SÀNG). Chưa rõ khả năng về nguy cơ đòi với
người.
Để thận trọng, khuyến cáo không dùng Exjade trong thai kỳ trừ khi thật sự cần thiêt.
Cho con bú
Trong các nghiên cứu ở động vặt, đã ghi nhận deferasirox được bải tiết nhanh vả
mạnh vảo sữa của vật mẹ. Chưa thảy tác dụng trên con. Chưa rõ deferasirox có
được bải tiết vảo sữa người hay không. Không khuyến cảo cho con bú trong khi
đang dùng Exjade. Ề
LÁ! xe vA VẬN HÀNH MÁY MÓC
Chưa có nghiên cữu được thực hiện về tác dụng cùa Exjade trèn khả năng lái xe
hoặc vận hảnh máy móc. Những bệnh nhân thỉnh thoảng gặp tác dụng phụ chóng
mặt cần thận trọng khi lái xe hoặc vặn hảnh máy móc (xem phần PHẢN ỪNG BÁT
LỢI CUA THUOC).
PHẢN ỪNG BÀT LỢI CÙA THUỐC
Những phản ứng bảt lợi thường gặp nhắt đã được ghi nhận trong khi điều trị kéo dải
với Exjade ở bệnh nhãn người iớn vả trẻ em bao gồm các rối Ioạn tiêu hóa trong
khoảng 26% bệnh nhân (chủ yêu lả buồn nòn, nôn, tiệu chảy hoặc đau bụng) và nối
ban da khoảng 7% bệnh nhân. Những phản ứng nảy phụ thuộc lièu dùng, hầu hêt là
nhẹ đến trung bình, nói chung chỉ thoáng qua và hầu hết mất đi ngay cả khi tiếp tục
điều trị. Tảng creatinine huyêt thanh nhẹ, khộng tiến triến, hầu hết iả trong mức binh
thường, xảy ra trong khoảng 34% bệnh nhân. Tinh trạng tăng cretinin nảy phụ thuộc
liêu dùng, thường tự thoái lui và đôi khi có thể giảm đi bằng cách giảm iièu (xem
phần CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG).
Đã có báo cảo về các trường hợp tảng transaminase gan trong khoảng 2% bệnh
nhân. Những trường hợp nảy không phụ thuộc iiẽu và phân lớn sô bệnh nhân nảy
đã có nòng độ men tảng trước khi dùng Exjade. Tăng transaminase cao hơn gâp 10
lần giới hạn trên của mức bình thường- gợi ý viêm gan— lả trướng hợp it gặp (0,3%).
00 những báo các hậu mải về suy gan ở những bệnh nhản được điều trị băng
Exjade. Hầu hết những báo cáo về suy gan |ièn quan đên những bệnh nhân mảc
đồng thới nhiều bệnh nặng bao gồm cả xơ gan và suy đa cơ quan; tử vong đá được
bản cáo ở một vải trong số những bệnh nhân nảy.
Cũng như điều trị bằng chất chelat hóa sắt khác, mất thinh iực đối với tần số cao và
đục thủy tinh thẻ (đục thùy tinh thể sớm) thinh thoảng đã quan sải thây ở bệnh nhân
được điêu tri bằng Exjade (xem phần CÀNH BẢO vA THAN TRỌNG ĐẬC BiẸT KHI
SỬ DỤNG).
Các phản ứng bảt lợi của thuộc, được liệt kê trong Bảng 1, được báo cảo trong các
thử nghiệm lâm sảng theo sau điều trị bằng Exjade. Các phán ứng bầt iợi được xếp
dưới đây sử dụng quy ước sau: rắt hay gặp (²; 1110); hay gặp (2 1_1100, < 1110); it
gặp (z 111.000, < 17100); hiếm gặp (2 1710.000, < 111.000); rải hiếm gặp (<
1/10000). Trong mỗi nhóm xếp theo tần suất, các phản ứng bắt lợi được trình bảy
theo thứ tự nghiêm trọng giảm đần.
Bảng 1 Cảc phản ửng bất lợi của thuốc được bảo cáo trong các thử
nghiệm lâm sảng
Rối loạn tâm thần _`
it gặp: Lo âu, rối loạn giầc ngủ
Rối ioạn hệ thần kinh
Hay gặp: Nhữc đầu
Ỉt gặp: Chóng mặt
Rối loạn về mắt
it gặpi Đục thủy tinh thể giai đoạn đầu, bệnh hoảng điểm
Hiêm gặp: Viêm dây thần kinh thị giác
Rối Ioạn tai vả mê đạo
it gặp: Mắt thính lưc CL
Rối Ioạn hô hấp, ngực và trung thắt ý
It gặp: Đau họng vả thanh quản
Rối Ioạn tiêu hóa
Hay gặp: Tiêu chảy, tảo bộn, nôn, buồn nõn, đau bụng, chưởng bụng,
khó tiêu
it gặp: Xuất huyết tiêu hóa, loét dạ dảy (bao gồm cả ioét đa ồ), loét
tá trảng, viêm da đảy.
Hiếm gặp: Viêm thực quản
Rối Ioạn gan mật
Hay gặp: Tăng transaminase
Ít gặp: Viém gan, sỏi mật
Rối Ioạn da vả mò dưới da
Hay gặp: Ban, ngữa
it gặp: Rối loạn sắctố
Hiếm gặp Hồng ban đa dạng
Rối loạn thận vả tiết niệu
Rảt hay gặp: Tăng creatinine máu
Hay gặpí Protein niệu
Ỉt gặp: Bệnh iý ống thận (hội chững Fanconi)
Rối loạn toản thân và tình trạng tại chỗ dùng thuốc
It gặp: Sốt, phù, mệt mỏi |
Danh sách các phản ứng bất lợi của thuốc từ những bảo cảo tự phảt hậu mãi
Cảo phản ưng bắt lợi được báo các tự p_hát được trình b_ảty trong Bảng 2 lá những
báo các tư nguyện vả thường không thể xác lặp tần suất hoặc môi quan hệ nhân
quả với việc dùng thuốc.
Bảng 2 Các phản ứng bắt lợi của thuốc nhặn được từ những bảo cáo tự
phảt
Rối loạn thận vả tiết niệu
Suy thận cắp (chủ yếu lả creatinin huyết thanh tảng > 2 lần giới hạn trên của
mức bình thường vả thường hồi phục sau khi ngừng điều trị), bệnh lý ông
thận- -mô kẻ
Rối loạn gan mật
Suy gan
Rối loạn da vả mô dưới da
Viêm mao mach qua măn (leukocytociastic vascuiiiis), rnảy đay, rụng tủc.
Rối Ioạn hệ miễn dịch
Các phản ưng quá mẫn (bao gồm phản ưng phản vệ vả phù mạch)
Có các báo các hậu mải (cả báo cậo tự _phát và báo cáo từ thử nghiệm_ iâm sảng) về f
cậc chứng giảm tế bảo máu bao gồm giảm bạch cầu trung tinh giảm tiều cầu vả lảm i
trầm trọng thẻm tinh trạng thiếu máụ ở bệnh nhân điêu trị với Exjade Hầu hết các zị, '
bệnh nhản nảy đều đã có sẵn các rối ioạn về máu có thường kết hợp với suy tủy "“v-
xương (xem phần CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG) Chưa
rõ môi quan hệ của cảc tình trạng nảy với trị liệu Exjade. J)Z
Vởi bệnh nhi: %
Bệnh lý Ống thận đă được bảo cảo trên bệnh nhân điều trị bằng Ex_jade. Phần lớn
bệnh nhân nảy iả trẻ em vả thiếu niên có bệnh Beta- thalassemia vả nỏng đồ ferritin
mảư thắp < 1.500 microgram/L
Thòng báo cho bác sĩ những PHÀN ỨNG BÁT LỢI CÙA THUỐC gặp phải khi
sử dụng thuôo.
QUÁ LIỂU
Các trường hợp quá iièu (gấp 2 đến 3 lần liều được kê trong nhiều tuần) đã được
báo cáo. Trong một trường hợp, điều nảy gây viêm gan cận lâm sảng (khòng có
biềụ hiện lảm sảng) nhưng tự khỏi mà không gảy hậu quả lảu dải sau khi ngừng
thuôo. Các liêu đơn 80 mglkg ở bệnh nhân thaiassaemia bị quá tải sảt đă được
dung nạp, chỉ ghi nhận có buồn nỏn nhẹ và tiêu chảy. Liều đơn đền 40 mglkg ở
người binh thướng được dung nạp tốt.
Cậc đặu hiệu qu_á liều cắp tinh bao gồm buồn nòn, nỏn, nhức đầu vả tiêu chảy. 06
thẻ điêu trị quả lièu bảng cách gảy nộn hoặc rừa dạ dảy vá điêu trị triệu chứng.
DƯỢC LỰC HỌC
Cơ chế tảc dụng
Deferasirox iả một thuốc lảm chelat hộa có hoạt tính dùng đường uống có tinh chọn
lọc cao đôi với sắt III Phản tử deterasirox gồm ba nhánh gắn vảo sất với ái lực cao
theo tỷ lệ 2: 1. Deferasirox Iảrn tăng cường bải tiết sắt, chủ yếu qua phân
Deferasirox có ái lực thắp đối với kẽm vả đồng, khòng gảy ra nộng độ thảp !ièn tục
trong huyết thanh cũa những kim ioại nảy.
Dược iực học
Trong một nghiên cứu về chuyển hóa đối với cản bằng sắt trèn những bệnh nhân bị
bệnh thiếu mảu Địa Trung Hải (Thalassaemia) bị quá tải sằt, Exjade với cảc Iièu
hậng ngả_y 10, 20 và 40 mglkg đã tạo ra bải tiêt sắt thực trung binh lả 0,119 mg
sặng thề trọng/ngảy đối với liều 10 mg/kg, 0,329 mg sật/kg thẻ trọng/ngảy đối với
liều 20 rnglkg và 0 445 mg sắtlkg thẻ trọng/ngảy đối với liều 40 mg/kg
Exjade đặ được nghiện cứu trên bệnh nhân người lớn vả trẻ em (từ 2 tuồi trớ lện) bị
quá tải săt mản tinh do truyền mảư Tinh trạng bệnh chinh cần truyền máu bao gồm
bệnh thalassemia beta, bệnh hòng cầu hinh liềm vả các bệnh thiếu mảu bấm sinh và
mắc phải khác (hội chững loạn sản tùy, hội chứng Diamond- Blackfan thiếu máu bất
sản va cảc thiêu máu hiếm gặp khác)
Điêu ttị iiảtttg ngảy bằng Exjade với các liẻu 20 vả 30 mg/kg trong một năm cho
những bệnh nhân người iớn và trẻ em được truyền máu thường xuyên do bệnh
thalassemia beta đã dẫn đên giảm cảc chỉ số sất toản phần trong cơ thế; nồng độ
sắt ở gan giảm trung bình khoảng -,0 4 mg sắtlg gan (trọng lượng khô khi sinh thiêt)
ớ iièu 20 mgikg vả -8, 9 mg _sắtịg gan ở liều 30 mgikg, vả ferritin huyêt thanh giảm
trung bình khoảng —36 ị.iglL ở iiều 20 mglkg vả -926 ụg/L ở liều 30 mg/kg Khi dung
cùng những liều nảy tỷ lệ giữa bải tịết sắt trên thu nhận sắt lả 1,02 (biếu thị cân bằng
sắt _thực) vả 1, 67 (biều thị Ioại bỏ sắt thực) tương ứng. Exjade tạo ra đảp ứng tương
tự ở bệnh nhân bị các bệnh thiếu mảư khảo có c_ịuá tải sẳt. Liều dùng hảng ngảy 10
mg/kg trong một nảm có thể duy tri nồng độ sắt ở gan và nồng độ ferritin trong huyêt
thanh, vả tạo ra cân bẩng sắt thực sự ở những bệnh nhản truyền mảư không thường
xuyên hoặc truyền thay máu. Ferritin huyết thanh được đảnh giả bầng cảch theo dõi
hảng tháng đã phản ánh các thay đồi nộng độ sắt trong gan cho thấy lả cảc biến
chuyển của ferritin huyêt thanh có thể được dùng để theo dõi đảp ứng với điều trị.
Đối với bệnh nhản có iắng đọng sải ở tim (MRI T2*<20ms) được điêu trị với Exjade
đều cho thắy sự thải trừ sắt lắng đọng được chứng minh bởi quá trinh cải thiện giá
trị T2“ trong hơn ba năm theo dõi Ở bệnh nhản không có lắng đọng sẳt ở tim,
Exjade đã cho thấy có tác đụng ngăn ngữa về lâm sảng sự lắng đọng sắt trong tim
có liện qu_an (duy tri T2'_ › 20ms) trong hơn 1 năm quan sải, mặc dù vẫn tiếp tục
được truyẻn mảư đáng kè.
DƯỢC ĐỘNG HỌC
Hắp thu
10
Deferasirox được hảp thu sau khi dùng đường uống với thời gian trung bình đạt
được nồng độ cao nhảt trong huyêt tương (tmax) khoảng 1.5 - 4 giờ. Sinh khả dụng
tuyệt đỏi (diện tỉch dưới đường cong nồng độ - AUC) của deferasirox ở viên nén
Exjade khoảng 70% so với một ịịèu tiêm tĩnh mạch. Tống lượng thuôo tồn lưu (diện
tích dưới đường cong) xắp xỉ gảp đôi khi dùng cùng với bữa ăn sảng nhiều chảt béo
(hảm lượng chất béo > 50% calo) vá khoảng 50% khi dùng cùng với bữa ăn sáng
chuẩn Sinh khả dụng (diện tích dưới đường cong nòng độ) của deferasirox tảng lên
vừa phải (khoảng 13-25%), khi được dùng trước bữa ăn 30 phút với hảm lượng chảt
béo bỉnh thường hoặc cao. Tống lượng thuốc tồn iưu (diện tich dưới đường cong
nồng độ) đối với deferasirox sau khi uống viên nén được phản tán trong nước cam
hoặc nước tảo tương đương vởi sau khi phân tán trong nước (tỷ lệ AUC tương đối
lẻ 103% khi dùng nước cam vá 90% khi dùng nước táo).
Phán bố
Deferasirox iiên kết mạnh với protein huyêt tương (99%). hầu như duy nhắt lả
albumin huyêt thanh, vả có thể tích phản bó nhỏ vèo khoảng 14 L ở người lởn.
Biến đổi sinh học
Glucuronide hóa lả đường chuyên hóa chính đối với deferasirox, sau đó bải tiét qua
mật. Sự khử liên hợp các glucuronide ở ruột và tái hắp thu sau đó (chu trình gan-
ruột) có thể xảy ra. Deferasirox chủ vếu đươc glucuronide hóa bởi UGT1A1 vá Với
một mức độ ít hơn bởi UGT1A3. Sự chuyến hóa deferasirox qua sự dị hóa CYP450
(oxy hóa) dường như rắt ít ở người (khoảng 8%). Chưa thấy sự ức chế chuyền hóa
deferasirox do hydroxyurea in vitro. Deferasirox trải qua chu trình gan ruột. Trong
một nghiên cứu trên người tình nguyện khỏe mạnh, dùng choiestyramine sau một
liều đơn deferasirox dẫn đèn giảm 45% mức tồn lưu của deferasirox (AUC).
Thải trừ
Qeferasirox vả cậc chẩt chuyền hóa của nó chủ yếu được bải tiết qua phận (84%
Iièu dùng). Bải tiêt deferasirox vả ca'c chât chuyềnhóa của nó qua thặn rât ít (8%
liều dùng). Thời gian bán thải (Í112) trung bình từ 8 đên 16 giờ.
Sự tuyến tinh] không tuyến tinh
Nồng độ cao nhất trong huyết tương (Cmax) và diện tich dưới đường cong nống độ
(AUCg 24 g.ò) của deferasirox tảng gần tuyến tinh vởi liều dùng ở trạng thái ôn định
Khi dùng đa iièu, tồn lưu thuốc tảng lên từ 1, 3 đến 2, 3 lần ạ
Bệnh nhân đặc biệt
Bệnh nhi
Tồn lưu thuốc toản bộ ở thiếu niên (12 đén s 17 tuối) và trẻ em <2 đến < 12 tuối) đối
với deferasirox sau khi dùng đơn lìều vả đa liều thi thấp hơn so với ở bệnh nhản
người lớn Ở trẻ em dưới 6 tuồi sự tồn iưu thuốc thảp hơn khoảng 50% so với người
lớn. Vì liều dùng được điều chỉnh cho từng bệnh nhi tùy theo đảp ứng nên không có
khả năng có các hậu quả trên lâm sảng
Giới tỉnh
Phụ nữ có độ thanh thải biểu kiến của deferasirox thấp hơn một cách vừa phải
(17,5%) so với nam giới. Vì liều dùng được điều chỉnh cho từng bệnh nhân tùy theo
đảp ứng nẻn khỏng có khả năng có các hậu quả trèn lâm sảng.
Bệnh nhán cao tuổi
11
Chưa có nghiên cứu về dược động học của deferasirox trên bệnh nhân cao tuồi (từ
65 tuỏi trớ lèn)
Suy thận hoặc suy gan
Chưa có nghiên cứu dược động học của deferasirox trèn bệnh nhân suy thận.
Diện tích dưới đường cong trung bỉnh của deferasirox ở 6 bệnh nhân bị suy gan nhẹ
(Chiid—Pugh A) tãng 16% so với giá trị có được cùa 6 bệnh nhân có chức năng gan
binh thường. Diện tích dưới đường cong trung binh của deferasirox ở 6 bệnh nhân
suy gan trung bình (Child—Pugh B) táng iên 76% so với giá trị có được của 6 bệnh
nhân có chức nảng gan binh thường.Nồng độ tối đa Cma, trung binh của deferasirox
ở cả bệnh nhản suy gan nhẹ và trung bình đèu iăng 22% so với bệnh nhân có chức
năng gan binh thường. Tác động đối với bệnh nhân suy gan nặng ịChiId-Fjugh C)
chi được đánhgiả ở một bệnh nhân ( xem phần LIÉU LƯỢNG VÀ CACH DUNG Vả
CÁNH BAO VA THẬN TRỌNG ĐẶC BIỆT). Dược độn học của deferasirox khỏng
bị ảnh hưởng bời các nồng độ transaminase gan cao đễn 5 lần so với giới hạn trên
cùa mức binh thường.
cÁc Dữ L1ẸU AN TOÀN TIỀN LÂM SÀNG
Các dữ liệu an toản tiền lâm sảng khỏng phát hiện nguy cơ đặc biệt nảo đối với
bệnh nhân bị quá tải sắt, dựa trên các nghiên cứu thỏng thường về dược lý học an
toan, ơộc tính ịlèu lặp ịạị, ơọc tính gen hoặc khả năng gây ung thư. Phât nịẹn chinh
là độc tinh với thận vả đục thủy tinh thề. Các phát hiện tương tự đã quan sát thấy ở
động vật mới sinh và động vật chưa trưởng thảnh. Độc tinh với thặn chủ yêu được
cho là do sự cạn kiệt sắt ở động vặt không bị quá tải sắt từ trước.
Khả năng gây độc đối với sự sinh sản đã được đánh giá trèn chuột_vả_thỏ.
Deferasirox khòng gây'quái thai nhưng lảm tăng tần suất những thay đôi vè bộ
xương vả chuột con chêt khi sinh khi dùng liều cao gảy độc mạnh cho vật mẹ không
bị quá tải sảt. Deferasirox khòng gảy các tác dụng khác trên sự thụ thai hoặc sự sinh
sản.
cÁc DỮ LIẸU AN TOÀN LÂM SÀNG ỉ
THỬ NGHIỆM LÂM SÀNG
Một thủ nghiêm lâm sảng phase …, biêt tẻn thuôc, ngẫu nhiên có đối chứng với
thuốc có hoạt tính, so sánh giữa Exjade vả Desferal (deferoxamin) được tiên hảnh
với bệnh nhân beta-thalassemia vả nhiễm hemosiderin do truyền máu. Bệnh nhân từ
2 tuồi trở lên được chia ngẫu nhiên với tỉ lệ 1:1 để nhận hoặc Exjade dạng uống với
Iièu khởi đầu 5, 10, 20 hoặc 30mglkg ngảy một lần hoặc Desferal (deferoxamin) tiêm
dưới da với liều khời đầu từ 20 đẻn 60mg/kg it nhảt 5 ngảy/tuần dựa trèn nồng độ
sảt trong gan (LIC) ở thời điếm bảt đằu nghiên cứu (2 đèn a. ›3 đến 7, ›7 đến 14 và
>14mg Felg trọng lượng khô (dw)). Bệnh nhân chọn ngẫu nhiên vảo nhóm
deferoxamine mà có gỉá trị LIC < 7mglg dw được tiếp tục dùng liều deferoxamin đã
dùng trước đó, mặc dù liều dùng đó có thế cao hơn đề cương nghiên cứu.
LIC được đánh giá vảo lúc bắt đầu và sau 12 tháng điều trị bằng sinh thiét gan hoặc
đo không xâm lấn băng thiết bị đo độ cảm ứng từ trường sinh học. Tỷ lệ thảnh công,
mục tiêu hiệu quả chinh, được xảc định bởi sự giảm giá trị LIC 23 mg Felg dw cho
các trướng hợp có giá trị LIC lúc ban đầu 210 mg Feig dw, giảm xuống mức <7 mg
Felg dw cho các trướng hợp có giá trị LIC lúc ban đầu trong khoảng từ 7 đén <10
mg Felg dw, hoặc duy tri hoặc giảm LiC cho các trường hợp giá trị LIC lúc ban đảu
<7 mg Felg dw. Exjade đã được công bố khòng kém hơn deferoxamine nêu giới hạn
12
thảp của khoảng tin cặy là 95% (hai phíaltwo-sided) của sư khác biệt trong tỷ lệ
thảnh công lá trèn -15%.
Tồng số có 586 bệnh nhản được điều trị ngẫu nhiên. Thống kê nhản khẩu học đã
được cản bằng tốt. 51% bệnh nhân dưới 16 tuồi. Tỷ ịệ thảnh công chung iả 52.9%
cho Exjade vả 66.4% cho deferoxamine vởi sư khác biệt khoảng -13.5% về tỷ lệ
thảnh công và khoảng tin cậy (Cl) 95% của [-21.6, -5.4]. Sự khỏng kém hơn so với
deferoxamine khỏng đạt được bởi giới hạn thẳp của khoảng tin cặy (Cl) dưới -15%.
Điều nảy được cho là do sự mải cân bằng giữa liều được được chỉ định theo đề
cương nghiên cứu với liều dùng thực tế trong hai nhóm bệnh nhản dùng Iièu thảp
nhát của nhánh điều trị deferoxamine (bảng 3). Tuy nhiên, sự khõng kém hơn nảy lại
được bièu thị ở một nhóm bệnh nhản vởi nồn độ sắt/gan UC lủc ban đầu z7 mg
Fe/g dw mã được chia vảo các nhóm dùng li u cao hơn (Exjade liều 20 hoặc 30
mg/kg vả deferoxamine liều 235 mglkg). Tỷ lệ thảnh công với Exjade vá
deferoxamine tương ứng lả 58.6% vả 58.9%, vả giới hạn thẳp của khoảng iin cặy CI
95% (-10.2%) đều trên ngưỡng không kém hơn lả —15%.
Với bệnh nhản có nồng độ sắt trong gan LIC z7 mg Felg dw mã được điều trị với
Exjade 20 đên 30 mglkg mỗi ngảy, sự giảm đáng kể có ý nghĩa thống kê nồng độ
sắt trong gan LIC so với nồng độ ban đầu đã được quan sát thắy (~5.3 1 8.0 mg
Felg dw, p <0.001, t-test), trong khi không có sự khảc biệt có ý nghĩa thống kê so
với deferoxamine (-4.3 i 5.8 mg Felg dw, p = 0.367). Sư phụ thuộc Iièu dùng ảnh
hưởng đến nồng độ ferritin huyết thanh và tỷ Iệbải tiết sắtlhắp thu sắt với iiồu
Exjade từ 5 đén 30 mglkg cũng đã được quan sát tháy (Bảng 3).
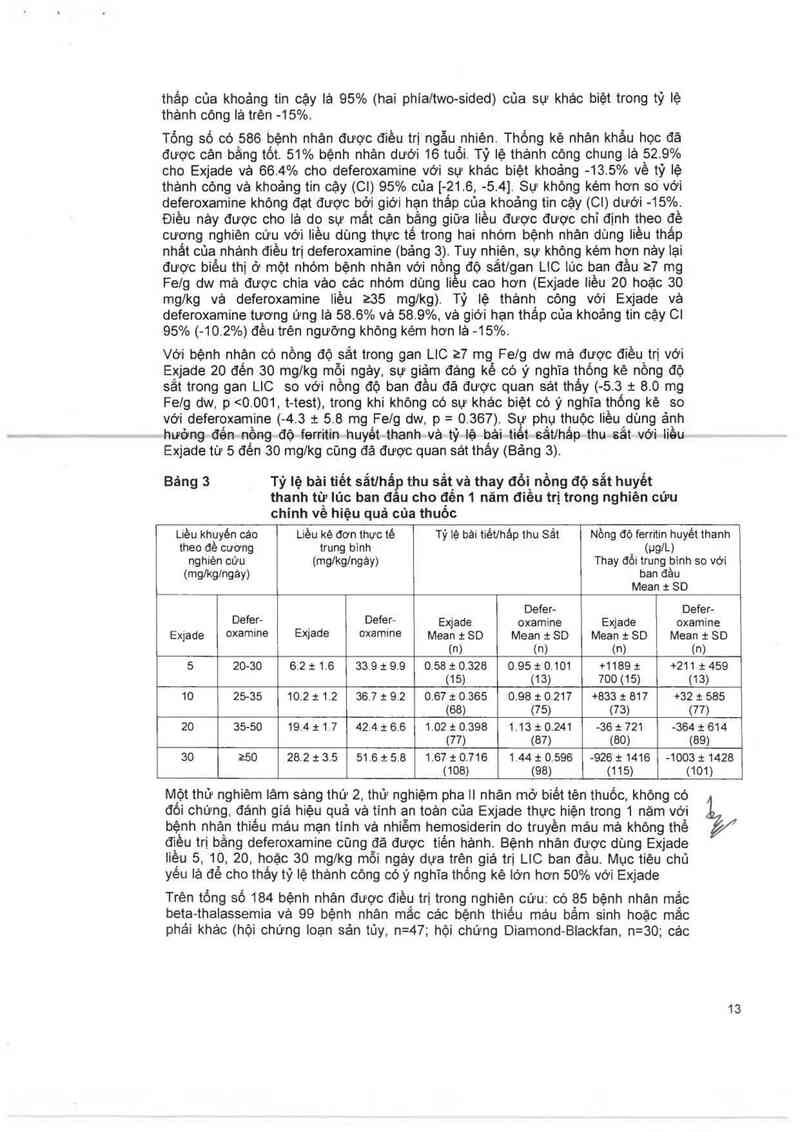
Bảng 3 Tỷ lệ bải tiết sắt/hấp thu sẳt'vả thay đỏị nồng độ sắt huyết
thanh từ Iủc ban đâu cho đên 1 năm điêu trị trong nghiên cứu
chinh vê hiệu quả của thuôc
Liều khuyên các Liều kê đơn thực tế Tỷ lệ bải tiétlhảp thu Sắt Nồng độ ferritin huyêt thanh
theo đề cương trung bình (ug/L)
nghiên cứu (mg/kg/ngảy) Thay đổi trung binh so với
(mglkg/ngảw ban đằu
Mean t SD
Ổ
Defer- Defer-
Defer- _ Defer— Exjade oxamine Exjade oxamine
Exjade oxamune E›qade oxamnne Mean t SD Mean ! SD Mean i- SD Mean i- SD
(n) (n) (n) (n)
5 20-30 6.2 x 1.6 33.9 1: 9.9 0.58 t 0.328 0.95 t 0.101 +1189 & +211 t 459
(15) (13) 700(15) (13)
10 25-35 10.2 1 1.2 36.7 :t 9.2 0.67 t 0365 0.98 1 0.217 +833 1 817 +32 1 585
(68) (75) (73) (77)
20 35-50 194 t1,7 42.4 1 6.6 1.02 :t 0.398 1.13 :t 0.241 -36 1 721 -364 1 614
(77) (87) (80) (89)
30 z50 28.2 x 3.5 51.6 3: 5.8 1.67 & 0.716 1.44 t 0.596 -926 i 1416 —1003 1 1428
(108) (98) (115) (101)
Một thử nghiêm lảm sảng thứ 2, thử nghiệm pha Il nhản mở biêt tên thuôo, khỏng có
đỏi chứng, đánh gíá hiệu quả vả tinh an toản của Exjade thực hiện trong 1 năm với
bệnh nhân thiêu máu mạn tính vả nhiễm hemosiderin do truyền máu mà khòng thể
điều trị bằng deferoxamine cũng đã được tiên hảnh. Bệnh nhân được dùng Exjade
liều 5, 10, 20, hoặc 30 mg/kg mỗi ngảy dựa trên giá trị LIC ban đầu. Mục tiêu chủ
yếu là đê cho thây tỷ lệ thảnh công có ý nghĩa thống kê lớn hơn 50% với Exjade
Trên tống số 184 bệnh nhân được đièụ trị trong nghiên cứu: có 85 bệnh nhản mắc
beta-thalassemia và 99 bệnh nhân mảc cảc bệnh thiếu máu bâm sinh hoặc mắc
phái khác (hội chứng loạn sản tủy, n=47; hội chứng Diamond—Blackfan, n=30; các
%
13
bệnh khác, n=22). 19% bệnh nhân <16 tuồi vả 16% bệnh nhản 265 tuối 37 bệnh
nhản không được nhận liệu phảp chelat hòa sắt trước độ, Trèn toản bộ bênh_nhản,
tỷ lệ thảnh cộng (50.5%) là cao hơn khộng có ý nghĩa thống kê so với 50%. Điêu nảy
được cho rằng là do lièu dùng 5 và 10 mglkg lá không đủ cho tốc độ tiên triến cũa
hắp thu săt từ những lần truyền mảu. Tuy nhiên, với bệnh nhân có LIC 27 mg Felg
dw ở cả lúc bắt đằu và lúc kết thúc nghiên cưu và những bệnh nhản được điều trị
bằng Exjade với iièu 20 đến 30 mg/kg mỗi ngảy, tỷ lệ thảnh còng lả 58.5% [p=0.022
(50 3, 66. 6)] và đã có một sự giảm có ý nghĩa thông kê cùa nồng độ sắt trong gan
LIC tuyệt đối từ lúc ban đầu cho đến khi két thúc nghiên cưu ( -5. 5 + 7 4 mg Felg dw,
p <0 001, t-test) Củng đă có sự phụ thuộc liều ảnh hưởng đến nồng độ ferritin huyết
thanh vá tỷ lệ bải tiết sắt/hẳp thu sắt theo liều tư 5 đên 30 mglkg mỗi ngảy.
Một nghiên cứu thử 3 được tiến hảnh ở bệnh nhản mắc bệnh hồng cầu hình lièm và
nhiễm hemosiderin do truyền máu. Đảy lẻ một nghiên cứu pha ||, ngẫu nhiên, nhản
mờ (biết tên thuôc), nghiên cứu tinh an toản vả hìệu quả của Exjade so sảnh với
deferoxamine trong một nảm. Bệnh nhản được điều trị ngẫu nhiên với Exjade với
các liều 5, 10, 20, hoặc 30 mg/kg mỗi ngảy hoặc deferoxamine tiêm dưới da với liều
tư 20 đến 60 mg/kg mỗi ngảy trong 5 ngảy/tuản theo giá trị của LIC lúc ban đầu.
Tống số 195 bệnh nhản được điêu trị trong nghiên cứu nảy: 132 với Exjade_vả 63
với deferoxamine. 44 % pệnh nhân <16 tuối và 91% là người da đen. Khi kèt thúc
nghiên cừu, mức thay đội LIC trung binh trong dân số nghiên cứu theo protocol-1
(PP-1)I bao gồm cảc bộnh nhân có ít nhât 1 đảnh giả về LIC sau khi điều trị, là -1.3
mg Felg dw cho bệnh nhân dùng Exjade (n=113) và -0.7 mg Felg dw cho bệnh nhản
dùng deieroxamine (n=54).
Một nghiên cứu nhánh về tim được tiên hánh như lá một phần cùa nghiên cưu pha
IV. Nghiên cứu nhánh về tim náy lả một nghiên cứu tiến cứu nhản mở, được tiên
hảnh trong một năm, bao gỏm hai nhóm bệnh nhãn beta-thalassemia bị quá tải sảt
nặng với giá trị phân suất tống máu thắt trải LVEF 256%: 114 bệnh nhân có giá trị
T2* lúc ban đầu lá >5 cho đến <20 ms biếu hiện có nhiễm sắt cơ tim (nhòm bệnh
nhân có mục tiêu lả điêu trị) vả 78 _bệnh nhản có giá trị T2“ cơ tim 220 ms chỉ ra
không bị láng động săt ở tim đáng kê trèn lâm sảng (nhộm bệnh nhân có mục tiêu iả
phòng ngưa). Trong nhóm bệnh nhặn cộ mục tièư điêu trị, Iiẻu khời đâu deferasirox
là 30 mglkgfngảy, với sự gia táng đèn liêu lớn nhât 40 mglkg/ngảy. Mục tiêu nghiên
cưu chinh cùa nghiên cứu nhánh về tim nảy iả thay đối của T2* vảo thới điếm_1
năm. Trong nhộm bệnh nhân mục tiêu là điều trị, T2“ (trung bình nhản t hệ số biên
thiên) tảng lèn một cách có ý nghĩa từ giá trị ban đầu lẻ 112 ms t 40.5% lèn 12.9
ms i 495%, thế hiện sự cải thiện đảng kề lả 16% (p <0.0001). Trong nhóm bệnh
nhản mục tiêu lả đi_èu trị, sự cải thiện T2' được quan sát thảy ở 69.5% bệnh nhân vả
sư ôn định T2“ thây được ở 14.3% bệnh nhán. LVEF duy trì ồn định vả trong giới
hạn bình thường 67 4 + 5. 7% đên 67 1 + 6 0% Trong nhóm bệnh nhản mục tiêu lả
phòng ngừa, giá trị T2* cơ tim đã được duy trì trong giới hạn bình thường và khỏng
thay đồi so với giá trị ban đầu, từ 32.0 ms + 25 6% đến 32 5 ms + 25 1% (+ 2%; p -
0 565) cho thắy rảng việc điêu trị hằng ngảy với deferasirox có thể phòng ngừa quá
tải sắt trong cơ tim trèn bệnh nhận beta-thalassemia có bệnh sử truyền máu nhiều,
vả đương nhìèn vần đang phải tiếp tục truyền máu.
Những bệnh nhân trong nhóm có mục tiêu là điều trị của nghiên cứu chinh 1 nảm đã
có sự lựa chọn để tham gia vảo hai nghiên cứu 1 nảm mở rộng Sau khoảng thới
gian ba năm điều trị, đã có một sự gia tảng có Iièn quan trèn lảm sảng, tiến triền vá
có ý nghĩa thống kê (p<0. 0001) về giá trị trung binh nhân chung cùa T2* tim từ ban
đầu, trong phân nhóm quá tải sắt ở tim nặng mà có nguy cơ cao về suy tim (T2' >5
cho đến <10 ms), vẻ với phản nhóm có quá tải sắt ở tim nhẹ và vưa (T2* tư 10 đên
20 ms) (Bảng 4) Sử dụng tỷ số trung bình nhản, sự gia tảng giá trị T2“ là 43% so
14
với giá trị ban đầu ở tảt cả các bệnh nhân, tảng 37% so với ban đầu ở phân nhóm
bệnh nhân có T2* từ >5 đên <10 ms, vả tảng 46% ở phân nhóm bệnh nhân có T2*
từ 10 đén <20 ms Việc tiép tục điều trị với Exjade cho đến 3 nảm với liều >30
mglkg/ngảy lảm giảm một cách hiệu quả lượng sắt trong tim ở bệnh nhản
thalassemia thể nặng có nhiễm sắt cơ tim như đã thấy ở sô bệnh nhân đã binh
thường hóa đựơc giá trị T2* hoặc cải thiện đến một tình trạng tương ứng với nguy
cơ thắp hơn về suy tim (Bảng 5)
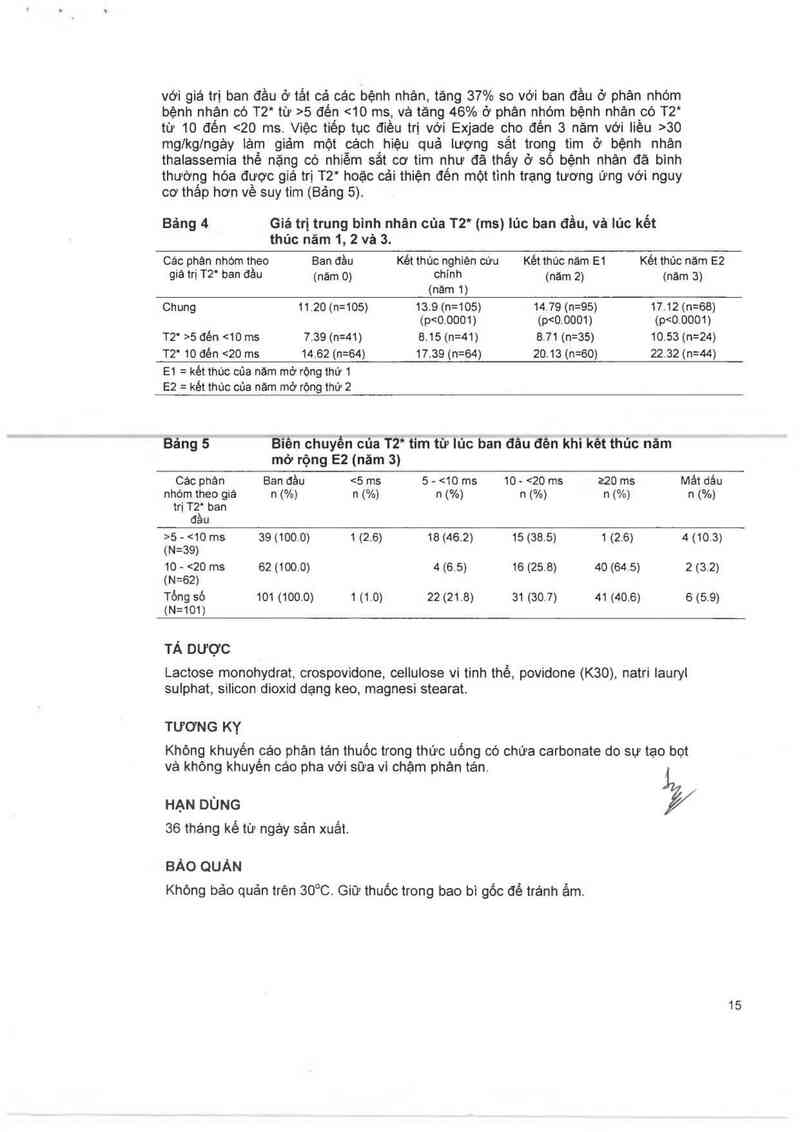
Bảng 4 Giá trị trung binh nhân của T2* (ms) lúc ban đằu, vả lủc kết
thủc năm 1, 2 vá 3.
ca: phân nhòm theo Ban đảu Két thúc nghiên cứu Két thúc nảm E1 Két thúc nảm E2
giá trị T2' ban đầu (nảm 0) chính (nảm 2) (nảm 3)
(nam 1)
Chung 11.20 (n=105) 13.9 (n=105) 14.79 (n=95) 17 12 (n= 68)
(p<0.0001) (p<0.0001) (p<0 0001)
T2' >5 đén <1o ms 7.39 (n=41) 8.15 (n=41) 8.71 (n=35) 10.53 (n=24)
T2' 10 đén <20 ms 1462 (n=64) 17.39 (n=64) 20.13 (n=60) 22,32 (n=44)
E1 = két thúc cùa nảm mở rộng thứ 1
E2 = két thúc của năm mở rộng thứ 2
Băng 5 `Biền chuyến của T2* tim từ Iủc ban đâu đền khi kềt thủc năm
mở rộng E2 (năm 3)
Các phân Ban đầu <5 ms 5 - <10 ms 10 — <20 ms z20 ms Mât dảu
nhóm theo giá n (%) n (%) n (%) n (%) n (%) n (%)
trị T2“ ban
đầu
>5 - <10 ms 39 (100.0) 1 (2,6) 18 (46.2) 15 (38.5) 1 (2.6) 4 (10.3)
(N=39)
10 - <20 ms 62 (100.0) 4 (6.5) 16 (25.8) 40 (64.5) 2 (3.2)
(N=62)
Tổng số 101 (100.0) 1 (1.0) 22 (21.6) 31 (30.7) 41 (40.6) 6 (5.9)
(N=101)
TẢ DƯỢC
Lactose monohydrat, crospovidone, cellulose vi tinh thẻ, povidone (K30), natri Iauryl
sulphat, silicon dioxid dạng keo, magnesi stearat.
TƯỚNG KY
Không khuyên các phản tán thuốc trong thức uống có chứa carbonate do sự tạo bọt
vả không khuyên các pha với sữa vi chậm phân tán
HẠN DÙNG Ề
36 tháng kế từ ngảy sản xuất.
BẢO QUẢN
Không bảo quản trèn 30°C. Giữ thuốc trong bao bì gốc để tránh ảm.
15
Không dùng Exjade quá hạn sử dụng được ghi "EXP” trẻn bao bi.
HƯỚNG DẦN sử DỤNG vÀ THAO TÁC
Note: Exjade phải đề xa tầm tay và tầm nhìn của trẻ em.
QUY CÁCH ĐÓNG GÓI
Exjade 125, 250, 500 mg: Hộp 4 vị x 7 viên nén phân tán.
TIÊU CHUẢN
Nhã sản xuảt
NHÀ SẢN XUÁT
Novartis Pharma Stein AG
Schaffhauserstrasse
CH-4332 Stein
Thụy Sĩ
~Gho Novartis Pharma—AG, Basle; -Thụy Sĩ
Tờ hướng dẫn sử dụng cho quốc tế
Ngảy phát hảnh thông tin: Tháng 7, 2012
® = Nhân hiệu đã đáng ký
, f'ỊịĨfmt
J' v~ t'›' .
// q f“,\g i `
/ VÀM PiiỌiiũ`
g DAI DiỆN _
_. THAiFề-t PHU
HO CHI i“viiii
LOUlS-GE GES LASSONNERY
C ịet Representative
PHÓ CỤC TRUONG The Representative Office of
JtỆzagaén 'Vãn %Ĩ’ỂM’LẨ Novartis Pharma Services AG in HCMC
16
'ỈẢ-_\` "ỂẾ' ,
;
í>
_, \lli `
J
l.
Oịm
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng