














noỵ,S …
BỘ Y TẾ
CLfC QUAN LÝ DƯỢC
ĐÃ PHÊ DUYỆT
Lí… đãu:..ffl.fl..íQ.…/Àẽllẫ…
,.g
lb NOVARTIS
Ó EXJADE
deferasirox
n cungnnù niu
disncưiie Was IWẸẮ ,
uisumhhs
”i
1 I— '
Ổ NOVARTI S
0 ỀXJADE __
21
!
deferasirox
28 comprimés disaersaMes |
đ'spurshie tablets |
comựimiúos dispersables
Ui N ova tư | s
JADỂ
:è: J
| W
4… …… ìW
' .
Ẩ Il ÌÍ' 1! Ý
wên phán tán chừa 125 mg ơeferasưux Hop 4 ví x 7 vuèn StĩlK` xx-xxxxvxx
. óng chỉ ơỊnh: xin dọc @ hướng uẩn sử dung
,)t m'LOT'1MFD 'EXV trẻn bao bì
1 của thang hẻt hạn ln hen bao hi. Xuát xứ: Thụ Sỹ. Khỏng báo quán tren 30°C Giữ ư…óc
im. Đế xu tĂm tay tre em Đọc kỹ han 4 n sủ dụng mm khi dùng.
xult bùi N lÃtr Pmrm: Stein AG. Schmulerlưlue. CH-4332 Sleln Swltzedand. ’
Ah Dvơng
L ~ iÀlLf uờnq :6 3 KCN viál Nam- -Sngupm 2 Thủ Dâu Méi iính Bình Dương
›:
b NOVARTIS
vo ; um … II mtsu MH uùlsaiion Tem mm u la uule: et 0: !: we ces enhnl: A … I ui sr.u sum:ch memcale
n: olll 1. A dznl l I'ldulm
& l' lui n l'hunlltl. Mẻuumem scumư i mcscnnlw mẻcnle. Prmure u mc'uczneri ả iem
Duma lu mmuulmèc nm dnl' m ma! la la mam. II |ìl Mn cn cntlu … ilkhlư.
Fu om use. Rm ihe packape lealiet oelưe use. Keep cui oi m rexh anc sợt! d ơdumn Liu nm as om… by : nsc1u
M mit … uhm 30 'c. 8… In … arlcmal uchu In uan » mm: Im: meimu.
Mm.nl pnmcl lub_min me… msr.nutlun` Tale … s medium cn in ematy slnmam «
mme um… … nm m… mllluin; na … sul… nm: ur :…
Vu cm Leu d praspeclc met de usar Mmtmci quaod mm: y tin h … m lu n r'm Lmlml únnmente come le nd›uue … medm
In cnnmar : mnmn sunuiu ; n~c. conumr en :| e… enginl pnn u…lrln « l: munun.
Medicamenle suptc I nrucmùùn médua mm ule rmdunmla cm :! estémc …
llmnmư in mmuimiđa … lw: aain le III mluión lln inụen li muliue Iu cemoơlnulu nhm.
i Cumunrnèluhbilcnnơmm - 125 mg oelemsưox
ùn=eni ! mini J mũenez Ia=lm_ lannu mm
MaMaclưm uy N…i: Fhum: Su… m. Sim. Swanc Im Nmn’s ane Mì Buc Smuehmd
UWLOWXJ
[
mua
012
Các lhđpơhnìỵ 1… xem trong tờ m.ng dũn sủ dụng kem theo ` /
/
' f '
Nhãn phụ
được dán sau khi nhập khẩu)
@
ancaw w Nmms Phu… sưa A6. Siem s…n nm Mnms Pham: AG. ùsneạ Sua
uAả: IIÌC 1509-5651-01—01
)
<>» …
x…ẵmW/
u… Em
ở @.
ZnUP OdMẵu
\…xz
ề o<›ẵ.…
&…mnmc
… 3…
9… m….
…›JỈ/…
nmc
mẹ
~.
Jc……
f.…
……
J~
………
3…
Ế
mu DiỆN
'v'AN Pi-iòiiG“
LOUlS-GEORGES LASSONNERY
zo<›w … z» OỦq/L
x…ẵij %…anwc
H… 3… … Em
ở Ế Dm ễỀx
ZmDPOAỀXù
rỉ
nmo
mở
1\
3…
Laufrlchtung Folie
ầNở<›
x…ẵ
w.zm
Z
… :
Dm …ẽ
..m
Ềx
U`>F …
mủnoe
…. m 3…
Ế
JK
Chief Representative
The Representatwe OIhce o!
Novartis Pharma Services AG in HCMC
Ủ› NOVARTIS
Exjade®
Thuốc lảm chelat hóa sắt
THÀNH PHẢN VÀ DẠNG BÀO CHE
Mỗi viên nén phản tán chứa 125 mg ! 250 mg | 500 mg deferasirox iả hoạt chầt.
Tá dược: Lactose monohydrate; Crospovidone; Microcrystalline cellulose; Povidone
(K30); Sodium |auryi sulphate; Silicon dioxide; Magnesium stearate
cui ĐINH
Exjade được chi địnhđề điều trị quả thừa sắt mãn tinh do truyền máu (chứng nhiễm
haemosiđerin do truyện máu) ở bệnh nhán người lớn và trẻ em (từ 2 tuôi trở iên).
LIẺU LƯỢNG vÀ CÁCH DÙNG
Khuyếưcảo—khởhđầu-điẻu-trị~bằng-Exjadesaưkhi-trưyền-khoảngư20~đơn—vi-hồng-cầư—
khối (khoảng 100 mL/kg) hoặc khi có dảu hiệu qua theo dõi trên lâm sảng là quá sắt
măn tính (ví dụ ferritin huyêt thanh >1.000 microgram/L). Liều dùng (tính bằng
mg/kg) phải được tinh và iảm tròn thảnh trọn viên có hảm lượng gần nhắt.
Mục tiêu của liệu phảp chelat hóa sắt lá để loại bỏ lượng sắt đã được đưa váo cơ
thể qua truyền mảu. và khi cần. để lảm giảm gánh nặng sắt hiện có. Việc quyêt định
loại bỏ lượng sắt tich lũy phải tùy thuộc vảo từng cá thể dưa trên lợi ích lâm sảng
được mong đợi và nguy cơ cùa liệu pháp chelat.
Liều khởi đầu Jầ
Liều Exjade khởi đằu hảng ngảy được khuyến Cảo lẻ 20 mg/kg thể trọng.
Có thể xem xét dùng liều khởi đầu hảng ngảy iá 30 mglkg cho những bệnh nhân
dùng trên 14 lekg/tháng hông câu khói (khoảng > 4 đơn vịltháng cho một người
lớn) vả đói với những người mã mục tiêu là lảm giảm sự quá thừa sảt.
Có thể xem xét dùng liều khởi đầu hảng ngảy lá 10 mg/kg cho những bệnh nhân
dùng dưới 7 mL/kg/tháng hồng cầu khối (khoảng <` 2 đơn vịltháng cho một người
lớn) và đói với những người mà mục tiêu lả duy trì nông độ săt trong cơ thề.
Đối với những bệnh nhản đáp ứng tốt khi điều trị bằng deferoxamine. có thể xem xét
dùng iièu Exjade khởi đầu bằng một nửa liều deferoxamine (ví dụ một bệnh nhân
đang dùng 40 mglkg/ngảy deieroxamine, 5 ngảy mỗi tuần (hoặc tương đương) có
thề chuyền sang liều Exjade khởi đầu là 20 mglkglngảy).
Liều duy trì
Khuyén_cáo theo dõi nồng độ ferritin trong huyết thanh mỗi tháng vả nẻu cản thì điều
chỉnh Iièu Exjade mõi 3—6 tháng dựa trên các biên chuyền của ferritin huyết thanh.
Có thể điều chinh liều từng bước 5-10 mg/kg, phù hợp với đáp ứng của từng bệnh
nhản và mục tiêu điều trị (điều trị duy trì hoặc tâm giảm gánh nậng về sắt). Với bệnh
nhân dùng liều 30 mg/kg mả không đủ kiềm soát tình trạng bệnh (ví dụ nòng độ
ferritin trong huyêt thanh vẫn lớn hơn 2.500 microgam/L và không thảy có chiều
// ~`\
hướng gìảmnồng độ theo thời ian thì Iièu dùng đến 40mg/kg cớ thể được xem xét.
Không khuyên cảo dùng các li u trèn 40 mglkg vì chưa có nhiêu kinh nghiệm với
các li u trèn mức nảy.
Ở bệnh nhân có nồng độ ferritin huyết thanh đạt tới mục tiêu điều trị (thường khoảng
từ 500 đén 1.000 microgam/L, sự giảm liều từng bưởc từ 5 đến 10mglkg cân được
xem xét để duy trì nồng độ ferritin huyết thanh trong khoảng muc tiêu. Néu ferritin
huyết thanh ha ốn định dưới 500 microgram/L, cần xem xét ngừng điều trị. Củng
như các thuốc chelat hóa sắt khác, nguy cơ độc tính của Exjade có thể tăng lên khi
dùng liều cao một cảch khỏng phù hơp cho bệnh nhản có mức gánh nặng vê` sảt
thảp hoặc có nồng độ territin huyết thanh tăng không đáng kể (xem phản CANH
BÁO VÀ THẬN TRỌNG ĐẬC BIỆT KHI SỬ DỤNG).
Cách dùng
Exjade phải dùng một iầnlngảy khi đói ít nhẳt 30 phút trước khi ản, tót nhát là dùng
vảo cùng một thời điềm mỗi ngảy. Viên nén đươc phân tán bằng cách khuấy trong
một ly nước hoặc nước táo hay nước cam (100-200 mL) cho đên khi đạt được hỗn
dich mịn. Sau khi uóng hỗn dich, bát kỳ lương cặn nảo cũng đèu phải được pha lại
thảnh hỗn dịch với một ít nước hoặc nước trái cây và uống. Khóng được nhai viên
thuốc hoảc nuốt nguyên cả viên. Khỏng khuyến cáo phân tán trong nước có chứa
carbonate (nước soda) hoặc sữa bởi sự tạo bọt và phân tán chậm. Xem phần
…LƯEFiGJLY_
Bệnh nhân cao tuối
Liều khuyến cáo cho bệnh nhân cao tuồi tương tự như đã mô tả trên. Trong các thử
nghiệm lâm sảng. bệnh nhân cao tuối có tần suất phản ứng bẩt lợi cao hơn người
lớn trẻ tuối vá họ cần được theo dõi sát về các phản ứng bát lợi vốn có thể cần phải
điều chỉnh liều.
Bệnh nhi
Liều khuyên cáo cho bệnh nhi tương tự như đối với bệnh nhãn nễười lớn. Phải tinh
đến sự thay đổi về cân nặng của bệnh nhi theo thời gian I 2 lần mức giới hạn trên của mức bình thường phù hợp theo tuối.
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI sử DỤNG
Đợc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thẽm thông tin, xin hòi ỷ
kiên bác sĩ.
Thuốc nảy chi dùng theo sự kê đơn của bác sĩ.
Quyết định thải trừ sắt tích tụ cần được cản nhắc cho từng cá thể bệnh nhân dựa
trên iợi ích và n uy cơ Iâmcảng cùa iiệu pháp chelat hóa theo dự đoán (xem phần
LIỆU LƯỢNG v CÁCH DUNG).
Cần thặn trọng với bệnh nhản cao tuồi do có tần suất cao hơn về các phản ứng bảt
lợi.
vè thận 'ầ
Đã ghi nhận creatinine huyêt thanh tảng không liên tục ở những bệnh nhản đươc
đìèu trị bảng Exjade, thường thì trong khoảng bình thường. Các trường hợp suy
thận cảp đá được báo cáo khi sử dụng Exjade trong giai đoạn hậu tiếp thị (xem
phần PHẢN ỪNG BÁT LỢI CÙA THUOC). Hìếm trường hợp suy thặn câp cần thầm
tách mảư.
Khuyên cáo đénh giá creatinine huyết thanh vảlhoặc độ thanh thải creatinine 2 iần
trước khi bảt đầu điêu trị vả sau đó theo dõi hảng tháng.
Bệnh nhân có sẵn bệnh thặn, hoặc bệnh nhân đang dùng những thuốc có khả nảng
lảm suy giảm chức nảng thận có thế có nguy cơ bị biến chứng nhiều hơn. Ở những
bệnh nhân nảy việc kiếm tra creatinin huyết thanh vèlhoặc độ thanh thải creatinine
được khuyến cáo thực hiện mỗi tuần trong tháng đầu tiên sau khi bắt đầu trị liệu
hoặc sau khi thay đồi trị liệu. và mỗi tháng sau đó. Cần thận trọng ở bệnh nhán có
độ thanh thải creatinine từ 40 đến dưới 60 mLJphủt, đặc biệt trong trường hợp có
kèm theo các yếu tố nguy cơ có khả nảng Iảm suy giảm chức năng thận như các
thuốc dùng đồng thời, sự mát nước. hoặc các nhiễm khuẩn nặng.
Bệnh lý ống thận đã được báo cáo trên bệnh nhản điều trị bằng Exjade. Phần lớn
bệnh nhân nảy lả trẻ em vả trẻ vị thảnh niên có bệnh Beta- thalassemia và nồng độ
ferritin huyết thanh < 1.500 microgam/L.
Xét nghiệm protein niệu phải được tiến hảnh hảng tháng.
Cần chú ý bồi phụ nước đầy đủ cho những bệnh nhản đang bị tiêu chảy h0ặc nôn.
Đối với bệnh nhân người lớn liều Exjade hảng ngảy có thể giảm còn 10 mglkg nếu
có tảng không tiền triến nồng độ creatinine huyêt thanh hơn 33% trên nòng độ trung
bình từ các xét nghiệm trước khi điều trị trong 2 lần kiêm tra liên tiếp vả không thể
quy cho nguyên nhân nảo khác (xem phần LIEU LƯỢNG VÀ CÁCH DÙNG) Đối với
bệnh nhi, có thế giảm liều còn 10 mg/kg nếu nồng độ creatinine huyêt thanh tảng
cao hơn giới hạn trèn của mưc binh thường theo tuối ở 2 lần kiếm tra Iièn tiếp.
Nếu creatinine huyết thanh tảng tiên_triẻn vượt hơn giới hạn trên của mức bình
thường thì phải ngững Exjade. Có thẻ khới đảu điều trị Exjade trở lại tùy theo tình
trạng tâm sảng của bệnh nhân.
Về gan
Exjade khỏng được khuyến cáo cho bệnh nhản bị Suy gan nặng (ChiId-Pugh C)
(xem phần LIEU LƯỢNG VÀ cAcn DÙNG vá DƯỢC LÂM SÀNG). Trị Iiệụ Eijade
chỉ được bắt đầu với bệnh nhản có mức men transaminase gan lúc ban đêm đèn 5
lần giới hạn trên của mức bình thường Dược động học của Deferasirox không bị
ảnh hướng bời những nồng độ transaminase như vậy. Deferasirox chủ yếu thải trữ
bảng phản ứng glucuronic hóa vả một lượng nhỏ (khoảng 8% ) chuyên hóa bới sư
oxi hóa qua cytochrome P450 (xem phần DƯỢC LÀM SÀNG)
Mặc dù tt gặp to 3%) tang các men transaminase hớn 10 lản mức tren cùagiớ'rhan
bình thường gợi ý tình trang viêm gan đá được quan sát thấy trong cảcthư nghiệm
lâm sáng Có những báo các hậu măi về Suy gan ở những bệnh nhân được điêu trị
bảng Exjade Hầu hết những báo cáo về suy gan đèn liên quan đến những bệnh
nhản bị mảc phối hợp nhiều bệnh nặng bao gồm cả xơ gan và suy đa cơ quan tử
vong đă được bảo cáo ở một vải trong số những bệnh nhân nảy (xem phần PHẢN
ỪNG BÁT LỢI CÙA THUOC). Nồng độ transaminase huyết thanh, bitirubin,
phosphatase kiềm cần được theo dõi trưởc khi bắt đầu điều trị mỗi 2 tuần trong
thảng đầu tiên và mỗi thảng sau đó. Phải ngừng dùng Exjade nếu nồng độ
transaminase trong huyêt thanh tảng liên tục vả tiên triển mã không thể quy cho
nguyên nhân náo khảo. Một khi đã xác định rõ nguyên nhản của cảc bắt thường về
xét nghiệm chức năng gan hoặc sau khi xét nghiệm chức nảng gan đã trở vê bình
thường, có thể cản nhắc bắt đầu điêu trị Exjade trở lại một cảch thận trọng với một
tiều thấp hơn, sau đó tăng liều dần dần Jz
vẻ tiêu hóa f/
Kích ứng đường tiêu hóa có thể xẩy ra trong quá trinh điều trị với EXJADE. Loét và
xuất huyết đường tiêu hóa trèn đá được báo cáo ở cảc bệnh nhân, bao gổm cả trẻ
em và thiếu niên dùng EXJADE. Rầt hiếm trường hợp tử vong do xuất huyết đường
tiêu hóa được báo cáo, đặc biệt ở người lớn tuồi bị bệnh máu ác tinh giai đoạn nặng
vả/hoặc bị giảm tiêu cầu Nhìèu ồ loét đă được quan sát thắy ở một số bệnh nhân
(xem phần PHẢN ỪNG BÁT LỢI CÙA THUOC) Bảo sĩ và bệnh nhản phải cảnh giảc
với các đế… hìệu và triệu chứng của loét vả xuất huyết tiêu hòa trong khi điều trị
bằng EXJADE và phải bắt đầu ngay !ảp tức việc kiềm tra vá điều trị thèm nêu nghi
ngờ có một biến có bẩt lợi nghiêm trọng của đường tiêu hóa.
Thận trqng với những bệnh nhản đang dùng EXJADE kết hợp với những thuốc
được biêt lá có khả nảng gảy loét như cảc thuôo khảng viêm khỏng steroid (NSAID)
corticosteroid hoán: bisphosphonate đường uống. và các bệnh nhân đang dùng
thuốc chõng đông (xem phần TƯỜNG TÁC) vá các bệnh nhản có số lượng tiều cảu
đưới 50 x 1OSIL
Cảc rối ioạn về da
Có thể có nồi ban ở da trong khi điều trị bằng Exjade. Đối với ban mừc đó nhe đén
trung bình, có thẻ tiêp tục dùng Exjade mả không cần điều chỉnh liều, vì ban thường
tự mảt đi. Đối với ban nặng hơn. có thể cần phải ngừng điều trị. có thể dùng Exjade
trở lại sau khi đã hết ban. với một Iìều thắp hơn, sau đó tăng liều dần dần. Trong
trường hợp nghiêm trọng có thế tiến hảnh điều trị trở lại phối hợp với một thụổc
steroid đường uống dùng trong thời gian ngắn. Hiếm trường hợp báo cáo vẻ hỏng
ban đa dạng trong thời gian trị iiệu Exjade.
Cảc phản ứng quá mẫn
Cảc trường hợp hiếm gặp bị các phản ứng quá mẫn nghiêm trọng (như phản ứng
phản vệ, phù mạch) đã được báo cáo ở những bệnh nhân dùng Exjade với khởi
phát phản ứng xảy ra ngay trong tháng đầu điềư trị ở phần lớn các trường hợp (xem
phản PHÀN ƯNG BÀT LỢI CUA THUOC). Nêu cảc phản ứng xảy ra nặng, phải
ngừng dùng Exjade vả phải tiến hảnh can thiệp y khoa thich hợp.
Thi giác và thính giác
Rối Ioạn thinh giác (nghe giảm) và rối ioạn ở mắt (đục thùy tinh thề) đã được ghi
nhận trong khi điều trị bằng Exjade (xem phần PHẢN ỪNG BẢT LỢI CÙA THUỐC).
Khuyến các xét nghiệm về thinh giác và về mắt (bao gồm soi đảy mắt) trước khi
~khời đầưđlèu tri bảng“Exjade"Văờ’hhững'Khoảng cách đèu đặn'sauđó'(mõi 12—~~*
théng). Nêu thảy có rối loạn, có thế cân nhắc giảm Iiẻu hoặc ngững dùng thuốc.
Các rối Ioạn về máu
Có những bảo cáo hậu mải (cả tự phát vả từ những thử nghiệm lảm sảng) về giảm
tế bảo máu ở bệnh nhản điều trị với Exjade. Hầu hềt cả bệnh nhân nảy đèu có
những rôi loạn vè máu từ trước thường liên quan đên suy tủy xương (xem phần
PHẢN ỨNG BÁT LỢI CÙA THUOC). Mối liên hệ giữa những triệu chứng nảy với
việc dùn thuốc Exjade iả không chắc chắn. Để đảm bảo việc quản lý lâm sảng
chuẩn đ i với những rối loạn về mảư nảy, phải kiểm tra công thức mảu thườn
xuyên. Ngừng điều trị với Exjade phải được xem xét ở những bệnh nhân bị giảm tè
bảo máu không giải thich được. Điều trị lại với Exjade có thế được xem xét một khi
nguyên nhản Iảm giảm tế bảo máu đã được sáng tỏ. Ề
Các lưu ý khác
Khuyên các xét nghiệm ferritin huyết thanh mỗi tháng để đánh giá đáp ứng của bệnh
nhán với điều trị (xem phần LIEU LƯỢNG VÀ CÁCH DÙNG). Với bệnh nhân có
nộng độ ferritin huyêt thanh đạt đến mục tiêu điều trị (thường trong khoảng từ 500
đẻn 1.000 microgam/L). Việc giảm liều từ từ từng bước 5 đên 10 mg/kg cần được
xem_ xét để duy trì nồng độ ferritin huyết thanh trong khoảng mục tiêu. Nếu ferritin
huyêt thanh hạ ôn định dưới 500 microgramlL, cằn xem xét ngừng điêu tri. Cũng
như với điều trị chelat hóa sắt khác, nguy cơ nhiễm độc Exjade có thề táng Ièn khi
dùng liêu cao không thich hợp cho những bệnh nhân bị gánh nặng về sải không
nhiều hoặc mức ferritin huyết thanh chỉ tảng nhẹ.
Exjade không liên quan với chặm tảng trướng ở trẻ em được theo dõi đến 5 năm
trong cảc thử nghiệm lâm sảng. Tuy nhiên như là biện pháp thận trọng chung, có thế
theo dõi thể trọng vả sự tăng trưởng chiều cao của bệnh nhì ở các khoảng cách đều
đặn (mỗi 12 tháng).
Khỏng được phối hợp Exjade với liệu pháp dùng chảt chelat hóa sắt khác vì tính an
toản của sự phối hợp nảy chưa được xác định.
Viên nén có chứa Iactose (1,1 mg Iactose đối với mỗi mg deferasirox). Thuốc nảy
không khuyến cáo dùng cho bệnh nhản bị các rối ioạn di truyền hiếm gặp về không
dung nạp gaiactose. thiếu hụt lactase trầm trọng hoặc kém hảp thu glucose—
galactose.
Đối với người điều khiển phương tiện và vận hảnh máy
Chưa có nghiên cứu nảo về ảnh hưởng củaẸxjade đén khảnăng lái xe và vặn hánh
máy móc được thực hiệanệnh nhân có thẻ có tác dụng bât lợi không thường gặp
như chóng mặt. hoa măt cân thận trọng khi lái xe hay vận hảnh máy.
TƯỜNG TÁC THUỐC
Thuốc Iảm giảm tiếp xúc toản thân Exjade
Trong một nghiên cứu trèn người tình nguyện khỏe mạnh, việc dùng đồng thời (đơn
liều 30mglkg) với rifampicỉn lả một chất cảm ứng mạnh UDP-
glucuronosyltransferase (UGT) (liều iặp lại 600 mglngảy) dẫn đến sự giảm mức tiẻp
xúc deferasirox xuống 44%. Do đó, việc sử dụng đồng thời Exjade với các thuốc gảy
cảm ửng mạnh với UGT (rifampicỉn. phenytoin. phenobarbital, ...) có thế lảm giảm
hiệu quả của Exjade. Nếu dùng đồng thời Exjade vả chảt cảm ứng mạnh UGT, việc
tăng liều Exjade cần được xem xét trên cơ sở đáp ứng điều trị lâm sảng.
Tương tác với…thức ăn
Sinh khả dụng cùa deferasirox tãng đén một khoậng thay đối khi được dưng cùng
với thức ăn. Vì vậy p_hải dt_`mg Exjade khi đói ít nhảt 30 phút trước khi ăn, tôt nhât lả
vảo cùng một thời điêm môi ngảy (xem phân LIÊU LƯỢNG VÀ CÁCH DUNG).
Tương tác với Midazolam vả các chẩt chuyển hóa bời CYP3A4
Trong một nghiên cứu trẻn người tình nguyện khỏe mạnh, việc dùng đồng thời
EXJADE vả midazolam (iả một chất nền CYP3A4) lảm giảm mức tiếp xúc
midazolam xuống 17%. Trong thưc té lảm sảng, tác dụng nảy thảy rõ rảng hơn. Do
tình trạng giảm tác dụng có thể xảy ra, phải thặn trọng khi dùng deferasirox cùng với
các thuốc được chuyền hóa qua CYP3A4 (ví dụ như ciclosporin, simvastatin, các
thuốc tránh thai nhóm nội tiết tố).
Tương tác với Repaglinide và các tác nhán chuyến hóa qua CYP2C8 ả
Theo một nghiên cứu trèn người tình nguyện khỏe mạnh, việc sử dụng đồng thời
Exjade (liều nhắc lại 30mglkglngảy) vả Repaglinide - cơ chắt cvpzce (đơn iièu
0,5mg) dẫn đến sự tảng diện tích dưới đường cong AUC vả Cmax của repaglinide lên
131% (90% Ci: 103% to 164%) và 62% (90% Ci: 42% to 84%) theo thứ tự. Khi dùng
đồng thời Exjade vả repaglinide, cần theo dỏi cản thận nồng độ glucose. Không thể
loại trừ tương tác giữa Exjade vả các cơ chẩt CYP2C8 khác như paclitaxel.
Tương tác vởi theophylline vả các tảc nhân chuyển hóa bời CYP1A2
Theo một nghiên cứu trện người tình nguyện khỏe mạnh, việc sử dụng đồng thời
Exjade (Iièu iặp lại 30mglkg/ngảy) vả Theophyline — cơ chảt của CYP1A2 (liều đơn
120mg) dẫn đén sự tăng diện tích dưới đường cong AUC của theophyline lên 84%
(90% CI: 73% to 95%). Nồng độ thuốc tối đa cmax khi dùng một liều đơn không bị
ảnh hưởng nhưng khi dùng với liều lặp đi lặp lại, nồng độ tối đa Cmax của
theophylline tảng lèn. Khi dùng đồng thời Exjade vả theophylline, cần thực hiện theo
dõi nồng độ theophylline vả có thể xem xét giảm Iìều theophylline nếu cần thiết. Sự
tương tảo giữa Exjade vả các cơ chắt khảo của CYP1A2 có thể xảy ra.
Các thông tỉn khác
Chưa thấy tương tác nảo giữa Exjade vả digoxin ở người tinh nguyện khoẻ mạnh.
Chưa có nghiên cứu chính thức về việc dùng đòng thời Exjade vả vitamin C. Liều
vitamin C đèn 200 mg/ngáy khòng kèm theo cảc hậu quả bảt iợi.
KHÔNG KHUYÉN CÁO DÙNG ĐÔNG THỜI VỚI CÁC THUOC ĐÁ ĐƯỢC DỰ
ĐOÁN CÓ sự TƯỜNG TÁC
Chưa có nghiên cứu chỉnh thức về việc dùng đồng thời Exjade vả các c_hế phảm
kháng acid chứa nhôm. Không được dùng viên'nén Exjade với cảc chê phârn kháng
acid chữa nhôm mặc dù deferasirox có ái lưc đôi với nhôm thảp hơn so với săt.
Dùng đòng thời Exjade với cảc thuốc được biêt có khả náng gảy loét như các thuốc
chống viêm không steroid NSAID, corticosteroid, hoặc bisphosphonat đướng uống.
và dùng Exjade cho bệnh nhân đang điều trị thuốc chốn đôn có thế Iảm tăng nguy
cơ gây kich thích đường tiêu hóa (xem phần CẢNH BỄO vẵ THẬN TRỌNG ĐẶC
BIỆT KHI SỬ DỤNG)
PHỤ NỮ có THAI VÀ CHO CON BỦ
cc thai
Chưa có dữ liệu lâm sảng về việc dùng deferasirox khi mang thai. Các nghiên cứu ở
“ ”độrigVặt đã ch`õ’thấyTriộicốđộ'c tinhiv'ẻ`ẻinh sản ở iiẽu độc cho Vặt mẹ (xem phân
CÁC DỮ LIEU AN TOÀN TIÊN LÀM SÀNG). Chưa rõ khả năng về nguy cơ đôi với
người.
Để thận trọng. khuyến cáo không dùng Exjade trong thai kỳ trừ khi thật sự cần thiết.
Cho con bú
Trong các nghiên cứu ở động vật, đã ghi nhận deferasìrox được bải tiết nhanh vả
mạnh vảo sữa của vật mẹ. Chưa thây tảo dụng trện con. Chưa rõ deferasirox có
được bải tiết vảo sữa người hay không. Không khuyên cáo cho con bú trong khi
đang dùng Exjade.
LÁI XE vÀ VẬN HÀNH MÁY MÓC ễ
Chưa có nghiện cứu được thực hìện về tác dụng cùa Exjade trèn khả năng lái xe
hoặc vận hảnh máy móc. Những bệnh nhân thỉnh thoảng gặp tác dụng phụ chóng
mặt cầ_n thặn trọng khi lái xe hoặc vặn hảnh mảy móc (xem phần PHÀN ỨNG BÀT
LỢI CUA THUOC).
PHẢN ỪNG BÁT LỢI CÙA THUỐC
Những phản ứng bắt lợi thường gặp nhảt đá được ghi nhặn trong khi điều trị kéo dải
với Exjade ở bệnh nhân người lớn vả trẻ em bao gồm các rói loạn tiêu hòa trong
khoảng 26% bệnh nhân (chủ yêu lả buồn nôn, nôn, tiêu chảy hoặc đau bụng) và nỗi
ban da khoảng 7% bệnh nhân. Những phản ứng năy phụ thuộc liều dùng, hầu hết là
nhẹ đên trung bình, nới chung chi thoáng qua và hầu hết mảt đi ngay cả khi tiêp tục
điêu trị. Tăng creatinine huyết thanh nhẹ, khỏng tiên triến, hảu hết lá trong mức binh
thường. xảy ra trong khoảng 34% bệnh nhản. Tình trạng tăng cretinin nảy phụ thuộc
liêụ đùng. thường tự thoải lui vả đỏi khi có thể giảm đi bằng cách giảm iiếu (xem
phân CẢNH BÁO VÀ THẶN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG).
Đã có báo cáo về các trường hợp tăng transaminase gan trong Ighoảng 2% bệnh
nhán. Những trướng hợp nảy không phụ thuộc iièu và phân lớn sô bệnh nhán náy
đã có nong độ men tăng trước khi dùng Exjade. Tăng transaminase cao hơn gảp 10
lần giới hạn trèn của mức bình thường gợi ý viêm gan- là trường hợp ít gặp (0, 3%).
Có những báo các hậu mải vè suy gan ở những bệnh nhản được điêu trị bằng
Exjade Hầu hềt những báo cáo vè suy gan lièn quan đến những bệnh nhán mảc
đồng thời nhiều bệnh nặng bao gồm cả xơ gan và suy đa cơ quan; tử vong đă được
báo cáo ở một vải trong số những bệnh nhân nảy.
Cũng như điếu trị bằng chắt cheia_t hóa sắt khác, mất thinh iưc đối với tần số cao và
đục thủỵ tinh thẻ (đục thủy tinh thẻ sớm) thỉnh thoảng đã quan sát thây ở bệnh nhản
được điều trị bằng Exjade (xem phần CÀNH BÁO VÀ THAN TRỌNG ĐAG BIẸT KHI
SỬ DỤNG).
Cảo phản ửng bẩt iợi cùa thuốc. được liệt kê trong Bảng 1 được báo cảo trong cậc
thử nghiệm Iảm sảng theo sau điều trị bằng Exjade Các phản ứng bắt lợi được xẻp
dưới đảy sử dụng quy ườc sau: rất hay gặp (> 1/10); hay gặp (> 1/100, < 1110); ít
gặp (› 111 000, < 1/100), hiẻm gặp (› mo ooo, < 111.000), rắt hiếm gặp (<
1/10 000) Trong mỗi nhóm xếp theo tần suất, các phản ứng bất lợi được trình bảy
theo thứ tự nghiêm trọng giảm dần.
Bảng 1 Cảo phản ứng bắt lợi cùa thuốc được báo cảo trong các thử
nghiệm lâm sảng
Rối Ioạn tâm thần
~ -~ tit~gặpt~ -~-Lơ—ảm-rốiloạn-giẳơngử* _ _________úỷ
Rối loạn hệ thần kinh
Hay gặp: Nhức đằu
ít gặp: Chóng mặt
Rối Ioạn về mắt
Ỉt gặp: Đục thủy tinh thể giai đoạn đầu, bệnh hoảng điếm
Hiêm gặp: Viêm dây thần kinh thị giác
Rối loạn tai vả mè đạo
Ítgặp: Mắt thinh lực
Rối ioạn hô hắp, ngực và trung thẩt Jẳ/
It gặp: Đau họng vả thanh quản
Rối loạn tiêu hóa
Hay gặpt Tiêu chảy, táo bón, nòn, buồn nón, đau bụng, chướng bụng,
khó tiêu
it gặp: Xuất huyềt tiêu hóa, Ioét dạ đáy (bao gồm cả loét đa ồ), loét
tả tráng, viêm đạ dảy.
Hiếm gặp: Viêm thực quản
Rối loạn gan mật
Hay gặp: Tăng transaminase
ĩt gặp: Viêm gan, sòi mật
Rối Ioạn da vả mô dưởi da
Hay gặp: Ban, ngưa
Ỉt gặp: Rối Ioạn sắc tố
Hiếm gặp Hồng ban đa dạng
Rối loạn thận vả tiết niệu
Rắt hay gặp: Tảng creatinine mảư
Hay gặp: Protein niệu
Ít gặp: Bệnh iý ống thận (hội chứng Fanconi)
Rối Ioạn toản thân và tinh trạng tại chỗ dùng thuốc
it gỉ Sốt, phù, mệt mỏi
Danh sách các phản ứng bắt lợi của thuốc từ những bảo các tự phát hậu mải
Cảo phản ứng bắt iợi được báo cảo tự phát được trình bậy trong Bảng 2, là những
báo cảo tư nguyện và thường không thế xảc lặp tân suảt hoặc mối quan hệ nhân
quả với việc dùng thuốc.
Bảng 2 Các phản ứng bất lợi của thuốc nhặn được từ những bảo cáo tự
phát
Rối loạn thặn và tiết niệu
Suy thận cảp (chủ yếu lả creatìnin huyết thanh tảng 2 2 Iản giới hạn trện của
mức bình thường và thường hôi phục sau khi ngưng điều trị), bệnh lý óng
thặn—mô kẻ.
Rối Ioạn gan mật
Suy gan
-BêUeăuáửưèéướitỉ _ … _ … __ __ … _ __
Vièm mao mạch quá mẫn (Ieukocytoclastic vasculitis), mảy đay, rụng tóc.
Rối Ioạn hệ miễn dịch
Cảo phản ứng quá mẫn (bao gồm phản ứng phản vệ và phù mạch)
Có các báo các hậu mải (cả bảo cáo tự phảt và bảo các từ thử nghiệm lâm sảng) về
các chưng giảm tế bảo máu bao gồm giảm bạch cầu trung tính, giảm tiêu cảu vả lảm
trầm trọng thêm tinh trạng thiếu máu ở bệnh nhân điều trị với Exjade. Hầu hêt các
bệnh nhân nảy đều đã có sẳn các rối loạn về máu có thường két hợp với suy tủy
xương (xem phần CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT KHI SỬ DỤNG). Chưa
rõ mối quan hệ cùa cảc tình trạng nảy vởi trị iiệu Exjade.
Với bệnh nhi: óầ
Bệnh lý ông thận đã được báocáo trên bệnh nhân điêu trị bằng Exjade. Phần lớn
bệnh nhân nảy lả trẻ em vả thiêu niên có bệnh Beta-thalassemia và nòng đồ ferritin
máu thảp < 1.500 microgram/L
Thông báo cho bác sĩ những PHẢN ỨNG BÁT Lợi CÙA THUỐC gặp phải khi
sử dụng thuôo.
QUÁ LIỀU
Các trường hợp quá liều (gầp 2 đến 3 lần liều được kê trong nhiều tuân) đã được
báo cáo. Trong một trường hợp, điều nảy gây vìêm gan cận lâm sảng (không có
biếu hiện Iảm sảng) nhưng tự khỏi mã không gây hậu quả lâu dải sau khi ngừng
thuôo. Các iiều đơn 80 mg/kg ở bệnh nhân thalassaemia bị quá tải sắt đã được
dung nap, chỉ ghi nhận có buồn nôn nhẹ và tiêu chảy. Liều đơn đén 40 mg/kg ở
người bình thường được dung nạp tốt.
Các dắu hiệu quệ liềụ cắp tinh bao gồm buồn nôn, nòn, nhức đầu vả tiêu chảy. Có
thể điều trị quá liêu băng cách gây nỏn hoặc rứa dạ dảy và điều trị triệu chứng.
DƯỢC LỰC HỌC
Cơ chế tác dụng
Deferasirox lả một thuốc lảm chelat hóa có hoạt tinh dùng đường uống có tính chọn
lọc cao đối với sắt ill. Phản tử deferasirox gồm ba nhánh gắn vảo sắt với ái lưc cao
theo tỷ lệ 2:1. Deterasirox Iảm tảng cường bải tiêt sắt, chủ yêu ua phản.
Deferasirox có ải lưc thảp đỏi với kẽm và đồng, không gây ra nồng độ th p liên tục
trong huyêt thanh của những kim Ioại nảy.
Dược lực học
Trong một nghiên cứu về chuyến hóa đối với cản bằng sắt trẻn những bệnh nhân bị
bệnh thiêu mảư Địa Trung Hải (Thalassaemia) bị quá tải sắt, Exjade với các liều
hặng ngảy 10, 20 và 40 mg/kẵ đã tạo ra bái tiét sắt th_ực trung bình là 0,119 mg
sảng thế trọnglngảy đòi với li u 10 mglkg, 0.329 mg săng the trọnglngảy đối với
iiều 20 mglkg và 0,445 mg sắng thề trọnglngảy đói với liều 40 mglkg.
Exjade đá được nghiên cứu trên bệnh nhản người iớn và trẻ em (từ 2 tuổi trở lẻn) bị
quá tải sắt mản tinh do truyền máu. Tinh trạng bệnh chinh cần truyền máu bao gòm
bệnh thalassemia beta, bệnh hồng cầu hình liêm vả các bệnh thiếu máu bầm sinh và
mắc phải khác (hội chưng loạn sản tùy, hội chứng Diamond-Blackfan, thiếu máu bảt
sản và các thiêu máu hiẻm gặp khác).
Điều trị hảng ngảy bẵng Exjade vởi cảc iĨễu 20 và ao mglkg trong một năm cho
những bệnh nhán người lớn và trẻ em được truyền máu thường xuyên do bệnh
thalassemia beta đã dẫn đến giảm các chỉ số sắt toản phần trong cơ thế; nòng độ
sắt ở gan giảm trung bình khoảng -0,4 mg sắtlg gan (trọng lượng khó khi sinh thiêt)
ở liều 20 mg/kg và -8.9 mg sắtlg gan ở iièu 30 mg/kg, vả ferritin huyết thanh giảm
trung binh khoảng -36 pg/L ở Iièu 20 mglkg và -926 ug/L ở Iièu 30 mglkg. Khi dùng
c0ng những liều nảy tỷ lệ giữa bải tiêt sắt trên thu nhận sẳt là 1,02 (biều thị cân bằng
săt thực) và 1,67 (biếu thị loại bỏ sắt thưc) tương ứng. Exjade tạo ra đáp ứng tương
tự ở bệnh nhân bị các bệnh thìếu máu khác có quá tải sắt, Liều dùng hảng ngảy 10
mg/kg trong một nảm có thế duy trì nồng độ sắt ở gan vả nồng độ ferritin trong huyết
thanh, và tạo ra cân bằng săt thực sự ở những bệnh nhân truyền máu khỏng thường
xuyên hoặc truyền thay máu. Ferritin huyêt thanh được đánh giá bằng cách theo dõi
háng tháng đã phản ánh các thay đồi nồng độ sắt trong gan cho thấy là các biến
chuyên của ferritin huyết thanh có thế được dùng để theo dỏì đáp ứng với điều trị.
Đối với bệnh nhân có iắng đọng săt ở tim (MR! T2*<20ms) được điều trị với Exjade
đèn cho thảy sự thải trừ sắt lắng đọng được chứng minh bởi quá trinh cải thiện giá
trị T2“ trong hơn ba năm theo dòi. Ở bệnh nhản không có lắng đọng sắt ở tim,
Exjade đã cho thắy có tác dụng ngản ngừa về lâm sảng sự lắng đọng sắt trong tim
có Iiẻn quạn (duy trì T2“ > 20ms) trong hơn 1 năm quan sát, mặc dù vẫn tiếp tục
được truyẻn máu đáng kể.
DƯỢC ĐỘNG HỌC ả
Hẳp thu
10
Deferasirox được hắp thu sau khi dùng đường uống với thời gian trung binh đạt
được nồng độ cao nhảt trong huyết tương (t….) khoảng 1 5- 4 giờ. Sinh khả dụng
tuyệt đối (diện tích dưới đường cong nồng độ- AUC) của deferasirox ở viên nén
Exjade khoảng 70% so với một Iièu tiêm tĩnh mạch. Tồng lượng thuốc tốn lưu (diện
tích dưới đường cong) xáp xi gảp đôi khi dùng cùng với bữa ản sáng nhiều chải béo
(hảm lượng chât béo > 50% caio) và khoảng 50% khi dùng cùng với bữa ăn sáng
chuẩn Sinh khả dụng (diện tich dưới đường cong nồng độ) cùa deferasirox tảng lên
vừa phải (khoảng 13- 25%), khi được dùng trước bữa ăn 30 phủt với hảm lượng chảt
béo bình thường hoặc cao Tỗng lượng thuốc tồn lưu (diện tich dưới đường cong
nồng độ) đối với deferasirox sau khi uõng viên nén được phân tán trong nước cam
hoặc nước táo tương đương với sau khi phân tán trong nước (tỷ lệ AUC tương đối
lả 103% khi dùng nước cam vá 90% khi dùng nước táo).
Phân bố
Deferasirox iiên kêt mạnh với protein huyết tương (99%), hầu như duy nhắt lả
albumin huyêt thanh, và có thể tích phân bố nhỏ vảo khoảng 14 L ở người lớn.
Biến đổi sinh học
Glucuronide hóa lả đướng chuyên hóa chinh đối với deferasirox, sau đó bải tiết qua
mặt. Sư khử Iièn hợp các glucuronide ở ruột vả tái hắp thu sau đó (chu trình gan-
' r"ưột) ĩ:õ thè' 'X'ảỹĩa.’ Dẽtèfáèỉr“oĩ ẻh'ủ“ýêiỉđượẽ ’giucủrỡnTcữehởaĩiĩới UGT1Ã1 ĩảWT
một mức độ it hơn bởi UGT1A3. Sự chuyến hóa deferasirox qua sự di hớa CYP450
(oxy hóa) dường như rắt ít ở người (khoảng 8%). Chưa thấy sự ức chế chuyến hóa
deferasirox do hydroxyurea in vitro Deferasirox trải qua chu trinh gan ruột Trong
một nghiên cứu trẻn người tình nguyện khỏe mạnh dùng cholestyramine sau một
Iièu đơn deferasirox dẫn đến giảm 45% mức tồn lưu cùa deferasirox (AUC).
Thải trừ
Deferasirox và các chảt chuyến hóa cùa nó chủ yếu được bải tiết qua phản (84%
Iièu dùng) Bái tiêt deferasirox và các chắt chuyến hóa của nó qua thện rắt it (8%
iiều dùng). Thời gian bán thải (tin) trung bình từ 8 đẻn 16 giờ
Sự tuyến tỉnh/ không tuyến tinh
Nòng độ cao nhảt trong huyêt tương (Cmẹx) vả diện tích dưới đường cong nồng độ
(AUCO 24 glc,) cùa deferasirox táng gản tuyến tinh với liều dùng ở trạng thải ôn định.
Khi dùng đa liêu tòn iưu thuốc táng lên từ 1, 3 đến 2, 3 lần.
Bệnh nhán đặc biệt JỄ>
Bệnh nhi
Tồn lưu thuốc toản bộ ở thiêu niên (12 đến s 17 tuồi) và trẻ em (2 đến < 12 tuồi) đối
với deferasirox sau khi dùng đơn liều và đa liều thì thắp hơn so với ở bệnh nhản
người lớn Ở trẻ em dưới 6 tuồi sự tồn lưu thuốc thảp hơn khoảng 50% so vời người
lớn. Vì liều dùng được điều chỉnh cho từng bệnh nhi tùy theo đáp ứng nên không có
khả năng có các hậu quả trên lâm sáng
Giới tỉnh
Phụ nữ có độ thanh thải bìẻu kiến cùa deferasirox thắp hơn một cách vừa phải
(17,5%) so với nam giới. Vì liều dùng được điêu chỉnh cho từng bệnh nhản tùy theo
đáp ứng nên không có khả năng có cảc hậu quả trèn lảm sảng
Bệnh nhân cao tuối
11
Chưa có nghiên cứu về dược động học của deferasirox trèn bệnh nhản cao tuồi (từ
65 tuổi trở lên).
Suy thặn hoặc suy gan
Chưa có nghiên cứu dược động học của deferasirox trên bệnh nhân suy thận.
Diện tich dưới đường cong trung bình của deferasirox ở 6 bệnh nhản bị suy gan nhẹ
(Child—Pugh A) tảng 16% so với giá trị có được của 6 bệnh nhân có chức năng gan
bình thường. Diện tích dưới đường cong trung bình của deferasirox ở 6 bệnh nhản
suy gan trung bình (Child— Pugh B) tảng iên 76% so với giá trị có được cùa 6 bệnh
nhản có chức năng gan binh thường Nồng độ tối đa Cma, trung binh của deferasirox
ở cả bệnh nhản suy gan nhẹ và trung bình đếu tảng 22% so với bệnh nhân có chức
năng gan bình thường Tảc động đối với bệnh nhản suy gan nặng (Child- Pugh C)
chi được đảnh giá ở một bệnh nhản ( xem phần LIEU LƯỢNG VÀ CACH DÙNG Vả
CẢNH BÁO VÀ THẬN TRỌNG ĐẶC BIẸT). Dược động học của deferasirox không
bị ảnh hưởng bời các nồng độ transaminase gan cao đén 5 lần so với giới hạn trẻn
của mức bỉnh thường.
cÁc DỮ LIẸU AN TOÀN TIÊN LÂM SÀNG
Các dữ liệu an toản tiền lâm sảng không phát hiện nguy cơ đặc biệt nảo đối với
bệnhnhân 'bi quá-tải-sắt, dựatrèn các~nghièn~cứu~thôngthườngvèđược-iý học an-——
toán, độc tinh Iièu lặp lại, độc tính gen hoặc khả năng gây ung thư. Phát hiện chinh
lả độc tinh với thản và đục thủy tinh thề. Các phảt hiện tương tự đã quan sát thây ở
động vặt mới sinh và động vặt chưa trưởng thảnh. Độc tính với thận chủ yêu được
cho là do sự cạn kiệt sắt ở động vặt không bị quá tải sắt từ trước.
Khả năng gây độc đối với sự sinh sản đã được đảnh giá trẻn chuột vả thỏ.
Deferasirox không gây quái thai nhưng Iảm tăng tần suất những thay đồi về bộ
xương vả chuột con chết khi sinh khi dùng Iièu cao gây độc mạnh cho vặt mẹ không
bị quá tải sắt. Deferasirox không gây các tác dụng khảc trên sự thụ thai hoặc sự sinh
san.
cÁc Dữ L1ẸU AN TOÀN LÀM SÀNG JỄ
THỬ NGHIỆM LÂM SÀNG
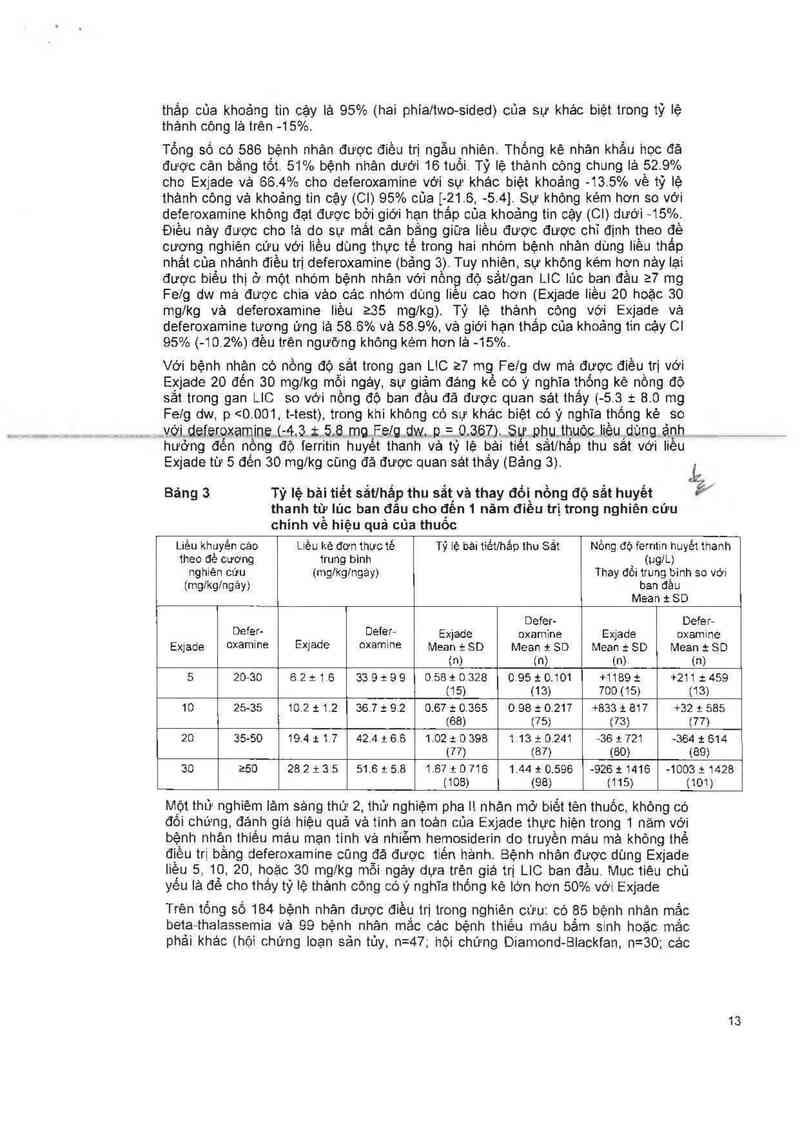
Một thừ nghiêm lảm sảng phase III, biết tèn thuỏc, ngẫu nhiên có đối chứng với
thuốc có hoạt tính, so sánh giữa Exjade vả Desferal (deferoxamin) được tiên hảnh
vởi bệnh nhản beta-thaiassemia vả nhiễm hemosiderin do truyền máu. Bệnh nhân từ
2 tuối trớ lèn được chia ngẫu nhiên với tỉ lệ 1:1 đế nhặn hoặc Exjade dạng uống với
liêu khới đầu 5, 10, 20 hoặc 30mglkg ngảy một lần hoặc Desferal (deferoxamin) tiêm
dưới da với Iièu khởi đầu từ 20 đến 60mg/kg ít nhảt 5 ngáy/tuần dựa trèn nồng độ
sắt trong gan (LIC) ở thời điềm bát đầu nghiên cứu (2 đên 3 >3 đến 7, ›? đến 14 và
>14mg Felg trọng lượng khô d(w)) Bệnh nhân chọn ngẫu nhiên vảo nhóm
deferoxamine mà có giá trị LIC < 7mg/g dw được tiếp tục dùng liều deferoxamin đã
dùng trước đó, mặc dù Iièu dùng đó có thế cao hơn đề cương nghiên cứu
LiC được đánh giá vảo lúc bắt đảu và sau 12 tháng điều trị bằng sinh thiết gan hoặc
đo không xâm Iản bảng thiết bị đo độ cảm ứng từ trường sinh học Tỷ lệ thảnh còng,
mục tiêu hiệu quả chính, được xác định bởi sự giảm giá trị LIC za mg Felg dw cho
các trướng hợp có giá trị LIC lúc ban đầu 210 mg Felg dw, giảm xuống mức <7 mg
Felg dw cho các trướng hợp có giá trị LIC lúc ban đầu trong khoảng từ 7 đến <10
mg Felg dw, hoặc duy trì hoặc giảm LIC cho các trường hợp giá trị LIC lúc ban đầu
5
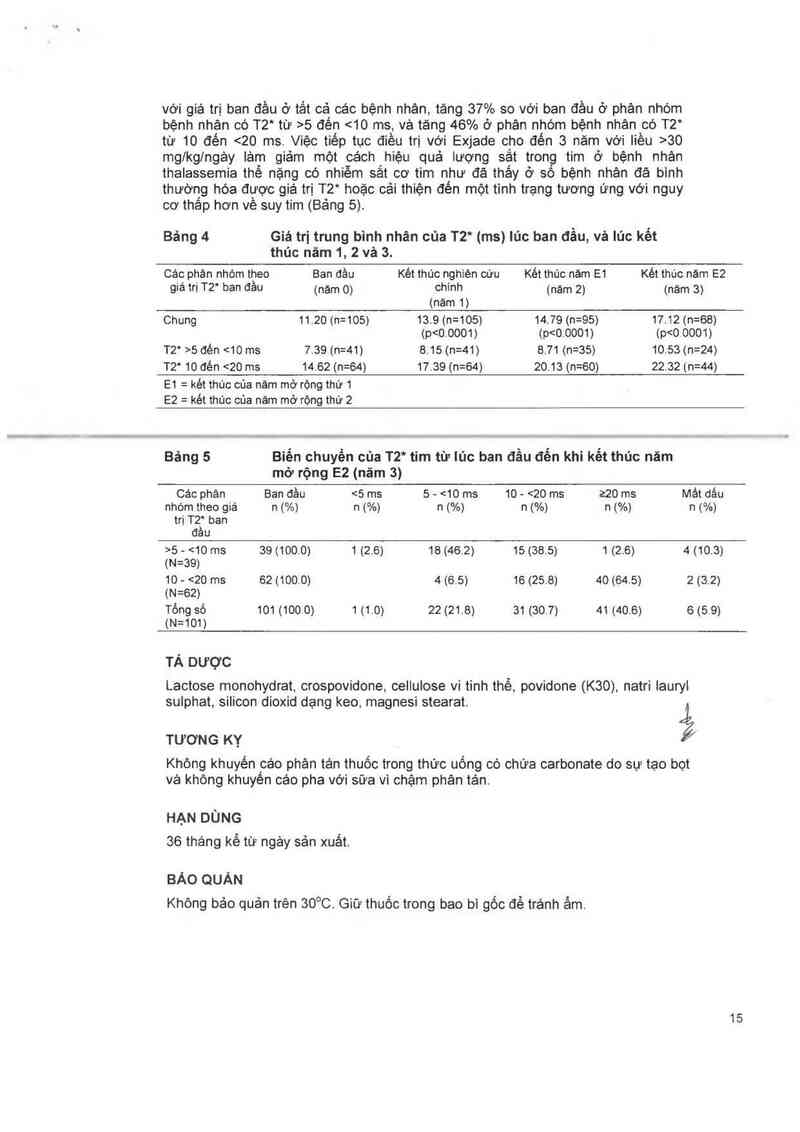
cho đên <10 ms), và với phân nhóm có quá tải sắt ở tim nhẹ vả vữa (T2* tư 10 đên
20 ms) (Bảng 4). Sử dụng tỷ sô trung bình nhản, sự gia tăng giá trị T2“ là 43% so
14
với giá trị ban đầu ở tẩt cả các bệnh nhản, tảng 37% so với ban đầu ở phân nhóm
bệnh nhân có T2“ từ >5 đến <10 ms, vả tảng 46% ở phán nhóm bệnh nhân có T2“
từ 10 đén <20 ms. Việc tiếp tục điều trị với Exjade cho đến 3 năm với liều >30
mglkg/ngảy Iảm giảm một cảch hiệu quả lượng sắt trong tim ở bệnh nhản
thalassemia thể nặng có nhiễm sắt cơ tim như đã thấy ở số bệnh nhản đá binh
thường hóa được giá trị T2“ hoặc cải thiện đẻn một tỉnh trạng tượng ứng với nguy
cơ thâp hơn vè suy tim (Bảng 5).
Bảng 4 Giá trị trung bình nhân của T2* (ms) lủc ban đầu, vả lủc kết
thúc năm 1, 2 vả 3.
Các phán nhóm theo Ban đèu Két thúc nghiện cứu Két thúc nảm E1 Két thúc nảm E2
giá trị T2“ ban đầu (nảm 0) chinh (nám 2) (nảm 3)
(năm 1)
Chung 11.20 (n=105) 13.9 (n=105) 14.79 (n=95) 17.12 (n=68)
(p<0.0001) (p<0.0001) (p5 - <10 ms 39 (100.0) 1 (26) 18 (46.2) 15 (385) 1 (2.6) 4 (10.3)
(N=39)
10 - <20 ms 62 (100.0) 4 (6.5) 16 (258) 40 (64.5) 2 (3.2)
(N=62)
Tổng Số 101 (100 0) 1 (1.0) 22 (21.8) 31 (30.7) 41 (40.6) 6 (5.9)
(N=101)
TẢ DƯỢC
Lactose monohydrat, crospovidone, cellulose vi tinh thê, povidone (K30), natri lauryi
sulphat, silicon di0xid dạng keo, magnesi stearat.
TƯơNG KY Ế
Khỏng khuyên cáo phản tán thuốc trong thức uống có chứa carbonate do sự tạo bọt
vả không khuyến các pha vời sữa vì chậm phân tán.
HẠN DÙNG
36 tháng kể từ ngèy sản xuất.
BẢO QUẢN
Không bảo quản trên 30°C. Giữ thuốc trong bao bì gốc để tránh ấm.
15
Không dùng Exjade quá hạn sử dụng được ghi "EXP" trèn bao bi.
HƯỞNG DẢN SỬ DỤNG vÀ THAO TÁC
Note: Exjade phải đề xa tầm tay và tầm nhin của trẻ em.
QUY cÁcu ĐÓNG GÓI
Exjade 125, 250, 500 mg: Hộp 4 ví x 7 viên nén phản tán.
TIÊU CHUÁN
Nhà sản xuảt
NHÀ SẢN XUẤT
Novartis Pharma Stein AG
Schaffhauserstrasse
CH-4332 Stein
Thụy Sĩ
Cho Novartis Pharma AG, Basic, Thụy Sĩ
Tờ hướng dãn sử dụng cho quốc tế
Ngảy phảt hảnh thỏng tin: Tháng 7, 2012
® = Nhăn hiệu đã đăng ký
' ~Jitii PHONG '
nm ntifit _
iỉ Ệ(Ti_ti THÀNH PHỐ
(\»0 c… t-fiii'lii
\
\
PHÓ cục TRUỞNG 0NNERY ',J
, ^ v, 7² Loms.Geonces t.Ass_
t/iỷagyeat %… ẵỗumtẵ Chief nepresentatwe
' ' !
The Representatwe Officc o
Novartis Pharma Services AG … HCMC
16
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng