




…
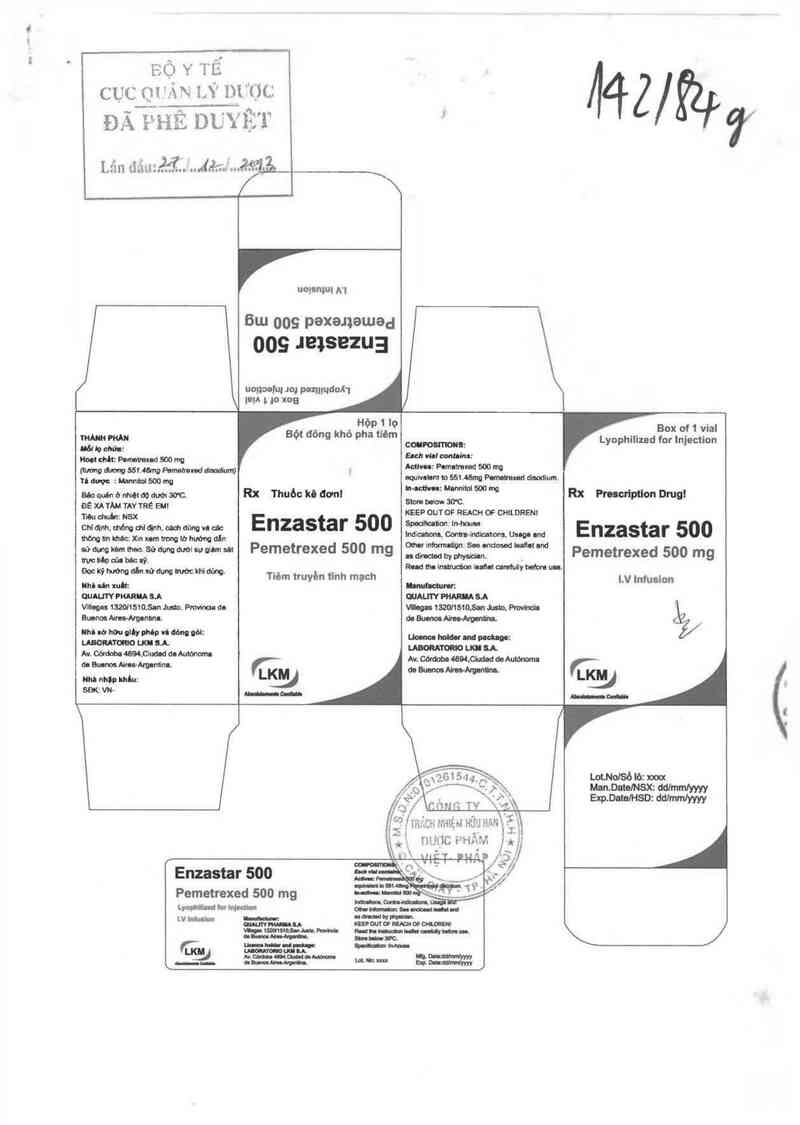
EỘ Y TẾ
CỤC m ự… m” nưsc: 4 2 / ỸZ.P
ĐÃ ầ-“JHẺ DUYỆT ' Ỹ
Lắn 'iiiưÁR/ẽ—tjị_
u°Fnlul A'l
6… oog pexanamad
009 12132le3
UONDĐM 10] pozmudoh
MA L 30 xoa
Hòp1 lọ B
. . ox of 1 via!
ẾỂ'ffl Bột đong khô pha tlẻm con &: Lyophilized for lnjection
Hoa OMt P. 500 m AĨiưíammnad 500 mo
0… m 56 . … M— … .
Tú d… : bhnnhnfểớẵ W mnd ) eqmahm » 561.48mn …… mm….
au qutn o mm ao … … Rx Thuốc kô đơn! Ịm m,;lỊỊM 500 W Rx Pnscrlptlon Drug!
ẵỉlxâlzf ỊỆỊTRỂ an KEEP OUT or REACH OF cmnaem
cm qnn. mem aaqm. … am … Ế Enzastar 500 mf" lữủiẵmm … Enzastar 500
Mmunlmlc: x…um mmhm n 'cm'h" 'uum
ùdĩiằMlheo.Sùdum Miwơlmstt Pemetrexed 500 mg Ệ"mỀfdw um… Pemetrexed 500 mg
… ơ. … nỷ. . . '
ĐockỷMnndhsủđwnúckde Tiêm truyền ìĩnh mạch Rudơnmmmm lu…nrduưyhdoum.
um … nh . LV lnfuslon
ounurv numu s.A mAerY PMARIIASA
Whou mzmsms… …. Fmvinu'a dn vm 1320l1510.5m Jum. …
Buenos Ams-Argnnhm. du … W…
umwhmgmmvnmna: .
……… mm…
Av. cau: ….cmu doAutdnomn M : w : a '
dn … Nru-Amuminn. tLKM du E ' &. ĩ
… nhu mủ: J KMJ
SDK:VN— …… mun nc ml
<Ĩ m.ẬCH J:HiẸ…' HỮU …… '? `
'Ịĩ_ n…jíc PHÂM |
i`v\~ xliổT IUẨ
\, \Vl l ' .!
L
Enzastar 500 ° g ®.2/
Pemetrexed 500 mg '
Lyophlllud lư MW
LV lnlulkm “
tn- |…M…an …
( u-unu-n—
LK] …unu
…J n…au.muumu
—… nm
. —
Thuốc kẻ dmz!
gủ Đọc kỹ hưởng dẫn sử dụng mtởc khi dũng
è 0/" \Ệ_\ ) Nêìi cần thém !lzỏng tỉn xin hói ý kiến băc sỹ
Q .-."1N~ TV \ 1 \
fễ ỀNZASTAR, 500
iỉ Oo ỹịỀủ'ủed Dis `'dium- Bột đông khô pha tiêm
AP
Hoạt chốt Pemetrexed (đạng Disodium Hcmypcntahydrate): 500 mg
Tá dược. Mannitol 500 mg Hydrochloric acid vă/hoặc Sodỉum hydroxide có thể được thêm văo để điều
chinh pH.
DUỢC LỰC HỌC
Pemetrexed lả một chất ức chế chuyển hóa tương tự như folate bằng cách bẻ gẫy quá trình chuyển hóa
phụ thuộc folate cẩn thiết cho sự nhân đòi tế băo. Nghiên cứu trên In vitro chỉ ra rằng pcmctrexcd ức chế
thymidylate synthase (TS), dihydrofolatc reductase (DHFR), vả glycinamide ribonucleotide
fmmyltransfcrasc (GARFT), lả các enzymes phụ thuộc folatc tham gia văo sinh tổng hợp thymidine vả
purine nucleotide. Pemetrexed đi qua mãng tế băo bởi chất vận chuyển qua măng như là chất mang khử
folatc và hệ thống vận chuyển protein gắn folatc tại măng tế băo. Khi dã vầo trong tế băo, pemctrcxed
được chuyển hóa thănh dạng polyglutamate bới enzyme folylpolyglutamatc synthetase. Dạng
polyglutamate có trong tế băo ức chế TS vã GARFT. Quá trình Polyglutamate hóa là một quá trình phụ
thuộc văo nồng độ vả thời gian xảy ra trong tế băo ung thư, vả nó được cho rằng xảy ra ít hơn trên mô
iảnh. Chuyển hóa Polyglutamatc hóa được cho lá có thời gian bán hủy trong nội băo tảng lên dẫn đến tác
động của thuốc kéo dăi ở tế bảo ác tính.
DƯỢC ĐỘNG HỌC CLZ/
Hâp thu:
Dược động học của Pcmctrcxcd đơn trị liệu liều tử 0.2-838mg/m2 truyền quá 10 phút, dược đánh giá trên .
426 bệnh nhân ung thư. AUC vả Cmax tăng tuyến tính theo liều. Dược động học của pemetrexed không \
thay đổi sau nhiều chu kỳ điều tri.
Phản bõ:
Pemetrexed có thể tích phân bổ ổn định là 16.1 L. Nghiên cứu trên In vitro chủ ra lá xẩp xỉ 81%
pemetrcxcd gắn văo protein huyết tương và không bị ảnh hưòng bởi mức độ suy thận.
Chuyển hóa và bải tiết: .
Pemetrexed chuyển hóa rất ít qua gan. Đảo thải chủ yếu qua nước tiểu với khoảng 70%-90% liêu dưới
dạng không thay đổi trong vòng 24 giờ sau khi dùng thuốc. Thanh thải giảm vã AUC tảng khi chức nảng
thận giảm. Tổng thanh thải toăn phẩn của pemetrexcd lả 91.8mL/phút và thời gian bán hủy của
pemetrexed là 3.5 giờ ở bệnh nhân có chức năng thặn bình thường.
CHI ĐINH .
U ng thư phổi khỏng phẩi tẻ'bảo nhỏ (NSCL ) khóng phái tẻ'bảo vẩy — Điếu trị kết hợp vói Cisplatin
Pemetrexed được chỉ định kết hợp với cisplatin trong điều trị đâu tay cho bệnh nhân ung thư phổi không
phải tế băo nhỏ không phải tổ băo vảy di căn hoặc tiển triển tại chỗ.
Ung lhưphổi khóng phải tếbảo nhỏ (NSCL) không phẩỉ té'ba`o vẩy — Điểu trị duy trì
Pcmetrcxcd được chỉ định trong điểu trị duy trì cho bệnh nhân ung thư phổi không phải tế băo nhỏ không
phải tế bảo vảy di cãn h0ặc tiến triển tại chỗ, những người mã bệnh không phát triển sau 4 chu kỳ hóa trị
liệu đẩu tay bẳng platinum.
Ung thu'phổi khóng phẩi té'bâo nhỏ (NSCL) không phái tẻ'bảo vầy — Sau khí hóa trị lỉệu
Pemetrexed được chỉ định đơn trị liệu trong điểu trị bệnh nhân ung thư phổi không phải tế băo nhỏ khỏng
phải tế băo vảy di căn hoặc tiến triển tại chỗ sau khi hóa trị liệu.
U trung biểu mô máng phổi
Pemetrexeđ kết họp với cisplatin được chỉ định điều trị cho bệnh nhân U trung biều mô măng phổi ác tính
mà không thể phẩu thuật cắt bỏ.
Giới han sử dung:
Pemetrexed không được chỉ định điều trị cho bệnh nhân Ung thư phổi không phải tổ băo nhỏ loại tế bảo
vay.
LIÊU LƯỢNG VÀ CÁCH DÙNG
Dùng kết hợp với Cisplatin
Ung lhưphổi khóng phẩi iê'báo nhỏ (NSCL) khóng phái té’báo vẩy vả U trung biểu mô mảng phổi
Liều khuyên cáo Pemetrexed lả 500 mg/m2 dùng tiêm truyền tĩnh mạch lièn tục trên 10 phút trong ngăy
thứ nhất của mổi chu kỳ 21 ngầy. Liều khuyến cáo của Cisplatin lả 75mg/m2 truyền liên tục trong hơn 2
giờ, bắt đẩu khoảng 30 phút sau khi kết thúc truyền Pemetrexed. Bệnh nhân cẩn bù nước đẩy đủ truớc
vả/hoặc sau khi truyền cisplatin.
Đơn trị liệu
Ung thưphổi không phẩi té'báo nhỏ (NSCL) khỏng phái tếbảo vẩy
Liều khuyên cáo của Pemetrexed lả 500mg/m2 truyền tĩnh mạch liên tục quá 10 phút ngăy ] mỗi chu kỳ
21 ngăy.
Dùng thuốc chuẩn bị trước khi truyền
Bổ sung Vilanu'n:
Để giám độc tính, bệnh nhân đuợc điểu trị với Pemetrexed phải được huớng dẫn uống folic acid liểu thấp
hoặc multivitamin có folic acid hăng ngảy. Dùng ít nhất 5 liêu folic acid trong vòng 7 ngăy trước khi
dùng liều đẩu tiên Pemetrexeđ; và tiếp tục dùng trong khi điểu trị vả tiếp tục trong 21 ngảy sau liêu cuối
cùng Pemetrexed. Bệnh nhân phải được tiêm bắp 1 lẩn vitamin B12 trong tuấn truớc khi dùng liều đẩu
tiên Pemetrexed vả mỗi 3 chu kỳ sau dó. Những lân tiêm vitamin B12 sau đó có thể dùng văo cùng ngăy
với Pemetrexed. Trong các thử nghiệm lâm săng, liểu của folic acid từ 350-1000 mcg, vả 1iểu của
vitamin Bi2 lả 1000 mcg. Liều thường dùng folic acid uõng trong các nghiên cứu lâm săng lả 400mcg.
Corticosteroid:
Phát ban được báo cáo thường gặp hơn ở bệnh nhân không dùng coxticosteroid. Điểu trị trước với
dexamethasonc (hOặc thuốc tương đương) lảm giảm tỷ lệ và mức độ nặng của các phản ứng da. Trong
các nghiên cứu lâm săng, dexamethasone 4 mg uống 2 1ẩn mổi ngăy: ngảy trước, trong vả sau khi truyền
Pemetrexcd. ~
Theo dỏỉ xét nghiệm và Khuyên cáo Giảm lỉểu hoác dừng thuốc: ằ/
Theo dõi xét nghiệm:
Dê'm tế băo máu toản diện, bao gổm đếm tiểu cẩu, cãn dược tiến hảnh trên tất cả các bệnh nhân sử dụng
Pemetrexed. Bệnh nhân cẩn dược theo dõi lúc số lượng tế băo máu giảm thẩp nhất và lúc hổi phục: trong
các nghiên cứu lâm săng thì các xét nghiệm được tiến hănh trước mỗi liều vả văo ngăy thứ 8 và 15 của
mỗi chu kỳ. Bệnh nhân không nên bắt đâu chu kỳ điểu trị mới trừ khi số đếm bạch câu trung tính tuyệt
đối 21500 tế băo/mm3, tiểu cẩu 2 100,000 tế băo/mm’, và thanh thải creatinine Z 45 mL/phút. Các xét
nghiệm khác nên được tiến hảnh định kỳ để đánh giá chức năng gan, thận.
Khuyến cáo giảm liều:
Chinh liều lúc bât đâu chu kỳ tiếp theo nên dựa v`ao số đếm tế bảo mãu lúc thấp nhẩt hoặc độc tính khác
mức tối đa của chu kỳ trước đó. Điều trị có thể trì hoãn để có đủ thời gian hổi phục. Tùy văo sự hổi phục,
bệnh nhân nên được điều trị tiẽp theo hướng dẫn trong bảng 1-3 cho việc sử dụng Pemetrcxed đơn trị liệu
h0ặc phò'i hợp với cisplatin.
Bảng 1: Giảm Iỉểu Pemetrexed (đơn trị líệu h0ặc phối hợp) và Císplatỉn — Các độc tính huyết học
F'SỐ—de'm bạch cẩu trung tính tuyệt đối (ANC) mức
thấp nhất < 500/mm3 và tiểu câu mức thấp nhất
2 SO,OOO/mm3 .
75% liều trước đây (pemetrexcd vả cisplatin)
ỳTiểu cẩu mức thấp nhất < 50,000/mm3 không có xuất
huyết (không cần quan tâm tới mức ANC thấp nhất) 75% "°“ trươc dây (pemeưexed va C'Splat'“)“
Tiểu cẩu mức thấp nhất < 50,000/mm3 có xuất huyết ²,
(không cẩn quan tâm tới mức ANC thấp nhất) 50% lieu trước đây (pemetrexed va c1splatm).
“ Những tiệu chí nảy tuân thủ theo định nghĩa về Tiêu chuẩn độc tính chung phiên bản 2.0 (Viện Ung
thư Quốc gia 1998) 2 xuất huyết Cấp độ 2.
Ìi-ì
'~ẩ—.\u
ợìế
? 1
l
Nếu bệnh nhân trải qua các độc tính khỏng phải huyết học (trừ độc tính thẩn kinh) 2 Độ 3 thì nên dừng
thuốc cho tới khi độc tính giảm xuống dưới hoặc bằng với mức trước khi điểu trị. Sau đó, điểu trị dược
tiếp tục theo các hướng dẫn trong Bảng 2.
Bảng 2: Giảm liều Pemetrexed (dơn trị liệu hoặc phối hợp) và Cisplatin — Dộc tính không phải huyết học “
Liêu Pemetrexed Liêu Cisplatin
(mglmz) 1mg/m2)
75% liều trước đây 75% liều trước đây
Dộc tính bẩt kỳ độ 3 hoặc 4 trừ viêm
miệng
Bất kỳ tiêu chảy cẩn nhập viện (bất kỳ cấp
độ nảo) hoặc tiêu chảy Độ 3 hoặc 4
Viêm miệng Độ 3 hoặc 4 50% iiểu trước đây 100% liều trước đậy
“ Theo Tiẻu chuẩn độc tính chung của Viện Ung thư Quốc gia
b Trù độc tĩnh thẩn kinh (xem Bảng 3).
75% liều trước đây 75% liều trước đây
Trong trường hợp độc tính thẩn kinh, liều khuyên cáo cho Pemetrexcd vả Cisplatin được mô tả trong bảng
3. Bệnh nhản nên dừng thuốc nếu độc tính thẩn kinh Độ 3 hoặc 4 xảy ra
Bảng 3: Giảm liều Pemetrexed (đơn trị liệu hoặc phối hợp) vả Cisplatin — Độc tính thẩn kinh
Cấp độ dộc tính Liêu Pemetrexed Liều Cisplatin
chung (mg/m2) (mg/m2)
O - 1 100% liều trước đây 100% liều trước đây
2 100% liều trước đây 50% liếu trước đây
K huyết: cáo dừng điều trị:
Nên dừng diếu trị Pemetrexed nểu bệnh nhân có độc tính huyết học hoặc không huyết học Dộ 3 hoặc 4
sau 2 lẩn giảm liều h0ặc ngay lập tức nếu phát hiện độc tính thẩn kinh Độ 3 hoặc 4.
Bệnh nhán suy thận:
Trong các nghiên cứu lâm săng, bệnh nhân có thanh thải creatinine 2 4SmL/phút không cẩn chỉnh liều
ngoăi những khuyên cão chung cho tất cả các bệnh nhân. Số lượng bệnh nhân có thanh thải creatinine <
45 mL/phút được điểu trị còn hạn chế để có thể đưa ra khuyên cão về liều lượng cho nhóm bệnh nhân
nảy. Vì vậy, không nên dùng Pemetrexed cho bệnh nhăn có thanh thải creatinine < 4SmL/phút đang dùng
công thức Cockcroft vả Gault:
[140 — Tuổi] x Trọng lượng cơ thể (kg) ỉ
Nam: …- = mL/phút
72 >< Serum Creatinine (mg/dL)
Nữ: Nam X 0.85
Thận trọng khi dùng Pemetrexed cùng với NSAID cho bệnh nhân có thanh thải creatinine < 80mL/ phút.
Thận trọng khi chuẩn bị và lúc tiêm truyền:
Cũng như các thuốc chống ung thư có nguy cơ gây độc, nên thận trọng khi cãm thuốc và chuẩn bị dung
dịch tiêm truyền Pemetrexed. Nẻn dùng gãng tay bảo hộ. Nếu dung dịch Pemetrcxed tiếp xúc với da, phải
rửa da ngay lập tức bằng nước và xả phòng. Nếu Pemetrexed tiếp xúc với niêm mạc, phải rửa bầng nước.
Pemetrexed không lăm rộp da. Không có thuốc chống độc đặc hiệu khi bị thoát mạch Pemetrexed.
Chuẩn bị dung dịch tiêm truyền liên tục:
1. Dùng các thao tác vô khuẩn để hòa tan bột vả pha loãng Pemetrexed để tiêm truyền liên tục.
2. Tính liều Pemctrexed vả xác định số 1ọ cắn dùng.
3. Hòa tan lọ IOOmg với 4.2 mL Natri clorid 0.9%; lọ 500mg với 20 mL Natri clorid 0.9%. Dung dịch
thu được chứa 25 mg/mL Pemctrexed. Lắc nhẹ cho dến khi bọt tan hoăn toản. Dung dịch thu được
trong vả không mảu đến văng hoặc xanh văng và không có ảnh hưởng tới tác dụng của thuốc. pH của
dung dịch sau khi hòa tan là 6.6 -7.8. KHÔNG CẨN PHA LOÃNG THÊM.
4. Thuốc tiêm cẩn được kiểm tra bằng mắt thường xem có vật thể lạ h0ặc mău sắc bất thường trước khi
truyền.
5. Lấy một lượng vừa đủ dung dịch Pemetrexed sau khi pha để pha loãng với Natri Clorid 0.9% (khòng
có chất bảo quản), để tổng thể tích thu được là 100 ml. Pemetrexed được truyền tĩnh mạch liẻn tục
trên 10 phút.
6. Dung dịch sau khi pha ổn định trong 24 giờ ở nhiệt độ phòng.
Dung dịch đuy nhẩt để hòa tan và dung dịch pha loãng trước khi truyền tĩnh mạch liên tục dược khuyên
cáo là Natri clorid 0.9%. Pemetrexed tương kỵ với dung môi chứa calcium, bao gồm Lactateđ Ringer vả
Ringer vì thế không được dùng. Dùng cùng Pemetrexed với các thuốc khác và dung mỏi khác chưa được
nghiên cứu vì thế không được khuyên cáo. Pemetrexed tương hợp với dây truyền polyvinyl chloride
(PVC) vã túi chứa dung dịch truyền.
CHỐNGCJHEHNH
Bệnh nhân có tiển sử mẫn cảm với pemetrexed hoặc bất kỳ thảnh phẩn nảo của thuốc.
Phụ nữ mang thai về cho con bú.
CÁNHBÁOVÀTHẬNTRỌNG
Dùng thuốc chuẩn bị trước khi truyền
Bổsung F olate vả Vílamin 812: Bệnh nhân được điểu trị với Pemetrexed phải được hướng dẫn uống folic
acid và tiêm vitamin 812 để phòng ngừa lảm giảm độc tính huyêt học vả không huyêt học. Trong các
nghiên cứu lâm sảng, ít độc tính hơn và giảm dộc tính huyết học Độ 3/4 và độc tính khỏng huyết học như
là giảm bạch cẩu, sốt giảm bạch cẩu, vả nhiềm khuẩn kèm giảm bạch câu Độ 3/4 đã được báo cáo khi sử
dung folic acid vả vitamin 812 trước khi truyền.
Corticosteroid: Phát ban đã được báo cáo thường xuyên ở bệnh nhân không được điểu trị trước bằng
corticosteroid trong nghiên cứu lâm sảng. Điểu trị trước với dexamethasone (hoặc tương đương) để lăm
giảm tỷ lệ và mức độ nặng của các phản ửng da.
Úc chẽ tủy xương
Pemetrexed có thể ức chế tủy xương, được biểu hiện như lả giảm bạch cẩu, giảm tiểu cắu vả thiếu máu;
ức chế tủy xương lả dộc tính phụ thuộc liều. Giảm liều cho những chu kỳ tiếp theo dựa trên số đếm bạch
cẩu, tiểu câu và độc tính tối đa không thuộc huyết học trong những chu kỳ trước đó.
Giảm chức nãng thặn
Pemetrexed chủ yểu đảo thải dưới dạng khỏng thay đổi qua thận. Khóng cân chỉnh liểu nểu thanh thải
creatinine 245 mL/phút. gệ
Dùng NSAID cho bệnh nhân suy thận nhẹ—trung bình:
Thận trọng khi dùng ibuprofen cùng với Pemetrexed cho bệnh nhân có suy thận nhẹ đến trung bình
(thanh thải creatinine 45-79 mL/ phút). Sử dụng thận trọng khi dùng với các thuốc NSAID khác.
Theo dõi xét nghiệm
Bệnh nhân không nên bắt đẩu chu kỳ điểu trị mới trừ khi số đểm bạch cẩu trung tính tuyệt đối 2 1500 tổ
bảo/mmẵ số đếm tiểu cẩu 2100,000 tế băo/mmẵ và thanh thải creatinine 2 45 mL/phút.
Phụ nữ có thai (Thai kỳ nhóm D)
Dựa tren cơ chế tác đông của thuốc, Pemetrexed có thể gây độc cho thai nhi khi dùng cho phụ nữ có thai.
Không có thử nghiệm có kiểm chứng phù hợp trẻn phụ nữ có thai. Pemetrexed độc với phói, độc thai, vả
gây ung thư ở chuột. Nếu dùng Pemetrexed trong thai kỳ hOặc nếu bệnh nhân có thai khi dang dùng thuốc,
cẩn thông báo cho bệnh nhân về nguy hiểm với thai nhi. Phụ nữ tuổi sinh đẻ nên sử đụng các biện' háp
tránh thai trong khi sử dung Pemetrexed.
Phụ nữ cho con bú
Khòng rõ Pemetrexed h0ặc các chẩt chuyển hóa có băi tiết qua sữa mẹ hay khộng. Vì nhiều thuốc băi.
qua sữa mẹ, và vì nguy cơ tác dụng phụ nghiêm trọng cho trẻ bú sữa, cân quyết định nẻn dửng gịi
hoặc dừng thuốc tùy theo sự quan trọng của thuốc với mẹ.
Trẻ em
An toăn và hiệu quả của Pemetrexed trên trẻ em chưa được chứng minh.
O
TÁC DỤNG KHÔNG MONG MUỐN
Vì các nghiên cứu lâm săng được tiến hănh tren các điêu kiện rất khác nhau, tỷ lệ tác dụng phụ không thể
so sánh trực tiếp với tỷ lệ trong cảc nghiên cứu lâm săng khác vả có thể khộng phản ánh tỷ lệ phát hiện
trên thực tế lâm săng.
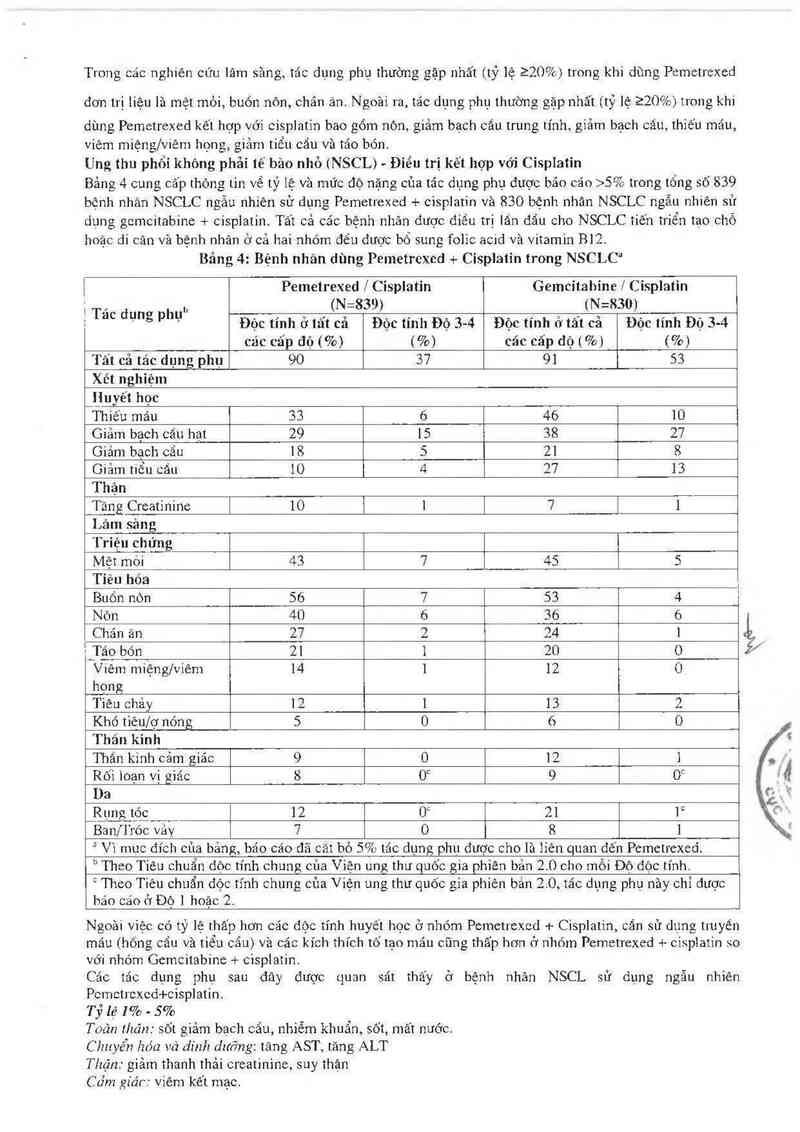
Trong các nghiên cứu lâm săng, tác dụng phụ thường gặp nhất (tỷ lệ 220%) trong khi dùng Pemetrexed
đơn trị iiệu lă mệt mòi, buôn nỏn, chán ản. Ngoăi ra, tác dt_mg phụ thường gặp nhất (tỷ lệ 220%) trong khi
dùng Pemetrexed kết hợp với cisỵ›lntin bao gổm nỏn, giảm bạch cắn trung tính, giảm bạch cầu, thìếu máu,
viêm miệng/viêm họng, giảm tiểu câu và táo bón.
Ung thu phổi khóng phâỉ tế băo nhỏ (NSCL) - Điểu trị kểt hợp với Cispiatin
Bảng 4 cung cấp thông tin về tỷ lệ và mức độ nặng của tác dụng phụ đuợc báo cáo >5% trong tổng số 839
bệnh nhân NSCLC ngẫu nhiên sử dụng Pemetrexed + cisplatin vả 830 bệnh nhân NSCLC ngẫu nhiên sử
dung gemcitabine + cisplatin. Tất cả các bệnh nhân được điều trị lẩn đẩu cho NSCLC tiến triển tạo chỗ
hoặc di căn vả bệnh nhân ở cả hai nhóm đều được bổ sung folic acid vả vitamin Bl2.
Bảng 4: Bệnh nhân dùng Pemetrcxcd + Cisplatỉn trong NSCLC“
ị Pemetrexed ÍCisplatin Gemcitabỉne ( Cisplatin
1 Tác dung phu" (N2839) (N=830)
' ' Độc tính ở tất cả Độc tính Độ 3-4 Độc tính ở tất cả Độc tính Độ 34
các căp độ (%) (%) các cẩp độ(%) (%)
Tất cả tảc dụng phụ 90 37 91 53
Xét nghiệm
_Huyết học
Thiếu mảu 33 6 46 10
Giảm bạch cẩu hạt 29 15 38 27
Giảm bạch cẩu 18 5 21 8
Giảm tiểu cấu 10 4 27 13
Thận
Tâng Creatinine 10 1 7 1
Lâm sảng
'1`riệu chứng
_Mệt mòí 43 7 45 5
Tiêu hóa
Buôn nòn 56 7 53 4
Nôn 40 6 36 6
Chán ản 27 2 24 1
i_TỄọ_bón 21 1 20 ()
Viêm miệnglviêm 14 1 12 0
họng
Tiêu chảy 12 1 13 2
Khó tiêu/ợ nóng 5 0 6 0
Thân kinh
Thấn kinh cảm giác 9 0 12 ]
Rối ioạn vị giác 8 0c 9 Oc
Da
_R_ụ_n_g_tỷ_c__ 12 Oc 21 ]C
Banfl`róc vảy 7 0 8 l
² Vì muc đích của bảng, báo cáo đã cắt bỏ 5% tác dụng phụ được cho lả 1iên quan đển Pemetrexeđ.
b Theo Tiêu chuẩn độc tính chung của Viện ung thư quốc gia phiên bản 2.0 cho mỗi Độ độc tính.
² Theo Tiêu chuẩn độc tính chung của Viện ung thư quốc gia phiên bản 2.0, tác dụng phụ năy chi dược
báo cáo ở Độ 1 hoặc 2.
Ngoài việc có tỷ lệ thấp hơn các độc tính huyết học ở nhóm Pemetrexeđ + Cisplatin, cẩn sử dụng truyền
máu (hông cắu vả tiễu cẩu) Vả các kích thích tố tạo máu cũng thẩp hợn ở nhóm Pemetrexed + cìspiatin so
với nhóm Gemcitabine + cisplatin.
Các tác dụng phụ sau dây được quan sát thấy ở bệnh nhân NSCL. sử dụng ngẫu nhiên
Pemctrcxcd+cìsplatin
Tỷ lệ 1% - 5%
Toản llzán: sốt giảm bạch cẩu, nhiễm khuẩn, sốt, mất nước.
Chuyển hóa vả dính dưỡng: tảng AST, tăng ALT
Thận: giảm thanh thải creatinine, suy thận
Cẩm gt'ár: viêm kết mạc.
Tỷ lệ < 1%
Tim mạch: loạn nhịp
Toản thản: đau ngưc
C huyéiz hỔa vả đính dưỡng: tăng GGT
Thần kính: bệnh thẩn kinh vận động.
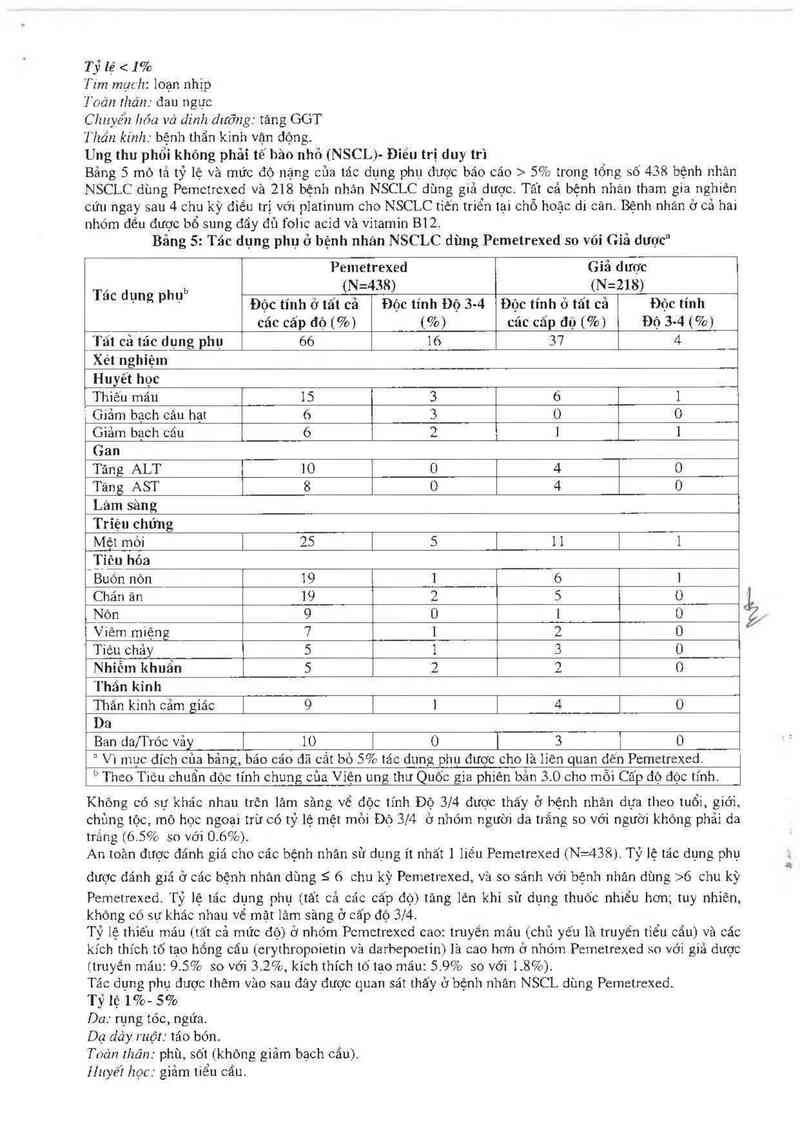
Ung thư phổi không phải tế hăo nhỏ (NSCLj— Điêu trị duy trì
Bảng 5 mô tả tỷ lệ và mức độ nặng của tác dụng phụ dược bảo cáo > 5% trong tổng số 438 bệnh nhân
NSCLC dùng Pemctrcxed và 218 bệnh nhân NSCLC dùng giả dược. Tất cả bệnh nhân tham gia nghiên
cứu ngay sau 4 chu kỳ điếu trị với platinưm cho NSCLC tiến triển tại chỗ hoặc di căn. Bệnh nhân ở cả hai
nhóm đến được bổ sung đẩy đủ folic acid vả vitamin 1312.
Bảng 5: Tác đụng phụ ở bệnh nhân NSCLC đùng Pcmetrexed so vói Giả dược“
Pemetrexed Giả dược
_, b (N =438) (N=218)
T°'° dụng phụ Độc tính ở tất cả Độc tính Độ 34 ĐọC tính ở tẩt cả Độc tính
cảc cấp độ(%) (%) các cấp độ[%) Độ 3-4{%)
Tẩt cả tác dụng phụ 66 16 37 4 __
Xét nghỉệm
Huyết học
Thiếu máu 15 3 6 1
² Giảm bach câu hat 6 3 0 O _
Giảm bạch cẩu 6 2 , 1 l
Gan
Tăng ALT 10 o 4 0
Tăng AST 8 0 4 0
Lâm sảng
Triệu chủng
Mêt mỏi 25 s ] 11 1
_'_ngê_u_ hóa
Buôn nôn 19 1 6 ]
Chán ăn 19 2 5 O
…N_ôn_ 9 0 1 o
Viêm miệng 7 1 2 0
Tiêu chảy 5 1 3 0
Nhiễm khuẩn 5 2 2 0 _
Thân kinh
Thân kinh cảm giảc l 9 1 1 | 4 l 0
Da
Ban da/Tróc vảy [ 10 _ o | 3 ] 0
“ Vì muc đích của bảng, bảo cáo đã cắt bỏ 5% tác dung phụ được cho lả 1ien quan dến Pemetrexed.
b Theo Tiêu chuẩn độc tính chung của Viện ung thư Quốc gia phiên bản 3.0 cho mỗi Cấp độ độc tĩnh.
Không có sự khác nhau trôn lám săng về độc tĩnh Độ 3/4 được thấy ở bệnh nhân dựa theo tuối, giới,
chủng tộc, mô học ngoại trù có tỷ lệ mệt mỏi Độ 3/4 ở nhóm người đa trắng so với người không phải da
trẳng (6.50/o so với 0.6%).
An toăn được đánh giá cho các bệnh nhân sử dụng ít nhất ] liều PemetreXed (N=438). Tỷ 1ệ tác dụng phụ
dược đánh giá ở các bệnh nhản dùng 5 6 chu kỳ Pemetrexed, vả so sánh với bệnh nhân dùng >6 chu kỳ
Pemetrexed. Tỷ lệ tác dỤng phụ (tẩt cả các cấp độ) tăng lên khi sử dụng thưốc nhiều hơn; tuy nhiên,
không có sư khác nhau về mật lâm sảng ở cấp độ 3/4.
Tỷ lệ thìếu máu (tất cả mức độ) ở nhóm Pemetrcxcd cao: truyền mảu (chủ yếu là truyền tiểu căn) và các
kích thích tố tạo hồng cẩu (erythropoietin vả darbepoetin) lả cao hơn ở nhóm Pemetrexed so với giả dược
[truyền máu: 9.5% so với 3.2%, kích thích tố tạo mảu: 5.9% so với 1.8%).
Tác đụng phụ được thêm văo sau đây được quan sảt thẩy ở bệnh nhân NSCL dùng Pemetrexed.
Tỷ lệ 1%- 5%
Da: rụng tóc, ngứa.
Dạ dây ruột: tảo bón.
Toản Jhân: phù, sõt (khòng giảm bạch cẩu).
Hnyêi học: giảm tiểu cẩu.
Thận: giảm thanh thải creatinine, tãng creatinine, gỉảm tỷ lệ lọc cẩu thận.
Ca’m gíác đặc biệt: bệnh mặt mắt (bao gôm viêm kết mạc), táng tiết tuyến lệ,
Tỷ lệ < 1%
Tim mạch : loạn nhịp trẻn thất.
Da: ban da hình.
Toản Jhản: sốt giảm bạch cãu, phản úng dị ửng/quá mẫn.
Thần kinh : bệnh thẩn kinh tự động.
Thận: su y thận.
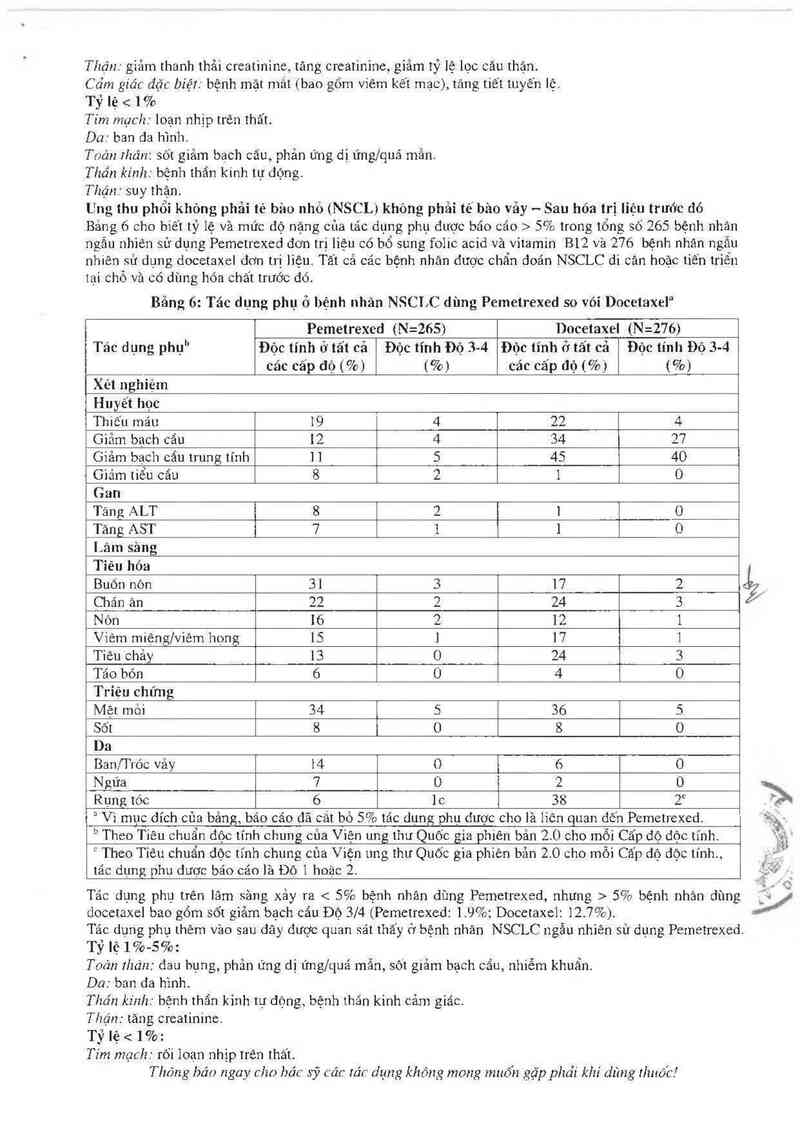
Ung thư phổi khỏng phải té bùo nhỏ (NSCL) không phải tế bảo vảy -- Sau hóa trị liệu trước đó
Bảng 6 cho biết tỷ lệ và mức độ nặng của tác dụng phụ được báo cáo > 5% trong tổng số 265 bệnh nhầm
ngẩn nhìên sử dụng Pemetrexed đơn trị liệu eó bổ sung folic acid vả vìtamin B12 và 276 bệnh nhẽ… ngẫu
nhiên sử dụng docetaxel đơn trị liệu. Tất cả các bệnh nhân được chẩn doán NSCLC di căn hoặc tiến triển
tại chỗ vã có dùng hóa chất trước đó.
Bảng 6: Tác dụng phụ ở bệnh nhân NSCLC đùng Pemetrexed so vói Docetmte]a
Pemetrexcd {N=265) Docetaxel (N=276)
Tác dụng phụ" Độc tính Ở tất cả Độc tính Độ 3-4 Độc tính ở tẩt cả Độc tính ĐỘ 3-4
các cấp độ(%) (%) cáccấp độ(%) {%)
Xét nghiệm
Huyết học
Thiếu máu 19 4 22 4
Giảm bạch cấu 12 4 34 27
Giảm bạch cẩn trung tính 1 1 5 45 40
Giảm tiểu cấu 8 2 1 0
Gan
Tảng ALT 8 2 1 0
Tăng AST 7 1 1 0
Lâm sâng
Tiêu hóa
Buồn nỏn 31 3 17 2 Ễ
Chán ản 22 2 24 3 /
Nôn 16 2 12 1
Viêm miệng/viêm họng 15 1 17 1
Tiêu chảy 13 0 24 3
Táo bón 6 0 4 0
Triệu chímg
Mệt mỏi 34 5 36 5
Sốt 8 0 8 O
Da
Ban/Tróc vảy 14 0 6 O
Ngứa 7 o 2 o
Rụng tóc 6 lo 38 2c ồ
“ Vì mục đích của bảng, báo cáo đã cắt bỏ 5% tác đụng phụ được cho là liên quan đốn Pemetrexed. `ề;_-. -
" Theo Tiêu chuẩn độc tính chung của Viện ung thư Quốc gia phiên bản 2.0 cho mỗi Cấp độ độc tính. `Ề…
² Theo Tiêu chuẩn dộc tĩnh chung của Viện ung thư Quốc gia phiên bản 2.0 cho mỗi Cấp độ độc tính., _. Jt'
tác dụng phu được báo cáo là Độ 1 hoặc 2. ư'"
Tác dụng phụ trên lâm sảng xảy ra < 5% bệnh nhân dùng Pemetrexed, nhưng > 5% bệnh nhản dùng y
docetaxel bao gổm sốt giảm bạch cắn Độ 314 (Pemetrexed: 1.9%; Docetaxel: 12.7%).
Tác dụng phụ thêm văo sau đây được quan sát thấy ở bệnh nhân NSCLC ngẫu nhiên sử dụng Pemetrexed.
Tỷ lệ 1 %-5%:
Toản rhán: đau bụng, phản ứng dị ửng/quá mẫn, sót giảm bạch cẩu, nhiễm khuẩn.
Da: ban đa hình.
Thần kỉnh: bệnh thẩn kinh tự động, bệnh thẩn kinh cảm giác.
Thận : tăng creatinine.
Tỷ lệ < 1%:
Tim mạch: rối loạn nhịp trên thất.
Thỏng háo ngay cho bác sỹ các tác dụng không mong muốn gập phẩỉ khi dùng thuốc!
TƯO'NG TÁC THUỐC
Thuốc NSAID
Ibuprofen: Mặc dù ibuprofen (400 mg x 4 lẩn mỗi ngảy) có thể lăm giảm thanh thải pemetrcxcd, vẫn có
thể dùng cùng với Pcmetrexcd ở bệnh nhân có chức nãng thận bình thường (thanh thải creatinine 2 80
mL/phút). Nên thận trọng khi dùng ibuprofen cùng với Pemctrcxed cho bệnh nhân suy thận nhẹ-trung
bình (thanh thải creatinine 45—79mL/ phút).
Các NSAID khác: Bệnh nhân bị suy giảm chức nặng thận mức dộ nhẹ - vừa nên Iránh dùng NSAID trong
hai ngăy trước, trong và 2 ngảy sau khi dùng Pemetrexed.
Đối với những thuốc NSAID có thời gian bán hủy dăi, nên dừng thuốc ít nhất 5 ngăy trước, trong, và 2
ngăy sau khi dùng Pemetrcxed. Nếu việc sử dụng NSAID lã cắn thiết, cắn theo dõi chặt chẽ câc độc tính
xảy ra, đặc biệt là ức chế tủy, độc tính trẻn thận và dạ dăy-ruột.
Các thuốc gây độc thặn: Pemetrexed đăo thải chủ yếu dưới dạng không thay đổi qua thận. Sử dụng cùng
với các thuốc gây độc thận dẫn đến sự thanh thải chậm Pemetrexed. Dùng cùng với các thuốc dược băi
tiết qua ống thận (ví dụ: probenecid) có thể dẫn dến thanh thải chặm Pcmctrexed.
QUÁ LIÊU
Khỏng có mấy trường hợp quá liều Pemetrcxcd. Độc tính được báo cáo gổm giảm bạch cẩu, thiếu máu,
giảm tiểu cẩu, viêm miệng vả ban. Biến chứng có thể tìên đoán gồm ức chế tủy xương biểu hiện như lả
giảm bạch cẩu. giảm tiểu cẩu và thiếu máu. Ngoài ra, có thể có nhiễm khuẩn kèm hoặc khỏng kèm theo
sốt, tiêu chảy và viêm miệng. Nếu quá liều xảy ra, các biện pháp hỗ trợ cấn được tiến hănh.
Trong các nghiên cứu lâm săng, Leucovorin dược dùng trong trường hợp giảm bạch cẩu dộ 4 quá 3 ngăy,
giảm bạch cấu trung tính dộ 4 quá 3 ngăy, vả dùng ngay khi giảm tíểu cẩu độ 4, xuất huyết liên quan đến
giảm tiểu cẩu Độ 3, hoặc viêm miệng Dộ 3 hoặc 4.
Khuyến cáo truyền tĩnh mạch Lcucovorin: ]00 mg/m2 một lẩn, sau đó là 50 ngm2 mõì 6 giờ trong 8 ~.
ngay.
ĐÓNG GÓI vÀ BẢO QUẢN JZJ
Hộp I lọ bột dỏng khô chứa 500m g pemetrexed.
Bảo quản thuốc ở nhiệt dộ dưới 30°C.
Dung dịch sau khi pha ổn định trong 24 giờ và bảo quản ở nhiệt độ phòng 2-8 °C.
Để xa tẩm tay trẻ em!
HAN DÙNG: 24 tháng kể từ ngăy sản xuất. Không dùng thuốc đã quá hạn in trên bao bì.
TIÊU CHUẨN: Nhà sản xuất.
NHÀ SÁN XUẤT:
QUALITY PHARMA S.A.
Villegas 1320|1510, San Justo, Provincia de Buenos Aires, Argentina.
NHÀ sớ HÙU GIẤY PHÉP VÀ ĐÓNG GÓI:
Laboratorio LKM S.A. _
. a.. rgentina
PHÓ cục TRUỞNG
JVỷugẫn ”VM W
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng