
















`x
\
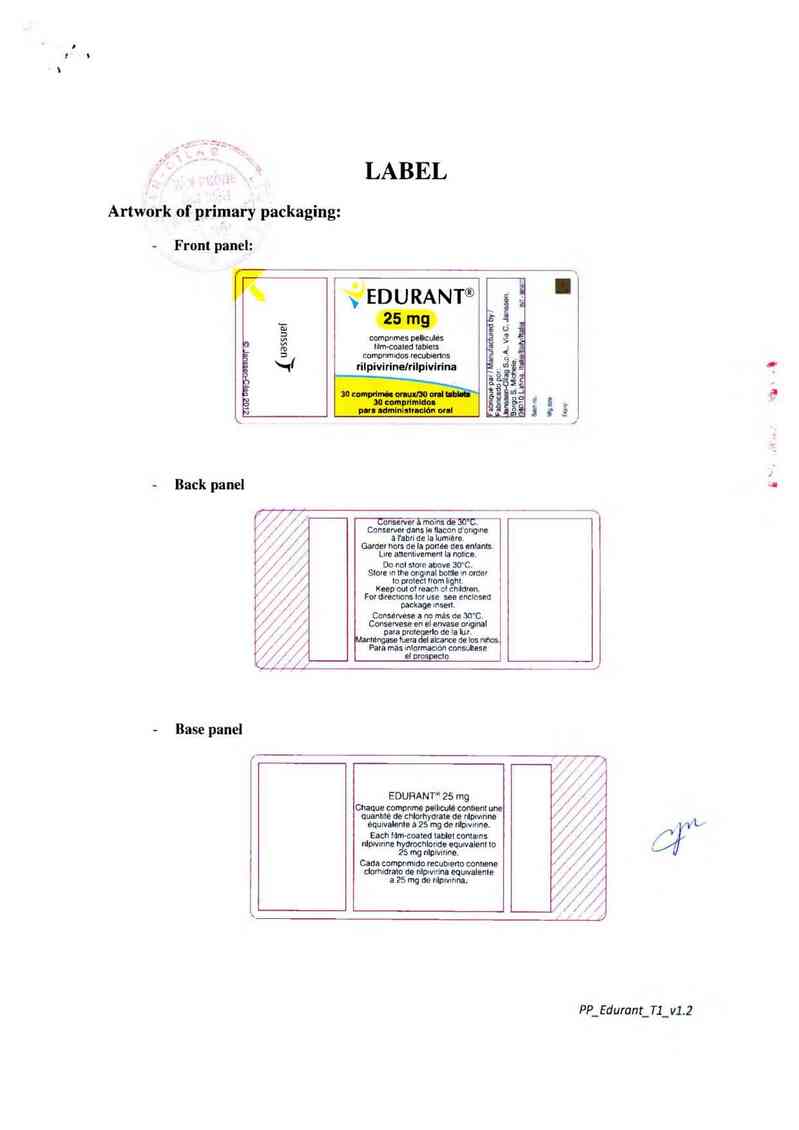
Artwork of secondary packaging
Ju dla
am: Tam
ou ưỉlEE
4›
Ý lEJO uợoensiuịuvpe e›ed sopuuuduioa oc
staqu lmo oc
xnmo sẹtuụdwoa og
cuụinidtulauụinidlu
souzuqnam sopnumdmoo
Slsịqu pamomuuu
saịnaiịịad sa…uduxoa
) - i,thunoaè
, ~{JEDURANT'Ệ
"
Janssen J
Fabvique par l Manulacluleđ byi
Fabncado pm
Janssen-Culag S p.A.. Vua C. Jansssn,
Bolgu S Michele 04010 Lalma Itahelltalleaha
LABEL
/ị , VV\
LS!
BỘ Y TẾ
CL'C QUẦN LÝ m"oc
ĐÃ PHÊ DLĨYỆT
ÝEDURANT®
cornprimés pelliculès
rilpivirine
`EDURANT
Rumunn bymochbmc 27 541 mg nuong ớuung với 25
mg nvalneị
MỏDV le0Mhừblccúum
… …… cx.n dnnq. r.th ac th cx uônu …
krAc el rqm um ivmq m huth uõn iù ou r~q um
…
oọc Kl uuơm DAN sữ nuNư mười: uu DÙNG
l'NIIÔC BÀN TNEO GIGN
nỉ nnu uv me su
581 va mu ::
sen sx N51 Hn wr smzn nc _ u; …: Eimy
usa nsu u.
iNng i~ii hư iI ngaydAu tlln cn Iqu ntmncì
WM ciu qvỏuở N“ OI ne hủ " Bảo quin img
um it…Ac qk : &: nhả u'n vu|i «| mm ;… ung
Sir xưđl lai JANSSfN—Cll lũ 5 n I ,
vu c Janum, Bcvọn s Mcnnln oAn'a …… v“
BNNK vưnndivrn @… Huơf; ~ Tưù Bìnr D…q
st …… n …
ÝEDURANT®
iiIm-coated tablets
rilpivirine
30 oral tablets
Do not store above ]o IO0.000 bản sao/ml cho thấy có nguy cơ kháng lại với nhòm thuốc NNRTI cao
hơn. Các bệnh nhân bị thẩt bại trong việc giảm tải lượng vi rút với EDURANT, sự phát triền
kháng thuốc Iiên quan tới Iamivudine/emtricitabine thường cao hơn so với nhóm thẩt bại
trong việc giảm tải Iưọng vi rủt khi điều trị bằng efavirenz. Thông tin nảy nên được xem xét
khi bắt đầu điều trị với EDURANT.
Tương tảc thuốc
Thận trọng khi sử dụng EDURANT với cảc thuốc mã có thế lảm giảm sự phoi nhiễm của
rilpivirine.
Thông tin về phần tương tác thuốc, xem phẩn Tương lác vởi các thuốc khác và các dạng
lương lác.
Nguỵ cơ tỉm mach
2/20
Ó mủc liều điều trị cao (75mg vả 300mg ngảy một lần), rilpivirine có liên quan đến kéo dải
khoảng QT trên điện tâm đồ (ECG) Vởi liểu khuyến cáo 25mg mỗi ngảy, EDURANT không
có ảnh hướng liên quan đển lâm sảng trên khoảng QT. Nên thận trọng khi dùng phối hợp
EDURANT với cảc thuốc khác mã đã biết lá có nguy cơ gây xoắn đinh (Torsade de Pointes)
Tái ghãn bố mỡ
Điều trị phối hợp thuốc khảng retrovius (CART) có liên quan đến sự tái phân bố mỡ cùa cơ
thể (rối loạn chuyến hóa mỡ) ở bệnh nhân nhiễm HIV Hiện chưa rõ hậu quả lâu dải cùa
những biển có nảy Sự hiểu biết về cơ chế gây ra củng chưa đầy đủ. Giả thiết vê mối liên quan
giữa u mỡ nội tạng. các chất ức chế protease (Pis), teo mô mỏ ở một số vùng và các thuốc ức
chế men sao chép ngược non- -nucleọsid (NRTIs) đã được dặt ra. Nguy cơ rôi ioạn chuyến hóa
mỡ cao hơn có liên quan đển các yếu tố cá nhân như tuồi tác và liên quan dến thuốc như điều
trị lâu dải với thuốc kháng retrovirus vả các rối Ioạn liên quan đến chuyền hóa. Việc thăm
khảm lâm sảng nên bao gồm cả đảnh giá về các dấu hiệu thực thể cùa tái phân bố mỡ (xem
phẩn Tác dụng khóng mong muốn)
Hội ch_ứne ohuc hồi miễn dich
Hội chứng phục hồi miễn dịch đã dược bảo cáo trên những bệnh nhãn diều trị kết hợp với các thuốc
kháng retrovirus, bao gốm cả Edurant. Trong giai đoạn điều trị ban đầu phối hợp với các thuốc điều trị
khảng retrovirus những bệnh nhân có đáp ứng miễn dịch có thể xuất hiện một phán ứng viếm đối với
tinh trạng nhiễm trùng cơ hội thầm lặng hoặc còn sót lại trước đó (ví dụ như nhiễm phức hợp
Mycobactcria avium. nhiễm vi rủt Cytomegaio, viêm phối do Pneumocystis jiroveci vá nhiễm lao),
bệnh nhân cẩn được kiếm tra lại vả có thế phải được diều trị. (xem phần Tác dụng khóng mong
muôn) .
Tương tảc vởi các thuốc khảc vả cảc dạng tương tác:
Cảc thuốc ánh hướng tới su ohoi nhiễm của rilpivirinc
Rilpivirine chủ yếu chuyền hóa qua cytochrome P450 (CYP)3A và do dò các thuốc cảm ứng
hoặc ức chế CYP3A có thề ánh hướng đển sự thanh thải của rilpivirine (xem phần Đặc điếm
dược động học). Dùng phối họp EDURANT với các thuốc cảm ứng CYP3A có thề lảm giảm
nồng độ cùa rilpivirine trong huyết tương do vậy có khả năng Iảm giảm hiệu quả điều trị của
EDURANT. Dùng phối họp EDURANT với cảc thuốc ức chế CYP3A có thề Iảm tảng nổng
độ cùa rilpivirine trong huyết tương.
Dùng kết hợp EDURANT với cảc thuốc lảm tãng pH dạ dảy có thề Iảm giảm nồng độ
rilpivirine trong huyết tương do vậy có khả năng Iảm giảm hiệu quả điều trị của thuốc.
Các thuốc bi ảnh hướnng sử dunỤlpivirinc
Dùng EDURANI` ò liều 25 mg ngảy | iẩn dường như không ảnh hưởng liên quan đến lâm
sảng trên sự phơi nhiễm cùa các thuốc chuyến hóa qua enzyme CYP. Cảc tưong tảc thuốc đã
được thiết lập và tương tác trên lý thuyết với một sô thuốc khảng retrovirus và các thuốc
không phải thuốc khảng retrovirus được liệt kế tương ứng trong bảng I và bảng 2.
Bãng rương tác
Tương tác thuốc giữa rilpivirỉne vả cảc thuốc phối hợp được liệt kê trong bảng sau (tảng
được biều thị bằng …1, giảm dược biếu thị bằng “”,l không thay đối dược biều thị bằng …..,~_
không ảp dụng được ký hiệu lả “NA", ! lầnlngảy được kí hiệu lả “q.d.” vả 2 lần/ngảy được kí
hiệu lả “b.í.d.“).
Bảng !: Cảc tương tác thuốc — Rilpivirine phối hợp với thuốc kháng retrovirus và
thuốc kháng vírus
Thuốc phốihợp Liều dùng Thuốc dược c.mu AUC c...…
của thuốc đảnh giá
phốihợp
.²' M
THUỐC Ức CHẾ ENZYME SAO CHẾ? NGƯỢC NUCLEOSIDE HOẶC
NUCLEOTIbE (NRTIs/NlthTls)
Didanosine'” 400 mg q.d. didanosỉne «› T 12% NA
rilpivirine <—› <…› <—›
Không phải hiệu chỉnh lỉều khi dùng EDURANT kểt hợp vởi
didanosine Vì didanosinc được dùng khi đói, nên uống didanosine
trưởc khi dùng EDURANT ít nhắt ] giờ hoặc sau khi dùng
EDURANT 2 giờ (EDURANT nên được uông vảo bữa ăn).
Tenofovir disoproxil 300 mgq.d. tenofovir 119% T23% ĩ24%
fumaratc*' rilpivirine <-› ++ <—›
Không phải hiệu chinh liều khi dùng phối hợp EDURANT vả
tenofovir disoproxil fumarate.
Cảc thuốc NRTIs khảc Căn cứ trên các đường thải trừ khác nhau cứa rilpivirine và các
(abacavir, cmtricitabine, thuốc NRTIs khảo, không có mối liên quan trên lâm sảng về tưong
lamivudinc, stavudine tảc thuốc có thể xảy ra giữa cảc thuốc trên và EDURANT.
and zidovưdinc)
THUỐC ỬC CHẾ ENZYME SAO CHÊP NGƯỢC NON- NUCLEOSIDE (NNRTIs)
NNRTIs Không khuyến cáo phối hợp EDURANT với NNRTIs.
(deiavirdine, cfavircnz,
etravirine, nevirapỉne)
CÁC THUỐC Ức CHẾ PROTEASE (Pls) - dùng kết hợp với liều thấp của ritonavir
Darunavir/ritonavir*" 800/100 mg darunavir <-› +—› 1 11%
q d rilpivirine i79% 1 130% 1 178%
Dùng phối hợp EDURANT với darunavirlritonavir có thề lảm
tăng nông độ cùa rilpivirine trong huyết tương (ức chế các enzyme
CYP3A) Không phải hiệu chinh liều khi dùng EDURANT kết hợp
vởi darunavir/rỉtonavir.
Lopinavir/ritonavir 400/100 mg lopinavir <—› <—› 1 11%
2%) có mức độ nghiêm trọng từ 2 trở lên là trẩm
cảm (3, 5% ở nhóm dùng FDURANT và 2, 2% ở nhóm dùng efavirenz), mẩt ngủ (2, 9%ờ
nhóm dùng EDURANT và 3,2% ở nhóm dùng efavircnz), đau đầu (2, 6% ở nhỏm dùng
EDURANT và 3, 4% ở nhóm dùng efavircnz), phát ban (2,2% ở nhóm dùng EDURANT vả
9,4% ở nhóm dùng efavirenz), những giấc mơ bắt thường (1,5% ở nhóm dùng EDURANT vả
3,8% ò“ nhớm dùng cfavirenz), buổn nôn (1,2% ở nhóm dùng EDURANT và 2,6% 61 nhóm
dùng efavirenz) vả chóng mặt (0,7% ở nhóm dùng EDURANT vả 6,6% ở nhóm dùng
efavircnz) (xem bảng 3 liệt kê đầy đủ các ADR).
Phần lớn cảc ADR được báo cảo trong suốt quá trình điều trị với EDURANT 25 mg ngảy [
lần có mức độ nghiêm trọng từ | tởi 2. Cảc ADR có mức độ nghiêm trọng là 3 hoặc 4 được
bảo cảo khi dùng EDURANT vả cfavirenz để điều trị lẩn lượt 13 3,1% vả 5,6%. ADR ớ mức
độ 3 vả 4 phố biển nhẩt lả tảng transamỉnasc (1,5% ở nhòm dùng EDURANT và 2,8% ở
nhóm dùng efavirenz), trẩm cảm (0,3% ở nhóm dùng EDURANT vả 0,6% ớ nhỏm dùng
cfavirenz), chỏng mặt (0,3% ở nhóm dùng EDURANT và 0,4% ở nhóm dùng efavirenz) vả
phảt ban (0, 3% ở nhóm dùng EDURANT và 0,6% ở nhóm dùng efavirenz ) 1, 6% bệnh nhân
ở nhóm dùng EDURANT phải ngừng điều trị do ADR so với 4, 0% ở nhóm bệnh nhân dùng
efavirenz. Ở nhóm dùng EDURANT, tắt cả cảc ADR dẫn tới phải ngừng điều trị đều có tỷ lệ
< 0,5% Ở nhóm dùng efavircnz, cảc ADR phố bỉến nhất dẫn đến phải ngứng đỉếu trị bao gôm
phảt ban (1, 5%), tãng transaminases (0, 7%), trầm cảm (0,6%) và những giâc mơ bất thường
(0, Ốo/o).
Cảc ADR trên lâm sảng từ mức độ vứa trờ lến (_>_ Mức độ 2) bảo cáo ở bệnh nhân trướng
thảnh được đỉếu trị bằng EDURANT được tống kết trong bảng 3. Các ADR được iiệt kế dựa
vảo phân loại theo hệ thống cơ quan (SOC) vả tần suất. Những bất thưòng về xét nghiệmđòi
hòi điếu trị được xem như phản ứng có hại được liệt kê trong bảng 4.
Bảng 3: Các ADR từ mức độ vừa trở lên (> mức độ 2) của EDURANT trên những bệnh
nhân trưởngthảnh bị nhiễm HIV-l chưa từng được điều trị
Phân loại theo hệ thống cơ Dữ liệu gộp từ 2 thứ n hiệm lâm sảng ECHO vẫ THRÍVE
quan (SOC) EDURANT + BR Efavirenz + Khác biệt trong
Phản ứng có hại của thuốc, N=686 BR điều trị (95%c1)
_% __ _ ___ N=682
Rối loạn chuyến hỏa và dinh dưỡng
Gỉảm sự thèm ăn 1 1,2% 1 0,6% 1 0,6 (-0,4; 1,6)
Rối loạn tâm thần
Trẫm cảm 3,5% 2,2% 1,3 (-0,5; 3,1)
Mẫt ngủ 2,9% 3,2% -o,3 (…2,1; 1,3)
Những giẳc mơ bẳt 1.5% 3,8% -2,4 (-4; -o,7)
thưòng*1
Rôi Ioạn giấc ngủ 1,2% 0,7% 0,4 (-0,6; 1,3)
Tâm ty_ạilgrchậriỳnảýn _ o,4% o,3% 0,1 (-0,3; 0,8) *
Rồi Ioạn hệ thần kinh
Đau đầu“ 2,6% 3,4% -0,8 (-2,6; 1,1)
Chóng mặt*“ 0,7% 6,6% …s,9 (-7,8; 3,9)
Ngủ lơ mơ 0,6% 1,3% -0,7 (-1,8; 0,3)
Rối Ioạn hệ tiêu hỏa
Đau bụng __ _ _ 1,3% 1,6% -0,3 (-1,6; |)
Buôn nôn“ 1,2% 2,6% . -1,5 (-2,9; 0)
9/20
Nôn 0,9% _ 1,6% -0,7 (-1,9; 0,4)
Khó chịu ở bụng 0,4% 0,1% 0,3 (-0,3; 0,9)
Rối Iogn ở da và mô dưới da
Nổi ban*” [ 2,2% [ 9,4% [ -7,2 (-9,6; -4,8)
Rối loạn toân thân và tình trgng nơi dùng thuốc
Mệtmòi 1 1,3% | 1,8% l-0,4(-1,8;0,9)
Đánh_giá_ _ _
Tảng Transaminase 1 2,5% 1 3,2% 1_-0,7 (-2,5; 1)
BR=Diếu trị nến; Cl=khoảng tin cậy
N= Tông sô đôi tượng nghiên cứu ở mỗi nhóm
* So sánh điều trị được định trước cho cảc ADR (phương pháp kiếm định Fisher)
' Giá trị p < 0,01
_ Giá trị p < 0,0001
1 Gìá trị p< 0,05
Không có thêm một loại ADR mới nảo được ghi nhận trên các bệnh nhân trướng thảnh trong
thử nghiệm lâm sảng TMC278-C204 giai đoạn 11 b kéo dải suôt 192 tuân.
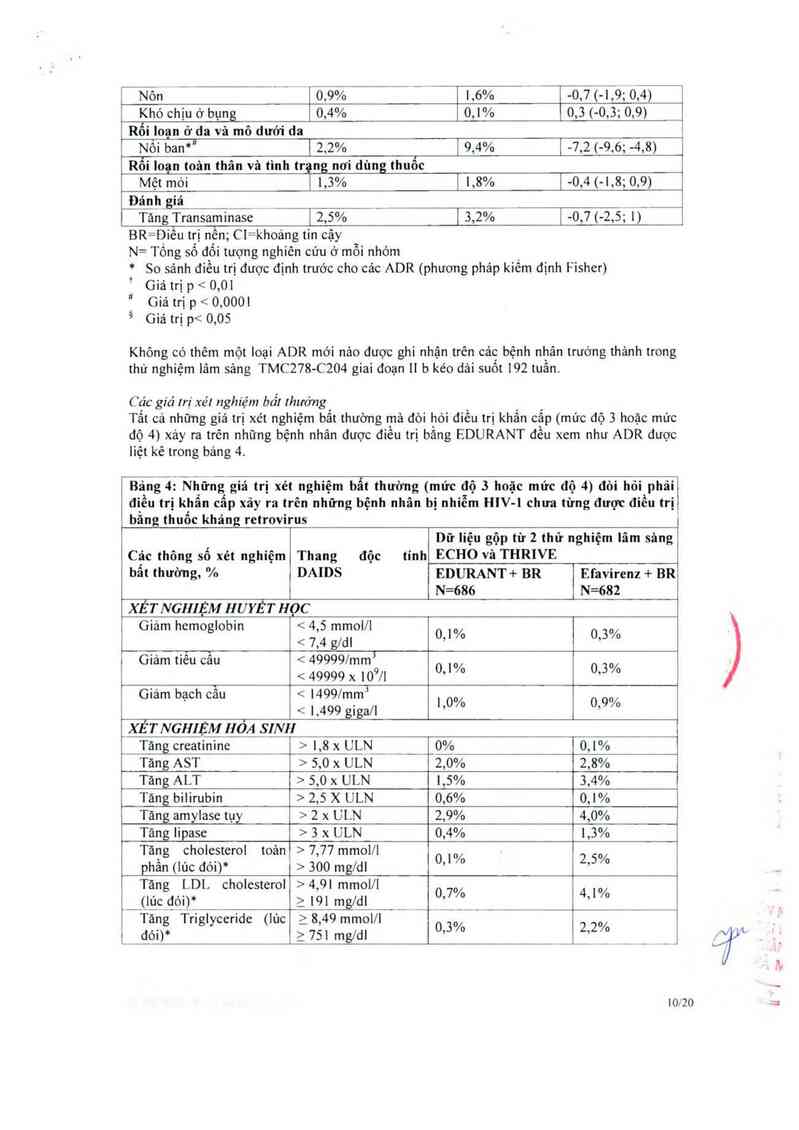
Các giả lrị xét nghiệm bẩl lhưởng
Tẩt cả những giá trị xét nghiệm bẳt thường mà đòi hòi điều trị khẩn cập (mức độ 3 hoặc mức
độ 4) xảy ra trên những bệnh nhân dược điêu trị bảng EDURANT đêu xem như ADR được
liệt kê trong bảng 4.
T3Ỉngỉi _Nhữn—g giá trị xét nghiệm bẩt thường (mức độ 3 hoặc mức độ 4) đòi hỏi phải
điều trị khẩn cẩp xãy ra trên những bệnh nhân bị nhiễm mv-1 chưa từng được điều trị
băng thuốc kháng retrovirus
Dữ liệu gộp từ 2 thứ nghỉệm lâm sảng
Các thông số xét nghiệm Thang độc tính ECHO Vả THRIVE
bẩt thường, % DAIDS EDURANT+ BR Efavirenz + BR
N=686 N=682
XET NGIII_ỆM HUYẾT HOC
Giảm hemoglobin < 4,5 mmol/l ,, ,,
<7,4ng1 0,1/o 0,36
Gia… tiếĨ Ễẫu < 4999971…3 ,, ,
< 49999 x 10°/1 0" /° 0*3 /°
Giảm bạch cẫu < 1499/mmĨ o 0
< 1,499 giga/l "M 019Á’
_XÉT NGHIỆM HÓA SINH
Tảng creatinine > 1,8 x UẸN__ ___…(Ểt 0,1%
Tảng AST › 5,0 x ULN 2,0% 2,8%
Tăng ALT › 5,0 x ULN 1,5% 3,4%
Tăng bilirubin › 2,5 x ULN 0,6% 0,1%
Tăng amylase tụy > 2 x ULN 2,9% 4,0%
Tărffl Iipase > 3 x ULN 0,4% 1,3%
Tảng cholesterol toản > 7,77 mmol/1 ,, 0
phần (lúc đói)* › 300 mg/dl 01"° 2’5 ’“
Tăng LDL cholesterol > 4,91 mmol/i ,, ,,
(Ig_đ6i)* 2 191 mg/dl 017/° _ 4’1/°
Tảng Triglyceride (lủc 2 8,49 mmol/l ,, ,,
dóỉ)* z 751 mg/dl 0’3 /° ²’²f _ _ __
10/20
BR=đieu trịỉến; ULN= giới hạn bình thưòng trên
N=tồng số đối tượng nghiên cứu ở mỗi nhóm
* p 5 0,001 theo phưong phảp kiềm định Fisher (sự khác biệt ở mức độ 3 so với mức độ 4
giữa hai nhóm điếu trị).
Ghi chú: Tỷ lệ phẩn trăm dược tính cho số đối tượng có kết quả cho phân tich.
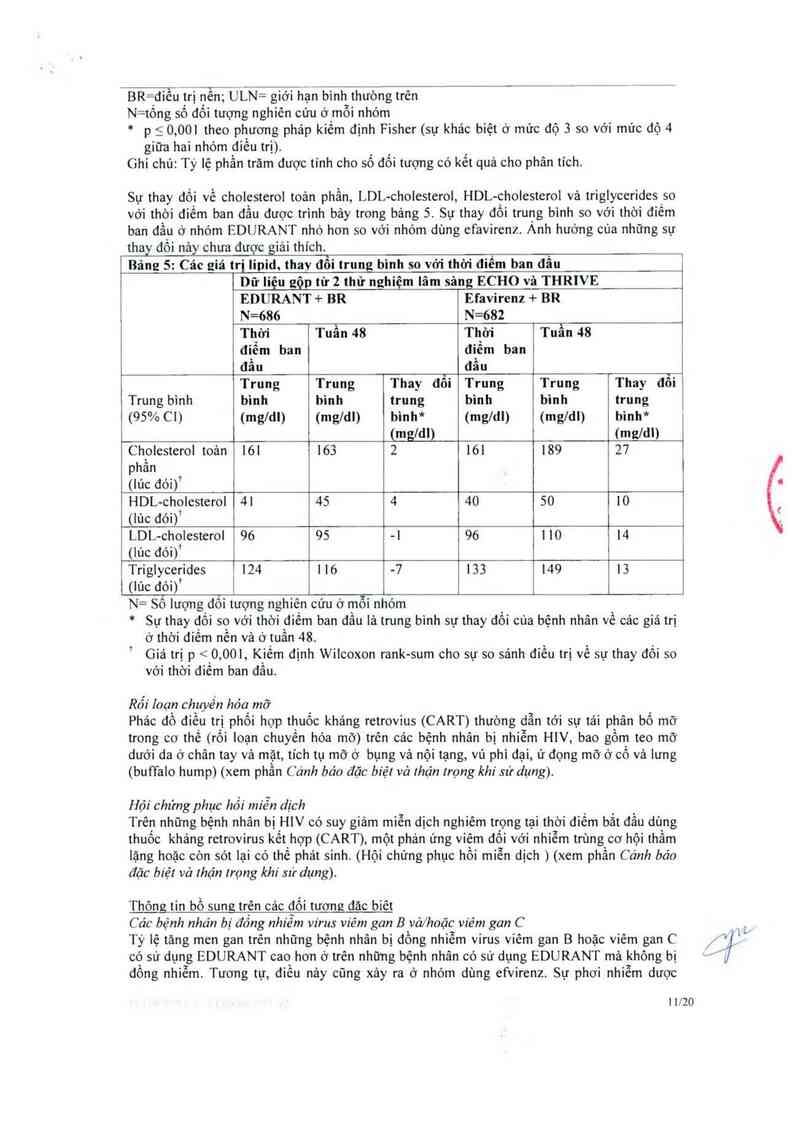
Sự thay đổi về cholesterol toản phần, LDL-cholesterol, HDL-cholesterol vả triglyccridesso
với thới điếm ban đầu được trình bảy trong bảng 5. Sự thay đối trưng bình so với thời diêm
ban đầu ở nhớm EDURANT nhỏ hon so với nhóm dùng et"avirenz. Ành hưởng cùa những sự
thay đối nảy chưa được giải thích.
Bãng 5: Các giá trị lipid, thay đổi trung bình so vởi thời điếm ban đầu
Dữ liệu gộp từ 2 thử nghiệm lâm sảng ECHO vã THRIVE
EDURANT + BR Efavirenz + BR
N=686 N=682
Thời Tuần 48 Thời Tuần 48
điểm ban điểm ban
đẫu đầu
Trung Trung Thay đổi Trung Trung Thay đổi
Trung bình bình binh trung bình bình trung
(95% C1) (mg/dl) (mg/dl) bình* (mg/dl) (mg/dl) bình*
(mgldl) (mg/dl)
Cholesterol toản 161 163 2 161 189 27
phẳn
(Iủc đới)*
HDL—cholesterol 41 45 4 40 50 10
(lủc đới)*
LDL-cholesterol 96 95 -1 96 1 10 14
(lúc đới)’
Triglycerỉdes 124 1 16 —7 133 149 13
(lủc đới)*
N= Số iượng dối tượng nghiên cứu ở mỗi nhóm
* Sự thay đối so với thời điếm ban đầu 151 trung binh sự thay đồi cùa bệnh nhân về cảc giá trị
ở thời điếm nến và ở tuần 48.
Giá trị p < 0,001, Kiếm định Wilcoxon rank-sum cho sự so sánh đỉều trị về sự thay đối so
với thời điềm ban đẩu.
Rối loạn chuyến hóa mỡ
Phảc đồ đỉều trị phối họp thuốc kháng retrovius (CART) thường dẫn tới sự tái phân bố mỡ
trong cơ thể (rối Ioạn chuyến hóa mỡ) trên cảc bệnh nhân bị nhiễm HIV, bao gổm teo mõ“
dưới da ở chân tay vả mặt, tich tụ mở ở bụng vả nội tạng, vú phì đại, ứ đọng mở ở cố và lưng
(bu ffalo hump) (xem phần Cảnh báo đặc biệt vả Ihận Irọng khi sử dụng).
Hội ch1’mgphục hồi miễn dịch
Trên những bệnh nhân bị 111v có suy giảm miễn dịch nghiêm trọng tại thời đìềm bắt đầu dùng
thuốc kháng retrovirus kết hợp (CART), một phản ứng viêm đối với nhiễm trùng cơ hội thầm
lặng hoặc còn sót lại có thế phát sỉnh. (Hội chứng phục hồi miễn dịch ) (xem phần Cảnh bảo
đặc biệt vả lhận Irọng khi” sử dụng).
Thông tin bổ sung trên các đối tuong đăc biết
Các bệnh nhán bị đống nhiễm virus vỉẽm gan B vả/hoặc viêm gan C
Tỷ lệ tăng men gan trên những bệnh nhân bị đổng nhiễm virus viêm gan B hoặc viêm gan C
có sử dụng EDURANT cao hon ở trên những bệnh nhân có sử dụng EDURANT mã không bị
dổng nhiễm. Tương tự, điếu nảy cũng xảy ra ở nhóm dùng efvirenz. Sự phơi nhiễm dược
11120
…)ử
động học cùaỵiipivirine ở những bệnh nhân đồng nhiễm lả tương đương so với những bệnh
nhân không đông nhiễm.
Thông báo cho bác sỹ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Quá liều
Chưa có thuốc giải độc đặc hiệu khi sử dụng quá liếu EDURANT Kinh nghiệm về quá liều
trên người dùng EDURANT còn hạn chế. Điều trị quả iiếu EDURANT dựa vảo cảc biện pháp
hỗ trợ chung bao gồm theo dõi các dấu hiệu sinh tồn và ECG (khoảng QT) cũng như theo dõi
trạng thái lâm sảng cùa bệnh nhân. Khi có chỉ định, cần thải hoạt chẩt chưa hắp thu bằng cách
rứa dạ dảy. Cũng có thể uống than hoạt để giúp thải lượng chẳt chưa hấp thu ra ngoải cơ thế
Vì rilpivirine liên kểt mạnh với protein huyêt tưong nên thấm tách máu ít có tác dụng loại trừ
thuốc ra khới cơ thể
ĐẶC ĐIEM DƯỢC LÝ
Đặc điểm dược lực học
Nhóm dươc 1v và mã ATC ' ’
Nhóm dược lý: thuôc kháng virus dùng đường toản thân, NNRTI (thuôc ức chế men sao chép
ngược non-nucleosid), Mã ATC: chưa có.
Cơ chế hoat đông
Rilpivirine lả một diary1py rimidine NNRT] cứa HIV— 1. Hoạt động Rilpivirine qua trung gian
ức chế không cạnh tranh cưa HIV— | reverse transcriptase (RT) Rilpivirine không ức chế các
nhân tế bảo DNA polymerase 01 [ẫvả y
Tảc dung kháiffl virus in vier
Rilpivirine thế hiện tác dụng chống lại cảc chủng trong phòng thí nghiệm cùa cảc chùng HIV-
1 hoang dại trong một dòng tế bảo T bị nhiễm cấp tính với giá trị ẸC50 HIV-1/lliB trung binh
lả 0,73 nM (0,27 ng/ml). Mặc dù rilpivirine thế hiện hạn chế tinh khảng 111v-2 trên in vitro
với giá trị ECso nằm trong khoảng 2510 tới 5220 nM (920 tới 1910 ng/ml), tuy nhiên người ta
không khuyến cảo điều trị nhiễm HIV-2 bằng EDURANT vi thiếu cảc dữ liệu nghiên cứu trên
lâm sảng.
Rilpivirine củng thế hiện tác dụng kháng virus một trên phố rộng chùng phân iập sơ cẩp HIV-
] thuộc nhóm M (phân tuýp A,B,D,F, G,H) với giá trị cùa ECso từ 0,07 cho tởi 1,01 nM
(0,03 cho tói' 0,37 ng/mi) vả trên chủng phân lặp sơ cẳp nhóm 0 với giá trị ECsn trong
khoảng 2,88 cho tới 8,45 nM (1,06 cho tới 3,10 ng/ml).
Rilpivirine thế hiện tác dụng khảng virus hiệp đổng khi phối hợp với các thuốc ức chế eznyme
sao chép ngược Ioại nucleoside [N(t)RTII abacavir, didanosine, emtricitabinc, stavudinc vả
tenofovir; cảc thuốc ức chế protease (P1) amprenavir, atazanavir, darunavir, indinavir,
lopinavir, neli'mavir, ritonavir, saquinavir and tipranavir; cảc thuốc ức chế enzyme sao chép
ngược không phải nucleoside (NNRTIs) efavirenz, etravirine vả nevirapine; chất ức chế phản
ứng tồng hợp enfuvirtỉde; và thuốc ức chế virus xâm nhập maraviroc. Rilpivirine thế hiện tác
dụng hiệp đống trong hoạt tính kháng virus đồng vận khi dùng phối hợp với NRTls
lamivudine vả zidovudine và thuốc ức chế ỉntegrase raltegravir.
Sư khảng thuốc
Trên các tế bảo nuôi cấy
Các chùng khảng với rilpivirine được chọn lọc từ các tế bảo nuôi cấy bắt đầu từ cảc chủng
HIV-l hoang dại với ngưồn gốc vả phân tuýp khác nhau cũng như các HIV-l khảng NNRTI .
12/20
ẬVLỊ
c`
Sự thay thế acid amin xảy ta phổ biến nhất bao gồm : 11001,1<10113, v1081, E138K, V179F,
Y181C, 11221v, F227C vả 1712301.
Điếm cắt sinh học (biological cưt-off— BCO) cùa rilpivirne được xác định khi số lấn tăng (FC)
giá trị ECso lảỌ3,7, trên cơ sớ phân tich tính nhạy cảm cùa một lượng lớn cảc chùng HIV—l
hoang dại tải tỏ hợp phân lập được trên lâm sảng.
Trên cảc đối lượng chưa n`mg được điều rrị
Phân tích khảng thuốc gộp lại từ cảc thử nghiệm lâm sảng giai đoạn 111, 62 (trong tổng số 72
trường hợp) thắt bại về tỷ lệ virus bị tiêu diệt ở nhóm sử dụng thuốc EDURANT cho thẳy cảc
dữ liệu vê khảng thuốc ở thòi điếm ban đầu và thời điếm thẳt bại. Sự thay thế acid amin gắn
liến với sự đề kháng NNRTI xảy ra phổ biến nhất ở ca'c đối tượng lả: V901, K1011-1, E138K.
E138Q, Y181C, V1891 vả H221Y. Tuy nhiến, trong cảc thử nghiệm lâm sảng, sự hiện diện
cùa thay thế V901 vả V1891 ở thời điềm ban đắn, không ảnh hưởng tới sự đảp ứng.
Xem ›gét các dữ liệu sẳn có in vilro và in vivo, sự thay thế các acid amin có mặt tại thời điếm
ban đâu sau đây, có khả nãng ảnh hướng tới hoạt động cùa rilpivirine: K10113, K101P,
131380, 13138K, E138R, E138Q, Y181C, Y1811, Y181V vả H221Y.
Sư khảng chếo '
Virus độ! biên điẻm định hướng với NNRTJ
Trên 67 chùng H1V— 1 tải tô họp trong phòng thí nghiệm có một acid amin thay thế ở vị trí RT
có liên quan tới sự khảng NNRT], bao gôm những ghi nhận phổ biến nhắt lả KIO3N vả
Y181C, rilpivirine thế hiện hoạt tính khảng virus với 64 (96%) cảc chùng trên Sự thay thế
các đơn acid amin gắn liền với việc Iảm mất tính nhạy cảm với rilpivirine lả K101P, Y1811 vả
Y181V
Các chủng phản lập lả! lố hợp Irẻn lâm sảng '
Rilpivirine 'vẫn duy trì tính nhạy cảm (FC 5000 bản sao/ml được tuyên chọn vảo nghiên cứu và được sảng
lọc vế sự nhạy cảm với N(t)RT1 vả sự vắng mặt cưa các đột biến đặc hiệu phối hợp với đề
khảng NNRTI (RAM) Trong thử nghiệm ECHO, chế độ điếu trị nến được kết hợp với các
N(t)RTls, tenofovir disoproxil fumarate phối hợp với emtricitabinc Trong thử nghiệm
THRIVE, chế độ điểu trị nến gồm 2 thuốc N(t)RT1 được nghiên cứu viên lựa chọn: tenofovir
disoproxil fumarate phối hợp với emtricitabine hOẬ zidovudine phối hợp với Iamivudine
h_oảc abacavỉr phối hợp với lamivudine Trong thử nghiệm ECHO, sự ngẫu nhiến hớa dược
phân tầng dựa trên tái lượng virus ở thời điếm sảng lọc Trọng thử nghiệm THRIVE, sự ngẫu
nhiên hóa dược phân tầng dựa trến tải lượng virus ớ thòi điếm sảng lọc vả theo chế độ điếu trị
N(t)RT1 nến.
Phân tích nảy bao gồm 690 bệnh nhân `trong thử nghiệm ECHO và 678 bệnh nhân trong thử
nghiệm THRIVE đã hoản tât 48 tuân điêu trị hoặc ngừng nghiên cứu sớm.
Phân tích gộp cho thử nghiệm ECHO vả THRIVE, đặc điềm nhân khấu học vả đặc diếm ban
đầu được cân bắng giữa nhóm dũng EDURANT và nhóm dùng efavirenz. Bảng 6 thế hiện
cảc dữ liệu về đặc điếm nhân khẩu học và đặc điếm ban đầu cùa cảc bệnh nhân ở nhóm dùng
thuốc EDURANT và nhóm dùng efavirenz.
Bảng 6: Đặc điểm về nhân khẩu học và đặc điểm bệnh học ban đầu của những bệnh
nhân trưởng thảnh bị nhiễm HIV-l chưa từng được điều trị trong thử nghiệm ECHO vả
THRIVE (phân tích gộp)
_ _ _ _ _ _ _ _ Dữ liệu gộp từ thử nghiệm ECHQ_v_ảỊHRIVE __
EDURANT + BR Efavirenz + BR
_ ỷ __ _ _ _ N=686 N=682 _
Đjc điếm nhân khẩu học Ữủ "
Độ tuối trưng bình, nảm (khoảng) 36 36
(18-78) (19—69)
Giới tính
Nam 76% 76%
Nữ 24% 24%
Chùng tộc
Người da trắng __ __ ___ 61% _ 60%
N gười da đen/Người Mỹ_gôe_Lhi 24% 23% g
Người châu A I 1% 14%
Khác 2% 2%
Không cho phép hòì theo quy định 1% 1%
cùa nước tham gia nghỉến cứu
Đặc điểm bệnh học ban đầu
Nỗng độ HIV-l RNA trung bình trong 5,0 1 5,0
huyết tương (khoảng), Iogio bản (2-7) | (3—7)
| 41’20
L
sao/mi
Trung binh sô lượng tế bảo CD4+ 249 260
(khoảng), x 1061ế bảo/l (1-888) ' (1-1137)
Phẫn trăm đối tượng bị đổng nhiễm:
virus viêm gan B/C 7,3% 9,5%
Phân trăm đỗi tưọng có chế độ điếu trị
nền như sau:
tenofovir disoproxil fumarate kết
hợp với emtricỉtabỉne 80,2% 80,1%
zidovudine kết hợp vởi lamivudine 14,7% 15,1 %
abacavir kết hợp với lamivudine 5,1% 4,8%
BR -chế độ điêu trị nến
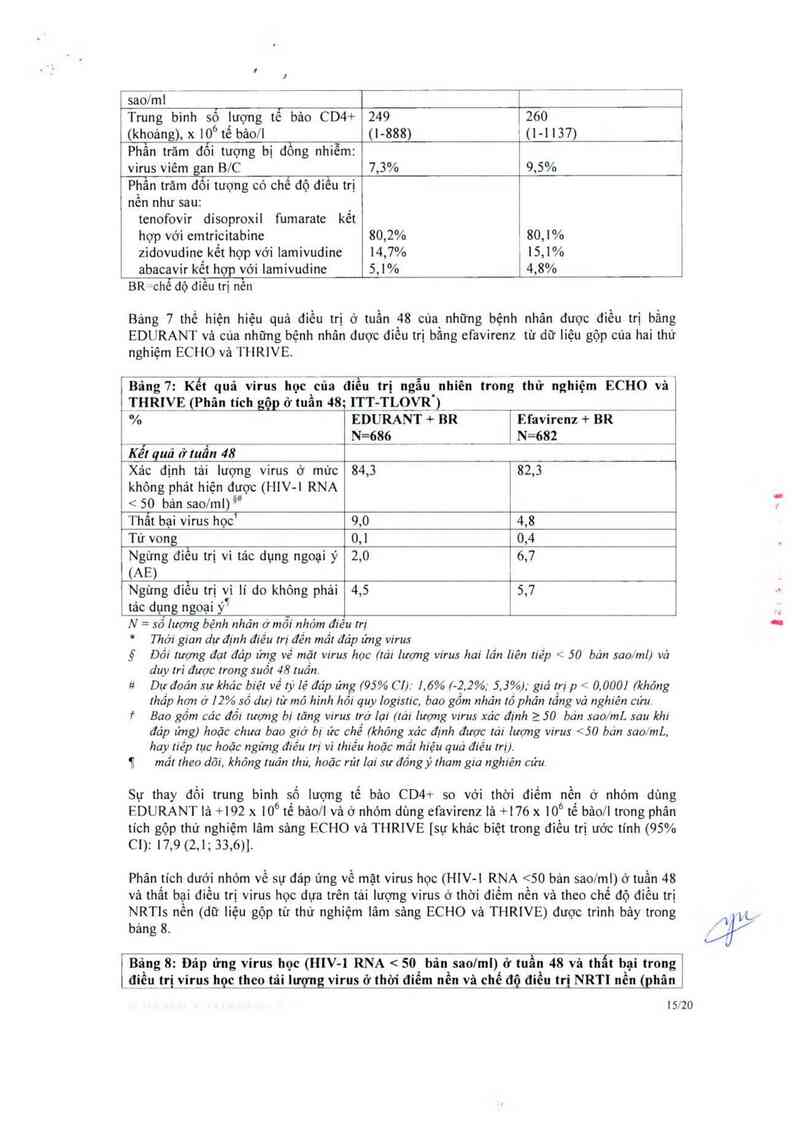
Bảng 7 thế hiện hiệu quả điếu trị ở tuần 48 của những bệnh nhân được điều trị bằng
EDURANT vả cùa những bệnh nhân dược điêu trị băng efavirenz từ dữ liệu gộp cùa hai thử
nghiệm ECHO vả THRIVE.
ếBảng 7: Kết quả virus học của diêu trị ngẫu nhiên trong thử nghiệm ECHO vảY
THRỊỵE_gẾn tích gg~g Ể_tỀ 48— iT_T TLOVR ')
% EDURANT + BR Efavirenz + BR
__ ___1l-É8ỉ _ N=682
Kềĩquả ởtuẩn 48
Xảc định tải lượng virus ở mưc 84,3 82,3
khỏng phảt hiện được (HIV-l RNA
< 50 bản sao/ml) 1“
Thất bại virus học’ 90 4,8
Tử vong 0,1 0,4
Ngừng điều trị vì tác dụng ngoại ỷ 2,0 6,7
(AE)
Ngừng diễu trị vì lí do không phải 4,5 5,7
tác dụng ngoại ỷ
N — sô lượng bệnh nhản ớmôi nhóm điêu rrị
* Thời gian dự định điếu Irị đến mẳr đáp ứng virus
ỷ Dối lượng đạt đáp ửng về mặt vírus học (rái lượng vírus hai lẩn liên liếp < 50 bản sao/ml) vả
duy m` được lrong suốt 48 Iuẩn
# Dự đoán sự khảc biệt về tỷ lệ đảp ưng (95% C1). l. 6% (- 2. 2%; 5, 3%), giá Irị p < 0, 0001 (không
!hẩp hon (7 12% số dư) lư mô hình hôi quy Iogislic, bao gồm nhản lồ phản lồng vá nghíên cưu
† Bao gồm các đối lượng bị tăng virus lrớ lại (lái lượng virus xác định > 50 bản sao/mL sau khi
đáp ứng) hoặc chưa bao giờ bị ức chế (không xác định được lái lượng virus <50 bản sao/mL,
hay Iiẻp lục hoặc ngừng điều trị vi thiếu hoặc mầl hiệu qua điếu Irị)
11 mẩ! Iheo dõi, khỏng Iuân Ihu, hoặc rú! lại sự đồng y [ham gia nghiên cửu.
Sự thay đồi trung bình số lượng tế bảo CD4+ so với thời điếm nền ở nhóm dùng
EDURANT 1ả +… x 10° tể bảo/l và ở nhóm dùng efavirenz lả +176 x 10° tể bảo/I trong phân
tích gộp thử nghiệm lâm sảng F.CHO vả THRIVE [sự khảc biệt trong điếu trị ước tính (95%
C1): 17,9 (2,1; 33,6)1.
Phân _tích dưới nhóm về sự đáp ửng về mặt virus học (HlV-I RNA <50 bản saolm_l) ờ tuặn 48
vả thât bại điêu trị virus học dựa trên tải lượng virus ở thời điêm nên và theo chế độ điêu trị
NRTIs nên (dữ liệu gộp từ thử nghiệm lâm sảng ECHO vả THRIVE) được trình bảy trong
bảng 8.
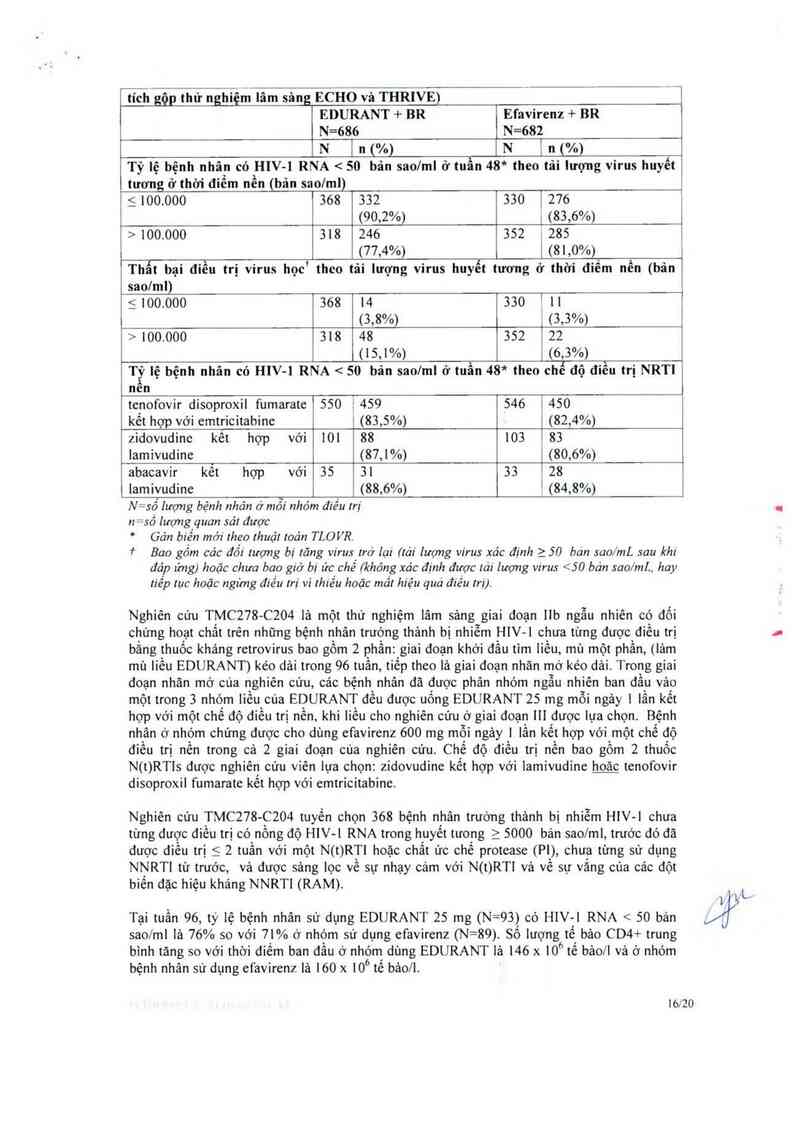
Bặng 8: Đáp ứng virus học (HIV—l RNA < 50 bản sao/ml) ở tuần 48 và thất bại trong
_đi_ệ_ụ_ trị ỵirgshọg theo tải lượng virus ở thời điểm nền và chế độ điều trị NRTI nên (phân
lSa’2O
`
tichẸộffli'ỉhỆhỉệủ lâm sản ECHO vả THRIVE)
EDURANT + BR Efavirenz + BR
N=686 N=682
N [ n (%) N 1n (%)
Tỷ lệ bệnh nhân có HlV—l RNA < 50 bãn sao/ml ở tuẫn 48* theo tải lượng virus huyết
tương ở thời điểm nển (bản sao/ml)
5 100.000 368 332 33(Ỉ1 276
(90,2%) ; (83,6%)
> 100.000 318 246 352 1 285
(77,4%) 1 (81,0%)
Thẩt bại điều trị virus học1 theo tâi lượng virus huyết tương ở thời điếm nền (bản
sao/ml)
5 100.000 368 14 330 1 11
(3,8%) [ (3,3%)
› 100.000 318 48 352 , 22
(15,1%) ) (6,3%)
Tỷ lệ bệnh nhân có HlV-l RNA < 50 bản saolml ở tuẫn 48* theo chế độ điều trị NRTI
À
nen
tenofovir disoproxil fumarate 550 1459 546 1450
kểt hợp với emtricitabine | (83,5%) 1 (82,4%)
zidovudinc kết hợp với 101 88 103 183
Iamivudine (87,1%) [ (80,6%)
abacavir kết hợp với 35 31 33 128
Iamivudine (88,6%) ’ (84,8%)
N— số lượng bệnh nhân ở mỗi nhóm điếu trị
n= số lượng quan sát được
Gán biển mới rheo rhuật loản TLOVR.
* Bao gồm các đối tượng bị tăng virus Irớ lại (tái lượng virus xăc định > 50 bán sao/mL sau khi
đáp ứng) hoặc chưa hao giờ bị z'rc chế (khỏng xăc định được 1ả1' lượng v1rus < 50 bán sao/mL. hay
uêp rục hoặc ngừng điêu m’ … lhiếu hoặc mẩ! hiệu qua điếu m)
Nghiên cứu TMC278- C204 là một thử nghiệm lâm sảng giai đoạn Ilb ngẫu nhiên có đối
chửng hoạt chất trên những bệnh nhân trướng thảnh bị nhiễm HIV- ! chưa từng đuợc điều trị
bằng thuốc kháng retrovirus bao gổm 2 phẩn: giai đoạn khới đầu tim liều, mù một phần, (lảm
mù liều EDURANT) kéo dải trong 96 tuần, tiếp theo là giai đoạn nhãn mở kéo dải. Trong giai
đoạn nhãn mớ cùa nghiên cứu, các bệnh nhân đã được phân nhóm ngẫu nhiên ban đầu vảo
một trong 3 nhóm liều cùa EDURANT đếu được uống EDURANT 25 mg mỗi ngảy 1 lần kết
họp với một chế độ diều trị nển, khi Iỉều cho nghỉến cứu ở giai đoạn 111 được lựa chọn. Bệnh
nhân ở nhóm chứng được cho dùng efavirenz 600 mg mỗi ngảy 1 lẳn kết họp với một chế độ
điều trị nền trong cả 2 giai đoạn cùa nghiên cứu. Chế độ điều trị nền bao gồm 2 thuốc
N(t)RTls được nghiên cứu vỉên lựa chọn: zidovudine kết hợp với lamivudinc 1Lăc tenofovir
disoproxil fumaratc kết hợp với emtricitabinc.
Nghiên cứu TMC278-C204 tuyến chọn 368 bệnh nhân trướng thảnh bị nhiễm HIV—l chưa
từng dược điều trị có nồng độ HIV—l RNA trong huyết tưong ; 5000 bản sao/ml, trưởc đó đã
được điếu trị 5 2 tuần với một N(t)RT1 hoặc chất ửc chế protease (Pl), chưa từng sử dụng
NNRTI từ trước, vả được sảng lọc về sự nhạy cảm với N(t)RT1 vả về sự vắng cùa cảc đột
bìến đặc hiệu khảng NNRTI (RAM).
Tại tuần 96, tỷ lệ bệnh nhân sử dụng EDURANT 25 mg (N=93) có HIV-l RNA < 50 bản
saolml là 76% so với 71% ở nhóm sử dụng efavirenz (N=89). Số lượng tế bảo CD4+ trung
bình tăng so với thời điếm ban đằu ở nhóm dùng EDURANT lả 146 x 106 tế bảo/1 và ở nhóm
bệnh nhân sử dụng efavirenz là 160 x 10ó tế bảo/I.
16/20
Trong số cảc bệnh nhân có đảp ủng ở tuấn 96,80% bệnh nhãn duy trì tải IƯỌng virus ở mức
không thể phát hiện được (HIV- 1 RNA < 50 bản sao/ml) ở tuần 192 Không có vấn đề gì về
tính an toản cùa thuốc được phát hiện ở trong phân tích tại tuần 192.
Đặc điểm dược động học
Dặc điếm dược động học của rilpivirine được đánh giá trên người tình nguyện trướng thảnh
khóe mạnh và trên cả những bệnh nhân trường thảnh bị nhiễm HIV- 1 chưa từng được điếu trị
bằng thuốc kháng retrovirus. Sự phơi nhiễm cùa rilpivirine trên những bệnh nhân bị nhiềm
HIV- 1 thường thấp hơn so với ở người tình nguyện khóc mạnh
Hấọ thu ' _
Sau khi tiông, rilpivirine thưòn đạt nông độ cực đại trong huyết tương trong vòng 4-5 giờ.
Chưa biêt sinh khả dụng tuyệt đôi cùa EDURANT.
Ánh hướng cùa thửc ăn tói sư hấn thu ’
Khi uống EDURANT vảo lủc dói, sự phơi nhiễm cùa rilpivirine thâp hon khoảng 40% so
với khi uộng cùng bữa ăn có mức nảng lưọng bình thường (533 kcal) hoặc một bữa ãn có hảm
lượng chẩt béo vả mức nãng lượng cao (928 kcal) Khi chi uông EDURANT cùng với thức
uông dinh dưỡng giảu protein, sự phơi nhiễm của rilpivirine thấp hon 50% so với khi uống
vảo bữa ăn.
P_hân bố
Rilpivirine liên kết với protein huyểt tương khoảng 99, 7% in vitro, chủ yếu lá với albumin. Sự
phân bố cùa rilpivirine vảo cảc dịch khác cùa cơ thể ngoải huyết tương (ví dụ như: dịch não
tùy, dịch tiết từ đường sinh dục) chưa được đánh giá trên người.
Chuvền hòa _ ' _
Thực nghiệm trên in vilro cho thây rilpivirine chủ yếu chuyên hỏa qua các phản ứng oxi hỏa
giản tiêp qua hệ thông cytochrome P450 (CYP) 3A.
I__hải trừ
Thời gian bản thải cùa rilpivirine xẩp xỉ 45 giờ Sau khi dùng đơn liều uống M-C -rilpivirine, có
khoảng 85% và 6,1 % chất phóng xạ được tìm thấy tương ứng trong phân vả nước tiếu. Có
khoảng 25% rilpivirine của liếu đã dùng được thải trừ nguyên vẹn qua phân Chi phát hiện
dẳu vết cùa rilpivirine nguyên vẹn (<1% Iiểu) trong nước tiêu
Thông tin bổ sung trên các đối tương đăc biêt
Trẻ em
Dược động học cùa rilpivirine trên bệnh nhi đang được đánh gìá. Do không có đủ dữ liệu nến
không thể đưa ra Iiếu khuyến cáo cho bệnh nhi (xem phần ”Liều lượng và cách dùng ").
Người giả
Phân tích về dược động học theo quần thể trên những bệnh nhân nhiễm HIV cho thẳy dược
động học cua rilpivirine không có sự khác biệt giữa các độ tuối đảnh giá (từ 18 đến 78).
Không phải hiệu chỉnh Iiếu EDURANT trên cảc bệnh nhân cao tuồi (xem phẳn “Liều lượng
vả cách dùng “).
Giới lính
Không có sự khảc biệt trên lâm sảng vê dược động học cùa rilpivirine gỉữa nam vả nữ.
Chúng lộc
17/20
Phân tich dược động học theo quần thể cùa rilpivirine trên những bệnh nhân bị nhiễm HIV
cho thây chùng tộc không ảnh hướng tới sự phơi nhiễm của rilpivirine trên lâm sảng.
Suy gan
Rilpivirine chuyền hóa vả thải trừ chủ yếu qua gan Trong một nghiên cứu so sánh trên 8 bệnh
nhân bị suy gan nhẹ (Thang điềm Child- Pugh A) với 8 bệnh nhân tưong đương 0 nhóm chứng
vả 8 bệnh nhân bị suy gan vứa (Thang điềm Child- Pugh B) với 8 bệnh nhân tương đương ở
nhóm chứng, sự phơi nhiễm cùa rilpivirine đa liều cao hơn 47% ở những bệnh nhân suy gan
nhẹ và 5% ở nhóm bệnh nhân suy gan vừa. Không phải hiệu chinh lỉếu trên nhũng bệnh nhân
suy gan nhẹ hoặc trung binh EDURANT chưa được nghiên cứu trên những bệnh nhân bị suy
gan nặng (Thang diềm Chìld- Pugh C). (xem phẩn “Liêu lượng và cách dùng”).
Đồng nhiễm vởi virus viêm gan B vò /hoặc viêm gan C
Phân tích dược dộng học theo quần thể cho thẩy việc đồng nhiễm với virus viếm gan B vả/
hoặc víêm gan C không có ảnh hướng tới sự phơi nhiễm của rilpivirine trên lâm sảng.
Suy !hặn
Dược động học cùa rilpivirine chưa được nghiến cứu trên các bệnh nhân bị suy thận. Sự thải
trừ cùa rilpivirine qua thặn lá không đáng kê. Không cẳn hiệu chinh liều của EDURANT trên
nhũng bệnh nhân suy thận nhẹ hoặc vừa. Cần sử dụng thặn trọng EDURANT trên những
bệnh nhân suy thận nặng hoặc bị bệnh thận giai đoạn cuối vi nông độ trong huyết tương có
thể tăng lên do thay đối hẩp thu, phân bố, hoặc/vả chuyến hóa thứ phát do rôi loạn chức năng
thận Vi rilpivirine liên kết mạnh vó1 protein trong huyết tương, do vậy mà thuốc sẽ không
được loại trừ đảng kế bằng chạy thận nhân tạo hoặc thẩm phân phúc mạc (xem phần ”Líều
lượng vả cách dùng").
Dữ liệu an toản tiền lâm sâng
Cảc nghiên cứu về đôc tính hoc nói chung
Nghiên cứu về độc tính cùa rilpivirine trên động vật đã được tiến hảnh trên chuột nhắt, chuột
cống, thò, chó và khi duôi dải. Các cơ quan và hệ cơ quan đích bị độc tính bao gồm vò thượng
thận vả hệ thống sinh tống hợp cảc steroid có liên quan (chuột nhắt, chuột cống, chó, khi đuôi
dải), cơ quan sinh sản (trên chuột cái, chó đực và chó cái), gan (chuột nhắt, chuột cống, chó),
tuyến giảp và tuyến yên (chuột cống), thặn (chuột nhắt, chó), hệ tạo máu (chuột nhắt, chuột
công, chó) vả hệ đông máu (chuột cống).
Nghiên cứu đôc tinh đối với sự sinh sản
Trong một nghiến cứu được thực hiện trên chuột, không thắy có ánh hướng gì tới sự giao
phối hoặc khả năng sinh sản khi sử dụng rilpivirine với liếu lên tới 400mg/kg/ngảy, liều cùa
rilpivirine gây ra độc tinh trên chuột mẹ. Liều nảy Iiến quan đến sự phơi nhiễm cao hon
khoảng 40 lần so với sự phoi nhiễm trên người tại liều khuyến cáo 25mg ngảy | lằn. Các
nghiên cứu trên động vật cho thấy không có bằng chứng liên quan tới dộc tính phôi thai hoặc
độc tính thai nhi hoặc tảc động lên chức năng sinh sản . Không có hiện tượng sinh quải thai
khi sử dụng rilpivirine trên chuột vả thò. Mức độ tảc dụng ngoại ý không quan sát thấy
(NOAELs) đối với sự phoi nhiễm trên phôi thai cùa chuột vả thò lần lưọ1 cao hơn 15 vả 70
lần so với sự phơi nhiễm trên người ở lìếu khuyến cáo 25 mg ngảy 1 lần. Trong một nghiến
cứu đánh giá sự phát triến trước và sau sinh ở trên chuột công, rilpivirine không tảc động lến
sự phát triến cùa con cải trong quá trình cho con bú hoặc trong quá trình cai sữa khi mẹ sư
dụng thuốc với liểu lên tới 400 mg/kg/ngảy.
Gâỵ ung thư vả đôt biến
Khả năng gây ung thu cùa rilpivirine được nghiên cứu trên chuột nhắt và chuột cống dùng
thuốc qua đường ông uống trong 104 tuần Liễu dùng hảng ngảy cho chuột nhắt 1ả 20, 60
18/20
vả160 mg/kg/ngảy vả liếu dùng hảng ngảy cho chuột cống lả 40, 200, 500
vả1500 mg/kg/ngảy. Tỷ lệ ung thư tế bảo gan vả ung thư biếu mô quan sảt được trên cả chuột
nhắt vả chuột còng. Tảng tỷ lệ u nang tế bảo tuyến yên vảlhoặc ung thư bỉếu mô tuyến yến
xảy ra trên chuột công. Dùng rilpivirine không gây ra sự gia tăng có ý nghĩa thống kê nảo vê
tỷ lệ bị u lảnh hoặc u ác tính trên chuột nhắt hay chuột công Phảt hiện trên tế bảo gan ghi
nhận ở chuột nhắt và chuột cống được xem như lá đặc trưng 01 loại gặm nhấm, có liến quan tới
sự cảm ứng men gan. Cơ chế tưong tự như vậy không xảy ra trên người; do vậy mả, cảc Ioại
ung thư nảy không có mối lỉên quan với con người. Phát hiện về tế bảo nang được xem lả dặc
trưng ở chuột công, gắn liến với tảng thanh thải cùa thyroxine và được xem là không có mối
liên quan với con người. Ở liếu dùng thấp nhất sử dụng trong cảc nghiên cứu về khả năng gây
ung thư, sự phoi nhiễm hệ thống (dựa trên diện tích dưới đường cong— AUC) cùa rilpivirine lả
21 lần (ở chuột nhắt) vả 3 lần (ở chuột cống), liên quan đến những ghi nhận trên người khi
dùng liều khuyến cáo (25mg ngảy 1 lằn).
Rilpivirine cho kết quả âm tính trong xét nghiệm về đột biến ngược Ames in vilro, xét nghiệm
vê sự sai lạc nhiễm sảc thế trên tế bảo lympho người trên in vilro và xét nghiệm về khả năng
gây tổn thưong trên nhiễm sắc thể ở tế bảo lympho chuột nhắt trên ỉn vilro, kiềm tra sụ có mặt
hay vắng mặt cùa hệ thống hoạt hóa sự chuyến hóa Rilpivirine không gây tốn thương nhiễm
sắc thể trong xét nghiệm vi nhân in vivo trên chuột nhắt
ĐẶC ĐIỂM CÙA THUỐC
Danh sách các tá dược
Viên nhân
Lactose monohydrate
Natri croscarmcllose
Povidone K30
Polysorbatc 20
Cellulosc vi tinh thể silic dioxide hóa
Magne stearatc
Lóg bao
Lactose monohydrate
Hypromcllose 2910 6 mPa.s
Titan dioxide
Polyethylene glycol 3000
Triacetin
Tương kỵ
Không ảp dụng
Hạn dùng
36 tháng kế từ ngảy sản xuất.
Không dùng thuốc đã quá hạn sử dụng ghi trên nhăn.
Lưu ý đặc biệt khi bảo quản
Không bảo quản ở nhiệt độ trên 30°C
Bảo quản trong chai thuôc gôc của nhả sản xuất đê tránh ánh sáng.
Tính chất và thảnh phần bao bì
19/20
`”u.
Chai polyethylcnc tỷ trọng cao (HDPE) dung tích 75 ml, khớp với nắp poiypropylene (PP) để
trẻ cm không mở được vả mảng cản nhiệt. Vỏ hộp bên ngoảỉ chứa một lọ thuôc có 30 viên
nén.
Lưu ý đặc biệt khi sử dụngltiêu hủy
Không có yêu cầu đặc biệt.
Để xa tầm tay của trẻ em.
Thuốc bán theo đơn
Đọc kĩ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hỏi ý kiến bác sỹ.
Sản xuấtvả xuất xưởng tại: JANSSEN-CILAG S.p.A
Via C. Janssen, Borgo S. Michele, 04010 Latina, Ý
%
PHÓ cục TRUỞNG
ƠVMỔ~ÚĨỔPJỬỂW
20/20 _1
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng