






ĩ›ip uoH
E)EldOXOCI
Rx Thuốc kè dơn!
DOXOPEG
\ Doxorubicin i
& Hydrochloride 20 mg/1O mL
Hỗn dich tiêm truyền tĩnh mẹch
dạng Llposome
THẦNH PHAN
Mối mL hõn dich tiêm Doưopeg chứa.
Hoạt chất: Doxorubicin Hydrochloride 2mg
Tá dược: vừa đủ
sau xuẤt w:
FARMACEUTICA PARAGUAYA S.A.
Waldim Ramon Lovua EIDeI Cannen
Y Don Bosco Femando De La More - Paraguay
Prescription Drugl
DOXOPEG
Doxorubicin
Hydrochloride 20 mg/1O mL
Liposomal Suspension for LV Infusion
COMPOSITIONS
Eadt mL suspenson for Inledion Doxopeg contains:
Actăvos: Doxorubicin Hydrochloride 2mg
ln-activn: q.s
Manuhclund by:
IARMACEUTICA PARAGUAYA &A.
\Matdino Ramon Lovura E/Del Carmen Y Don Bosco
Femando De La Mua ~ Paraguay
Rl Prcneupuon Dmm
KEEP OUT CF YHE REACH ư CHiLDREN'
St… un a nngemoưM'C; Do not nnu DOXOPEG
W | am;
5 "" “ ' ! ooxoauncm 1
ưwtnduud by: lnyROCI-ILORIDE
FARMACEUNCA PIRAGUAYẦ S A ²0 W30 IIIL
: WIdlm Ru… Lm EIDnt Cmmnn
1 y Don Buon pemm De u Mon . pimu“ Llp…l Sulmlbfl … I,V mm…
tai No Em mL mm b mmum
nu Duc Mũìl
Ew D… Dexononm hn…ondn zmg }
BỘYTỂ
UC UÁ '
ỦƯỢC
Ă PHÊ DUYỆT
liẩn dẩn:.dẵJ.Dd…J…ẵâflắ
|.V Infusnon
DOXOPEG
\-
A
...
.-
A
C
Ư.
E
…
w
A
ƯI
1
.-
..
"
v
Ư)
r\
\:
Q
—3
Thudẽ kê đon!
Đọc kỹ huớng dẫn sử dụng mm’c khi đùng.
Nếu cẩn thém thông tin xin hỏiý kỉéĩi bãc sỹ.
DOXOPEG
MÔ TẢ
Doxopeg lã hỗn dịch vô trùng, trong mờ vã mău đó dùng để tiêm truyền tĩnh mạch.
Mỗi ml Doxopeg chứa 2mg doxorubicin hydrochloridc dạng pegylated liposome. Doxopeg dạng liposome lã
doxorubicin hydrochloride được bao bởi cãc tiểu phân liposomes với lớp methoxypolyethylene glycol
(MPEG) ở bề mặt ngoăi. Quá trình năy được biểt đến như PEG- hóa vả bảo vệ các tiểu phân liposome khỏi sự
phát hiện của hệ bạch cầu đơn nhân (MP3), dẫn đến tảng thời gian tốn tại trong máulhệ tuân hoãn
THÀNH PHẨN
Mỗi lọ hỗn dịch Doxopeg chũa:
Hoạt clzảĨ: 20.0mg Doxorubicin hydrochloride (dạng liposome)
Tế dưọc: 31.9mg N—(carbonyl-methoxypolyethyiene glycol 2000)-1,2-distearoyl—sn—glycero3—
phosphoethanolamine sodium salt; 95.8mg hydrogenated soy phosphatidylcholine; 31.9 mg Cholesterolg 20.0
mg Ammonium suifate; 1000.0 mg Sucrose; 15.5mg Histidine; Hydrocloric acid vã Sodium hydroxide (để
điều chinh pH) vừa đủ; Nước cất 10.0 mL
DUỌC LỰC HỌC
Nhóm dưọclý điểu ừ_i: Tác nhân gây độc tế bảo (nhóm anthracycline và các chất liên quan).
Hoạt chất của Doxopeg lả doxorubicin hydrochloride, một kháng sinh nhóm anthracycline gây độc tế bảo thu
được từ Streptomyces pcucelius var. caesius. Cơ chế chính xác của hoạt tính kháng ung thư của doxorubicin
lả chưa rõ. Sự ức chế tổng hợp DNA, RNA vả protein được cho lả nguyên nhân chính gây độc tố băo. Đây có
thể lả kểt quả của sự xen anthracycline vảo giữa các cặp bazơ kế cặn trong chuỗi xoắn kép DNA từ đó ngản
cản sự tháo xoắn để sao chép.
Nghiên cứu ngẫu nhiên pha III Doxorubicin HCl liposome vs doxorubicin đã hoản thănh trên 509 bệnh nhân
ung thư vú di cản. Mục tiêu cụ thể hóa để chứng minh sự khỏng kém hơn giữa Doxorubicin HCl liposome vã
doxorubicin đã dược đáp ứng, tỉ số nguy cơ (HR) sống không mang bệnh (PFS) lả 1.00 Phân tích cơ bản dộc
tính trẻn tim chi ra nguy cơ phát triển tai biến tim mạch khi hoạt dộng của liêu anthracycline tích lũy thấp
hơn đáng kể với Doxorubicin HCl liposome so với doxorubicin (HR=3.16, p<0.001). Ở liều tích lũy > 450 \
mng không có tai biển tim mạch với Doxorubicin HCl liposome. '
DUỌC ĐỘNG HỌC 4/
Doxopeg lả Doxorubicin hydrochloride dạng liposome gắn pegylate tổn tại kéo dăi trong máu. Các liposome
gắn pegylate chứa các cao phân tử có đặc tính thân nước ở bề mặt methoxypolyethylene giycol (MPEG). Các
đoạn MPEG nảy trải rộng trên bề mặt liposome tạo ra một lớp mãng bảo vệ ]ảm giảm tương tãc giữa lớp _
măng kép lipid và các thănh phân trong huyết tương. Điểu năy cho phép cãc tiểu phân liposome của _:
Doxorubicin HCl liposome tổn tại kéo dăi trong máu. Các tiểu phân pegylated liposome đủ nhỏ (đường kính
trung binh xấp xỉ lOOnm) để khuếch tán nguyên vẹn qua mạch máu đi văo các khối u.
Ó liều tương đương, nổng độ huyết tương vả giá trị AUC của Doxorubicin HCl liposome tôn tại ở dạng
doxorubicin hydrochloride liposomal pegylate (chứa 90 % đển 95 % doxorubicin do được) cao hơn đáng kể
so với những gì dạt được với chế phẩm doxorubicin hydrochloride chuẩn.
Không được sử dụng thay thế doxorubicin hydrochloride dạng khác cho Doxorubicin HCl liposome
Dươc đỏng hoc Uẻn đa sổbẻnh nhản
Dược động học của Doxorubicin HCl liposome được đánh giá trẻn 120 bệnh nhân từ 10 nghiên cứu lâm săng
khác nhau. Dược động học của Doxorubicin HCl liposome trong khoảng liễu 10 mg]…2 — 60 mg/m2 được mô
tả rõ răng nhất bởi kiểu không tuyến tính 2 ngăn với đầu văo bằng 0 và thải trừ theo công thức Michaelis—
Menten. Thanh thải trung bình bên trong của Doxorubicin HC] liposome là 0.030 l/giờ/mz (trong khoảng
0.008 - 0.152 l/giờ/mz) và thể tích phân bổ lã 1.93 l/m2 (trong khoảng 0.96 — 3.85 l/mz) xấp xỉ thể tích huyết
tương. Thời gian bán hủy thay đổi trong khoảng 24 - 231 giờ, trung bình là 73.9 giờ.
Trẻn nhũng bẻnh nhân ung thư vú
Dược động học của Doxorubicin HC] liposome được xác định trẻn 18 bệnh nhân ung thư vú tương tự với dược
động hỌC được xác định trèn nhóm hơn 120 bệnh nhân ung thư các loại. Thanh thải bẻn tron
l/giờ/mz (trong khoảng 0.008 - 0.027 l/giờ/m2), thể tích phân bổ trung tâm lã 1.46 l/m2 (trong
dJ—a ›
, J……Ặ`Ỹ…
.TỮ`~\CẦF
1.64 llm²). Thời gian bán hủy trung bình là 71.5 giờ (trong khoảng 45.2 - 98.5 giờ). __ CÔNG TY \”ằ
' kỂ(mÁCH NHIỆM miụ HAN Ế )
cm ĐỊNH *` DUỌC mixm *
DOXOPEG (Doxorubicin HC] liposome injection) được chỉ định: ỆỘ\\VIỆT- PHÁP "gì
— Điểu trị đon trị liệu cho những bệnh nhân ung thư vú di căn trong trường hợp có nguy cơ trên ti Ả &?
blẬ'y _ 1 /
- Diêu trị ung thư biểu mô buổng trứng tiến triển ở phụ nữ bị mã thất bại với phâc đổ hóa trị liệu đẩu tay với
platinum.
- Kết hợp với bortezomib trong điều trị đa u tủy tiển triến ở những bệnh nhân đã từng điểu trị ít nhất một 1iệu
pháp trước đó và những người đã trải qua hoặc khòng thích hợp với cấy ghép tủy xương.
- Điểu trị bệnh sarcom Kaposi liên quan AIDS (KS) ở những bệnh nhân có số bạch cẩu CD4 thấp (< 200 CD4
lymphocytes/mmỗ vả bẹnh niêm mạc da hoặc bệnh nội tạng nghiêm trọng.
Doxopeg có thể được sử dụng như hóa trị liệu toần thân đâu tay h0ặc liệu pháp thứ nhì cho những bệnh nhân
AIDS-KS mã tình trạng bệnh đã tiến triễn hoặc bệnh nhân không dung nạp với hóa trị liệu hệ thống kết hợp
trước đó bao gồm ít nhất hai trong số những thuốc sau: vinca alkaioid, bleomycin vả doxorubicin chuẩn (hoặc
chế phẩm anthracyclỉne khác).
LIÊU LUỌNG vÀ CÁCH DÙNG
Doxopeg phải được điều trị dưới sự theo dõi của bác sỹ chuyên khoa ung thư chuyên về các tác nhân gây độc
tế bảo.
Doxopeg thể hiện các tính chất dược động học khác biệt vã không được sử dụng thay thế bởi các dạng khác
của doxorubicin hydrochloride.
Điểu tri ung thư vú/ biếu mỏ buốnz trímg:
Doxopeg được dùng để tiêm truyền tĩnh mạch với liều 50 mg/m2 mỗi 4 tuấn cho đến khi tình trạng bẹnh
không tiến triển và bệnh nhân tiếp tục đáp ứng điểu trị.
Điếu trí đa u tủy xương. Doxopeg liều 30 mg/m² văo ngảy thứ 4 của phác đồ 3 tuần điểu trị của bortezomib,
thời gian tiêm truyền lả ] giờ ngay lập tức sau khi tiêm truyền bonezomib. Phác đổ điểu trị bortezomib bao
gổm Iiểu 1.3 mg/m² văo các ngăy thứ 1, 4, 8, và 11 của mổi 3 tuấn. Liều được nhắc lại nểu bệnh nhân đáp
ứng tốt và dung nạp điểu trị. Liều của cả 2 thuốc ở ngăy thứ 4 có thể hoãn lại cho tới 48 giờ nếu cẩn. Các liêu
bortezomib phải cãch nhau ít nhât 72 giờ.
Dối với liều < 90 mg: pha loãng Doxopeg trong 250 ml dung dịch tiêm truyền glucose 5 % (50 mglml) để
tiêm truyền.
Đối với liếư ì90 mg: pha loãng Doxopeg trong 500 ml dung dịch tiêm truyền glucose 5 % (SO mglml) để ,
tiêm truyền.
Để giảm thiểu nguy cơ của các phản ứng tiêm truyền, iiểu khởi đẩu được truyền với tốc độ không quá ]
mg/phút. Nếu không phát hiện thẩy phản ứng tiêm truyền năo, những lẩn tiêm truyền Doxopeg tiểp theo có
thể tiến hănh trong khoảng 60 phút.
Ở những bệnh nhân có phản ứng tiêm truyền, cân phải điểu chinh phương pháp tiêm truyền như sau:
5 % tổng liêu được truyền chậm trong 15 phút đẩu. Nếu được dung nạp mã không có phản ứng nâo, tốc độ
tiêm truyền có thể tãng ien gấp đôi trong 15 phút tiếp theo. Nếu được dung nạp, tiêm truyền có thể được kết
thúc văo giờ tiếp theo với thời gian truyền tổng cộng là 90 phút.
Điểu tri KS Iiẻn guan AIDS?
Doxopeg được tiêm truyền tĩnh mạch với liều 20 mg/m² mổi 2 đến 3 tuân. Tránh cách quãng liêu dưới 10
ngây vì không thể loại trừ tích lũy thuốc và độc tinh tãng iẻn. Khuyên cáo điểu trị trong 2-3 tháng cho bệnh
nhân để đạt được đáp ứng điểu trị. Cẩn tiếp tục điểu trị để duy trì đáp ứng trị liệu.
Doxopeg được pha với 250 m| dung dịch tiêm truyền glucose 5 % (SO mg/ml) đễ tiêm truyền tĩnh mạch trong
hơn 30 phút. Í
Đôĩ vói tâĨ cã bẻnh nhán:
Nếu bệnh nhân có các triệu chứng hoặc dấu hiệu ban đẩu của phản ứng tiêm truyền, ngay lập tức phải ngùng
tiêm truyền, dùng thuốc chuẩn bị thích hợp như (antihistamine vă/hoặc corticosteroid tác dụng ngắn) vả bắt
đẩu lại với tốc độ chậm hơn.
Không được truyền nhanh Doxopeg hoặc dạng chưa pha. Khuyên cáo dây truyền Doxopeg được nối với
đường tiêm truyền tĩnh mạch glucose 5% để được dung dịch pha loãng hơn vã giảm thiểu nguy cơ huyết khối
và thoát mạch. Tiêm truyền có thể được tiển hănh thông qua tĩnh mạch ngoại vi. Không sử dụng bộ lọc bên
trong đường truyền. Không được tiêm truyền Doxopeg đường tiêm bắp h0ặc dưới da.
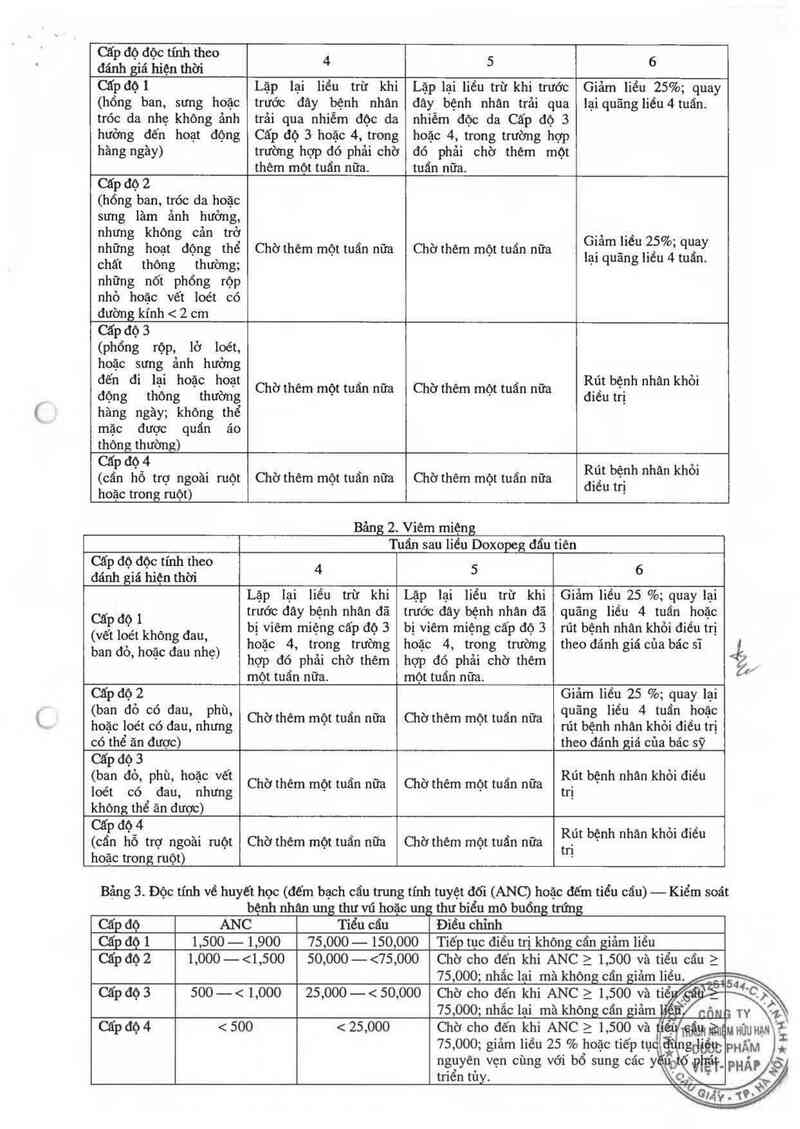
Để kiểm soát các tác dụng phụ như hội chứng tay-chân (palmar-piantar erythrodysesthesia (PPE)), viêm
miệng hoặc độc tính về huyết học, có thể giảm hoặc trì hoãn liểu. Hướng dãn điều chinh liều Doxopeg sau
những tác dụng phụ năy được trình băy trong những bảng dưới đây. Độc tính được phân loại trong các bảng
năy dựa trên Các tiêu chuẩn Dộc tính chung của Viện nghiên cứu Ung thư Quốc gia (NCI-CFC).
Bảng cho Hội chứng PPE (Bảng 1) và viêm miệng (Bảng 2) cung cẩp phác đồ đìểu chinh liều trong các
nghìẽn cứu lâm săng về điểu trị ung thư vú hoặc ung thư biểu mô buổng trứng (điểu chinh liêu của chu kỳ
điêu trị 4 tuấn được khuyên cáo): nểu những độc tính năy xảy ra ở những bẹnh nhân KS liên quan AIDS, chu
kỳ điểu trị 2—3 tuần theo khuyên cáo có thể được điểu chinh tương tự.
Bảng chỉnh iiều cho độc tính về huyết học (Bảng 3) biểu diễn phác đồ điều chỉnh liều trong cãc n
lâm săng điều trị chỉ cho những bệnh nhân ung thư vú hoặc biểu mô buổng trứng. Q )
QỂ" cÔNG TY "Pj._
²°' ỈmÁCH NHtỆM WLỂ “… “zị
., euefPttÀM I
ĩxẹ\xiv.ịÊT pJHẢP_,Ệ
QỸỀ QR
HUớNG DẮN CHỈNH LIÊU DOXOPEG
Bâng 1. HỘ_I CHÚNG TAY-CHÂN (PPE)
] Tuân sau liều Doxopeg đẩu tỉén
Ế=`JẢỸ - 1°'
Cấp độ độc tính theo
đánh giá hiẹn thời
4
5
6
Cấp độ 1
(hổng ban, sưng hoặc
tróc da nhẹ không ảnh
hưởng đểu hoạt động
hăng ngăy)
Lặp lại liếư trừ khi
trước đây bệnh nhân
trải qua nhiễm độc da
Cấp độ 3 hoặc 4, trong
trường hợp đó phải chờ
thèm một tuân nữa.
tuần nữa.
Lặp 1ại liều trừ khi trước
đây bệnh nhân trải qua
nhiễm độc da Cẩp độ 3
hoặc 4, trong trường hợp
đó phải chờ thêm một
Giảm liều 25%; quay
lại quãng liêu 4 tuấn.
Cấp độ2
(hổng ban, tróc da hoặc
sưng lăm ảnh hưởng,
nhưng không cản trở
những hoạt dộng thể
chẩt thòng thường;
những nốt phổng rộp
nhỏ hoặc vết loét có
đường kinh<2cm
Chờ thêm một tuấn nữa
Chờ thêm một tuần nữa
Giảm iiêu 25%; quay
lại quãng liẻu 4 tuân.
Cấp độ3
(phổng rộp, 1ở Ioét,
hoặc sưng ảnh hưởng
hoặc trong một)
đến đi lại hoặc hoạt , - , - Rút bệnh nhân khỏi
động thỏng thường Chờ thêm một tuân nưa Chờ them một tuân nưa điêu trị
hăng ngãy; khỏng thể
mặc được quẩn áo
thông thường)
Cấp độ4 . .
(cấn hỗ trợ ngoải ruột Chờ thèm một tuần nữa Chờ thêm một tuân nữa đRiễiibtỀinh nhân khỏl
Bảng 2. Viêm miệng
Tuân sau liều Doxopeg đâu tiên
Cấp độ độc tính theo
đánh giá hiện thời
4
5
6
Cấp độ 1
(vết loét không đau,
ban đỏ, h0ặc đau nhẹ)
Lặp lại liều trừ khi
trưởc đây bệnh nhân đã
bị viêm miệng cấp độ 3
hOặc 4, trong trường
hợp đó phải chờ thêm
một tuân nữa.
Lặp lại liều trừ khi
trước dây bệnh nhân dã
bị viêm miệng cấp độ 3
hoặc 4, trong trường
hợp đó phải chờ thêm
môt tuân nữa.
Giảm liêu 25 %; quay 1ại
quãng liêu 4 tuân hoặc
rút bệnh nhân khỏi điều trị
theo đánh giá cùa bác sĩ
Cấp độ 2
(ban đỏ có đau, phù,
hoặc loét có đau, nhưng
Chờ thèm một tuần nữa
Chờ thêm một tuân nữa
Giảm liều 25 %; quay lại
quãng liều 4 tuần hozặc
rút bệnh nhân khỏi điều trị
1’
có thể ăn được) theo đánh gỉã của bác sỹ
Cấp độ 3
(ben đợ, phu, hoặc vêt Chờ thêm một tuân nữa Chờ thém một tuân nữa R11 t bẸnh nhân kho: đ1eu
loet co đau, nhưng ' trị
không thể ãn được)
Cấp độ 4 ; 1 * ~ &
(cẩn hỗ trợ ngoăì ruột Chờ thèm một tuần nữa Chờ thêm một tuân nữa ảm bệnh nhân kho: đ1eu
hoặc trong một)
Bảng 3. Độc tính về huyết học (đếm bạch cầu trung tính tuyệt đối (ANC) hoặc đếm tiểu cẩu) — Kiểm soát
bệnh nhân ung thư vú hoặc un thư bỉểư mộ buồng trúng
Cấp độ AN C Tiêu cãu Điều chỉnh
Cấp độ 1 1,500 — 1,900 75,000 — 150,000 Tiểp tuc điểu tri không cẩn giảm liều
Cấp độ 2 1,000—<1,500 50,000 — <75,000 Chờ cho đến khi ANC ì 1,500 vả tiểu Cẩu 2
75,000; nhắc lại mà không cẩn giảm liều. /
Cấp độ 3 500— < 1,000 25,000 —< 50,000 Chờ cho đểu khi ANC 2. 1,500 Vả tỉể _ -
75,000; nhắc lai mã không cẩn giảm '
Cấp độ 4 < 500 < 25,000 Chờ cho dển khi ANC 2 1,500 và F
75,000; giảm liều 25 % hoặc tiếp tụ'
nguyên vẹn cùng với bổ sung các y
triển tủy.
Đối với những bệnh nhân đa 11 tủy được điều trị với Doxopeg kết hợp với bonezomib, những người mã trải
qua hội chứng PPE hOặc viêm miệng, cẩn điêu chinh liều Doxopeg như được mô tả trong bảng 1 và 2 tương
ứng như trẻn. Bảng 4, phía dưới cung cấp phác đồ chĩnh liều khác trong các nghiên cứu iảm săng điều trị cho
những bệnh nhân đa 11 tủy dùng phối hợp Doxopeg vả bonezomib. Để biết thỏng tin chi tiết về liều vả chĩnh
liều bortemmib, xem Tóm tắt đặc tính thuốc (SPC) bortezomib.
Bâng 4. Điều chinh liều Doxopeg trong điểu trị kết hợp với Bortezomib
ANC < 1,000|mm3
năy nểu trước ngăy thứ 4; nếu
sau ngăy thứ 4 thì giảm 25% liều
tiểp theo.
cho bệnh nhân đa 11 tủy
Tinh trạng bẹnh nhân Doxopeg Bortezomib
Sốt _>_38°C và Không dùng thuốc trong chu kỳ Liễu tiếp theo giảm 25%.
Vảo bất kỳ ngăy dùng thuốc năo
sau ngăy thứ 1 của mỗi chu kỳ:
Đếm tiểu câu < 25,000/mm3
Hemogiobin < 8 g/dl
ANC < 500/mm3
Không dùng thuốc trong chu kỳ
năy nếu trước ngảy thứ 4; nếu
sau ngăy thứ 4 giảm 25% lỉểu kế
tiếp trong chu kỳ tiếp theo nếu
bortezomid được giảm vì độc
tính về huyết hoc.
Không dùng thuốc; nểu 2 hoặc hơn
2 liều khỏng được dùng trong một
chu kỳ, giảm 25% lỉểu trong chu kỳ
tiếp theo.
Độc tính Cấp độ 3 hoặc 4 liên
quan đển thuốc khòng phải về
hu_yểt học
Không dùng thuốc cho đến khi
khỏi phục ở cấp độ <2 vả giảm
25 % cho tẩt cả liêu tiếp theo*.
Không dùng thuốc cho đển khi khôi
phục ở cấp độ <2 vả gìảm 25 % cho
tẩt cả liếư tiếp theo.
Dau dây thân kinh hoặc bệnh
Khỏng chỉnh liều
Xem tóm tắt đặc
tính của
thẩn kinh ngoại biên bortezomib.
*Để biểt thêm thỏng tin chi tiểt về liêu và chinh liều bortezomib, xem Tóm tắt đặc tính sản phẩm (SPC) của
bortezomib.
Bênh nhán suỵ gan. Dược động học của Doxopeg được xác định trên một số lượng nhỏ bệnh nhân với mức
bilirubin toăn phẩn tăng khòng khác so với những bệnh nhân có mức bilirubin toản phẩn binh thường; tuy
nhiên, cho tới khi có nhiều kinh nghiệm hơn, nên giảm liều Doxopeg cho những bệnh nhân suy gan dựa văo
kinh nghiệm từ chương trình thử nghiệm lâm săng trên những bệnh nhân ung thư vú và buồng trứng như sau:
bắt đẩu đỉểu trị, nếu mức bilirubin là 1.2 — 3.0 mg/dl, liêu đẩu tiên giảm 25 %. Nếu mức bilirubin > 3.0 mg/dl,
liễu đẩu tiên giảm 50 %. Nếu bệnh nhân dung nạp liều đẩu tiên mã không kèm tăng bilirubin huyết thanh
hoặc các enzyme trong gan, thì liêu cho chu kỳ 2 có thể tăng lén mức liều tiếp theo, ví dụ, nếu giảm đi 25 %
đối với liễu đẩu tiên, thì tảng lẻn thănh ]iểu đẩy đủ cho chu kỳ 2; nếu giảm đi 50 % đối với liều đẩu tiên, thì
tảng lên 75 % của liều đẩy đủ cho chu kỳ 2. Nếu được dung nạp, có thể tảng lén mức liều đẩy đủ cho các chu
kỳ tiểp theo. Doxopeg có thể được chỉ định cho những bệnh nhân di căn gan kèm mức bilirubin và các
enzyme trong gan tãng lên gấp 4 lẩn so với mức cao nhất thông thường. Trước khi dùng Doxopeg, cẩn kìểm
tra chức nâng gan sử dụng cãc test lảm săng thông thường như ALT/AST , alkaline phosphatase, vả bilirubin.
Bênh nhán suy thảm Vì doxorubicin được chuyển hóa bởi gan vã băi tỉết qua mật nên khỏng cẩn diều chinh
lỉểu. Dữ liệu dược động học (thanh thải creatinine được test trong khoảng 30 - 156 ml/phút) cho thẩy thanh
thải Doxopeg khòng bị ảnh hưởng bởi chức năng thận. Khòng có dữ 1iệu dược động học trên những bệnh
nhân có thanh thải creatinine < 30mI/phút.
Bénh nhân AIDS—KS bí phẩu thuật cẩt bó la’clr. Vì chưa có kinh nghiệm với Doxopeg ở những bệnh nhân đã
phẫu thuật cắt bỏ lãch, nên điều trị với Doxopeg không được khuyến cáo.
T1e' em: Kinh nghiệm dùng thưốc trên trẻ em còn hạn chế. Doxopeg không được khuyên cáo ở những bệnh
nhân dưới 18 tuổi.
Neưòilón tuổi. Phân tích dựa trên đa số bệnh nhân chỉ ra rằng độ tuổi trong khoảng được thử nghiệm (21 -—
75 tuổi) không lăm thay đổi đáng kể dược động học của Doxopeg.
CHỐNG CHỈ ĐỊNH
Quá mãn với bất cứ thânh phẩn năo của thuốc.
Doxopeg khỏng được dùng để điểu trị bệnh AIDS-KS khi mã có thể điểu trị hiệu quả với liệu pháp tại chỗ
hoặc dùng alfa—interferon toăn thân.
CẢNH BÁO VÀ THẬN TRỌNG
Đôc ÍIIIÍ7 trẻn tim: Khuyến cáo cẩn kiểm tra thường xuyên ECG của tẩt cả bệnh nhân dùng Dox0peg cẩn
kiểm tra thường xuyên ECG. Thay đổi ECG thoáng qua như dẹt sóng T, hạ đoạn S- T và loạn n/Ị: :'- .
được xem lã dấu hiệu chắc chắn hơn của độc tính trẻn tim. Nếu thay đổi năy xảy ra, xét ng '
nhẩt đối với các tổn thương cơ tim do anthracycline như sinh tiết tim phải dược tiến hânh. F°. _
Các phương pháp cụ thể hơn để đánh giá vã kiểm tra chức nãng tim như được so sánh với .!
tống máu thất trái bằng siêu âm tim hoặc tốt nhất lả bằng cht,Jp X quang mạch (MUGA). 'l_Ẩ
năy phải được tiến hãnh đểu đặn trước khi bắt đẩu điều trị với Doxopeg vã được lặp lại địn -'
trình điều trị. Kiểm tra hoạt động cùa thất trái là bắt buộc trước mỗi lân dùng thêm Doxopeg, mả vượt quá
liếư anthracycline tích lũy suốt đời 450 mglm².
Các test và biện pháp đánh giá được để cập phía trên liên quan đến kiểm tra hoạt động cùa tim trong quá ttinh
điều trị với anthracycline được tiển hănh theo trật tự sau: kiểm tra ECG, đo độ tống xuất của tâm thất trái,
sinh tiết tim. Nếu một kểt quả cho thấy tổn thương tim có thể xảy ra liên quan với thuốc Doxopeg, thi phải
cân nhắc giữa lợi ích của việc tiểp tục dùng thuốc vã nguy cơ tổn thương tim.
Ở những người bị bệnh tim cẩn phải điểu trị, dùng Doxopeg chựn chỉ khi lợi ích vượt xa nguy cơ đối với
bệnh nhân.
Cân thận trọng với những bệnh nhân suy tim mả điểu trị với Doxopeg.
Bất kể khi năo nghi ngờ bệnh cơ tim ví dụ như, độ tống xuất của tâm thất trái giảm dẩn so với giá trị trước khi
điều trị vă/hoặc độ tống xuất cùa tảm thất trái thẩp hơn giá trị tiên iượng (ví dụ < 45 %), cân tiển hầnh đến
sỉnh tiết tim vã phải cân nhắc cẩn thận giữa lợi ích của tiếp tục điểu trị và nguy cơ phát triển tổn thương tỉm
không'Ỉhể phục hổi. Suy tim sung huyết do bệnh cơ tim có thể xảy ra đột ngột, mã không kèm thay đổi EOG
trước đó vã cũng có thể xảy ra trong văi tuân sau khi dừng thuốc.
Phải thận trọng ở những bệnh nhản đã dùng thuốc anthracycline khác. Tổng liều doxorubicin hydrochloride
cũng phải tính đến bất kỳ thuốc nâo dùng trước đây (hoặc dùng đổng thời) với các thuốc gây độc tim như các
anthracyciine/anthraquinone khác hoặc ví dụ như 5-fluorouracil. Độc tính trén tim cũng có thể xảy ra ở liều
anthracycline tích lũy thẩp hơn 450 mg/m2 trén những bệnh nhân xạ tim trước đó hoặc ở những người dùng
đổng thời với thuốc cyclophosphamide.
Các tăi liệu về liều an toăn cho tim được khuyến cáo cho cả ung thư vú và ung thư biểu mô buổng trứng (SO
mg/mz) tương tự với liều 20 mglm2 cho những bệnh nhân AIDS-KS.
Úẻ chếtúỵ: Nhiều bệnh nhân điểu trị với Doxopeg bị ức chế tủy do những yếu tố như khi bệnh HIV tổn tại từ
trước hoặc do các thuốc dùng đổng thời hoặc dùng từ trước, hoặc các khối u liên quan tủy xương. Trong
nghiên cứu chủ chốt trén những bệnh nhân ung thư buổng trứng dùng liều 50 mglm², ức chế tủy nhìn chung lả
nhẹ đến vừa, có thể hổi phục, và khỏng liên quan đến tình trạng nhiễm trùng hoặc nhiễm khuẩn bạch cẩu
trung tính. Hơn nữa, trong nghìên cứu lâm săng được kiểm chứng Doxopeg vs_. topotecan, tỉ lệ nhiễm trùng
liên quan đến điều trị giảm dẩn ở những bệnh nhân ung thư buống trứng dùtĨg—IỐoxopeg so với nhóm dùng
topotecan. Một tỉ lệ thấp tương tự của ức chế tủy được quan sát thấy trẻn những bệnh nhân ung thư vú di cân
dùng Doxopeg trong nghiên cứu lâm sảng đẩu tay. Trái ngược với kinh nghiệm trên những bệnh nhân ung thư
vú hoặc ưng thư buổng trứng, ức chế tủy dường như là tác dụng phụ giới hạn liêu ở những bệnh nhân AIDS-
KS. Vì nguy cơ ức chếtủy xương nên đểm máu định kỳ cẩn phải được tiên hănh thường xuyên trong quá trình
điểu trị với Dox0peg, vả tối thiểu là trước mỗi liều Doxopeg.
Ức chế tùy nghiêm trọng kéo dăi, có thể gảy bội nhiễm hoặc xuất huyết.
Trong các nghiên cứu lâm săng được kiểm chứng trẻn những bệnh nhân AlDS-KS kháng lại phác đồ
bleomycin/vỉncristine, nhiễm trùng cơ hội có vẻ thường xuyên xảy ra hơn trong quá trình điểu trị với
Doxopeg. Bệnh nhân và bác sĩ phải nhận thức được nguy cơ cao năy và có những biện pháp phù hợp.
Cũng như các tác nhân kháng ung thư gây tổn thương DNA khác, ung thư bạch cẩu dạng tủy thứ cấp và loạn //
sản tùy đã được báo cảo trên những bệnh nhân điểu trị kết hợp doxorubicin. Do đó, bất kể bệnh nhân năo điếu
trị với doxorubicin cẩn phải được theo dõi chặt chẽ về huyết học.
Dựa văo sự khác nhau về dữ liệu dược động học vả phác đồ iiểu, không được sử dụng thay thế Doxopeg với
các dạng khác cùa doxorubicin hydrochloride.
Phán ứng ]iẻn quan đêh tiêm truvến: Các phản ứng tiêm truyền nghiêm trọng và đôi khi đe dọa tính mạng đặc
trưng bởi các phản ứng giống dị ứng hoặc giống phản ứng phản vệ, với các triệu chứng bao gổm hen. xuất
huyết, ban mề đay, đau ngực, sốt, tăng áp, tim đập nhanh, ngứa, ra nhiều mồ hôi, khó thở, phù mặt, ớn lạnh,
dau lưng, thắt ngực vã họng, vă/hoặc tụt áp có thể xảy ra trong vòng vầi phút khi bắt đẩu tiêm truyền
Doxopeg. Rất hiểm khi, co giật được quan sảt thấy liên quan với phản ứng tiêm truyền. Tạm dừng tiêm truyền
thường giải quyết được những triệu chứng nảy mã không cẩn dùng thêm thuốc năo nữa. Tuy nhiên, dùng
thuốc để điều trị những triệu chứng năy (ví dụ như: antihistamine, corticosteroid, adrenaline, và thuốc chống
co giật), cũng như các thiết bị cấp cứu phải sẩn có để có thể sử dụng ngay. Điểu trị ở hẩu hết các bệnh nhân
có thể bắt đâu dùng lại thuốc sau khi tất cả các triệu chứng được giải quyết, không xuất hiện trở lại. Các phản
ứng tiêm truyền hiếm khi tái đỉễn sau chu kỳ điều trị đẩu tiên. Để giảm thiểu nguy cơ của phản ứng tiêm
truyền, liêu khởi đầu cân được truyền với tốc độ khỏng quá 1 mglphút.
Bên]: nháp tiéiJ đường. Lưu ý rằng mỗi lọ Doxopeg chứa sucrose vả thuốc được trưyển tro
glucose 5 % (SO mglml).
oỔ cõne'1v
°?" micunmỆnnưụmn
2 n
_Duợc PHA’M .
TUỐNG TÁC THUỐC
Khòng có nghiên cứu tương tác thuốc chính thức nảo được tiến hảnh với Doxopeg, mặc dù thử
phôi hợp với các hóa chất truyền thống đã được tiến hănh trên những bệnh nhân ung thư bộ p
Cân thận trọng khi sử dụng đổng thời các thuốc tương tác với doxorubicin hydrochloride chuẩn.
các chế phẩm doxorubicin hydrochloride khác, Doxopeg có thể kích thich độc tính cùa các thuốc chống ung
thư khác. Trong các nghiên cứu lâm săng trén bệnh nhân có khối 0 đặc (bao gổm ung thư vú và buổng trứng),
những người điều trị đổng thời với cyclophosphamide hoặc taxane, không phát hiện thêm độc tính mới năo. Ở
những bẹnh nhân AIDS, bộc phát viêm băng quan xuất huyết do cyclophosphamide và bộc phát độc tinh trên
gan của 6-mercaptopurine đã được báo cáo với doxorubicin hydrochloride chuẩn. Phải thật thận trọng khi
dùng đổng thời với bất cứ tác nhân gây độc tố băo năo khác, đặc biệt các tác nhân lăm hoại từ xương.
Phụ nữ mang thai vã cho con bú
Phụ nữ mang thai: Doxorubicin hydrochloride bị nghi ngờ lã gây ra các khuyết tật bẩm sinh nghiêm trọng khi
người mẹ dùng thuốc trong thai kỳ. Do đó, không nên dùng Doxopeg trong thai kỳ trừ khi thật cẩn thiết.
Phụ nữ có khả nảng có thai phải được khuyên tránh thai trong khi chính họ hoặc chổng của họ dùng Doxopeg
và trong 6 tháng sau khi đừng điều trị với Doxopeg.
Phụ nữ nuôi con bú: Vẫn chưa rõ Doxopeg có được bải tiê't qua sữa mẹ hay không. Bởi vì nhiều thuốc, bao
gổm các anthracycline được băi tiểt qua sữa mẹ và vì nguy cơ của các tác dụng phụ nghiêm trọng trên trẻ sơ
sinh, vì vậy các bả mẹ phải dimg cho con bú trước khi bắt đẩu điểu trị với Doxopeg.
Tác động trẻn khả năng lái xe vă vận hânh máy móc
Doxopeg không có h0ặc ảnh hưởng khỏng đáng kể trên khả nảng lái xe và vận hănh máy móc. Tuy nhiên,
cho đển nay trong các nghiên cứu lâm sảng, chóng mặt và buồn ngủ (< 5 %) ít liên quan tới dùng Doxopeg.
Những bẹnh nhân chịu những tác đụng năy phải tránh lái xe vã điều khiển máy móc.
TẤC DỤNG KHÔNG MONG MUỐN
Tác dụng phụ thường xuyên nhất được báo cáo trong các thử nghiệm lâm săng ung thư vú/ buổng trứng (liều
SOmg/m2 mỗi 4 tuân) là hội chứng tay- -chân (PPE)). Ti lệ chung của PPE được báo cáo lả 44.0 % 46.1 %.
Những tác dụng năy hẩu hết lả nhẹ, với những trường hợp nặng (Cấp độ 111) được báo cáo ở 17 % - 19. 5 %. Tỉ
lệ các trường hợp nguy hiểm tinh mạng (Cấp độ IV) là < 1 %. Ít khi phải dỉmg điều trị vĩnh viễn do hội chứng
PPE (3.7 % - 7.0 %). PPE đặc trưng bởi ban da chấm đô về đau. Những bệnh nhân mắc hội chứng năy,
thường phát hiện thấy sau 2 hoặc 3 chu kỳ điểu trị. Tinh trạng tiến triển thường lả từ 1-2 tuân, vả trong một số
trường hợp có thể mất tới 4 tuân hoặc lâu hơn để dứt điểm hoăn toăn. Pyridoxine ở liều 50 - 150 mg/ngăy vã
cãc thuốc corticosteroid được sử dụng để phòng ngừa và điều trị hội chứng PPE, tuy nhiên, những thuốc năy
khỏng được kiểm tra trong các nghiên cứu pha 111. Các biện pháp khác để phòng ngửa và điều trị PPE có thể
được bắt đâu từ 4 đến 7 ngăy sau khi điểu trị với Doxorubicin HCl liposome bao gổm giữ cho tay chân mát
mẻ bằng cách tiếp xúc với nước mãt như (ngâm nước, tắm hoặc bơi), tránh nước quá nóng và giữ cho tay chân
được thoải mái (không đi tất, găng tay, hoặc giây bó chặt). PPE có vẻ liên quan chủ yếu với phác đồ liều vã
có thể giảm đi bầng cách mở rộng khoảng cách giữa các Iiều tử 1 ~ 2 tuần. Tuy nhiên, phản ứng năy có thể
nặng và khiến cơ thể suy nhược ở một số bệnh nhân và có thể phải dừng điểu trị. Viêm miệng/viêm niêm mạc
vả bổn nôn cũng được báo cão trên những bệnh nhân ung thư vú/buổng trứng, trong khi ở Chương trình
nghiên cứu AIDS-KS (20 mg/m2 mỗi 2 tuân), ức chế tùy xương (hấu hết là giảm bạch câu) là tãc dụng phụ
thường xuyên nhất (xem AIDS-KS). PPE được báo cáo ở 16% bệnh nhân đa u tùy điểu trị với Doxopeg phối
hợp bortezomib. PPE Cấp độ 3 được báo cáo ở 5 % bệnh nhân. Không có báo cảo về PPE cấp độ 4. Các tác
dụng phụ (nổi bật trong điểu trị liên quan đến thuốc) được báo cão thường xuyên nhẩt trong điều trị phối hợp
(Doxorubicin HCl liposome + bortezomib) là buồn nộn (40 %), tiêu chảy (35 %), giảm bạch cẩu (33 %),
giảm tiểu cẩu (29 %), nôn (28 %), mệt mỏi (27 %), và táo bón (22 %).
Chương ninh nghiên cúu ung thư vú. 509 bệnh nhân ung thư vú tiên trìển, trước đây không hóa trị liệu diẩỷ/
căn, được điều trị với Doxopeg (n=254) Iiều 50 mg/m2 mỗi 4 tuần, hoặc doxorubicin (n=255) liều 60 mg/m2
mỗi 3 tuân trong một nghiên cứu lâm sảng pha 111 (197-328). Những tác dụng phụ phổ biến sau đây được báo
cáo thường xuyên hơn với doxorubicin so với Doxopeg: buổn nòn (53 % vs. 37 %; Cấp độ III/IV 5 % vs. 3
%), nôn (31 % vs. 19 %; Cấp độ 111/1V 4 % vs. < 1 %), rụng tóc (66 % vs. 20 %), rụng tóc nhiều (54 % vs.7
%), và giảm bạch cẩu trung tính (10 % vs. 4 %; Cấp độ III/IV 8 % vs. 2 %).
Viém niêm mạc (23 % vs. 13 %; Cấp độ III/IV 4 % vs. 2 %), và viêm miệng (22 % vs. 15 %; Cấp độ IIIIIV 5
% vs. 2 %) được báo cão thường xuyên hơn với Doxopeg so với doxorubicin. Thời gian trung binh của cãc tác
dụng phụ phổ biến (Cấp độ III/IV) cho cả 2 nhóm lả 30 ngăy hoặc ít hơn. Xem bảng 5 để biết danh sách hoản
chinh các tâc dụng không mong muốn được báo cáo trẻn những bệnh nhân điều trị với Doxopeg.
Tỉ lệ cãc tác dụng phụ về huyết học nguy hiểm đến tính mạng (Cấp độ IV) là < 1.0 % và nhiễm trùng được
báo cáo ở 1 % bệnh nhân. Bổ sung cãc yểu tố phát triển hoặc truyền máu là cẩn thiết ở 5.1 % vã 5.5 % bệnh
nhân, tương ứng.
Các bất thường đáng kể trên lâm săng (cấp độ III và IV) trong nhóm năy là thấp, với mức bilirubin, AST ,
ALT toăn phẩn tăng được báo cáo ở 2.4 %, 1.6 % vả < 1 % tương ứng. Không có bão cáo về tăng creatinine
huyết thanh đáng kể trèn lâm săng.
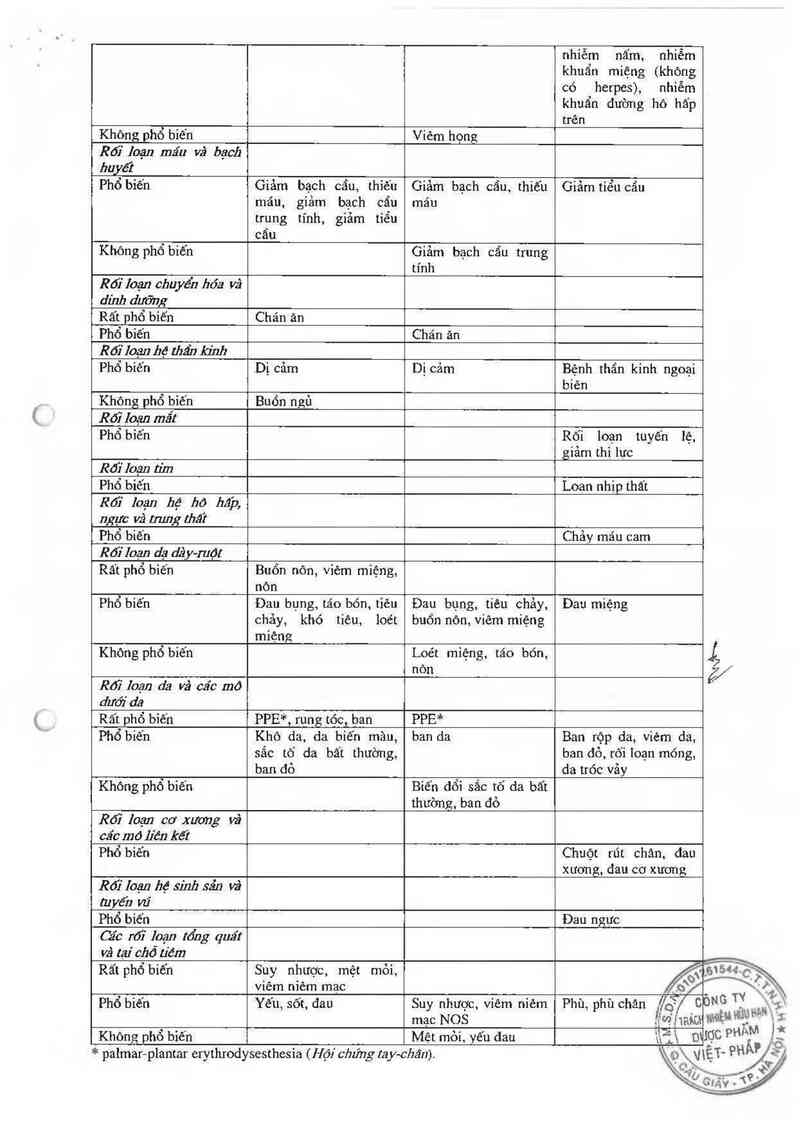
Bảng 5. Các tác dụng kh0ng mong muốn lien quan đến điêu trị được báo cáo trong các thử nghiệm la… săng
Ung thư Vũ (50 mg]…2 mỏi 4 tuân) (Bệnh nhân đùng Doxopeg) theo Mức độ nặng nhẹ, Phân loại các hệ cơ
quan theo MedDRA vã các thuật ngữ: Rất phổ biến (2 1/ 10); phổ biến (2 1/100, < 1/ 10); không phổ biến (Z
1/1,000, < 1/100)
Các tác dụng phụ theo Ung thu vú Ung thưvũ Ung thu vú n=404 `
hệ cơ quan Tất cả các cấp độ Cấp độ III/IV 5%) Không đưỢC/ ,_
n=zs4 (25%) n=zs4 (25%) cão trước trên cá,éQ ưc
nghiêm lâm sănỂm' ~;gig
Nhiễm khuđiz vả ký 1 Ế g _
sinh ừùug Ỉn '
Phổ biến Viêm họng Viêm chân '
"
nhiễm nẩm, nhiễm
khuẩn miệng (không
có herpes), nhiễm
khuẩn đường hô hấp
trên
Không phổ biến Vìêm họng
Rỏĩ Joạn mãn vả bạch
huyéi
Phổ biến Giảm bạch cẩu, thiếu Giảm bạch cắu, thiếu Giảmtiểu cẩu
máu, giảm bạch cẩu máu
trung tính, giảm tiễu
cấu
Không phổ biến Giảm bạch cẩu trung
tính
Rỏĩloạn cbuyến hóa vá
diab duõng
Rất phổ biến Chán ăn
Phổ biến Chản ăn
Rỏĩloạn bệ tbẨn kinh
Phổ biến Dị cảm Dị cảm Bệnh thẩn kinh ngoại
biên
Không phổ biến Buổn ngủ
Rối Ioạn mẩ!
Phổ bìến Rối loạn tuyến lệ,
gìảm thì lưc
Rdĩloạn Lím
Phổ biến Loạn nhịp thất
Rôĩ Ioạn bệ hô hâj›,
ngực về trung Lhế!
Phổ biến
Chảy máu cam
RđĨ Ioạn dạ dèy-một
Rất phổ biến Buổn nõn, viêm mỉệng,
nÔn
Phổ biến Đau bụng, táo bón, tiêu Đau bụng, tiêu chảy, Dau miệng
chảy, khó tiêu, loét buổn nỏn, viêm miệng
miệng
Khỏng phổ biến Loét miệng, táo bón,
nôn
Rới loạn da vả ca'c mô
dưỡÍ da
Rất phổ bỉến PPE*, rung tóc, ban PPE*
Phổ biển Khô da, da biến mầm, ban da Ban rộp da, viêm da,
sắc tố da bất thường, ban đỏ, rối ioạn móng,
ban đó đa tróc vảy
Không phổ biến Biến dối sắc tố da bất
thường, ban đỏ
Rối Ioạn cơ xưong vả
ca'c mô Iíẻn kết
Phổ biến
Chuột rút chân. đau
xương, đau cơ xương
Rôĩ Joạ.n hệ sinh sẩn vả
tuyển ní
Phổ biến
Đau ngực
Cẵc róĩ Ioạn tổng qua'!
Vả tại chỗ u'ém
Rất phố biển Suy nhược, mệt mỏi,
v1em mem mạc
Phổ biến Yếu, sốt, đau Suy nhược, viêm niêm Phù, phù chân //ỆỂ C
mạc N08 f°? tRẢG1
Không phổ biến Mệt mỏi, vếu đau
* palmar-plantar erythrodysesthesỉa ( Hội chúng tay-cbân).
Ức chế tủy hâu hết lã nhẹ hoặc vừa và có thể kiểm soát được. Nhiễm trùng liên quan đến giảm bạch cầu
khỏng thường xuyên được quan sát thấy (<1%). Các yếu tố phát triển không thường xuyên phải bổ sung
(<5%) vả truyền máu xấp xỉ 15% bệnh nhân.
Trong một nhóm nhỏ 410 bệnh nhân ung thư biểu mô buổng trứng, các bất thường đáng kể xảy ra trong các
thử nghiệm iâm săng với Doxorubicin HCl liposome bao gổm tăng bilirubin toản phẩn (thường lã ở những
bệnh nhân di cản gan) (5%) và creatinine huyết thanh (5%). Tăng AST được báo cáo không thường xuyên
(
0.25 mg/kg/ngăy vã suy thoải ống sinh tinh diện rộng vã giảm đáng kế khả năng sinh tinh được quan sát thẩy
trên chó sau liều nhắc lại 1 mglkg/ngảy. “\
Đỏc mm trên thâm Một nghiên cứu đã chỉ ra rằng Doxorubicin HCl liposome ở liều tiêm tĩnh mạch duy nhẩt
gấp hơn 2 1ẩn liều lâm săng gảy ra độc tính trên thận ở khi. if
TUỜNG KY Ế …,
Không có tương kỵ giữa các thănh phân của thuốc. 'ỂJ
Không nẻn trộn lẫn thuốc năy với các thuốc khảc. :
HẠN DÙNG: 18 tháng kể từ ngảy sản xuất. /
ĐÓNG GÓI Hộp 1 lọ thuỷ tinh x iOmL hỗn dịch tiêm Doxopeg
BẨO QUẢN: Bảo quản trong tủ lạnh (2°C- 8°C). Không để đóng băng.
TIÊU CHUẨN: Nhã sản xuất
NHÀ SÀN XUẤT:
FARMACEUTICA PARAGUAYA S.A.
Waidino Ramon Lovera E/Del Cannen Y Don Bosco
Femando de la Mora — Paraguay
%… cuc muòne
WM 'Vđu W
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng