
























… zzợx:
Ĩí'C QLẢN i \ DI OC
ĐÀ PHÊ DL'YỆ’Ỉ
Lân dảu:ẺỊ…ẢĨA ..aZâĩlỄ.
a;sp luide
.… ,……
… Wi²B
iqulõuJoz amaqa
lexeịaooo
11112 00 l²i^ L
\ v…l oi 2mi Encn v›u commns mmg duoetuel u
ncliu ingmd›ent UOmg/mly
Eltipiơfili Foiysmbaie aa. cllhc nc…
Docetaăẵ' |2 [ lnhy'dibul. macmgol 3041 and elth
m m Must bn miutod mu… us
Ebewe °
FoJ si-glu uu only Du:am my
im_ WWW EMỸ'NS
Run psnkngn iniiu boimu uligl
Ku» « 1 of lnnuch nnu mg… oi
1 vui ot ?ml
Docetaxel
Ebewe 20mg/2ml
m… . … ……g … … v…… ›n:…
Concentrate ior solution u…i… zì ' Cencentrate tor soiutinn … 6…
íor intusion. ,… ,,,,,,_ ,_ [m inlusion. Mmhcll pmduct sutioct [c mmcnl
. mm n…… nu … n n ng m prnưript or
For mtvavenous use. A ur.uưJ,e … Ausn For intravenous use. l
n,inirưa_nunn mm. uu n
0
uy… …… ….ah Inng…lhi
Inn. … dn luh' IIIÚI Am… GIIIIIN
nm .
nsx. ND: 1… “Bach … Moml uu 'uszpq em
ưỒnìnb mm»… InMDi «uinnqnuhon
… uu ~…» u… quAnmeũd u….q \anu. (
b c wma… llnv nm u MỀ iu… 64 In um
uu m ưnnnunluỉir i muh …
Amnu Au…ìiA mumAá uhAaupỄhh c……
……
nu…m '… i-c; . ~n›ưc… zu ng
9 88883 509736
1 vlai of 2ml
Docetaxel
Ebewe 20mgl2ml
743140-01
Nhán phụ tiếng Việt
+
EBEW Pharma
Ges mbii. NigKG
A-4866 Unterach / Austria
Sau khi nhập hờng vởi nhản gốc về Việt Nam, nhãn phụ tiếng Việt sẽ được dán ở Việt Nam
để phù hợp với quy chế nhăn trước khi bán ra thị trường
734034~01vek nndd I
Etikette AMP o IDST Q
CARINI-Standard 2007
Artikelnummer: 734034-01 (inkl. Klỉscheevermerk):
Format: 38 x 18 mm
Farben: o schwarz C 0
o Pantone 185 C 0 Pantone 226 C
Eindruckfeld rechts: 6 mm 0 8 mm `ợ
Code: 2182 Seite: rechtstoswá links (AMP) o
Stellung: M4
FGENEHMIGT
`Von Iechnpam , 08:05, 10.12.2009
EBEWE Pharma
Ges m.b.H. Nfg KG
A—4866 Unterach lAustria
1 via! of 2ml
Docetaxel
Ebewe2Omg/2ml_
…
Concentrate fo
solution for infusion.
Intravenous use.
Must be diluted
before use.
vôaor
734o34-o1 w
ep muew
oN uozeg
ezep ẤJỊng
2411 zoos 11:35:01
aưp m.;
ỎWD ;…
un « …u
l…elõwoe emeqa
laxe;eooo
IlUũ [° lBl^ L
I vncl of Oml
Docetaxel
Ebewe BDmg/Bml
Cnncentrate íor solution
Ior Inluslon.
For intravenous use.
80mg—
sa… IIIM4 Ileullưl … … A c
c
un mu. Ju ulIM
cơ r … w … ….
az.dơrcs |nr mu… ::
w………v
EnEWE W…nu ôn ư & u um «:
A mnmia…ụ AJSIRA
008888
\ vui ol &…
Docetaxel
Ebewe 80mg/Bml
l_
Concenlrate Oor solution
fer infusion.
For intravenous use.
80mg
\ wal 01 Brnì
Docetaxel
Ebewe 80mg/Brnl
Fưh …! :ummm utng dctnnnl ::
l:lwe mqledlent (lOmg/m:
Fucomnts FolymrbateMl. mrc lcm.
lnhydmus. mìuogn! 300 lnd m-…:x
Mus! be dtllnỈGd belme us
Fm smq'e use on\y D.:can: uny
unuseđ cnntems
Êeac pncuqe luflel beÍme Luge
Keep o… ot me iuch lnd qum …
I:h ĩdlen
Memcn product 1uu;ecY ln men ca!
pưsctuhon
I_lhníxìlnlfiulln Slkn uu u
Ducuul'lhnn' nep | mu…mummmuuu
uu nợ… Ùulìu mu um dk dính e…q nưman
wm «… nm. … ụh. on a…. ui.. un
an. … th. mun uu. n nt mlng unhu …
du nmq m huang đẦn ús.…g u N u. nu. Mb-
1… um… u…tum. up: uu um boom
ugAy Muhu… nqtyM rt.a thnq : huulnuín mm
Otoẹnnnmmmgm qu! n'f.mnh Anh
\Mq uMqaơemum lu nuyuIm npnf
nu. Iỉn n qu mm: … IQ ng IM un un
ẾIIII UMIm l'noun uu Il. KG IAmunil 1,
’I.A4MWuithum Ixunn_ mua A uh ..z n
lẨẦ HMle Mnuíu KM.
Nhãn phụ tiêhg Việt
EBEWE Pha… `a
Ges m b.H NngG
A-4866 Unterach lAustria
Sau khi nhập hảng với nhăn gốc về Việt Nam, nhăn phụ tiếng Việt sẽ được dản ở Việt Nam
để phù hợp với quy chếnhãn trước khi bán ra thị trường
733021 -01 vek,mdd I
@
IGENEHMIGT
`Von Iechnpam , 08:02, 10.12.2009
1 via! ot 8m1 1 vial contains 80mg ẳ
docetaxel. polysorbate Ế
DOcetaxel 80. cưtic acid anhydrous. g
macrogol 300 and ethanol. m
f!
Ebewe 80mg/8ml Must be dưuled beioơe use
_ _ › __ _ For sungle use only
Keep out ot the reach and
Concentrate for stght of chxldten
SOỈUtỈOÍI fỌr ỈHÍUSỈOI'I. Store a! voorn lemperature not
over 25°C. Do not refrigerate
Intravenous use. … .,eeze
Manufacturev. Keep the vnal tn the ÓBÙW
EBEWE Pharma outer canon in ` ru…
Ges.m.b.N. Nig.KG order to protect
A-4866 Unluach, AUSTRJA hom lỉghl 733021—01
°N U°l²ũ
Mlllllllllll
aưm dea
' vi n“ M
Docetaer
Ehewe RừanGmt "“
I:“. & .— &
CMMMIII lnr
Mlulmn lnt hủlmn
Dnvmnmn …
u—uư
Ềj“
`Ì
EBEWE Pharma
Gesm.b H Nfg.KG
A—4866 Unterach | Austria
Etikette AMP O IDST O
CARINl-Standard 2007
Artikelnummer: 733021 —ffl(inkl.
Format: Ẹ xử…
FarbenzọẸantomẽ_jảậ
Stellung: MA
. Schwarz C
. Pantone 226 C .
Eindruckfeld rechts: ômm 0 8 mm )0
Code: 979 Seite: rechts(DST)b links (AMP) o
Klischeevermerk):
@
2411 2009 14:54:09
ĐỌC kỹ hướng dẫn sử dụng lrưởc khi dùng Nếu cần biết thêm thỏng Iin xin hòi ý kiến
bác sĩ. Thuốc dùng lheo đơn bác sĩ.
DOCETAXEL “EBEWE”
Dạng thuốc : Dung dịch đậm đặc dề pha dung dich tiêm truyền
Hãng sân xuất : Ebewe Pharma Ges.m.b.HNfg.KG
MondseestraBe ] l, A-4866 Unterach am Attersee, Cộng hòa Ảo
Thânh phần : Mỗi lọ đựng dung dịch đậm đặc dể pha thảnh dung dịch tiêm truyền
chứa 20 mg, 80mg Docetaxel. Một ml dung dịch đặm đặc để pha dung
dich tiêm truyền chứa IOmg docetaxel là hoạt chất chính.
Tá dược: Citric Acid Anhydrous, Macrogol 300, Polysorbate 80, Ethyl
alcohol .
!. Tính chẩt dược lụt học 0 [M
L
Nhóm tác dụng đuợc lý: Taxan, mã ATC: LOICD02
Cơ chế tác dụng
Docetaxel là một thuốc chống tân sinh có tảc dụng kích thích sự bó chặt cảc tubulin
thânh cấu trúc vi ống bển vững và ức chế sự phân rã cùa cảc bó tubulin nảy dẫn đến giảm rõ
rệt cảc tubulin tự do. Việc gắn docetaxel vâo cấu trúc vi ống không Iảm thay đối số lượng cùa
cảc phần tử tubulỉn.
Trên in vitro. docetaxel cho thấy tác dụng phá vỡ mạng lưới vi ống cúa tế bảo vốn là
cẩu trúc cần thiểt cho chức nảng tế bảo sống trong kỷ nguyên phân vả kỳ trung gian.
Tác dụng dược lý
In vilro. docetaxel cho thấy tảc dụng gây độc tế bảo chổng lại một số dòng tế bảo khối u
người và chuột, chổng lại cảc tế bảo khối u người vừa bị cắt bỏ trong các nghỉên cứu trên tế bảo
vô tính. Docetaxel đạt nồng độ cao trong tế bảo với thời gian lưu lại trong tế bảo lâu. Hơn nữa,
docetaxel được chi ra lá oó hoạt tính trên một số - nhưng không phải là tắt cá - dòng tế bảo có
biếu hiện quá mức p-glycoprotein lả protein được mã hóa bới gen khảng đa thuốc. In vivo,
docetaxel hoạt động độc lập và cỏ phố rộng về hoạt tinh chống ung thư trên thực nghiệm chống
lại khối u ghép tiến ttiền ở người và chuột.
Dữ liệu lâm sâng
Unz thư vú
DOCETAXEL phối họp vởi doxorubicin vò cyclophosphamid: liệu phảp bó trợ
Các dữ liệu từ một thử nghiệm ngẫu nhiên mờ nhãn đa trung tâm hỗ trợ cho việc sử
dụng docetaxel trong điều trị bổ trợ cho bệnh nhân ưng thư vú, hạch dương tính, giai đoạn có
thề phẫu thuật được vả KPS ? 80%, ở độ tuối từ l8 đến 10. Sau khi phân tầng theo số luợng
hạch bạch huyết dương tính (1-3, 4+), 1491 bệnh nhân đuợc lụa chọn ngẫu nhiên đề điểu trị
1
L)
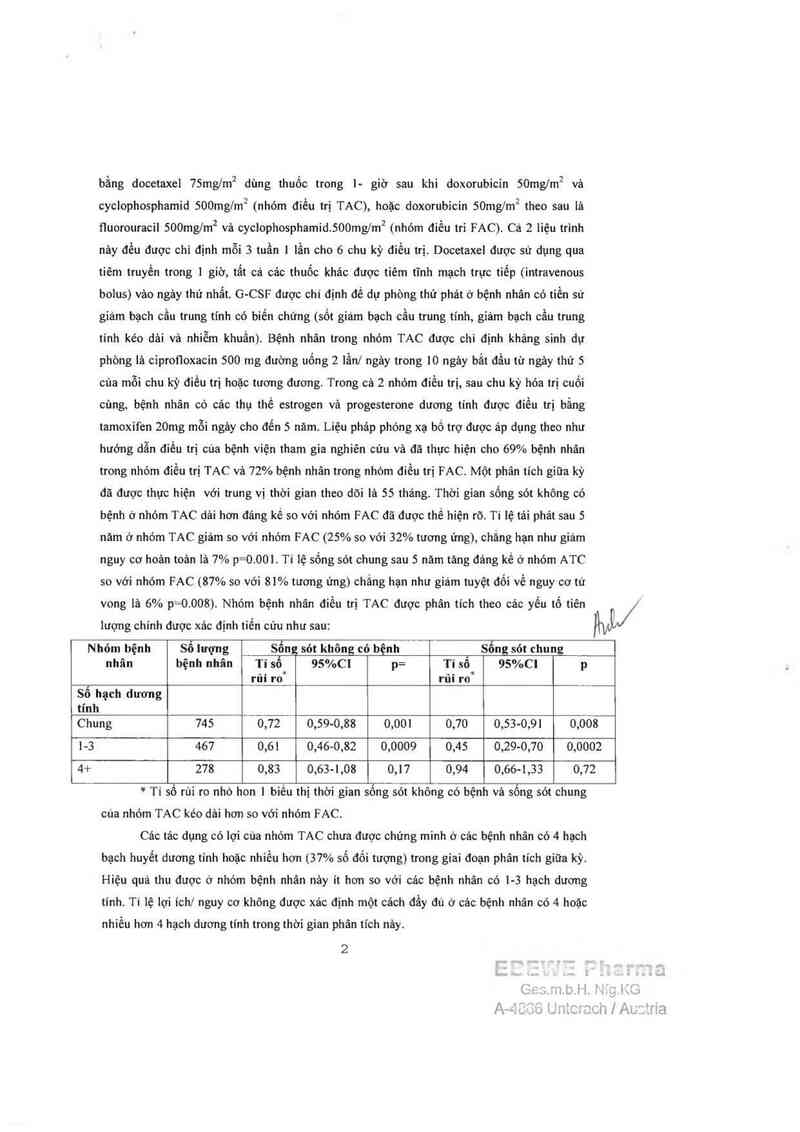
bằng docetaxel 75mg/m2 dùng thuốc trong l— giờ sau khi doxorubicin 50mg/m2 vả
cyclophosphamid 500mglm² (nhỏm điều trị TAC), hoặc doxorubicin 50mng theo sau là
fluorouracil SOOngm² vả cyclophosphamid.SOOmg/m² (nhóm diều tri FAC). ca 2 liệu trình
nảy đều được chỉ định mỗi 3 tuần | lần cho 6 chu kỳ điểu trị. Docetaxel được sử dụng qua
tiêm truyền ttong ] giờ, tất cả các thuốc khảo được tiêm tĩnh mạch trực tiếp (intravenous
bolus) vâo ngảy thứ nhẩt. G—CSF được chỉ định để dự phòng thử phảt ở bệnh nhân có tiền sử
giảm bạch cầu trung tính có biến chứng (sốt giám bạch cầu trung tinh, giảm bạch cầu trung
tính kéo dải và nhiễm khuẩn). Bệnh nhân trong nhóm TAC được chỉ định khảng sinh dự
phòng lá ciprofioxacìn 500 mg đường uống 2 lẫn] ngảy ttong 10 ngảy bắt đầu từ ngảy thứ 5
của mỗi chu kỳ điều trị hoặc tuơng đưong. Trong cả 2 nhóm điểu trị, sau chu kỳ hóa trị cuối
cùng, bệnh nhân có các thụ thể estrogen vả ptogesterone dương tinh được điều trị bằng
tamoxìfen 20mg mỗi ngảy cho đển 5 năm. Liệu pháp phóng xạ bổ trợ được áp dụng theo như
hướng dẫn điều trị của bệnh viện tham gia nghìên củu và đã thực hiện cho 69% bệnh nhân
trong nhóm điều trị TAC và 72% bệnh nhân trong nhóm diều trị FAC. Một phân tỉch giũa kỳ
đã đuợc thực hiện với trung vị thời gian theo dõi là 55 thảng. Thời gian sống sót không có
bệnh ở nhóm TAC dái hơn đáng kể so với nhóm FAC đã được thế hiện rõ. Tỉ lệ tải phảt sau 5
năm ở nhóm TAC giảm so với nhỏm FAC (25% so với 32% tương ứng), chắng hạn như giảm
nguy cơ hoản toản là 7% p=0.00L Tỉ lệ sổng sót chung sau 5 năm tảng đáng kể ở nhóm ATC
so với nhóm FAC (87% so với 81% tương ứng) chắng hạn như giám tuyệt đối về nguy cơ tử
vong [ả 6% p=0.008). Nhóm bệnh nhân điểu trị TAC được phân tích theo cảc yếu tổ tiên
iượng chinh được xác định tiến cứu như sau:
W
Nhỏm bệnh sả lượng sám. sót không có bệnh . Sổng sót chung
nhân bệnh nhân Tỉ số 95%C! p= Tỉ sô 95%Cl p
rủi ro“ rủi ro'
Sô hạch duơng
tính
Chung 745 0,72 0,59-0,88 0,00! 0,70 0,53-0,91 0,008
1-3 467 0,6! 0,46-0,82 0,0009 0,45 0,29-0,70 0,0002
4+ 278 0,83 0,63-1,08 0,17 0,94 0,66-1,33 0,72
* Tỉ số rùi ro nhỏ hon | biều thị thời gian sống sót không có bệnh và sống sót chung
cùa nhóm TAC kéo dải hơn so vởi nhóm FAC.
Các tảc dụng có lợi cùa nhòm TAC chua đuợc chứng minh ở các bệnh nhân có 4 hạch
bạch huyết duơng tính hoảc nhiều hơn (37% số đối tượng) trong giai đoạn phân tích giữa kỳ.
Hiệu quả thu được ở nhỏm bệnh nhân nảy ít hơn so với các bệnh nhân có l-3 hạch dương
tính. Ti lệ lợi ich/ nguy cơ không được xác định một cách đầy đủ ở cảc bệnh nhân có 4 hoặc
nhiều hơn 4 hạch dương tinh trong thời gian phản tích nảy.
2
DOCETAXEL đơn tri liệu
Hai nghiên cứu so sảnh pha … ngẫu nhiên, bao gổm tổng số 326 bệnh nhân ung thư
vú di căn điều trị thất bại với các tác nhân aikyl và 392 bệnh nhãn thất bại với anthracyciin,
tiến hảnh với docetaxel mức liều khuyến nghị và chế độ liều lả iooinglm² mỗi 3 tuần 1 lần.
Đối với bệnh nhân thất bại với tác nhân aikyl, docetaxel được so sánh với doxorubicin
(75mglm2 mỗi 3 tuần ] lần). Không ánh hướng đến thời gian sống sót chưng (docetaxel 15
tháng so với doxorubicm 14 thảng, p=0,38) hoặc thời gian để bệnh tiển triến (docetaxel 27
tuần so với doxorubicin 23 tuần p=0,54), docetaxel lảm tăng ti lệ đảp ứng (52% so với 37%,
p=o,on vả rủt ngắn thời gian để có đáp ứng <12 tuần so với 23 tuần, p=0,007). 3 bệnh nhân
điểu trị docetaxel (2%) bị ngừng điều trị do ứ dịch, trong khi 15 bệnh nhân điếu trị
doxorubicin (9%) ngừng điều trị do độc tính trên tim (trong đó 3 trường hợp bị suy tim xung
huyết dẫn đến tử vong).
Đối với các bệnh nhân thất bại điểu trị với anthracyclin, docetaxel được so sánh với
mitomycin c phối hợp với vinblastin (l2mg/mz mỗi 6 tuần ! lần và ớmgm² mỗi 3 tuần 1 lần).
Docetaxel Iảm tãng ti lệ đáp ửng (33% so với 12%, p<0,000I), kéo dâi thời gian để bệnh tiển
ttiền <19 tuần so với I I tuần, p=0,004) vả kéo dải thời gian sổng sót chung (! ] thảng so với 9 , J
tháng, p=0,0I). AML/
Trong suốt 2 nghiên cứu pha III nảy, hồ sơ an toản cùa docetaxel phù hợp với hồ sơ an
toân quan sảt được trong nghiên cứu pha li (xem mục ““Tác dụng không mong muốn”).
Một nghiên cứu pha Il! ngẫu nhiên, đa trung tâm, mớ nhãn đã được tiến hảnh để so
sánh docetaxel đon trị liệu vả paclitaxel trong điểu trị ung thư vú tiến triền trên bệnh nhân đã
được điều trị từ trước với anthracyclin. Tống số 449 bệnh nhân được chọn ngẫu nhiên để điều
trị hoặc docetaxel đơn ttị liệu lOOmg/m2 tiêm truyền trong ] giờ hoặc pachtaxel I7Smg/m2
tiêm truyền trong 3 giờ. Ca' 2 chế độ nảy đuợc thực hiện mỗi 3 tuần ] lần.
Không ánh hướng đến tiêu chí nghiên cứu chính, tỉ lệ đáp ứng chung (32% so với
25%,p=0,l0), docetaxel kéo dải khoáng thời gian trung bỉnh để bệnh tiến triến (24,6 tuần so
với l5,6 tuần; p<0,01) và thời gian sống sót trung bình ( I5,3 tháng so với l2,7 tháng; p=0,03).
Các biến có bắt lợi mức độ 314 được nhận thẳy ớ nhóm đơn trị liệu docetaxel (55,4%)
so với nhóm paclitaxel (23%).
DOCETAXEL lrong phối hợp vởi doxorubicin
Một nghiên cứu pha … ngẫu nhiên qui mô lớn bao gổm 429 bệnh nhân bị ung thư dí
căn mà chưa được điều trị trước đó, đã được tiển hảnh với doxorubicin (50mg/ổ) phối hợp
với docetaxel (75mg/mồ (nhóm AT) so vởi doxorubicin (60mg/ml) phối hợp với
cyclophosphamid (600mg/m2 (nhỏm AC). Cả 2 phác đồ thuốc nảy được thực hiện vảo ngảy
đầu tiên cùa mỗi chu kỳ 3 tuần.
Thời gian để bệnh tiển triền (TTP) kẻo dải hơn rõ rệt ở nhóm AT so với nhóm AC,
p=0,0138. TTP trung bình cùa nhóm AT lả 37,3 tuần (95%C1: 33,4-42J) vả 31,9 tuần (95% Cl:
27.4-36,0) trong nhóm AC.
Tỉ lệ đảp ủng chung (ORR) ở nhóm AT cao hơn rõ rệt so với nhóm AC, p=0,009.
ORR ớ nhóm AT là 59,3% (95%C1: 52,8-65,9) so với 46,5% ớ nhóm AC (95% Cl: 39,8-
53,2), Trong thư nghiệm nảy, người ta nhận thắy nhóm AT có ti lệ cao hơn về giám bạch cầu
trung tinh nặng (90% so với 68,6%), giám bạch cầu trung tính kèm sốt cao hơn (33,3% so với
10%), nhiễm khuẩn (8% so với 2,4%), tiêu chảy (7,5% so với 1,4%), mệt móilsuy nhược
(8,5% so với 2,4%) và đau (2,8% so với 0%) so với nhỏm AC. Mặt khác, nhóm AC có ti lệ bị
thiếu máu nặng cao hơn so với nhóm AT (15,8% so với 8,5%), hơn nữa tỉ lệ độc tính trên tim
nặng cũng cao hơn như suy tim xung huyết (3,8% so với 2,8%), giám LVEF tuyệt đối 2 20%
(13,1% so với 6,1%), giảm LVEF tuyệt đối 2 30% (6,2% so với 1,1%). Chết do nhiễm độc xay
ra ở 1 bệnh nhân trong nhóm AT (suy tim xung huyết) và 4 bệnh nhân trong nhóm AC ([
người do sổc nhỉễm khuẩn và 3 người do suy tim xung huyết).
Trong cả 2 nhóm, chẩt lượng cuộc sống xác định bằng bản câu hòi EORTC là tương tự
nhau và ốn định trong suốt thời gian diều trị và theo dõi. .
DOCETAXEL Irong phối hợp với Irasluzumab Â'l Ll/
Docetaxel trong phối hợp với trastuzumab được nghiên cứu để điểu trị bệnh nhân ung
thư vú di cãn có khối u có biếu hiện quá mức HER2, và ở bệnh nhân trước đó không được
điều trị hóa iiệu cho ung thư di căn. 186 bệnh nhân được chọn ngẫu nhiên để điều trị
docetaxel (lOOmg/m2) kèm hoặc không kèm với trastuzumab; 60% bệnh nhân được điều trị
hóa trị liệu bổ trợ bằng thuốc nhỏm anthracyclin trước đó. Docetaxel phối hợp với
trastuzumab có hiệu quả ớ bệnh nhân có hay không được điều trị anthracyclin bổ trợ trước đó.
Phương phảp chính được dùng để xảc định HER2 dương tính trong thử nghiệm nảy là hóa mô
miễn dịch (IHC). Một số ít bệnh nhân được kiềm tra bằng kĩ thuật lai tại chỗ phảt huỳnh
quang F ISH (fluorescence in-situ hybridization). Trong thử nghiệm nảy, 87% bệnh nhân mắc
bệnh có [HC 3+, và 95% bệnh nhân tham gia mắc bệnh có IHC3+ vả/hoặc FISH dương tính.
Cảc kết quả về hiệu quả cùa thuốc được tóm tắt trong bảng sau đây:
Thông số Docetaxel phối hợp với DocetaxelI n = 94
trastuzumabl n = 92
T1 lệ đáp ứng 61% 34%
(95%C1) 50 — 71) (25-45)
4
… if Ẩ'N.LỔ i1ỄÌ
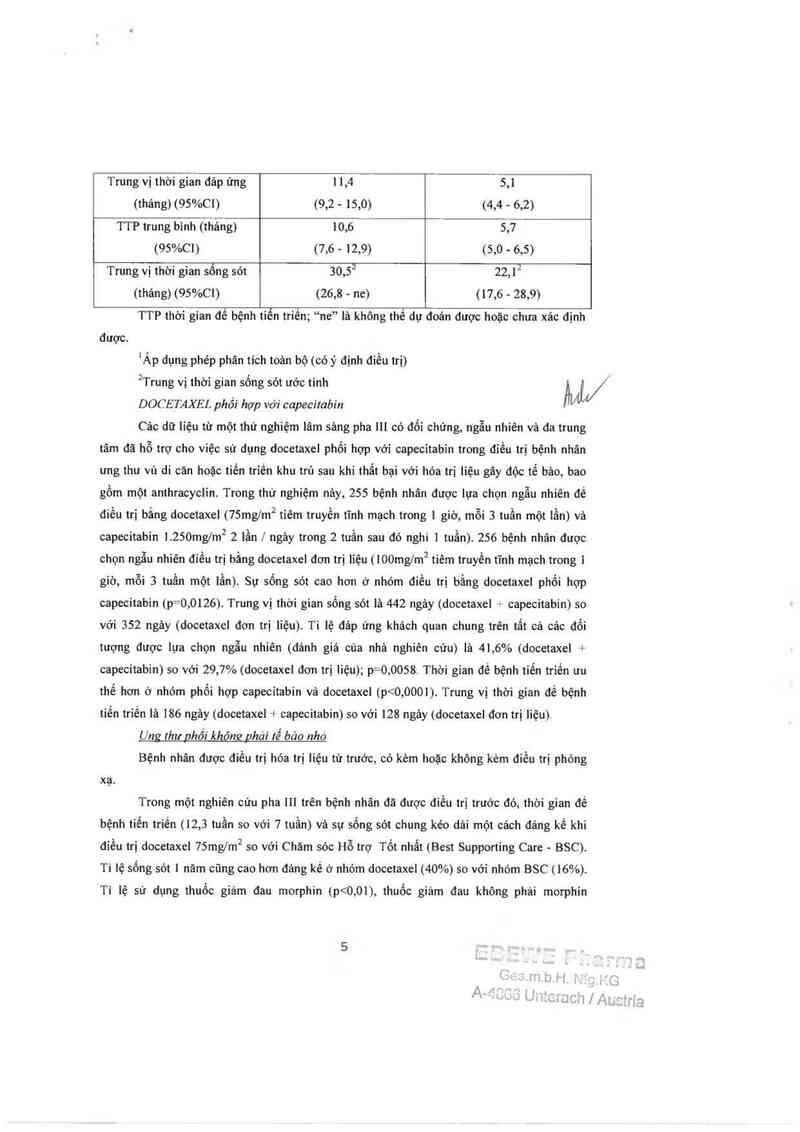
Trung vị thời gian đảp ứng 1 1,4 5,1
(tháng) (95%C1) (9,2 - 15,0) (4,4 - 6,2)
TTP trung binh (tháng) 10,6 5,7
(95%C1) (7,6 - 12,9) (5,0 - 6,5)
Trung vị thời gian sống sót 30,52 22, | 2
(thảng) (95%C1) (26,8 - ne) (17,6 - 28,9)
TTP thời gian đê bệnh tiến triến; “ne” lá không thể dự đoán được hoặc chưa xảc định
đuợc.
1Áp dụng phép phân tich toản bộ (cóỷ định điều trị)
²Trung vị thời gian sống sót ước tính W
DOCETAXEL phồi hợp vở] capecitabin
Các dữ liệu từ một thử nghiệm lâm sảng pha 111 có đối chứng, ngẫu nhiên và đa trung
tâm đã hỗ trợ cho việc sử dụng docetaxel phối hợp với capecitabin trong đỉểu trị bệnh nhân
ưng thư vú di căn hoặc tiến triền khu trú sau khi thẩt bại với hóa trị liệu gây độc tế bảo, bao
gồm một anthracyclin. Trong thử nghiệm nảy, 255 bệnh nhân được lựa chọn ngẫu nhiên để
điều trị bằng docetaxel (75mglm² tiêm truyền tĩnh mạch trong 1 giờ, mỗi 3 tuần một lần) và
capecitabin 1.250mg1m2 2 lần | ngảy trong 2 tuần sau đó nghỉ 1 tuần). 256 bệnh nhân được
chọn ngẫu nhiên điều trị bằng docetaxel đơn ttị liệu (lOOmg/m2 tiêm truyền tĩnh mạch trong 1
giờ, mỗi 3 tuần một lần). Sự sống sót cao hơn ở nhóm điều trị bằng docetaxel phối hợp
capecitabin (p=0,0126). Trung vị thời gian sống sót là 442 ngảy (docetaxel + capecitabín) so
với 352 ngây (docetaxcl đơn trị liệu). Tỉ lệ đáp ứng khách quan chung trên tất cả các đối
tuợng được lựa chọn ngẫu nhiên (đánh giá cùa nhà nghiên cứu) là 41,6% (docetaxel 4—
capecitabin) so với 29,7% (docetaxel đơn trị liệu); p=0,0058. Thời gian để bệnh tiến triến ưu
thế hơn ở nhỏm phối hợp capecitabin vả docetaxel (p<0,0001). Trung vị thời gian để bệnh
tiến trỉến là 186 ngảy (docetaxel + capecitabin) so với 128 ngảy (docetaxel đợn trị liệu)
Ung Ihư QhQ'i khọịng Qhảt' tế bảo nho
Bệnh nhân được điều trị hóa trị liệu từ truớc, có kèm hoặc không kèm điểu trị phóng
xạ.
Trong một nghiên cứu pha 111 trên bệnh nhân đã được điểu ttị trước đó, thời gian để
bệnh tiến triến (12,3 tuần so với 7 tuần) vả sự sống sót chung kéo dải một cảoh đảng kể khi
điều trị docetaxel 75mg/m2 so với Chăm sóc Hỗ trợ Tốt nhẩt (Best Supporting Care — BSC).
Tỉ lệ sống sót ! nảm cũng cao hom đáng kể ớ nhóm docetaxel (40%) so với nhóm BSC (16%).
Tỉ lệ sử dụng thuốc giám đau morphin (p<0,01), thuốc giảm đau không phải morphin
` "1 / fi i_,
iỉ_
(p<0,01), cảc thuốc khác liên quan đến bệnh (p=0,06), vả điểu trị phóng xạ [p<0,01) thẩp hcm
ở nhóm bệnh nhãn điều trị bằng docetaxel 7StngIm² so với nhỏm BSC.
Ti lệ đáp ứng chung 1ả 6,8% trên cảc bệnh nhân có thế đánh giá được, trung vị khoảng
thời gỉan đảp ứng lả 26,1 tuần.
DOCETAXEL trong phối hợp vởi các thuốc platin trên cảc bệnh nhân chưa đuợcđiểu
trị hóa trị Iiệu.
Trong một nghỉên cứu pha 111, 1218 bệnh nhân ung thư phối không phải tế bảo nhỏ ở
giai đoạn 111B hoặc IV không thế cẳt bò được, vởi KPS 70% hoặc hơn, vả những bệnh nhân
không điểu trị hóa trị liệu trước đó cho tình trạng nảy, được lựa chọn ngẫu nhiên để điều trị
docetaxel (T) 75mg/m2 tiểp theo ngay sau đó lả cisplatin (Cís) 75mg/111² tìêtn truyền 30-60
phủt, mỗi 3 tuần một lần, docetaxel 75mg/m2 tiêm trưyến tr0ng ] giờ phối hợp với carboplatin
(AUC 6mg/ml.phút) tiêm truyền 30-60 phút, mỗi 3 tuần 1 lần, hoặc vinorclbin (V) 251ng/1n2
tỉêm truyền trong 6-10 phút vảo các ngảy 1, B, 15, 22 tiếp theo sau đó tiêm truyền cisplatin
lOOmglm2 chi dịnh vảo ngảy ] cúa cảc đợt điều trị, lặp lại 4 tuần 1 lằn.
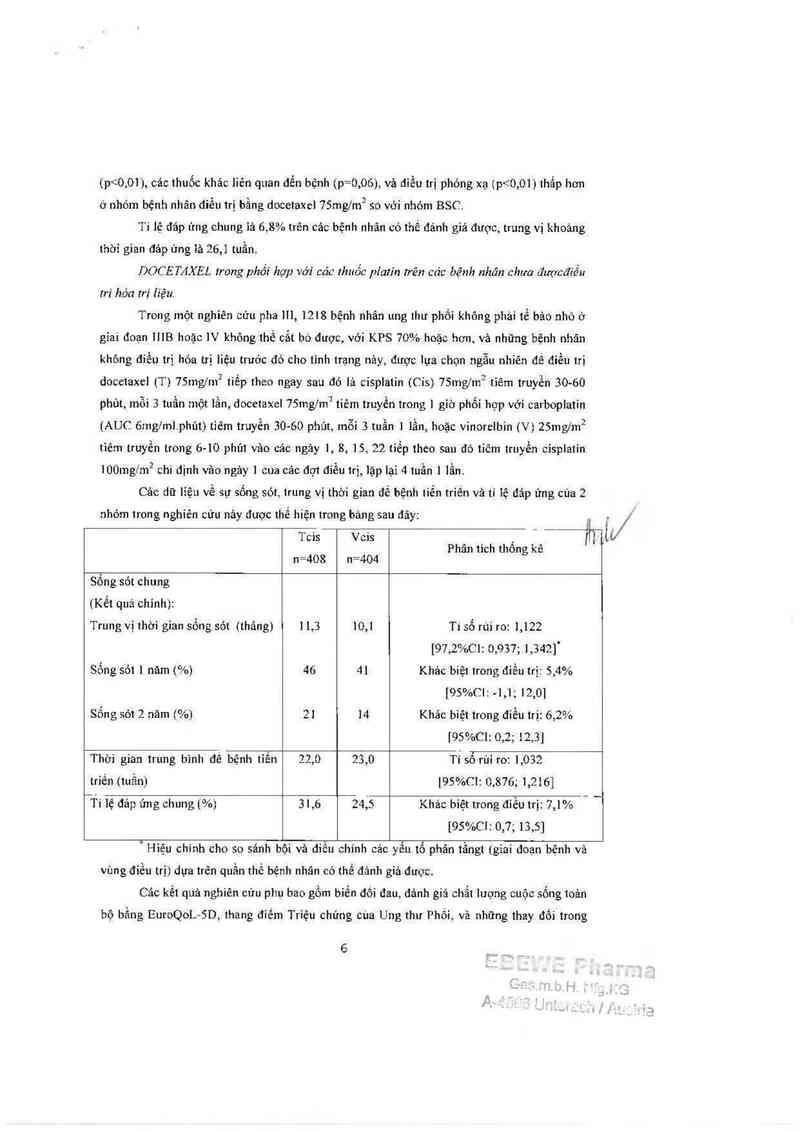
Cảo dữ lỉệu về sự sống sót, trung vị thời gian để bệnh tiển triến và tỉ iệ đáp ứng của 2
nhóm trong nghiên cửu nảy được thế hiện trong bảng sau đây:
11
Tcis Vcis ,
n=408 n=404 Phân tich thông kê
Sống sót chung
(Kết quả chỉnh):
Trung vị thời gỉan sống sót (tháng) 11,3 10,1 Ti số r01 ro: 1,122
[91,2%c1: 0,937; 1,342]'
8011 g sót 1 nảm 1%) 46 41 Khảc biệt trong điểu trị: 5,4%
[95%c1:-1,1;12,01
Sống sót 2 năm (%) 21 14 Khác biệt trong diểu trị: 6,2%
[95%C1: 0,2; 12,3]
Thời gian trung bình đề bệnh tiến 22,0 23,0 Ti sổ rùi ro: 1,032
triến (tuần) 195%c1: 0,876; 1,216]
711 1ệ đảp 1111 g chung [%> 31,6 24,5 Khảc bỉệt trong điều trị: 7,1% “ "
195%c1:0,7; 13,5]
'Hiẹu chỉnh cho so sánh bội vả diều chinh cảc yếu tố phân tầngt (giai đoạn bệnh và
vùng điếu trị) dựa trên quần thể bệnh nhân có thế đảnh giả được.
Các kểt quả nghiên cửu phụ bao gổm biến đồi đau, đánh giá chắt lượng cuộc sống toản
bộ bằng EuroQoL-SD, thang điềm Triệu chứng cùa Ung thư Phối, và những thay đối trong
6
,,...-_
thang điếm biếu hiện trạng thải chức nãng Kamofsky (KPS). Cảo kết quả phụ nảy giúp hỗ trợ
cho kểt quả chinh.
Trong phối hợp docetaxel/carboplatỉn, không chứng minh được có hiệu quả tương
đương cũng như hiệu quả hơn khi so sánh với phối hợp điều trị VCis.
Une Ihư tiển liẻl Iuvến
Hiệu quả và tính an toản của docetaxel khi phổi hợp với prcdnisone hoặc prednisolon
trên bệnh nhân ung thu tiền lỉệt tuyến di căn kháng hormone được đánh giá trong một thử
nghiệm pha 111 ngẫu nhiên đa trung tâm. T ổng số 1006 bệnh nhân có KPS 2 60 được chọn ngẫu
nhiên vảo các nhóm điều tri sau đây:
0 Docetaxel 75mg/mz mỗi 3 tuần 1 1ần cho 10 đọt điểu trị.
0 Docetaxel 30mg/mz dùng mỗi tuần trong 5 tuần dầu tiên cùa một đợt điều trị 6
W“
Cả 3 chế độ điều trị nảy được chỉ định phối hợp với prednisonc hoặc prednisolon 5 mg
tuần gổm 5 chu kỳ điều tri.
o Mitoxantron 12mg/m2 3 tuần 1 lần trong 10 đợt diều tri.
2 lẩn 1 ngảy dùng liên tục.
Bệnh nhân được điểu tri docetaxel 3 tưần 1 lần đã chứng minh được thời gian sống sót
chung kéo dèi hơn đáng kể so với khi điều trị bằng mitoxantron. Nhận thắy nhỏm điểu trị
hảng tuần bằng docetaxel có tãng thời gian sống sót nhung không có ý nghĩa thổng kê so với
nhóm chứng điểu trị bằng mitoxantron. Tiêu chí hiệu qua' cúa nhóm điểu trị docetaxel so với
nhỏm chứng được tóm tắt trong bảng sau:
Kết quả nghiên cứu Docetaxel mỗi Docetaxel mỗi tuần Mitoxantron mỗi
3 tuần 1 lần 3 tuần 1 1ần
sỏ bệnh nhân 335 334 337
Trung vị thời gian sống 18,9 17,4 16,5
sót (tháng)
95%c1 (17,0 - 21,2) (15,7 - 19,0) (14,4 - 18,6)
T1 số mi ro 0,761 0,912 …
95%c1 (0,619 - 0,936) (0,747 - 1,113) …
Giá trị p” 0,0094 0,3624 .-
sỏ bệnh nhân 291 282 300
Ti 1ệ đáp ứng PSA" 45,4 47,9 31,7
95%c1 (39,5 - 51,3) (41,9 - 53,9) (26,4 - 37,3)
Giá trị p' 0,0005 < 0,0001 ——
sỏ bệnh nhân 153 154 157
Ti 1ẹ đáp ứng đau (%) 34,6 31,2 21,7
95%c1 (27,1 - 42,2) (24,0 … 39,1) (15,5 - 28,9)
Jflfiụ',_y '.Ĩý
Giá trị p' 0,0107 0,0798 ——
Sô bệnh nhân 141 134 137
Ti 1ẹ đảp ủng khối u (%) 12,1 11,2 6,6
95%c1 (7,2 … 18,6) (4,2 - 14,2) (3,0 - 12,0)
Giá trị p' 0,1112 0,5853 …
'Kiếm định Iog-rank đã phân tầng
'Nguờng cho ý nghĩa thống kê - 0,0175
“ Khảng nguyên đặc hiệu tuyển tiền liệt
Thực tế cho thấy docetaxel điều lrị háng tuần có tính an toản cao hơn một chút so vởi
docetaxcl điếu trị mỗi 3 tuần một lần, một số bệnh nhân nhất định có thể thấy được hiệu quả
của việc điếu trị docctaxel mỗi tuần 1 lần.
Không có sự khảo biệt có ý nghĩa thống kê quan sảt được giữa cảc nhóm diều trị cho
chỉ số Chẩt lượng Cuộc sống Toản bộ (Global Quality of Life). M/
Một thư nghiệm ngẫu nhiên, biết tên thuốc (11hân mờ), đa trung tâm được tiến hảnh dễ
đánh giá tinh an toản vả hiệu quả của docetaxcl trong điều trị bệnh nhân ung thư hiếu mô
tuyến dạ dảy di căn, kể cả ung thư biếu mô tuyến đoạn nối đạ dảy—thực quản, bệnh nhân chưa
đỉểu trị hóa trị liệu trước dò cho bệnh di cân. Tổng số 445 bệnh nhân có KPS › 70 được điều
trị hoặc bằng docetaxel(T) (?Smgfm2 vảo ngáy 1) phối hợp với cisplatin (C) (75mg/1112 vảo
ngảy ]) vả S—i`luorouracil (F) (750mgỵ'm2 mỗi ngảy trong 5 ngảy), hoặc cisplatĩn (IDDIng/m2
v`ao ngảy 1) và 5-fìuorouracil (1000mg1m² mỗi ngảy trong 5 ngảy). Độ dải một chu kỳ điểu trị
là 3 tuấn cho nhóm TCP và 4 tuần cho nhóm CF. Số chu kỳ điều trị trung bình cho mỗi bệnh
nhân là 6 (biển thiên từ 1-16) trong nhóm TCP so với 4 (biến thiên tử | — 12) trong nhóm CF.
'\
Thời gỉan dế bệnh tiến triền (TTP) là kết quả nghiên cứu chính. Tỉ lệ giám nguy cơ tiến trên F
cùa bặnh là 32,1% và có liên quan với TTP kéo dải hcm dảng kề (p=0,0004) thỉẽn về nhỏm
TCF. Sự sống sót chung kéo dải hơn dảng kế ở nhóm TCF (p=0,0201) với tỉ lệ giảm nguy cơ
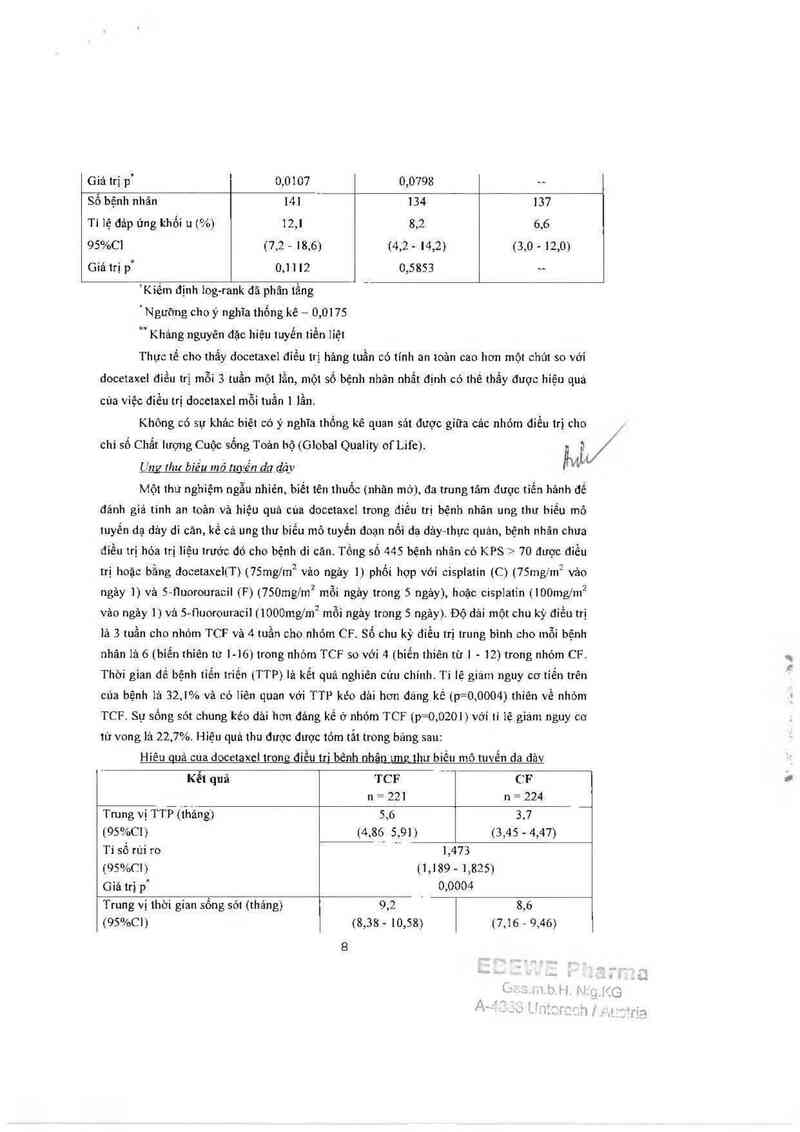
tử vong là 22.7%. Hiệu quả thu được dược tóm tắt trong bảng sau:
Hiên quả cua docetaxcl trom; diều tri bênh nhân ưng thư biếu mô tuvễn da dảv
Kết quả TCF CF '
n = 221 n = 224
Trung vị TTỄ(ihầng) 5,6 3,7 “
(95%C1) (4,86 5,91) (3,45 - 4,47)
Tỉ số mi ro ` ` "' 1,473
(95%C1) {1,189 — 1,1125)
Giá trị p' 0,0004
Trung vị lhời gian sống sót (thảng) 9.2 . 8,6
(95%C1) (8,38 - 10,58) (7,16 — 9,46)
Ước tinh 2 nám (%) 18,4 | 8,8
Tỉ số rủi ro 1,923
(95%C1) (1,041 - 1,606)
Gìá trị p' 0,0201
Tỉ lệ đảp ứng chung (CR+PR) (%) 36,7 | 25,4
Giá trị p ’ 0,0106
Bệnh tiền triên khi đảp ứng chung 101 16,7 25,9
nhất (%)
' Kiềm định log rank không phân tìng
Cảc phân tích phân nhóm từ bệnh nhân qua độ tuồỉ, giới tính vả chủng tộc thiên lệch
một cách nhẩt quán cho nhóm TCF so với nhóm CF.
Một phân tích cập nhật về sự sống sỏt được tíến hảnh với khoảng thời gian theo dõi
trung binh 41,6 thảng đã không cho thắy sự khác biệt có ý nghĩa thống kê mặc dù kểt quả Ìuôn
thiên về nhóm TCP và cho thẳy lợi ích thu được từ nhóm TCF cao hơn rõ rệt so với nhóm CF
trong khoáng thời gian theo dõi 18 đến 30 thảng.
Nhìn chung, chất lượng cuộc sống (QoL) và các lợi ich trên lâm sảng cho thấy sự cái
thiện thiên về nhỏm TCP một cảch nhất quán. Bệnh nhân được điều trị trong nhóm TCF có
thời gian để giảm 5% tình trạng sức khóe toản bộ kéo dải hơn dựa trên báng câu hòi QLQ-
C30 (pJO,OI2IJ vả thời gian để điếm bỉếu hỉện trạng thải chức năng Karnofsky xẳu đi một
cảch rõ rệt củng kéo dâi hơn (p'—0,0088) so với cảc bệnh nhân điều trị trong nhóm CF. J
Umz thư đầu vả cố iiytl’
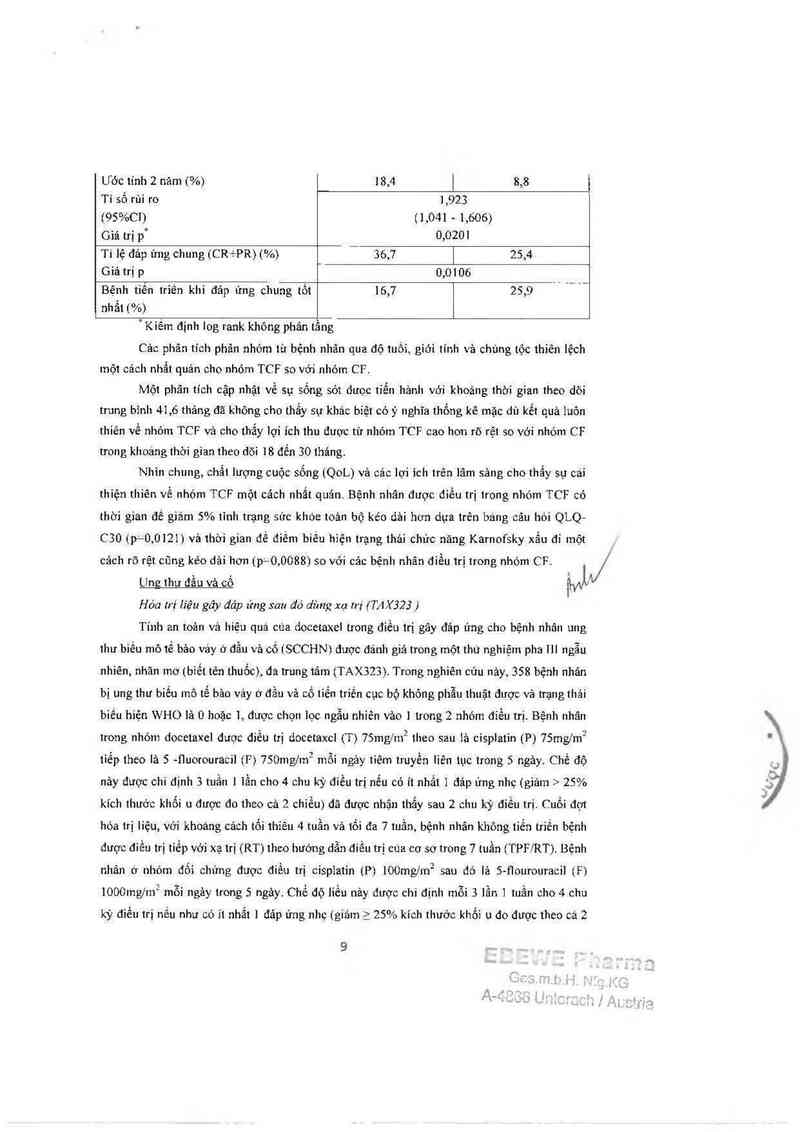
Hóa rrị liệu gây đáp ửng sau đó dùng Il_l rrị (TAX323 )
Tính an toản vả hỉệu quá cùa docetaxel trong điếu trị gây đáp ứng cho bệnh nhân ung
thư biều mô tế bảo vảy ù đầu vả cố (SCCHN) được đảnh giả trong một thú nghiệm pha III ngẫu
nhiên, nhản mơ (biết tên thuốc), da trung tâm (TAX3Z3). Trong nghiên cúu nảy, 358 bệnh nhân
bị ung thư biểu mô tế băn vảy ở đẳư vả cố tiến triến cục bộ không phẫu thuật dược vả trạng thải
biền hiện WHO là 0 hoặc 1, được chọn lọc ngẫu nhiên vảo 1 trong 2 nhóm điều trị. Bệnh nhân
trong nhỏ… docetaxel dược diều trị docctaxc] (T) 75mg/m2 theo sau ìả cisplatin (P) 75mg/m2
tiếp theo tả 5 -tiuorouracil (F) 750mg/1n2 mỗi ngảy tiêm truyền liên tục trong 5 ngảy. Chế độ
nảy được chỉ định 3 tuần 1 lằn cho 4 chu kỳ điều trị nếu có ít nhất 1 đáp ứng nhẹ (giảm > 25%
kích thưởc khối 11 được do theo cả 2 chiều) dã dược nhận thẳy sau 2 chu kỳ đỉều trị. Cuối đợt
hóa trị liệu, với khoáng cảch tối thiếu 4 tuần vả 161 đa 7 tuần, bệnh nhân không tiến triến bệnh
được điều trị tiểp với xạ trị (RT) theo hướng dẫn điều trị cưa cơ sơ trong 7 tuần (TPF/RT). Bệnh
nhân tư nhỏ… đối chứng được điểu trị cisplatin (P) lOOmg/m2 sau đó lã S—fìourouracil (F)
lOOOmgỉm2 mỗi ngảy trong 5 ngảy. Chế dộ lìếu nảy được chỉ định mỗi 3 lần ] tuần cho 4 chu
kỳ điều trị nếu như có it nhắt ] đảp ứng nhẹ (giảm a 25% kích thước khối 11 do dược theo cả 2
9
chiều) đã được nhận thấy sau 2 chu kỳ điều trị. Cuối đợt hóa trị liệu với khoảng thời gian tối
thiếu 4 tuần vả tối đa 7 tuần, bệnh nhân không tiển triến bệnh được điều tri tiếp bằng xạ trị theo
huớng dẫn điều trị của cơ sở trong 7 tuần (PF/RT). Liệu pháp điểu trị tại chỗltại vùng bằng xạ
trị tiến hảnh theo phân liều thông thuờng (1,80y — 2,00y ! lần] ngảy, 5 ngáy/tuần vời tống liều
66 đển 7OGy), hoặc các chế độ xạ trị liều cao/xạ trị cường độ mạnh (2 Iần/ngảy, khoảng cách tối
thiếu giữa các phân liều là 6 giờ, 5 ngảy/ tuần). Tống liễu 7OGy được khuyến cảo cho chế độ xạ
tri cường độ mạnh và 74Gy cho xạ trị iiều cao. Phẫu thuật cắt bỏ được cho phép sau khi đỉều trị
hóa trị iiệu, trước hoặc sau khi xạ trị. Bệnh nhân trong nhỏm TPF đuợc điều trị kháng sinh dự
phòng bằng ciproiìoxacin 500mg đường uống 2 lẳn/ngảy trong 10 ngảy bắt đầu từ ngảy thứ 5
cùa mỗi chu kỳ điều trị , hoặc tuơng đương. Kết quả chính của nghiên cứu nảy là sự sống sót
không tiến triến (PFS) đã kéo dải hơn dảng kế 01 nhóm TPF so với nhóm PF , p=0,0042 (trung vị
PFS: 11,4 so với 8,3 thảng tương ứng) với khoáng thời gian theo dõi trung bình 33,7 thảng.
Trung vị thời gian sổng sót chung cũng kẻo dải hơn rõ rệt ở nhóm TCF so với nhóm PF (Trung
vi OS: 18,6 so với l4,5 tháng tương ứng) với nguy cơ tử vong giám 28%, p=0,0128. 414/1
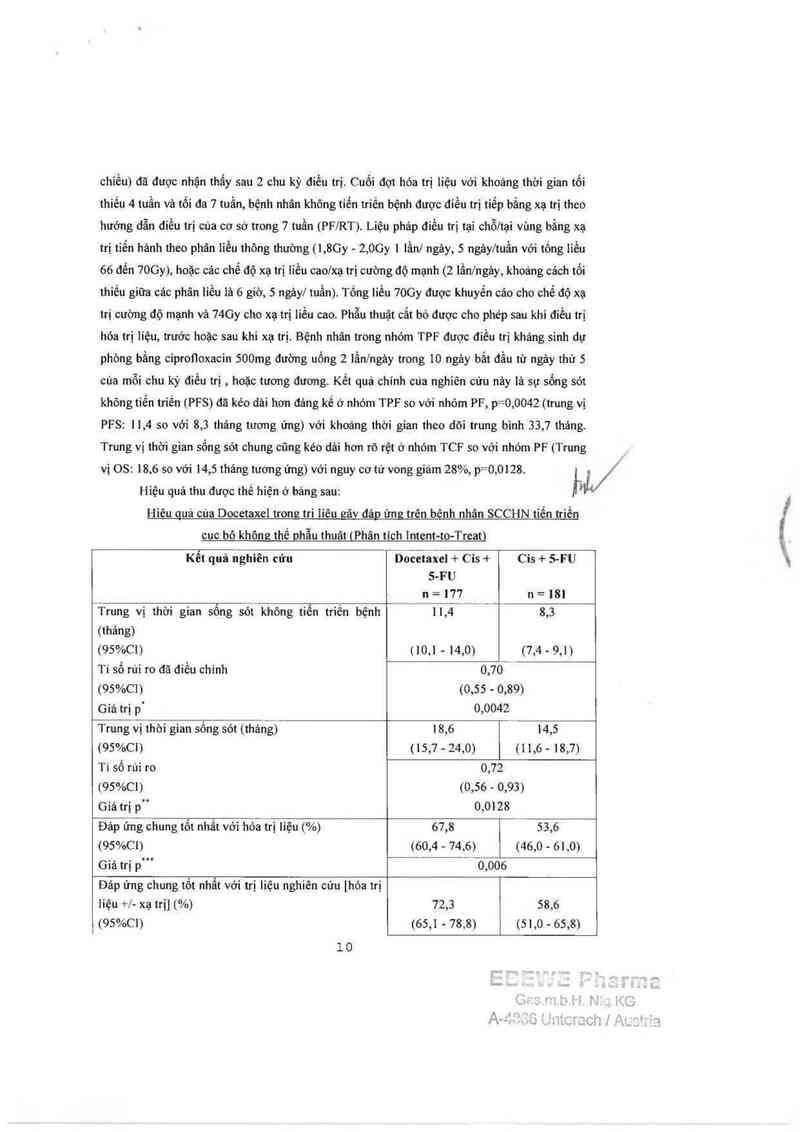
Hiệu quả thu đuợc thế hiện ở bảng sau: 1
Hiên guá củạ Docetaxel tromz tri liêu zâv đáp ứng trên bênh nhân SCCHN tiến triển
cuc bỏ không thế ghẫu thuât (Phân tich intent-to-Treat}
Kết quả nghiên cứu Docetaxel + Cis + Cis + S-FU
S-FU
= 177 11 = 181
Trung vị thời gian sổng sót không tiến triên bệnh “—1T,4— 8,3
(thảng)
(95%C1) (10,1 - 14,0) (7,4 - 9,1)
Tỉ số rùi ro đã điều chinh 0,70
(95%C1) (0,55 - 0,89)
Giá trị p' 0,0042
Trung vị thòi gian sống sót (tháng) 18,6 14,5
(95%C1) (15,7 - 24,0) (11,6 - 18,7)
Ti sổ rủi ro 0,72
(95%C1) (0,56 - 0,93)
Giá 111 p" 0,0128
Đảp ứng chung 161 nhẫt với hóa trị liệu (%) 67,8 53,6
(95%C1) (60,4 - 74,6) (46,0 - 61,0)
Giá trị p'" 0,006
Đáp ứng chung 101 nhất với 111 liệu nghiên cứu [hóa 111
iiệu +/- xạ trị] (%) 72,3 58,6
(95%C1) (65,1 — 78,8) (51,0 - 65,8)
10
A.f …,.v.. "
f-ự…_ _~ Ư … iz..L'iltl i
Giá 111 p`“ 0,006
Thời gian tmng bình của đáp ứng với hóa trị liệu + n-128 n-106
xạ trị (tháng) 15,7 1 1,7
(95%C1) (13,4 - 24,6) (10,2 - 17,4)
Tỉ số rúi ro 0,72 _
(95%C1) (0,52 — 0,99)
Giá trị pn 0i0457
Tỉ số rủi ro nhớ hơn 1 thiên về nhóm docetaxel + cisplatin + 5-FU
' Mô hinh Cox (diều chinh cho vị 111 khổi u nguyên phảt, các giai đoạn lâm sảng T vã
N và PS WHO)
" Kiếm định logrank
… Phép thử Chi-square
Các thỏng số về chất Imợng cuộc sống
Bệnh nhân trong nhóm '1`CF` có biểu hiện it bị sút giám đáng kể về số điếm sức khóc ,
toản bộ so với bệnh nhân nhóm PF (p=0,01, sư dụng thang EORTC QLQ-C30). M
Các !hông số về lợi ích lrên lám sảng Ị1ì
Trên thang điếm trạng thái biếu hiện, phân nhóm thang điềm về đầu vả cố (PSS-HN) được
thiết kế để đảnh giá khả năng hiền được lời nói, khả năng ãn uống nơi công cộng, và tính bình
thường của chế độ ăn thiên về nhóm TPF rõ rệt so vởi nhóm PF .
Thời gian trung binh để có sự giam sủt đầu tiên về điềm số trạng thái biếu hiện WHO
dải hợn rõ rệt ở nhớm TPF so với nhóm PF. Điếm về cuờng độ đau được cải thỉện trong suốt
quá trinh điều trị ớ cả 2 nhóm cho thẩy đủ khả nãng kiềm soát đau.
Đìểu Irì hóa tri liêu gâv đáp ứng sau đó lả hóa xa Iri (T AX 324)
Tinh an toản vả hiệu qua' cùa docetaxel trong trị liệu gây đáp ứng cho bệnh nhân ung
thư biểu mô tế bảo hình vảy ở đầu và cố tiển triền cục bộ (SCCHN) được đảnh giá trong một
11111 nghiệm pha … ngẫu nhiên nhãn mở (biết tên thuốc), đa trung tâm (TAX324). Trong
nghiên cứu nây, 501 bệnh nhãn bị SCCHN tiển triến cục bộ vả có trạng thải biếu hiện WHO
mức 0 hoặc 1, được lựa chọn ngẫu nhiên vảo một trong 2 nhóm. Các đối tượng của nghiên
cứu bao gổm bệnh nhân mắc bệnh không thê phẫu thuật cắt bỏ được, bệnh nhân có xảc suất
chữa lãnh thấp với điều 111 phẫu 11111ậ1, bệnh nhân nhắm tởi báo tốn cơ quan. Đảnh giá về hiệu
quả vả tính an toản chi tập trung váo các kết quả nghiên cứu chinh về sống sót và sự thảnh
công trong việc bao tồn cơ quan vẫn chưa đuợc chỉnh thức lưu ý đến. Bệnh nhân trong nhóm
docetaxel được điều trị docetaxel (T) 75mg/m2 tiêm truyền tĩnh mạch vảo ngảy 1 sau đó
cisplatin(P) lOOmg/m2 tiêm truyền tĩnh mạch trong 30 phút đến 3 giờ, tiếp đó tiêm truyền tĩnh
mạch 5-fiuorouracil (F) lOOOmg/mzlngây liên tục 11: ngảy 1 đền ngảy 4. Các chu kỳ diểu trị
lặp lại mỗi 3 tuần 1 lần trong 3 chu kỳ. Tắt cả các bệnh nhân không tiển triền bệnh đuợc điều
1 l
111 bằng hóa xạ 111 (CRT) dựa theo thiết kế nghiên cứu (TPFICRT). Bệnh nhân nhóm đối
chứng đuợc điểu tri bầng cispiatin (P) lOOmg/m2 tiêm truyền tĩnh mạch trong 30 phút đến 3
giờ sau đó tiêm truyền tĩnh mạch 5-tiuorouracil (F) 1000mglm²/ngảy liên tực tù ngảy 1 dến
ngảy 5. Các chu kỳ điều trị lặp iại mỗi 3 tuần 1 lần trong 3 chu kỳ. Tắt cá cảc bệnh nhân
không tiển triền bệnh được diều ni CRT như 1111é1 kế nghiên cứu (PFICRT).
Bệnh nhân ở cá 2 nhỏm điều trị được điểu trị 7 tuần với CRT sau đó lả hớa trị liệu gây
đáp ứng với khoảng cách 161 thiếu lả 3 tuần vả không dải hơn 8 tuần sau khi bắt đầu chu kỳ
điều 111 cưối cùng (ngảy 22 dển ngảy 56 của chu kỳ diều trị cuối cùng). Trong suốt quá trình
xạ trị, carbopiatin (AUC 1,5) được chỉ định hảng tuần tiêm truyền tĩnh mạch trong 1 giờ cho
tối đa 7 liều. Xạ trị sử dụng thiết bị megavon phân liều 1 lần 1 ngảy (26ylngảy, 5 ngảy/tuần
trong 7 tuần, với tổng liều 111 70—72Gy1. Phẫu thuật ở vị 111 bệnh ngưyên phát vảlhoặc cố có
thể được cãn nhắc bất kì thời gian nảo sau khi kết thúc hóa xạ trị. Tất cả các bệnh nhân trong
nhóm đỉều trị có docetaxel cùa nghiên cứu nảy đuợc chỉ định khảng sinh dự phòng. Kết quả
chính về hiệu quả cùa thuốc trong nghiên cứu nảy, sự sống sót chung (OS) kéo dải hơn đáng
kể (kỉếm định log-rank, p=0,0058) với chế 110 điểu trị có docetaxel so với nhóm PF (OS trung
vị: 70,6 so với 30,] tháng tương ứng) và giám 30% nguy cơ tử vong so với nhỏm PF (ti số rùi
ro (HR) = 0,70, 95% khoảng tin cậy (CI) = 0,54-0,90) với khoáng thời gian theo dõi trung
bình là 41,9 thảng. Kết quả nghiên cứu phụ, PFS, đã chứng minh sự giám 29% nguy cơ bệnh
tiến triến hoặc tử vong và sự cải thiện 22 tháng về trung vị thời gian PFS (35,5 thảng trong
nhóm TPF vả 13,1 thảng trong nhóm PF). Điểu nảy cũng có ý nghĩa thống kẽ với HR bằng
0,71; 95%c1 0,56—0,90; kiềm định log—rank p=0,004 Các kết quả về hiệu quả điểu 111 thế hiện
trong bảng sau đây: W
Hiên uả cùa docetaxcl tron diều tri â đá ứn cho bênh nhân ung thư biều mô tế
bảo vảv ớ đ`u vả cố tiến triến c c ” Phân tich cho du đ`nh điều tri
Kết quả Docetaxel + Cis + Cis + 5—FU
S-FU
n = 255 11 = 246
Trung vị thời gian sống sớ1 chung (tháng) 70,06 30,1
(95%C1) (49,0 - NA) (20,9 - 51,5)
Tỉ số rủi ro: `0,70 _
(95%C1) (0,54 - 0,90)
Giá trị p“ 0,0058
Trung vị thời gian PFS (thảng) 35,5 13,1
(95%C1) (19,3 - NA) (10,6 - 20,2)
Tỉ số 1111 ro 0,71
(95%C1) (0,56 - 0,90)
1 2
Giá 111 p" 0,004
Đảp ửng chung tốt nhẫt (CR+PR) với hóa trị liệu (%)
71,8 64,2
(95%C1) (65,8 - 77,2) ()57,9 - 70,2
Uiá 111 p'" 0,070
Đảp ứng chung tôt nhât (CR+PR) với trị liệu nghiên
cứu [hóa tri lìệu +l- xạ tri] (%) 76,5 71,5
(95%C1) (70,8 - 81,5) 65,5 - 77,1
Giá 111 p'" 0,209
Ti sô rủi ro nhỏ hơn 1 nghiêng về nhỏm dooctaxcl + cisplatin + f1uorouracil
' Kiếm đinh logrank không điều chỉnh
" Kiềm định logrank không điểu chinh, không điểu chinh cho so sảnh bội
… Kiểm định Chi-squarc, không điều chinh cho so sánh bội
NA- không thích hợp
2. Đặc tinh dược động học
Dược động học của docetaxcl được đánh giá trên bệnh nhân ưng thư sau khi điểu trị
docetaxcl 20-115ngm2 trong các nghiên cứu pha 1. Một phân tỉch dược động học quần thể
của docctaxcl đã được tỉến hảnh trên 577 bệnh nhân. Các thông số dược động học được ước
tính trong mô hình nảy rẩt gần với các thông số được ước tính ttong các nghiên cửu pha 1.
Dược động học cùa docetaxcl không thay dối theo tuốĩ vả gỉởi tinh cùa bệnh nhân. W
@
Sau khi dũng một liều lOOmgjm2 tiêm truyền tĩnh mạch trong 1 giờ, nồng độ đinh
trong huyết tương trung bình 11… được 111 3,711ng với AUC tương ứng 11 4,6h.ựg/mL
ủbố
Đặc tinh dược động học của dooctaxcl không phụ thuộc mức liều vả nhắt quản, với mô
thức dược động hợc 3 pha với thời gian hán hùy pha (1, B, và 7 tượng ứng là 4 phủt, 36 phút
vả ] 1,1 giờ. Một phần cùa pha sau là do sự thải ra chậm tương đối của đocctaxcl từ ngoại vi.
Docetaxel liên kết trên 96% với protein huyết ương.
Giá 111 trung bình của độ thanh thâi toản phần của cơ 1hẻ vả 111ề tich phân bố 6 trạng
111111 ổn đinh 111611g ứng 13 21 1117g167111² vả 113111. Biến thiên giữa các cá thế về 116 thanh 111111
toản phần của cơ thể 13 xẩp xi 50%. Một nghiên cứa về doceimehC“ đã được tìển hảnh 11811 3
bệnh nhân ung thư. Docetaxel được thải trừ qua nước tiều vả phân thco con đường chuyền
hỏa oxy hóa qua cytochrom P450 của nhớm tcrt-butyl wtcr, trong vòng 7 ngảy, lượng bảì tiết
qua nước tiểu chỉếm 6% Vả qua phân 111 75% của hoạt chất phóng xa đã dùng. Khoảng 80%
,, EBEWE Pharma
Ges.m.b.H. Nfg.KG
A-4866 Unterach lAustria
họat chắt phỏng xạ được tim thấy trong phân trong 48 giờ đầu dưới dạng một chẳt chuyến hóa
không có hoạt tính chinh và 3 chất chuyến hỏa không có hoạt tính phụ vả một lượng rẳt nhỏ
thuốc không chuyền hóa.
Trong một số ít hệnh nhân (n=23) có các dữ liệu hóa lâm sảng biều hiện suy chức
năng gan nhẹ và vừa (nống độAST vả/hoặc ALT cao gấp 1,5 lần ULN đồng thời alkalỉnc
phosphatasc z 2,5 1ần ULN), độ thanh thải toản thân thắp hơn 27% so với mức binh thường.
Độ thanh thải cúa docctaxcl không bị biến đổi 6 bệnh nhân 11 địch nhẹ và vừa và không có dữ
liệu nghiên cứu ưên cảc bệnh nhân ứ dịch nặng.
Tương tảc dươc đông hoc vởi cản chẳt khảc
Khi dùng trong điều trị phối hợp, đocctaxcl không ảnh hưởng đến độ thanh thải của
doxorubicin vả nồng độ doxorubicinol trong huyết tương (một chẳt chuyến hớa của
doxorubicin). Dược động hợc của docctaxel, doxorubicin vả cyclophospharnỉd khỏng bị ảnh
hưởng khi dùng phối hợp vởỉ nhau.
Nghiên cứu pha ! đảnh giả tảc dụng cùa capccitahin trên dược động học cùa docctaxcl
và ngược lại cho thấy capccitabin không có tảc đụng trên dược động học của docetaxel (Cmax
vả AUC) vả đocctaxcl không có tảc động đến dược động hợc cùa một chẳt chuyến hóa có tiên /
quan đễn capecitabin 5`-DFUR. ft1/11
Độ thanh thải cùa docctaxel trong phổi hợp trị liệu với cisplatin tương tự vởi độ thanh
thải cùa docctaxel trong đơn trị lĩệu. Đặc tĩnh được dộng hợc cùa cispiatin điều trị ngay sau
khi tìêm truyền đocctaxcl tương tự vởi tính chẳt dược động hợc cùa cisplatin dơn trị liệu. Phối
hợp điều trị cùa docctaxcl, cisplatỉn vả S-ftoưrouracỉl trên 12 bệnh nhân có khối u đặc không
có ảnh hưởng đểu dược động học cùa mỗi thuốc riêng hĩệt. Tảc dụng cúa prcdnỉsonc trên
dược động học cùa docctaxcl được chỉ định điều trị sau khi đỉếu trị chuẩn trước bằng
dcxamcthason được nghiên cửu trên 42 bệnh nhân. Người ta không nhận thẳy tảo động cùa
prednỉson trẻn dược động học của docetaxcl.
3.C111011111 điều 111
Ung thư vú
DOCETAXEL “EBEWE” phối hợp với doxorubicin vả cyclophosphamidc được chỉ
định điều 111 bổ trợ cho bệch nhân ung 11111 vú ớ'1 hạch bạch huyết dương 11n11, có thề phẫu
thuật được.
DOCE'I`AXEL “EBEWE" phối hợp với doxorubicin được chỉ định trong đỉều trị bệnh
nhân ung thư vú di cãn hoặc tìến triền cục bộ không được điều trị bằng Iĩệu pháp gây độc tể
hảo trước đỏ.
'4 EBEWE Pharma
Ges.mbH Nfg.KG
A—4866 Unterach |Austría
DOCETAXEL “EBEWE” đơn trị liệu được chỉ định trong điều trị bệnh nhân ung thư
vú di cãn hoặc tiến triển cục bộ sau khi thất bại trong lỉệu pháp gây độc tế bảo. Hóa trị liệu
trước đó nên bao gổm một anthracyclỉne hoặc một tảc nhân alkyl hớa.
DOCETAXEL “EBEWE" phối hợp với trastuzumab được chỉ định trong điều trị bệnh
nhân ung thư vú di căn có biều hiện quá mức thụ thể HER2 và cho bệnh nhân không được
điều 111 hớa 111 liệu 111161: đó cho bệnh di căn.
DOCETAXEL “EBEWE" phối hợp vởi capecitabìn được chỉ định trong điều trị bệnh
nhân ung thư vú di căn hoặc tiển triến cục bộ sau khi thất bại trong liệu pháp gây độc tế bảo.
Liệu pháp điều trị trước đó nên bao gốm anthracycline.
ủath_ưpủglmấỉịểilặọn_hộ
DOCETAXEL “EBEWE” được chi định trong diều 111 ung 11… phối không phái 11²1 bảo
nhớ di cãn hoặc tiến triển cục bộ sau khi thẩt bại trong hỏa trị liệu trước đó.
DOCETAXEL “EBEWE" phối hợp với cisptatin dược chi dịnh bệnh nhân ung thư
phổi không phải tế bảo nhớ di cán hoặc tỉền triền cục bộ không thể cắt bỏ được và không điều
trị hảa trị liệu trước đó cho tinh trạng bệnh nảy. /,
Ung thư tuỵến tiền liẽt M
DOCETAXEL “EBEWE" phối hợp với prednisone hoặc prcdnisolon được chi dịnh
trong điều trị bệnh nhân ung thư tiền liệt tuyến di căn khảng hormon.
Unz thư biếu mô tuvển da dảv
DOCETAXEL “EBEWE” phối hợp với cisplatin vả 5-fluorouracil được chỉ định trong
điều trị bệnh nhản ung thu biền mô tuyển dạ dảy di cản bao gồm ung thư biểu mô tuyến đoạn
nối dạ dảy-thực quản không được điểu trị hớa trị liệu trước đó cho bệnh di cãn.
Ung thư cổ vả đầu
DOCETAXEL “EBEWE” phối hợp với cisplatin vá S-fìuorouracil được chỉ định trong
điều trị gây đảp ửng (7 bệnh nhân ung thư biền mô tế bảo váy ớ đầu vả cố tiển triển cục bộ.
4. Liều lượng và cách đùng
Việc sử dụng docetaxel nên được kiềm soát bới các đơn vị chuyên khoa trong điểu tri
hóa trị liệu gây độc tế bảo vả nên được sử dụng dưới sự giám sát cúa các bác sĩ có du kinh
nghiệm về hớa trị liệu chống ung thư (xem mục “Thận trọng đặc biệt khi sử dụng”).
Mức liều khuvến cảo
Đối với ung thư cổ, đầu, dạ dảy, ung thư phối không phải tế bảo nho, ung thư vú, có
thể chi định dùng trước corticosteroid đường uống như dexamcthasone 16 mglngảy (ví dụ 8
mg/lần, 2 Iằn/ngáy) trong 3 ngảy, bắt đầu 1 ngảy trước khi dùng Docetaxel “Ebewe” trừ khi
15
có chống chỉ định (xem mục “Cảnh bảo đặc biệt và thận trọng khi sử dụng"). G-CSF dự
phòng có thế được chỉ định để Iảm giám nguy cơ độc tinh về máu.
Đổi với ung thư tiền lỉệt tuyến, khi chỉ định đồng thời prednison hoặc prednisolon với
docetaxel thi chế độ thuốc dùng trước tri liệu được khuyến cảo lả dexamethason 8 mg, uống
12 giờ, 3 giờ và 1 giờ trước khi truyền Docetaxel “Ebewe” (xem mục “Cảnh báo đặc biệt và
thận trọng khi sử dụng").
Docetaxel “Ebewe” được dùng tiêm truyền trong 1 giờ mỗi 3 tuần 1 lần. Xem chi tiết
trong mục “Thận ưọng đặc biệt khi sử dụng” về cảch chuẩn bị dung dịch tiêm truyền.
Cần cẩn trọng khi tiêm truyền để tránh thoát mạch.
Ung thư vú
Trong đỉều trị bổ trợ cho ung thư vú có hạch bạch huyết dương tính, mức liều khuyến
cảo của Docetaxel “Ebewc” lả 75mg/m2 được truyền trong | giờ sau khi dùng doxorubicin
50mg/m2 vả cyclophosphamid 500mng, mỗi 3 tuần 1 lần trong 6 chu kỳ điều trị (xem mục
điều chinh liều trong khi điều 111).
Trong điều trị bệnh nhân ung thư vú di cản 110ặ0 tỉển triền cục bộ, mức iiểu khuyến cáo
cúa Docetaxel “Ebewe” lả lOOmg/m2 trong đơn trị liệu. Trong điều trị hảng dầu, Docetaxe /
"Ebewe" 75mg/m2 dược chi đinh phối hợp với doxorubicin (50mg/mồ. ji"
Trong phối hợp với trastuzumab, mửc liều khuyến cáo cùa Docetach “Ebewe” lả
lOOmg/m2 mỗi 3 tuần | lằn, phổi hợp với trastuzumab dùng mỗi tuần. Trong một thử nghiệm
chính, Docetaxel “Ebewe” sẽ được bắt đầu tiêm truyền sau khi điểu tri liều đầu tiên cua
trastuzumab. Cảo liều kế tiếp của docetaxel được chỉ định tiêm trưyền ngay lập tức sau khi
hoản tẩt tiêm truyền trastuzumab nếu như mức liều trưởc cùa trastuzumab được dung nạp tốt.
Xem tóm tắt đặc tính sán phấm cúa trastuzumab về liều lượng và cảoh dùng trastuzumab.
Trong phối hợp với capecitabin, mức liều khuyến cáo cùa Docetach “Ebewe” lả
75mg/m2 mỗi 3 tuần 1 lần, phối hợp với capecitabin 1250mg/m2 2 Iần/ngảy (trong vòng 30
phủt sau bữa ăn) trong 2 tuần sau đó nghi 1 tuần. Xem tóm tắt đặc tinh thuốc cùa capecitabin
về việc tính liều cho capecitabin dựa trên diện tich bề mặt cơ thề.
Ung thư phối không Dha'i tế bảo nhỏ
Trên bệnh nhân ung thu phối không phải tế bảo nhỏ chưa được điểu trị bằng hóa trị
liệu, chế dộ trị liệu được khuyến cáo lả tiêm truyền Docetaxel “Ebewe” 75mg/m2 tiếp theo
ngay sau đó với cisplatin 75mg/m2 tiêm truyền trong 30-60 phủt. Đối với điều trị sau khi thất
bại với hỏa trị liệu bằng platin truớc đó, mức liều khuyến cáo lả 75mglm² docetaxel dùng đơn
đôc.
Ung thu tiền liêt tuỵến
16 ` ,J -
ỤỤ
Mức liều khuyến cảo của Docetaxel “Ebewe” lả 75mg/mẫ Prednison hoặc prednisolon
Sing dùng dường uống 2 lầnl ngảy được dùng liẽn tục (xem mục “Tính chẩt dược lục học).
Ung thư biều mô tuvển da dảv
Mức liều khuyến cáo cúa Docetaxel “Ebcwe” lả 75mg/m2 tiêm ttuyền trong 1 giờ, tiếp
theo sau 111 cisplatin 75111g/111²1111yề11 trong 1 -3 giờ (truyền cả 2 thuốc chỉ 11611g ngảy đằu 11611)
sau đó là 5-fluorouracil 750mg11112 mỗi ngảy tiêm truyền liên tục trong 24 giờ trong 5 ngảy bắt
đầu sau khi kết thúc tiêm truyền cisplatin. Liệu trinh đuợc lặp lại mỗi 3 tuẳn 1 lần. Bệnh nhân
phái được điều 111 111166 bầng thuốc chống nôn và biện phảp 1111 nước thich hợp 11111 điều 111
bằng cisplatin. Nên dùng G-CSF dự phòng đề 111… giảm bớt nguy Cơ gây độc vế mảu (xem
“Điều chinh liều lượng trong khi điều trị"),
Ung thư đầu vả cổ
Bệnh nhân phải được điều 111 trước bằng thuốc chống nôn vả có biện pháp 1111 nước
thích hợp (trước và sau khi dùng cisplatin). Có thể dùng G-CSF dự phòng đề 121… giảm nguy
cơ gây độc cho mảư. Tắt cả bệnh nhân trong cảc nhóm điều trị có docetaxel trong các nghiên ,
cứu TAX323 vả TAX324 đều được chỉ định khảng sinh dự phòng. ÍịÌJẨ/
— Hóa trị liệu gây đảp ứng tiếp theo sau là xạ trị (TAX323)
Trong trị liệu gây đâp ứng cho bệnh ung thư tế bảo vảy ở đầu và cố tiểu triến cục bộ
không phẫu thuật được (SCCHN), mức liều khuyến cảo cùa Docetaxel lả 75mg/m2 tiêm
truyền trong 1 gíờ sau đó tiêm truyền cisplatin lả 75111g/1112 hơn 1 giờ, vảo ngảy đầu tiên, sau
đó tiếp tục tiêm truyền liên tục 5-fluorouracil 'TStng/m2 mỗi ngảy trong 5 ngảy. Chế độ nảy
được chỉ định mỗi 3 111ầ11 1 1%… trong 4 chu kỳ 61è11111. Sau hóa 111 111311, bệnh nhân nên dược
điểu trị xạ trị.
' Hóa trị liệu gây đáp ứng sau đó dùng hóa xạ trị (TAX3Z4)
Trong 111 liệu gây cám ứng cho bệnh nhân ung 11111 1é bảo váy ở đầu và cố tiến 111611
cục bộ (SCCHN) (không cắt 116 được vi lý do kỹ thuật, 11 111111 năng chữa lảnh bằng phẫu thuật,
và nhằm vảo bảo tồn cơ quan), mức liều khuyến cảo cúa docetaxet tả 75mg/m2 tiêm truyền
tĩnh mạch 1 giờ vảo ngảy đầu tiên, sau đó là cisplatìn lOOmg/m2 tiêm truyền tĩnh mạch 30
phút đến 3 giờ, sau đó lả 5-fiuoroưracil lOOOmg/mỀ'ngảy tiêm truyền iiẽn tục từ ngảy ] đến
ngảy 4. Chế độ nảy được chỉ định mỗi 3 tuần 1 lần trong 3 chu kỳ điều 111. Sau hớa 111 liệu,
bệnh nhân được điều trị hớa xạ trị. Dế chinh liều của cisplatin vả 5-fiuorouracil đề nghị xem
tóm tắt đặc tinh cùa cảc dược phẳm nảy.
Điếu chinh liều trong khi điều tri
Tống gưảt
l'7
Docetaxel “Ebewe” nên đuợc chi dịnh khi số lượng bạch cằu trung tính ì 1.500 tế
bảolmm’. Đối với bệnh nhân bị giảm bạch cầu trung tính gây sổt hoặc số lượng bạch cầu
trung tính < 500 tể bảo/mm3 trong hơn 1 tuần, h0ặc cỏ phán ứng da tich lũy hoặc nặng hoặc
bệnh thần kỉnh ngoại biên nặng trong suốt liệu trình điều trị bằng Docetaxel “Ebewe”, mức
iiểu cúa Docetaxel “Ebewe” nên được giám từ lOOmg/m2 xuống 75mg/m2 vảlhoặc tù
75mglm2 xuống 60mg/mz. Nếu bệnh nhân tiếp tục có những phán ứng nảy ở liều 60mg/m2
việc điểu trị nên được ngừng lại
Liêu Dháp đỉều 111 116116 cho une 11111 vú
Trong một thư nghiệm chính, các bệnh nhân được điều trị bổ trợ ung thư vú và có biến
chứng giảm bạch cầu trung tính (bao gổm giảm bạch cầu trung tính kéo dải, giảm bạch cẳu
trung tính gây sổt, hoặc nhiễm trùng) được khuyến cảo sư dụng G-CSF để dự phòng (chằng
hạn ngảy 4 đển ngảy 1 1) trong tất cả các chu kỳ điều trị tiếp theo. Nếu bệnh nhân tiếp tục gặp
các phán ứng nảy thì nên duy tri sư dụng G-CSF và mức iiều của docetaxel nên giảm xuống
60mg/111².
Tuy nhiên, trên thực tiễn lãm sảng hiện tượng giảm bạch cầu trung tinh có thể xảy ra
sớm hon. Vì vậy việc sư dụng G-CSF nên được xem là việc cẩn thiểt về nguy cơ giảm bạch
cầu trung tính cúa bệnh nhân và của các khuyến nghị hỉện nay. Bệnh nhân bị viêm miệng mức
độ 3 hoặc 4 nên giám liều xuống 60mg/mẤ IM
Trong 111161 hgp với cisglạtin
Đối với bệnh nhân đã được đinh iiều Docetaxel “Ebewe” ngay ban đầu lả 75mglm2
phối hợp với cisplatin và bệnh nhân có lượng tiểu cầu thẳp nhắt trong suốt quá trinh điểu trị
trước đó lả < 25.000 tế bzto/mm3 hoặc bệnh nhân đã tùng bị giám bạch cầu trung tính gây sốt
hoặc bệnh nhân có độc tinh không thuộc huyết học nghiêm trọng, mức liều Docetaxei
“Ebewe” trong các chu kỳ tiếp theo nên giám xuống 65mgim². Để điều chinh liều của
cisplatin đề nghị xem tỏm tắt đặc tính thuốc của cisplatin.
Trong ohối hơn với capecitabin
0 Để điều chinh liều của capecitabin, xin xem tóm tắt đặc ttnh thuốc cúa
capecitabin.
' Đối với bệnh nhân xuất hiện các dắu hiệu ban đầu cùa độc tính cấp 2 và vẫn tiếp
diễn trong quá trình điều trị Docetaxel “Ebewe” capecitabin tiếp theo, trì hoãn
điều 111 cho đến khi khắc phục đuợc chi còn cắp độ 01 sau đó khôi phục lại 100%
liều lượng ban đẫu.
. Đối với bệnh nhán xuất hiện dấu hiệu thứ phát cưa độc 111111 cắp 2 hoặc dấu hiệu
ban đầu cúa độc tính cẩp 3 tại bất kì thời điềm nảo trong suốt chu kỳ điều trị, tri
18
/
hoãn điều 111 cho đến khi khắc phục được độc tinh chi còn cấp độ 0-1, sau đó tiểp
tục điểu trị bằng Docetaxel “Ebewe” 55mglm²
0 Khi xuất hiện các dẩu hiệu đến sau của độc tính hoặc bất kì một biến hiện nảo của
độc tính cắp 4, ngừng điều trị bằng Docetaxel “Ebewe”.
Để điều chinh liều cùa trastuzumab, xem tóm tắt đặc tinh sán phầm của trastuzumab.
Ifflmgỵhối hgp v61 cisglatin vả 5-fìuorouracil
Nếu một giai đoạn cùa gỉa'm bạch cầu trung tính gây sốt, giảm bạch cầu trung tính kéo
dải hoặc giảm bạch cẩu trung tính gây nhiễm khuấn xảy ra mặc dù có sư dụng G—CSF , mức
lỉều cùa Docetaxel nên giảm từ 75mg/m2 xưống 60mglm². Nếu cảc giai đoạn tiếp theo của
giảm bạch cầu trung tính có biến chứng xảy xa thì mức liều cùa Docetaxel “Ebewe” cần giảm
từ 60 xuống 4Smg/mẮ Trong trường hợp gỉảm tiếu cầu mức độ 4 mức liều của Docetaxel
“Ebewe” nên giám từ 75 xuống 60 mg/mz. Bệnh nhân không nên điều trị tiềp bằng Docetaxel
“Ebewe” trong các chu kỳ tiếp theo cho đển khi số lượng bạch cầu trung tính khôi phục lại
đến mức > 1.500 tế bảo/mm3 và số 1ượng tiều cầu khôi phục lại đến mức > 100.000 tế
bảo/mmẵ Ngừng điểu trị nểu các độc tinh nảy kéo dải (xem mục “Cánh báo đặc biệt và thận
trọng khi sử dụng”). [I1111ĩ1/
Điều chỉnh mức liều khuyến cảo đựa vảo độc tính 11611 bệnh nhân điều 111 bầng
Docetaxel “Ebewe” phối hợp với cisplatin vả 5-fluorouracil (S-FU):
Độc 111111 Điều chỉnh liểu
Tiêưễhảy mức độ 3 Giai đoạn 1: giám 20% liều 5—FU
Giai đoạn 2: sau đó giảm 20% liếu Docetaxel “Ebewe”
Tiêu chảy mức độ 4 Giai đoạn 1: giam 20% liều Docetaxel “Ebewe” vả 5—F U
Giai đoạn 2: ngừng đỉều 111
Viêm miệng/ viêm niêm Giai đoạn 1: giám 20%1iểu 5-FU
mạc mức độ 3 Giai đoạn 2: ngừng điều tri bằng 5-FU ở tẩt cả các chu kỳ điều trị tiếp
theo.
Giai đoạn 3: giám 20% liều Docetaxel “Ebewe”
v16111 miệng/ viêm niêm Giai đoạn 1: chi ngừng 61è11 111 5-FU cùa 1ả1 cả cảc chu kỳ điều 111
mạc mức độ 4 tiếp theo.
Giai đoạn 2: giám 20% liều Docetaxel “Ebewe”
Đế chinh liều cúa cisplatin vả 5-fluorouracil, xem tóm tắt đặc tỉnh thuốc của cảc thuốc
nảy.
Trong cảc thử nghiệm SCCHN chính, bệnh nhân bị giám bạch cầu trung tinh có biến
chứng (bao gồm gìám bạch cằu trung tính kéo dâi, giám bạch cầu trung tinh gây sốt hoặc
19
ACm Ii` _, 1y11,
nhiễm khuẩn) đuợc khuyến cáo sử dụng G-CSF để dự phòng (ví dụ ngảy 6-15) trong tất cả
các chu kỳ điểu trị tiểp theo.
Bênh nhân bị suv chức năng gan:
Dựa trên các dữ liệu dược động học với docetaxel lOOmg/m2 lá thuốc điều trị duy
nhất, bệnh nhân bị tăng transaminase (ALT vảlhoặc AST) cao gấp 1,5 lần nổng độ giới hạn
trén của mức bình thường (ULN) vả alkaline phosphatase gấp 2,5 lần ULN, 1111 mửc liều
khuyến cảo cùa docetaxel lả 75mg/m2 (xem mục “Cánh báo đặc biệt vả thận trọng khi sử
dụng” và “Tinh chất dược động học”). Đối với bệnh nhân có bilirubin huyết thanh > ULN
vảlhoặc ALT vả AST > 3,5 lần ULN có liên quan 161 alkaline phosphatase > 6 lẫn ULN, chỉ
sử dụng docctaxel khi có chỉ định nghiêm ngặt. Trong phối hợp với cisplatin vả 5—tìuorouracil
đề điểu trị bệnh nhãn ung thư biếu mô tuyến dạ dảy, thử nghiệm lâm sảng chính đã loại trừ
các bệnh nhân có ALT vả/hoặc AST > 1,5 lần ULN kểt hợp với alkaline phosphatase > 2,5
lần ULN vả bilirubin > ULN; đối với những bệnh nhân nảy chi sủ đụng docetaxel khi có chỉ
định nghiêm ngặt. Không có dữ liệu về bệnh nhân bị suy giảm chức náng gan điều 111 bằng
docetaxel phối hợp trong các chi đinh khác.
Dược phẩm nảy bao gồm 27% thể tích lả ethanol (cồn). Điều nảy phái được cân nhắc
ớ nhỏm có nguy cơ cao như cảc bệnh nhân bị bệnh gan. l
Bênh nhân bi suv chức năng thân Piì
Không có dữ liệu về cảc bệnh nhân bị suy chức nảng thận nặng được điều trị docetacel
Tre em vả tre“ vi thảnh niên
Docetaxel “Ebewe” không được khuyến cáo sử dụng ở trẻ em do không đủ dữ liệu về
an toản vả hiệu quả cúa thuốc.
Người giả
Dựa ưẻn các phân tích dược động hỌc quần thể, không có chi dẫn đặc biệt về sử dụng
thuốc nảy ở người giả. Khi phối hợp với capccitabin cho bệnh nhân 60 tuối hoặc hơn, khuyến
cảo giảm mủc liều ban đầu của capecitabin xuống 75% (xem tỏm tắt đặc tính thuốc cùa
capecitabin).
s. Chống chỉ định
- Mẫn cám với hoạt chắt chinh hoặc bất kì thảnh phần nảo cưa thuốc
- Docetaxel “Ebcwe” không được chi đinh cho bệnh nhân lủc bắt đẩu điều trị đã có
số lượng bạch cằu trung tính < 1500 tế bảolmma.
- Docetaxel “Ebewe” không được chi định cho phụ nữ có thai vả cho con bú (xem
mục “Phụ nữ mang thai vả cho con bú”).
20
- Docetaxel “Ebewe” không được chi định cho bệnh nhân bị suy chưc năng gan nặng
vì không có dữ tiệu chứng minh (xem mục “Liều lượng vả cảch dùng” vả “Cánh báo
đặc bỉệt và thận trọng khi sử dụng”).
~ Cảc chống chỉ định cùa các dược phẩm khảo cũng được áp dụng khi điều trị phối
hợp với docetaxel.
6. Tác dụng không mong muốn
Các phản ứng bất lợi có thể xảy ra hoặc có thể có liên quan tởi việc đỉều trị bằng
docetaxel đã được thu thập trên:
0 1312 vả 121 bệnh nhân được điều trị bằng docetaxel đơn trị liệu lOOmg/m2 vả
75mg/m2 tương ứng.
0 258 bệnh nhân điều trị với docetaxcl phối hợp doxorubicin.
. 406 bệnh nhân điều 111 với docctaxel phối hợp cisplatin.
o 92 bệnh nhãn được điểu trị với docetaxel phối hợp trastuzumab
9 255 bệnh nhân được điều trị với docetaxel phối hợp capecitabin
' 332 bệnh nhân được điều trị với docetaxel phối họp prednisone hoặc prednisolon
(các phản ứng bất lợi trên lâm sảng quan trọng, liên quan đến điểu trị đã được bảo
cảo) AVỊA/
0 744 bệnh nhân được điều trị docetaxel phối hợp doxorubicin vả cyclophOSphamid
(cảc phán ứng bất lợi trên lâm sảng, quan trọng, tiên quan đến điều trị được báo
cáo)
0 300 bệnh nhân ung thư biểu mô tuyến dạ dảy (221 bệnh nhân ở pha Il] cùa nghiên
cứu vả 79 bệnh nhân 0 pha II) được điểu trị docetaxel phối hợp với cisplatin và 5-
tiuorouracil (các phán ưng bất lợi trên lãm sảng, quan trọng, liên quan đến điều trị
được bảo cảo)
. 174 và 251 bệnh nhân ung thư đầu vả cố duợc điểu 111 docetaxel phối hợp với
cisplatin vả 5-fiuorouracit (cảc phán ứng bất lợi trên iâm sảng, quan trọng, 1iên
quan đển điều trị được báo cảo).
Các phản ứng được mô tả dụa trên cảc tiêu chuẩn về độc tinh chung NC! (NCI Common
Toxicity Criteria) (mức độ 3=G3, mức độ 3—4=G3l4, mức độ 4=G4) vả các thuật ngữ
COSTART. Các tần sưẩt được định nghĩa như sau: rẳt thường gặp (2 1/10), thường gặp (2
1/100), < 1l10), không thuờng gặp (2 1/1.000, < 1/100), hiếm gặp (> 1/10.000, < 1/1.000), rất
hiếm gặp (< 1110.000).
Trong mỗi nhớm tần suất, các tác dụng không mong muốn được trinh bảy theo mức
trầm trọng giảm dần. Các tảc dụng không mong muốn phổ biến nhất cùa docatexel dùng đơn
21
trị iiệu lả: giảm bạch cầu trung tinh (có thể hồi phục và không tích lũy, khoáng thời gian trung
binh đến lủc luợng bạch cầu trung ttnh ở mức thấp nhất là 7 ngảy vả khoảng thời gian trung
bình bệnh nhân bị giám bạch cầu trung tính nặng (< 500 tế bảo/mml) lả 7 ngảy, thiếu mảu,
rụng tóc, buốn nôn, nôn, viêm mìệng, tiêu cháy và suy nhược. Mức độ nặng của cảc biến cố
bẩt lợi của docetaxel có thế tảng khi docetaxel được dùng phối hợp với các thuốc hớa trị liệu
khác.
Trong phối hợp trastuzumab, các phản ứng bắt lợi (tắt cả các mức độ) được báo cảo ì
10% số bệnh nhân. Có sự gia tăng 11 16 mắc cảc phán ứng 11á1 lợi nghiêm trọng (40% so với
31%) và cảc phán ứng bắt lợi mức độ 4 (34% so với 23%) trong nhóm điểu trị phối hợp với
trastuzumab so với điều trị docetaxel đơn trị liệu.
Trong phối hợp với capecitabin, các tác dụng không mong muốn thường gặp nhắt có
iiên quan đến điều 111 (E 5%) báo cảo trong thử nghiệm pha 111 ở bệnh nhân ung 11… Vũ thất
bại với điều trị bằng anthracyclin được đưa ra (xem tóm tắt đặc tinh thuốc cúa capecitabin).
Thường thấy các phán ứng bất lợi sau đây cùa docetaxel:
Rối Ioan hê thằn kinh
Cần phái giảm liều khi thắy xuất hiện các độc tính thần kinh ngoại biên nặng (xem
mục “Liều lượng và cách dùng” và “Cảnh bảo đặc biệt và thận trọng khi sử dụng”). Các triệu
chứng thần kinh cảm giác từ nhẹ đến trung binh được mô tả như lá dị cám, loạn cám hoặc đau
bao gồm nớng rát. Các biến cố trên thần kinh vận động được mô tả chủ yếu là yếu sức cơ.
Rối loan mô da vả dưới đa
Đã quan sát được cảc phán ứng da có thể phục hổi và có mức độ từ nhẹ đến nặng. Cảo
phản ứng được mô tả như ban bao gồm phát ban cục bộ chủ yếu ớ bản chân và bản tay (bao
gồm hội chứng bản chân vả bản tay nặng) nhưng cũng có trên cánh tay, mặt hoặc ngực và
thường kèm với ngứa. Phảt ban thường xay ra trong vòng 1 tuần sau khi tiêm truyền
docetaxel. Ít gặp hơn là các triệu chứng nậng như phát ban theo sau bới bong tróc da hiếm khi
lảm gián đoạn hoặc ngừng điều trị docetaxei (xem mục “Liều lượng và cảch dùng” và “Cảnh
bảo đặc biệt và thận trọng khi sử dụng"). Các rối loạn móng nặng được miêu ta như giám sắc
tế hoặc tăng sắc tố, đôi khi bị đau và bong mỏng.
Các rối loan toản thân vả các ghản ứng tai chỗ tiêm
Các phán ứng tại chỗ tiêm thuờng nhẹ và gồm có tăng sắc tổ, viêm, đó hoặc khô da,
viêm tắc tĩnh mạch hoặc thoát mạch vả sưng phù tĩnh mạch. Ú' dịch bao gồm các hiện tượng
như phù ngoại biên, ít phố biển hơn là trản dịch mảng phổi, trản dịch mảng tim, cổ trướng vả
tăng cân. Phù ngoại biên thường 1161 đầu ở chi dưới và có thể trở thảnh phù toản thân với khối
22
luợng cơ thể tãng đễn 3kg hoặc hơn. Sự ứ dịch là tích lũy về mức độ nặng cùa bệnh vả tỉ lệ
mắc bệnh (xem mục “Cảnh báo đặc biệt và thận trọng khi sử dụng”).
Rối loan hệ thống miễn dich
Các phản ứng quả mẫn thường xảy ra trong vòng một vải phút sau khi bắt đầu tiêm
truyền docetaxel vả thường từ mủc độ nhẹ đến trung binh. Các triệu chứng được báo cáo phổ
biến nhẩt là cơn nóng bừng, phát ban kèm hoặc không kèm ngứa, đau thắt ngực, đau lưng,
khó thở và sốt hoặc rét run. Các phản ứng nặng được mô tả như hạ huyềt ảp vả/hoặc co thẳt
phế quản hoặc phát ban/ban đò toản thân (xem mục “Cánh báo đặc bỉệt và thận trọng khi sử
dụng).
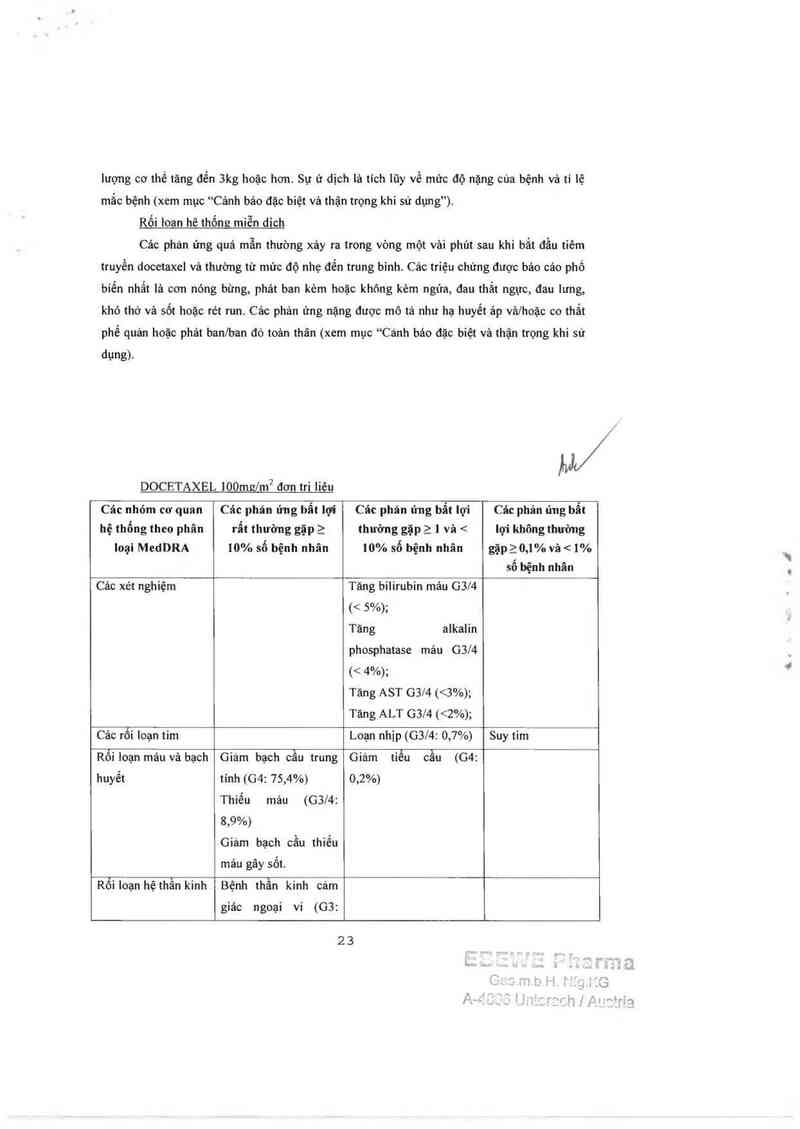
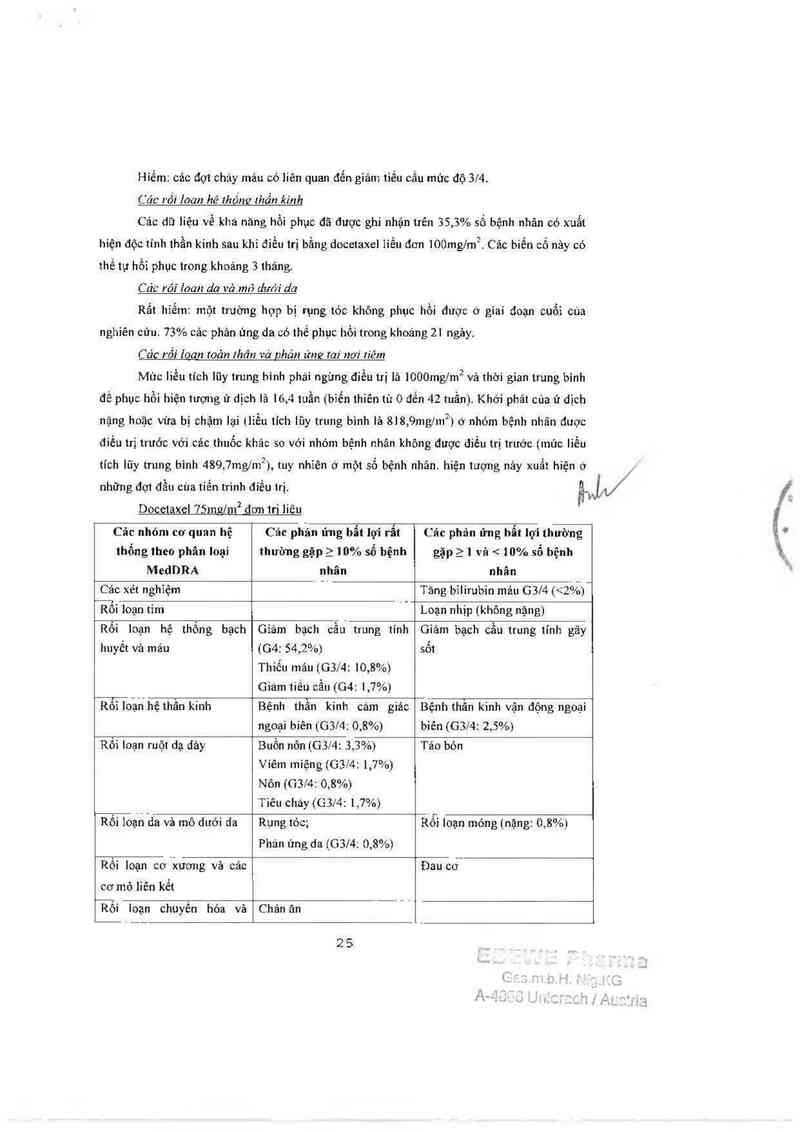
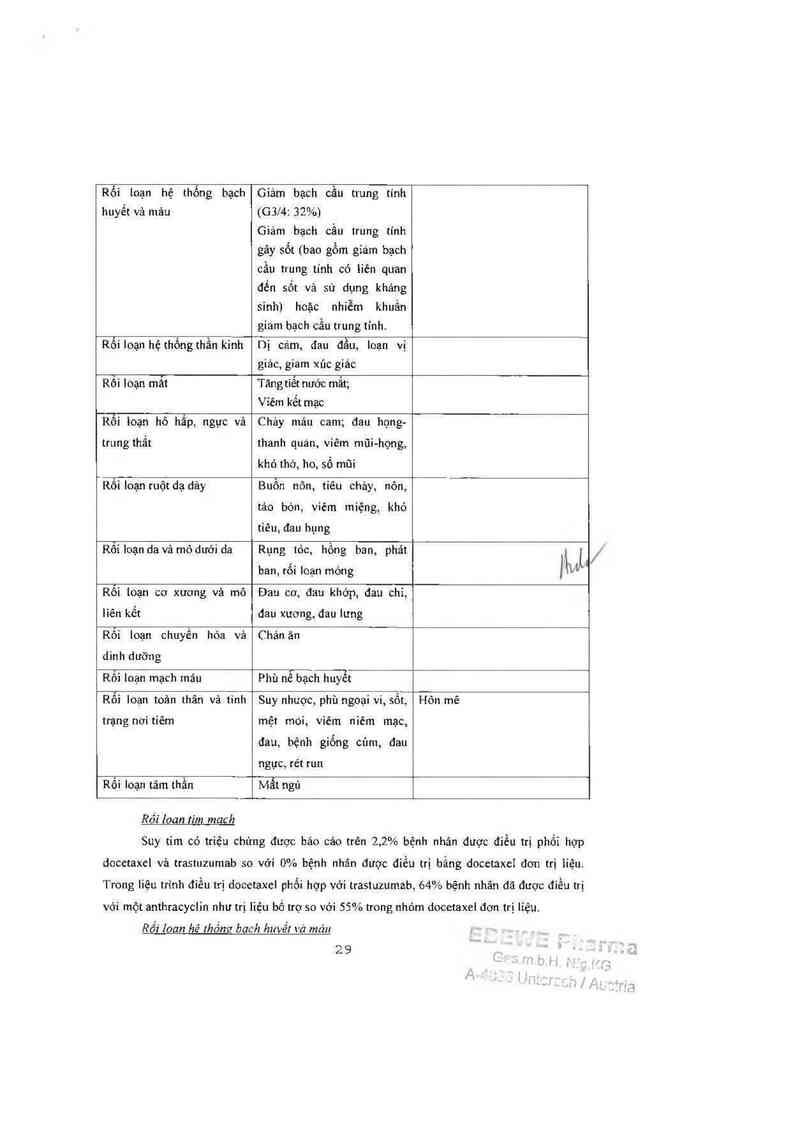
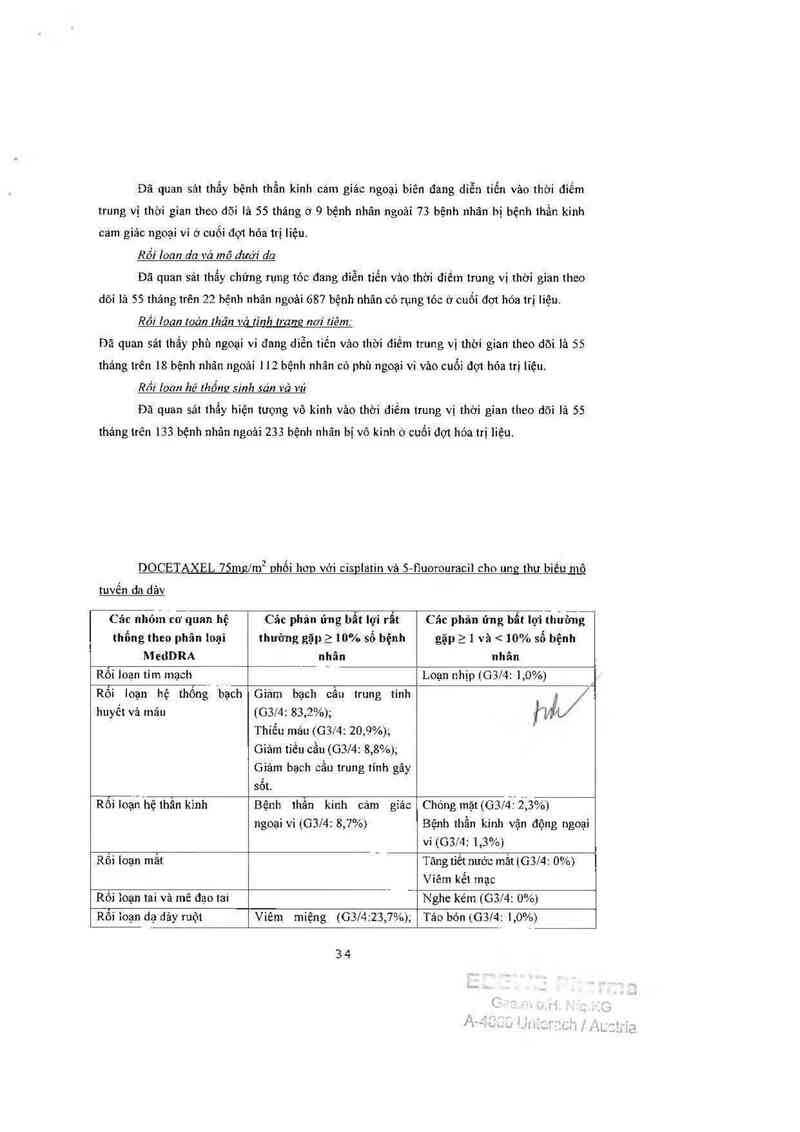
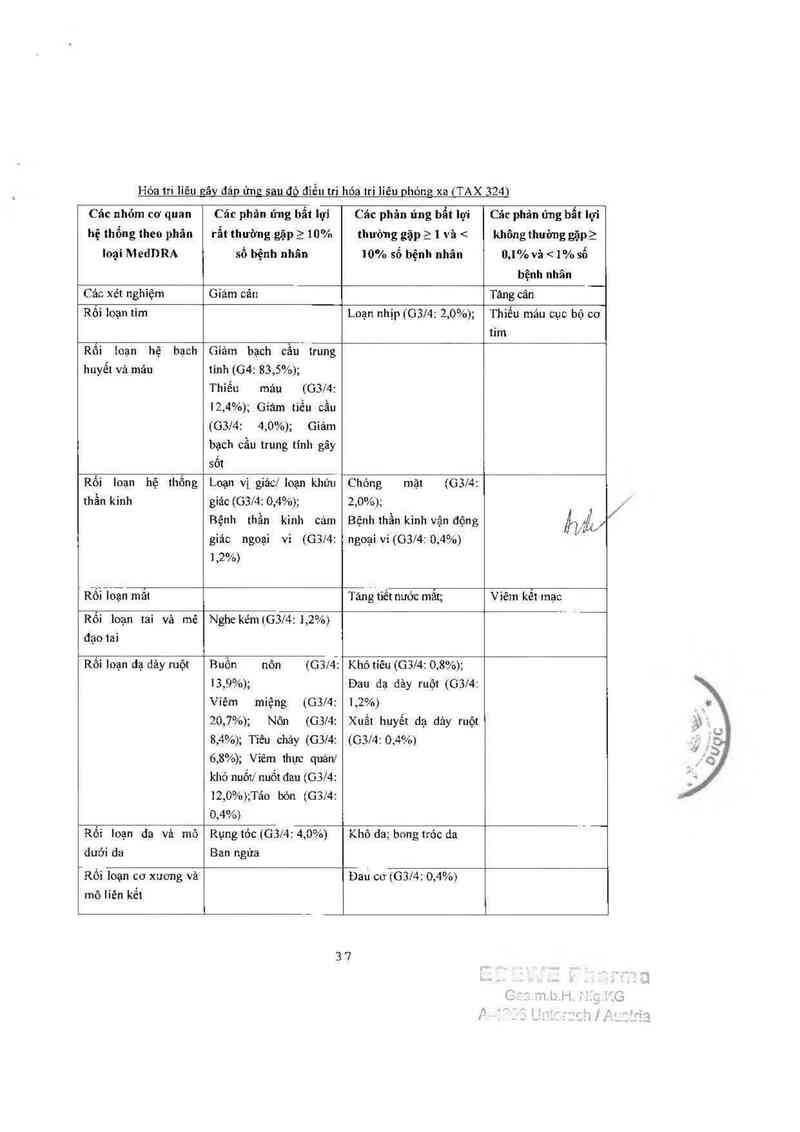
DOCETAXEL lOOmzlm² đơn tri liêu
)1/
Các nhỏm cơ quan Các phán ửng 11111 11Ỉ" Các phản ứng 11111 lợi Các phản ứng 11111
hệ thổng theo phân rẩt thường gặp 2 thường gặp 2 1 và < lợi không thường
Ioại MedDRA 10% số bệnh nhân 10% số bệnh nhãn gặpầ 0,1% và < 1%
sô bệnh nhân
Các xét nghiệm Tăng biiirubin mảư G3l4 _
(< 5%);
Tăng alkalin
phosphatase máu G3l4
(< 4%);
Tăng AST 0314 (<3%);
Tăng ALT G3/4 (<2%);
Cảc rỗi Ioạn tim Loạn nhịp (GSM: 0,7%) Suy tini
Rỗi loạn máu vả bạch Giảm bạch cầu trung Giảm tiểu cầu (04:
huyết tính (04: 75,4%) 0,2%)
Thiếu máu (G3l4:
8,9%)
Giảm bạch cầu 1111é11
máu gây sốt.
Rối ioạn hệ thần kinh Bệnh thần kinh cảm
giác ngoại vi (GB:
2 3
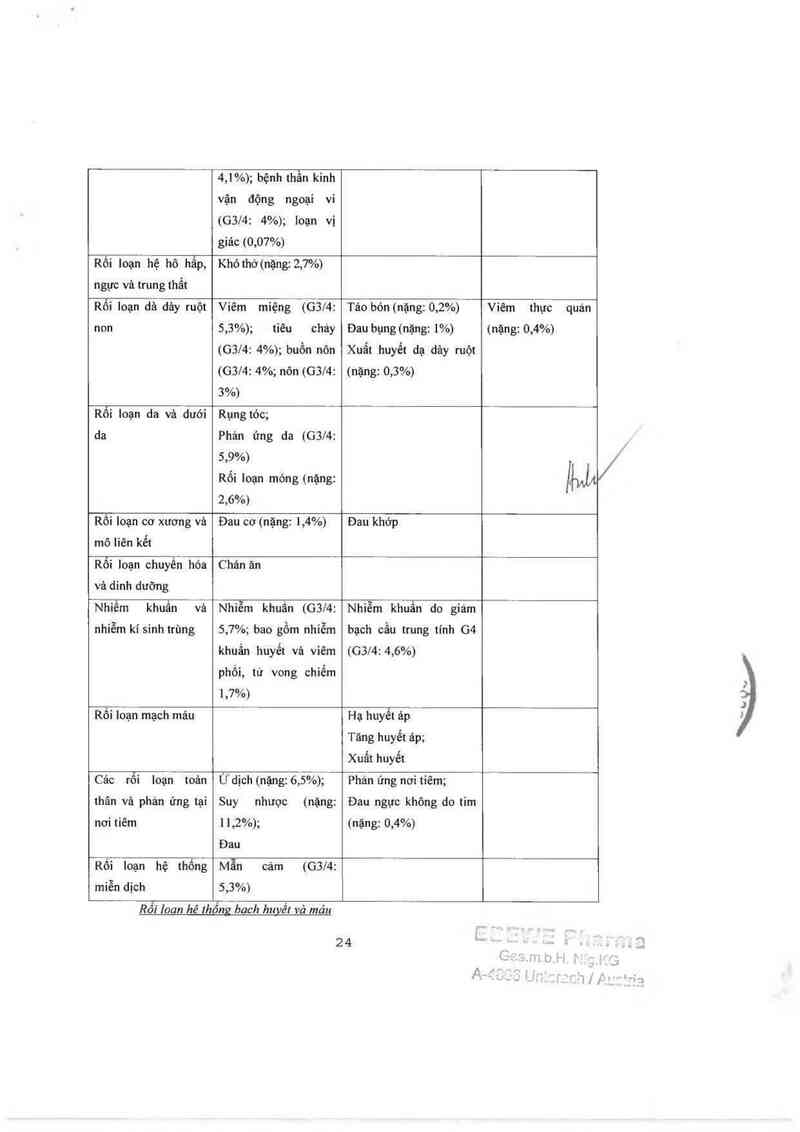
,.
lJ1' ,
4,1%); bệnh thằn kinh
vận động ngoại
(G3/4: 4%); 1oạn vi
giâc (0,07%)
vi
Rồi Ioạn hệ hô hấp›
ngực và trung thẩt
Khó thớ (nặng: 2,7%)
Rối loạn dã đảy ruột
non
Viêm miệng (C13/4:
5,3%); cháy
(G3/4: 4%); buồn nôn
(G3l4: 4%; nôn (G3l4:
3%)
tiêu
Tảo bón (nặng: 0,2%)
Đau bụng (nặng: 1%)
(nặng: 0,3%)
Xuất huyết dạ dảy ruột
Viêm thực quán
(nặng: 0,4%)
Rối loạn da vả dưới
da
Rụng tớc;
Phản ứng da (G3/4:
5,9%)
Rối loạn móng (nặng:
2,6%)
Rối loạn cơ xương và Đau cơ (nặng: 1,4%) Đau khởp
mô liên 11é1
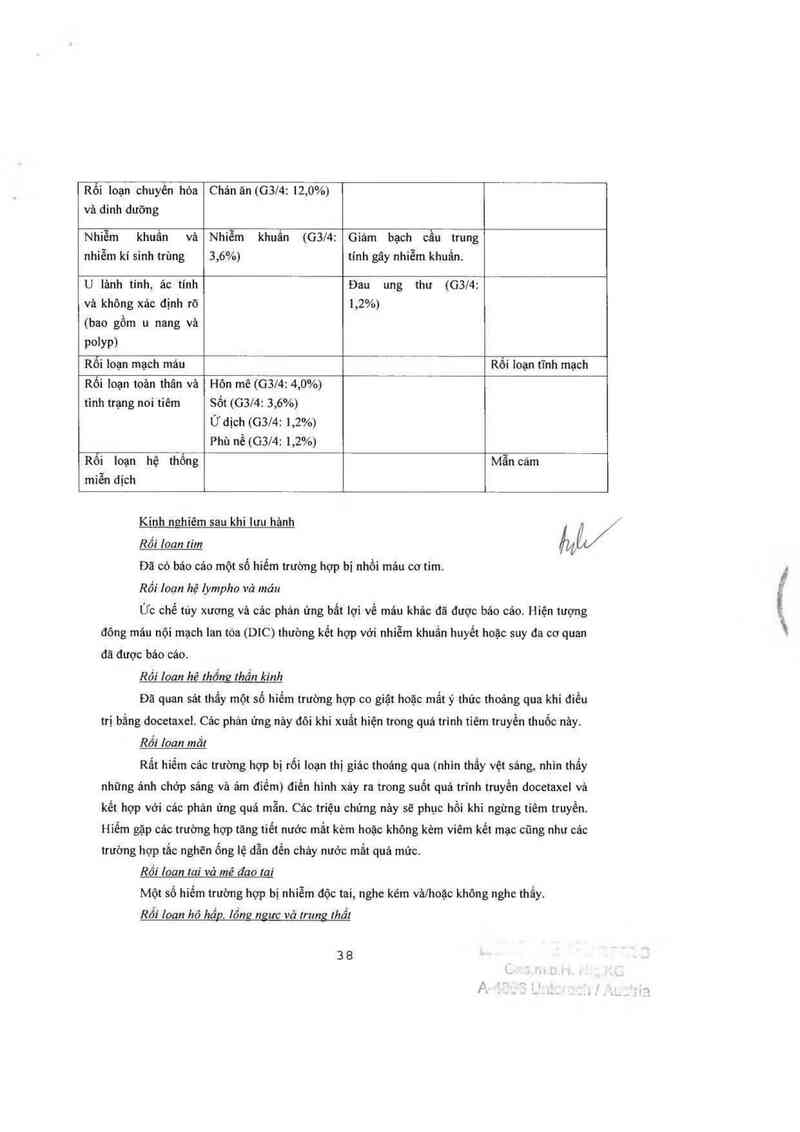
Rối loạn chuyền hóa Chán ăn
vả dinh dưỡng
Nhiêm khuẩn và Nhiễm khuẩn (G3/4: Nhiễm khuẩn do giảm
nhiễm kí sinh trùng
5,7%; bao gồm nhiễm
khuẩn huyết vả viêm
phổi, tử vong chiếm
1,7%)
(G3/4: 4,6%)
bạch cầu trung tinh 04
Rối Ioạn mạch máu Hạ huyết áp
Tăng huyết ảp;
Xuất huyết
Các rối Ioạn toân Ửdịch (nặng: 6,5%); Phản ứng nơi tiêm;
thân và phản ứng tại Suy nhược (nặng: Đau ngực không do tim
nơi tiêm 1 1,2%); (nặng: 0,4%)
Đau
Rối loạn hệ thống Mẫn cảm (G3l4:
miễn dịch 5,3%)
Rỗi loan hê Ihống bach huỵếl và máu
24
Hiếm: các đợt chùy máu có liên quan đến giảm tiếu cầu mức độ 37'4.
Các rối Ioan hê ihốrm thẳn kinh
Các dữ liệu về khả năng hối phục đã được ghi nhận trên 35,3% số bệnh nhăn có xưắt
hiện độc tính thần kinh sau khi điều trị bằng đocetaxel liều đơn 100mglm². Cảc biến cố nây có
thể tự hồi phục trong khoảng 3 thảng.
C ác rỏi Ioan da vả mô dirởi' da
1161 1116111: một truờng hợp 111 rụng tóc không phục 1161 được 6 giai đoạn cuối cùa
nghiên cứu. 73% các phản ứng da có thể phục hồi trong khoảng 21 ngảy.
Cảc rối Ioan roản Ihản vả ghán ửng lai nơi ir'ẻm
Mức Iiểu tich lũy trung hinh phải ngừng đỉếu trị lả 1000mg/m2 và thời gỉan trưng bỉnh
dể phục 1161 hiện tượng 11 dịch 111 16,4 tuần (bìến thiên 111 0 11611 42111611). Khởi phảt của 11 dịch
nặng hoặc vùa bị chậm lại [liếu tich lũy trung bình lả 818,9n1g/1112) (3 nhóm bệnh nhân đuợc
điếu trị truớc với cảc thuốc khảo so vởi nhóm bệnh nhân không được diếu trị trước (mức lỉềư
tích lũy trưng bình 489,7111g/1112), tuy nhĩên ớ một số bệnh nhân. hiện tượng nảy xuất hiện ớ
những đợt đầu cùa tiến trinh điều trị. @“mlA/
1
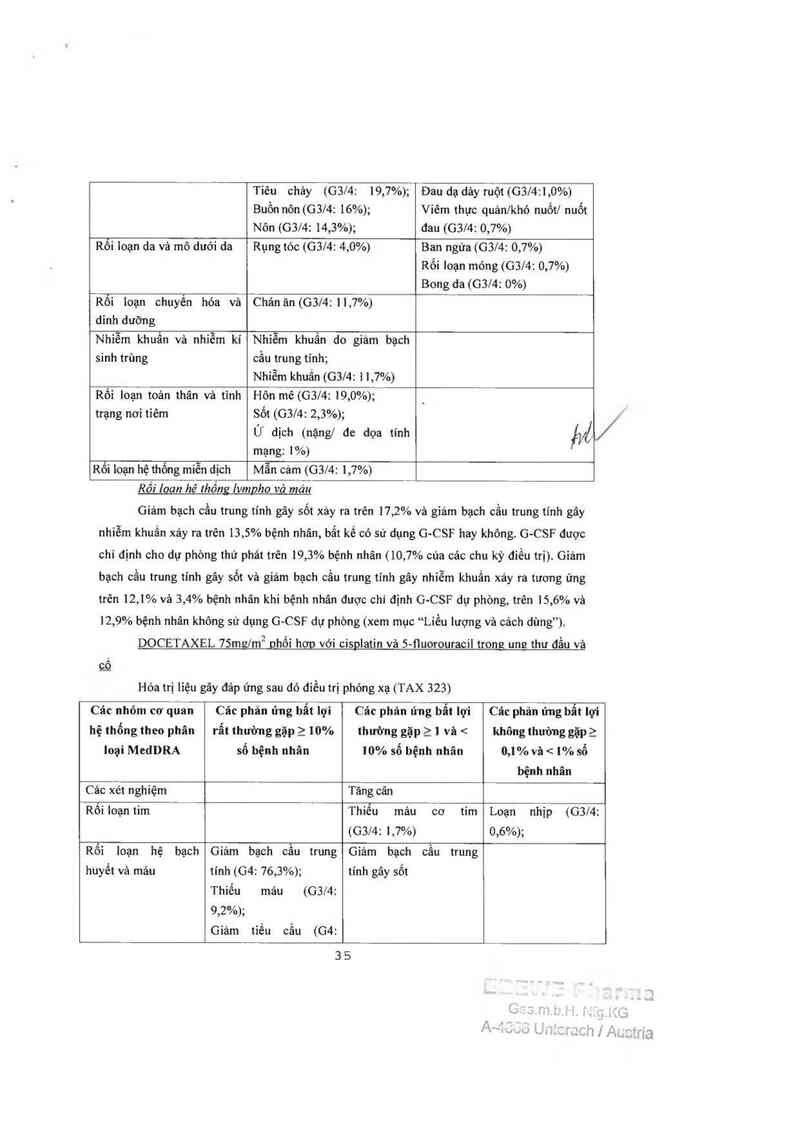
Docetaxel 7511127’1112 đơn tri liêu
Cảc nhỏ… co' quan hệ
thổng theo phân loại
MedDRA
Cảc phần úng bẩt lợi rẩt
thường gặp 2 10% số bệnh
nhân
Cảc phản ứng 1161 lợi thường
gặp 21 và <10% số bệnh
nhân
Các xét nghiệm
Tãng bỉlirubin máu G374 (<2%)—
Rôi loạn tim
Loạn nhịp (không nậng)
Rối loạn hệ thống bạch
huyêt và máu
Giảm bạch cầư trung tính
(64: 54,2%)
Thiếu máu (G3/4: ]0,8%)
Giám 11611 cầu (G4: 1,7%)
Giảm bạch cầu trung tính gây
sốt
1161 1111111' hệ thân kinh
Bệnh thằn kinh cảm giảc
ngoại biên (G3l4: 0,8%)
Bệnh thần kinh vận động ngoại
biên (G3/4: 2,5%)
Rối loạn ruột dạ dảy
1311611 nôn (G3/4: 3,3%)
Viêm miệng (G3f4: 1,7%)
Nỏn (G3/4: 0,8%)
Tiêu cháy (G3/4: 1,7%)
Táo bón
Rối ioạh“6a vả 1116 dưới 1111
Rụng tóc;
Phán ứng da (G3f4; 0,8%)
Rỗi loạn móng (nặng: 0,8%)
Rối loạn cơ xương vả các
cơ mô liên kết
Đau cơ
Rối Ioạn chuyên hóa và
Chản ăn
25
dinh duõng
Nhiễm 111111ầ11 vả 11111ẽ111111
Nhiễm khuẩn (G3/4: 5%)
dịch
sinh trùng
Rối ioạn mạch máu Hạ huyết ảp
Rối loạn toản thân và tình Suy nhược (nặng: 12,4%)
trạng nơi tiêm Ử dịch (nặng: 0,8%)
Đau
Rối loạn hệ thống miễn Mẫn cảm (không nậng)
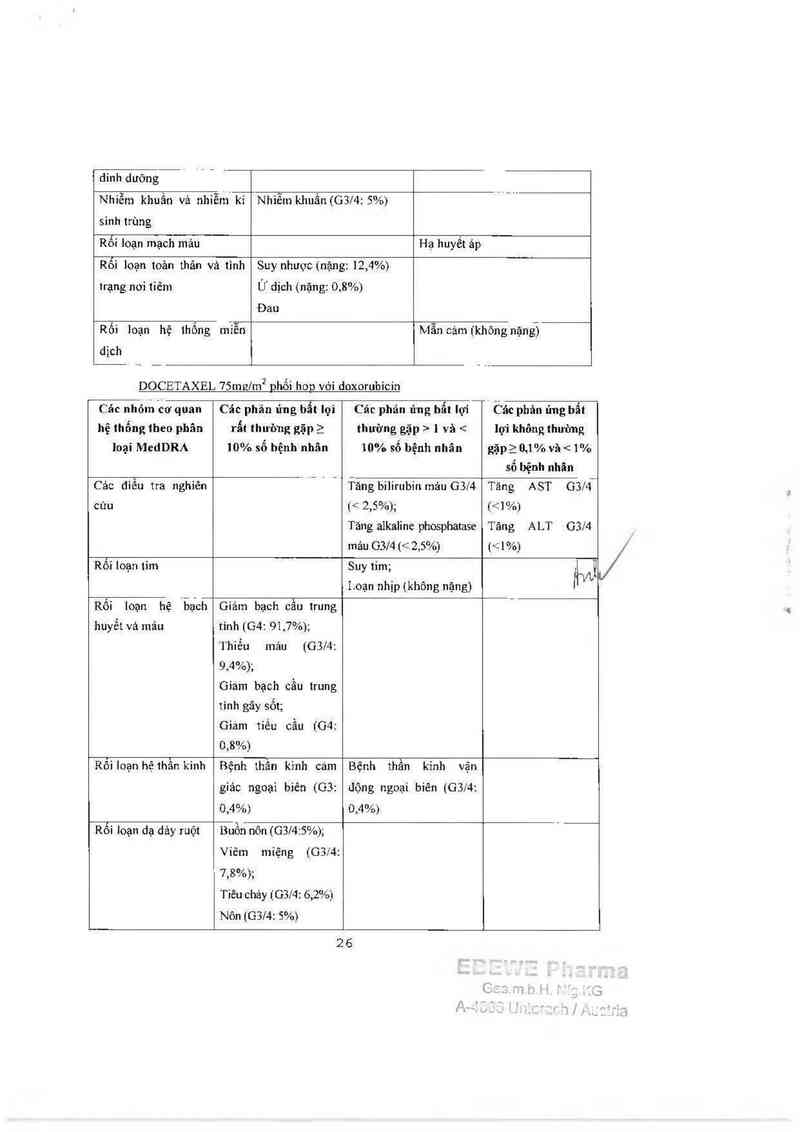
DOCETAXEL 75m117m² 111161 hop với đoxorubỉcin
Cảc 11116111 cơ quan
hệ thống theo phân
loại MedDRA
Các phãn ửng bẫt lợi
rẫt thường gặp 2
10% số bệnh 11111111
Cảc điểu 1111 nghiên
cứu
Các phản ửng 1161 lợi _
thuờng gặp > ] vả <
10% số hệnh nhân
Ễác phân úng bẩt
lợi không thnờng
gặpZ 0,1% và < 1%
số bệnh nhãn
1`ăng bilirubin mảư G31'4
(< 2,5%);
Tăng atkaline phosphatase
mảư 03/4 (< 2,5%)
Tăng AST G374"
1<1%)
Tảng ALT G3/4
Rôi loạn tim
Suy tim;
Loạn nhịp (không nặng)
1<1041
11171i
` Rối 'Bạ'ch
huyễt vá mảư
loạn hệ
Giảm bạch cầu trưng
111111 (134: 91,7%);
'l`hiếu (G314:
9,4%);
Giám bạch cầu trung
mảư
tinh gâysốt;
Giam tiếu cầu (04:
0,8%)
Rối loạn hệ thẫn kinh
Bệnh thân kinh cám
giảc ngoại biên (63:
0,4%)
Bệnh thần kỉnh vặn
dộng ngoại biên (G3/4:
0,4%)
1161 loạn dạ dảy 11161
Buồn nôn (G3/4:5%);
Viêm miệng (G3/4:
7,8%);
Tiệu cháy (G374: 6,2%)
Nôn (13374: 5%)
26
1"
Táo bỏn
Rôi loạn da và mô
dưới da
Rụngtóc;
Rối loạn móng (nặng:
0,4%);
Phản ứng da (không
nặng)
Rôĩ loạn cơ xương và
mô ]íên kêt
RỂi loạn chuyển hóa
vả dinh dưỡng
Đau cơ
Chản ãn
Nhiễm khuẩn và
nhíễm kí sinh trùng
Nhiễm khuẳn (G3/4:
7,8%)
Rôi loạn mạch mảư
Hạ huyết ảp
Rối loạn toân lhãn vả
tình trạng nơi tiêm
Suy nhược .. (nặng:
8,1%)
Ửdịch(nặngz 1,2%)
Đau
Phản úng tại chỗ tỉêm
FRỗí loạn hệ thống
miễn dịch
Mẫn cám (<3314:1,2%)
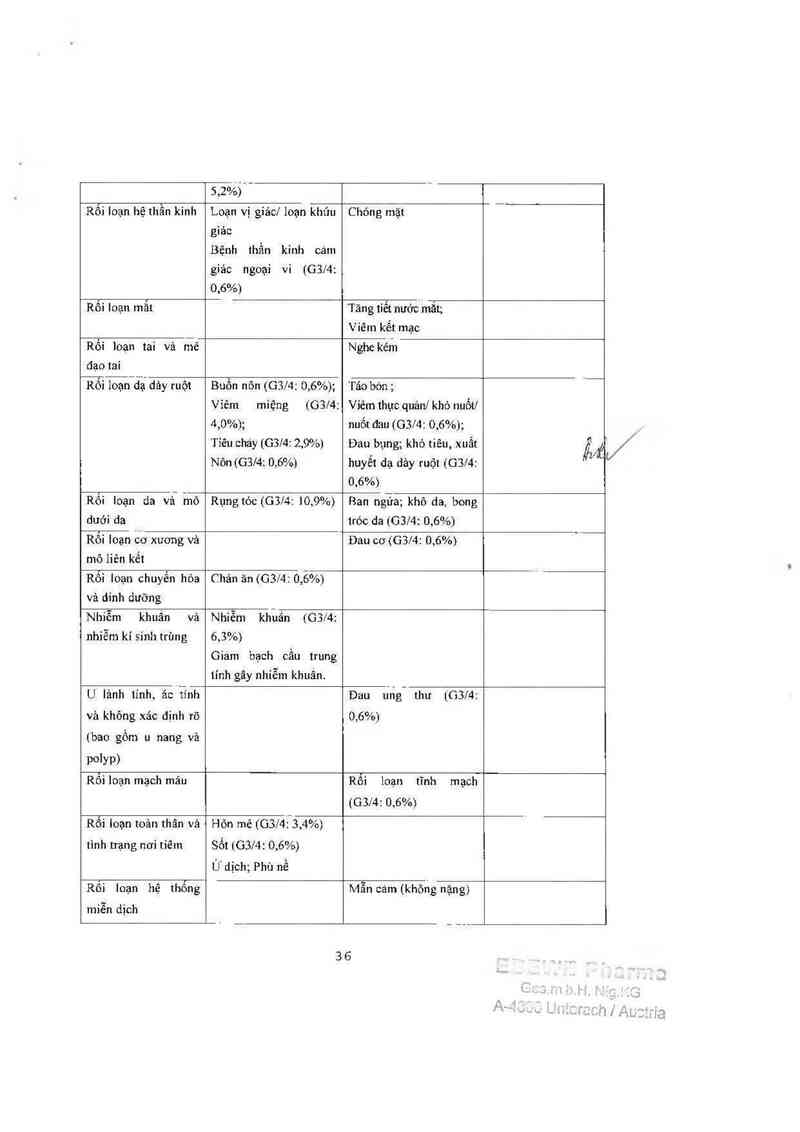
DOCETAXEL ’2'5mle’m2 Dhối hơn với císolatin
Các nhóm cơ quan
hệ thổng theo phân
loại MedDRA
Cảc phím ứng bẩt lợi
rất thường gặp 210%
số bệnh nhân
Các phân ứng bẩt lợi
thường gặp 21 vả <
10% số bệnh nhân
cm: phân ửng bẫt lợi
không thuòng gặp 2
0,1%1111 <1% số
bệnh nhân
Ỏác xét nghiệm
Tăng bĩlỉrubin mảu 631'4
(< 2,10/0Ìị
ALT G3/4 tăng {<1,3%)
Tăng AST G314
(<0,5%)
Tảng alkalínc
phosphatase máu G3l4
(<0,3%)
Rôi loạn lim mạch
Loạn nhịp G31’41 0,7%);
Suy tỉm
mRỗi— 113Ệ11 hệ bạch
huyêt vả mảư
Giám bạch cầu trung
tính [Gd: 51,5%);
Thiếu mảu (G3/4:
6,9%);
Gíảm tiểu cẩu (G4:
0,5%)
Gỉảm bạch cầỉ trung
tinh gây sốt;
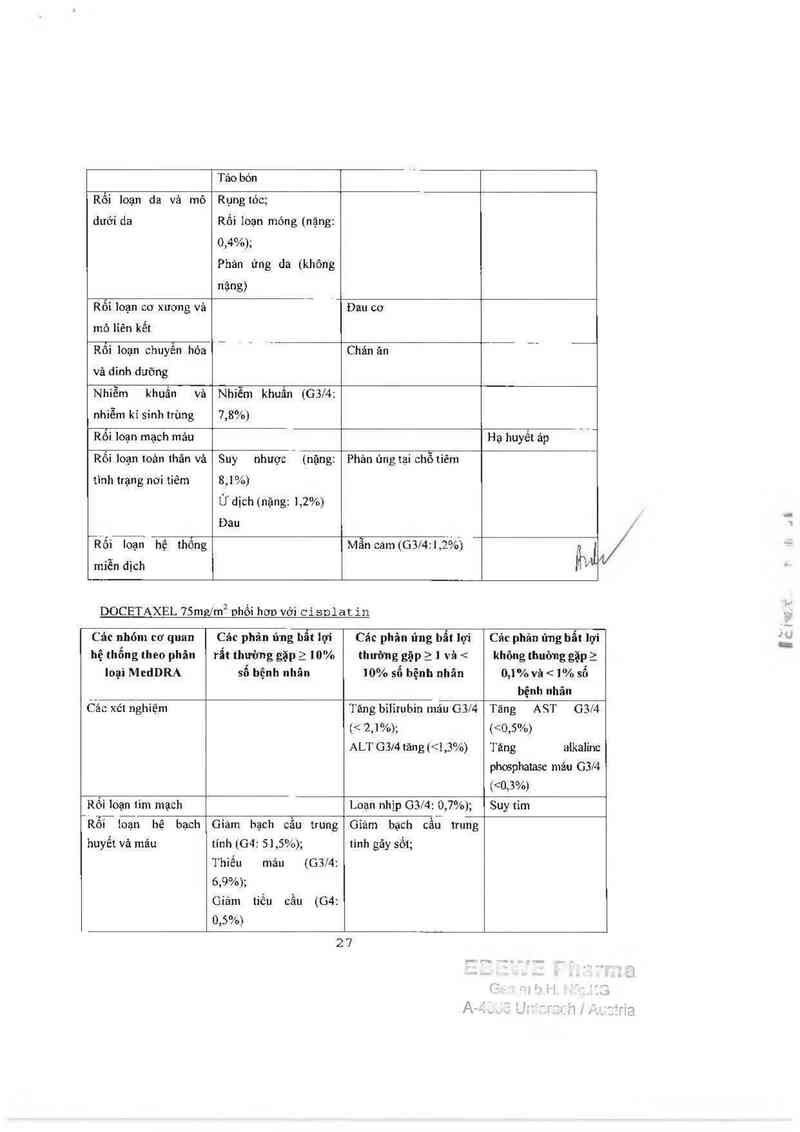
27
11111/ 1
ỮẨ` 1 -1
”1ỉỗi loạn hệ 111ầ11 kinh
Bệnh thằn kinh cám
giảc ngoại bìên (63:
3,7%)
Bệnh thẳn kỉnh vận
động ngoại biên (G3/4:
2%)
Rối loạn dạ dảy ruột
Buồn nỏn (G314: 9,6%);
Nõn (GSM: 7,6%);
chảy (03l4: 6,4%)
Viêm mỉệng (G3f4: 2%);
Tiêu
Táo bón
Rối loạn da vả mô
dưới da
Rungtóc;
Rối loạn móng (nặng:
0,70/o);
Phán ứng da (G3/41
0,2%)
Êi loạn cơ xuơng vả
mô lỉên kểt
Đau cơ (nặng: 0,5%);
nhiễm kí sinh trùng
Rối loạn chuyển hóa Chán ản
và dinh dưỡng
Nhiễm khuân vả Nhìễm khuẩn (G31’4;
s,7%;
Rối loạn mạch máu
Hạ huyết ảp (GSM:
0,79’0J
Rối loạn toản thân và
tinh trạng nơi tiêm
Suy nhuợc (nặng: 9,9%)
Ử dịch (nặng: 0,7%)
Sốt (0314: 1,2%)
Phán ứng tại chỗ tiẽm
Dau
Rối loạn hệ thổng
mỉên dịch
Mẫn cảm (G3ỉ4:2,5%)
DOCETAXFJL lOOmg/m2 gl1ối hơp với trastuzumab
Các nhóm cơ quan hệ
thổng theo phân Ioại
MedDRA
Các phản ứng bẩl lợi rẫt
thường gặp 2 111% số bệnh
nhân
Các phản ứng bẩt lợi 1111111111g
gặp 21 và < 111% số bệnh
nhân
Các xẻt nghìệm
Tảng cân
Rôi loạn tim mạch
Suy tím
28
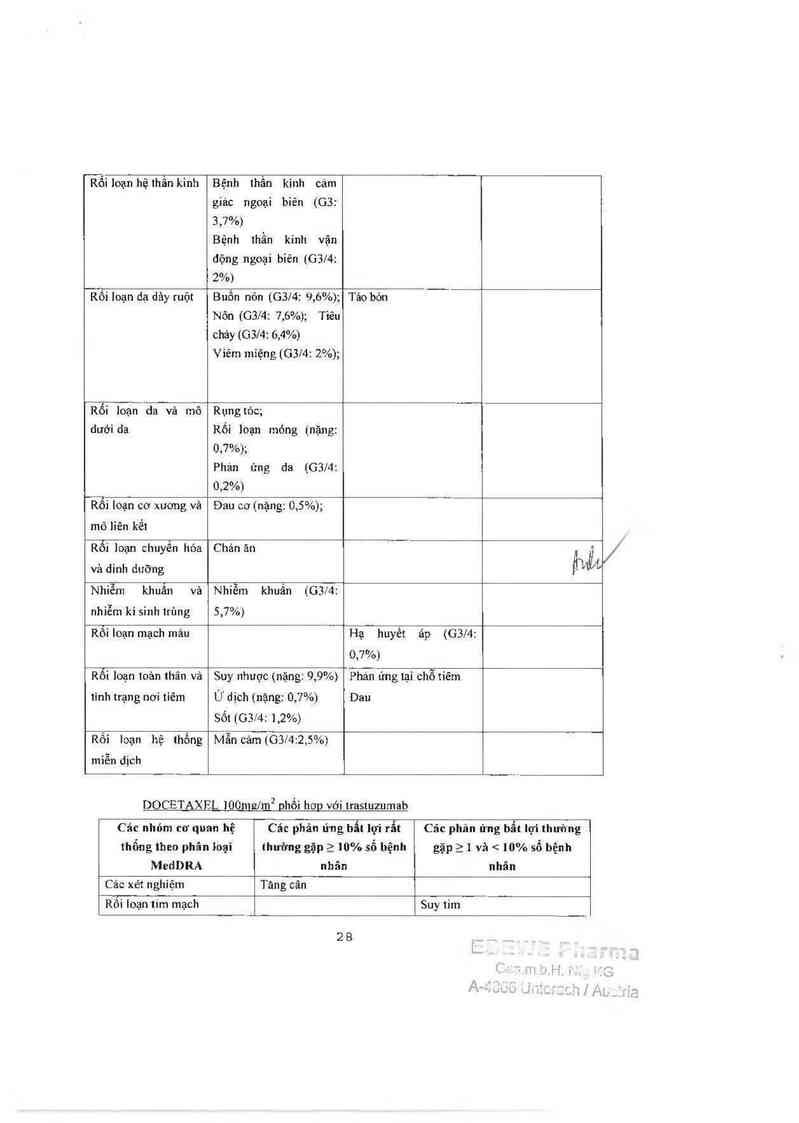
Rối loạn hệ thống bạch
huyếtvả mảu
Giảm bạch cầu trung tính
(GB/4:32%1
Giảm bạch cầu trung tính
gây sốt (bao gốm gỉảm bạch
cầu trung tính có liên quan
đến sốt và sủ dụng khảng
sinh] hoặc nhiễm khuẩn
giam bạch cầu trung tính.
Rối Ioạn hệ thống 1111²… ki1ĩ1“
Dị cám, đau đầu, loạn vị
giảc, giám xúc giảc
Ĩỗi Ioạn 1Ỉẩt
Tăng tiết nước mắt;
Vĩêm kết mạc
Rôi ìoạn hô hâp, ngục và
trung thẳt
Chảy máu cam; đau họng-
thanh quán, viêm mũi-họng,
khó thờ, ho, sổ mũi
† Rối loạn ruột dạ dảy
Buổn nôn, tiêu chảy, nỏn,
táo bón, viêm miệng, khó
tiêu, đau bụng
Rỗí loạn da vả mô dưới da
Rụng tóc, hống ban, phát
ban, rối loạn móng
Rối loạn cơ xuong và mô
liên kêt
Đau cơ, đau khớp, đau chỉ,
đau xuơng, đau lung
Rối loạn chuyển hóa và
dinh dưỡng
Chản ăn
Rõỉ loạn mạch máu
Phù nễ bạch 1…yẻ1
Rối loạn toản thân và tinh
trạng nơi tiêm
Suy nhuợc, phù ngoại vi, sốt,
mệt mòi, viêm niêm mạc,
đau, bệnh gỉống cúm, đau
ngực, rét run
Rối loạn tâm thần
Mất ngủ
Rói loan tim mach
Suy tim có triệu chửng được bảo cảo trên 2,2% bệnh nhân được điểu trị phối hợp
docetaxel vả trastuzumab so với 0% bệnh nhân được điều trị bằng docetaxel dơn trị 1íệu.
Trong liệu trình điếu trị docetaxel phối hợp với trastuzumab, 64% bệnh nhân đã được điều trị
với một anthracyclin nhu trị liệu bổ trợ so với 55% trong nhóm docetaxel đơn trị Iĩệu.
Rồi Ioan hê [hồng bach huvết vả máu
29
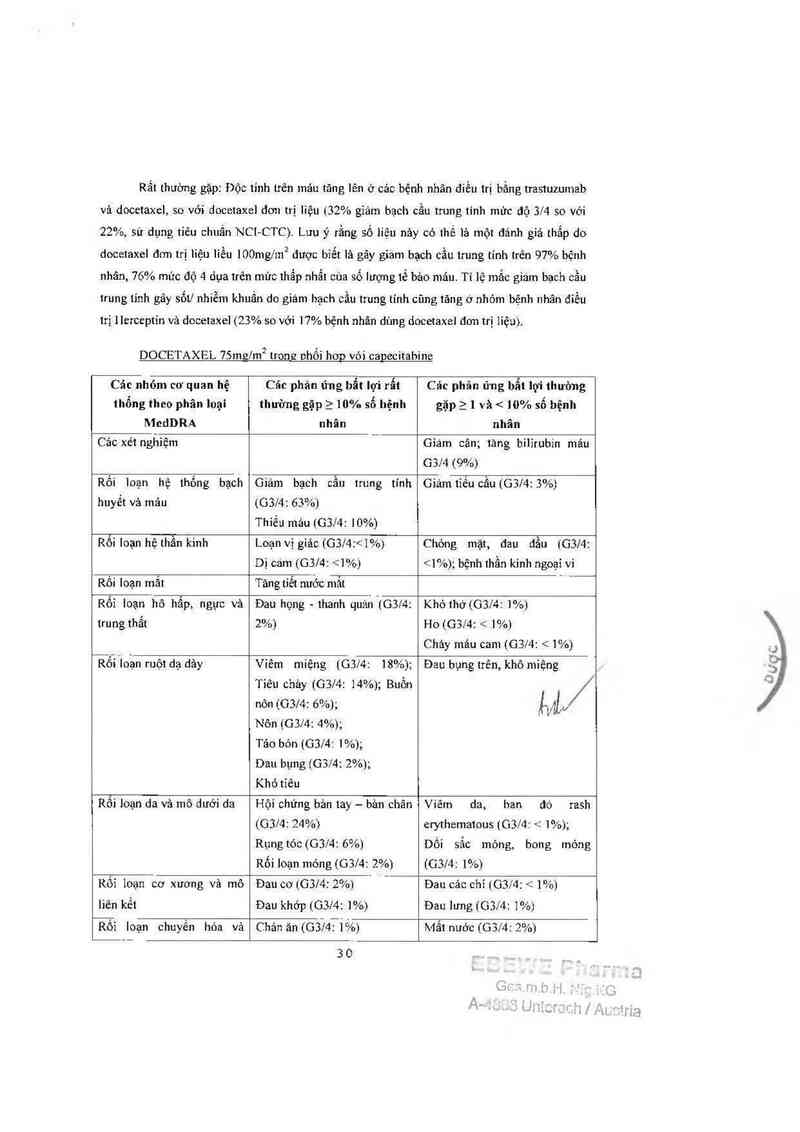
Rất thuờng gặp: Độc tinh trên mảư tăng lên ở các bệnh nhân điếu trị bằng trastuzumab
vả docetaxc], so với docetaxel dơn trị liệu (32% gỉảm bạch cầu trung 1inh mửc độ 31’4 so vởi
22%, sử dụng tiêu chuẩn NCl—CTC). Lưu ý rằng số liệu nảy có 11114. 111 một đánh gỉá thẳp do
docetaxel đơn 111 liệu lỉểu 1110111g1111² duợc bỉết lả gãy gíảm bạch cầu 1rung 111111 trên 97% bệnh
nhân, 76% mức độ 4 dụa trên mức thẳp nhẳt của số lượng 1ế bảo mảu. Tỉ lệ mắc giám bạch cầu
trung tỉnh gây sốt/ nhiễm khuẩn do giám bạch cầu trung tính cũng tăng ở nhỏm bệnh nhân đỉễu
trị lIcrccptín vả docetaxel (23% so với 17% bệnh nhân dùng docetaxel đơn trị liệu).
DOCETAXEL 75111111111² 1rona nhối hơp vói capecitabine
Các nhóm 1:o` quan hệ
thổng theo phân loại
MedDRA
Các phản ứng bẩt lợi rẩt
thuửng gặp 2 10% số hệnh
nhãn
Các phân ửng bẫ1 lợi thu-ỉmg
gặp 2 1 11 < 111% số bệnh
nhân
Các xẻ! nghiệm
Giám cân; tăng bilĩrubin máu
G3/4(9%)
Rối loạn hệ thống bạch
huyết và mảu
Giảm bạch cầu trung tính
(03/4:63%)
Thiếu mảu (G3/4: 111%)
Giảm tìêu câu (G3l4: 3%)
Rốì loạn hệ 1111… kinh
Loạn vị giảc [G37'41<1%)
Dị cám (03l4: <1%)
Chòng mặt, đau đầu (6314:
< 1%); bệnh thần kỉnh ngoại vi
Rối Ioạn mắt
Tảng tiết nước mắt
Rối loạn hô hẩp, ngực và
trung 1hẩt
Đau họng - 111an11 quán (6314:
2%)
Khó1hớ(G3l4: 1%)
Ho (63/4: < 1%)
Cháy máu cam (G3/4: < 1%)
Ĩố1 iloần ruột dạ dảy
Viêm miệng (6314: 18%);
Tiêu chảy (G3/4: 14%); Buỗn
nôn ((13/4: 6%);
Nôn (6314: 4%);
Tảo bón (G3/4: 1%);
Dau bụng (G314: 2%);
Khótỉêu
Đau bụng trên, khô miệng
11/
Rối Ioạn da và mô dưới da
Hội chứng bản tay — bản chân
(C1314: 24%)
Rụng tóc (G31'4: 6%)
Rối Ioạn mòng (G3/4: 2%)
Viêm da, han đò rash
erythematous (G3/4: < 1%);
Dối sắc móng, bong móng
(G3/4: 1%)
Rối loạn cơ xương và mô
Iìên kết
Đau cơ (G3/4: 2%)
Đau khớp (G3/4: 1%)
Đau các chỉ (G3/4: < 1%)
Đau lưng (G31'4: 1%)
Ệỉ loạn chuyển hóa và
Chán ăn (6374Ỉ1%)
Mất nuớc (G3/4: 2%)
30
dình dưỡng
Giám ngon miệng
Nhiễm khuẩn và nhiễm kí
sinh lrùng
Nhiễmnnấm Candida ờ miễrígử
(6314:<1%)
Rôi loạn toản thân vả tình
trạng nơi tiẽm
Suy nhược (6314: 3%);
Sốt (G3/4: 1%)
Mệt mo'ỉ/ suy nhuợc (6314: 5%);
Phù nể ngoại vi (6314: 1%)
Hỏn mê;
Đau
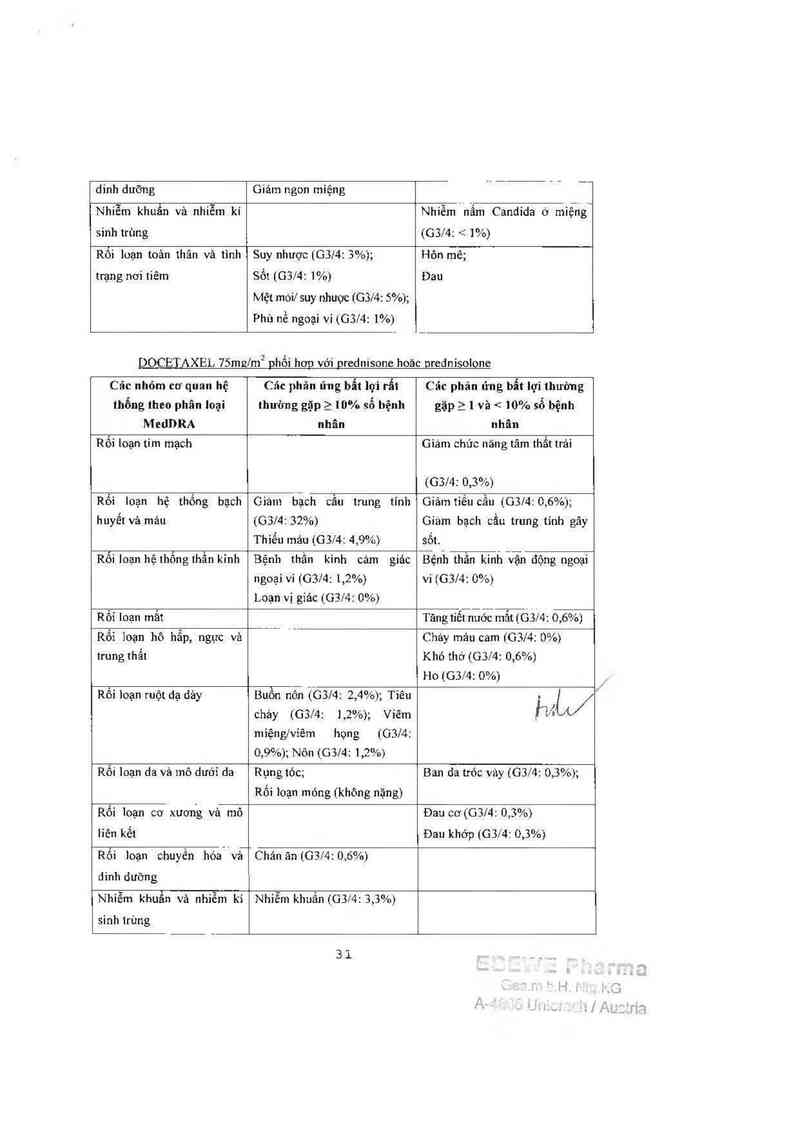
DOCETAXEL 7Slem2 phổi hgg vởi grednisone hoãc nrednisolone
Cảc nhỏm co' quan hệ
1hống 11…) phân loại
MedDRA
Cảc 11111… ứng bẫt lợi rẩt
lhu~ờng gặp 2 10% số bệnh
nhân
Các phăn ứng bẩt lợi thường
gặp 21vă < 111% số bệnh
nhân
Rối loạn tim mạch
Giám chức nảng tãm thẳt trải
(6314: 0,3%)
Rối Ioạn hệ thống bạch
huyêt vả máu
Giảm bẵch cẩu trung tính
(6314t32%)
Thiếu mảu (G3/4: 4,9%)
Giảm tỉểu cằn (6314: 0,6%);
Giám bạch cẳu trung tỉnh gây
sốt.
Rối Ioạn hệ 1hỗng 1hần kỉnh
Bệnh 111ầ11 kinh cám giác
ngoại vì (0314: 1,2%)
Loạn vị gỉảc (6314: 0%)
Bện11 thân kinÍz Ẩẫn động ngoại
vi (G3l4: 0%)
Rũĩ loạn măt
Tăng tiéĩnỉã mẳt (6314: 0,6%)
Rối loạn 110 hắp, ngực và
lrungthẩt
Chảy mảư cam (6314: 0%}
Khó thờ (0314: 0,6%)
Rối Ioạn ruột dạ đảy
Buồn nôn (6314: 2,4%); Tiêu
chảy (6314: 1,2%); Viêm
míệng/vỉêm họng (6314;
0,9%); Nôn (6314: 1,2%)
Ho (6314: 0%)
hẩLt/
Rôi loạn da vả mô dưới da
Rụng 1óc;
Rối loạn móng (không nặng)
Ban da tróc vảy (63/4: 0,3%);
Rối loạn cơ xương và mô
liên kết
Đau cơ (6314: 0,3%)
Đau khớp (G31'4: 0,3%)
Rỏi loạn chuyển hóa vả
dinh đường
Chản ăn (6314: 0,6%)
Nhiễm khuẩn và 11111ẻ111 kí
sinh lrùng
Nhiễm khuần (6314: 3,3%)
31
trạng nơi tìém
Rối loạn toăn thân và tinh
Mệt nói (6314: < 3,9%);
[1 dịch (nặng: 0,6%)
Rối loạn hệ
dịch
thống miễn
Mẫn cảm (6314: 0,6%)
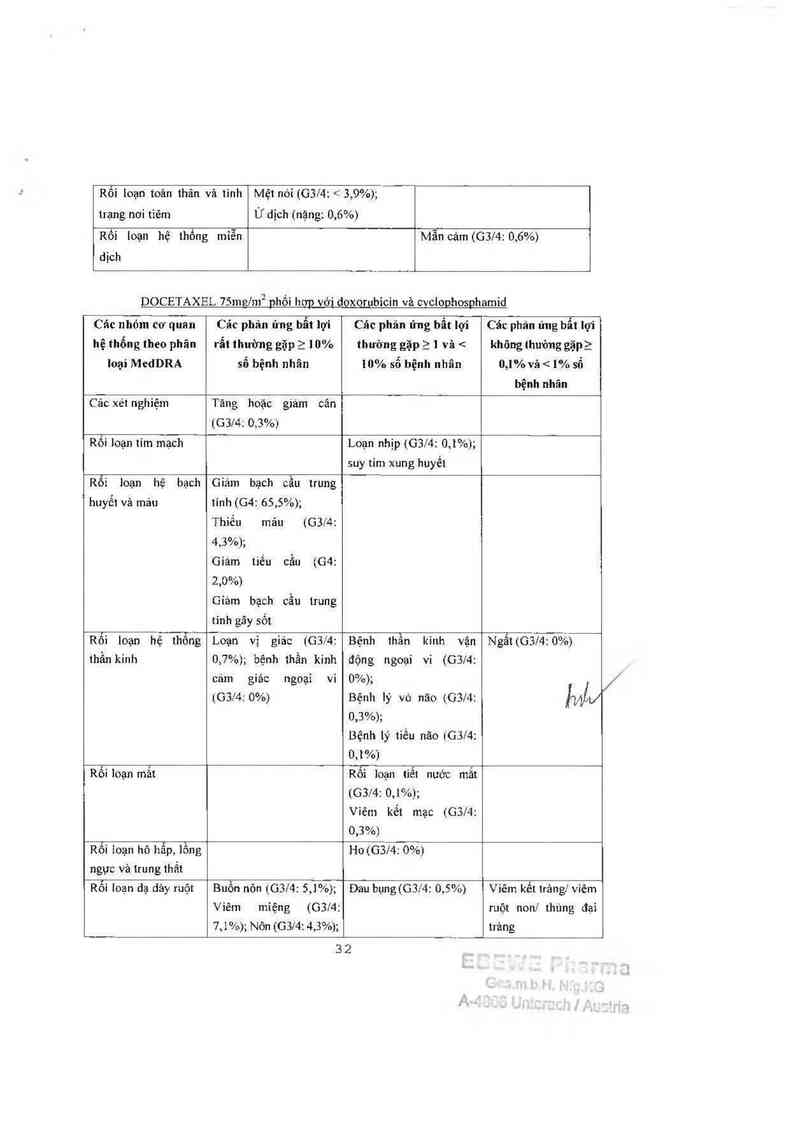
DOCETAXEL 7311121111² phối hơp với doxorubicin vả cyclophosphamid
Cảc nhỏm cơ quan
hệ thổng 1heo phân
loại MedDRA
Các phản ửng bất lợi
rẩt thuửng gập ; 10%
số bệnh nhãn
Các phân ửng bẩt lợi
thường gặp 2 1 và <
111% số bệnh 11111…
' Các phản ủng bẩt lọi
không thuòng gặp ì
0,1% và < 1% số
bệnh nhãn
Cảc xét nghiệm
Tảng hoặc giảm cân
(G3/4: 0,3%)
Rối loạn tim mạch
Loạn nhịp (6314: 0,1%);
suy tim xung huyết
Rối
huyếl vả mảu
loạn hệ bạch
Rôì Ioạn hệ thônỈ
111ầ111111111
Giảm bạch cầu trung
tính (64: 65,5%);
Thiếu mãn (6314:
4,3%);
Giám tiếu cầu (64:
2,0%)
Gíảm bạch cầu trung
tỉnh gâysốt
Ĩoạn vị giảc (6314:
0,7%); bệnh 111ầ11 kinh
cám gìác
(6314: 0%)
ngoại vi
Bệnh 111ầ11 kinh vận
động ngoại vì (6314:
0%);
Bệnh lý vò năo (6314:
0,3%);
Bệnh lý 11ẻ11 não (G3/4:
0,1%)
Ngẳt (6314: 11%)
11111
Rối loạn mắt
Rối loạn liết nuớc mắt
(6314: 0,1%);
Viêm kết mạc (6314:
0,3%)
Rối ìoạn hô hấp, lõng
ngực vả trung 1hất
Ho (6314: 0%]
Rối loạn dạ dảy ruột
Buồn nôn (6314: 5,1%);
Viêm mỉệng (6314:
7,1%); Nõn (631414,3%);
Dau bụng (6314: 0,5%)
Viêm kết trảng' viêm
ruột non! thùng đại
trảng
32
Tiêu €1111y (6314: 3,2%);
Táo bón (0314: 0,4%)
Rôỉ loạn da và mô
dướỉda
Rụngtỏc;
Độc tính da
0,7%)
Rối Ioạn móng (6314;
0,4%)
(6314:
Rôi loạn cơ xương vả
mõ lìên kết
Đau cơ (6314: 0,8%)
Dau khỏp (6314: 0,4%)
Rối loạn chuyến hóa
và dinh dưỡng
cnz… ăn (G314: 2,2%)
Nhiễm khuấn và
nhiễm kí sinh trùng
Nhẫễm khuẩn (0314:
3,2%)
Giảm bạch cầu trung
tinh gây nhỉễm khuẩn.
Không có trường hợp tử
vong do nhiễm khuẳn
huyết.
Rối loạn mạch máu Giãn mạch (6374: Hạ huyết ảp (6314: 0%) Viêm lắc tĩnh mạclf
0,9%) (6314: 0%)
phù nề bạch huyết
(6314:0%)
Rối Ioạn toản thân và
tình trạng nơi tiêm
Suy nhược (6314: ] 1%)
sẽ» (6314: 1,2%)
Phù nể ngoại vi (6314:
0,4%)
Phản ứng tại chỗ tỉẽm
Đau
M/
Rỗì loạn hệ thống
miễn dịch
Mẫn cam (6314:1,1%)
Rôi loạn hệ sinh sán
và vũ
Mât kinh
Rói 1an vé 11'm
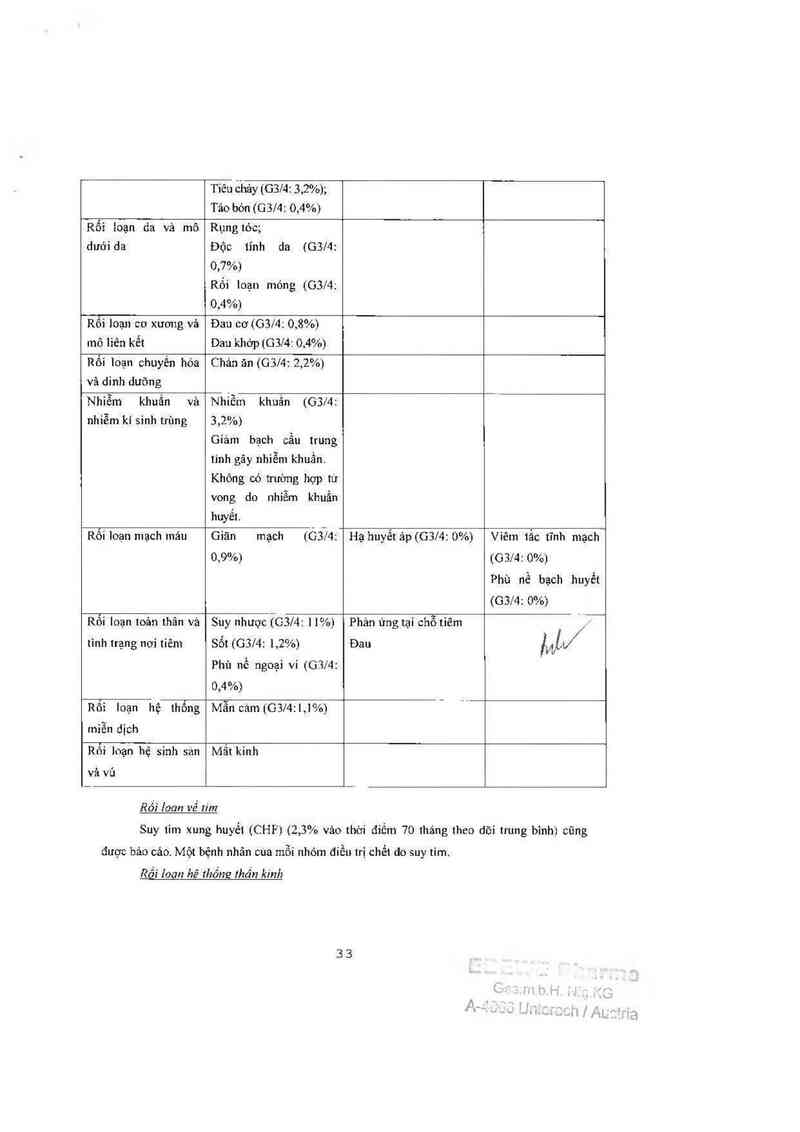
Suy tim xung huyết (CHF) (2,3% vảo thởi điếm 70 1háng theo dõi trung bình) cũng
được bảo cảo. Một bệnh nhân cùa mỗi nhỏm điếu trị chểl do suy tim.
Rối 10611 hê thống !hần kinh
33
11
.1l "1` ~
Dã quan sảt thẳy bệnh thẳn kinh cảm gíảc ngoại biên đang diễn tỉến vảo thởi đỉểm
trung vị thời gian theo dõi lả 55 tháng ở 9 bệnh nhân ngoảí 73 bệnh nhân bị bệnh lhằn kinh
cám giảc ngoại vi ở cuối đợi hóa trị liệu.
Rỏi loan da vả mõ dưới da
Đã quan sảt thẩy chứng rụng tòc đang diễn tiến vảo thời điếm trung vị thời gìan theo
dõi là 55 thảng trên 22 bệnh nhân ngoải 687 bệnh nhân có rụng 161: ở cuối đợt hóa trị liệu.
Rồi loan loản Ihăn vả fình írang nơi riẻm:
Đã quan sát thấy phù ngoại vì đang diễn tiến vảo thời điềm trung vị thời gian theo dõi là 55
thảng trên 18 bệnh nhãn ngoải | 12 bệnh nhân có phù ngoại vi vảo cuối dợt hóa trị líệu.
Rối Ioan hé 1hỏne sinh sản vờ vú
Đã quan sát thẩy hiện tuợng vô kinh vảo thời điềm trung vị thời gian theo dõi lả 55
thảng trên 133 bệnh nhân ngoảì 233 bệnh nhân bị vô kinh ở cuối đợt hóa trị liệu.
DOCETAXEL 75111 /m2 nhối hơn với 015 latin vả S—fiuorouracil cho mm thu biếu mô
tuvến da dảv
Các nÌlól1’l Ico' quan hệ
thổng theo phân loại
M eđDRA
Các phản ứng bẩt lợi rẩt
thường gặp 2 111% số bệnh
nhân
Rối loạn tim mạch
Các phản ứng bẩt lợi ĩ1111—11ĩ1ặ—
gặp 21vă < 111% số bệnh
nhân
Loạn nhịp (6314: 1,0%)
Rối loạn hệ thống `bạch
huyếtvảmáu
Giảm bạch câu trung tinh
(6314: 83,2%);
Thíếu mảư (6314: 20,9%):
Giảm tiếu cầu (6314: 8,8%);
Giảm bạch cẳu trung tỉnh gây
sốt.
111/
Rối loạnhệ thân kình
Bệnh thân kinh cảm gỉảc
ngoại vì (6314: 8,7%)
Chóng mặt (63145 2",3%)
Bệnh thẩn kinh vận động ngoại
vi (6314: 1,3%)
Rôi loạn mắt
Tâng tìết nước mắt (6314: 0%)
Viêm kết mạc
Rối loạn lai vả mê đạo tai
Nghe kém (6314: 0%)
Rối loạn dạ dảy ruột
Viêm miệng (6314:23,7%);
Tảo bòn (6314: 1,0%)
34
Tiêu chảy (0314:
Buồn nôn (6314: 16%);
Nôn (6314: 14,3%);
19,7%);
Đau dạ dảy ruột (6314:1,0%)
Viêm thực quảnlkhó nuốtl nuốt
đau (03/4: 0,7%)
Rối loạn da vả mô dưới da
Rụng tóc (G3/4: 4,0%)
Ban ngứa ( G3/4: 0,7%)
Rối loạn móng (G3/4: 0,7%)
Bong da (63/4: 0%)
Rối loạn chuyến hỏa vả
dinh dưỡng
Chán ãn (G3/4: ] 1,7%)
Nhiễm khuẩn và nhíễm kí
sinhtrùng
Nhiễm khuẩn do gỉảm bạch
cầu trung tính;
Nhỉễm khuẩn (6314: 1 1,1%)
Rối Ioạn toản thân và tình
trạng nơi tiêm
Hôn mê (63/4: 19,0%);
sỏ1 (6314: 2,3%);
[1 dịch (nặng/ đe dọa tính
mạng: 1%)
M
Rối Ioạn hệ thống miễn dịch
Mẫn cảm (G3/4: 1,1%)
Rối loan hé Ihống Iỵmgho vả máu
Giảm bạch cằn trung tính gây sốt xay ra trên 17,2% vả giảm bạch cẩu trung tính gây
nhiễm khuẩn xảy ra trên 13,5% bệnh nhân, bắt kế có sử dụng G-CSF hay không. G-CSF duợc
chỉ định cho dự phòng thứ phát trên 19,3% bệnh nhân (10,7% cùa cảc chu kỳ đỉều trị). Giảm
bạch cầu trung tính gây sốt và giảm bạch cầu trung tính gây nhiễm khuẩn xảy ra tương ứng
trên I2,1% vả 3,4% bệnh nhân khi bệnh nhân duợc chỉ định G-CSF dự phòng, trên 15,6% vả
12,9% bệnh nhân không sử dụng G-CSF dự phòng (xem mục “Líều lượng vả cách dùng”).
DOCETAXEL 75mgịm2 ghối hợp với cisplatin vả S-í]uorouracỉl trong une thu dẩu vả
9.Q
Hóa trị liệu gây dáp ứng sau đó điểu trị phóng xạ (TAX 323)
Các nhỏm cơ quan Các phản ứng bẩt lọi Các phản úng bẩt lợi Cảe phản úng bẩt lợi
hệ thống theo phân rẩt thuửng gặp 2 10% thường gặp 2 ] vả < không thuòng gặpì
Ioại MedDRA số bệnh nhân 111% số bệnh nhân o,1% vè < 1% số
bệnh nhân
Các xét nghiệm Tăng cân
Rỗi loạn tim Thiẵt máu cơ tỉm Loạn nhip (G3l4:
(03/4: 1,7%) 0,6%);
Rối Ioạn hệ bạch Giảm bạch cầu trung Giảm bạch cẩu trung
huyết và máu tính (64: 76,3%); tính gây sốt
Thiếu mảu (6314:
9,2%);
Giám tỉểu cầu (64:
3 5
.A—J 1 ;) j %
5,2%) "
Rối loạn hệ thân kinh
Loạn vị giác/ loạn khí…
giác
Bệnh thần kỉnh cám
giác ngoại vi (6314:
0,6%)
Chóng mặt
Rối loạn măt
Tăng tiết nước1năt;
V iêm kết mạc
Rối loạn tai vả mé Nghe kéìh
đạotai
Rối loạnlĩạỉ dảy ruột Buổn nôn (6314: 0,6%); Táo bón;
Viêm mỉệng (6314:
4,0%);
Tĩẽu cháy (6314: 2.9%)
Nôn (6314: 0,6%)
Viêm thục quảnl khó nuốt/
nuốt đau (6314: 0,6%);
Đau bụng; khó tiêu, xuất
huyết dạ dảy ruột (6314:
0,6%)
Rối loạn da vả mô
duởỉda
Rụng tòc (6314: 10,9%)
Ran ngứa; khô da, bong
tróc da (6314: 0,6%)
Ròi loạn cơ xuong và
mô 1iẽn kết
' Đau cơ (6314: 0,6%)
Rôi loạn chuyền hóa
và dinh dưỡng
Chản ăn (6314: o,ẻ%)
Nhiễm khuắn và
nhiễm kí Sinh trùng
Nhiễm khủán (6314:
6,3%)
Giảm bạch cầu trung
lính gây nhíễm khuấn.
U Iảnh tính, ác'ỉnh
vả không xác dịnh rõ
(bao gồm u nang vả
polyp)
Đau urẵgỌ thư [G3/4:
0,6%)
Rôi loạn mạch mảu
Rối 1oạn tĩnh mạch
(6314:0,6%)
Rôi loạn toản thân và
tình trạng nơi tiêm
Hôn mê (6314`:`3,4%)
sỏr (6314: 0,6%)
Ử dịch; Phù nề
Rôì loạn hệ thỗng
miễn dịch
Mẫn cám (khôhg nặng)
36
Hòa tri liêu aâv đản ứng sau đó đìểu tri hóa tri liêu QhÓHE xa (TAX 324)
Các nhỏm co' quan
hệ thống theo phân
loại M edDRA
Cảc phản ứng bẳt lợi
rẩt thường gặp Ẹ 10%
số bệnh nhân
Các phân ửng bẩt lợi
thưòng gặp 2 ] vả <
10% số bệnh nhân
Các phản ủng bất lợi
không thuừng gặpặ
[l,l%vă < 1% số
bệnh nhân
Cảo xe't nghiệm
Giảm câu
——
Tảng cân
Rối loạn tim
Loạn nhịp (6314: 2,0%);
Thìều mảư cục bộ cơ
tim
Rôi
huyêt vả mảư
loạn hệ bạch
Giảm bạch cầuẮnmg
tinh (64: 83,5%);
Thiếu mẻ… (6314:
12,4%); Giảm tiếu cẳu
(6314: 4,0%); Giảm
bạch cầu trung tính gây
sốt
Rối loạn hệ thống
thần kinh
Loạn vị giảcl loạn khứu
giảc (6314: 0,4%);
Bệnh
giác ngoại vi
1,20/0)
thằn kinh cám
(6314:
Chóng
2,0%);
Bệnh thần kinh vận động
ngoại vi (6314: 0,4%)
mặt (G314:
),),
1iổììbỆn mảt
TảnẢgịtìết nước mẳt;
Viêm kêt mạc
Rối loạn tai và mẽ
Nghe kém (6314: 1,2%)
đạo tai
Rối loạn dạ dảy ruột Buồn nôn (63141 Khó tiêu (6314: 0,8%);
13,9%); Đau dạ dảy ruột (6314:
Viêm miệng (6314: 1,2%)
20,7%); Nôn (6314: Xuất huyết dạ dảy ruột
8,4%); Tỉêu chảy (6314:
6,8%); Vìêm thực quản/
khó nuốt] nuốt đau (6314:
12,0%);TáO bón (6314:
0,4%)
(6314: 0,4%)
Rối loạn da và mô
dướida
Rụng tóc (6314: 4,0%)
Ban ngứa
Khô da; bong tróc da
Rối loạn cơ xuong vả
mô liên kết
Đaú cơ (6314: 0,4%)
37
Rỗi loạn chuyến hóa
và dinh dưỡng
Chán ăn (6314: 12,0%)
Nhiễm khuẩn và
nhỉễm kí sinh trùng
Nhiễm khuấn (6314:
3,6%)
Giám bạch cầu trung
tính gây nhiễm khuẩn.
U lảnh tỉnh, ảc tính
và không xác định rõ
(bao gổm u nang và
polyp)
Đau ung thu (6314:
I ,2%)
Rối loạn mạch máu
Rối loạn tĩnh mạch
Rối loạn toản thân và
tình trạng noi tiêm
Hôn mê (6314: 4,0%)
Sốt (6314: 3,6%)
Ửdịch (6314: 1,2%)
Phù nể (6314: 1,2%)
Rối loạn hệ thống
miễn dịch
Mẫn cảm
Kinh nghiêm sau khi luu hảnh
M
Đã có bảo cáo một số hiếm trường hợp bị nhồi mảư cơ tim.
Rối loạn hệ lympho vả máu
1,1/
Ức chế tủy xương và cảc phán ứng bắt lợi về máu khác đã đuợc báo cáo. Hiện tượng
đông máu nội mạch lan tóa (DIC) thường kểt hợp với nhiễm khuẩn huyết hoặc suy đa cơ quan
đã được báo cáo.
Rối Ioan hê thống thần kinh
Đã quan sảt thấy một số hiểm truờng hợp co giật hoặc mắt ý thức thoảng qua khi điểu
trị bằng docetaxel. Các phản ứng nảy đôi khi xuất hiện trong quá trình tiêm truyền thuốc nảy.
Rỏi loan mắt
Rắt hỉếm cảc trường hợp bị rối loạn thị giác thoáng qua (nhìn thấy vệ! sáng, nhìn thẩy
những ánh chớp sáng vả ám dỉểm) diều hình xảy ra trong suốt quá trinh truyền docetaxel vả
kết hợp với các phản ửng quá mẫn. Các triệu chứng nảy sẽ phục hồi khi ngừng tiêm truyền.
Hiếm gặp cảc trường hợp tảng tiết nước mắt kèm hoặc không kèm viêm kết mạc cũng như cảc
truờng hợp tắc nghẽn ống lệ dẫn đến chảy nước mắt quá mức.
Rối Ioan tai và mê đao tai
Một số hiểm truờng hợp bị nhiễm độc tai, nghe kém vãlhoặc không nghe thẩy.
Rối` Ioan hô hấp. lồng neưc vả Irtmg thất
38
I -m"
Hiểm có báo cảo về hội chứng suy hô hẩp cắp tính tiến tríến (ARDS), viêm phối mô
kẽ vá xơ phối. Hiếm trường hợp viêm phối do phóng xạ đuợc phảt hiện ở cảc bệnh nhãn đuợc
điều tri xạ trị đồng thời.
Rối Ioan da dảỵ ruôt
Một số hiếm các truờng hợp bị mẩt nuớc, hậu quả cúa cảc biến cố bất lợi trên dạ dảy
ruột, thúng dạ dảy-ruột, viêm đại trảng thìếu máu cục bộ, vỉêm đại trảng vả viêm ruột do giảm
bạch cầu trung tính cũng duợc bảo cảo. Một số hiếm trường hợp bị tắc ruột.
Rối loan da vả mô dưới da
Rất hiếm truờng hợp bị lupus ban đỏ vả phảt ban bóng nước trên da như hồng ban đa
dạng, hội chứng Steven - Johnson, hoại tử da do nhiễm độc khi điều trị bằng dooetaxel. Trong
một số trường hợp, cảc yếu tế đi kèm có thể góp phẫn Iảm phát triền những tác dụng phụ nảy.
Đã có báo cáo về những thay đối giống xơ cứng bì thưòng gặp phái sau khi bị phù bạch huyết
ngoại vi.
U Iảnh tính, ác tính hoảc không xg’c đinh rõ ( bao zổm u nang và nolvn)
Rẩt hiếm trường hợp gặp ung thu bạch cầu dòng tủy cẳp tính hoặc hội chứng Ioạn sản
túy có liên quan tởỉ docetaxel khi điều trị phối hợp với các thuốc hóa trị iiệu hoặc liệu pháp
phóng xạ. ffl/
Rối loan mach máu
Một số hiếm trường hợp bị huyểt khổi thuyên tắc tĩnh mạch đuợc bảo cảo.
Rối loan toân thân và tinh trang nơi tiêm
Hỉếm gặp hiện tượng xuất hiện tồn thương tại vùng da truóc dáy duợc chiếu xạ. Ử
dịch không di kèm với các đợt thiều niệu hoặc hạ huyết ảp. Mắt nước và phù phổi hiếm gặp.
Rối Igan hê thộng miễn dich
Một số trường hợp sốc phản vệ, đôi khi tử vong dã dược báo cảo.
Rối loan trên gan - mât
Một số hiếm trường hợp viêm gan, dôi khi tử vong chủ yểu ở cảc bệnh nhân đã có rối
loạn gan trước dó.
T hông báo cho các bác sĩ biểt những tác dụng không mong muốn gặp phải khi sử
dụng !huổc.
7. Khi mang thai và thời kì cho con bú
Không có thông tin về việc sử dụng docetaxel ở phụ nữ mang thai. Docetaxel dã cho
thấy 1ả có gây độc cho phôi hoặc gây quái thai ở thò vả chuột, vả lảm giảm khả năng sinh sán
cùa chuột. Giống như cảc thuốc gây độc tế bảo khác, docetaxel có thể gây hại cho bảo thai khi
sử dụng cho phụ nữ có thai. Vì vậy, docetaxel không đuợc sư dụng trong khi mang thai. Phụ
39
C)
nữ ở độ tuổi sinh con nên được khuyên tránh thai và phái thông báo với bảc sĩ điều trị ngay
lập tức nếu sự thụ thai xáy ra.
Docetaxel là một chắt ải dầu nhưng người ta vẫn chưa biểt liệu nó có được bải tiểt trong
sữa người hay không. Do có khả năng gặp các phán ứng có hại ở tre” sơ sinh, cần phái ngừng cho
trẻ bú sữa mẹ trong suốt thời gian mẹ điều trị bằng docetaxel.
8. Ảnh hưởng đến khả năng lái xe và vận hănh máy móc
Thuốc nảy chứa 27% thể tích 131 ethanol (cồn), ví dụ 160 mg (liều lrung binh) chứa
4100mg cổn, tương đương với ít hơn 100 ml bia. Số lượng cồn trong thuốc nảy có thế lảm
giảm khả năng Iải tảu xe vả vặn hảnh máy mỏc.
9. Cảnh báo dặc biệt và thận trọng khi sử dụng
Đối với ung thư vú và ung thư phối không phải tế bảo nhó, điều trị truớc bao gổm một
corticosteroid đường uổng như dexamethason 16mg mỗi ngảy (chỉa 2 lần, mỗi lần 8 mg)
trong 3 ngảy bắt đầu 1 ngảy trưởc khi điểu trị bằng docetaxel trừ khi có chống chỉ định, có thề
lảm giảm tỉ lệ và mức độ ứ dich cũng như mức độ của các phán ứng quả mẫn. Đối vởi ung thu
tiền liệt tuyến, điếu trị trước bao gồm dexamethason đường uống 8 mg, 12 giờ, 3 giờ và 1 gỉờ
trước khi truyền docctaxel. M/
vè huvết hoc
Giảm bạch cầu trung tính là phán ứng bất lợi phổ biến nhắt cúa docetaxel. Số lượng
bạch cằu trung tính giảm xuống 0 mức thắp nhất trong khoảng thời gian trung binh 7 ngèy
nhưng khoáng thời gian nảy có thế ngắn hon 01 các bệnh nhân dã được diển trị mạnh tay truớc
đó. Tắt cả cảc bệnh nhân điều trị bầng docetaxel nên dược kiếm tra công thức máu toản phần
thường xuyên. Bệnh nhân nên được tiếp tục điều trị bằng docetaxel khi số lượng bạch cầu
trung tính hồi phục lại 2 1.500 tể bảo/mmJ (xem mục “Liều lượng vả cảch dùng”). Trường
hợp giảm bạch cầu trung tính nặng (< 500 tể bâo/mm3 trong 7 ngảy hoặc hơn) trong một dợt
điểu trị bằng docetaxel, cần cân nhắc giảm liều cho các đọt điều trị tiếp theo hoặc sử dụng các
biện phảp điều trị triệu chứng thich hợp (xem mực “Liều luợng vả và cách dùng”).
Ó cảc bệnh nhân điều trị docetaxel phối hợp với cisplatin vả S-fluorouracil (TCP), hiện
tượng giám bạch cầu trung tính gây sốt và giám bạch cầu trung tính gãy nhiễm khuấn xảy ra
với 11 lệ thẳp khi bệnh nhân đuợc điều trị dự phòng G-CSF. Bệnh chân điều trị TCF nên được
điều trị dự phòng G-CSF đế lảm giảm nguy cơ giám bạch cầu trung tính có biến chứng (giám
bạch cầu trung tính gây sốt, giám bạch cẳu trung tính kéo dải vả giám bạch cằu trung tính gây
nhiễm khuấn). Bệnh nhân đuợc điều trị TCF nên đuợc kiếm soát chặt chẽ (xem mục “Liều
lượng và cách dùng“ vả ““Tác dụng không mong muốn”).
Các ghán ứng guá mẫn
40
A--.: ………,.…1…1.11
`ci……_.
LJÌ
ELS
Bệnh nhân nên được quan sát chặt chẽ về cảc phản ứng quá mẫn đặc biệt là trong suốt
lần trưyền dịch đầu tiên và thứ 2. Cảo phán ứng quả mẫn có thể xảy ra chi trong vòng một vải
phủt sau khi bắt đầu tiêm truyền docetaxcl, vì thế các phương tiện điều trị hạ huyết ảp và co
thắt phế quản phải lưôn luôn có sẵn. Nếu cảc phản ứng quá mẫn xảy ra, triệu chửng nhẹ như
phản ứng bừng dò da hoặc phán ứng da tại chỗ thì không cần dừng điểu trị.Tuy nhiên các
phán ứng nặng như hạ huyết áp nặng, co thắt phế quán hoặc ban đò/ban toản thân thì ngay lập
tức dừng điều trị bằng docetaxel vả có liệu pháp điều trị thích hợp. Bệnh nhân đã có các phản
ứng quá mẫn nặng với docctaxel thi không nên tỉếp tục điểu trì với thuốc nảy.
Các phán ứng da
Đã quan sảt thắy hồng ban khu trú ớ các chi (lòng bân tay hoặc lòng bản chân) với phù
nề vả kế tiếp 1ả tróc váy. Các trìệu chứng nặng như phát ban, tróc váy dẫn đến gián đoạn hoặc
ngừng điều trị bằng docetaxel đã được báo cảo (xem mục “Liều iượng và cách dùng”).
@
Bệnh nhân bị ứ dịch nặng như trản dịch mảng phổi, trản dịch mảng ngoải tim và cố
trướng nên được theo dỏỉ chặt chẽ. M/
Bẽnh nhân bi suv chức nãnz aan
Bệnh nhân điều trị đơn trị liệu với docetaxel IOOmg/m2 có nồng độ transaminase huyết
thanh (ALT vảlhoặc AST) lớn hơn 1,3 lần ULN đổng thời nồng độ alkaline phosphatase
huyết thanh lớn hơn 2,5 lần ULN, có nguy cơ cao mắc các phản ứng bất lợi nặng như các
trường hợp chết do nhiễm độc bao gổm nhiễm khuấn huyết và xuất huyết dạ dảy ruột có thể
dẫn đển tu vong, giảm bạch cầu trung tính gây sốt, nhiễm trùng, giảm tỉểu cẩu, viêm miệng vả
suy nhược. Vì thế mức iiều khuyến cáo cùa docetaxel ớ nhóm đổi tượng có xét nghiệm chức
năng gan cao (LFTs) lả 75ngm2 và LTFs nên được thục hiện từ ban đầu và trước mỗi chu kỳ
điều trị (xem mục “Liều lượng và cách dùng”).
Bệnh nhân có nổng độ bi1irubin huyết thanh > ULN vả/hoặc ALT vả AST > 3,5 lần
ULN đồng thời nổng độ alkalíne phosphatase huyết thanh > 6 lớn ULN, chi sử dụng docetaxel
khi được chỉ định nghiêm ngặt. Trong phối hợp với cisplatin vả S—fiuorouracil trong điều trị
bệnh nhãn ung 11… biếu mô tuyến dạ dảy, mu nghiệm lâm sâng chính đã Ioại trừ các bệnh
nhân có ALT vảlhoặc AST > 1,5 lần ULN kèm với alkalinc phosphatase > 2,5 lần ULN vả
bilirubín > ULN; đối với nhũng bệnh nhãn chỉ sử dụng docetaxel khi có chỉ định nghiêm ngặt.
Không có dữ lỉệu về bệnh nhân suy chức năng gan dùng docetaxel trong điều trị phối hợp cho
cảc chỉ định khảc.
Bẽnh nhân suỵ chức nãna thân
Không có dữ liệu về các bệnh nhân sưy chức năng thận nặng duợc điều trị bằng
docetaxel.
41
Hè thống thần kinh
Cần giám liều docetaxel khi có diễn tỉến độc thần kinh ngoại biên thể nặng (xem mục
“Liều lượng vả cách dừng")
Đôc tính trên tỉm
Đã quan sát thắy suy tim ở cảc bệnh nhân đuợc điều trị docetaxel phối hợp vởi
trastuzumab dặc biệt là khi điểu trị tiếp theo sau bằng hóa trị liệu có bao gổm anthracycline
(doxorubicin vả epriubicin). Tinh trạng nảy có thể vùa hoặc nặng vả có thể dẫn đến tử vong
(xem mục “Tác dụng không mong muốn”).
Nên đánh giá cảc chức nãng tim ngay từ ban đầu nếu dự định điều trị bệnh nhân bằng
docetaxel phổi hợp vởi trastuzumab. Chức năng tim nên được theo dõi chặt chẽ hơn trong
suốt quá trình điều trị (ví dụ 3 tháng 1 lấn) để giúp phát hìện các bệnh nhân mắc cảc rối Ioạn
về tim. Xem tóm tắt đặc tính thuốc của trastuzumab đề bìểt thêm chi tiết .
Cảnh báo khác
Các biện pháp tránh thai phái được ảp dụng cho cả nam và nữ trong suốt quá trình
điểu trị và ít nhẩt 3 tháng sau khi ngừng điều trị (xem mục “Phụ nữ mang thai vé cho con
bủ”). W
Cảo ca'nh báo thêm về sử dung thuốc trong điều tri bổ trơ un thư vú
Giám bach cầu trunz tính có biển chứng
Đối với bệnh nhân bị giảm bạch cầu trung tinh có biến chứng (giảm bạch cầu trung
tính kéo dải, gỉám bạch cầu trung tính gây sốt hoặc nhiễm khuẩn), nên cân nhắc sử dụng 6—
CSF vả giảm lìều (xem mục “Liều lượng vả cảoh dùng").
Các ghản ứng da dảỵ ruôt
Các trìệu chửng như đau bụng sớm vả nhạy cảm đau, sốt, tiêu cháy, kèm hoặc không
kèm gỉảm bạch cầu trung tính, có thế là những biều hiện sớm của các độc tính nghiêm trọng
trên dạ dây ruột vì thế nên được đánh giá vả điều trị nhanh chóng.
Suv tim xung huỵểt
Bệnh nhân nên được kiếm soát cảc trìệu chứng của suy tìm xung huyết trong suốt quá
trình điều trị và trong suốt giai đoạn theo dõi.
Bênh bach cầu
Bệnh nhân được diều trị bầng docetaxel, doxorubicin vả cyclophosphamìd (TAC) cần
được theo dõi về huyết học do có nguy cơ bị loạn sản tủy xuong muộn hoặc ung thư bạch cầu
dòng tùy muộn.
Ẹệnh nhân có > 4 hach bach huvết dương tính
T1 số lợi ích/nguy cơ của TAC đối với bệnh nhân có 2 4 hạch bạch huyết duơng tính
chưa đuợc xác định đầy đủ trong phân tich giữa kỳ (xem mục “Tính chẳt dược lực học”)
42
Người giá
Không có dữ liệu về các bệnh nhân trên 70 tuối điều trị docetaxel phối hợp với
doxorubicin vả cyclophosphamid.
Trong số 333 bệnh nhân được điểu tri docctaxel mỗi 3 tuần 1 lần trong một nghiên cứu
về ung thu tiền iiệt tuyển, có 209 nguời 65 tuổi hoặc hơn vả 68 bệnh nhân hơn 75 tuổi. Trong
các bệnh nhân được điều trị docetaxcl mỗi 3 tuần 1 lần, 11 hệ bệnh nhân 2 65 mối bị biến đối
về móng cao hơn 10% so với nhóm đối tượng trẻ hơn. Ti lệ bệnh nhân ì 75 tuối bị sổt, tiêu
chảy, chản ăn, và bị phù ngoại vi cao hơn 10% so với nhóm it hơn 65 tuối.
Trong 300 bệnh nhân (221 bệnh nhân 6 pha 111 và 79 bệnh nhân ở pha 11 cùa nghiên
cứu) được điều trị bằng docetaxel phối hợp với cisplatin vả 5-f1uorouracil trong nghiên cứu về
ung thư dạ dảy, có 74 người 2 65 tuối và 4 người 2 75 tuổi. Tỉ lệ mắc các biến cố bẩt lợi
nghiêm trọng ở nhóm các bệnh nhân lớn tuối cao hơn so với nhóm trẻ tuồi hơn. Tỉ lệ mắc cảc
biến cố bất lợi như (ở tắt cả cảc mức độ): hôn mê, viêm miệng, giám bạch cầu trung tính
nhiễm khuẩn ớ nhóm bệnh nhân 2 65 tuổi cao hơn hoặc bầng 10% so với nhóm trẻ tuổi hơn.
Người giả được đỉểu trị bằng TCP nên được kiềm soát chặt chẽ. M/
Cánh báo đăc biêt
Dược phẩm nảy chứa 27% ethanol (cồn), chắng hạn trong 160 mg (liều trung bình) có
chứa 4100mg cổn tương đương với ít hơn 100m1 bia.
Có hại cho những người nghiện rượu. Cần cân nhắc đổi với phụ nữ có thai, người cho
con bủ, tre“ em và nhỏm có nguy cơ cao như bệnh nhân bị bệnh gan hoặc các bệnh khác tảc
động lên hệ thống thần kinh trung uong.
Lượng cồn của thuốc nảy có thế lảm thay đổi tảc dụng cưa cảc thuốc khác.
10. Tương tác thưốc và các dạng tương tác khác.
Các nghiên cứu in vilro cho thấy quá trình chuyền hóa cùa docetaxcl có thế bị biển đối
khi sử dụng đồng thời với các thuốc khảo kích ứng, ức chế h0ặc được chuyền hóa bới
cytochrome P450-3A (vả vì vậy có thế ức chế enzyme một cảch cạnh tranh) như cyclosporine,
tcrfnadỉne, ketoconazole, erythromycin vả troleandomycin. Do đó cấn cẩn trọng khi điểu trị
cho bệnh nhân được chỉ định đổng thời docetaxel với các thuốc nảy do có khả năng gặp tương
tác thuốc đảng kề.
Docetaxel liên kểt với protein cao (>95%). Mặc dù khá nãng tương tác in vivo cưa
docctaxel với cảc thuốc sư dụng đồng thời vẫn chưa được nghiên cứu chính thức, các tương
tác in vitro với các thuốc liên kết với protein cao như crythromycin, diphenhydramin,
prooranolol, propafenone, phenytoin, salicylate, sulfamethoxazone vả sodium vaiproat không
ảnh hướng đến khả năng liên kểt protein của docetaxel. Hơn nữa, dexamethason không tảc
43
động đến liên kểt protein cúa docetaxel. Docetaxel không ánh hướng đển liên kết của
digítoxin.
Dược động học của docetaxel, doxorubicin vả cyclophosphamid không bị ảnh hướng
khi chúng đuợc dùng phối hợp với nhau. Dữ iiệu hạn chế từ một nghiên cứu đơn không đối
chứng đã gợi ý về tương tảc giữa docetaxel vả carboplatin. Khi phổi hợp với docetaxel, độ
thanh thái cùa carboplatin cao hơn 50% so với giá trị được báo cảo trước đó trong đơn trị lỉệu
bằng carboplatin. Dược động học cưa docetaxel khi có mặt prednisone đã được nghiên cứu ở
cảc bệnh nhân ung thu tiền liệt tuyến di căn. Docetaxel đuợc chuyền hóa bới CYP3A4 vả
prednisone được biết đển lá thuốc kỉch ửng CYP3A4. Không quan sảt thẳy tác dụng có y’
nghĩa thống kê của prednisone trên dược động học của docetaxel.
Docetaxel nên được chi định cấn trọng ở cảc bệnh nhân đuợc đỉểu trị đồng thời với
các chẳt có khả náng gây ủc chế CYP3A4 (chẳt ủc chế protease như ritonavir, chẳt chổng
nắm azole như ketoconazol hoặc itraconazol). Một nghiên cứu về tương tác thuốc tiến hảnh
trên các bệnh nhân đỉều trị bằng ketoconazol vả docetaxel cho thẩy độ thanh thái cùa
docetaxel giảm xuống một nưa khi phối họp với ketoconazole, có thể do quá trinh chuyền hóa
cúa docetaxel có liên quan tới CYP3A4 [ả con đường chuyến hóa chủ yểu (duy nhất) cùa
docetaxel. Sự giảm dung nạp docetaxel có thể xảy ra ngay cả với mức liểu thấp hơn. /
11. Quá Iiểư. M
Có một vải bảo cảo về quá liều. Chưa có thuốc giái độc cho docetaxel quá liều. Trong
trường hợp quá liều, bệnh nhân nên được giữ lại trong các đơn vị chuyên khoa và các chức
năng sống nên được kiềm soát chặt chẽ. Các biến cố bẩt 1ợi có thề trầm trọng hơn trong
trường hợp quá liều. Cảc biến chứng cùa quả liểu được dự bảc bao gồm suy tùy xương, nhiễm
độc thần kinh ngoại biên và viêm niêm mạc. Bệnh nhân nên được điều trị với G-CSF sớm
ngay khi có thể sau khi phải hiện ra quá liều. Các phương pháp điều trị triệu chứng thích hợp
nên đuợc áp dụng khi cần thiểt.
12. Trình bây vả đỏng gỏi.
Lọ thuỷ tinh (týp [) không mảư, nút chận bằng cao su, nắp bằng nhôm có kèm hoặc
không kèm vỏ bọc bảo vệ bên ngoải bằng chẩt dẻo (Onko- Safe).
Đỏng gói
Hộp 1 lọ 2 ml. Hộp1 lợ 8 ml.
13. Thận trọng đặc bỉệt khi sử dụng
Kiếm tra trước khi sử dung:
Giống như tắt cả các thuốc không dùng qua đường uống, dung dịch đậm đặc để pha
dung dịch tiêm truyền Docetaxel “Ebewe” nên được kỉềm tra bằng mắt để phải hiện cảc hạt lạ
44
hay hìện tượng đồi mảư trước khi sử dụng, cho cả dung dịch pha và lọ đựng, dung dịch pha
loãng mà có kết tùa thì nên loại bỏ. 1
Chuẩn bi dung dich tiêm truỵển. M/
Phải pha loãng trước khi sử dụng
Dung dịch tiêm truyền cần được chưẩn bị với natri chloride 0,9% hoặc glucose 5% và
dùng theo đường tiêm truyền tĩnh mạch. Dung dịch tiêm truyền có thế được chuẩn bị nhiều
nhẩt 4 giờ trước khi sử dụng. Lượng địch cần dùng có thế được rủt ra trục tỉếp khỏi lọ. Có thế
cần hơn 1 lọ đề có được mức liều cần dùng cho bệnh nhân. Dụa trên mủc liều cần dùng cho
bệnh nhận được tính bằng mg, rủt một lượng dịch tương ứng chứa lOmglmi docetaxel từ một
số lọ thuốc thích hợp trong điều kiện vô trùng, sử dụng bơm tiêm chia độ có gắn kim tiêm. Ví
dụ mức liều 140mg docetaxel yêu cầu 14m1 docetaxel dung dịch đậm đặc để pha dung dịch
tiêm truyền.
Tiêm lượng dịch cần dùng vảo tủi hoặc chai truyền dịch 250m1 có chứa dưng dịch
giucose 5% hoặc natri chlorid 0,9%.
Nếu một mức liều lớn hơn 200mg được yêu cầu thì sử dụng một dụng cụ truyền có thể
tích lớn hon nhờ vậy nồng độ docetaxel không bị vượt quá 0,74mg1m1.
Trộn đều dịch truyền trong tủi ho_ăc chai bằng cảch lắc bắng tay.
Dung dịch tiêm truyền docetaxel nên được sư dụng trong vòng 4 giờ và nên được tỉêm
truyền trong vòng 1 giờ trong điều kỉện vô trùng ớ nhiệt độ phòng (dưới 25°C) và trong điều
kiện ánh sáng bình thường. Theo quan điếm vi sinh học, sản phẩm nảy nên được sử dụng
ngay sau khi pha.
Sự tiếp xúc cùa dung dịch đậm đặc docetaxel với cảc thiết bị hoặc dụng cụ lảm bằng
chất dèo PVC dùng để chuẩn bị dung dịch đậm đặc dế pha dung dịch tiêm truyền không được
khuyến cáo. Nhằm mục đích hạn chế bệnh nhân tiếp xúc với chẩt de'o DEHP (di-2-ethylhcxyl
phtalat) có thế được tiết ra từ các tủi hoặc thiết bị truyền PVC, dung dịch pha loãng cuối cùng
để tiêm truyền Docetaxel “Ebewe” nên được đựng trong các chai (thủy tinh, poiypropylene)
hoặc tủi chất dèo (polypropylene, polyoleftn) vả tiêm truyền qua bộ dây tiêm truyền bằng
polyethylene.
pH vò nồng độ lhầm Ihấu cua dung dịch hoản nguyên
03 mglmL trong Glucose 5%: pH = 3,6; 517 mOsmlkg
0,74 mg/mL trong NaCl 0,9%: pH = 3,3 — 3,6; 849 mOsm/kg
Hướng dẫn xử lý an Ioản các thuống chống lân sinh.
Công tác chuẩn bị thuốc gây độc tế bảo không nên được thực hiện bới nhân viên có
thai. Nhân vỉên đã qua đảo tạo nên pha loãng thuốc nảy. Công việc nảy nên được tỉến hảnh 6
45
một khu vực riêng. Bề mặt cùa nơi thực hiện chuẩn bị thuốc nên được phủ bằng giấy thấm,
mặt dưới bằng chất dèo, dùng một lần.
Cánh bảo sủ dụng găng tay, mặt nạ, vả quẩn áo bảo vệ thích hợp. Cần cẩn trọng để
trách thuốc vô tinh tiểp xúc với da hoặc niêm mạc, vùng bị tiếp xúc nên được rửa sạch với xã
phòng và nước. Nếu thuốc tinh cờ tiếp xúc với mắt thì nên rứa sạch ngay với nuớc. Sử dụng
dụng cụ khóa Luer cho tất cả các bơm tiêm và thiết bị. Kim tiêm loại 1ớn được khuyến cáo sử
dụng để giảm thiếu áp 1ục vả khả náng hinh thầnh các bọt khí. Bọt khí có thể được giám thiếu
bằng cách dùng kim có lỗ thông khí (venting needle).
Bất kì lượng thuốc nảo không sử dụng đều nên được Ioại bó. Chăm sóc và cảnh bảo
thích hợp nên được đua ra trong việc loại bỏ các vật dụng dùng pha Ioãng Docetaxel
“Ebewe”. Bất kì một sán phầm không sử dụng hOặc vật dụng đã dính thuốc đều nên cho vảo
các túi chứa rác thải loại nguy cơ cao. Các vật sắc nhọn (như kim tiêm, bơm tiêm, lọ,…) nên
cho vảo một hộp cứng thích hợp. Cá nhân có liên quan đển việc thu nhặt vả loại bỏ cảc vật
phâm thải nảy nên có nhận thức về các rủi ro có thể gặp phải. Bất kì sán phấm nảo không sử
dụng hoặc nguyên liệu thửa nên được loại bớ theo các thủ tục chuẩn áp dụng cho các thuốc
gây độc tế bảo. Bắt ki luọng dung dịch thừa ra nên được xã sạch trực tiếp qua ống dẫn lưu với
một lượng nước lớn. /
Dược phẩm nảy chi dùng một lẩn. N
Tương kị
Dược phẩm nảy không được trộn với dược phấm khác.
Đường dùng
Docetaxel “Ebewe” chi dùng tiêm truyền tĩnh mạch.
14. Thời hạn sử dụng.
Dang đóng gỏi để bán:
Chưa mớ: 24 tháng
Sau khi mở trước khi pha loãne:
Độ ốn định về mặt vặt lý vả hóa học khi sử dụng được chúng minh lá trong 28 ngảy ớ
25°C sau khi đưa kim tiêm vảo vả rt'tt dịch ra.
Thời han sử dung sau khi pha loãng
Dộ ổn đinh về mặt vật lý vả hóa học khi sử dụng được chứng minh là 4 giờ ớ nhiệt độ
2 ~ 80C trảnh ảnh sáng và dưới 25°C không trảnh ánh sáng trong dung dịch glucose 5% và
sodium chlorid 0,9%(0,30mg1m1 vả 0,74mg/m1).
46
Trên quan điểm vi sinh học, sán phẩm nảy nên đuợc sử dụng ngay. Nếu không sử
dụng ngay lặp tức thì thời gian bảo quản khi
nhiệm của người sử dụng.
15. Thận trọng đặc biệt về bão quản
Dạng đóng gói đề bản
Bao quản ớ nhiệt độ không quá 25°C
Không lảm 1ạnh hoặc đóng băng
Giữ lọ ở trong hộp đề trảnh ánh sáng
sư dụng vả điều kiện trước khi sử dụng là trách
//
ÍỂ/
4/
Điều kiện bảo quân của sản phẩm sau khi đã pha loãng xem mục “thời hạn sử dụng”
PHÓ cục TRUÒNG
JVW 741% W …
ria
47 1.1 ' `
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng