










BỘ
Ct_fC 311 "
ĐÃ PH
.. 1
Lân đáuz..…
Thảnh phân:
Mỗi viên nén phán tán chứa:
Deferasirox ............. 500 mg
Tá dược: vừa đủ 1 viên nén
Chi đinh. cách dùng. chóng chỉ định. các
thông tin khác: đề nghị xem trong tờ
hướng dãn sử dụng kèm theo.
Để xa tầm by ừả em.
Đọc kỹ hưởng dẩn sử dụng trước khi
dùng.
Bảo quản:
Nơi khô ráo. tránh ánh sáng. nhiệt độ
đườiSO“C.
Rx _Thuốc bán theo đơn
Deferox 500
Deferasirox 500 mg
Hộp 1 ví x10 viẽn nẻn
450/19156
gng
sở đảng ký
SỐ 10 sản xuất :
Ngảy sán xuất :
Han dùng
Sán xuáttẹỉ:
CÒNG TY CP DƯỢC PHÁM TRUNG ươNG 2 -
DOPHARMA
Đia chi: Lô 27 Khu oỏng nghiệp Quang Minh. thi trán
Quang Minh. huyện Mê Linh. thánh phố Hà Nội.
Chủsởhữu sảnphẩmvảCỏngtyđăng ký.
CONGTYTNHH RELNPHARMA
Đia chi: 22Hi. đường 40. Khu dân cư Tân Quy
Đớng.phuớngnnthg.quặnzmảnhphóHò
ChiMinh.
Deferox 500
Deferasirox 500 mg
ỄỗanểẹYmổP DƯỢC PHAM TRUNG ƯơNG 2
- DOPHARMA
. “T“Ẹ'Um'ã'nầửiv“... &… *V'
Deferox 500
Deferasirox 500 mg
Sán xuất tai:
CÔNG TY CP DƯỢC PHẨM TRUNG ươNG 2
- DOPHARMA
ChủeởhữucảnphấmvèC d“ ':
CÔNGTYTNHH REUV Fffl angky
Deferox 500
Deferasirox 500 mg
Ế
Cả
O
sa…ánu: 5
cơncwcpoượcmkumuucươu …
—oommm
'sởhửusănphẩmvá '.
uGTY`I'NHHRELNPi-ICỪAIỄẸMẦẮGỦ9ky
Deferox 500
Deferasirox 500 mg
Sánxuáttại:
CÔNGTYCPDƯơCPHÀMTRUNGƯONGZ
—DOPHARMA
Chủsờhữusửiphấmvè
CÓNGTYTNHHRELNPH tyđmgkỵ
_ J
CTCP Dược phẫm trung ương 2 Hướng dẫn sử đụng thuốc DEFEROX 500 Trang 1112
RX- Thuốc “Ở
. O" `
`Í _ DEFEROX 500
THÀN p
Mỗi viên n
Hoạt chất: Deferasirox .......................................................... 500 mg
Tá dược: Cellulose vi tinh thế, lactose, povidon, bột talc, magnesi stearat, silicon dioxyd keo, natri
lauryl sulfat, crospovidon, Natri Croscarmellose.
DƯỢC LỰC HỌC
Cơ chế tác dụng: Deferasirox là chất tạo phức chelat (phức cảng cua) chọn lọc với sắt (dạng Fe“)
đường uống. Là một phối tử có 3 chạc, có ái lực cao với sắt, gắn với tỉ lệ 2 : 1. Mặc dù deferasirox có
ái lực thắp với kẽm và đồng, vẫn có khả năng giảm nồng độ trong huyết thanh của cảc vết kim loại nảy
sau khi uống deferasirox. Ý nghĩa lâm sảng của những sự giảm nảy lá không chắc chẳn.
Dược lực học của thuốc được đảnh giả trong một nghiên cứu về chuyền hóa sắt cho thấy deferasirox
(10, 20 vả 40 mg/kg/ngảy) trung bình có thề bải tiểt tương ửng 0,119; 0,329 và 0,445 mg sắtfkg thế
trọng/ngảy trong khảng tương tự trên lâm sảng (0,1 — 0,5 mg/kg/ngảy). Sự bải tiểt sắt chủ yếu là qua
A
phan.
. DƯỢC ĐỌNG HỌC
Hấp thu
Deferasirox được hấp thu sau khi uống với thời gian trung vị đạt nồng độ đinh trong mảu (Tmax) là
khoảng 1,5 — 4 giờ. Cmax vả AUC cùa thuốc tăng xấp xỉ tuyến tính với Iiều sau khi dùng liều đơn vả
cả khi ở trạng thải ổn đinh. Sinh khả dụng cùa deferasirox tăng lên do sự tích lũy 1,3 — 2,3 sau khi
dùng đa liều. Sinh khả dụng tuyệt đối (AUC) cùa viên phân tản tạo hỗn dịch uống deferasirox lả 70%
so với đường tĩnh mạch. Sinh khả dụng (AUC) cùa deferasirox có thể thay đổi khi dùng thuốc trong
bữa ăn.
Phân bố
Deferasirox liên kểt mạnh (khoảng 99%) với protein chủ yếu là albumin huyết thanh. Tỉ lệ thuốc hạn
chế trong tế bảo mảu lả 5% ở người. Thể tích phân bố 6 trạng thái ổn định (Vss) là 14,37 :1: 2,69 L 6
người lớn.
' Chuyến hóa
Sự glucuronid hóa là con đường chuyển hỏa chinh của deferasirox, sau đó bải tiểt qua ”t. Có thĂ xảy
ra sự thủy phân phức hợp glucuronid hóa ở ruột và sau đó tải hấp thu (chu trinh gan—m_ rasirox
CTCP Dược phẫm trung ương 2 Hưởng dẫn sử dụng thuốc DEFEROX 500 Trang 2/12
chủ yếu được glucuronid hóa bời UGTlAI chuyển thảnh UGTIA3 mức độ thấp hơn. Sự chuyến hóa
bởi CYP4SO có vẻ như ít xảy ra ở người (khoảng 8%). Sự thủy phân chất chuyến hóa glucuronid hóa
trong ruột sau đó tải hấp thu (chu trình gan—ruột) đã được xảc minh trong một nghiên cứu trên người
tình nguyện khỏe mạnh uống cholestyramin (gắn mạnh với deferasirox và chất liên hợp) 12 g X 2
lần/ngảy 4 và 10 giờ sau khi uống liều đơn deferasirox dẫn tới giảm sinh khả dụng (AUC) 45% do chu
trình gan — mật của deferasirox.
Thãi trừ
Deferasirox và chất chuyến hóa chủ yếu đảo thải qua phân (84% liều). Sự thải trừ qua thận cùa
deferasirox và chất chuyến hoá là tối thiểu (8% iiều dùng). Thời gian bán thải trung bình (t…) nằm
trong khoảng 8 — 16 giờ sau khi uống thuốc.
Dược động học trên các đối tượng đặc biệt
Bệnh nhi: Sau khi uống lỉều đơn hoặc đa, sinh khả dụng toản thân của thanh thiếu niên và trẻ em nhỏ
hơn so với người lớn. Ó bệnh nhân < 6 tuổi, sinh khả dụng toản thân khoảng 50% ở người lớn.
~ Người cao tuồi: Dược động học cùa deferasirox chưa được nghiên cứu trên người cao tuổi (từ 65 tuổi
trở lên).
Giới tính: Nữ giới có độ thanh thải biếu kiến thấp hơn so với nam giới (17,5%).
CHỈ ĐỊNH
Deferasirox được chỉ định điều trị bệnh quá tải sắt mạn tính do truyền mảu (1ắng đọng hemosiderin do
truyền máu) 6 bệnh nhân từ 2 tuối trở lên. Ở những bệnh nhân nảy, thuốc đã cho thấy lảm giảm nồng
độ sắt ở gan và nồng độ ferritin huyết thanh. Cảo nghiên cứu lâm sảng nhằm chứng minh gỉa tăng tỉ lệ
sống sót hoặc hiệu quả lâm sảng chưa được hoản thảnh.
Quyểt định khỏi đầu điều trị bằng deferasirox dựa trên sự cân nhắc giữa hiệu quả và nguy cơ của việc
điều trị trên 1âm sảng, có tinh đến các yếu tố như tuối thọ dự tính và cảc bệnh mắc kèm của bệnh nhân.
. An toản và hiệu quả cùa deferasirox khi dùng cùng với cảc liệu phảp tạo phức chelat với sắt khảo chưa
được công bố.
LIÊU LƯỢNG VÀ CÁCH DÙNG
Thông tin về Iiều
Trước khi bắt đầu điều trị, cần kiểm tra nồng dộ ferritin và sắt trong huyết thanh. Nguy cơ ^c tính có
thế gia tãng khi dùng thuốc ở bệnh nhân có mức dung nạp sắt thấp hoặc ở bện ân ng độ ferritin
huyết thanh chỉ tăng nhẹ.
Liều khời đầu khuyến cáo là 20 mg/kg thể trọng.
CTCP Dược phẩm trung ương 2 Hưởng dẫn sử dụng thuốc DEFEROX 500 Trang 3/12
Dùng deferasirox 1 lần/ngảy vảo lúc đói ít nhất 30 phủt trước bữa ăn, tốt nhất là cùng một thời điểm
hảng ngảy. Không nhai hoặc nuốt cả viên thuốc. Không dùng thuốc với cảc chế phẩm antacid có chứa
nhôm. Tính toản lìều (mg/kg/ngảy) lảm tròn đến liều nguyên viên gần nhất. Phân tán hoân toản viên
bằng cách khuấy cốc nước, nước cam ép, nước tảo ép cho đến lúc tạo được hỗn dịch đồng nhất. Phân
tản liều dưới 1 g trong 100 ml chất lỏng và từ 1 g trở lên trong 200 ml chất lỏng. Sau khi uống hết hỗn
dịch, thêm một lượng nhỏ nước để trảng cốc sau đó uống hết.
Quyết định loại phần sắt tích lũy dựa trên hiệu quả và nguy cơ trên lâm sảng đã được dự đoán. Ó bệnh
nhân cần điều trị bằng phương pháp tạo phức chelat với sắt, khuyến cáo rằng nên bắt đầu điều trị với
deferasirox khi có bằng chứng bị quá tải sắt mạn tính, ví dụ như truyền khoảng 100 mng hồng cầu
_ (khoảng 20 đơn vị đối với người 40 kg) và ferritin huyết thanh tương ứng › 1000 ụg/L.
Điều chỉnh liều
Deferasirox có thế cần phải điều chinh liều, ngừng hoặc dừng đo độc tinh hoặc do một trong những
nguyên nhân dưới đây:
Dựa trên ferritin huyết thanh:
Sau khi bắt đầu điều trị, cần theo dõi ferritin huyết thanh hảng thảng và điều chinh liều deferasirox nếu
cần mỗi 3 — 6 thảng dựa trên xu hướng ferritin huyết thanh. Điều chinh liều từng bước 5 hay 10 mg/kg
và phù hợp với đảp ứng của từng bệnh nhân và mục tiêu điều trị (duy trì hay giảm sắt trong cơ thể). Ở
bệnh nhân không được kiểm soát đầy đủ với liều 30 mg/kg (ví dụ, nồng độ ferritin huyết thanh liên tục
trên 2500 ụg/L và không thấy xu hướng giảm theo thời gian), có thế cân nhắc liều lên tới 40 mg/kg.
Không khuyến cảo dùng liễu trên 40 mg/kg.
Nếu ferritin huyết thanh giảm Iiên tục xuống dưới 500 pg/L, cân nhắc tạm thời ngừng thuốc.
' Dựa trên creatinin huyết thanh:
Đối với người lớn, giảm liều 10 mg/kg/ngảy nếu có tăng creatinin huyết thanh tới > 33% trên mức
trung binh trước khi điều trị trong 2 lần kiểm tra liên tiểp, và không thế là do nguyên nhân khác. Đối
với bệnh nhi, giảm liều 10 mg/kg/ngảy nếu nồng độ creatinin huyết thanh cao hơn mức giới hạn trên
của chỉ số bình thường tùy theo mức tuổi ớ 2 lần kiếm tra liên tiếp.
Dùng đồng thời với thuốc gây cám ứng UGT ( UDP-glucuronosyltransferase) hoặc cholestyramin:
Dùng đồng thời với thuốc gây cảm ứng UGT hoặc choiestyramin lảm giảm sinh khả dụng toản thân
của deferasirox (AUC). Trảnh dùng thuốc đồng thời với cholestyramin hoặc chẩt gây cảm ứng UGT
mạnh (ví dụ, rifampicin, phenytoin, phenobarbital, ritonavir). Nếu cần phải dùng đồng thời cảc thuốc
nây với nhau, cần cân nhắc tăng liều dùng của deferasirox lên 30 mg/kg, và theo dõi nồng độ ferritin
huyết thanh và đảp ứng lâm sảng để thay đối liều.
Suy gan: Tránh dùng deferasirox ở bệnh nhân suy gan nặng (Child-
' khời đầu ở bệnh nhân suy gan trung bình (ChiId-Pugh B). Theo dõi
CTCP Dược phẫm trung ương 2 Hướng dẫn sử dụng thuốc DEFEROX 500 Trang 4/12
(Child-Pugh C) hoặc trung binh (Child—Pugh B) đề phòng thiếu hoặc phản ứng bất lợi có thể cần chuẩn
độ liều.
CHỐNG CHỈ ĐỊNH
Deferasirox chống chỉ định ớ những bệnh nhân:
- Độ thanh thải creatinin < 40 lephủt hoặc creatinin huyết thanh > 2 lần giới hạn trên cùa giá trị
bình thường tùy lứa tuôi.
- Chức năng hoạt động kém và hội chứng loạn sản tủy nguy cơ cao hoặc di căn tiến triến.
- Số lượng tiểu cầu < 50 X 109ÍL.
- Quá mẫn với deferasirox và bất kỳ thảnh phần nảo cùa thuốc.
KHUYẾN CÁO VÀ THẬN TRỌNG
Thận
Suy thận cấp, gây tử vong ở một số bệnh nhân và yêu cầu thấm tách máu ở cảc bệnh nhân khác, đã
được báo cảo sau khi deferasirox được đưa ra thị trường. Hầu hết cảc trường hợp tử vong đều xảy ra ở
những bệnh nhân có bệnh đi kèm và những bệnh nhân rối loạn huyết học đang trong gỉai đoạn tiến
triển. Theo dõi creatinin huyết thanh vâ/hoặc độ thanh thải creatinin ở những bệnh nhân: có nguy cơ
biến chứng, có bệnh thận trước đó, người giả, mắc kèm các bệnh khác, hoặc dùng cảc thuốc gây ảp lực
trên thận. Theo dõi nghiêm ngặt chức năng thận ở những bệnh nhân có độ thanh thải creatinin giữa 40
và dưới 60 mL/phút, đặc bỉệt trong tình huống bệnh nhân có thêm cảc yếu tố nguy cơ có thể gây tổn
thương thận như dùng thuốc, mất nước hoặc nhiễm khuẩn nặng.
Đánh giá creatinin huyết thanh vảlhoặc độ thanh thải creatinin trước khi điều trị để thiết lập biếu đồ
các chỉ số cơ bản trước khi điều trị, thông qua một loạt cảc xét nghỉệm. Theo dõi creatinin huyết thanh
vâ/hoặc độ thanh thải creatinin hảng thảng sau đó. Ở các bệnh nhân có thêm cảc yếu tố nguy cơ trên
thận, theo dõi creatinin huyết thanh vả/hoặc độ thanh thải creatinin hảng tuần trong tháng đầu tiên điều
trị hoặc khi điều chinh chế độ điều trị hoặc hảng thảng sau đó.
Xem xét giám lỉều, ngưng, hoặc dừng thuốc nếu creatinin huyết thanh tăng. Nếu có sự gia tăng Iỉên tục
creatinin huyết thanh lên trên giới hạn trên cùa chỉ số binh thường tùy theo lứa tuổi, cần ngừng thuốc.
Chỉ khi creatinin nằm trong khoảng giới hạn binh thường, mới bắt đầu lại điều trị với deferasirox ở liều
thấp hơn sau đó tăng dần lên, nếu hiệu quả lâm sảng dự kiến lớn hơn nguy cơ tiềm ẫn,
Trong cảc nghiên cứu lâm sảng, đối với creatinin huyết thanh tăng trong 2 lần đo liên tiểp (> 33% ở
bệnh nhân trên 15 tuổi hoặc > 33% hoặc cao hơn giới hạn trên của chỉ số bình thường tùy theo mức
tuổi đối với cảc bệnh nhân dưới 15 tuổi), cần giảm liều deferasirox 10 mglkglngảy. Bệnh nhân có biền
đồ creatinin huyết thanh vượt giới hạn trên của chỉ số bình thường được loại trừ tr
lâm sâng.
’…J lì
Ẻa.oèf
CTCP Dược phẫm trung ương 2 Hưởng dẫn sử đụng thuốc DEFEROX 500 Trang 5/12
Trong cảc nghiên cứu lâm sảng, bệnh nhân điều trị bằng deferasirox có mức tãng creatinin huyết thanh
Iiên quan liều dùng. Những gia tăng nảy xảy ra ở tần số lớn hơn so với bệnh nhân điều trị bằng
deferoxamin (tương ứng 38% và 14% trong nghiên cứu 1; 36% và 22% ở nghiên cửu 3). Hầu như
creatinin vẫn duy trì trong giới hạn bình thường. Cũng đã có cảc bảo cáo bệnh ống thận ở cảc bệnh
nhân điều trị bằng deferasirox. Phần lớn những bệnh nhân nảy là trẻ em và thanh thiếu niên bị bệnh
thiếu mảu huyết tán (B-thalassemia) và nồng độ ferritin huyết thanh < 1500 pg/L.
Suy giảm chửc năng gan
Trảnh dùng thuốc ở bệnh nhân suy gan nặng (Child-Pugh C). Bệnh nhân suy gan trung bình (Child-
Pugh B) khuyến cảo giảm 50% liều khới đầu. Theo dõi nghiêm ngặt ở bệnh nhân suy gan nhẹ (Chỉld-
Pugh A) và trung bình (Child-Pugh B) có thể bị thiếu hoặc xuất hiện phản ứng ngoại ý cần phải định
lượng liều.
Trong nghiên cứu 1, 4 bệnh nhân dừng deferasirox do bất thường chức năng gan (viêm gan do thuốc ở
2 bệnh nhân và tăng transaminase huyết thanh ở 2 bệnh nhân). Đã có các báo cảo sau khi đưa thuốc ra
' thị trường về suy gan, một số tử vong, ở cảc bệnh nhân điều trị với deferasirox. Hầu hết những biến cố
xảy ra ở bệnh nhân trên 55 tuổi. Hầu hết cảc bảo cáo suy gan bao gồm các bệnh nhân có bệnh đi kèm,
bao gồm cả xơ gan và suy chức năng đa cơ quan. Cần theo dõi transaminase huyết thanh và bilirubin
trước khi khời đầu điều trị, mỗi 2 tuần trong tháng đè… tìên vả hảng thảng sau đó. Xem xét điều chinh
hoặc ngưng dùng thuốc khi có tăng nghiêm trọng hay kéo dải.
Dạ dây — ruột
Tử vong do chảy mảu tiêu hóa, đặc biệt ở bệnh nhân cao tuổi có 11 ảc tính huyết học tiến triển vả/hoặc
số lượng tiểu cầu thấp, đã được bảo cáo. Kích ứng, loét và chảy máu đường tiêu hóa trên không tử
vong đã được báo cáo ở cảc bệnh nhân, bao gồm trẻ em và thanh thiếu niên dùng deferasirox. Bác sĩ và
bệnh nhân cần chủ ý về dấu hiệu và triệu chứng loét và chảy mảu tiêu hóa khi dùng deferasirox và kịp
thời đảnh giả thêm và điều trị nếu phảt hiện biến cố ngoại ý trên tiêu hóa nghiêm trọng. Cần thận trọng
khi dùng deferasirox đồng thời với cảc thuốc gây loét hoặc chảy mảu, như các thuốc chống viêm
' không steroid (NSAIDs), corticosteroid, biphosphonat đường uống, hay thuốc chống đông máu.
Giảm tế bâo máu
Đã có cảc bảo cảo khi lưu hảnh thuốc trên thị trường (cá tự phát và từ cảc thử nghiệm lâm sảng), bao
gồm mất bạch cẩu hạt, giảm bạch cầu, giảm tiểu cầu, ở các bệnh nhân điếu trị bằng deferasirox. Một số
bệnh nhân tử vong. Mối liên hệ với điều trị bằng deferasirox chưa chắc chắn. Hầu hết cảc bệnh nhân đã
có rối loạn huyết học thường Iiên quan bệnh suy tủy xương. Cần theo dõi công th'c mảu thư` g `
xuyên. Cân nhắc ngưng điều trị ở bệnh nhân gỉảm tế bảo mảu không giải thích được. ế xét_g
tải điều trị với deferasirox một khi nguyên nhân gây giảm tế bảo mảu được lâm sáng tỏ
Inrbl
CTCP Dược phẫm trung ương 2 Hướng dẫn sử dụng thuốc DEFEROX 500 Trang 6/12
Mẫn cảm
Cảc phản ứng quả mẫn nghiêm trọng (như sốc phản vệ và phù mạch) đã được bảo cảo ở bệnh nhân
dùng deferasirox, với khới phát của phản ứng xảy ra ở phần lớn cảc trường hợp trong thảng đầu tiên.
Nếu phản ứng là nghiêm trọng, dừng thuốc và can thiệp y tế thích hợp.
Phát ban
Có thể xuất hiện phảt ban trong quá trình điều trị với deferasirox. Đối với phát ban từ nhẹ đến trung
binh, có thể tiếp tục điều trị mà không cần điều chinh liều, do phát ban có thể tự hết. Trong cảc trường
hợp nghiêm trọng, cần ngưng thuốc. Có thể xem xét tải điều trị ở mức liều thấp hơn phối hợp với cảc
steroid dạng uống trong thời gian ngắn. Đã có bảo cảo về hồng ban đa dạng khi điều trị với
_ deferasirox.
Bệnh mắc kèm
Các thử nghiệm lâm sảng nhằm chứng minh tỉ lệ sống sỏt tăng lên và xảo minh hiệu quả lâm sảng chưa
được hoản thảnh. Deferasirox cho thấy lảm giảm ferritin huyết thanh và nồng độ sắt trong gan trong
cảc thử nghiệm lâm sảng. Cân nhắc tầm quan trọng của cảc yếu tố nây cũng như các yểu tố từng cá thể
bệnh nhân và tiên lượng do trạng thải tiềm ẩn trước khi khởi đầu điều trị với deferasirox.
Khi thuốc lưu hảnh trên thị trường, đã có bảo cáo về các phản ứng bất lợi nghiêm trọng, một số đã dẫn
tới tử vong 6 bệnh nhân dùng deferasirox, chủ yếu 0 bệnh nhân cao tuối, biến chứng từ cảc bệnh tỉềm
tảng hoặc bệnh rất nặng. Hầu hết các trường hợp tử vong xảy ra trong vòng 6 thảng sau khi điều trị với
deferasirox và nói chung sẽ lảm xấu đi tinh trạng bệnh tiềm tảng. Cảo bảo cáo không loại trừ khả năng
deferasirox đóng vai trò trong sự tử vong.
Các giác quan đặc bỉệt
— Rối loạn thính giảc (mất khả năng nghe tần số cao, giảm thính giảc), vả rối loạn thị giảc (mờ mắt, đục
thùy tinh thế, tăng nhãn ảp, và rối loạn võng mạc) đã được báo cáo với tần số < 1% khi đỉều trị với
deferasirox trong cảc nghiên cứu lâm sảng. Khuyến cảo kiếm tra thính giảc và thị giảc (cả khảm đèn
khe vả giãn nở võng mạc) trước khi điều trị bằng deferasirox và đều đặn sau đó (mỗi 12 thảng). Nếu
xuất hiện rối loạn, xem xét giảm liều hoặc ngưng dùng thuốc.
Xét nghiệm
Kiềm tra ferritin hảng tháng để đánh giá đáp ửng với đỉều trị và đảnh giá khả năng tạo phức chelat với
sắt quá mức. Nếu ferritin huyết thanh liên tục giảm xuống dưới 500 ụg/L, xem xét tạm ngừng điều trị.
Trong cảc nghiên cửu lâm sảng, hệ số tương quan giữa ferritin huyết thanh và LI ` O . Do đó, thay
dối nồng độ ferritin huyết thanh không phải luôn luôn phân ảnh sự thay đổi LIC.
Tìến hảnh theo dõi xét nghiệm chức năng thận và gan.
_ Độc tính không lâm sảng:
Ung thư hỏa, biến đổi gen và suy giãm chức năng sinh sản:
hái
[ ệJ` ."Í i-.» .
CTCP Dược phẫm trung ương 2 Hướng đẫn sử dụng thuốc DEFEROX 500 Trang 7l12
Một nghiên cứu 104 tuần về gây ung thư bằng đường uống ở chuột Wìstar không thấy có bằng chứng
về sự gây ung thư cùa deferasirox ở liều lên tới 60 mg/kg/ngảy (0,48 lần MRDH (Maximum
Recommended Human Dose — Liều khuyến cảo tối đa ở người) tính trên mglm²). Một nghiên cứu 26
tuần về gây ung thư bằng đường uống ở chuột biến đổi gen p53 (+/-) không thấy có bằng chứng
deferasirox gây ung thư ở 1iều lên tới 200 mg/kg/ngảy (0,8 lần MRHD tinh trên mg/m²) ở chuột đực
và liều 300 mg/kg/ngảy (1,21 lần MRDH tính trên ngm²) 6 chuột cái.
Deferasirox âm tính với test Ames và kiểm tra đột biển thể nhiễm sắc lympho bảo ngoại vi. Thuốc
dương tính với xét nghiệm vì nhân đường uống ở chuột in vivo.
Liều deferasirox lên tới 75 mg/kg/ngảy (0,6 lần MRHD tính trên mg/m²) cho thấy không có tảc dụng
ngoại ý trên khả năng sinh sản của chuột đực và cải.
ẤNH HƯỞNG ĐẾN KHẢ NĂNG LÁI XE VÀ VẬN HÀNH MÁY MÓC
Không có nghiên cứu về tảo dụng của deferasirox lên khả năng lảỉ xe và vận hảnh máy móc. Bệnh
nhân đã từng bị phản ứng ngoại ý về chóng mặt cần thận trọng khi lâi xe và vận hảnh máy móc.
TƯỢNG TÁC THUỐC
Dùng đồng thời deferasirox với các chế phẩm kháng acid (antacid) có chứa nhôm chưa được nghiên
' cứu chính thức. Mặc dù deferasirox có ải lực thấp với nhôm hơn là với sắt, không dùng deferasirox với
cảc chế phẩm antacid có chứa nhôm.
Tác đụng của deferasirox trên câc enzym chuyển hóa thuốc:
Deferasirox ức chế CYP3A4, CYP2C8, CYP1A2, CYP2A6, CYP2D6, vả CYP2CI9 ở người in vitro.
Không rõ sự ức chế của deferasirox với CYP2A6, CYP2D6 vả CYP2CI9 trên lâm sảng.
Tương tác với midazolam và các tảc nhân chuyển hỏa bới CYP3A4 khác:
Ở người tình nguyện khỏe mạnh, dùng đồng thời deferasirox với midazolam (cơ chất của CYP3A4)
dẫn tới giảm nồng độ đỉnh của midazolam khoảng 23% và sinh khả dụng khoảng 17%. Trong thực tế
lâm sảng, tác dụng nảy có thể sẽ rõ hơn. Do vậy, theo khả năng giâm nồng độ của cơ chất CYP3A4 và
bị mất hiệu quả, cần thận trong khi dùng đồng thời deferasirox với cảc thuốc chuyến hóa bới CYP3A4
(ví dụ, cyclosporin, simvastatin, cảc tảo nhân trảnh thai nhờ hormon).
_ Tương tác với repaglidin và các tác nhân chuyển hóa bởi CYP2C8 khác:
Trong một nghiên cứu trên người tinh nguyện khỏe mạnh, dùng đồng thời deferasirox (30 mg/kg/ngảy
trong 4 ngảy) vả cơ chất của cvpzcs repaglinid (liều đơn 0,5 mg) dẫn tới sinh khả dụng toản thân của
repagiinid (AUC) tãng iên tới gấp 2,3 lần mức kiếm soát và Cmax tăng 62%. Nếu deferasirox vả
repaglinid được dùng đồng thời, xem xét giảm Iiều repaglinid và theo dõi chặt chẽ nồn độ glucose
máu. Cần thận trọng khi dùng deferasirox với các cơ chắt của CYP2C8 khác
Tương tảc với theophyllin và các tảc nhân chuyển hóa bởi CYP1A2 khác:
CTCP Dược phẩm trung ương 2 Hưởng dẫn sử dụng thuốc DEFEROX 500 Trang 8/12
Trong một nghiên cứu lâm sảng trên người tinh nguyện khỏe mạnh, dùng đồng thời deferasirox (liều
lặp lại 30 mg/kglngây) và cơ chất của CYP1A2 theophyllin (liều đơn 120 mg) dẫn tới xấp xỉ gấp đôi
' AUC và thời gian bản thải của theophyllin. Cmax của liều đơn không bị ảnh hưởng, nhưng dự đoán
Cmax cùa theophyllin sẽ tãng khi dùng dâi ngảy. Sự gia tăng nồng độ trong huyết tương nảy có thể dẫn
tới có các triệu chứng lâm sảng trên thần kinh trung ương do theophyllin hoặc các triệu chứng khác.
Trảnh dùng đồng thời theophyllin hoặc cảc cơ chất CYP1A2 có chi số điều trị thấp với deferasirox.
Nếu buộc phải dùng đồng thời, theo dõi nồng độ theophyllin vả xem xét điều chỉnh liều.
Cần thận trọng khi dùng deferasirox với các thuốc chuyền hóa bởi CYP1A2 khảc như cyclobenzaprin,
imipramin, haioperidol, fiuvoxamin, mexiletin, olanzapin, tizanidin, zileoton, vả zolmitriptan.
Tương tảc với các tác nhân cảm ứng UDP — glucoronosyltransferase (UGT):
Trong một nghiên cứu trên người tinh nguyện khỏe mạnh, dùng đồng thời deferasirox (liều đơn 30
mg/kg) với chất gây cảm t'mg UGT mạnh rỉfampicìn (600 mg/ngảy trong 9 ngảy) dẫn tới giảm sinh khả
dụng cùa deferasirox (AUC) 44%. Do đó, dùng deferasirox với các thuốc gây cảm ứng UGT mạnh (ví
' dụ, rifampicin, phenytoin, phenobarbital, ritonavir) có thể gây thiếu deferasirox.
Trảnh dùng đồng thời cảc thuốc gây cảm ứng UGT mạnh với deferasirox mạnh. Nếu buộc phải dùng
đồng thời với cảc thuốc nảy, cân nhắc tăng liều khởi đầu deferasirox lên 30 mg/kg và theo dõi nồng độ
ferritin huyết thanh và đáp ứng lâm sảng để tiếp tục điều chinh liều.
Tương tác với cholestyramin:
Dùng đồng thời deferasirox với cholestyramin dẫn tới thiếu deferasirox. Ở người tinh nguyện khỏe
mạnh, dùng cholestyramin sau một lỉều đơn deferasirox dẫn tới giảm 45% sinh khả dụng (AUC) của
deferasirox. Tránh dùng đồng thời cholestyramin vả deferasirox. Nếu buộc phải dùng cảc tác nhân nây
với nhau, cân nhắc điều chinh lỉều deferasirox tới 30 mg/kg và theo dõi nồng độ ferritin huyết thanh và
đảp ứng lâm sảng dễ tiếp tục điều chỉnh liều.
sử DỤNG CHO PHỤ NỮ có THAI VÀ CHO CON BỦ
- Phụ nữ có thai
Phụ nữ có thai nhóm C.
Không có nghiên cứu đầy đủ và có kiểm soát khi dùng deferasirox trên phụ nữ có thai. Dùng
deferasirox ở động vật trong thời gian mang thai và nuôi con bú dẫn tới giảm khả năng sống sót của
thai và tăng tỉ lệ bất thường chức năng thận ở thai nhì là nam giới ở nồng độ nhỏ hơn nồng độ khuyến
cảo ở người. Chỉ nên dùng deferasirox ớ phụ nữ có thai khi mà lợi ích nhiều hơn nguy cơ dối với thai
nhi.
Trong các nghiên cứu trên sự phảt triển của thai nhi, chuột và thô có thai đ Ăng d rasirox trong
quá trình hinh thảnh cảc cơ quan ở liều lên tới 100 mg/kg/ngảy ở chuột và g/ngảy ở thò (0,8
L— .. …...q
CTCP Dược phẫm trung ương 2 Hướng đẫn sử dụng thuốc DEFEROX 500 Trang 9112
lần liều khuyến cáo tối đa trên người tính trên ngm²). Quan sát thấy những liều nảy dẫn tới độc tính ớ
người mẹ nhưng không có hại dối với thai nhi.
Trong một nghiên cứu về sự phảt triến trưởc và sau khi sinh, chuột có thai uống deferasirox hảng ngảy
từ khi hình thảnh các cơ quan tới ngảy 20 cho con bù 0 liều 10, 30 và 90 mg/kg/ngảy tương ứng gấp
0,08; 0,2; và 0,7 lần liều khuyến cáo tối đa trên người tính trên mg/m². Độc tính trên mẹ, mất thể tích,
và giảm khả năng sống cùa thai xuất hiện ở mức 0,7 lẩn liều khuyến cáo tối đa trên người tính trên
ngm², và tăng tỉ lệ bất thường thận ớ thai nhi là nam xảy ra ở mức 0,2 lần liều khuyến cảo tối đa trên
người tính trên mgfm².
Phụ nữ nuôi con bú
. Không rõ deferasirox có bải tiết vảo sữa mẹ hay không. Deferasirox vả chẩt chuyển hóa được bảì tiết
trong sữa của chuột. Do có nhiều thuốc bải tiết vảo sữa mẹ và do khả năng xảy ra cảc phản ứng ngoại ý
nghiêm trọng ở trẻ bú mẹ do deferasirox và chất chuyến hóa, cần cân nhắc ngừng cho con bú hoặc
ngừng thuốc, tùy vảo tầm quan trọng của thuốc đối với người mẹ.
TÁC DỤNG KHÔNG MONG MUÔN
Dữ liệu trong các thử nghiệm lâm sâng:
Cảc phản ứng ngoại ý sau đã được thảo luận trong các phần trước:
Suy thận, suy gan, chảy mảu tiêu hóa tử vong và không tử vong, giảm tế bảo mảu.
Do cảc thử nghiệm iâm sảng được tiến hảnh ở cảc điều kiện khảo nhau, tỉ lệ các phản ứng ngoại ý quan
sảt thấy trong cảc thử nghiệm lâm sảng cùa thuốc không thế so sánh trực tỉểp với tỉ lệ trong các thử
nghiệm lâm sảng cùa thuốc khảo và có thế không phản ảnh được tỉ lệ quan sảt được trên thực tế.
, Tổng số 700 bệnh nhân người lớn và trẻ em được điều trị với deferasirox trong 48 tuần trong nghiên
cửu tiền thị trường. Trong đó bao gồm 469 bệnh nhân thiếu mảu tan máu (3 (B-thalassemia), 99 bệnh
nhân thiếu máu hiểm và 132 bệnh nhân bị hồng cầu lưỡi liềm. Trong số đó, 45% là nam giới, 70% là
người da trắng và 292 bệnh nhân dưới 16 tuổi. ờ nhóm bệnh nhân bệnh hồng cầu lưỡi liềm, 89% lá
người da đen. Trung vị thời gìan điều trị cho bệnh nhân hồng cầu lưỡi liềm là 51 tuần. Trong số 700
bệnh nhân được điều trị, 469 bệnh nhân (403 bệnh nhân thiếu mảu tan mảu và 66 bệnh nhân thiếu mảu
hiếm tham gia vảo phẩn mở rộng cùa đề cương nghiên cứu ban đầu. Trong cảc nghiên cứu mở rộng,
trung vị thời gian điếu trị là 88 - 205 tuần.
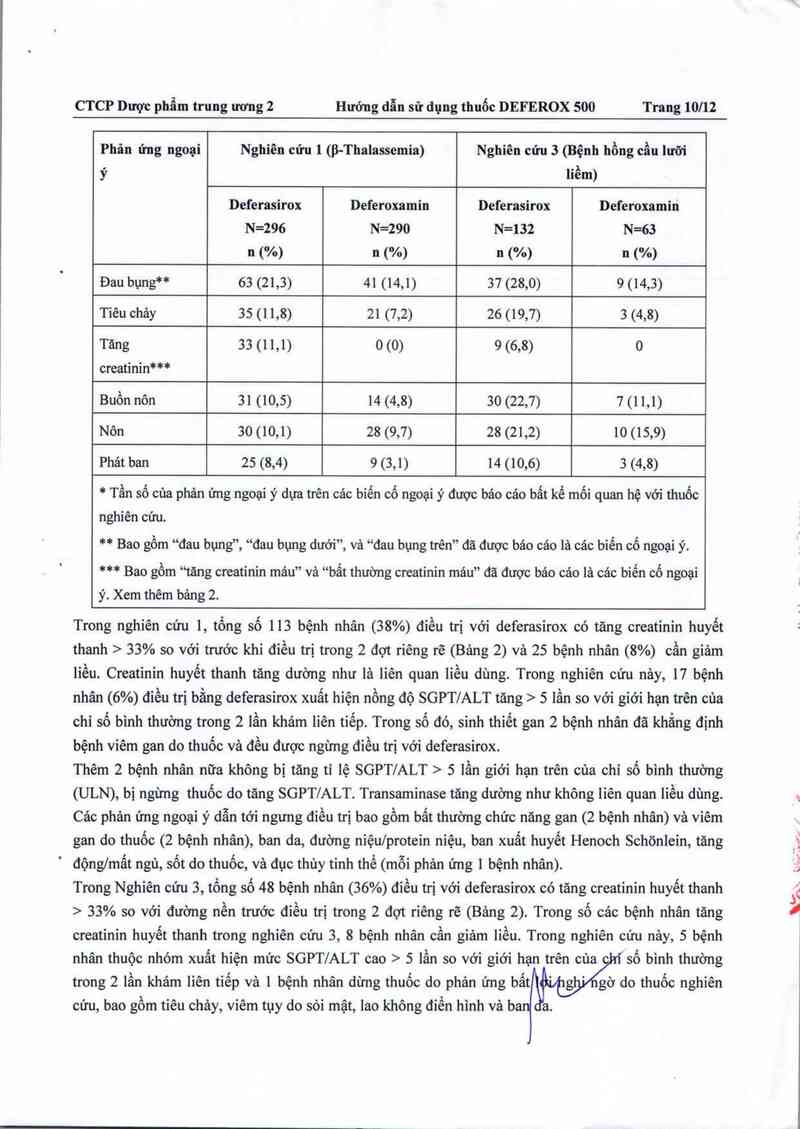
Bảng 1 biếu diễn các phản ứng ngoại ý xảy ra › 5% ớ bệnh nhân thiếu máu tan mảu (3 (Nghiên cứu 1)
và bệnh nhân bị hồng cầu lưỡi liếm (Nghiên cứu 3) điều trị bằng deferasirox với nghi ngờ liện quan
đến thuốc nghiên cứu. Đau bụng, buồn nôn, nôn, tiêu chảy, ban da, và tăng creatinin huyết thanh là
những phản ứng ngoại ý thường gặp nhất đã được bảo cảo với nghi ngờ 1ả do deferasirox. Các triệu
chứng tiêu hóa, tăng creatinin huyết thanh và ban da là có phụ thuộc liều dùng.
' Bảng 1: Cảc phản ứng ngoại ý xuất hiện ở > 5% bệnh nhân điều trị b erasirox trong
Nghiên cứu 1 và Nghiên cửu 3*
`9\ \\ r
CTCP Dược phẫm trung ương 2 Hướng dẫn sữ dụng thuốc DEFEROX 500 Trang 10112
Phản ứng ngoại Nghiên cứu 1 (lì-Thalassemia) Nghiên cứu 3 (Bệnh hồng cầu lưỡi
ý liềm)
Deferasirox Deferoxamin Deferasirox Deferoxamiti
N=296 N=290 N=132 N=63
n (%) n (%) n (%) n (%)
Đau bụng** 63 (21,3) 41 (14,1) 37 (28,0) 9 (14,3)
Tiêu chảy 35 (11,8) 21 (7,2) 26 (19,7) 3 (4,8)
Tăng 33 (11,1) 0 (0) 9 (6,8) 0
creatinin***
Buồn nôn 31 (10,5) 14 (4,8) 30 (22,7) 7 (11,1)
Nôn 30 (10,1) 28 (9,7) 28 (21,2) 10 (15,9)
Phát ban 25 (8,4) 9 (3,1) 14 (10,6) 3 (4,8)
* Tần số của phản ứng ngoại ý dựa trên cảc biến cố ngoại ý được báo cáo bất kể mối quan hệ với thuốc
nghiên cửu.
** Bao gồm “đau bụng”, “đau bụng dưới”, và “đau bụng trên” đã được báo các lá các biến cố ngoại ỷ.
*** Bao gồm “tăng creatinin máu” và “bất thường creatinin máu” đã được báo cáo là cảc biến cố ngoại
ý. Xem thêm bảng 2.
Trong nghiên cứu 1, tổng số 113 bệnh nhân (38%) điếu trị với deferasirox có tăng creatinin huyết
thanh > 33% so với trước khi điều trị trong 2 đợt riêng rẽ (Bảng 2) và 25 bệnh nhân (8%) cần giảm
liều. Creatinin huyết thanh tăng dường như là liên quan liều dùng. Trong nghiên cứu nảy, 17 bệnh
nhân (6%) điều trị bằng deferasirox xuất hiện nồng dộ SGPT/ALT tăng › 5 lần so với giới hạn trên của
chi số bình thường trong 2 lần khảm liên tiểp. Trong số đó, sinh thiết gan 2 bệnh nhân đã khẳng định
bệnh viêm gan do thuốc và đểu được ngừng điều trị với deferasirox.
Thêm 2 bệnh nhân nữa không bị tăng tỉ lệ SGPT/ALT > 5 lằn giới hạn trên cùa chỉ số bình thường
(ULN), bị ngừng thuốc do tăng SGPT/ALT. Transaminase tăng dường như không liên quan liều dùng.
Các phản ứng ngoại ý dẫn tới ngưng điều trị bao gồm bất thường chức năng gan (2 bệnh nhân) và viêm
gan do thuốc (2 bệnh nhân), ban da, đường niệulprotein niệu, ban xuất huyết Henoch Schõnlein, tăng
' động/mất ngù, sốt do thuốc, và đục thủy tinh thế (mỗi phản ứng 1 bệnh nhân).
Trong Nghiên cứu 3, tổng số 48 bệnh nhân (36%) điều trị với deferasirox có tăng creatinin huyết thanh
> 33% so với đường nền trước điều trị trong 2 đợt riêng rẽ (Bảng 2). Trong số cảc bệnh nhân tăng
creatinin huyết thanh trong nghiên cứu 3, 8 bệnh nhân cần giảm liếu. Trong nghiên cứu nảy, 5 bệnh
nhân thuộc nhóm xuất hỉện mức SGPT/ALT cao › 5 lần so với giới hạn trên của
trong 2 lần khảm liên tiếp và 1 bệnh nhân dừng thuốc do phản ứng bất ' '
số bình thường
gờ do thuốc nghiến
cứu, bao gồm tỉêu chảy, viêm tụy do sỏi mật, lao không diển hình và ba
Hướng dẫn sử dụng thuốc DEFEROX 500 Trang 11112
CTCP Dược phẫm trung ương 2
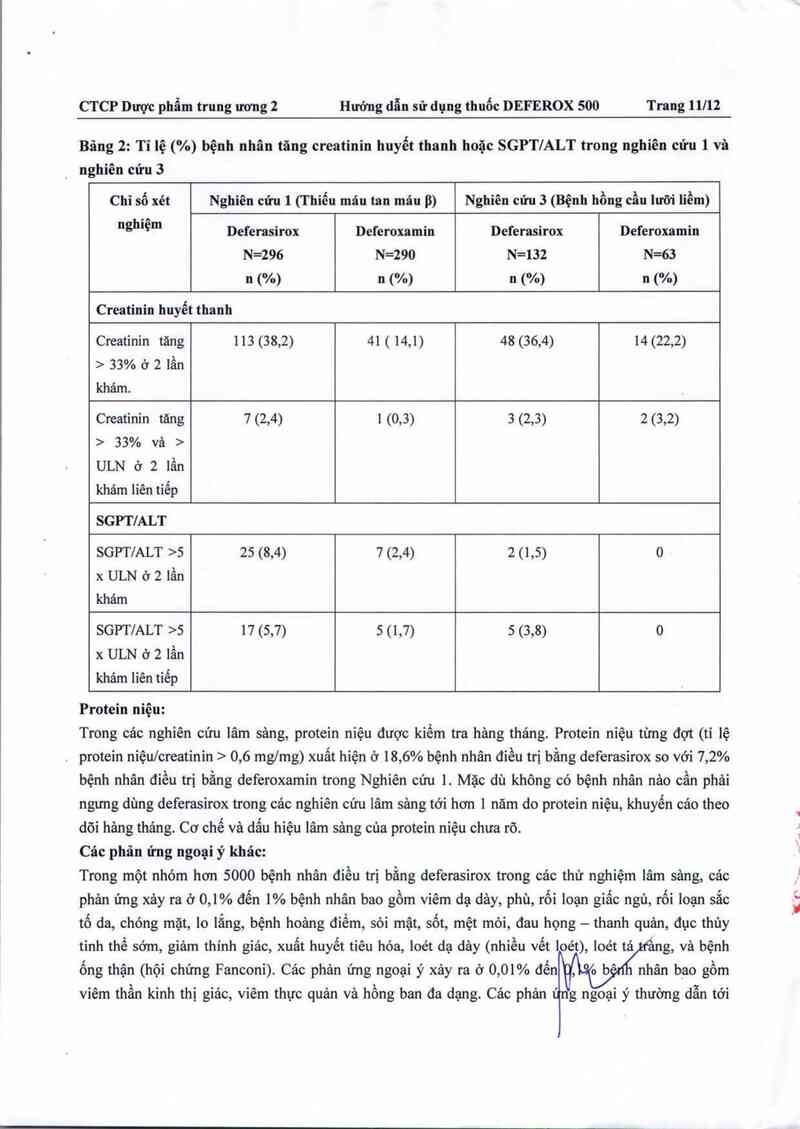
Bảng 2: Tỉ lệ (%) bệnh nhân tăng creatinin huyết thanh hoặc SGPT/ALT trong nghiên cứu 1 và
_ nghiên cứu 3
Chỉ số xét Nghiên cửu 1 (Thiếu mảu tan máu p) Nghiên cứu 3 (Bệnh hồng cầu lưỡi liềm)
nghiệm Deferasirox Deferoxamin Deferasirox Deferoxamin
N=296 N=290 N=132 N=63
n (%) n (%) n (%) n (%)
Creatinin huyết thanh
Creatinin tăng 113 (38,2) 41 ( 14,1) 48 (36,4) 14 (22,2)
› 33% 0 2 lần
khám.
Creatinin tăng 7 (2,4) 1 (0,3) 3 (2,3) 2 (3,2)
› 33% và ›
ULN ở 2 lần
khảm liên tiếp
SGPTIALT
SGPT/ALT ›5 25 (8,4) 7 (2,4) 2 (1,5) 0
x ULN 6 2 lẩn
khám
SGPTIALT >5 17 (5,7) 5 (1,7) 5 (3,8) 0
x ULN 6 2 lần
khảm liên tiếp
Protein niệu:
Trong các nghiên cứu lâm sảng, protein niệu được kiếm tra hảng thảng. Protein niệu từng đợt (tỉ lệ
. protein niệu/creatinin > 0,6 mglmg) xuất hiện ở 18,6% bệnh nhân điều trị bằng deferasirox so với 7,2%
bệnh nhân điều trị bằng deferoxamin trong Nghiên cứu 1. Mặc dù không có bệnh nhân nâo cần phải
ngưng dùng deferasirox trong các nghiên cứu lâm sảng tới hơn 1 năm do protein niệu, khuyến cảo theo
dõi hảng thảng. Cơ chế vả dắu hiệu lâm sảng cùa protein nỉệu chưa rõ.
Các phân ứng ngoại ý khảc:
Trong một nhóm hơn 5000 bệnh nhân diều trị bằng deferasirox trong các thử nghiệm lâm sảng, cảc
phản ứng xảy ta ở 0,1% đến 1% bệnh nhân bao gồm vỉêm dạ dảy, phù, rối loạn giấc ngủ, rối loạn sắc
tố da, chóng mặt, lo lắng, bệnh hoảng đỉếm, sòi mật, sốt, mệt mòi, đau họng - thanh quản, đục thùy
tinh thể sởm, giảm thính giảc, xuất huyết tiêu hóa, loét dạ dảy (nhiều vết loét), loét tả
ống thận (hội chứng Fanconi). Cảc phản ứng ngoại ỷ xảy ra ở 0,01% đến
ng, và bệnh
nhân bao gồm
viêm thần kinh thị giác, vỉêm thực quản và hồng ban đa dạng. Các phản ' g ngoại ý thường dẫn tới
'ct'n ——
CTCP Dược phẫm trung ương 2 Hướng dẫn sữ dụng thuốc DEFEROX 500 Trang 12|12
phải ngưng thuốc hoặc điều chinh liều dùng trong cảc nghiên cứu lâm sảng bao gồm phát ban, rối loạn
tiêu hóa, nhiễm khuẩn, tăng creatinin huyết thanh và tăng transaminase huyết thanh.
Nghiên cứu trong quá trình lưu hânh thuốc:
Cảo phản ứng ngoại ý sau được bảo cảo trong quả trinh sử dụng deferasirox. Do những phản ứng bất
lợi được tự nguyện báo cáo bởi nhóm người không rõ cỡ mẫu, ở những bệnh nhân nảy có thể đang
dùng đồng thời nhiều thuốc, nên không phải lủc nảo cũng ước tính được tần số một cách tin cậy và đưa
ra mối quan hệ nhân quả đối với thuốc điều trị.
Rối loạn da và mô dưới da: Viêm tiếu mạch ở da, mề đay, rụng tóc.
Rối loạn hệ miễn dịch: phản ứng quả mẫn (bao gồm cả sốc phản vệ và phù mạch).
QUẢ LIÊU VÀ XỬ TRÍ KHI QUÁ LIÊU
Các trường hợp quá liều (liều gấp 2 — 3 lần lỉều được kê trong vải tuần) đã được báo cáo. Trong một
trường hợp, quá liều dẫn tới viêm gan mà mất đi sau một thời gian ngưng thuốc. Liều đơn lên tới 80
mg/kglngảy ở bệnh nhân thỉếu mảu huyết tản bị quá tải sẳt đã bị nôn và tiêu chảy. Ở người tinh nguyện
khỏe mạnh, có thẻ dung nạp được Iiếu iên tới 40 mglkg/ngảy. Không có chất giải độc đặc hỉệu cho
deferasirox. Trong trường hợp quá liều, ảp dụng biện phảp gây nôn vả rừa dạ dảy.
TRÌNH BÀY
Hộp 1 ví >< 10 viên
HẠN DÙNG
_ 24 tháng kể từ ngảy sản xuất
Không sử dụng thuốc quá hạn dùng in trên nhãn hộp
BẢO QUẢN
Bảo quản nơi khô, nhiệt độ dưới 30°C, tránh ảnh sáng.
THUỐC NÀY CHỈ DÙNG THEO ĐON CỦA BÁC SỸ
ĐỌC KỸ HƯỚNG DĂN sử DỤNG TRƯỚC KHI DÙNG
NỂU CÀN THÊM THÔNG TIN XIN HỎI Ý KIÊN BẢC sĩ, DƯỢC sĩfU°UỄJFỄỊỄỀỄZỄ
ĐỂ XA TÀM TAY TRẺ EM n .: ffl- nổ Jt’ẳìng
I' 6 t
Sán xuất tại: CÔNG TY CP DƯỢC PHẨM TRUNG ƯO'NG 2
Lô 27 khu công nghiệp Quang Minh, thị trấn Quang Minh, huyện Mê Linh, thảnh phố Hà Nội. )
Chủ sở hũu sản phấm vả cóng ty đăng ký: CÔNG TY TNHH RELIV
Số 22H], Đường số 40, Khu dân cư Tân Quy Đông, Phường Tân Phong, Quận ố Hồ Chí Minh.
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng