






cồơcE Z.…ìm O…ẵ… ỏ ...ỡ
3Ềm
A…x…mx.ẵầắ
ỉmẫtz... ẵmẽzm Znẩ ỡcẵ...
OOua
XXÍX : . i < : . v
OS Ncắ OEnư
43>` 3. Im…anẵễ:
Ế
\ ÊìN.NOỆ
Amx…mxẳo/
zx Emễảằẵ aễu
ESAỄỄ REE…
..ozcẫỉma uoc 36
' umxmmn WỘỘ 3…nqnmqmắu
o offl:…9 xmmư mã u.…mxuom .…w…ĩ… ấỂ…n. ẫo.
uex o… _ ư..ỂE …… ổ ầã.Gmỡa ……Ễmữ
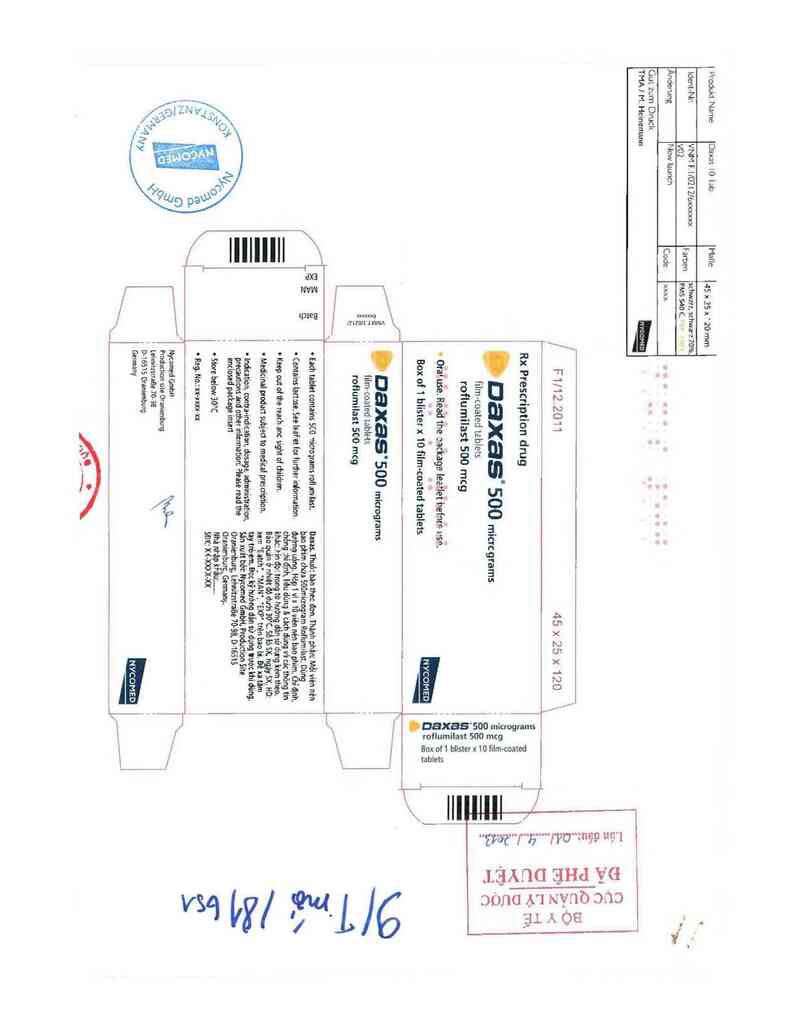
.DaXĐS'SOO mỉcograms
Box of 1 blister x 10 tilm-coated
roflumilast 500 mcg
tablets
:::.SEẺ EưĨ…
..oacẵzmun …nó 36
ulnug
lĨlZNI'J WW\
' umxmm . WOO :.Ểonỉaõ
\
đ)G
. 2% 322 Sẵẩ …8 ẫỄaẵ ẫễ.ẵ.
mm
mưa
. noẫẩ .ẵẵ. %… Ế… …… ế Ểaắ …ẵãăẵ
. x…G oc… % ã… EE. wã ầỉ % ẽỄỄ.
. zễnẫ. uẫẵ …ẳẵ 3 ..ẫỂ. E…RỄẫ.
. .:ẵằẵ. Saẵ.ĩẵằẵ no…ễu: &aỉềẵẵ
Eễ.…ẵ ma BỂ …:…nẵẳã gẵa Ễn Ễ
…ẵoề. v……ỉì …:…ẫ
. …sa ỉẵ …oắ
. zể. zpẳễ…ẵẳ
a….ãutẵỆu ư»: 9nn ao?qẵẵ uăa… zẻ ắ: ...»:
ơB u1:.. nẾm …Êaỡ Ế... mc:ẵ…ẫ. 25
Êợể ã . ..ễ _ s …. _ ắ: ỉ: ỉo uơẩ. %.… s.ẳ
nảẳ …:. …::. ..Ễ ềau › 89 a..ẵ 5 &… …ãẽ Ể
Eẵ… I: ẵ.… Ểẵ 3 ỂSõ n…: …..n EBm ã5 38.
a…o nữ... .… :ẵ… 8 93… wo.n. & 3 So : .« …x zu…
ấa .…ẵỄ .Z>z.. .…ẫ… ã.a ưoo z. umWỗ .…a
Ế Ế.ẵ. 8… ã Ế…ẵ %.. Ê %ẳ ẫ... ẫ ạ..ễ.
&: Ễ… ẵ… ẫ…ẵ& oẵỊ ẫgẵỡ: …ấ
OS:…SỂB. .hẫwẵũa» ỗ.ẵ. o.ổ…G
oẵ…BỂẫ ……nãu3.
ẳ ỉ... ỉsẫ
…Ẻn xA.xxxxixx
ễGãẵ Oaửz
Ponẵẫ …:… o.đẵẳ:.d
ĩăẵỉao ằ.…a
c.. mỉ … oũ:ỂỂõ
eẵăễ
Ễ
… 6 .m
v. ……
… d @ n…
W wv V.Ọ
…r N .A
… 1
…b % Ặffl.
.…l Á 0
… .3v .m
… l 3
\
—Ll6
.W
|
vsq W |
,0/Tntfỵgị
1
…
CN Dlxu 500 mcg Jo uh \
Produkt Name Daan 30 Tat
ldcnt-Nr. VNN 1.1|021
'V`02
Anderung New Iaunch
Gut zum Druck
TMA ] Mirko Heinemann
\, llllltlll /
ỔJTMÉÍẨẶbSJ
@
`
Rx Thuốc bản theo đơn
Daan
Viên nén bao phim
Roflumilast 500 microgram
MÔ TẢ VÀ THẢNH PHẦN
Daxas lả viên nén bao phim mảu vảng hinh chữ D khắc chữ "D" trèn một mặt. Mỗi viên
nén bao phim chứa 500 microgram roflumilast vả các tác dược: Lactose monohydrat.
Tinh bột ngó, Povidon (K90), Magnesium stearat, Hypromellose 2910, Macrogol 4000,
Titan dioxiđ (E171) vả oxid sắt vảng (E172).
DẠNG BÀO cuE
Viên nén bao phim
Dược LÝ LÀM SÀNG
Dược lực học
Cơ chế tảc dung
Roflumilast lá chẩt ức chế PDE4, một chắt chống viêm non—steroid được chỉ định cho cả
viêm phối vả toản thản liên quan đến COPD. Cơ chế tác dụng lá ức chế PDE4 một
enzym chuyền hóa adenosln monophospnat tuần noan cnủ yêu (CAMP) dược tim thảy
trong cảc tế báo viêm và cắu trúc quan trọng với sỉnh bệnh học của COPD. Rofiurnilast
hướng tởi các loại Iiẻn kẽt PDE4A, 48 vả 40 vởi ái lực tương tự nhau trong phạm vi nano
phân từ. Ái lực vởi kết nối PDE4C thầp hơn gắp 5 10 lần Cơ chế tác dụng và tính chọn
Ioc náy cũng áp dụng vởí roflumilast N- oxid. chắt chuyến hóa hoạt tính chính cùa
roflumilast.
Tác dung dươc lươc
Ừc chế PDE4 lảm tăng nồng độ cúa cAMP nội bảo vả giám sự kém hoạt động của bạch
cằu cac té báo cơ trơn mạch phôi và đường thờ các te bảo vả nguyên bảo sợi bíếu mô
đường thớ vả mảng trong trong các mô hinh thực nghiệm. Theo kìch thích in vitro cùa các
bạch cằu trung tinh. bạch câu đơn nhản đại thực bảo hoặc tế bảo lympho của người.
roflumilast vả roflumilast N— oxid ngãn giải phóng các chất trung gian viêm như leukotriene
84, các loại oxy phản ửng tác nhân hoại tử u ơ. interteron y và granzyme B
Trên nhửng bệnh nhản có COPD. rofiumilast lảm giảm các bạch cầu trung tinh đờm Hơn
nữa. roflumilast lảrn giảm bạch cầu trung tinh vá tế bảo ưa eozỉn vảo đường thở cùa
nhũ ng nguôi tinh nguyện khóe iitạnh dùng ÒIIIJÙỈUAỈII
Dwọ'c động học
Roflumilast được chuyển hóa rộng rải trong cơ thế. dưới dạng chắt chuyền hóa cờhoạt
tinh dược lực học chỉnh lả roflumilast N-oxid. Vi cả roflumilast vá roflumilast N-oxid đèu có
hoạt tinh ức chẻ in_ vivo PDE4, dược động học được tinh đên dựa trẻn tỏng hoạt ttnh ừc
chê PDE4 (tức lả tông tác dụng vơi roftumilast vả roflumilast N—oxid).
H__ẳo thu
Sinh khả dụng của roflumilast với Iiẻu uống 500 microgram xắp xi khoảng 80% Nồng độ
roflumilast tối đa trong huyết tương thường đạt được sau khoảng mòt giờ dù! « '
(khoảng từ 0 5 đến 2 giờ) trong tinh trạng ôn định Nồng độ tối đa của chắt
oxid đạt được sau khoảng 8 giờ (khoảng từ 4 đến 13 giờ). Thức ăn khỏng _
rotlumilast một giờ và giảm C,… khoảng 40%. Tuy nhiên. 6… vả tma,
oxid không bị ảnh hưởng.
P_hân bố
Roflumilast vả chải chuyến hóa N— oxid liên kết vởi protein huyết tương lần lươt lả 99% vả
97%. Thể tích phản bố cho liêu đơn 500 microgram roflumilast lả khoảng 2 91/kg.
Chuỵển hóa
Roflumllast được chuyến hòa nhờ pha ! (cvtochrome P450) và pha || ị'tlẻp hợp). Chải
chuyển hóa N- oxid lả chất chuyến hóa chinh trong huyết tương. AUC huyết tương cùa
chắt chuyến hóa N- oxid khoảng gắp 10 iằn AUC huyết tương cùa roflumilast. Do đó chắt
chuyền hóa N- oxid được xem là đóng góp chinh vảo tống hoạt tinh ức chế PDE4 in vivo.
Cảo nghiên cứu in vitro vả nghiên cứu tương tác lảm sáng gợi ý rằng rot1umilast chuyền
hóa thánh chắt chuyền hóa N- oxid nhờ CYP1A2 vả 3A4. Dựa trên cảc kết quả in vitro trèn
mỉcrosome gan người nồng độ huyết tương điêu trị của roflumilast vả roflumilast N- oxid
khỏng ưc chế CYP1A2 2A6. 286. 2C8 209, 2019 206 2E1,3A415 hoặc 4A9/11. Do đó
ít có khả nảng xảy ra tương tác liên quan vơi các hoạt chắt được chuyển hóa bời cảc
enzym P450 nảy. Thèm nữa, các nghiên cứu in vitro chứng minh rằng roflumilast không
có cảm ứng vởì CYP1A2, 2A6, 2C9. 2C19. hoặc 3A4/5 và chi có cảm ứng yếu vơi
CYP286.
T_hải trừ
Thanh thải huyết tương sau khi truyền tĩnh mạch thơi gian ngắn rotlumilast lả khoảng
9 61/giờ. Đối vơi Iiẻu uống thời gian bản thải trung bình cùa roflumilast và chất chuyền
hỏa N oxid iằn lượt lả 17 vả 30 giờ. Nồng độ huyết tương của rotlumitast vá chất chuyền
hóa N- oxid dạt đến ốn định sau khoảng 4 ngảy đối vởi rotlumilast vả 6 ngảy đối vơi
roflumilast N— oxid sau khi dùng một tiẻu hảng ngây.
Đi theo roflumilast được đánh dắu đồng vị phòng xạ dùng đường tĩnh mạch hoặc uống,
khoảng 20% tính phỏng xạ được ihll lại trnng phân vả 70% trnng nước tiểu dưới dạng
chắt chuyền hóa không hoạt tính
luỵến tinhlPhi tuvên tinh
Dược động học cùa, roflumilast vá chắt chuyến hóa N-oxid tỷ lệ Vởi liều trén khoảng liẻu
từ 250 mỉcrogram đẻn 1000 mỉcrogram.
Nhóm bênh nhân đăc bièt
Đổi vời người cao tuổi. nữ giởi và không phải người da trắng. tồng hoạt tinh ức chế PDE4
tăng. Tống hoat tính ức chế PDE4 giảm nhe trên người hút thuốc. lá Khõng thắy có thay
đổi nảo có ý nghĩa Iảm sảng. Khòng cần phải hiệu chỉnh lièu trèn những bệnh nhân nảy.
Kết hợp các yêu tố như nữ giới da đen khỏng hút thuốc có thề lảm tảng tác dụng ức chế
vả không dung nap kéo dái Trong trường hợp nảy, nên đảnh giá lại việc điều trị bằng
Daxas (xem phần "Cảnh báo vả thận trọng đặc biệt trong sử dụng").
Bệnh nhân su y thận
Tổng hoạt tính ưc chế PDE4 giảm 9% trên những bệnh nhán suy thặn nặng {độ thanh
thải creatinin 10 30 mllphiit) Khỏng nần thiết phải hiện nhinh iiều
Bệnh nhản suy gan
Dược dộng học của Daxas 2bU microgram mòt liều hang ngay được đanh gia trén 8 bệnh
nhán suy gan nhẹ đến vừa thuộc nhóm Chitd- —Pugh A vả B Trẽn những bệnh nhán nảy,
tống hoạt tĩnh ức chế PDE4 tâng khoảng 20% ttên những bệnh nhân Child- -Pugh A vả
khoáng 90% trẻn những bệnh nhán Child- P-ugh B Những mô phỏng gợi ý liếu phù hợp
giữa Daxas 250 vả 500 microgram trẻn những bệnh nhân suy gan nhẹ vả vừa. Cần thặn
trọng vơi những bệnh nhân Child-Pugh A (xem phần "Liều lượng vả cách dùng" ). Không
nẻn dùng Daxas cho những bệnh nhân suy gan vưa hoặc nặng thuộc nhóm ChiId-Pugh B
hoặc C (xem phần "Chống chỉ dịnh")
Các nghlẽn cứu lâm sảng
Bệnh phối tắc nghêu mạn tinh (copo)
Hiệu quả vả độ an toản của ROFLUMILAST trong bệnh phổi tắc nghẽn mạn tính (COPD)
đã được đảnh giá trong 8 thử nghiệm iảm sảng ngẫu nhíẻn mù đòi, có đối chứng. nhóm
song song ở 9394 bệnh nhán người lờn (4425 dùng ROFLUMILAST 500 mcg) tư 40 tuồi
trở lẻn bị bệnh phối tắc nghẽn mạn tính Trong sỏ 8 thứ nghỉệm, 2 thử nghiệm lả thử
nghiệm iựa chọn liều có đối chứng vởi giả dược (Thử nghiệm 1 vả 2) trong thời gian 6
tháng, đảnh giá hiệu quả cùa ROFLUMILAST 250 mcg vả 500 mcg, 1 lầnlngáy, 4 thử
nghiệm lá các thử nghiệm 1 năm có đối chững với giá dược (Thứ nghiệm 3, 4, 5 vả 6),
chủ yêu được thỉết kế để đánh giá hiệu quả của ROFLUMILAST vẽ các đợt kịch phát cùa
bệnh phồi tắc nghẽn man tinh vả 2 thứ nghỉệm iả cảc thư nghiệm đánh giá hiệu quả trong
6 thảng (Thử nghiệm 7 vả 8) đảnh giá hiệu quả của ROFLUMILAST như trị iiệu hỗ trợ cho
thuốc đòng vận beta tác dụng kéo dải hoặc thuốc kháng muscarin tảo dụng kéo dải. 8 thử
nghiệm đã đưa vảo nghiên cữu những bệnh nhản bị bệnh phổi tắc nghẽn khỏng hổi phục
(Thể tích thở ra gắng sức trong 1 giậy đẩu (FEV )lDung tich sống gảng sức (FVC) s 70%
vá cải thiện 5 12% hoặc 200 ml vẻ FEV, đáp ứng với 4 nhát xịt aibuierollsaibutamol)
nhưng mức độ nặng cùa sự tắc nghẽn dòng khí lúc ban đầu khải: nhau giữa các thử
nghiệm Những bệnh nhản tham gia vảo các thử nghiệm lựa chọn Iiều có đầy đủ các mức
độ nặng của bệnh phối tắc nghẽn mạn tinh (FEVt 30- 80% giá trị dự đoản); tuối trung binh
63, 73% nam vả 99% lá người da trắng Những bệnh nhản tham gia vảo 4 thử nghiệm về
ca'c đơt kich phát có bệnh phối tắc nghên mạn tinh nặng (FEVI s 50% gỉa' trị dự đoán);
tuối trung binh 64. 74% nam vả 90% lá người da trắng. Những bệnh nhân tham gia vảo 2
thử nghiệm đảnh giá hiệu quả trong 6 tháng có bệnh phối tắc nghẽn mạn tinh mức độ từ
trung bình đến nặng (FEV, 40- 70% giá trị dự đoán) tuổi trung binh 65. 68% nam vả 97%
lá người da trắng Các đợt kich phát của bệnh phổi tắc nghẽn mạn tính vả chức nảng phối
(FEV,) lá các sô đo hiệu quả chính kềt hợp trong 4 thử nghiệm 1 nảm Trong 2 thử
nghiệm hỗ trợ đảnh giá hiệu quả trong 6 tháng, chỉ chức nảng phôi (FEVt) là sở đo hỉệu
quả chinh.
Hai thử nghiệm lưa chon liếu đánh giá hiệu quả trong 6 tháng (Thử nghiệm 1 vả 2) đã
khảo sải liêu 250 mcg vả 500 mcg, 1 iằn/ngảy trong tong số 1929 bệnh nhản (751 bệnh
nhán dùng ROFLUMILAST 250 mcg vả 724 bệnh nhản dùng ROFLUMILAST 500 mcg).
Việc iưa chọn liều 500 mcg chủ yêu dựa váo sự cải thiện trẻn danh nghĩa về chức nảng
phổi (FEVI) so vởi liều 250 mcg. Chế độ iiẻu dùng 1 Iần/ngảy chủ yêu dựa trèn sụ xác
định thời gian bán hùy trong huyết tương lá 17 giờ đối vởi rotlumilast vả 30 giờ đối vởi
rofiumiiast N— oxide lả chắt chuyến hóa có hoạt tinh của nó [xem Dươc lý lâm sâng (duoc
đóng hỌC)l
Hiệu quả đối vởi' các đợt kịch phát
Hiệu quả của ROFLUMILAST 500 mcg 1 Iằn/ngảy đối vời các đơt kịch phảt của bệnh
phổi tắc nghẽn mạn tính đã được đánh giá trong 4 thử nghiệm 1 năm (Thử nghíệm 3 4,5
vả 6).
Hai trong số cảc thử nqhiẻm (Thử nơhiẻm 3 vả 4) đươc tiến hảnh đầu tiên đã đưa váo
nghiên cứu một nhóm bệnh nhản bị bệnh phồi tắc nghẽn mạn tính nặng (FEV1 s 50% giá
trị dự đọản) bao gồm những người bị viêm phế quản mạn tinh vả/hoặc trản khí có tỉèn sứ
hUt tnuốo lả it nhất la“ 10 gói—nám. Corticosteroid dạng hit được phép sử dụng như một
thuốc dùng đồng thời vả được sử dụng ở 61% bệnh nhân được điều trị bằng
ROFLUMILAST vả bènh nhán dùng giả dược vả thuốc đồng vặn beta tác dụng ngắn
được phép sử dụng như lá thuốc điều trị cấp cứu. Việc sử dụng thuốc đồng vận beta tảo
dụng kéo dải. thuốc kháng muscarin tác dụng kéo dải vả theophylline bị cầm. Tỷ lệ cảc
đợt kịch phảt cùa bệnh phối tắc nghẽn mạn tính trung bỉnh hoặc nặng lả tỉèu chi đánh giá
chính kết hợp ở cả hai thử nghiệm Không có định nghĩa đợt kịch phát về mặt triệu chứng
ở 2 thử nghiệm nảy. Các đợt kich phảt được xác đinh theo mức độ nặng cần phải đi
thân trong Thử nghiệm 3 hoặc glucocorticosteroid toản thân vảlhoặc khán
Thứ nẵhiệm 4 vả một đợt kịch phát nặng được đinh nghĩa là cần phải nhặp '
dẫn đ
thử nghiệm đã chọn ngẫu nhiên 1176 bệnh nhân (567 bệnh nhân dùng R
trong Thử nghỉệm 3 và 1514 bệnh nhân (760 bệnh nhãn dùng ROFLUMILA
Jz
,_ NN
nghiệm 4. Cả hai thử nghiệm không cho tháy giảm đảng kể về tỷ lệ cảc đợt kịch phảt cùa
bẽnh phối tắc nghẽn mạn tinh
Phân tich thảm dò cảc kết quả cùa Thử nghiệm 3 vả 4 đã xac định được một phản nhóm
bệnh nhản bị bệnh phối tắc nghẽn mạn tính nặng iièn quan với viêm phế quản mạn tính
vả các đọt kịch phảt của bệnh phối tắc nghẽn mạn tinh trong nám trước đó mả duòng
như cho thắy có đáp ưng tốt hơn về mữc giám tỷ lệ các đợt kịch phát cúa bệnh phổi tậc
nghẽn man tính so Với toản bộ nhóm đổi tượng nghiên cứu. Kết quả lả 2 thử nghiệm tiếp
theo (Thử nghiệm 5 vả Thử nghiệm 6) đã được thực hiện đưa vảo nghiên cứu những
bệnh nhân bị bệnh phồi tắc nghẽn mạn tinh nặng nhưng có iiẽn quan vởi viêm phế quản
mạn tinh có ít nhất một đợt kịch phát cùa bệnh phối tắc nghẽn mạn tính trong nảm trước
độ vả có tiền sử hủt thuốc lá ít nhất lả 20 gói- nãm. Trong những thử nghiệm nảy, thuốc
đồng vận beta tác dung kéo dải vả thuốc kháng muscarin tác dụng ngăn được phép sử
dụng vả thuốc đổng vận beta tác dụng kéo dải đă được dùng bời 44% bệnh nhân được
điêu trị bằng ROFLUMILAST, thuốc kháng muscarin tác dụng ngắn đã được dùng bởi
35% bệnh nhán được điều trị bằng ROFLUMILAST. thuốc đồng vận beta tác dụng kéo
dải đã được dùng bởi 45% bệnh nhản được fflẽu trị bảng giá dược vá thuốc kháng
muscarin tảo dụng ngắn đã được dùng bởi 37% bệnh nhản được điều trị bằng giá dược.
Viẻc sử dung corticosteroid dang hít bị cắm. Như trong cảc thử nghiệm 3 và 4, tỷ iẻ các
đợt kịch phát trung binh (được định nghĩa lá cần có sự can thiệp bâng glucocorticosteroid
toản thán) hoặc cảc đợt kich phải nặng (được định nghĩa là dẫn đẽn nhặp viện vảlhoặc tử
vong) lả tiêu chi đánh giá chinh kết hợp.
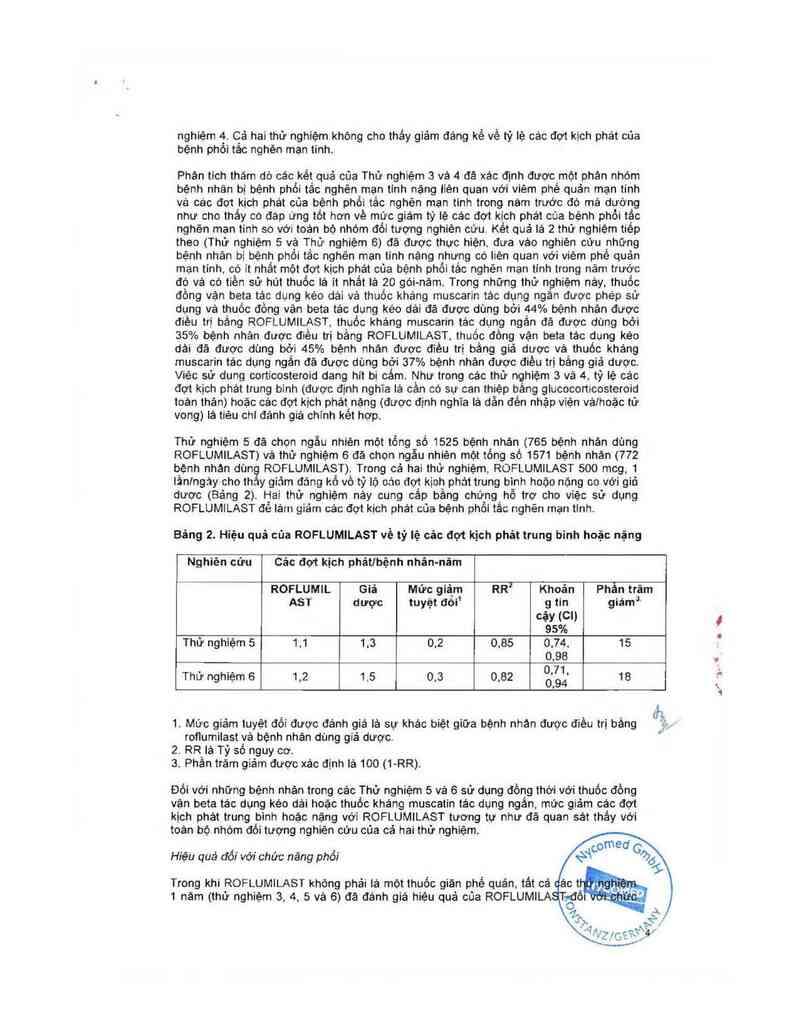
Thử nghiệm 5 đã chọn ngẫu nhiên một tổng số 1525 bệnh nhán (765 bệnh nhản dùng
ROFLUMILAST) vả thử nghiệm 6 đã chon ngẫu nhiên một tổng số 1571 bệnh nhân (772
bẹnh nhán dùng RDFLUMILAST) Trong cả hai thử nghiệm ROFLUMILAST 500 mcg,1
Iẩnlngảy cho thắy giảm đảng kố vô tỷ 1ộ oác đợt kịch phải trung binh hoặc nộng co với gió
dược (Bảng 2) Hai thử nghiệm nảy cung cắp bằng chứng hỗ trợ cho việc sử dụng
ROFLUMILAST đế lả… giảm cảc đợt kịch phát của bệnh phổi tắc nghẽn mạn tinh.
Bảng 2. Hiệu quả cùa ROFLUMILAST về tỷ 1ệ cảc đợt kịch phát trung bỉnh hoặc nặng
Nghiên cứu Cảc đợt kịch phảtibệnh nhán-năm
ROFLUMIL Giả Mưc giả_m RR² Khoán Phân trăm
AST dược tuyẹ't đồi1 g tin giámi
cáv (Cli
95%
Thử nghiệm 5 1.1 1.3 0,2 0,85 0.74, 15
0,98
Thử nghiêm 6 1 2 1 5 o 3 o 82 0'71- 18
' ' ' ' ' 0.94
t,
1. Mức giảm tưyệt đối được đánh giá là sự khác biệt giữa bệnh nhán được điều trị bảng
roflumilast vả bệnh nhân dùng giả dược.
2 RR lả Tỷ số nguy cơ.
3. Phần trăm giảm được xác định lả 100 (1— RR)
Đối với những bệnh nhân trong các Thử nghiệm 5 và 6 sử dụng đồng thời vởi thuốc đồng
vặn beta tác dụng kéo dải hoặc thuốc kháng muscatin tác dụng ngản, mức giám các đợt
kịch phát trung binh hoặc nặng với ROFLUMILAST tương tự như đã quan sát thầy với
toản bộ nhóm đối tượng nghiên cứu cùa cá hai thử nghiệm.
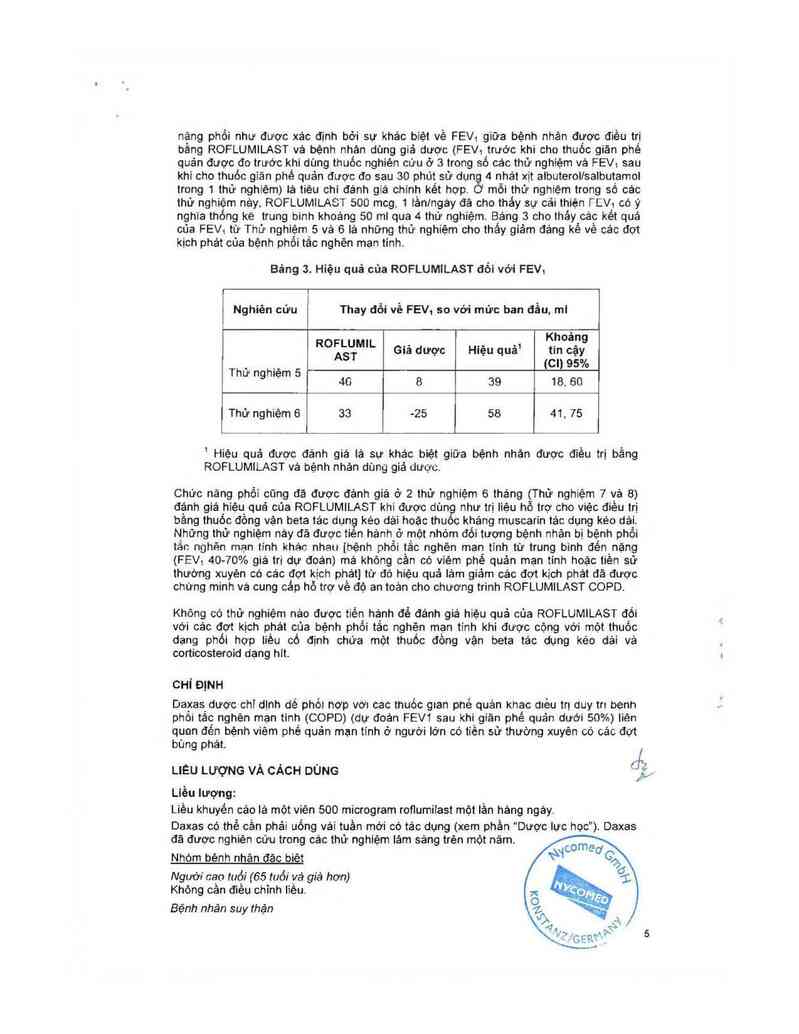
Hiệu quả đối với chức nãng phổi
Trong khi ROFLUMILAST không phải là một thuốc giản phế quản tất cả áct NV "
1 năm (thử nghiệm 3, 4, 5 và 6) đã đánh giá hiệu quả cùa ROFLUMILA 1đốl ' --—=
nặng phồi như được xảo định bởi sự khác biệt về FEV1 giữa bệnh nhân được điếu trị
bằng ROFLUMILAST vả bệnh nhân dùng giả dược (FEV1 trước khi cho thuốc giãn phế
quản được đo trước khi dùng thuốc nghiên cữu ở 3 trong số các thử nghiệm vá FEV1 sau
khi cho thuốc giản phế quản được đo sau 30 phút sữ dun 4 nhát xịt albuteroilsalbutamoi
trong 1 thử nghiệm) tá tiêu chỉ đánh giá chinh kết hợp. mỗi thử nghiệm trong sộ các
thử nghiệm nẻy ROFLUMILAST 500 mcg, 1 iản/ngáy đã cho thảy sự cái thiện FEV1 có ý
nghĩa thống kê trung binh khoáng 50 ml qua 4 thử nghiệm. Báng 3 cho tháy các kết quả
cúa FEV1 từ Thử nghiệm 5 vả 6 lá những thử nghiệm cho thấy giảm đáng kể về các đot
kịch phát cùa bệnh phổi tắc nghẽn mạn tính.
Bảng 3. Hiệu quả cùa ROFLUMILAST đối với FEV1
Nghiên cứu Thay đổi về FEV1 so với mửc ban đầu. mt
Khoảng
ROẮỀẸMIL Giả dược Hiệu quả' tin cậy
. .. (01) 95%
Thư nghiẹm 5
46 8 39 18. 60
Thử nghiệm 6 33 -25 58 41, 75
` Hiệu quả được đánh giá lả sư khác biệt giữa bệnh nhãn được điều trị bằng
ROFLUMILAST vả bệnh nhán dùng giá được.
Chức nảng phối cũng đã được đảnh giá ở 2 thử nghiệm 6 thảng (Thử nghiệm 7 vả 8)
đặnh giá hiệu quả của ROFLUMILAST khi được dùng như trị liệu hỗ trợ cho việc điều trị
bằng thuốc đồng vận beta tác dụng kẻo dải hoặc thuốc kháng muscarin tác dụng kéo dải.
Những thử nghiệm nảy đã được tiên hảnh ở một nhỏm đối tương bệnh nhân bị bệnh phồi
tắc. nghẽn mạn tinh khảc nhau [hẹnh phổi tắc nghẽn mạn tính từ trung binh đến nặng
(FEVt 40- 70% giá trị dự đoản) mả khỏng cần có viêm phế quản mạn tính hoặc tiên sư
thường xuyên có các đợt kịch phát] từ đó hiệu quả lảm giảm các đợt kịch phát đã được
chững minh vả cung cáp hổ trợ vè độ an toản cho chương trình ROFLUMILAST COPD
Không có thử nghiệm nảo được tiến hảnh để đánh giá hiệu quả của ROFLUMILAST đối
với các đợt kịch phảt của bệnh phổi tắc nghẽn mạn tinh khi được cộng với một thuốc
dạng phối hợp liều có định chứa một thuốc đống vận beta tác dụng kèo dải vả
corticosteroid dạng hit
cui ĐỊNH
Daxas dược chi dịnh dẻ phỏt nợp vơi cac tnuóc gian pnẻ quản khac diều trị duy tn bẹnh
phối tảc nghẽn mạn tinh (COPD) (dự đoản FEV1 sau khi giản phế quản dưới 50%) iiẻn
quan đến bệnh viêm phế quản mạn tính ở người lớn có tiến sử thường xuyên có các đợt
bùng phát.
LIÊU LƯỢNG VÀ CẢCH DÙNG Ủỉề
Liều lượng:
Liều khuyến cáo lả một viên 500 microgram roflumilast một lằn hảng ngáy.
Daxas có thể cần phải uống vải tuần mởi có tảc dụng (xem phần “Dược lưc học”). Daxas
đă được nghiên cứu trong các thử nghiệm lảm sảng trèn một năm.
Nhộm bẻnh nhân đảc biêt
Nguời cạo tuội (65 tuồi yả giá hơn)
Khõng cân đtêu chĩnh Iiẻu.
Bệnh nhân suy thận
Khỏng cằn điều chinh liều.
Bệnh nhân suy gan
Dữ liệu lâm sảng của Daxas trên những bệnh nhân suy gan nhẹ thuộc nhóm Child- -Pugh
A khỏng đầy đủ để hướng dẫn hiệu chinh liều (xem phản “Dược động học' ) vá do đó nẻn
thân trong khi sử dụng Daxas trẻn những bệnh nhán nảy.
Những bệnh nhân suy gan vữa vả nặng thl_lỘC nhỏm ChiId—Pugh B hoặc C không nẻn
dùng Daxas (xem phần "Chống chỉ định").
Trẻ em _
Daxas không có sử dung thich hợp trẻn trẻ em (dưới 18 tuói). Khỏng nèn sử dụng Daxas
cho trẻ em dưới 18 tuôi.
Cảch dùng
Dững đường uống.
Nên uỏng thuốc bằng nước vả uống thuốc cùng một thời điếm mỗi ngảy. Có thể dùng
thuốc cùng hoặc không cùng thức ân.
CHỐNG CHỈ ĐỊNH
Mẫn cảm với rotiumilast hoảc bả! kỷ thảnh phần nảo cùa thuốc.
Người suy gan vừa hoặc nặng (ChiId-Pugh B hoặc C).
CÁNH BÁO VÀ THẬN TRỌNG ĐẶC BIỆT KHI sữ DỤNG
Đọc kỹ hướng dẫn sữ dụng trưởc khi dùng. Nếu cần thêm thỏng tin, xin hỏi ý kiến
bác sĩ.
Thuốc nảy chi dùng theo dơn cùa bảc sĩ.
Cánh báo và thận trọng
Thuốc cáo cứu
Roilumiiast là một hoạt chắt chống viêm được chỉ định đề điếu trị duy trì COPD nặng iiên
quan đền bệnh viêm cuống phối mạn tinh ở ngưởi lớn có tiền sử của các đợt kịch phát
thường xuyên như hỗ trợ thèm trong diều tri giản. phế quản Thuốc khỏng được chỉ
định như một thuốc cấp cứu để giảm co thắt phế quản cắp tính.
Giảm cân
Gác nghiên cữu 1 năm (M2- -124 M2—125). các bệnh nhán được điều trị bằng Daxas xảy
ra giảm cản nhiêu hơn so với những bệnh nhân được điều trị bằng giá dược. Sau khi
ngừng sử dung Daxas, đa phần cảc bệnh nhân trở lại cản nặng như trước sau 3 thảng.
Nên kiềm tra thể trọng cùa các bệnh nhân bị giảm cản mỗi lần khảm. Bệnh nhân nèn
kiếm tra thề ttọng trẻn cơ sở bình thường. Trong trường hợp có giảm cản iiên quan đền
lâm sáng vả không giải thich được, nén dưng uông Daxas vả theo dội thẻm thể trọng.
Cả tr n lảm sảng đảc biêt
Vì thiếu kinh nghiệm thích hợp, khộng nẻn bắt đằu điều trị Daxas hoặc dừng điều trị
Daxas trén những bènh nhản có bẻnh miễn dịch nậng (vdznh1ễm HIVI xơ cứng nhìẻu, [
luput ban đò, viêm chắt trắng nâo nhiều ố tiến triển) bệnh nhiễm trùng cắp tinh nặng. ung ’
thư (ngoại trừ ung thư biếu bì tế bảo cơ bản), hoặc những bệnh nhảm đang điều trị thuốc ,/
ức chế miễn dịch (vd: methotrexate. azathioprine, infiiximab, etanercept hoặc cảc
corticosteroid dùng kéo dải; ngoại trừ cảc corticosteroid toản thân ngản hạn). Kinh nghiệm
trẻn những bệnh nhản nhiễm khuẩn tiềm tảng như Iao. viêm gan vitus, nhiễm éc pét bị
giới hạn.
Chưa có nghiên cứu với những bệnh nhân suy tim (NYHA độ 3 vả 4) do đó khóng nèn
điêu trị thuốc trên những bệnh nhán náy.
Rối loan tâm thần com eơ G
Daxas có liên quan đến nguy cơ tảng rối ioạn tâm thằn như chứng mắt ngủ cRÌẵng. bồn ’òỎ
chồn, vả trầm cảm. Hiếm có trường hợp có hảnh vi và suy nghĩ tự tử bao gồm ~
›
«
:
o
)
Do đò, nẻn thận trọng đánh giá nguy cơ vả lợi ich của việc bắt đầu hoặc tiếp tục điều trị
với Daxas nếu bệnh nhân báo cáo trước đó hoặc có triệu chững tặm thần hoặc nếu có ý
định thử trị đồng thới với cảc thuốc khác có thẻ gảy các vản đề về tảm thần. Bệnh nhản
nẻn được chi dẵn để báo cho bác sĩ bắt kỳ những thay đồi nảo trong hảnh vi h0ặc tảm
trạng vả bắt kỳ ý nghĩ tự tử náo. Hơn nữa, khõng khuyến cáo dùng Dexas trèn những
bệnh nhân có tiền sử trầm cảm iién quan đến ý nghi hoặc hảnh vi tự từ.
Khỏnđ dung nao kéo dái
Trong khi các phản ứng bắt lợi như tìêu chảy, buồn nôn, đau bụng vậ đau đầu chủ yếu
xảy ra trong những tuần đầu điều trị vả phần lớn được giải quyết khi điếu trị tiếp theo, nèn
đánh giá lại việc điêu tri Daxas trong trường hợp không dung nạp kéo dải. Đó có thể iá
trường hợp trên những nhóm bệnh nhản đặc biệt có mức độ phơi nhiễm cao hơn, như
phụ nữ da đen, khỏng hút thuốc (xem phần 5.2) hoặc trèn những bệnh nhân được điều trị
cùng thuốc iiuvoxamine ức chế CYP1A2 hoặc thuốc ức chế kép CYP3A4I1A2 như
enoxacin vả cimetidine (xem phần 4.5).
Theoghỵiiine
Khóng có dữ Iiệu iảm sáng để xác minh việc điều trị đ_ông thới vời theophyline cho điêu trị
duy tri Do đó, khòng khuyên cảo điều trị đồng thời với theophyliin.
TƯỚNG TÁC VỚI cÁc THUỐC KHẢO VÀ cÁc DẠNG TƯỜNG TÁC KHÁC
Những nghiên cữu về tương tảo thuốc đã được tiến hảnh trên người lớn
Giai đoạn chính trong chuyến hỏa roflumilast iả N oxy hóa roiiumilast thảnh roflumilast
N- oxid nhờ CYP3A4 vả CYP1A2. Cả roflumilast vả roflumilast N- oxid đèu có hoạt tinh ữc
chế phosphodiesterase 4 (PDE4) Do đó khi dùng roflumilast tác dụng ức chế PDE4 lá
kềt hợp tác dụng của cả roflumilast vả roflumilast N- oxid. Cảo nghiên cứu tương tảc lảm
sang vơi erythromycm vá ketpconazole ừc chẻ CYP 3A4 chi ra rầng cúa tỏng hoạt t_inh ức
chẻ PDE4 tăng 9% (tức tá tỏng lượng roilumilast vả roilumilast N- oxid trong cơ thẻ). Các
nghiên cứu tương tác với iluvoxamin ức chế CYP1A2, vá enoxacin vả cimetidine ức chế
kép CYP3A4/1A2 chi ra rảng tống hoat tính ức chế PDE4 lần lượt lẻ 59%, 25% vả 47%
Dùng Daxas cùng các hoạt chắt nảy có thề iảm tăng tảc dụng _ức chế và không dung nạp
keo dái . Trong trướng hợp nảy, nẻn đánh giá lại việc điêu trị bảng Daxas (xem phản 4.4).
Dùng ịifampicin tảo nhân gảy cảm ứng enzym cytochrome P450 lảm giảm tồng hoạt tinh
ưc chê PDE4 khoáng 60%. Do đỏ, việc sử dụng các tảc nhân Ệảy cám ững cytochrom
P450 mạnh (vd: phenobarbttal. carbamazeplne. phenytoin) có th lam glảm hiệu quả đlẻu
trị của roflumilast.
Điều trị đổng thời cùng theophyllin lảm tảng 8% tổng hoạt tinh ức chế PDE4 (xem phần
'Cảnh báo vá thận trọng đặc biệt khi sử dụng' '.) Trong một nghiên cứu tương tác với
thuộc tránh thai đường uống chứa gestoden vả ethinyi oestradiol tống hoạt tinh ức chế
PDE4 tảng 17%
Không có tương tác nảo được quan sát với budesonid, formeterol. salbutamol dạng hit vả
liiuulelukast, dlguxin, watỉatln, slidenafll vả illld'dZOlalti dạng uống.
Điêu trị đồng thời cùng thuốc kháng acid (kẻt hợp aluminium hydroxyd vả magnesi
hydroxyd) khỏng la“m thay đỏi hắp thu hoặc dược động học của roflumilast hoặc
roflumilast N-oxid.
KHẢ NĂNG SINH SẢN. PHỤ NỮ có THAI VÀ CHO con BÚ
Phụ nữ có thai
Dữ liệu về sử dụng roflumilast cho phụ nữ có thai bị giơi hạn.
Cảc nghiên cứu trèn động vặt chỉ ra độc tinh trẻn khả nảng sinh sản,
khuyến cáo dùng cho phụ nữ có thai vả phụ nữ có khả nảng sinh đẻ kh
pháp tránh thai
Phụ nữ đang cho con bú
Dữ liệu về dược động học trên động vật chỉ ra rằng roflumilast hoặc chắt chuyến hóa cùa
nó bải tiết vảo sữa Khỏng thể loại trừ nguy cơ đối với trẻ còn bú Khỏng nẻn sử dụng
Daxas trong thời kỳ cho con bú.
Khả nảng sinh sản
Trong một nghiên cứu về sinh tinh ở người, roflumilast 500 microgram khộng có tảc động
đén các trị sỏ tinh dỊch hoặc lảm giảm hớc món trong giai doạn 3 tháng diẻu trị vả 3 thảng
tiền theo sau khi dừng điều trị.
TÁC ĐỌNG TRẺN KHẢ NÁNG LÁ1 xe vÀ VẬN HÀNH MÁY MÓC
Daxas không ảnh hưởng đến khả nảng lái xe vá vặn hảnh máy mỏc.
TÁC DỤNG KHÓNG MONG MUỐN
Trong các nghiên cứu COPD Iảm sảng. khoảng 16% bệnh nhân có các phản ứng bắt iợi
với roflumilast ( so sánh với 5% đối với giả dược). Phản ứng bắt lợi được bảo cáo nhiều
nhắt lả tiêu chảy (5 9%) giảm cân (3, 4%), buồn nôn (2,9%), đau bụng (1 9%) và đau đầu
(1. 7%). Phần iởn các phản ưng bắt lợi nảy iả nhẹ hoặc vữa. Những phản ứng bắt lợi nậy
chủ yêu xảy ra trnng những tuần đầu điều trị vả phần tớn được giải quyềt khi điều trị tiềp
tục.
Trong bảng dưới đảy, các phản ứng bất lợi được sắp xếp theo phản Ioại tần suất
MedDRA.
Hay gặp (21/10); thường ặp _(z1/100 to <1I10); ít gặp (2111,000 to <1/100); hiềm gặp
(21I10.000 to <1l1,000); r t hiêm gặp (<1/10.000), không rõ (khỏng thê đánh giá từ dữ
liệu đã có).
Vởltnỗlnhónitằh suấn các phản ưng bảilợiơượcinnh bayiheo gán:oảnrnưc ơọ
nghiêm trọng.
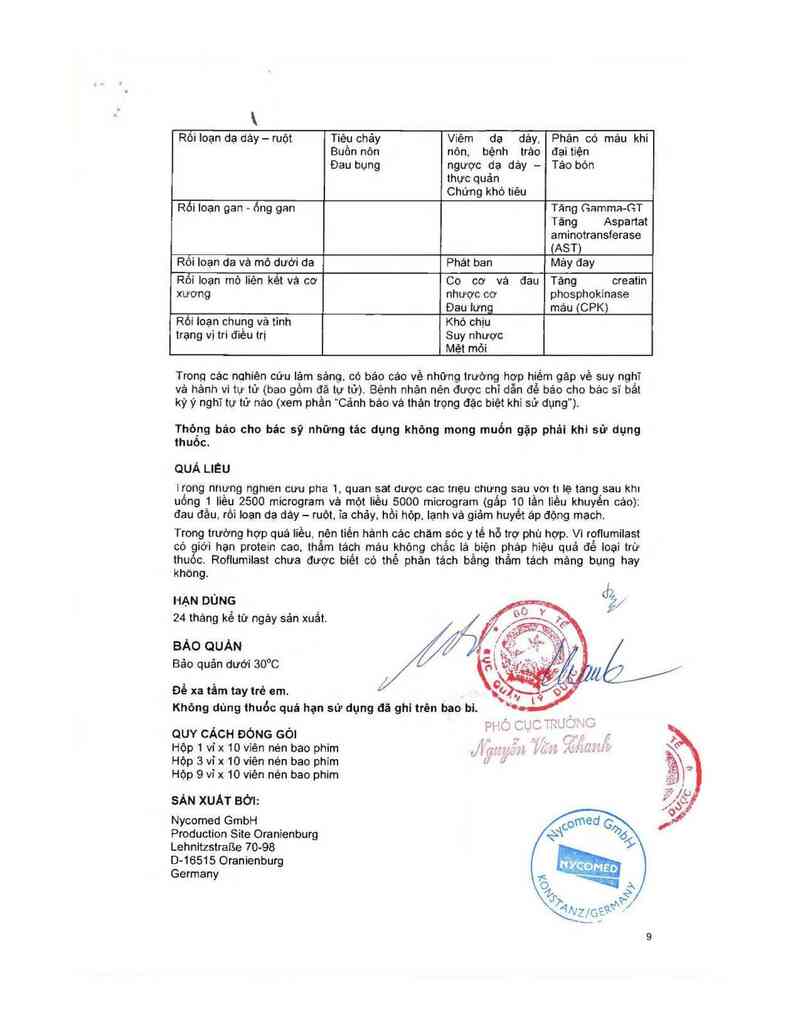
Bảng 1. Phản ứng bất lợi của roflumilast trong các nghiên cứu COPD lâm sảng
_ Tần suất Thường gặp Il gặp Hỉễm gặp
Hệ thông
Nhỏm bộ phận
Rối loạn hệ thỏng miễn Mẫn cảm
dịch
Rối loạn nội tiết _
Tu_yẻn vú phải
triẻn to ở nam giới
Rối loạn dinh dưỡng và Giảm cán
chuyền hòa Ản kém ngon miệng
Rối Ioạn tám thần Mảt ngủ Lo lảng lrảm cam
Bốn chồn
Rối Ioạn hệ thông ilìâti Đau đâu Run Luạnvịgiảc
kinh Chóng mặt
Hoa mắt
Rối Ioạntim mạch Hồi hộp, trống
ngưc
Rôi loạn hô hâp, ngưc vả Nhiễm khuân
trungthất đường hô hắp
(ngoai trữ viêm
' meo
è`ịr'o 6%
’ív
ồ " A
ờ ;;
'{N’
—ĩ—BiJ
L….ivC-
\
Rõi Ioạn dạ dảy — ruột Tiêu chảy Viêm da dảy, Phân có mảu khi
Buôn nôn nôn, bệnh trảo đại tiện
Đau bụng ngược dạ dảy — Tâo bón
thưc quản
Chứng khó tiêu
Rối loạn gan - ổng gan
Tăng Gamma-GT
Tăng Aspartat
aminotransferase
(AST)
Rối loạn da vả mô dưởi da Phát ban Mảy đay
Rối Ioạn mô liên kêt vả cơ Co cơ vả đau Tăng creatin
xương nhược cơ phosphokinase
Đau lưng máu (CPK)
RỔi ioạn chung vả tình Khó chịu
trạng vi tri điều trị Suy nhược
Mệt mỏi
Trong các nqhiẻn cứu lâm sảng. có báo cáo về những trường hơp hiềm gảp về suy nghĩ
vả hảnh vi tự từ (bao gôm đã tư từ). Bệnh nhân nên được chỉ dẫn để bảo cho bảo sĩ bât
kỳ ý nghĩ tư từ nảo (xem phần "Cảnh bảo vả thận trọng đặc biệt khi sử dụng").
Thông báo cho bác sỹ những tác dụng không mong muốn gặp phái khi sử dụng
thuóc.
QUÁ LIỂU
lrong nhựng nghien cưu pha 1. quan sat được cao triẹu chưng sau vơ: ti lẹ tang sau khi
uỏng 1 liếụ 2500 microgram vả một Iiều 5000 microgram (gắp 10 lần Iiẻu khuyến cáo):
đau đầu rối loạn dạ dảy - ruột ia chảy. hồi hộp lạnh vả giảm huyết áp động mạch.
Trong trường hợp quá iiều nên tiến hảnh các chảm sóc y tế hỗ trợ phù hợp. Vi roflumilast
có giới han protein cao. thẩm tách máu không chắc lả biện pháp hiệu quả để Ioại trừ
thuốc Roflumilast chưa được biết có thể phân tảch bằng thắm tảch mảng bụng hay
khõng
NẠN DÙNG
24 tháng kể từ ngảy sản xuất.
BÁO QUẢN
Bảo quản dưới 30°C
Đề xa tẩm tay trẻ em.
Không dùng ihuốc quá hạn sử dụng đã ghi trên bao bi.
QUY CÁCH ĐÓNG GÓI
Hộp 1 ví x 10 viên nén bao phim
Hộp 3 ví x 10 viên nén bao phim
Hộp 9 vị x 10 viên nén bao phim
SÁN XUAT BỞI:
Nycomed GmbH
Production Site Oranienburg
Lehnìtzstraíồe 70-98
D-16515 Oranienburg
Germany
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng