












kOT'III'OI rroor wew rroor correcuons
__J" Format 82 x 50 x 47 mm
" Register Nl'. 97-4.3541 Date: ............................ Date: ............................ Date: ............................
NP 91 ẮỹỸ/ẶL
29_10_2008 15:00:10 ' Visa: ............................ VLsa: ............................ VLsa: ............................
Grundschnft 7 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Wsa: ............................ Visa: ............................
10095956 FE 10095956 FE 10095956 FE 10095956 FE 10095956“ CE , ’f
FILM1VON s FILM z VON s FILM a VON s FILM 4 von s Fth S VON s iỸ'Ỹ / ỂỈ
Schwarz PMS 300 PMS 485 PMS 288 PMS 245 ,
29.10.08 29.10.08 29.10.08 29.10.08 29 10.08
i
- BỌ Y TE L ~
Medicine: keep out of re
children
Dosage and administration:
package insen
Do not store above 30°C
anun_uũmu
HLamzamuwưnnũ
LhLỉ1hlL M Tư Ìuuunun' ởLũn
nụmm
MaEe for
F. Hoffmann—La Roche Ltd
Basel, Switzeriand
by Patheon Inc., Mississauga. Canada
CỤC QL'ẢN LÝ DƯỢC
ĐÃPHÊDEYỆT
Lân aa……Ễ…u ỒLẮ
Ribavirin
42 film-coated tablets
©
Copegus
Ribavirin
42 film-coated tablets
©
~
/
1 sx cho FHoffmann La Roche Ltd. Basel.
szanEỊ pĐJ.EOD-UJIU ZtJ
ULJLAGCLLLL
,,sn6adog
1 fiIm-coateđ tablet -
200 mg rlbavirin
1 viên nén bao phim chùa ²00an ribavirin
Dùng dường uống
HOp chứa 1 lọ x 42 viên nén bao phủ
Cảc thdng Lln chi LLẻL (Ch! dlth chóng chỉ
dinh. lièu_vả cách dùng, ): xin xem trong tờ
hưởng dản sử dụng
Không bảo quán ở nhiệt ao lrẻn so°c
THUOC CHỈ BÁN meo ĐơN.
ĐỂ LLA LAM TAY cùn TRẺ EM.
ĐỌC LgỸ HƯỞNG DẦN sứ DỤNG mước
KHI DUNG
Sô dang kỷ:
NSX. số lô SX. HD xin xem phản MFD. sô
lũ, EXP in tren vỏ hộp. Ngảy hét hẹn Lá ngáy
01 của mủng`
Thuỵ sỹ bời Pathoon Inc.
2100 Synlex Court
LSN7K9 Mississauga. Ontario. Canada
Đóng_ẵẳcbờt F.Hoffmann-Ln Roche Ltd..
tmrm, g. CL-L-4303 Kaiseraugst.
Thưx.tL "
_, _ Ă
L_Jha nhảp khẮ_b\ oA\
10095956
FE 1111
91
/LQí
PREPRESS - INFORMATION PREPRESS - ROCHE BASEL CUSTOMER
Control Proof New Proof Corrections
Format 95 x 28 mm
Reglster Nr. 98.4.3650 Date: ............................ Date: ............................ Date: ............................
NP 9702
29.10.2008 15:00:45 Visa: ............................ Visa: ............................ Visa: ............................
Grundschrlft 5 Punkt
OK for Printing Control File OK for Printing
Date: ............................ Date: ............................ Date: ............................
Visa: ............................ Visa: ............................ Visa: ............................
10095955 FE 10095955 FE 10095955 FE 10095955 FE T LL 95*ỉằ5 FE
FILM 1 VON 5 FILM 2 VON 5 FILM 3 VON 5 FILM 4 VON 5 :'w
Schwarz PMS 300 PMS 485 PMS 288
29.10.08 29.10.08 29.1008 29.1006
P 'f'f~`\ [f—f \
. ' , | .…Ị ` \ầ '
/' f'x .<
L'AL: f—`—LLLtL L …,ẵẵmầẵndviflễ'“ TCopẹgus_' "* "“ '“ ²²“' …
ĩ" HL'LLLLLLLL mLLLờm … ofreach … Ribavirin
JL L~mnj P ( lnhhdmmistnu'm su
H ỆẸG noưEbme JD'C Jilmếm`sỏn L…
Ệ\ À N! L :fLư:ãâ'Lă.i— .… H & N ộ
\ ." L:"LLLLẸLLLẸL. …. Lm…»
LE Ế… WẸ'“'”t'° CMm _ 'AalufzẵưMed <…) MFD \
\
_ l \ __
ĨẮ-ễffli L
ẨỄ baVihùhliH VFỔ
ẵọn
Ầ\ặnoc HA N ỤI
Ệủt7 tảc động trực tiểp
.\Ụ//
1. MÔ TẢ
1.1 Nhỏm dược lý | điều trị
Thuốc chống vi rút tảc động trục tíếp
1.2 Dạng liều dùng
Copegus
Được cung cấp dưới dạng viên nén bao phim hình oval dùng đường uổng. Viên thuốc mầu hổng nhạt, một mặt có
chữ ROCHE, mặt kia có chữ RIB 200 /ểlớ
1.3 Đường dùng /
Đường uống
1.4 Thảnh phần định tính và định lượng
Hoạt chất chính: Mỗi viên nén có chửa 200mg ribavirin
2. CÁC ĐẶC TỈNH LÂM SÀNG
2.1 Chỉ định điều trị
Copegus được chi đinh phối hợp với pegimerferon aifa-2a hoặc interferon alfa-2a trong điều trị viêm gan C mạn
tinh ở người tmởng thảnh vả những người nảy có HCV- RNA huyết thanh dương tinh, bao gồm cả những bệnh nhân
bị xơ gan còn bù. <
/Ệhẹ,fo fi “N
\ \
/
Tham khảo hướng dẫn sử dụng của cảc thuốc peginterferon alfa-2a hoặc interferon alfa—2a để biết thêm thông tin.
2. 2 Liều lượng và cảch dùng
Copegus được dùng phối hợp với peginterferon alfa-2a hoặc ỉnterferon alfa-2a. Liều chính xác và thời gian điều trị
phụ thuộc vảo thuốc interferon dùng cùng.
Xin tham khảo phần hướng dẫn sử dụng cùa peginterferon alfa-2a hoặc interferon alfa-2a để biết thêm thông tin về
Iiều và thời gian đỉều trị khi COpegus được dùng phối hợp với một trong hai thuốc nảy
Phổi hgp với Pegffls (gegimerteron alta-2al
Liều hảng ngảy và thời gian diều trị của Copegus phối hợp vởi Pegasys thay dối tùy từng cá nhân dựa vảo kiểu gen
vi rủt và cân nặng cùa bệnh nhân (xem Bảng 1). Liều hảng ngây cùa Copegus đươc chia lảm hai lần (sáng và tối)
uống trong khi ản.
Viêm ean C man
Bảng ] Liễu khuyến cáo cũa Copegus phối hợp với peginterferon alfa-2a cho những bệnh nhân HCV
Kiểu gen Liều Copegus dùng hèng ngèy Thời gian điểu m; Số viên 200mg
Kiều gen 1,4* < 75 kg = 1000 mg 48 tuần 5 (2 viên buổi sảng; 3 viên buổi tối)
z 75 kg = 1200 mg 48 tuần 6 (3 viên buổi sáng; 3 viên buõi tổi)
CDS l5.0 /0.2014
Kiểu gen 2, 3 800 mg (không tinh đến cân nặng) 24 tuần 4 (2 viên buối sảng; 2 viên buồỉ tối)
*Nhin chung, bệnh _nhân bị nhiễm kiều gen 4 được xem lá khó điều trị và số liệu nghiên cứu hạn chế (N=49) thích hợp với liều
lượng như nhóm kíẽu gen ].
Đẩne nhíễm HIV-HCV
Liễu khuyến cản của Copegus, phối hợp với ]80 mcg peginterferon alfa-2a là 800 mg ribavirin dùng hảng ngảy
trong 48 tuần khỏng tính đên kiêu gen. Tính an toản vả hiệu qịuả cùa liệu pháp diển trị kết hợp với Copegus ìiều lớn
hơn 800 mg dùng hảng ngảy hoặc thời gian điếu trị dưới 48 tuân chưa được nghiên cứu.
C' 0 thể dự đoán trưởc tính đáp ủng vả khỏng đáp ửng
Đảp ứng vi rút sớm vảo khọảng tuần 12, xác định bằng lượng vi rủt giảm 2]og hoặc lượng HCV RNA không phảt
hiện được đã cho thấy có thể dự đoản trước khả năng đảp ứng bền vững (xem Bảng 2)
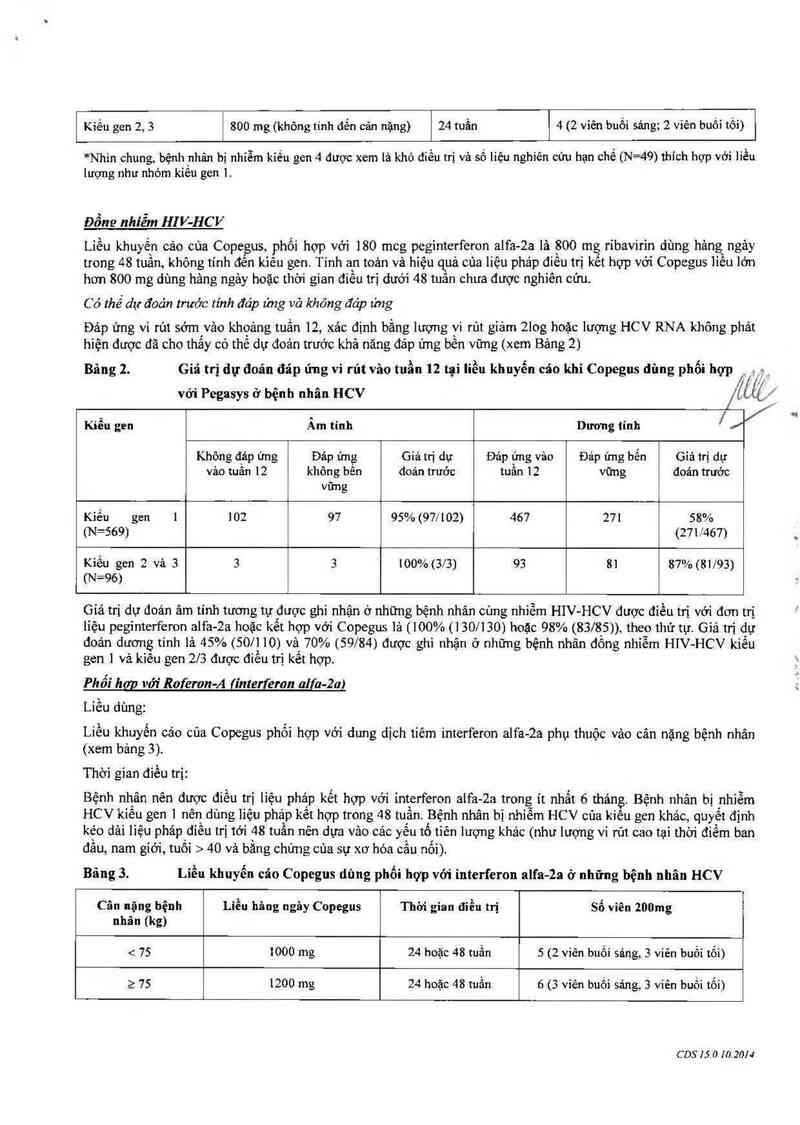
Bảng 2. Giá trị dự đoản đãp ứng vi rút vảo tuần 12 tại liều khuyến ca'o khi COpegus dùng phối hợp .
| lề""
với Pegasys ở bệnh nhân HCV /LẤLẶ
. . ]
Kiêu gen Am tinh Dương tinh ’ //
Không đảp ứng Đảp ửng Giá trị dự Đảp t'mg vảo Đảp ứng bển Giá trị dự
vảo tuân 12 không bên đoán trước tuân 12 vững đoán trước
vững
Kiểu gen 1 102 97 95%(971'102) 467 271 58%
(N=569) (271 L'467)
Kiếu gen 2 và 3 3 3 100% (3/3) 93 8] 87% (81/93)
(N=96)
Giá trị dự đoán âm tính tương tự được ghi nhận 0 những bệnh nhãn cùng nhiễm HIV— HCV được điểu trị với đon trị
lỉệu peginterferon alfa-2a hoặc kết hợp với Copegus lả (100% (1 30/ 130) hoặc 98% (83/85)) theo thứ tự. Giá trị dự
đoản dương tính lả 45% (50/110) và 70% (59/84) được ghi nhận ở nhũng bệnh nhãn đồng nhỉễm HIV-HCV kiểu
gen ] vả kiêu gen 2/3 dược điếu trị kết hợp.
Phối hop vói I_ìoferon-A (t_'nterferon aIfa-Za)
Liễu dùng:
Liều khuyến cảo của Copegus phối hợp với dung dịch tiêm interferon alfa-2a phụ thuộc vảo cân nặng bệnh nhân
(xem bảng 3).
Thời gian điều trị:
Bệnh nhân nên được điều trị lỉệu pháp kết hợp với ínterferon alfa- 2a trong ít nhẳt 6 tháng. Bệnh nhân bị nhiễm
HCV kiếu gen ] nên dùng liệu pháp kết hợp trong 48 tuần Bệnh nhân bị nhiễm HCV cũa kiêu gen khảo quyết định
kẻo dải liệu phảp đỉểu trị tới 48 tuần nên dưa vảo cảc yếu tổ tiên lượng khảo (như lượng vi rút cao tại thời điểm ban
đằu, nam giởi tuối > 40 vả bằng chúng của sự xơ hóa cầu nối)
Bãng 3. Liều khuyến cân Copegus dùng phổi hợp với interferon alfa-2a ở những bệnh nhân HCV
Cân nặng bệnh Liều hảng ngảy Copegus Thời gian điển trị Số viên 200mg
nhân (kg)
< 15 :000 mg 24 hoặc 48 tuần 5 (2 viên bnồi sảng, 3 viên buổi tối)
2 75 1200 mg 24 hoặc 48 tuần 6 (3 viên buốỉ sảng, 3 viên buồi tối)
CDS 1500 10.2014
q
2.2.1 Các hướng dẫn liều đùng đặc biệt
Điều chinh liều khi gặp các phản ứng ngoạiỷ
Tham khảo từ hướng đẫn sử dụng thuốc của peginterferon alfa-2a h0ặc interferon alfa-2a để biết thêm thông tin về
điều chỉnh lỉều vả việc ngưng diếu trị cùa hai thuốc nảy.
Nếu xuất hiện cảc phản ứng ngoại ỷ nặng h0ặc cảc bất thường về xét nghỉệm trọng quá trình điều trị với Copegus vả
peginterferon alfa-2a hoặc interferon alfa-Za, điều chỉnh liều cùa từng sản phẩm cho đến khi không còn cảc phản
ứng ngoại ỷ. Nếu vẫn còn tinh trạng không dung nạp sau khi điều chỉnh liều cùa Copegus, việc ngừng điều trị có thế
lả cân thiết
Đế kiếm soát hiện tượng thiếu mảu do điều trị, cảc hướng dẫn sau được thực hiện trong cảc thử nghỉệm lâm sảng
(xem bảng 4).
Bâng 4. Hướng dẫn điểu chinh liều Copegus trong việc kiểm soát hiện tượng thiếu máu đo điều trị
Cải: chỉ số xét nghiệm Giảm liều Copegus xuống còn úOOmg/ngây* chi nểu m…: Ngừng điều trị Copegus
Á
neu như“
Hemoglobỉn: Bệnh nhân không <10 gai < 8,5 g/dl /ẤZQ _`
có bệnh tim mạch ;.
Hemoglobin: Bệnh nhân có tiền
sử bệnh tim mach ôn đinh > 2 g/dl hemoglobin gìảm trong bẳt kỳ giai đoạn nảo kéo dải 4 < 12 g/dl sau 4 tuần giảm
tuấn trong khi điếu trị (giảm lìều thuờng xuyên) liếư
* Liều Copegus cùa bệnh nhãn giam xuống còn 600 mg dùng hảng rtgảy` uống một vỉên 200 mg vâo buổi sảng vả hai viên 200
mg vảo buồí tối
** Nếu các bắt thường về xẻt nghiệm xuất hiện trơ lại, Copegus có thế được bắt đầu lại Với 600 mg mỗi ngảy, và tăng tới 800
mg mỗi ngảy với sự thận trọng cùa bảo sĩ điều trị. Tuy nhiên không khuyến các trở lại liều cao hơn.
Tham khảo hướng dẫn sử dụng của peginterferon alfa-2a hoặc interferon alfa-2a đế biềt thêm thỏng tin.
2.3 Chống chỉ định
Chống chỉ định dùng Copegus ở những bệnh nhân quả mẫn cảm với ribavirin h0ặc với bắt kỳ tả dược nảo.
Không được dùng Copegus ở những phụ nữ có thai hoặc nam giới có bạn tình đang mang thai.
Chống chỉ định dùng C0pegus ở những bệnh nhân bị bệnh hemoglobin (ví dụ bệnh thalassemia, bệnh thiếu mảu
hinh liềm).
Chống chỉ định dùng chế độ điều trị kết hợp Pegasys vả Copegus ở những bệnh nhân bị bệnh gan mẩt bù.
Chống chỉ định Pegasys ở những bệnh nhân đồng nhiễm HIV- HCV bị xơ gan có điểm Child- P-ugh_ > 6 ngoại trừ
trường hợp tăng bilirubin gỉản tiểp huyết thanh do thuốc như atazanavir vả indinavír (Tham khảo thông tin sản
phẩm của Pegasys đế biểt thang điềm đảnh giả Chỉld-Pugh).
2.4 Cảnh bảo và thận trọng
2.4.1 Thận trọng chung
Dựa vảo kểt quả từ cảc thử nghiệm lãm sảng, dùng ribavỉrin đơn độc không hiệu quả và do đó Copegus không được
sử dụng đơn trị liệu.
Copegus trong chế độ điếu trị kểt hợp nên được dùng theo hướng dẫn cùa bác sĩ được huấn luyện chuyên môn và có
kinh nghiệm trong vỉệc gỉảm liều do phản ứng bất lợi ở mức độ trung bình đến nặng, ngừng thuốc tạm thời hoặc
ngừng điều trị để chuyến sang chế độ đỉều trị khảo.
Nguy cơ sinh quái thai Trước khi bắt đầu điều trị với Copegus, bác sĩ phải thông tin một cách đẳy đủ cho bệnh
nhân nguy cơ gây quái thai của ribavirin sự cằn thiết cùa bìện pháp ngừa thai liên tục và hỉệu quả khả năng của các
biện pháp chống thai có thế thẳt bại vả hậu quả có thai có thể xảy ra trong quá trình điều trị với ribavirin (xem phần
2.5.1).
CDS 15.0 [0.2014
Quá mẫn cám cẩp Nếu xảy ra phản ưng quá mẫn cấp (ví dụ mề day phù mạch, co thẳt phế quản, phản vệ) phải
dừng Copegus ngay lập tức và có những biện phảp đỉếu trị thích hợp. Những trường hợp phảt ban thoảng qua không
cần thiết phải ngừng điều trị
Hệ tim mạch vả máu Nếu như có bẩt kì sự giảm nồng độ hemoglobin mảu, nên tạm ngưng hoặc ngừng dùng
Copegus (xem phẳn 2. 2, Bảng 1). Mặc dù rỉbavirin không tảc động trực tiêp lên hệ tim mạch, thiếu máu do Copegus
có thế gây ra giảm chức nãng tim, hoặc Iảm nặng thêm triệu chứng cùa bệnh mạch vảnh, hoặc cả hai. Vì vậy, nên
dùng Copegus thận trọng ở những bệnh nhân có bệnh không ỏn định hoặc bệnh nặn dã có từ trước Cần đảnh giá
tình trạng tim mạch trước khi điều trị vả theo dõi lâm sảng trong quá trình đỉểu trị. Neu tim mạch xấu đi, cần ngừng
diều trị ríbavirin (xem phần 2. 2, Bảng 4) Khuyến cảo bệnh nhân có tỉền sử bất thường tim mạch nên được lảm điện
tâm đồ trước và trong quá trình điếu trị.
Điều trị phối hợp Copegus vả pegỉnterferon alfa—2a cho bệnh nhân viếm gan siêu vi C mạn đă thẳt bại điều trị trước
đó, không được nghiên cứu đây đủ ở những bệnh nhân đã ngímg điểu trị trước đó vì các biến cố bất lợi về huyết
học. Bảc sĩ điều trị nên được nhắc cấn thặn cảc nguy cơ so vởi lợi ích cùa việc sử dụng lại thuốc.
Thiếu mảu do suy tủy (giảm đảng kể cả 3 dòng hồng cầu, bạch cằu vả tiều cầu) và ức chế tùy xương xảy ra trong
khoảng 3 đến ? tuân sau khi sử dụng đồng thời ribavirin vả azathioprine đã được ghi nhận trong y vãn. Tinh trạng
nhiễm độc tủy xương hồi phục trong khoảng 4 đến 6 tuần khi ngừng đồng thời lỉệu phảp khảng virut HCV vả,;i/ L
azathioprìne vả không lập lại khi sử dụng lại 1 trong 2 đỉều trị nòi trên (xem phẳn 2 4 5) L-1 ịÚ/
Ivịgrườí nhận rạng ghép. Tính an toản vả hiệu quả của điều trị Pegasys vả Copegus chưa được thỉết lập ở bệnhth
ghép gan hay các tạng khảc. Tương tự cảc interferon alpha khác, sự ]oại bỏ mảnh ghép gan và thận đã dược ghi
nhận khi đìều trị Pegasys đơn trị hay phối hợp với COpcgus.
Chỷc năng gan: Những bệnh nhân có bầng chứng gan mắt bù trong quả trinh điều trị, nên ngùng điều tri Copegus
phôi hợp với peginterferon alfa-2a hoặc interferon alfa-2a.
Suy rhận:
Dược động học của ribavỉrin bị thay đổi ở bệnh nhân rối loạn chức nãng thận do giảrn thanh thải thuốc trên những
bệnh nhân nảy (xem mục 2 5.5 vả 3.2.5). Khuyến cảo đánh giá chức năng thận trên tất cả bệnh nhân trước khi bắt
đầu dùng Copegus. Dựa trên mô hình dược động học và mô phòng, khuyên cản hiệu chinh liều trên bệnh nhân Suy
giảm chức năng thận rõ rệt (xem mục 2.2.1)
Bệnh nhân có độ thanh thải creatinin nhỏ hơn hoặc bằng 50 mL/phút nên được theo dõi chặt chẽ khi dùng Copegus.
Các xét nghiệm
Cảc xét nghiệm huyết học chuẩn vả sinh hớa máu {công thức máu toản bộ [CBC] và biệt hóa số lượng tiền cẩu, điện
giải, creatỉnin huyết thanh xét nghiệm chức nãng gan, acid uric) cần được lảm ở tất cả các bệnh nhân trước khi bắt
đầu điều trị. Khi bắt đầu điều trị Copegus. nên lảm lại cảc xét nghiệm đảnh giả sau 2 hoặc 4 tuần điều trị và định kỳ
sau đó tùy theo diễn biến lâm sảng. Các giá trị xét nghiệm ban đâu châp nhận bao gồm truớc khi dùng Copegus phối
hợp với peginterferon alfa-2a hoặc interferon alfa-2a bao gồm:
' Hemoglobin Z 12 g/d] (nữ); 2 13 gldl (nam)
- Tỉều cầu 2 90 OOO/mm3
' Lượng bạch cầu trung tính 2 ] 500/mm3
' Với bệnh nhân đồng nhiễm HIV-HCV: CD4+ ì 200/ụ1 hoặc CD4+ ì 100/ụ] - < 200/121 vả HlV-l RNA < 5000
phiên bản /ml sử dụng thử nghiệm theo dõi HIV-l Amplicor, v 1.5.
Cho những phụ nữ có khả năng mang thai. Bệnh nhân nữ phải ]ảm cảc xét nghiệm thử thai đều đặn hảng tháng
trong quá trình điểu trị vả trong 6 tháng sau đớ. Bạn tình của những bệnh nhân nam phải lảm thử nghiệm thử thai
hảng thảng trong quả trinh đỉều trị và 6 thảng sau đớ.
Tăng trường vờ phát m'ên (bệnh nhi)
Trong quá trình đìều trị bằng Pegasys kết hợp với rỉbavirin kéo dải đến 48 tuần trên bệnh nhân từ 5 đến 17 tuồi,
thường gặp hỉện tượng giảm cân và ức chê tãng trưởng (xem mục 2 6. 2)
Tại thời diếm 2 năm sau điều trị, 16% bệnh nhi có cân nặng thẳp hơn 15 bảch phân vị so với đường cong tãng
trướng ban đầu, 1 1% bệnh nhi có chiều cao thẳp hơn 15 bảch phân vị so với đướng cong chiều cao ban đằu
CDS l5.0 10.2014
Tại thời diếm 5 đến 6 năm sau điều tn_, bệnh nhi bệnh nhi có bảch phân vì giảm 15% so với ban đẳu tại thời điểm 2
năm sau điều trị đã hồi phục về mức bách phân vị chiều cao như ban đầu hoặc một yếu tố gây ảnh hưởng khảc
không liên quan đến điều trị được xảc định Dữ liệu theo dỏi dải hạn cho thấy điểu trị kết hợp Pegasys với ribavirin
dường như không liên quan đến sự ức chế lâu dải sự tãng tn.rờng ở trẻ em. Trong từng trường hợp, cảc lợi ích điếu
trị dự kiến nên được cân nhắc thận trọng so với tính an toản dựa trên dữ liệu đã dược ghi nhận ở trẻ em và trẻ vị
thảnh niên trong cảc thử nghiệm lâm sảng (xem mục 2.6.1).
Điều quan trọng cần cân nhắc là việc đìều trị phối hợp có gây ra sự ức chế tăng trướng ương quá trình điếu trị
Nguy cơ nảy nên được cân nhắc với đặc điềm bệnh của trẻ, như bằng chứng về sự tiến triến của bệnh (đặc biệt là
bệnh lý xơ hóa), các bệnh lý mắc kèm theo có ảnh hưởng tiêu cực đến tiên triển bệnh cũng như cảc yếu tổ tiên
lượng đáp' ung (genotype HCV vả tải lượng virus).
2.4.2 Lạm dụng và phụ thuộc thuốc
Không có thông tin
2. 4. 3 Khả năng lái xe và vận hảnh máy mỏc
Copegus không có hoặc có ảnh hướng không đảng kế 1ên khả năng lải xe vả vận hảnh máy móc; tuy nhiên,
interferon alfa—2a hoặc peginterferon alfa-2a sử dụng kết hợp có thế có tác động nảy. Do đó, bệnh nhân có thế có
mệt, buồn ngủ, hoặc lẫn lộn trong quá trình điều trị vả cần chú ý tránh lải xe và vận hảnh máy mỏc.
2.4.4 Xét nghiệm cận lâm sâng /Ẩ L’íZ
Tham khảo mục 2.4.1 (Cảnh bảo vả thặn trọng, Thận trọng chung) /
2. 4. 5 Tương tác thuốc với các thuốc khâc vả cảc hình thức tương tác thuốc
Cảc nghiên cứu về tươn tảc thuốc được tiển hảnh với ribavirin kết hợp với peginterferon alfa-2a, interferon alfa-2b
vả thuốc khảng acid. Nông độ ribavirin là tương đương khi dùng đơn dộc hoặc phối hợp với peginterferon alfa- 2a
hoặc interferon alfa-2b.
Bất cứ khả năng tương tác thuốc nảo có thể kéo dải tới 2 thảng (tương ứng với 5 lần thời gian bản thải cùa ribavirin)
sau khi ngừng Copegus do thời gian bản hủy của thuôc dâi.
Kết quả từ các nghiên cửu in-vitro sử dụng cả ti thể gan chuột và người chỉ ra rằng chuyến hóa của ribavirin không
qua men trung gỉan cytochrome P450. Ribavirin không ức chế cytochrome P450 Khộng có bằng chứng từ cảc
nghiên cứu độc tính cho rằng ribavirin kỉch hoạt men gan. Vì vậy, nguy cơ là tối thiếu đối với tương tảc qua enzym
P450.
Thuốc kháng acid Sinh khả dụng của ribavirin 600mg giảm khi dùng cùng với thuốc khảng acid có chứa magiê,
nhôm và methicone; AUC,noản phẩn giảm 14%. Có thế giả thuyết độ khả dụng sinh học giâm trong nghiên cứu nảy
do thuốc di chuyến chậm trong ông tiên hỏa hoặc do thay đối pH. Tương tảc nảy không được coi lá có ý nghĩa lâm
sảng.
Các thuốc tương tự nucleoside: Kết quả in-vỉtro cho thấy ribavirin ức chế sự phosphoryl hỏa của zidovudine vả
stavudỉne Ý nghĩa lâm sảng của những nghiên cửu nảy chưa được sảng tò Tuy nhiên, những nghiên cứu in—vitro
nảy đưa ra khả Inãng dùng đồng thời Copegus với zidovudine hoặc stavudine có thể dẫn đến tăng tải lượng vi rút
HIV trong huyết tương Vì vậy, khuyến cảo theo dõi chặt chẽ số phiên bản RNA HIV huyết tương ở những Ibệnh
nhân được điều trị bằng Copegưs cùng với một trong hai thuốc trên. Nếu mức RNA HIV tăng, có thế cân nhắc lại
việc dùng đổng thời Copegus vói các thuốc ức chế sao chép ngược.
Từ một nghên cứu phụ 12 tuần về dược động học đảnh giá hìệu quả cùa ribavirin trên sự phosphoryl hoá trong tế
bảo cùa một số thuôc ức chế sao chép ngược nucleoside (lamivudine, zidovudine hoặc stavudine), không có băng
chứng về tương tác thuốc được ghi nhận ở 47 bệnh nhân đồng nhiễm HIV- HCV. Tồng lượng thuốc trong huyêt
tương của ribavirin dường như không bị ảnh hướng bới sự dùng cùng các thuốc ức chế sao chép ngược nucleoside
(NRTIs)
Dídanosine (dd1). Ribavirin Iảm tăng tác dụng khảng vi rút cùa didanosine (dd!) in-vitro và trên động vật bằng cách
tãng tạo chất đống hóa triphosphate có hoạt tính (ddATP). Quan sát nảy cũng cho thấy khả năng mà dùng dồng thòi
ribavirin vả dd! cũng lâm tăng nguy cơ cảc phản ứng bất lợi có liên quan đến dd! (như bệnh thần kinh ngoại biên,
viêm tụy cẩp, vả chửng gan nhíễm mỡ gan kèm theo toan chuyển hóa acid lactic) Trong khi ý nghĩa lâm sảng của
những nghiên cứu nảy chưa được sảng tò, một nghiên cứu dùng ribavirin cùng với dd] ở những bệnh nhân nhiễm
CDS I5.0 l0.2014
u'-.
HIV đã không lảm giảm thêm tải lượng vi rút mảu hoặc không Iảm tãng cảc phản ửng bẩt lợi. Dược động học huyết
tương cùa dd! khỏng ảnh hướng nhiếu khi dùng cùng với ribavirin, tuy nhiên lượng ddATP trong tế bảo đã khỏng
được đo lường.
Không khuyến cảo dùng ribavirin cùng với didanosine. Nổng độ của didanosine hoặc chẩt chuyến hoá có hoạt tính
của chúng (dideoxyadenosine 5’—triphosphate) tăng khi didanosine được dùng cùng vởi ribavirin. Cảc bảo cảo về sự
suy gan nặng cũng như bệnh thẳn kinh ngoại biên, viêm tuy cấp, vả tăng acid lactic hưyết thanh/ nhiễm toan acid
lactic đã được ghi nhận khi dùng ribavirỉn.
Azathioprine Ribavirin, thông qua tác dụng' ưc chế' mosine monophosphate dehydrogenase, có thế ảnh hướng đến
chuyến hỏa của azathioprìne và có thể dẫn đến tích tụ 6-methylthioinosine monophosphate (6— —MTIMP), được xem
là có liên quan với nhiễm độc tủy xương ở những bệnh nhân điếu trị bằng amthioprine.
Trong trường hợp khi lợi ích của việc sử dụng đổng thời ribavirin với azathioprine được xảo nhận có nguy cơ tiềm
ân, khuyến cảo theo dõi sát các tảc dụng phụ huyết học trong suốt quá trinh điều trị đồng thời với azathioprine đế
phảt hiện cảc dấu hìệu nhiễm độc tùy xương. Trong trường hợp nảy nên ngừng điều trị(xem phần 2 4.1)
2.5 Dùng thuốc ở những đối tượng đặc biệt /[ /
2.5.1 Phụ nữ có thai
Copegus không được dùng cho phụ nữ có thai hoặc những người đản ông mả bạn tình của họ đang mang thai.
Đảnh giả từ những nghiên cứu động vật trên thực nghiệm cho thấy độc tính trên sinh sản Nguy cơ cho phôi vả/hoặc
gây quái thai được chúng minh cho ribavirin ở tắt cả các loải động vật trong những nghiên cứu thích hợp, xảy ra &
liếư thẳp hơn liếư dùng được khuyến cảo ở người. Những bất thường vê xương sọ, vòm miệng, mắt, hảm, chân tay,
khung xương, đường tiêu hóa cũng được ghi nhận. Tỉ lệ và độ trầm trọng của những tác động gây quải thai tăng
cùng với sự tăng liều của ribavirin. Sự sống cùa phôi vả thai giảm.
Cần phải quan tâm để tránh mang thai ở những bệnh nhân nữ. Không được dùng Copegus cho đến khi có kết quả
xét nghiệm thử thai am tính trước khi bắt dầu điều trị.
Do bắt cứ biện phảp phòng tránh thai nâo cũng có thế thẳt bại nên một rất quan trọng đối với những phụ nữ có khả
năng mang thai và những bạn tinh cùa họ phai sử dụng cùng một lủc hai hình thức trảnh thai có hiệu quả,, trong quả
trinh điếu trị vả trong 6 tháng sau điều trị; cảc xét nghiệm thử thai phải lảm đều đặn hảng tháng trong thời gian nảy.
Nếu mang thai trong quá trình điều trị hoặc trong vòng 6 tháng sau khi ngừng điều trị, bệnh nhân cân được tư vân
về nguy cơ cao của ribavirin gây quái thai cho phôi.
Nhung bệnh nha'n nam vả những người bạn tình của họ.- Cần lưu ý để trảnh mang thai cho những bạn tình của
những bệnh nhân nam đang dùng Copegus Ribavirin tich lũy trong tế bảo vả được đảo thải khỏi cơ thể rất chặm.
Trong những nghỉên cứu ở động vật, ribavirin lảm thay đổi tinh dịch tại liếư thấp hơn liếư lâm sảng. Hiện không rõ
liệu ribavirin cỏ trong tinh dịch sẽ gây nhĩmg tảc động quải thai đã biết sau khi thụ tinh với trứng. Vì vậy. phải
hướng dẫn cho những bệnh nhân nam sử dụng bao cao su đế tmyền tối thiều ribavirin cho người bạn tinh của họ.
Bệnh nhân nam và bạn tình cùa họ ở lứa tuôi sinh sản cẩn được tư vấn sử dụng hai bỉện phảp trảnh thai trong quá
trình điều trị với Copegus và trong vòng 6 tháng sau khi điều trị. Người phụ nữ phải có xét nghiệm thử thai am tính
trước khi bắt đầu điều trị.
2. 5. 2. Phụ nữ cho con bú
Người ta vẫn chưa biết Iiệu Copegus có tiết qua sữa mẹ không Do đó có thể có cảc phản ứng bất lợi ở trẻ bú mẹ,
nên quyết định ngừng cho bú hoặc không dùng thuốc.
2. 5. 3. Dùng thuốc ở trẻ em
Tính an toản và hiệu quả cùa iibavirin khi dùng phối hợp với peginterferon alfa-2a vả interferon alfa-2a ở những
bệnh nhân nảy chưa được đánh giá. Điểu trị với Copegus không được khuyến cảo cho dùng 0 trẻ em và thanh thiếu
niên dưới 18 tuối.
2. 5. 4. Dùng thuốc ở người giả
Tuổi tảc dường như khỏng ảnh hưởng đến dược động học của ribavirin. Tuy nhiên, tương tự những bệnh nhân trẻ
hơn, nên kiềm tra chức năng thặn cho bệnh nhân trước khi dùng Copegus
2.5.5. Ở bệnh nhân suy thận
CDS l5.0 l0.2014
Dược động học cùa ribavirin thay đổi ở những bệnh nhân có rối loạn chức nãng thận do giảm độ thanh thải rõ rảng
ở những bệnh nhân nảy (xem phần 3. 2). Do đó khuyến cảo đảnh giá chức năng thận ở tất cả cảc bệnh nhân trước
khi bắt đầu dùng Copegus, tốt nhẩt lả đảnh giả thông qua độ thanh thải creatinỉn cùa bệnh nhân.
Bệnh nhân suy thận mức độ trung bình hoặc nặng (độ thanh thải creatinin 550 mL/phủt) không lọc mảu định kỳ
không dung nạp được mức liều hảng ngảy tương ứng lả 600 mg vả 400 mg cùa Copegus vả có nồng độ ribavirin
trong huyết tương cao hơn so với bệnh nhân có chức năng thận bình thường (độ thanh thải creatinin >80 mL/phút)
sau khi dùng liều chuẩn của Copegus (xem mục 2.2.1 vả mục 3. 2. 2).
Trong một nghiên cứu trên bệnh nhân bệnh thận mạn giai đoạn cuối (ESRD) phải lọc mảu định kỳ, hầu hết cảc bệnh
nhân nảy phải dùng các yếu tố kích thích hệ tạo máu, Copegus được coi lả an toản ở mức liếư 200 mg hảng ngảy
Trong nghiến cứu nảy, bệnh nhân ESRD được lọc máu định kỳ dùng ribavirin với liều hảng ngây 200 mg có nông
độ ribavirin trong huyết tượng thấp hơn khoảng 20% so với bệnh nhân có chức năng thận bình thường sau khi dùng
Copegus hảng ngảy vởi liều chuẩn 1000/1200 mg (xem mục 2.2.1 và mục 3.2.2)
2.5.6. Ở bệnh nhân suy gan
Không có tương tác dược động học giữa ribavirin vả chức năng gan. VÌ vậy, không cấn điều chinh liều Copegus ở
bệnh nhân bị suy gan. Chông chỉ định dùng peginterfcron alfa-2a hoặc ỉnterferon alfa-2a ở những bệnh nhân có
bệnh gan mất bù. J |“
2.6 Tác động không mong muốn /ẻQ/
Thông bảo cho bác sĩ bất kì tác dụng phụ nảo liên quan đến vỉệc dùng thuốc.
2.6.1 Các thử nghiệm lim sâng
Loại vả tần suất cảc tác dỤng phụ trong chế độ điều trị phối hợp phù hợp với tải liệu về độ an toản được biết cùa
interferon alfa-Zạ hoặc peginterferon alfa-2a và các tảc dụng không mong muốn đi kèm với ribavirin.
Bênh nhân người !ởn bi viêm gan C man n'nh
So sảnh điều trị với Copegus 1000/1200 mg vả pegỉnterferon alfa-2a 180mcg vởi thời gian kéo dải tới 48 tuần, Iiệu
trình điều trị giảm xuông còn 24 tuần và liếư Copegus xuông còn 800 mg đã lảm giảm tỷ lệ cảc biến cố bất 1'
nghiêm trọng ( | 1% so với 3%), tỷ lệ bệnh nhân mắc phải ngừng thuốc sớm vì lý do an toân(l3% so với 5%), và
lệ phải thay đối liếư của Copegus (39% so với 19%). °
Bênh nhịn Ire em bi viêm zan C man n'nh
Trong một thử nghiệm lâm sảng trên 114 bệnh nhi (từ 5 đển 17 tuổi) được điếu trị bằng Pegasys đơn độc hoặc kết
hợp với ribavirỉn, khoảng 1/3 bệnh nhi đã cần phải thay đối liều, chủ yếu do giảm bạch cẩu trung tinh và thiếu mảu.
Nhìn chung, dữ liệu về độ an toản của thuốc ghi nhận trên bệnh nhi tương tự trên bệnh nhân người lớn. Trong
nghiến cứu nhi khoa, cảc biến cố bất lợi thường gặp nhất trên bệnh nhân được điểu trị kết hợp ribavirin vả Pegasys
trong thời gian lên tới 48 tuần bao gồm hội chứng giả củm (91%), nhiễm trùng đường hô hấp trên (60%). đau đầu
(64%) rối loạn tiêu hóa (56%), rối loạn da (47%) và phản ủng tại vị trí tiêm (45%). Bảy bệnh nhân dùng kết hợp
ribavirin vả Pegasys trong 48 tuần phải dừng điều trị vì lý đo an toản (trầm cảm, đánh giá tâm thần không bình
thường, mù thoảng qua, xuất tiểt võng mạc, tãng đường huyết, đảỉ tháo đường típ ] vả thỉếu mảu). Hầu hết các phản
ứng bất lợi được ghi nhận trong nghiên cứu nảy ở mức độ nhẹ đến trung bình. Các biến cố bất lợi nghiêm trọng
được ghi nhận trên 2 bệnh nhân trong nhóm điếu trị kểt hợp ribavirín vả chasys (tăng đường huyết vả cẳt bò tủi
mật).
Ửc chế sự phảt triến đã được quan sảt thắy trên bệnh nhi (xem mục 2.4.1 Cảnh bảo và thận trọng).
Bệnh nhi được đìều trị bằng Pegasys kết hợp ribavirỉn cho thẩy chậm tăng trướng về thể trọng vả chiếu cao so với
ban đầu sau 48 tuần điều trị. Chỉ số z-scores về thể trọng vả chiếu cao theo tuổi cũng như bảch phân vị thể trọng vả
chiều cao cua bệnh nhán đều giảm so với chuản trong quá trình điều trị. Tại thời điếm kết thủc 2 nãm theo dõi sau
điều trị. hầu hết bệnh nhân có bảch phân vị trở lại binh thường như ban đẩu đối với cân nặng (trung bình 64 bách
phân vị tại thời điếm ban đầu, trung bình 60 bảch phân vị tại thời điếm 2 năm sau điếu trị) Vả chiều cao (trung bình
54 bảch phân vị tại thời điếm ban đầu, trung binh 56 bách phân vị tại thời điếm 2 năm sau diều ui). Khi kết thúc
điếu trị , 43% (23 trong tống số 53 bệnh nhân) giảm hơn 15 bảch phân vị thể trọng vả 25% (13 trong tổng số 53
CDS 15.0 !0.2014
bệnh nhân) giảm hơn 15 bách phân vị chiều cao so với đường cong tãng trướng bình thường. Tại thời điềm 2 năm
sau điều trị, 16% (6 trên 38 bệnh nhân) có bách phân vị cân nặng giảm hơn 15 bảch phân vị so với đường cong thê
trọng ban đầu và 11% (4 trên 38 bệnh nhân) có chiếu cao giảm hơn 15 bảch phân vị so với đường cong chíểu cao
ban đầu.
55% (21 trên 38 bệnh nhân) đã hoản thảnh nghiên cứu bạn đầu tham gia vảo quá trình theo dõi dải hạn kéo dải tới 6
năm sau điếu trị. Nghiên cứu đã cho thấy sự phục hổi tăng trướng tại thời điềm 2 năm sau điều trị vẫn được duy trì
cho đến thời điềm sau 6 năm. Một số ít bệnh nhân có sự giảm dưới 15 bảch phân vị chiếu cao so với ban đầu tại thời
điểm 2 nãm sau điều trị, đã hổi phục bảch phân vị chiều cao tương đương ban đầu ở giai đoạn 6 năm sau đỉếu trị
hoặc một yếu tố gây anh hướng khác không Iiên quan đến điều trị được xác định. Nhìn chung, dữ lỉệu theo dõi dải
hạn cho thắy điều ni bằng Pegasys kết hợp với ribavirin dường như không liên quan đến vỉệc ức chế lâu dải tăng
trưởng ở trẻ em.
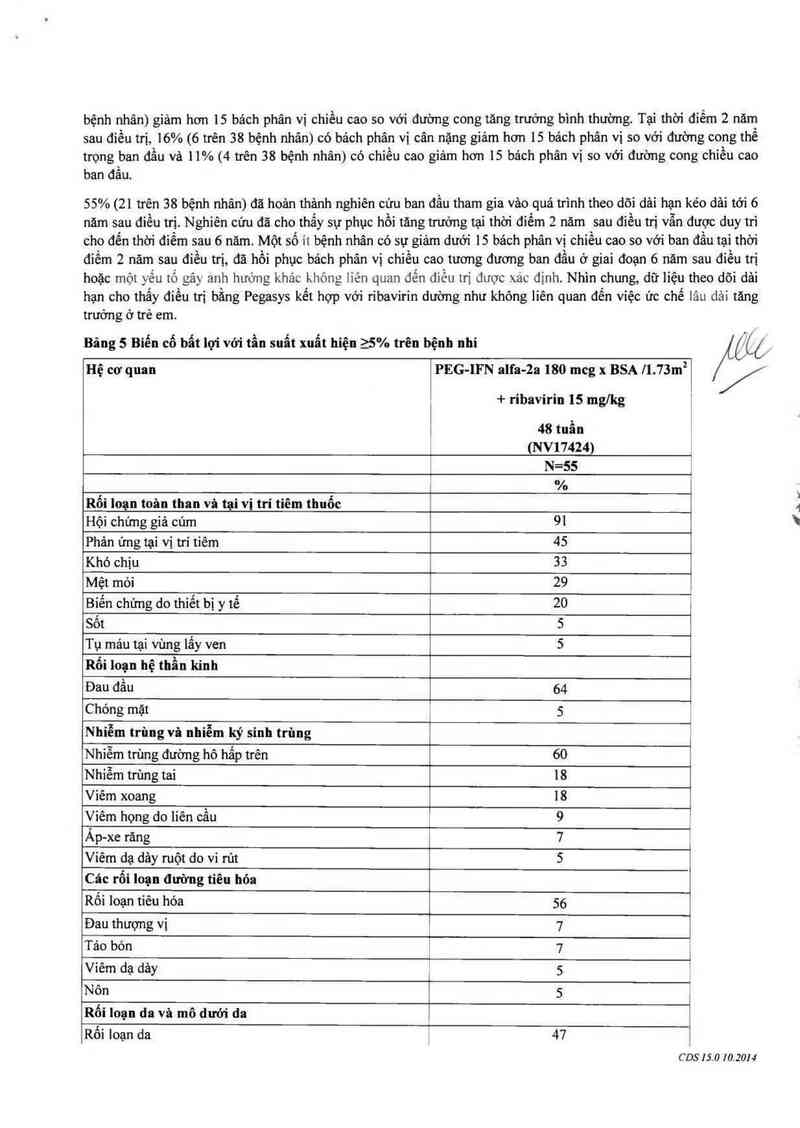
Bâng 5 Biến cố bất lợi vởi tần suất xuất hiện 25% trên bệnh nhi CCÓ
nệ cơ quan PEG-IFN alfa-2a 180 mcg x BSA 71.73m² /í/
+ ribavirin 15 mglkg
48 tuần
(NV17424)
=55
, %
Rối Ioạn toân than và tại vị trí tiêm thuốc 1
Hội chứng giả củm 91
Phản ứng tại vị trí tiêm 45
Khó chịu 33
Mệt mòi 29 ,
Biến chứng do thiết bị y tế 20 '
Sốt S
Tụ máu tại vùng lấy ven 5
Rối loạn hệ thần kinh
Đau đầu 64
Chóng mặt , 5
Nhiễm trùng vã nhiễm ký sinh trùng 1 ,
Nhiễm trùng đường hô hấp trên 60 ’
Nhiễm trùng tai 18
Viêm xoang 18
Viêm họng do liên cầu 9 Ể
Áp—xe rãng 7 1
Viêm da dảy ruột do vi rứt 5
Các rổi loạn đường tiêu hóa
Rối loạn tiếu hóa 56
Đau thượng vị 7
Táo bỏn 7 1
Viêm dạ dảy 5 ²
Nôn 5 1
Rối 1011… da vã mô dưới da ẩ
Rối loạn da 47
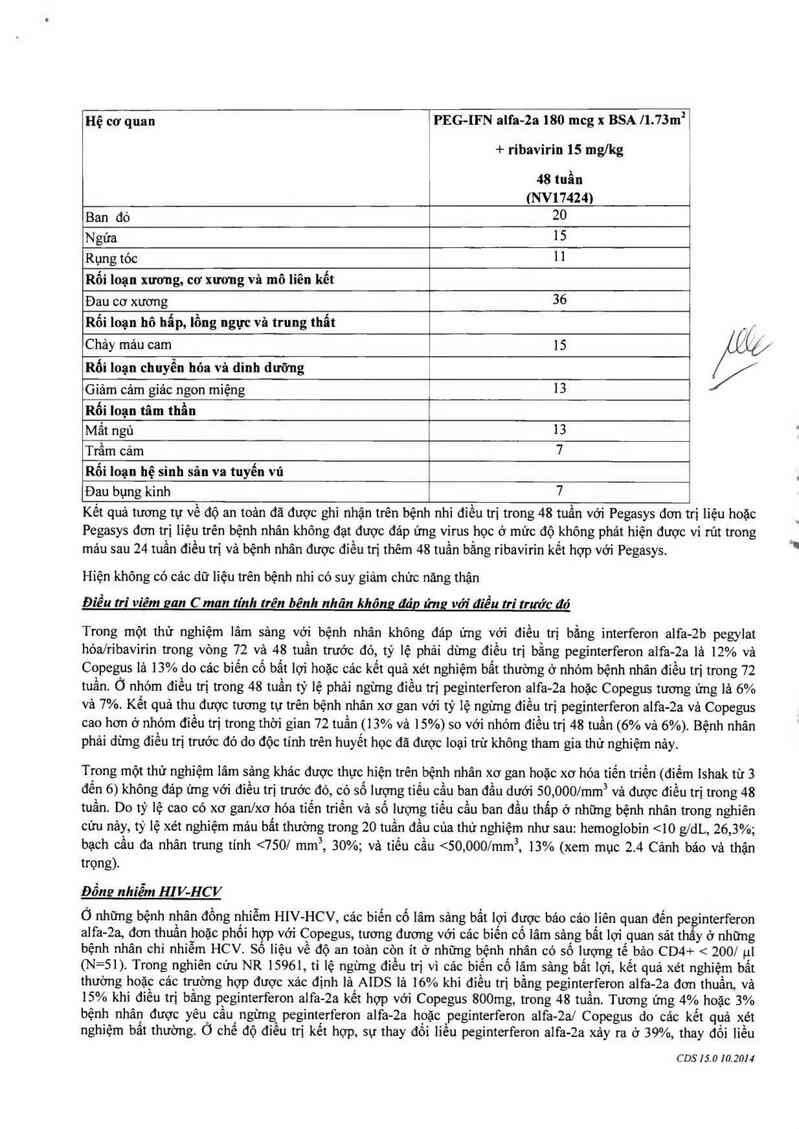
CDS 15.0 10.2014
Hệ cơ quan lPEG-IFN alfa-2a 180 mcg x BSA /l.73m²ỉ
+ ribavirin 15 mglkg
48 tuần
(NV17424)
Ban đỏ 20
Ngứa 15
Rụng tóc 1 l
Rối loạn xương, cơ xương và mô liên kết
Đau cơ xương 36
Rối loạn hô hấp, lồng ngực và trung thất
Chảy mảu cam 15 .’ ,
Rối loạn chuyến hỏa và dinh dưỡng L /
Giảm cảm giảc ngon miệng 1 13
Rối loạn tâm thần
Mất ngủ 13
Trầm cảm 7
Rối Ioạn hệ sinh sản va tuyến vú
Đau bụng kinh 7
Kết quả tương tự về độ an toản đã được ghi nhặn trên bệnh nhi điều trị trong 48 tuấn với Pegasys đơn tlrị liệu hoặc
Pegasys đơn trị liệu trên bệnh nhân không đạt được đáp ứng virus học ở mức độ không phản hiện được vi rủt trong
mảu sau 24 tuần điều trị và bệnh nhãn được điếu trị thếm 48 tuần bắng ribavirin kêt hợp với Pegasys.
Híện không có cảc dữ liệu trên bệnh nhi có suy giảm chức năng thận
Điều tri viêm zan Cman tính trên bênh nhân không đáe ứng với điều !ri trưác đó
Trong một thử nghiệm lâm sâng với bệnh nhân không đảp ứng với điều trị bằng interferon alfa-2b pegylat
hóa/ribavìrin trong vòng 72 vả 48 tuần trước đó, tỷ lệ phải dùng đỉêu trị băng pcginterferon alfa-2a là 12% và
Copegus là 13% do cảc biến cố bất lợi hoặc cảc kết quả xét nghiệm bẩt thường ở nhóm bệnh nhân điếu trị trong 72
tuần. Ổ nhóm điều trị trong 48 tuần tỷ lệ phải ngùng điếu trị peginterferon alfa-2a hoặc Copegus tương ứng lả 6%
và 7%. Kểt quả thu được tương tự trên bệnh nhân xơ gan với tỷ lệ ngưng điếu trị peginterferon alfa-Za vả Copegus
cao hơn ở nhóm điểu trị trong thời gian 72 tuần (1 3% và 15%) so với nhóm điếu trị 48 tuần (6% vả 6%). Bệnh nhân
phải dimg điểu trị trước đó do độc tính trên huyết học đã được Ioại trừ không tham gia thử nghiệm nảy.
Trong một thử nghiệm lâm sâng khác được thực hiện trên bệnh nhân xơ gan hoặc xơ hóa tiến triến (điếm Ishak từ 3
đến 6) không đáp ứng với điều trị tmớc đó, có số lượng tìếu cầu ban đẩu dưới 50, OOO/mm vả được điếu trị trong 48
tnần. Do tỷ lệ cao có xơ gan/xơ hớa tiến triển và số lượng tiếu cằn ban đầu thấp ở những bệnh nhân trong nghiên
cứu nảy, tỷ lệ xét nghiệm máu bất thường trong 20 tuần đầu cùa thử nghiệm như sau: hemoglobin < 10 gdL, 26,3%;
bạch cầu đa nhân trung tính <750/ mm, 30%; và tiếu cầu <50, OOO/mmẵ 13% (xem mục 2. 4 Cảnh báo vả thận
trọng).
Đổng nhiễm HIV HCV
Ở những bệnh nhân đồng nhiễm HIV- HCV, cảc biến cố lâm sảng bắt lợi được bảo cảo liên quan đến peginterferon
alfa-2a, đơn thuần hoặc phối hợp với Copegus, tương đương với cảc biển có lâm sảng bất lợi quan sát thây 0 những
bệnh nhân chi nhiễm HCV. Số lỉệu vế độ an toản còn ít ở những bệnh lnhân cớ sô lượng tế bảo CD4+ < 200/ 111
(N= 51). Trong nghiên cứu NR 15961, tỉ lệ ngừng điều trị vì các biến cố lâm sảng bất lọi, kểt quả xét nghiệm bất
thường hoặc cảc trường hợp được xảc định là AIDS lả 16% khi điều trị bằng peginterferon alfa—2a đơn thuần và
15% khi điều trị bắng peginterferon alfa-2a kết hợp với Copegus 800mg, trong 48 tuần. Tương ứng 4% hoặc 3%
bệnh nhân được yêu câu ngừng peginterferon alfa-2a hoặc peginterferon alfa-2a/ Copegus do cảc kết qụả xét
nghiệm bất thường. Ó chế độ điếu trị kết hợp, sự thay đổi iiếu pegỉnterferon aifa-2a xảy ra ở 39%, thay đổi liều
CDS 15.0 10.2014
Copegus xảy ra ở 37% số bệnh nhân đồng nhiễm. Cảc biến cố bất lợi nghiêm trọng được ghi nhận ở 21% và 17% số
bệnh nhân dùng đơn trị liệu peginterferon alfa-2a h0ặc kết hợp với Copegus,
Phác đồ điếu trị chứa pẹginterferon alfa-Za gây giảm số lượng tuyệt đối tế bảo CD4+ trong quá trình điếu trị mà
không lảm giảm ti lệ phẩn trăm tế bảo CD4+. Lượng tế bảo CD4+ đã trở về giá trị ban đầu trong giai đoạn sau cùa
nghiến cứu. Phác để chỉnh peginterferon alfa-2a không có tảc động bất lợi rõ rệt lên sự kiểm soát tải lượng vi rút
HIV trong máu trong quá trinh điếu trị hoặc sau điều trị.
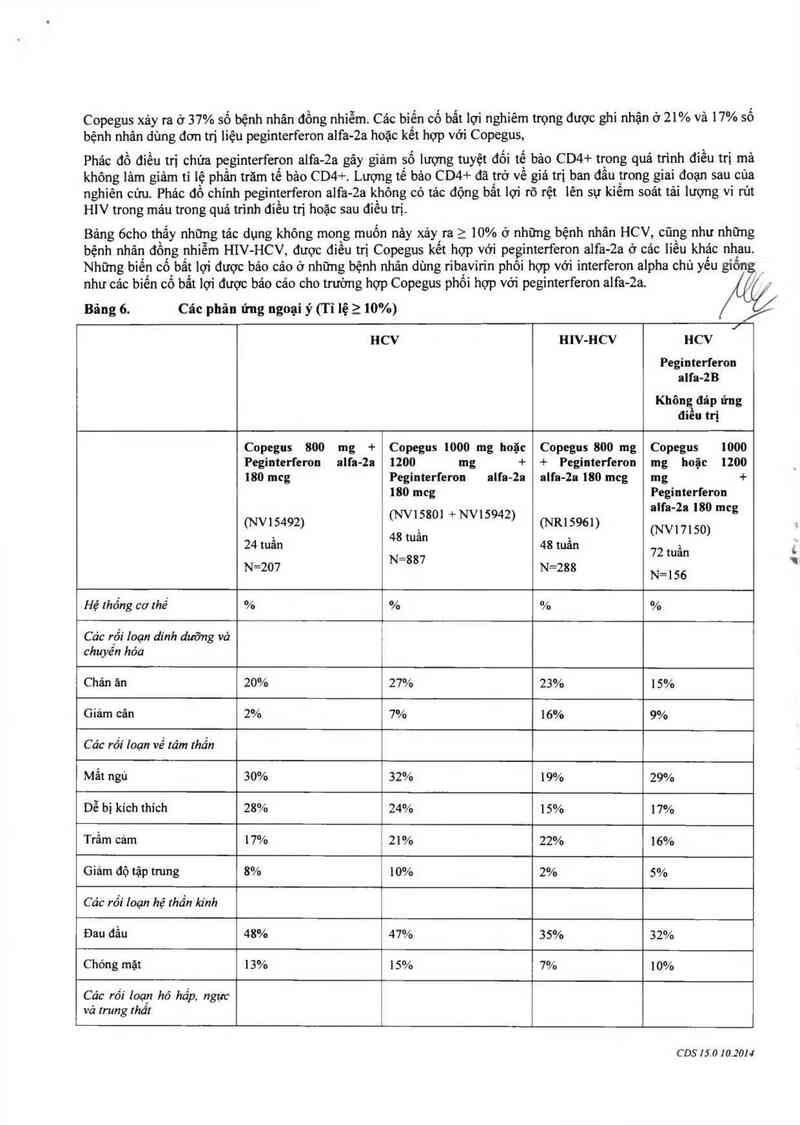
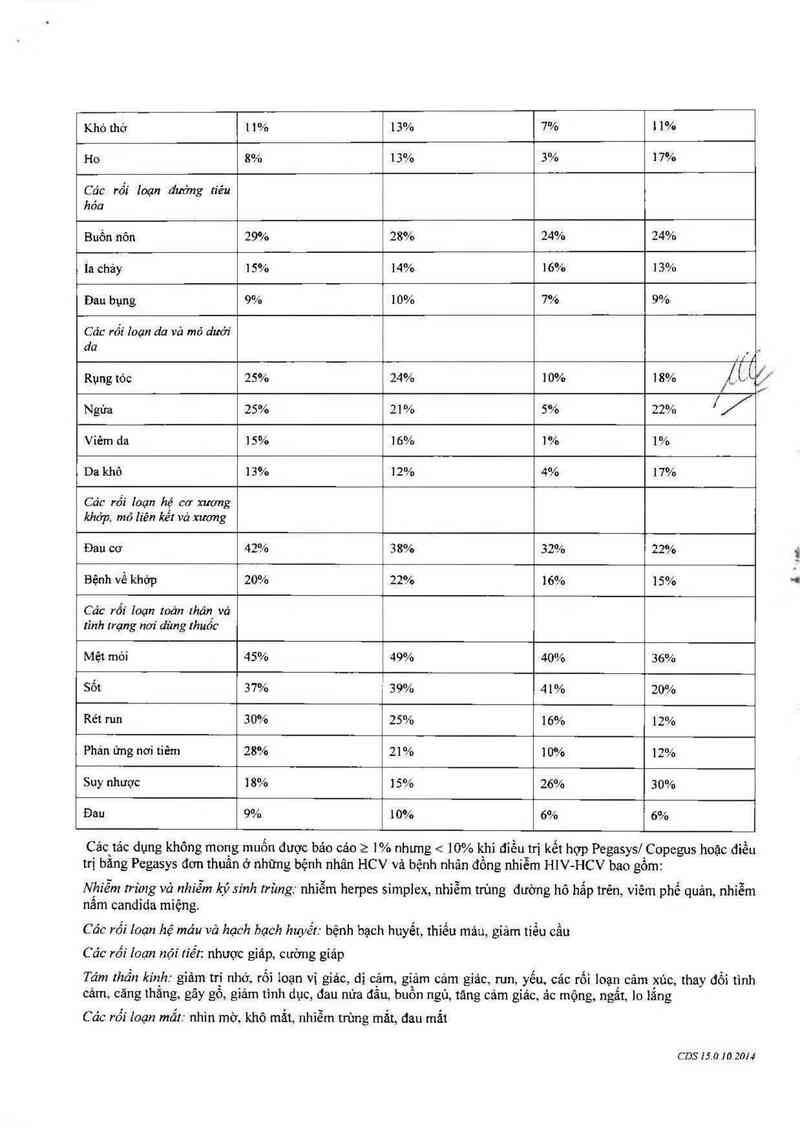
Bảng ócho thẳy nhũng tảc dụng không mong muốn nảy xảy ra > 10% ở những bệnh nhân HCV, cũng như những
bệnh nhân đồng nhiễm HIV-HCV, được điều trị Copegus kết hợp với peginterferon alfa—2a ở cảc liếư khác nhau.
Những biến có bất lợi được báo cảo ở những bệnh nhân dùng ribavirin phội hợp vởi interferon ạlpha chủ yếu giốn ` _
như các bỉến cố bất lợi dược bảo cảo cho trường hợp Copegus phối hợp với peginterferon alfa-2a. '
Các phản ứng ngoại ý (T 1 lệ 2 10%)
Bâng 6.
|
HCV HlV-l-ICV HCV
Peginterl'eron
aIfa-2B
Khôn đáp ửng
đieu trị
1
Copegus 800 mg + Copegus 1000 mg hoặc Copegus 800 mg Copegus 1000
Peginterferon alfa-2a 1200 mg + + Peginterferon mg hoặc 1200
180 mcg Pegintcrferon aIfa-2a alfa-Za 180 mcg mg +
180 mcg Peginterferon
alfa—2a 180 mcg
(NV15492) fNVISSOI + NV15942) (NR15961)
48 t (NVI7I 50)
), tuan ì
24 tuan 48 tuan :
\ N=887 72 tuan
N—207 . N—288 N= ] 56
, . 1
Hệ thông cơ thê % L % % %
Các rối Ioạn dinh duỡng vả
chuyên hóa
Chán án 20% 27% 23% 15%
Giảm cãn 2% 7% 16% 9%
Các rối“ Ioạn về Iảm thẳn
Mắt ngủ 30% 32% 19% 29%
Dễ bị kích thích 28% 24% 15% 17%
Trầm cảm 17% . 21% 22% 16%
Giảm độ tập trung 8% 10% 2% 5%
|
Các rối 10an hệ Ihần kinh
Đau đầu 48% 47% 35% 32%
C hóng mặt 13% 15% 7% 10%
Các rối Ioạp hô hấp. ngực
vả rrung thái
CDS 15.0 10.2014
If…
Khó thờ 1 1% 13% 7% 1 1%
Ho 8% 13% 3% 17%
Các rối loạn đường n'ẻu
hỏa
Buồn nõn 29% 28% 24% 24%
1a chảy 15% 14% 16% 13%
Đau bụng 9% 10% 7% 9%
Các rối loạn da và mỏ dưới
da ` _ .
i/ Í
Rụng tóc 25% 24% 10% 18% /ẬƯ
/
Ngứa 25% 21% 5% 22% f/
Viêm da 15% 16% 1% 1%
Da khô 13% 12% 4% 17%
Các rối Ioạn hệ cơ xương
khóp, mỏ Iiẻn kẻt vả xmg
Đau cơ 42% 3 8% 32% 22%
Bệnh về khớp 20% 22% 16% 15%
Các rối Ioạn roìm thán vả
tình trạng nơi dùng thuóc
Mệt mói 45% 49% 40% 36%
Sốt 37% ' 39% 41% 20%
Rét run 30% 25% 16% 12%
Phản ứng nơi tiêm 28% 21% 10% 12%
Suy nhược 18% 15% 26% 30%
Đau 9% 10% 6% 6%
Các tác dụng không mong muốn được bảo cảo > 1% nhưng < 10% khi điếu trị kết hợp Pegasys/ Copegus hoặc điếu
trị bằng Pegasys đơn thưẳn 0 những bệnh nhân HCV và bệnh nhân đổng nhiễm HIV-HCV bao gôm:
Nhỉễm Irùng vả nhiễm kỷ sính trùng. nhiễm herpes simplex, nhiễm trùng đường hô hắp trên, viêm phế quản, nhiễm
nấm candida mìệng
Các rối Ioạn hệ mảu vả hạch bạch hưyết: bệnh bạch huyết, thiếu mảu, giảm tiếu cầu
Các rối Ioạn nội tiết: nhược giáp, cường giáp
Tám thần kinh: giảm trí nhớ, rối Ioạn vị giảc, dị cảm, giảm cảm giảc, run, yếu cảc rối loạn câm xúc, thay đổi tình
cảm căng thẳng, gây gổ, giảm tình dục, đau nửa đầu, buồn ngủ, tảng cảm giảc, ảc mộng, ngất, lo lẳng
Các rối Zoạn mắt. nhìn mờ, khô mắt, nhiễm trùng mắt, đau mắt
CDS 15.0 10.2014
\\
iL
Các rối Ioạn về tai vả tai trong: chóng mặt, đau tai
Các rối loạn tim mạch: đảnh trống ngực, phù ngoại biên, mạch nhanh
Các rối Ioạn mạch máu: chứng đỏ bừng
Cảc rối Ioạn hô hấp, ngực vả trung thất: đau họng, viêm mũi, viếm mũi họng, xung huyết xoang, khó thở khi gắng
sức, chảy máu cam
Các rối loạn đường tỉêu hỏa: nôn, khó tiếu, đầy hơi, khó miệng, loét miệng, chảy máu lợi, viêm dạ dảy, khó nuốt,
viêm lưỡi
Các rối Ioạn da vả mó dưới da: cảc rối loạn da, sẩn ngứa, eczema, vẩy nến, mề đay, phản ứng nhạy cảm ảnh sảng,
tăng tiêt mồ hôi, ra mô hôi đêm
Các rổi loạn hệ cơ xương khóp. mô liên kết vả xương. đau xương, đau lưng, đau cổ, chuột rút, yếu cơ, đau cơ
xương, viêm khớp v.
Các rối Ioạn hệ sính sán vả vú: bất lực ẮỨỐ
Các rối loạn toãn thân và tình trạng nơi dùng thuốc: ốm giả cúm khó chịu ngủ 11… nỏng bừng, đau ngực khảt/
Các biến cố bất lợi khác được bảo cảo với tỷ lệ > 1% dến s 2% ở những bệnh nhân nhiễm HIV- HCV đang điếu trị
kết hợp Pegasysl Copegus bao gồm: tăng acid lactic mául nhỉễm acid lactic, cúm, viêm phổi, tính tình không ôn
định, lãnh đạm, ù tai, đau hẳn họng, viêm môi, loạn dưỡng mỡ và sắc tố niệu.
Tương tự cảc chế độ điều trị vói interferon alpha khảc, cảc biển cố bất lợi nghiêm trọng với tần suất từ không
thường gặp đến hiếm sau đây được bảo cáo ở những bệnh nhân dùng phối hợp Pegasys/Copegus hoặc dùng Pegasys
đơn thuân trong cảc thử nghiệm lâm sảng: nhiễm trùng dường hô hâp dưới, nhiễm trùng da, viêm tai ngoải, vỉêm
nội tâm mạc, tự tử, quá liều, rối loạn chức năng gan, gan nhiễm mỡ, viêm đường mặt, khối u gan ảc tính, loét dạ
dầy, xuất huyết tiệu hóa, vỉêm tuy, rối loạn nhịp tim, rung nhĩ, viêm mảng ngoải tim, bệnh tự miễn (ví dụ: ITP, viêm
tuyến giáp, vây nến, viêm khớp dạng thấp, SLE), viêm cơ, bệnh thần kinh ngoại biến, bệnh sarcoit, viêm phổi kê có
thể gây tử vong, tắc mạch phổi, loét giác mạc, hôn mê và chảy máu não, 'ITP, rôỉ Ioạn tâm thần, và ảo giác.
Rất hiếm gặp, alpha interferon bao gổm Pegasys, dùng đon thuần hoặc kết hợp với ribavirin, có thế đi kèm với giảm
toản thể huyết câu bao gổm thiếu mảu bất sản.
Các chí số xét nghiệm. Trong cảc thử nghiệm lâm sảng Copegus phối hợp với peginterferon alfa—Za hoặc interferon
alfa-2a, phần lớn các trường hợp có chi sô xét nghiệm bất thường được kiếm soát bằng việc hiệu chỉnh liều (xem
phần 2 2.1, Các hướng dẫn liếu dùng đặc biệt).
Tan máu là độc tính hạn chế của Iiệu pháp điếu trị ribavirin. Đã ghi nhận được lượng hemoglobin giảm xuống mức
<10 gldl ở 15% bệnh nhân được điều trị trong 48 tuần với Copegus 1000/1200 mg phối hợp với peginterferon alfa-
2a vả 1ẽn tớỉl9% bệnh nhân phối hợp với interferon alfa-2a. Khi dùng Copegus 800 mg phối hợp với peginterferon
alfa-2a trong 24 tuần, 3% số bệnh nhân có mức hemoglobin giảm xuông mức < 10 g/dl. Bệnh nhân không cần
ngừng điểu trị nếu chỉ giảm lượng hemoglobin đơn thuần. Trong đa sô trường hợp, giảm hemoglobin xảy ra sớm
trong quả trinh điều trị và on định đồng thời với sự tăng bù trừ của số lượng hổng cầu lưới.
Các gịá tri xét nghiêm ở những bẻnh nhăn đồng nhiễm HIV-HCV
Mặc dù độc tính huyết học như giảm bạch cầu trung tính, giảm tiểu cầu và thiếu máu xảy ra thường xuyên hơn ở
những bệnh nhân nhiếm HIV- HCV, phẩn lớn được kiếm soát được bằng sự thay đối liều vả dùng cảc yếu tố tang
trưởng, hiểm khi phải ngừng điểu trị sớm. Giảm số lượng tuyệt đối bạch cầu (ANC) dưới 500 tê bảolmm được ghi
nhận ở 13% vả 1 1% sô bệnh nhân tương ứng đang điếu trị pegínterferon alfa— 2a đơn thuần vả được điều trị kết hợp.
Thiếu mảu (hemoglobin < 10 gldl) được ghi nhận tương ứng ở 7% và 14% số bệnh nhân diếu trị với peginterferon
alfa-Za đơn thuần hoặc điếu trị kết hợp.
2.6.1.1 Xét nghiệm bẩt thường
Bệnh nhi: giảm hemoglobin, bạch cẳu trung tính và tiếu cầu có thể đòi hỏi phải giảm liều hoặc ngừng điếu trị vĩnh
viễn. Hầu hết các xét nghiệm bất thường được ghi nhận trong cảc thử nghiệm lâm sảng trở lại mức ban đầu ngay
sau khi dừng điếu trị
2.6.2. Báo các lưu hânh thuốc
CDSI5.0 10.2014
Trong giai đoạn sau khi đưa thuốc ra thị trường, hổng ban đa dạng, hội chứng Steven Johnson, hoại từ biểu bì nhiễm
độc, bất sản nguyên hồng cầu (PRCA) và ý định giết người đã được ghi nhận rất hiếm gặp khi điếu trị kềt hợp
Pegasys vả ribavirin.
Mất nước đã được ghi nhận hiếm gặp khi điếu trị kết hợp Copegus vả alpha interferons.
Tương tự các interferons alpha khác, bong thanh dịch võng mạc đã được ghi nhận khi điếu trị phối hợp chasys vả
Copegus.
Tương tự cảc interferons alpha khảo, thải trừ sau ghép tạng gan và thận đã được ghi nhận khi dùng Pegasys, đơn
độc hoặc kêt hợp với Copegus.
2. 7 Quá liếư
Không có trường hợp quá liều Copegus được ghi nhận trong cảc nghiên cứu lâm sảng. Giảm ca1cỉ máu và giảm
magiế mảu được ghi nhận ở những người dùng liếư lớn hơn bốn lần liều tối đa được khuyến cáo. Trong cảc trường
hợp nảy, ribavirin được dùng bằng đường tĩnh mạch. Ribavirin không được loại bỏ một cảch hữu hiệu bằng thẳm
phân mảu.
3. HIỆU QUẢ VÀ CÁC ĐẶC TÍNH DƯỢC LÝ
3.1 Các đặc tính dược lực học
3.1.1 Cơ chế tác động
Ribavirin là một chất đồng dạng nucleoside tống hợp cho thẩy có hoạt tính trên in- v-itro chống lại một vải RNA vả
DNA của vi rủt. Cơ chế mã ribavirin phối hợp với alpha interferon hoặc peginterferon alfa-Za có tảc dụng chống lại
HCV chưa được biết.
Dạng uống cùa ribavirin trong đơn trị lỉệu đã dược nghiên cửu như là liệu phảp cho điểu trị viêm gan C mạn tính
trong một vải thừ nghiệm lâm sảng. Kết quả của nhũng thử nghiệm nảy cho thẩy ribavirin đơn trị liệu không có tảc
động loại trừ vi rủt viêm gan (HCV RNA) hoặc cải thỉện mô gan sau liệu pháp điều trị 6 đến 12 tháng và 6 thảng
sau đó.
3. 1.2 Các nghiên cứu lâm sảng/Hiệu quả
Copegus phối hợp với peginterferon alfa-2a
Viêm gan C man tính
Kểt quả nghiên cứu
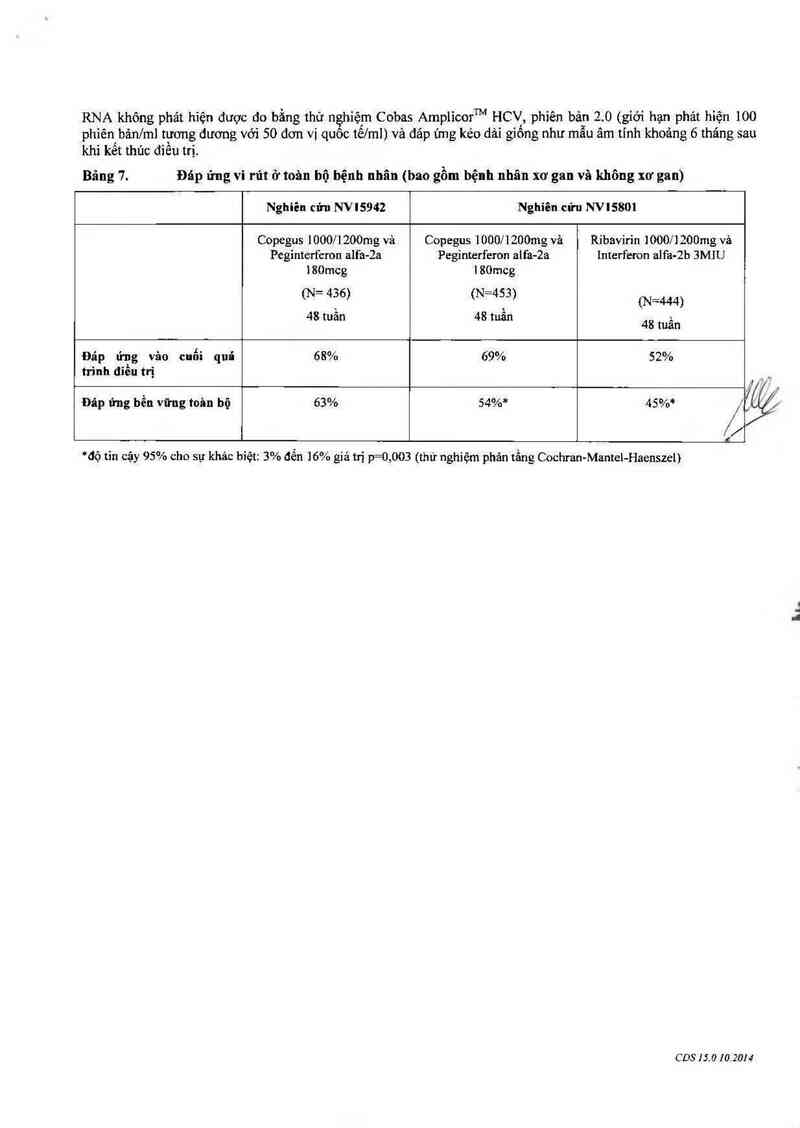
Tính hỉệu quả vả độ an toản của việc kết hợp Copegus vả peginterferon alfa-2a được xảc lập trong hai nghiên cứu
then chốt (NV15801+ NV15942), bao gốm 2405 bệnh nhãn. Những bệnh nhân trong nghiên cứu bao gôm những
bệnh nhân bị viếm gan C mạn (CHC) chưa được điếu trị bằng interferon bao giờ được xảc định bằng lượng HCV
RNA trong huyết thanh, nổng độ ALT tăng, và sinh thiết gan phù hợp với tinh trạng viếm gan C mạn tính.
Nghiên cứu NV15801 (1121 bệnh nhân được điều trị) so sánh hiệu quả của 48 tuần điếu trị với peginterferon alfa-
2a (180 mcg tuần một lần) và Copegus (1000l1200 mg dùng hảng ngảy) với hoặc đơn trị liệu peginterferon alfa—2a
hoặc điều trị kểt hợp interferon alfa- 2b vả ribavirin. Sự kểt hợp peginterferon alfa-2a vả Copegus có hiệu quả hơn
nhiều so với sự kết hợp với interferon aifa-2b vả ribavirin hoặc điều trị bằng peginterferon alfa-2a đơn thuần (xem
Bảng 7).
Nghiên cửu NV 15942 (1284 bệnh nhân được đíếu trị) so sánh hiệu quả cũa hai liệu trình điều trị (24 tuần với 48
tuần) vả hai dạng Iiều cùa Copegus (800 mg với 100011200 mg).
Những bệnh nhân bị nhiễm kiểu gen ], đảp ứng vi rút bền vững sau 48 tuần đìều trị cao hơn sau 24 tuần điều trị
(p=O, 001) và với Iiều Copegus cao hơn (p=O, 005). Tuy nhiên, với nhủng bệnh nhân nhiểm kiến gen 2/3 không có
khảc biệt rõ rệt có ý nghĩa thống kê giữa 48 tuần vả 24 tuần điếu trị vả giữa liều cao vả thắp cùa Copegus (xem
Bảng 8). Những kiêu đảp ứng nảy không bị ảnh hướng bới lượng vi rút hoặc sự có mặt hoặc không có xơ gan, vì
vậy sự điều trị không phụ thuộc vảo những đặc điếm ban đẩu nảy. Đảp ứng vi rủt được xảc định bằng lượng HCV
CDS 15.0 I0.20l4
is.
RNA không phảt hiện được do bằng thử nghiệm Cobas Amplìcorm HCV, phiên bản 2.0 (giới hạn phảt hiện 100
phiếnbản/m] tương đương với 50 đơn vị quôc tê/rnl) và đáp ứng kéo dải giông như mẫu âm tỉnh khoảng 6 tháng sau
khi kêt thủc điêu trị.
Bảng 7. Đáp ứng vi rút ở toản bộ bệnh nhân (bao gồm bệnh nhân xơ gan và không xơ gan)
Nghiên cửu NV15942 Nghiên cứu NV15801
Copegus 1000f1200mg vả Copegus 1000/1200mg vả Ribavirin iooonzootng vả
Peginterferon alfa-2a Peginterferon alfa-2a Interferon alfa-2b 3MIU
180mcg 180mcg
(N= 436) (N=453) (N=444)
48 tuân 48 tuân ~.
48 tuan
Đáp ứng vân cuối quá 68% 69% 52%
trình đỉều trị
#
Đâp ứng bền vững toân bộ 63% 54%* 45%* ,/ -
//
(
*độ tin cậy 95% cho sự khảo biệt: 3% đến 16% giá trị p=0,003 (thử nghiệm phân tằng Cochran-Mantel-Haenszel)
CDS 15.010.201'4
In-
\Ỉề
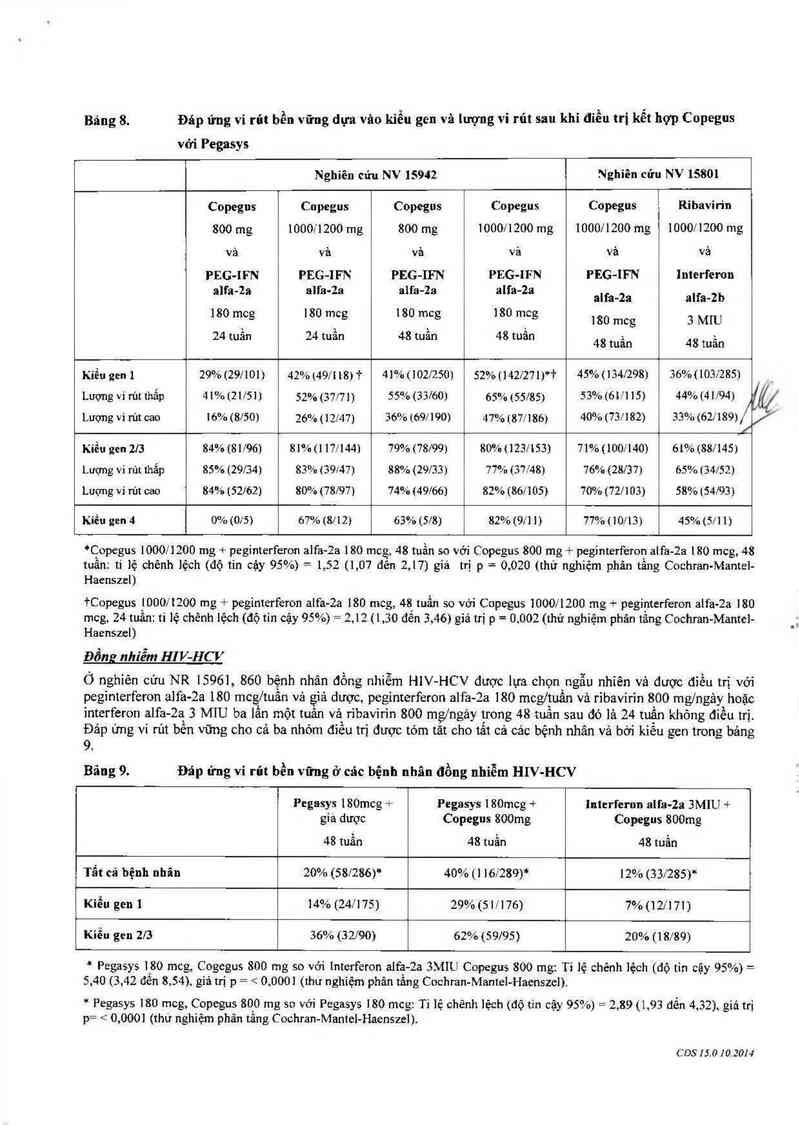
Bảng 8. Đáp ứng vi rút bền vững dựa vâo kiểu gen và lượng vi rút sau khi điều trị kết hợp Copegus
vởi Pegasys
Nghỉên cứu NV 15942 Nghiên cứu NV 15801
Copegus Cnpcgus Copegus Copegus Copegus Ribavirin
800 mg 1000/1200 mg 800 mg 1000/1200 mg 100011200 mg 1000l1200 mg
vả và vả vả vả vả
PEG-IFN PEG-IFN PEG-IFN PEG—IFN PEG-IFN Interferon
alfa-2a alfa~Za alfa-Za alfa-Za alfa-2a alfa-2b
180 mcg 180 mcg 180 mcg 180 mcg 180 mcg 3 MIU
24 tuân 24 tuan 48 tuan 48 tuan 48 tuẩn 48 tuần
Kiểu gen ] 29% (291101) 42%(491'118)7 41% (1021250) 52% (142071)*1' 45%11344298) 36%110342851
Lượng vi rứt thẳp 41% (2 1151) 52% (37/71) 55% {33/60) 65% (55l85) 53% (61H 15) 44% (41/94)
Lượng vi rủt cao 16%(8150) 26% (12747) 36% ((197100) 47% (871186) 40% (73/182) 33% (621189) /
Kiểu gen 2|3 84% (81/96) 81% (1 171144) 79% (78199) 80% (1231153) 71% (100/140) 61% (881145)
Lượng vỉ rủt thắp 85% (29/34) 83% (39147) 88% (29ỉ33) 77% (371'48) 76% (28137) 65% ( 34/52)
Lượng ví rủt cao 84% (52162) 80% {78/97) 74% (49166) 82% (86/105) 70% (72/103) 58% (54/93)
Kiếu gen 4 0% (015) ớ7% (8712) 63% (518) 82% (971 1) 77% (10113) 45% (571 1)
*Copegưs 100011200 mg peginterferon alfa-Zạ 180 mcg, 48 tuần so với Copegus 800 mg + peginterferon alfa 28 180 mcg, 48
tuẩn: tỉ lệ chẽnh lệch (độ tin cậy 95%) — 1, 52 (1,07 đên 2 ,17) giá trị p = 0,020 (thử nghiệm phân tầng Cochran›Mantel-
Haenszel)
+Copegus 1000J1200 mg + peginterferon alfa-2a 180 mcg, 48 tuần so với Copegus 1000/1200 mg + peginterferon alfa-2a 180
mcg, 24 tuần: tỉ lệ chênh lệch (độ tin cậy 95%)= 2,12 (1,30 đến 3 ,46) giá trị p= 0,002 (thử nghiệm phân tầng Cochran- Mantel-
Haenszcl)
Đồng nhiễm HIV-HCV
Ó nghiên cứu NR 1596], 860 bệnh nhân đồng nhiễm H1V- HCV được lựa chỌn ngẫu nhiên vả được điều trị vởi
peginterferon alfa-2a 180 mcgjtuấn vả giả dược, peginterferon alfa-2a 180 mcg/tuần vả ribavirin 800 mg/ngảy hoặc
interferon ạlfa-2a 3 MIU ba lấn một tuân vả ribavirin 800 mg/ngảy trong 48 tuần sau đó là 24 tuần không điếu trị
Đảp ứng vỉ rủt bền vững cho cả ba nhóm điếu trị được tóm tăt cho tất cả các bệnh nhân vả bới kiếu gen trong bảng
9.
Bãng 9. Đáp ửng vi rủt bền vững ở cãc bệnh nhân đồng nhiễm HIV-HCV
chasys 180mcg + chasys 180mcg + lntcrferon alfa-2a 3MIU +
gia dược Copegus 800mg Copegus 800mg
48 tnần 48 tuần 48 tuần
Tẩt cả bệnh nhân 20% (581286)* 40%(1 161289)* 12% (331285)*
Kiến gen ] 14% (24/175) 29% (511176) 7%(121'171)
Kiến gen 273 36% (32/90) 62% (59195) 20% (18/89)
* Pegasys 180 mcg, Cogegus 800 mg so với Interferon alfa-2a 3MIU Copegus 800 mg: Tỉ lệ chênh lệch (độ tìn cậy 95%)— =
5,40 (3, 42 đến 8 ,,54) giá trị p= / 0, 000] (thư nghiệm phân tằng Cochran- Mantel- Haenszei)
* Pegasys ]80 mcg, Copegus 800 mg so với Pegasys 180 mcg: Tỉ lệ chẽnh lệch (độ tin cặy 95%) = 2,89 (1,93 đến 4,32), giá trị
p= < 0,000] (thử nghiệm phân tâng C ochran-Mantel-Haenszel).
CDS 15.0 10.2014
Ribavirin kết hợp vởi interferon alfa—2a
Hiệu quả điều trị của interferon aIfa-2a đơn thuần và kết hợp với ribavirin dạng uống được so sảnh trong cảc thử
nghiệm lâm sảng ở những bệnh nhân chưa được điếu trị bao giờ (chưa được điều trị trước đây) vả những bệnh nhân
bị tải phát được ghi nhận về mặt mô học, sỉnh hỏa, vi rút học lả viêm gan C mạn tính. Sản thảng sau khi kết thủc
điều trị đảp ứng vi rủt vả sinh hóa cũng như mô học được đảnh gìả lá có cải thiện.
Đáp ứng sinh hóa và vi rủt kéo dải tăng gấp 10 lần một cách có ý nghĩa thống kê (từ 4% đển 43%; p < 0 ,01) được
quan sảt thẩy ở những bệnh nhân bị tải phát (M23136; N= —99). Cảc tải liệu tán thảnh liệu phảp đỉếu trị kết hợp củng
phản ánh tỷ lệ đảp ứng có liên quan đển kiếu gen HCV hoặc lượng vi rủt ban đầu. Trong nhóm điếu trị kểt hợp và
đơn trị liệu interferon, tỷ lệ đảp' ưng bền vững tương ứng ở những bệnh nhân HCV có kiêu gen ] là 28% so với 0%
và với kiểu gen khảc ] là 58% so với 8%. Ngoài ra, sự cải thiện vẻ mặt mô học ủng hộ lỉệu phảp dỉểu tri kết hợp.
Cảc kết quả có ích hỗ trợ (đơn trị liệu so với kết hợp; 6% so với 48%, p < 0,04) từ một nghiên cửu nhỏ đã được xuất
bản gổm những bệnh nhân chưa được điều trị (N=40) ghi nhận dùng interferon aifa—2a (3 M1U 3 lấn mổi tuấn) vởi
ribavirin.
3.2 Cảc đặc tính dược động học / "
3.2.1 Hấp 11…
Ribavirin được hấp thu nhanh chóng sau khi uống Copegus liếư đơn (thời gian trung bình đề đạt nổng độ tối đa
trong máu 1ả 1-2 gỉờ). Thời gian bán hùy giai đoạn cuôi trung bình cùa rỉbavirin sau khi dùng Copegus liều đơn
trong khoảng từ 140 đến 160 gìờ. Số lỉệu cùa ribavirin trong các tải lìệu chứng minh sự hấp thu có phạm vi rộng với
khoảng 10% Iiều được đảnh dẩu phóng xạ đượcĂtiết theo phân. Tuy nhiên, đó khả dụng sinh học tuyệt đôi khoảng
45-65%, có thế do chuyên hóa bước đâu. Có môi quan hệ tương đương giữa liêu và AUth sau khi dùng ribavirin
]iếu đơn 200-1200 mg. Độ thanh thải trung bình cùa ribavirin thấy rõ sau khi uống Copegus liều đơn 600 Img trong
khoảng từ 22 đến 29 lit1giờ. Thể tích phân bố khoảng 4500 lít sau khi dùng Copegus. Ribavirin không gắn kết với
protein huyết tương
Tác động của thửc ăn
Độ khả dụng sinh học cùa Copegus liều đơn 600 mg tãng khi dùng trong bữa ăn có nhiều chắt béo. Cảc thông số về
nổng độ cùa ribavirin lả AUC… mm và Cmax tăng khoảng 42% vả 66%, theo thứ tự, khi Copegus được dùng cùng với
bữa ăn sáng nhiều chất béo so với dùng cùng với bữa ăn chay Sự liên quan về lâm sảng giữa kết quả và nghiên cứu
liều đơn nảy chưa được biết. Nổng độ của ribavirin sau khi dùng đa 1iếu cùng với thức ăn được so sảnh ở những
bệnh nhân dùng peginterferon alfa-2a vả Copegus vả interferon alfa-2b vả ribavin'n Để đạt nông độ ribavirin huyết
tương tối đa, nên dùng ribavirin cùng với thức ăn.
3. 2. 2 Phân bố
Ribavirin cho thấy nó có dược động học thay đổi ngay trong một cá thế và giữa các cá thể sau khi dùng Copegus
liều đơn (sự thay đối trong một cá thế 5 25% cho cả AUC và C,…), đỉều nảy có thế do sự chuyến hỏa bước đầu ở
phạm vi rộng vả di chuyến trong và ngoâí khoang mảu.
Sự vận chuyển ribavirin trong cảc khoang không phải huyết tương được nghiên cứu một cách rộng rãi trong các tế
bảo hồng câu, và được xác định là chủ yêu qua các chất vận chuyển nucleoside có tính cân bằng loại e,. Loại chất
vận chuyền nảy có mặt hầu như ở tất cả cảc loại tế bảo vả có thể chiếm thể tích phân bố lớn cùa ribavirin. Tỉ lệ cùa
máu toản bộ: nồng độ ribavirin huyết tương là khoảng 60: ]; Lượng thừa cùa ribavirin trong mảu toản bộ tổn tại
dưới dạng nucleotide rìbavirin ản trong cảc hồng câu.
3 2.3 Chuyển hoá
Ribavirin có hai con đường chuyển hóa: 1) con đường phosphoryl hỏa có thể đảo ngược, 2) con đường thoái hóa
bao gổm deribosyl hóa vả sự thùy phân amit để sinh ra chất chuyến hóa triazole carboxyacid. Ribavirin và hai chất
chuyên hóa cùa nó lả triazole carboxamide vả triazole carboxylic acid đến được đảo thải bởi thận.
Sau khi dùng đa liều, rỉbavirin tích lũy nhỉều trong huyết tương với AUC… g,, sau khi dùng đa liều gấp 6 lần
AUCnsm sau khi dùng Iiều đơn dựa vảo cảc tải Iiệu nghiên cứu. Sau khi uông liều 600 mg hai lần một ngảy, nồng
độ ôn đinh đạt được sau khoảng 4 tuần, với nồng độ huyết tương trung bình ở trạng thái on định vảo khoảng 2200
nng
CDS 15.0 10.20/4
3.2.4 Đâu thâi
Sau khi ngừng dùng thuốc, thời gian bán thải vảo khoảng 300 giở, điều nảy có thể phản ảnh sự đảo thải chậm từ cảc
khoang không phải huyêt tương.
5.2.5 Dược động học ở những đối tượng đặc bỉệt
Bệnh nhân bị suy lhận:
Dược động học của ribavirin sau khi dùng liều đơn bị thay đối (tăng AUC,f và C…) ở những bệnh nhân rối loạn
chức năng thận so với những bệnh nhân nhóm chứng có độ thanh thải cao hon 90 ml/phút. Độ thanh thải cùa
ribavirin sau khi uống giảm nhiếu ở những bệnh nhân có hảm lượng creatinine huyêt thanh › 2 mng hoặc độ thanh
thải creatỉnin < 50 mlfphủt. Khõng đủ sô liệu về độ an toản vả tính hỉệu quả của ribavirin ở những bệnh nhân nảy vả
vì. thể, phải rất thận trọng khi dùng Copegus và có hảnh động thích hợp bao gồm ngừng thuốc phải được cân nhắc
nền xuât hỉện cảc phản ứng ngoại ý (xem phần 2.2.1) Nồng độ huyết tương của ribavirin về cơ bản không thay đổi
bới sự lọc mảu.
Bệnh nhân bị rối loạn chức nãng gan:
Dược động học cùa ribavirin liều đơn ở những bệnh nhân bị rối loạn chức năng gan nhẹ, trung bình vả nặn lả
tương tự dược động học của những người bình thường. 1 1
Người giả (2 65 tuốij- Ả/g/
Cảo đánh gỉả dược động học chuyên biệt cho những người lớn tuồi chưa được tiến hảnh. Tuy nhiên, trong nghiên
cứu được xuất bản vẽ dược động học dân sổ, tuối không phải là yếu tố quan trọng trong động học cùa ribavirin;
chức năng thận iả yếu tố quyẽt định.
Bệnh nhân dưới 18 tuối:
Các nghiên cứu dược động học chuyên bỉệt chưa đảnh giá đầy đủ ở nhưng bệnh nhân dưới 18 tuổi. Copegus phối
hợp với peginterferon alfa- 211 hoặc interferon alfa-2a được chỉ định điều trị cho viêm gan C mạn tính ở những bệnh
nhân từ 18 tuổi trở lên.
C hủng tộc:
Một nghiên cứu dược động học ở 42 người cho thẳy không có sự khác biệt có ý nghĩa iâm sảng về dược động học
cùa ribavirin giữa những chủng tộc người da đen (n=14), chủng tộc ngưòi Tây Ban Nha và Bộ Đảo Nha (n=l3) vả
chùng tộc người da trăng (n=15).
3.3 Độ an toân tiến lâm sâng
3. 3. 1 Tính gây ung thư
Trong một nghiên cứu về Itính gãy ung thu ở chuột nhắt 53 (+1-) vả một nghiến cứu về tính gây ung thư 2 năm ở
chuột tại liếư lẽn tới liều tổi đa được dung nạp lả 100 mg/kg/ngảy và 60 mg/kgfngảy, theo thứ tự, ribavirin khõng là
chất gây ung thư. Dựa vảo điện tích bề mặt cơ thế, những liều nảy khoảng bằng 0,5 và 0,6 lần liều ribavirin tối đa
24 giờ ở người được khuyến cáo.
3.3.2 Sự suy giảm khả nãng sinh sân
Trong những nghiến cứu nhắc lại liều ở chuột để chứng minh tảc động lên tinh dịch vả tinh hoản gây ra bới
ribavirin, những bất thường cùa tinh dịch xảy ra ở động vật với lỉều thấp hơn liếư điều trị Sau khi ngừng đỉều trị, về
cơ bản toản bộ sự nhiễm độc lên tinh hoản do ribavirin hồi phục trong một hoặc hai chu kỳ sinh tinh
3. 3. 3 Cảc tảc động khảc
Hlống cầu lả đích đầu tiên của sự nhiễm độc rìbavỉrìn trong các nghỉên cứu động vật. Thìếu máu xảy ra ngay sau khi
bắt đầu dùng thuốc, nhưng nhanh chóng hồi phục sau khi ngừng điều trị.
Cảc nghỉên cứu nhìễm độc gen đã chứng minh rằng ribavirin có một vải hoạt tính nhiễm độc gen. Ribavirin có hoạt
tinh ở in- -vitro trong thử nghiệm biến đồi. Hoạt tính nhiễm độc gen được quan sát ở in-vỉvo thử nghiệm nhân nhỏ
chuột. Nghiệm pháp gây chết phôi ở chuột lả âm tính, chi ra răng nêu đột biến gen xảy ra ở chuột chúng không
truyền qua giao tử đực. Có thế không loại trừ khả năng nguy cơ gây ung thư cho người
CDS 15.0 10.2014
Dùng ribavirin kết hợp với peginterferon aifa—2a không phát sinh bất cứ độc tính không được trông chờ nảo ở khi.
Thay đối chủ yểu có liên quan đến điểu trị có thể quay ngược lại từ thiểu máu nhẹ đến thiếu mảu vừa, mức độ trầm
trỌng cùa thay đổi nảy lớn hơn mức độ gây bởi từng chẳt một.
4. CÁC ĐẶC TÍNH DƯỢC HỌC
4.1 Danh sách tả dược
T á dược vie'n nén:
Lôi viên thuốc:
Pregelatinised starch, sodium starch giycolate, microcrystallỉne cellulose. maize starch, magnesium stearate
Bao phim:
Hypromellose, talc, titanium dioxide (El7l), yellow iron oxide (E172), red iron oxide (E172), ethylceiluiose
aqueous dispersíon, triacetỉn
4.2 Độ tin định
Hạn dùng: 4 nãm
Không nên sử dụng thuốc sau ngảy hết hạn (EXP) được ghi trên vỏ hộp thuốc.
Xem vỏ hộp thuốc để biết lưu ý về bảo quản.
4.3. Bâo quản
Copegus được đựng trong lọ nhưa polyethylene tỷ trọng cao (HDPE) với nắp xoáy polypropylene ngăn cản trẻ em
tháo mở.
Không bảo quản thuốc ở trên 30°C.
4.4 Hướng dẫn đặc biệt về sử dụng, thao tác và thải bỏ
Xử lý cảc thuốc không sử dụng hoặc hết hạn.
Nên hạn chế tối đa việc thải thuốc ra môi trường Thuốc không nên được thải bỏ qua đường nước thải và chất thải ở
các hộ gia đinh. Sử dụng “hệ thống thug om" nêu có tại địa phương
5. ĐỎNG GÓI
Viến nén bao phim 200 mg. Lọ 42 viến. Hộp 1 lọ. )
Thuốc: Để xa tầm tay cũa trẻ em
Đọc kỹ hưởng dẫn sử dụng trước khi dùng. Nếu cần biết thêm thông tin xin hỏi ý kiểu bác sĩ của bạn.
Dùng thuốc theo sự kê đơn của bác sĩ.
Lưu hảnh tháng 10 năm 2014
Tiêu chuẩn: Nhã sản xuất
Sản xuất cho F . Hoffinann-La Roche Ltd., Basel, Thụy sỹ
bởi PATHEON INC.
2100 Syntex Court
Mississauga, Ontario. Canada LSN 7K9
TUQ. cuc muỏno
PTRLỦNG PHÒNG
Jiỳuỵen Mc, Jfíìnỵ
Đóng gói bởi F.Hotĩmann—La Roche Ltd.
Wurmỉsweg, CH-4303 Kaiseraugst, Thụy sỹ.
CDS 15.0 l0.2014
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng