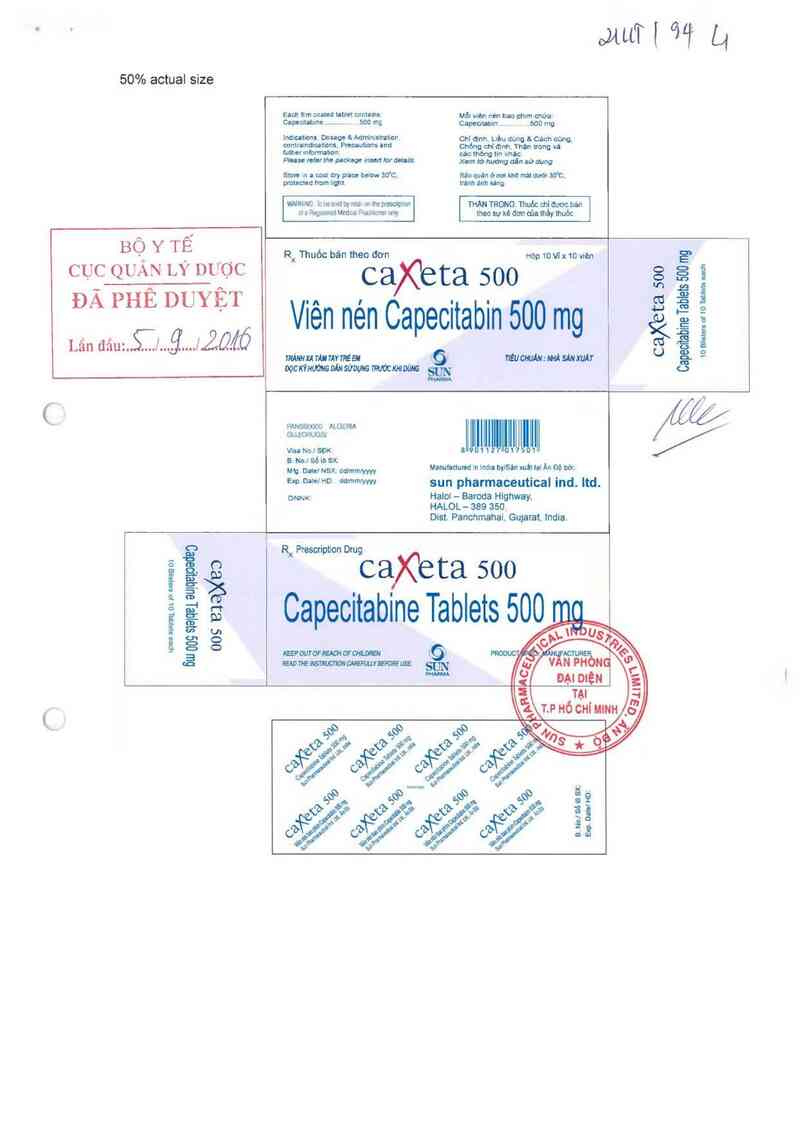





50% actual size
J…TI qu 14
BỘ Y TẾ
CỤC QUẢN LÝ DUỌ'C
ĐÃ PHÊ DUYỆT
Lân đauS—lglắfỔ/ỈÓ
M& Mn nen bao phim d'u'ra'
Each fnlm contcd mom cnnulns
…500 capeomm ................ son mg
Clpaiabllìu… mg
lneocahom. Douoe & Mmlmstnuon.
mnfru'ndiclủnũ. meuủns lnd
MMr mbmulon:
Chỉ dnh Laèu dùng & Cách dùng.
cnóng chỉ dlnn. Thìn tmng vá
cò: them lln khóc
Phno nhnho pcdrlm … lordctllls xgm m nMg dln sử cung
Suan m : … dry plnm … :o'c. Bto quăn ửnui mo núm… ao'c.
pmncưd from llơu. mm tnh slnn`
WARNWG Ju be sơd w ren cn ìhe nramlptm
m a Regmeed Medca4 Fưaơnheneơ my
THẬN TRONG: Thuóc mi a… bểm
mon sự kê đơn cùa tth muòc
Ru Thuốc bán meo dơn
ca)Ceta soo
Viên nén Capecitabin 500 mg
Hộp 10le10vièn
wma…mvnưa: 6 m….— mawa
ĐỌCKỸWDMSỬDWG Mmm fflN
…
10 Blisllrl 01 10 ìblch eich
ca)Ce ta soo
Capecitabine Tablets 500 mg
PANSGOOOO ALGEN
GUJ/DRUGS/
Vlsa No 7 SĐK:
B. No.] 56 lò SX“
…; m… NSX: ud/mmlym
Em. Dalat HD: ddlmnwm
lllJllllllì
Memhamnd 4n mm; byISản Wấl lụi Ản eo hởI;
1
Halol - Badea Hảghway.
HALOL- 389 350.
Díst. Panchmahat. Gujamt. India.
DNNK:
sun pharmaceutical ind. ltd.
\ề
uaưommomtmot
Moosmawmwửo
oos mq)(eo
R: Presưiption Drug
ca)Ceta soo
Capecitabine Tablets 500
IEPMOFHWOFM ĩgl
MHEIEWMALYWM fflN
…
%ẵỆỂ'x, ’ờỆỀ› <ờỆỘ
ớẮ'” o'fựỄ oư/Ị Ấf
ổ’ỘỊ ạởầ
B. N01 sô lũ SX:
em ommơ
ỐỂÍẾ óẳỂj/ỷ óẳỂẵỆ ằo'Ể/ỹ
Rx Thuốc bán theo đơn
CAXETA 500
Viên nén bao phim Capecitabin 500 mg
Thânh phần
Mỗi viên nén bao phim chứa:
Dược chất. Capecitabin USP. ..500 mg.
Tá dược Cellulose vi tinh thể, croscarmellose natri, hypromellose, lactose khan, talc, magnesi stearat, Opadry
II Orange 30F530001.
Dược lực học
chât dùng đường uông cùa 5- fluorouracil (5- FU) gây độc tế bảo
Cơ chế hoạt động:
Capecitabin được kích hoạt bởi một số bước bằng enzym. Enzym tham gia vảo quá trinh chuyền đổi cũ`ỗi
cùng thảnh 5— FU, thymidin phosphorylase (ThyPase), được tìm thấy trong các tế bảo khối 4.4 với nồng độ cao
hơn so với các tế bảo bình thường xung quanh Cả 2 loại tế bảo bình thường và tế bảo khối 44 có chuyển hóa
5- FU thảnh 5- fiuoro-2' —deoxyuridin monophosphat (F dUMP) và 5- fiuorourỉdin triphosphat (FUTP) Cảo chất
chuyền hóa 0nây gây ra tổn thương tế bảo bời hai cơ chế khác nhau. Đầu tiên, FdUMP vả folat cofactor (nhóm
ngoại),N 0-methylenetctrahydrofolat, liên kết với thymidylat synthase (TS) thảnh một phức hợp gồm 3 yêu
tố đồng hóa trị. Liên kết nảy ức chế hình thảnh thymidylat từ 2-' deoxyuridylat. Thymỉdylat lả một tiền chất
cần thiết cùa thymidin triphosphat, một chất cần thiết cho sự tổng hợp DNA, do đó thiếu hụt chất nây có thể
ức chế sự phân chia tế bảo
Thứ 2, các enzym phiên mã nhân có thế kểt hợp nhầm lần với FUTP thay vì vói uridin triphosphat (UTP)
trong quá trình tông hợp RNA. Lỗi chuyến hóa nảy có thể ảnh hưởng tới sự xử lý RNA vả tông hợp protein
DNA vả RN A rât cân thiết cho sự phân bảo và tăng trướng, ảnh hưởng cùa 5- FU có thể gậy ra tình trạng thiếu
hụt thymidin kích thích phát triển mất cân bằng và chết tế bảo. Những ảnh hưởng của thỉếu hụt DNA và RNA
được đảnh dấu trên hấu hết các tế bảo tãng sinh nhanh và chuyền hóa 5-FU ở tốc độ nhanh
Capecitabin là một dẫn xuất fiuoropyrimidine carbamate không gây độc tế bảo có chức năng như một tj4 /
/…
j 0/
Dược động học
Sau khi uông, capecitabin được hấp thu nhanh và mạnh, tiếp theo lá chuyền đổi mạnh thảnh các chất chuyển
hóa, 5'- deoxy-S— -fluorocytidin (5'- DFCR) vả S'-deoxy-S- -fluorouridin (5'- DFUR) Capecitabin đạt nông độ
đỉnh trong mảư sau khoảng 1,5 giờ (T,…) với nông độ đỉnh pic cùa 5- FU xảy ra tối đa một chút sau đó, sau 2
giờ Thức ăn lảm giảm cả mức độ và tốc độ hẩp thu capecìtabin với C,… và AUCo ,, trung bình giảm tương
ứng là 60% và 35% Giá trị C,… và AUC… cùa S-FU cũng giảm bởi thức ăn tương ứng là 43% và 21% Thức
ăn lảm chậm thời gian đạt nồng độ đỉnh (T,…) của cả chất gôc và 5- FU là 1,5 giờ. Nồng độ capecitabin và các
chất chuyền hóa liên kết với protein huyết tương tối đa dưới 60% và không phụ thuộc vảo nồng độ.
Capecitabin iiên kết chủ yếu với albumin người (xấp xỉ 35%)
Capecitabin được chuyển hóa đầu tiên bời carboxylesterase ở gan tạo thảnh 5'-DFCR, chắt nảy sau đó được
chuyển hóa thảnh S'-DFUR bởi cytidin deaminase, lả enzym tập trung chủ yếu ở gan và mô khối u. Enzyme
thymidin phosphorylase (dTthase) sau đó sẽ thủy phân 5'- DFUR tạo thânh 5- FU là chất hoạt động. Enzym
dihydropyrimidin dehydrogenase hydro hóa 5- FU tạo thảnh chất ỉt độc tỉnh hơn nhiều là 5- fiuoro-S, 6-
dỉhydrofluorọuracil (FUHz) Dihydropyrimidinase cắt vòng pyrìmidin thảnh 5- fiuoro- ureido- 2 propionỉc acid
(FUPA). Cuối cùng, |3— ureìdo- -propionase phân cắt FUPA tạo thảnh a-fluoro- [3- alanine (FBAL) được thải trừ
qua nước tiều Thời gỉan bản thải của capecitabin, 5 '-DFCR, 5'-DFUR, S-FU vả FBAL tương ứng là 0, 85,
1,11, 0,66, 0,76 và 3 23 giờ. Capecitabỉn vả cậc chất chuyến hóa được bải tỉết chủ yếu qua nước tiêu; 95,5%
liều dùng capecitabìn tái hấp thu trong nước tiểu. Bải tiết rất ít qua phân (2,6%).
Chất chuyến hóa chính được bảỉ tiết qua nước tiểu lả FBAL chiếm 57% liều dùng. Khoảng 3% liều dùng
được bải tiêt qua nước tiều dưới dạng không chuyền hóa.
Bệnh nhân với suy gan nhẹ đển vùa, cả AUC… vả Cmx cùa capecitabin tăng 60% so với nhưng bệnh nhân
với chức năng gan bình thường. Ành hưởng suy gan nặng tới capecỉtabin không được biết.
Dựa trên một nghiên cứu dược động học ở những bệnh nhân ung thư, phơi nhiễm toản thân cùa capecitabin
cao hơn khoảng 25% ở cả hai trường hợp suy thận vừa và nặng. Bệnh nhân suy thận vừa và nặng cho thấy
«*J—ciUh.
phơi nhiễm toản thân cùa FBAL cao hơn 85% và 258% vảo ngảy thứ 1 so với bệnh nhân với chức năng thận
bình thường. Phơi nhìễm toản thân cùa 5' -DFUR cao hơn tương ứng khoảng 42% và 71% ở bệnh nhân suy
thận vừa và nặng so với bệnh nhân với chức năng thận bình thưòng.
Tuổi tác không ảnh hưởng đáng kể đển dược động học cùa 5'- DFUR vả 5-FU trong độ tuổi từ 27 tới 86 nãm.
Tuổi tăng 20% lảm AUC của FBAL tăng 15%.
Chỉ định
Ung thư vú di căn
Đơn trị lìệu: Capecitabin đơn trị liệu cũng được chỉ đinh điều trị cho bệnh nhân ung thư vú di căn sau khi thất
bại với chế độ hóa trị liệu bao gôm cả paclỉtaxel vả anthracyclin hoặc khảng với paclitaxel và cho những ung
thư khảc mả không có chỉ định dùng anthracyclin (ví dụ, bệnh nhân đã dùng liều tích lũy 400 mg/m2
doxorubicin hoặc tuơng đương).
Đa trị liệu: Capecitabin dùng kểt hợp với docetaxel được chỉ định cho bệnh nhân ung thư Vũ đi căn sau khi
thất bại với chê độ hóa trị líệu bằng anthracycline trước đó.
Ung thư đại trực trảng
Như chỉ định đầu tay cùa bệnh nhân ung thư đại trực trảng di cản khi điểu tri bắng liệu pháp fluoropyrimidin
đơn lẻ được ưu tiên. //W
Liều dùng và cách dùng
Viên nén bao phim capecitabin nên được2 nuốt với nước (không nhai) trong vòng 30 phút sau khi ăn. Liều
khuyến cảo của capecitabin là 1250 mg/m2 dùn đường uông ngảy 2 lần ( buổi sáng và buổi tối; tương đương
với tồng lìềụ 2500 mg/m2 trên ngảỵ) trong 2 tuan và tiếp theo là 1 tuần nghỉ ngơi được coi là chu kỳ 3 tuân.
Khi dùng kết hợp với docetaxel, liều khuyến cáo cùa capecitabin lzả 1250 mg/m2 ngảy 2 iần trong 2 tuần và
tiểp theo lá 1 tuần nghỉ ngơi, kết hợp với docetaxel ở liều 75 mg/m2 dưới dạng truyền tĩnh mạch trong vòng 1
giờ vói chu kỳ 3 tuân. Thuốc dùng trưởc, theo hướng dẫn ghi trên nhãn cùa docetaxel, nên bắt đầu trước khi
dùng docetaxel cho bệnh nhân dùng kết hợp capecitabin với docetaxel.
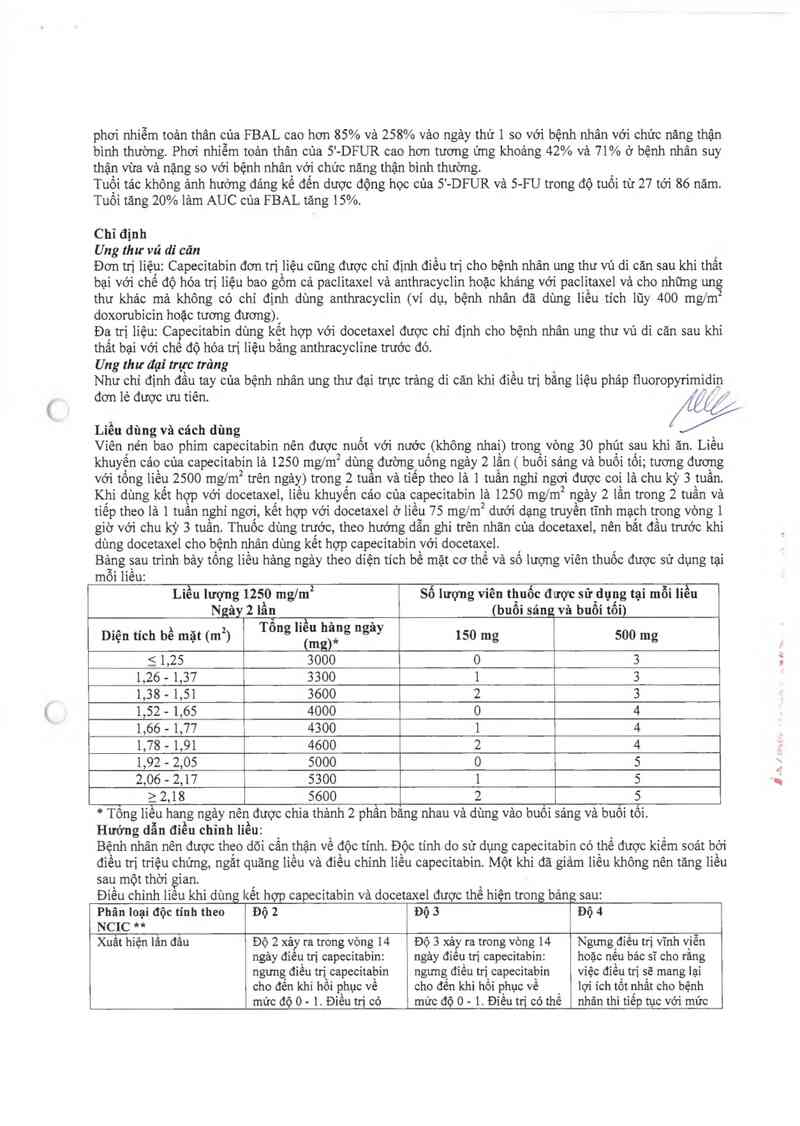
Bảng sau trình bảy tổng liều hảng ngảy theo diện tích bề mặt cơ thế và số lượng viên thuốc được sử dụng tại
môi liều:
Liều lượng 4250 mglm² sô lượng viên thuốc được sử dụng tại mỗi iiều
Ngây 2 lần Ă ( buổi sáu và buổi tối)
Diện tích bề mặt (m²) Tong "Ềằẳĩfg “gay 450 mg 500 mg
5 4,25 3000 0 3
1,26 - 4,37 3300 4 3
4,38 - 4,54 3600 2 3
4,52 - 1,65 4000 0 4
4,66 - 4,77 4300 1 4
1,78 - 4,94 4600 2 4
4,92 - 2,05 5000 0 5
2,06 - 2,47 5300 1 5
a 2,18 5600 2 5
*Ễng liễu hang ngảy nên được chia thảnh 2 phần băng nhau và dùng vảo buối sảng vả bẵồi tôi.
Hướng dẫn điều chinh liều:
Bệnh nhân nên được theo dõi cẩn thận về độc tính. Độc tính do sử dụng capecitabin có thể được kiểm soát bới
đỉều tri triệu chứng, ngắt quãng liều vả điều chỉnh liều capecitabin Một khi đã giảm liều không nên tãng liều
san một thời gian. ' ,
Điêu chjnh liêu khi dùng kêt hợp capecitabin vả docetaxel được thê hiện trong bảng sau:
Phân loại độc tính theo Độ 2 Độ 3 Độ 4
NCIC **
Xuất hiện lần dẩn Độ 2 xảy ra trong vòng 14 Độ 3 xây ra trong vòng 14 Ngưng điều tri vĩnh viễn
ngảy điên trị capecitabin: ngảy điều trị capecitabin: hoặc nêu bảc sĩ cho rằng
ngưng điêu tri capecitabin ngưng điều trị capecitabin việc điều trị sẽ mang lại
cho đến khi hổi phục về cho đến khi hồi phục về lợi ích tốt nhất cho bệnh
mức độ 0 - 4. Điều trị có mức độ 0 - 4, Điều trị có thể nhân thì tỉếp tục vởi mức
ol.
.Ềt/l -
thế được phục hỗi trong chu
kỳ ở iiễu capccitabin tương
tự. Liều capecitabin bỏ lỡ
trong chu kỳ đỉếu trị không
được thay thế 'Đỉều trị dự
phòng thay thế nên được
thực hiện nên có thế, _
Độ 2 vẫn còn tại thời điêm
điêu txị '
capecitabirưdocetaxel tỉẽp
theo: ngưng điều trị cho đến
khi hồi phục về mức độ 0 -
1, sau đó tiếp tục ở mức
100% cúa iiẽu capecitabin
vả docetaxel ban đâư. Điêu
trị dự phòng thay thế nên_
được thực hìện nểu cỏ thê.
được phục hồi trong chu kỳ
với mức 75% liếu
capecitabin. Liều
capecitabin bỏ lỡ trong chu
kỳ điều trị không được thay
thể. Điều trị dụ phòng thay
thế nên được thực hiện nêu
có thề _
Độ 3 vẫn còn tại thời điêm
điều trị
capccitabin/docctaxel tiếp
theo: ngưng điều trị cho đến
khi hồi phục về mức độ 0 -
1.
Đối với bệnh nhận có độc
tinh độ 3 tiến triên bất cứ
lúc nảo trong chu Ị<ỳ đỉẽu
trị, khi hổi phục vê mức độ
0 - 4, chu kỳ đỉều ưị sau đó
nên được tiếp tục với mức
75% liều 2capccitabin gốc và
55 ngm 2đối với đocetaxel
Điều trị dự phòng thay thế
nên được thực hiện nêu có
thế
50% liều ban đầu.
Xuât hiện lần 2
Độ 2 xảy ra trong vòng 14
ngảy điều trị capecitabin:
ngưng đỉều trị capecitabin
cho đến khi hồi phục về
mức độ 0-1 Đíêu trị có thế
được điều chình liều ở mức
7ặ% liếu capecitabin ban
đâu. Liêu capecitabin bỏ lỡ
trong chu kỳ điều trị không
được thay thế. Điều trị dự
phòng thay thế nên được
thực híện nếu có thể. _
Độ 2 vẫn còn tại thời điêm
điêu trị
capecitabiư’docetaxel tiếp
theo: ngưng điều trị cho đến
khi hồi phục về mức độ 0 -—
1.
Đối với bệnh nhận cớ độc
tính độ 2 tiên trỉên bât cứ
lúc nảo trong chu kỳ điêu
trị, khi hồi phục về mức độ
0-1 chu kỳ đỉêu trị sau đó
nên được tiêp tục với mức
75% liều 2cape:citabin gốc và
55 rr4g/m2 đối vởi docetaxel
Điều trị dự phòng thay thế
nên được thực hiện nêu có
mẻ.
Độ 3 xảy ra trong vòng 14
ngây điều trị capccitabin:
ngưng điều trị capecitabin
cho đến khi hối phục vê
mức độ 0-1 Điếu tn có thế
đuợc phục hồi trong chu kỳ
vởi mức 50% liều
capecitabin. Liễu
capecitabin bỏ lỡ trong chu
kỳ đỉều trị không được thay
thế Điếu trị dự phòng thay
thế nên được thực hiện nêu
có thề _
Độ 3 vẫn còn tại thời điểm
điểu trị '
capecítabin/docetaxel tiêp
theo: ngưng điều trị cho đến
khi hồi phục về mức độ 0 -
1.
Đối vởi bệnh nhân có độc
tính độ 3 tiến triền bẩt cứ
lúc nảo trong chu l_cỳ đìêu
trị, khi hồi phục về mửc độ
0 - 4, chu kỳ điềutrị sau đó
nên được tiêp tục với 444ức
50% liếu capecitabin gôo vả
ngimg sử dụng đocetaxel.l
Điểu trị dự phòng thay thẻ
nên được thực hìện nên có
thê.
Ngưng điều trị.
Xuất hiện lấn 3
Độ 2 xảy ra trong vòng 14
ngảy điếu trị capecitabin:
ngưng điếu trị capecitabin
cho đển khi hồi phục vê
Ngưng điếu trị.
mức độ 0- 1. Điếu tti có thế
được điều chỉnh liều' ơ mức
50% liều capecitabin ban
đẩu. Liều capecitabin bò iỡ
trong chu kỳ dỉếu trị không
được thay thế Điều trị dự
phòng thay thế nên được
thực hiện nếu có thề.
Độ 2 vẫn còn tại thời điếm
điều trị
capecitabim'docetaxel tiếp
theo: ngưng điều n-ị cho đểu
khi hổi phục về mức độ 0 —
1.
Đối với bệnh nhận có độc
tinh độ 2 tiến triển bẳt cứ
lúc nản trong chu kỳ điều
tri, khi hồi phục về mức độ
0 - 1, chu kỳ điều trị sau đó
nên được tiêp tục với mức
50% ìiểu capecitabin gốc vả
ngưng sử dụng docetaxel.
Điều trị đự phòng thay thế
nên được thực hiện nếu có
thề.
/46
Xuất hiện lần 4
Ngưng điểu trị.
** Phân loại tiêu chí độc tính chung của viện ung thư quốc gia Canada (N ational Cancer Institute ofCanada
Common Toxicity Criteria) được sử dụng ngoại trừ hội chứng tay-chân.
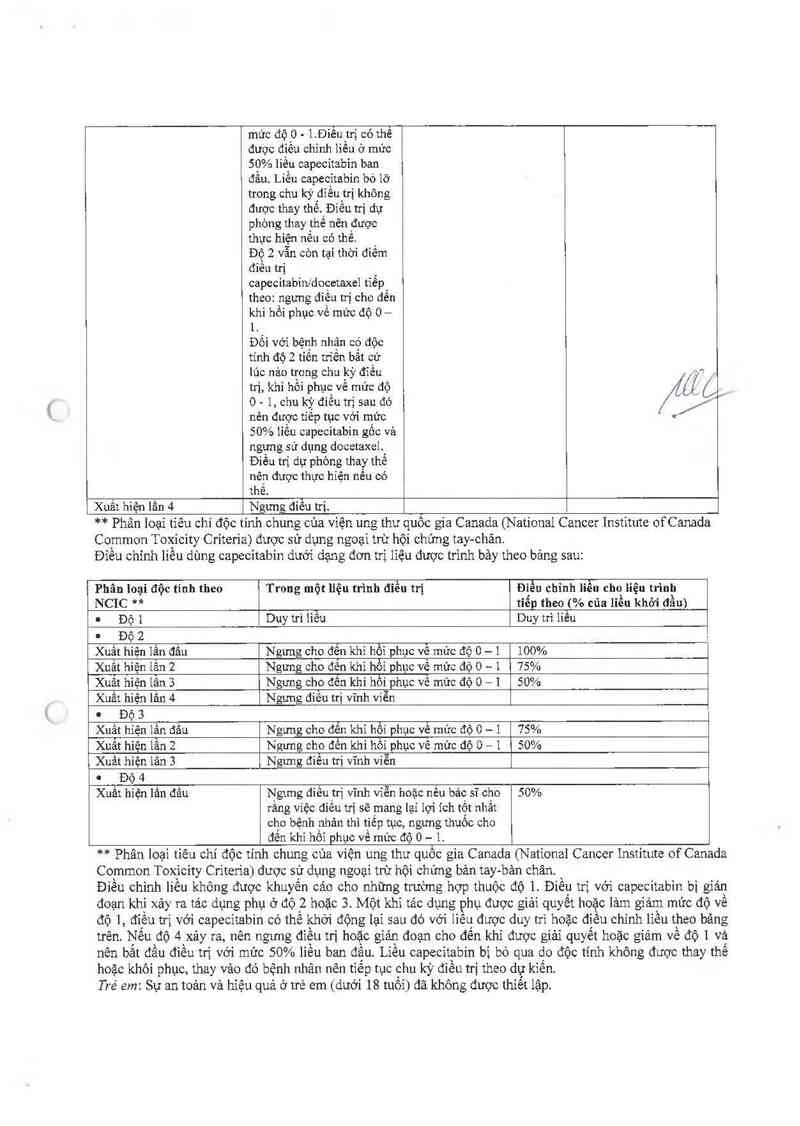
Điếu chinh liếu dùng capecitabin dưới dạng đơn trị lỉệu được trinh bảy theo bảng sau:
Phân ioại độc tính theo
Trong một liệu trình điều trị
Điều chình iiều cho Iỉệu trình
NCIC ** tiến theo 4% của liều khởi đầu)
. Độ 4 Duy trì 44`ểu Duy trì liêu
" Độ 2
Xuất hiện lấn đầu Ngưng cho đên ichỉ hổi phục về mức độ 0 — 1 100%
Xuất híện iẫn 2 Ngưng cho đến khi hổi phục về mức độ 0 — 1 75%
Xuất hiện lẳn 3 Ngưng cho đên khi hồi phục vế mức độ 0 — 1 50%
Xuất hiện lấn 4 Ngưng điêu trị vĩnh viễn
I Độ 3
Xuất hiện lấn đấu Ngưng cho đên khi hồi phục về mức độ 0 - 4 75%
Xuất hiện lân 2 Ngưng cho đến khi hồi phục về mửc độ 0 — 1 50%
Xuất hiện lân 3 Ngưng điêu trị vĩnh viễn
O Độ 4
Xuất hiện lần đấu Ngưng điểu trị vĩnh viễn hoặc nếu bảo sĩ cho 50%
rằng việc điếu trị sẽ mang lại lợi ích tốt nhẳt
cho bệnh nhân thì tiếp tục ngưng thuốc cho
đên khi hôi phục về múc độ 0 — l.
** Phân loại tiêu chí độc tính chung cúa viện ung thư quốc gìa Canada (N atỉonal Cancer institute of Canada
Common Toxỉcỉty Criteria) được sử dụng ngoại trư hội chứng bản tay-bân chân.
Điểu chinh liều không được khuyến cảo cho nhưng trường hợp thuộc độ 1. Điếu trị với capecitabin bị gỉản
đoạn khi xảy ra tác dụng phụ ở độ 2 hoặc 3 Một khi tảc dụng phụ được giải quyết hoặc lảm giảm mức độ vê
độ 1 điếu trị với capecitabin có thể khởi động lại sau dó với lỉẽu được duy tri h0ặc điểu chỉnh liểu theo bãng
trên. Nếu độ 4 xảy ra, nến ng4mg điều trị hoặc giản đoạn cho đển khi được giải quyểt hoặc giảm về độ 1 và
nên bắt đầu đìều trị với mức 50% liếu ban đầu. Liễu capecitabin bị bỏ qua do độc tính không được thay thế
hoặc khôi phục, thay vảo đó bệnh nhân nên tiếp tục chu kỳ điều trị theo dự kiến
T re em: Sự an toản vả híệu quả ở trẻ em (dưới 18 tuối) đã không được thíết iập.
Người cao tuốt“: Không điều chinh liều khởi đầu là cần thìết trong quá trình capecỉtabìn đơn trị liệu. Tuy
nhiên, tảc dụng phụ liên quan đến điều trị độ 3 hoặc 4 thường xảy ra ở những bệnh nhân_ > 60 tuốì so với
những bệnh nhân trẻ. Khuyến khích giám sảt chặt chẽ ở những bệnh nhân > 60 tuổi. Đối với bệnh nhân > 60
tuôi được điều trì với sự kêt hợp của capecitabin vả docetaxel, liều khời đầu cùa capecỉtabin được giảm xuống
75% (950 mg/m2 2 lần/ngảy) được khuyến cảo. Nếu không có độc tính được ghi nhận ở những bệnh nhân >
60 tuôỉ được điểu trị với liều khởi đầu capecitabin đã giảm kết hợp với docetaxel, liều cùa capecitabin có thế
được phục hồi thận trọng tới 1250 mg/m2 2 lần/ngảy.
Suy gan. Ở những bệnh nhân có rôỉ loạn chức năng gan nhẹ đến vùa do ung thư di cãn tới gan, không cần
thiết phải điều chinh liều khởi đầu; tuy nhiên, bệnh nhân phải được theo dõi thận trọng. Bệnh nhân có rối loạn
chức năng gan nặngĂ chưa được nghiên cứu.
Suy thận. Không điều chỉnh liều khởi đầu capecitabin được khuyến cảo ở những bệnh nhân suy thận nhẹ (độ
thanh thải creatinin 51—80 mllphút). Ờ nhũng bệnh nhân suy thận vừa (độ thanh thải creatinin 30- 50 ml/phút),
giảm liều tới mức 75% liều khới đầu capecỉtabin khi được sử dtmg đơn trị liệu hoặc kết họp với docetaxel (từ
1250 mg/m2 tới 950 mg/m2 2 lần/ngảy) được khuyến cảo Capecitabin bị chống chỉ định ở nhũng bệnh nhân
suy thận nặng (độ thanh thải creatinin dưới 30 ml/phủt).
Chống chỉ định ễỞ
//
Quá mân với capecitabin, S- fluorouracil hoặc với bất kỳ thảnh phần nảo của thuốc.
- Thiếu hụt dihydropyrimidin dehydrogenase (DPD).
- Suy thận nặng.
— Suy gan nặng.
- Có tiến sứ phản’ ưng nghiêm trọng và bất ngờ với liệu pháp fiuoropyrimidine.
- Giảm bạch câu, bạch câu trung tính, tiều cầu nặng
- Điều trị bằng sorivudin hoặc các chất lỉên quan với nó về mặt hóa học, ví dụ như brivudin.
Cảnh báo và thận trọng:
Chỉ số đông n4áu vả/hoặc chỉ số chảy mảư bị thay đổi, bao gồm cả tử vong đã được báo cảo ở bệnh nhân đùng
capecitabin kết hợp với dẫn xuất cùa coumarin như warfarin vả phenprocoumon. Những biến cố nảy xảy ra
trong vòng vải ngảy và lên đến vải tháng sau khi bắt đầu điều trị bằng capecitabin Vả trong một vải trường
hợp xảy ra trong vòng 1 tháng sau khi ngưng thuốc. Bệnh nhân dùng đồng thời capecỉtabin và thuốc chống
đông dẫn xuất của coumarin đường uống nên có giám sát thường xuyên đáp ứng chống đông máu cùa chúng
(INR hoặc thời gian prothrombin) nhằm điều chinh liều thuốc chống phù hợp Những bệnh nhân trên 60 tuổi
chuẩn đoán ung thư độc lập khiến bệnh nhân tăng nguy cơ rối loạn đông mảu.
Bệnh nhân được đìều trị với capecỉtabin nện được theo dõi bởi bác sĩ có kinh nghíệm trong việc sử đụng
những tảc nhân hóa trị liệu cho ung thư. Hầu hết các tác dụng phụ có thể phục hoi va không cân thỉểt phải
ngưng thuốc mặc dù liều lượng có thể cần phải khấu trừ hoặc giảm.
Bệnh nhân suy thận nhẹ và vừa nên được theo dõi thận trọng vẽ các tác dụng phụ. Ngưng điều trị kip thời với
điều chỉnh liều tiếp theo nên được khuyến cáo nếu bệnh nhân tiến triển cảc tảc dụng phụ.
Capecitabin có thế gây ra tỉêu chảy, đôi khi nghiêm trọng. Bệnh nhân bị tiêu chảy nặng cần được cấn thận và
bổ sung nước vả điện giải nếu bệnh nhân mất nước. Điều trị bằng thuốc chữa tiêu chảy điển hình (ví dụ,
loperamìd) nên được khuyến cáo. Trong trường hợp tiệu chảy độ 2, 3 hoặc 4; việc sử dụng capecitabin nên
ngưng ngay tức thì cho đến khi tiêu chảy được giải quyết hoặc giảm cường độ.
Sau khi tải phảt tiêu chảy độ 2 hoặc xảy ra bất kỳ tiêu chảy độ 3 hOặc 4, liều capecitabin tiếp theo nên được
giảm.
Hội chứng bản tay-bản chân (rối loạn cảm giảc đò da lòng bản tay-bản chân hoặc gây ban đó đầu chỉ do hóa
tri liệu) là độc tính da với phạm vi nghiêm trọng của độ 1- 3. Độ 1 hội chứng bản tay- -bản chân được đặc 4ng
như tê liệt loạn cảm/dị cảm, ngứa ran, sưng đau hoặc ban đỏ của lòng bản tay vả/hoặc bản chân vảfhoặc khó
chịu mã không lảm gián đoạn hoạt động bình thường. Độ 2 hội chứng bản tay- -bản chân được xác định là ban
đó gây đau và sưng ở lòng bản tay vả/hoặc bản chân vả/hoặc ảnh hưởng khó chịu đểu hoạt động của bệnh
nhân trong sinh hoạt hằng ngây. Độ 3 hội chứng bản tay-bản chân được xác định là tróc vây âm ướt, loét,
phồng rộp hoặc đau nặng ở lòng bản tay vả/hoặc bản chân vả/hoặc khó chịu nghiêm trọng là nguyên nhân dẫn
tới bệnh nhân không thể lảm việc hoặc thực hìện cảc động tác trong sinh hoạt hằng ngảy. Nếu hội chứng bản
tay- -bản chân độ 2 hoặc 3 xảy ra, vỉệc sử dụng capecitabin nên ngưng cho đến khi cảc triệu chửng được giải
quyết hoặc giảm xuông độ 1. Hội chứng bản tay-bản chân sau độ 3, liêu tiếp theo capecitabin nên được giảm.
Hiếm khỉ, độc tính nặng không mong muốn (ví dụ, viêm miệng, tiêu chảy, giảm bạch cầu trung tính và độc
thần kinh) liên quan đến with 5-FU đã được quy cho sự thiếu hụt dihydropyrimidin dehydrogenase (DPD)
hoạt động có một lìên kểt giữa giảm nồng độ DPD và tăng ảnh hưởng độc hại có khả năng gây tử vong của 5-
FU, do đó không thế loại trừ
Độc tính trên tim đã được bảo cáo với liệu pháp điều trị bằng fluoropyrimidin bao gồm nhồi máu cơ tim, đau
thắt ngực, loạn nhịp, sôc tim, đột tứ và những rôi loạn trên điện tâm đồ. Những tảc dụng phụ nảy thường gặp
hơn ở những người có tiển sử bệnh động mạch vảnh. Cần thận trọng ở những bệnh nhân có tiền sử bệnh tim
mạch, loạn nhịp tim vả đau thắt ngực đảng kế.
Bệnh nhân có rôi loạn chức năng gan từ nhẹ đến vừa do ung thư di căn tới gan nên được theo dõi thận trọng
khi sử dụng capecitabin. Ành hưởng cùa rôi loạn chức năng gan nặng về xử lý capecitabin không được biết.
Nếu độ 2-4 lỉên quan đến thuốc vê bilirubỉn xảy ra, việc sử dụng capecitabin nên ngưng ngay lập tức cho đến
khi gíải quyết tình trạng tăng bilirubỉn trong máu hoặc giảm cường độ vê độ 1.
Giảm hOặc tăng calci huyết đã được báo cảo trong khi sử dụng capecitabin cho điều trị. Caution must be
exercised … patients with pre existing hypo-or hypercalcemia. Cấn thận trợng ở những bệnh nhân mắc bệnh
thuộc hệ thần kinh trung ương hoặc ngoại vi ví dụ, u di căn não hoặc bệnh thân kinh. Cần thận trọng ở những
bệnh nhân mắc bệnh tỉểu đường hoặc rôi loạn điện giải, vì chúng có thế trầm trọng hơn trong quá trình điều trị
với capecitabin. _
Bệnh nhân độ 2 hoặc buồn nôn/nôn/viếm miệng tăng lên nến được chỉ dẫn ngưng thuốc ngay lập tức. u ên
cảo khởi đầu đỉếu trị triệu chứng. ả
Sử dụng cho phụ nữ mang thai và cho con bú
Capecitabỉn có thể gây hại thai nhi khi dùng cho phụ nữ mang thai. Chưa có nghiến cứu đầy đủ và được kiềm
soát tốt trong phụ nữ mang thai sử dụng capecitabin. Nếu thuốc được sử dụng trong khi mang thai, hoặc nếu
bệnh nhân có thai trong khi dùng thuốc, bệnh nhân cân được thông bảo về những môi nguy cơ tiềm ẩn đối với
thai nhi Phụ nữ trong độ tuôi sinh đẻ nên được khuyên trảnh mang thai trong khi điều trị với capecitabin
Không biết liệu thuốc có bảỉ tiết qua sữa mẹ hay không Bởi vì những phản' ưng phụ nghiêm trọng tiềm ân cho
trẻ bú sữa từ capecitabin, khuyến cáo nên ngung cho trẻ bú trong quá trình điếu trị capecitabin.
Ành hưởng tới khả năng lái xe và vận hặnh máy móc
Capecitabin có ảnh hưởng nhỏ và vừa đến khả năng lải xe và vận hảnh máy móc. Capecitabin có thể gây
chóng mặt, mệt mòi và buồn nôn.
'Ị`ương tảc thuốc
Ảnh hưởng của thuốc khảng acid có chứa nhôm hydroxid vả magnesi hydroxid lên dược động học cùa
capecitabin đă được nghỉên cứu. Có sự tăng nhẹ nông độ capecitabin và một chất chuyển hóa (5' —DFCR)
trong huyết tương; không thấy có tác động lên 3 chất chuyển hóa chính (S'-DFUR, S- FU vả FBAL).
Chăm sóc cân được thực hỉện khi capecitabìn dùng chung với các cơ chất của CYP2C9. Thay dồi các thông
số đông máu vả/hoặc chảy máu, kể cả tử vong dã được bảo cáo ở những bệnh nhân sử dụng capecitabin kêt
hợp với thuốc chống đông máu dẫn xuất của coumarin như warfarin vả phenprocoumon.
Nồng độ phenytoỉn trong huyết tương tãng lên dẫn đến các triệu chứng của ngộ độc phenytoỉn trong một số ca
đơn lẽ đã dược bảo cáo trong khi sử dụng đồng thời capecitabin với phenytoỉn. Nồng độ phenytoỉn nến được
theo dõi thận trọng ở những bệnh nhân đang dùng capecitabin và liều phenytoỉn có thế cần phải giảm bớt.
Tương tác thuốc-thuốc có ý nghĩa vẻ mặt lâm sảng giữa sorivudin vả 5—FU, kểt quả từ sự ức chế
dihydropyrỉmidine dehydrogenase bởi sorivudine, đã được mô tả. Sự tương tảc nảy, dẫn đến ]ảm tảng độc tính
của fiuoropyrimidin, có thể gây tử vong. Vì vậy capecỉtabin không được dùng đổng thời với sorivudin hoặc
các chất tương tự có liên quan vẻ mặt hóa học như brivudin.
Acid folinic không ảnh hưởng lớn đến dược động học của capecitabin vả cảc chất chuyển hóa của nó. Tuy
nhiên acid folinic có ảnh hưởng đến dược lực học cùa capecitabin, lỉều dung nạp tối đa (MTD) cùa
vcapecìtabin dùng đơn lẻ với phác đồ điếu trị gián đoạn là 3000 mg/mz/ngảy trong khi chỉ là 2000
mg/m2 /ngảy khi dùng capecitabin kết hợp vởi acid folinic (30 mg dường uông 2 lần/ngảy)
Nông độ 5- FU được tăng lên vả độc tính của nó có thể được tăng cường bằng leucovorin Tử vong do viêm
ruột, tiêu chảy, mất nước nặng đã được bảo cảo ở bệnh nhân cao tuổi sử dụng leucovorin vả fiuorouracil hảng
tuần. Tương tảc vởi allopurinol đã được ghi nhận với 5- FU; với hiệu quả của 5- FU có thể giảm Nên trảnh sử
dụng đổng thời allopurinol với capecitabin.
Liều dung nạp tối đa của capecitabin là 2000 mglm²/ngảy khi sử dụng kết hợp với interferon alpha-2a (3
MIU/mz/ngảy) so vói 3000 mg/m²/ngảy khi dùng capecitabin đơn lè.
Tác dụng không mong muốn
Tác dụng không mong muốn phổ biến nhất được bảo cảo với capecitabìn lả:
Hệ tiêu hóa: Tiêu chảy, buồn nôn, nôn, khô miệng, viêm mỉệng, đau bụng,, rối loạn như động ruột, tảo bón,
khó tiêu, khó chịu miệng, rối loạn viêm nhiễm đường tiêu hóa trên, xuất huyết tiêu hóa, tắc ruột.
Da vả tô chức dưới da: Hội chứng bản tay-bân chân, viêm da, rối loạn sắc tô da, các rối loạn móng, rụng tóc,
phảt ban đò, ly móng, ngứa.
Toản thân: Mệt mòi/suy yếu, suy yếu, phù. nề, đau, đau ngực, suy nhược, thờ ơ, cúm giống bệnh, đau ơ chi.
Thần kinh: Đau thần kinh cảm giảc ngoại vi, nhức đầu, chóng mặt, mất ngù, dị cảm, rôi loạn vì giảc, giảm
cảm giảc
Metabolism: Giảxn ngon miệng, mất nước, giảm cân, chản ăn.
Mắt: Kích' ưng mắt, thị lực bất thường, tăng chảy nước mắt, viêm kết mạc.
Respiratory: Khó thở, ho, rối loạn thanh quản, chảy mảư cam, đau họng, chảy nước mũi, trản dịch mảng phổi
Cơ xương khóp: Đau lưng, đau khớp, đau cơ, đau xương ẽ’Z ,
Mạch máu: Huyết khối tĩnh mạch, đỏ bừng, phù mạch bạch huyết. /
T am thần: Thay đổi tâm trạng,tr trầm cảm.
Nhiễm trùng. Virus, nhiễm nâm cadida miệng, nhỉễm trùng đường tỉết niệu, nhiễm trùng đường hô hấp trên.
Máu vả bạch huyết: Thiếu máu, giảm bạch cầu trung tính, giảm tiếu cầu, giảm bạch câu lympho, giảm bạch
cầu, giảm bạch cầu hạt.
T im: Phù.
Gan mặt: Tăng bilirubỉn mảu.
T hông báo cho Bác sĩ các tác dụng phụ gặp phải khi sử dụng thuốc.
Quá liều
Cảc biếu hỉện của quá liều cấp tinh bao gồm buồn nôn, nôn, tiêu chảy, kích thích và chảy mảư đường tiêu hóa,
và suy tủy. Việc điều trị quá liều nên bao gồm can thiệp về mặt y khoa hỗ trợ nhằm chữa trị những triệu
chứng lâm sảng đang hiện diện Mặc dù chưa có kinh nghiệm lâm sảng về sự dụng thẩm tách trong điểu trị
quá liều capecitabin đă được báo cảo, thẩm tảch mảu có thế có iợi trong việc Iảm giảm nổng độ S'-DFUR
trong máu, một chắt chuyến hóa có phân tử lượng thấp của hợp chất gôc
Bảo quản: Bảo quản ở nơi khô mát dưới 30°C. Tránh ánh sảng.
Hạn dùng: 24 thảng kể từ ngảy sản xuất.
Trình bây: Hộp 10 vì x 10 viên.
Khuyến cáo:
— Tránh xa tầm tay trẻ em.
- Đọc kỹ hướng dẫn sử dụng trước khi dùng.
— Nếu cần thêm thông tin xin hỏi ý kiến bác sĩ.
- Thuốc bán theo đơn.
TUQ. CỤC TRUỞNG
P.TRgỒNG _PHÒNG
Jmnỵ }
Sản xuất bởi:
ẫagẻn Jfủy
SUN PHARMACEUTICAL INDUSTRIE L _D f
Halo] — Baroda Highway, Halol — 389 350, Gujarat, An độ.
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng