









Mỗi viên nén bao phim ứa Capecitabine 150mg. _
Chi đunh. cáoh dùng. ch ng chỉcfflnh vá các thòng tin khác: )ẵểnml-Llẩớng dẫn sư
dụn kèm theo.Đ k Hươn nsử dụn t ckhidùn . cn oảitâm
tay gò em. Bảo qtỉẵn 8 nhiệt ẵộ <30°C, trán 2iẵ g g
——-——=— ›
Each film coated tablet oontains Mfg. Lic. No.: 26/MN/APIZO1OIFIG
150 mg of Capecitabine. Batch No.lSố lô SX:
Mfg.DatelNSXz
Exp.Date/HDz
Dosage: As directed by the VN Reg_NojSố ĐK:
physician. Doanh nghiệp nhặp khẩu:
Store below 30°C and protect
fr isture
K out of reach of children.
Manufactuer by|Cơ sở sản xuất:
ẵ') HETERO LABS LlMITED
n “ UM `~Vl. SY.NOÁỈOMỈ 1. APIIC Fonmlntícn SEZ
4Í—T
Polopllly Wllgc, Juddưn: Mmi. Mahaboonigm
Dim. Andhm Pndeah - An ao
Refer product insert for
more information.
1 Rx-tmunmnom
… …c,fflmn, mm "’ CAPETERO 1 50 Hộp 3 vì x 10 viên j
. “%.BẺTERO 15_0 _
"'CAPETERO 150
(Capecitablno Tablet 150 mg)
tl_d CJ
\J ~_
L'r '1
~:iẹ r
Eiỷả.Ct
mị; -<
EF…=
;; Ẹ
. ) '
—Q
›-ẻ n
(`bá'l'lẽ'ffl'fflb'lll’ẻ lauras l—Ju mm
091- Oìlẵlẵẵẹẵ
(Bus ost ….t ……
Size: 136x30x83 MM
Alu Alu pack
PANTDNE Prucess Hlack C
Spec: 300 gsm peral graphic board with
Aqua varnish coating
Both side open
533…
3mm
R'CAPETERO 150
@
on
Ể (Capecitabine Tablets 150 mg) Ê
tu
. ›-
Ễ Each film coated tablet oontalns Refer product insert for …
ỗ 150 mg of Capecitabine. more information. I
c, D°Ểẫẻféễ Ẩẫ đĩỂctễdb'ỷ'thẻ Mfg. Lic. No.: 26lMNIAPI201OIFIG
Ẹ physucnan. 0
o _ ::
ffl Store at below 30 C and Manufactured by: m
iỉ protect from monsture. 1 HETERO LABS LIMITED El
đ. _ u Unit VI, Polepally. Jadcherla, I
g Keep out of reach of chxidren. Mahaboob Nagar . 509 301. India.
lì X
g CAPETERO 150 o Ệ
g (Capecitabine Tablets 150 mg) n: ễ
… … ><
Ễ Each film coated tablet contains Refer product insert for E Ễ
ỗ 150 mg of Capecitabine. more information. I ặ
)(
_ ><
,, Dosasẹf AS d'fe°ted by the Mfg. Lic. No.: 26/MN/AP/2010/F/G
Ẹ physucnan. 0 Ẹ
g o 1 tẽẹ
… Store at below 30 C and Manufactured by; … ẵ 3 E
Ê protect from moisture. HETERO E 5 ả ổ
n. M Unit Vi. Polep ly. erla. I ả ẳẳ
g Keep out of reach of children. Mahaboob Nag 509 301. India.
Smrn
Foii Width : 0.025 x 141 mm
Blister Size : 133 x 80 mm XXXXXXXXXXXXXXX
Repeated Leangth : 53.3 mm '
Colours : 1 PANTONE Black C) Baìch codmg Area
fflỉ/ợs bs4
CAPETERO 150
(V len nén bao phim Caqpecitabin 150)
HƯỚNG DẨN SƯ DỤNG
Đọc kỹ hướng dẫn sử dụng trước khi dùng. Nếu cần thêm thông tin, xin hỏi ý kiểu bác sỹ.
Thuốc bản theo đơn.
Thảnh phần: Mỗi viên nén bao phim chứa capecitabin 150mg.
Tả được: Lactose, anhydrous (Super Tab 21N), croscarmeliose sodium (Ac-di-sol), hypromellose
2910 SCPS (mehocel E5 LV premium), microcrystalline cellulose (Avỉcel pH 112), magnesium
stearate, opadry pink 03B84048.
Dược lực học
Capecitabin lả dẫn xuất fiuoropyrimidin carbamat được điều chế để dùng đường uống, là thuốc độc tế
bảo được hoạt hóa bời khối u và chọn lọc trên khối u.
Capecitabỉn không phải là chất độc tế bảo in vitro. Tuy nhiên, in vivo, thuốc được biển đổi liên tiếp
thảnh chất gôc độc tế bảo là 5- fluorouracil (5— —FU), chất nả sẽ được chuyến hóa tiếp.
Thymidine phosphorylase (ThyPase), enzym liên quan đen sự biến đổi cuối cùng thảnh 5-FU, được
tìm thấy mô bị ung thư, vả ở cả cảc mô Iảnh, nhưng thường với số lượng ít hơn. Sự biến đối sinh học
tuần tự của men từ capecitabin thânh 5- FU dẫn tới nông độ của 5- FU cao hơn trong mô khối u. Sau
khi cho bệnh nhân ung thư đại trực trảng (N=8) uống capecitabin, tỉ số nồng độ của SFU ở khối u đại
trực trảng so với các mô gần kể là 3,2 (dao động từ 0,9 đến 8,0). Tỷ số nồng độ khối 0 so vởi huyết
tương lả 21,4 (dao động từ 3,9 đến 59,9) trong khi tỷ số ở các mô khỏe mạnh so với huyết tương là
8,9 (dao động từ 3,0 đến 25,8). Hoạt tính cùa thymidỉne phosphorylase cao hơn gấp 4 lần ở khối u dại
trực trảng so với mô bình thường bên cạnh.
Một vải khối u ở người, như ung thư vú, dạ dây, đại trực trâng, cổ tử cung và buồng trứng có nồng độ
thymidin phosphoryiase cao hơn (có khả năng chuyến 5’-DFUR [S’-deoxy-S-fluorouridinl thânh 5-
FU) so với cảc mô binh thường tương ứng.
Cảc tế bảo bình thường và các tế bảo khối u chuyển hóa 5-FU thảnh 5-fluoro-2-deoxyuridin
monophosphat (FdUMP) vả 5—fiuorouridin triphosphat (FUTP). Những chất chuyển hóa nảy sẽ lảm
tổn tương tế bâo bằng hai cơ chế. Đầu tiên, FdUMP và đồng yểu tố folat NS“lo methylenetetra
hydrofolat gắn với thymỉdylat synthase (TS) tạo nên một phức hợp gồm 3 yểu tố đồng hóa trị. Sự gắn
kết nảy sẽ ức chế sự hình thânh thymidylat synthase (TS) tạo nên một phức hợp gồm 3 yếu tố đồng
hóa trị. Sự gắn kết nảy sẽ ức chế sự hinh thảnh thymidylat từ uraeil. Thymidylat iâ một tiền chất cân
thiết cùa thymidin trỉphosphat, một chất cần thiết cho sự tổng hợp D , vì vậy sự thiếu hụt hợp chất
nảy có thể ức chế sự phân chia tế bảo. Thứ hai, các men sao chép n có ễ kểt h một cảch nhẩm
lẫn FUTP thay vì uridin triphosphat (UTP) trong quá trinh tổng hợp®NA. Lỗi chuyen hóa nảy có thề `
ảnh hưởng tới sự tổng hợp RNA vả protein.
Dược động học
Hấp thu: Sau khi uống, capecitabin được hấp thu nhanh và rộng khắp, sau đó được chuyền hóa mạnh
thảnh chất chuyển hóa 5’ -deoxy-S- fiuorocytidin (5’ -DFCR). Dùng cùng với thức ăn lảm gỉảm tỷ lệ
hấp thu capecỉtabin, nhưng chỉ ảnh hưởng rất ít đến AUC của 5’- DFUR và chất chuyến hóa tiếp theo
của nó là 5—FU Với liều lZSOmglm2 vảo ngảy thứ 14 dùng sau khi ăn, nồng độ dinh huyết tương
(Cmax tính bằng ụg/ml) cho capecitabin, 5’-DFCR, 5’-DFUR, 5- FU vả FBAL tương ứng lả 4,47; 3,05;
12,1; 0,95 và 5,46. Thời gian để đạt tới nồng độ đỉnh huyết tương (T,… tính bằng giờ) tương ứng là
1,50; 2,00; 2,00; 2,00 và 3,34. Giá trị AUCg,10 tính bằng ụgh/ml tương ứng là 7,75; 7,24; 24,6; 2,03
và 36, 3.
Gắn kết vởi protein: Các nghiên cứu huyết tương in-vitro đã chứng minh rằng tỷ lệ gắn kểt protein
cùa capecitabỉn, S’-DFCR, 5’-DFUR và 5- FU lần lượt là 54%, 10%, 62% và 10%, chủ yếu găn với
albumin.
Chuyến hóa. Capecitabỉn chuyển hóa đẩu tiên bởi men carboxylesterase ở gan thảnh 5’-DFCR, chẳt
nảy sau đó được chuyền thảnh 5’ -DFUR bởi cytidin deamỉnase, lả men tập trung chủ yếu ở gan và
mô khối u. Sự hinh thảnh 5- FU xảy ra chủ yếu tại vị trí khối u bởi yếu tố tạo mạch có lỉên quan đến
khối u lả dTthase, do đó lảm giảm tối đa mức độ của mô Iảnh vởi 5— FU trong cơ thế.
AUC huyết tương của 5-FU thẳp hơn 6 đến 22 lần nồng độ sau khi truyền tĩnh mạch nhanh 5- FU
(liều 600111g/m2 ). Cảo chất chuyển hóa của capecitabỉn chỉ trở iên có độc tính sau khi chuyển thảnh 5-
FU và các chất đồng hóa cùa 5- FU. 5- FU được chuyến hóa tiếp thảnh các chất chuyến hỏa không có
hoạt tính dỉhydro-S- fi-uoruracil (F UH2) 5- t1uoro-ureidopropionic acid (FUPA) vả ớ-fiuoro- B…alanin
(FBAL) thông qua dỉhydro- pyrimidin dekydrogenase (DPD) chất nảy mang tính chuyển hóa chậm
171á1' trừ. Thời gian bản thải (tu; tính bằng giờ) của capecitabỉn, 5’-DFCR, 5’-DFUR, 5- FU vả FBAL
tương ứn là 0 ,;85 1,11; 0,66; 0,76 và 3, 23. Dược động học của capecitabin được đảnh gỉả trên
khoảng lieu lả 502-3514 mg]m²lngảy. Cảo thông số cùa capecitabỉn, 5 -DFCR vả 5’-DFUR được đo
vảo ngảy đầu tiên và ngảy 14 lá như nhau. AUC cùa 5-FU lả 30%-35% cao hơn vảo ngảy 14, nhưng
không tăng lên sau đó (ngảy 22). Tại liều điếu trị, dược động học của capecitabin vả cảc chất chuyển
hỏa của nó tỉ lệ với liều, trừ 5-FU. Sau khi uống, các chất chuyến hóa cùa capecitabin được tìm thấy
chủ yếu trong nước tiến 95, 5% liều capecitabỉn được dùng tìm thấy trong nước tỉếu. Bảỉ tiết trong
phân rấtt ít (2, 6%) Chẳt chuyến hóa chính có trong nước tiểu lả FBAL, chiếm 57% liều dùng
Khoảng 3% liều dùng được đảo thải trong nước tiếu dưới dạng thuốc không đối
Chỉ định điều trị
Ung thư đại trực trâng
o Capecitabin được chỉ định như một tác nhân đon trị để điều trị hỗ trợ cho những bệnh nhân bị
ung thư đại trực trảng Dukes C sau khi phẫu thuật cắt bỏ toản bộ khối u nguyên phảt khi lựa
chọn liệu phảp đỉều trị bầng fluoropyrìmidin đơn lè. Tỷ lệ sống thêm bệnh không tiến triển
(DFS) cùa capecitabin không thấp hơn 5-fiuorouracỉl vả leucovorỉn (5- -F.U/LV) Bảc sỹ đỉều
trị cân xem xét kết quả của các cuộc thư nghiệm kết hợp lỉệu phảp hoả trị lỉệu đã chứng tỏ sự
cải thiện trong tỷ lệ sống thêm bệnh không tỉến trỉến (DFS) và thời gian sống sót chung (OS),
khi kê đơn tác nhân đơn trị capecitabỉn trong điều trị hỗ trợ ung thư đại trực trảng Dukes’ C.
0 Capecitabin được chỉ định đỉều trị lần đầu cho những bệnh nhân bị ung thư đại trực trảng di
cãn khi lựa chọn liệu pháp điểu trị bằng fluoropyrimidin đơn lẻ. Sự kểt hợp hoả trị liệu đã
mang lại khả năng sống sót nểu so với dùng 5- FU/LV đơn lẻ Khả nảng sông sỏt nếu so với
dùng 5- FU/LV chưa được chứng mỉnh khỉ đùng đơn trị capecitabin. Sử dụng capecỉtabin thay
cho 5-FU/LV trong điếu trị kết hợp chưa được nghiên cứu đầy đủ để đảm bảo độ an toản và
tăng khả nãng sông sót.
Ung thư vú
o Capecitabin kết hợp với docctaxel được chỉ định để điều trị cho những bệnh nhân bị ung thư
vú di căn sau khi đã thẳt bại với liệu phảp hoả trị liệu chứa anthracyclin. Capecitabỉn đơn trị
cũng được chỉ định để đỉếu trị cho những bệnh nhân bị ung thư vú di căn kháng cả hai phảc
đồ hoá trị iỉệu chứa paclitaxel vả anthracyclin hoặc kháng paciitaxel và trên những bệnh nhân
không được chỉ định điểu trị thêm bằng anthracyclin (ví dụ như bệnh nhân dùng cảc liều tich
tụ doxepuhicmlìgặc doxorubicin tương đương với 400 mg/m2). Sự khảng thuốc được định
nghĩa là bệnh vân ,Ệến trỉến trong khi diều trị, có hoặc không có đảp' ưng ban đẩu hoặc tải phảt
trong vòng 6 thảấg sau khi hoản thảnh điều trị với phảc đổ hỗ trợ chứa anthracyclin
Liều lượng và cách sư ụng
Capecitabin cần nuốt nguyên viên cùng với nước trong vòng 30 phủt sau khi ãn. Liều capecitabin
được tính dựa trên díện tích bề mặt cơ thề.
Liều khởi đầu tiêu chuẩn
Đơn trị (ung thư đại trực trảng di căn, đỉều trị hỗ trợ ung thư đại trực trảng, ung thư vú di căn)
Liều khuyến cáo capecitabin là 1250 mg/m2 dùng đường uống ngây hai lần (vảo buổi sáng và tối
tương đương với tổng liều hảng ngảy là 2500 mg/m2 theo chu kỳ 3 tuần - dùng thuốc trong vòng 2
tuần tiếp theo là 1 tuần nghĩ (xem bảng 1).
Điều trị hỗ trợ trên những bệnh nhân bị ung thư đại trực trảng Dukes’ C được khuyến cáo dùng trong
6 thảng [có nghĩa là liều thuốc uống capecitabin 1250 mg/m2 ngảy hai lần trong 2 tuần tiêp theo sau
là 1 tuần nghi trong 1 chu kỳ 3 tuần, với tổng cộng 8 chu kỳ (24 tuần)].
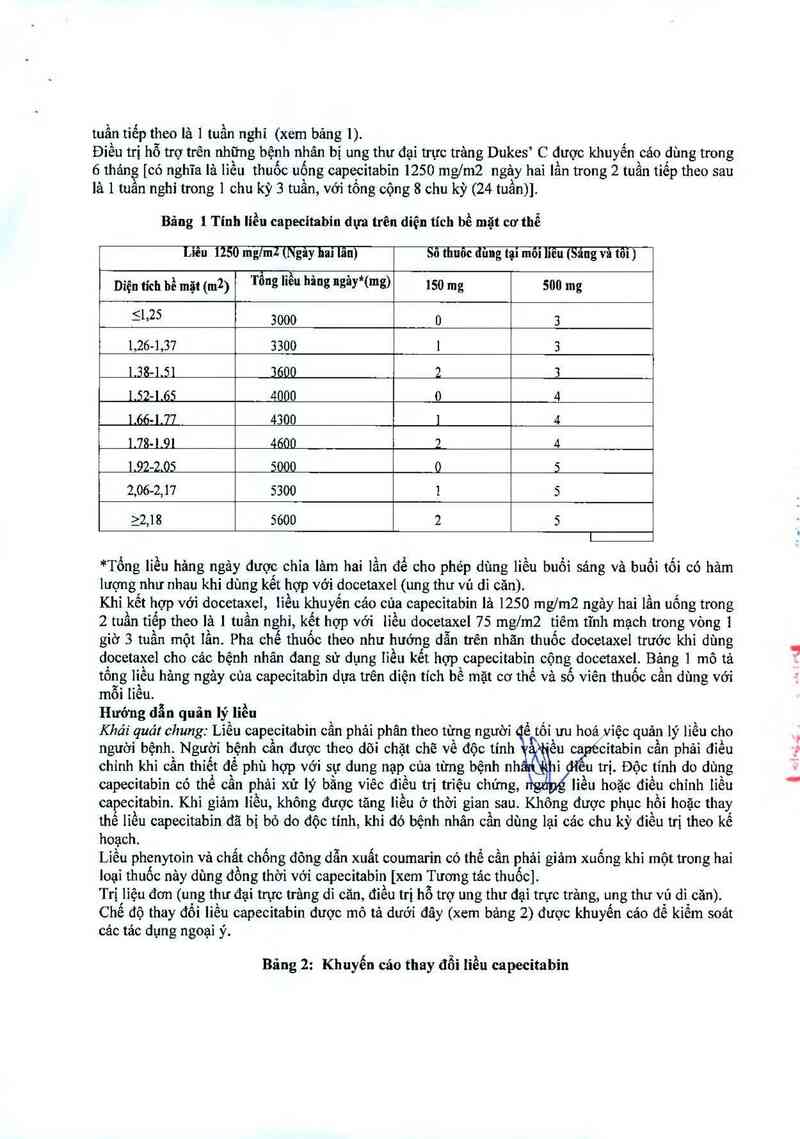
Bảng 1 Tính liều capecitabin dựa trên diện tích bề mặt cơ thể
Diện tích hồ mặt (m²) hâng ugây*(mgì 150 mg
511²5 3000 0
1 1 3300 1
2,06-2,17 5300
22,1 8 5600
*Tổng líễu hảng ngảy được chia lảm hai lần để cho phép dùng liều buồi sảng vả buối tối có hảm
lượng như nhau khi dùng kết hợp vởi docetaxel (ung thư vú di căn).
Khi kết hợp với docetaxel, liều khuyến cảo cùa capecitabin là 1250 mg/m2 ngảy hai lẩn uống trong
2 tuần tiễp theo là 1 tuần nghi, kểt hợp với lỉều docetaxel 75 mglm2 tiêm tĩnh mạch trong vòng 1
giờ 3 tuần một lần Pha chế thuốc theo như hướng dẫn trên nhãn thuốc docetaxel trước khi dùng
docetaxel cho cảc bệnh nhân dang sử dụng Iìễu kểt hợp capecỉtabin cộng docetaxel. Bảng 1 mô tả
tống 1iếu hảng ngảy cùa capecitabin dựa trên diện tích bề mặt cơ thể và số viên thuốc cần dùng với
mỗi liễu.
Hướng dẫn quản lý liều
Khái quát chung. Liều capecitabin cần phải phân theo từng người ế tối ưu hoá việc quản lý liều cho
người bệnh Người bệnh cân được theo dõi chặt chẽ vê độc tinh ẵ eu ca citabỉn cân phải điều
chinh khi cẩn thỉết để phù hợp với sự dung nạp của từng benh nh u trị. Độc tính do dùng
capecitabin có thể cần phải xử lý bằng viêc điều trị triệu chímg,ủẳlftiẩiiÉ hoặc điều chỉnh Iỉều
capecitabin. Khỉ gỉảm liều, không được tăng lỉều ở thời gian sau Không được phục hồi hoặc thay
thế lỉều capecitabin đã bị bỏ do độc tính, khi đó bệnh nhân cân dùng lại các chu kỳ điếu trị theo kế
hoạch.
Liều phenytoỉn vả chẩt chống đông dẫn xuất coumarin có thế cần phải giảm xuống khi một trong hai
loại thuốc nảy dùng đồng thời với capecitabỉn [xem Tương tảo thuốc].
Trị lỉệu đon (ung thư đại trực trảng di căn, điều trị hỗ trợ ung thư đại trực trảng, ung thư vú di căn).
Chế độ thay đổi liều capecitabin được mô tả dưới đây (xem bảng 2) được khuyến cảo đế kỉếm soát
cảc tác dụng ngoại ý.
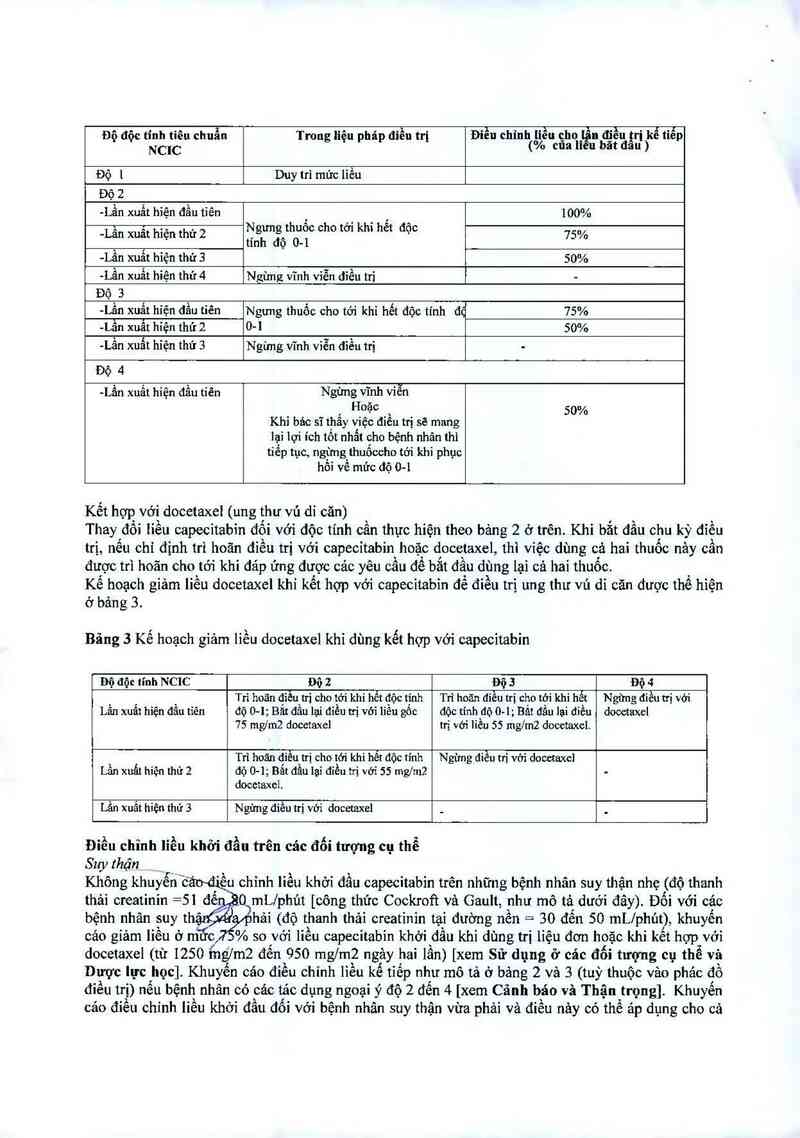
Bảng 2: Khuyến cáo thay đổi liều capecitabin
Độ độc tỉnh tiêu chuẩn Trong liệu pháp điều trị Điều chỉnh liều cẵhol ÌỆn nđiều utr i kể tiếp
NCIC bãtđ “ )
Độ [ Duy trì mức liều
Độ 2
-Lần xuất hiện đầu tiên _ ' 100%
-Lằn xuất hiện thứ 2 Ì`Ểgm’gfhu°° °h° “" kh“ ”et dọ° 15%
` f tinh đọ 0-1
-Lân xuât hiện thứ 3 50%
-Lằn xuất hỉện thứ 4 Ngừng vĩnh viễn diều tri -
Độ 3
~Lân xuât hỉện đâu tiên Ngưng thuốc cho tởi khi hết độc tinh đ“ 75%
-Lân xuât hỉện thứ 2 0-1 50%
-Lằn xuất hỉện thứ 3 Ngừng vĩnh viễn điểu trị -
Độ 4
-Lần xuất híện đầu tỉên Ngừng vĩnh viễn
Hoặc 50%
Khi bâc sĩ thấy việc điều trị sẽ mang
lại lợi ích tốt nhẩt cho bệnh nhân thì
tiểp tục, ngừng thuốccho tới khi phục
hồi vê mức độ 0-1
Kết hợp vởi docetaxel (ung thư vú di căn)
Thay đổi liều capecitabin đối với độc tính cần thực hiện theo bảng 2 ở trên. Khi bắt đầu chu kỳ điều
trị, nếu chỉ định trì hoãn đỉều trị với capecitabin hoặc docetaxel, thì vỉệc dùng cả hai thuốc nảy cần
được trì hoãn cho tới khi đảp ứng được các yêu cầu để bắt đầu dùng lại cả hai thuốc.
Kế hoạch gỉảm liều docetaxel khi kết hợp vởi capecitabin dễ điều trị ung thư vú di căn được thế hiện
ở bảng 3.
Bảng 3 Kế hoạch giảm liều docetaxel khi dùng kểt hợp với capecitabin
Độ độc tính NCIC Dộ 2 Độ 3 Độ 4
Trì hoãn đìều trị cho tởi khi hễt độc tính Trì hoãn diễu trị cho tới khi hết Ngừng điều trị với
Lần xuất hiện đầu tiên đó 0-1; Bắt đầu lại đỉều trị với 1iểu gốc độc tính đó 0… 1; Bắt đầu lại điều dooetnxel
75 mgfm2 docetaxe] trị với liều 55 mg/m2 docetaxel.
Trì hoãn điêu trị cho tới khi hêt độc tinh Ngừng điều trị với docetaxel
Lần xuất hiện thủ 2 dộ 0-1; Bắt dầu lại diều ni với ss mg/m2 —
docetaxel.
Lần xuất hiện thứ 3 Ngừng điều trị với docetaxel _ _
Đỉều chỉnh liều khởi đầu trên cảc đối tượng cụ thể
Suy thận
Không khuyến ch chinh liều khởi đầu capecitabin trên những bệnh nhân suy thận nhẹ (độ thanh
thải creatinin 51 ạđeẵO mL/phút [công thức Cockrofi vả Gault, như mô tả dưới đây). Đối với các
bệnh nhân suy th hải (độ thanh thải creatìnin tại đường nền = 30 đến 50 mL/phủt), khuyến
cáo giảm liếu ớ m'ửcỉẵ’ẩso với liều capecỉtabin khởi đầu khi dùng trị liệu đơn hoặc khi kết hợp với
docetaxel (từ 1250 mg/m2 đến 950 mng ngảy hai lần) [xem Sử đụng ở các đối tượng cụ thể và
Dược lực học]. Khuyến cáo điểu chỉnh liều kế tỉếp như mô tả ở bâng 2 và 3 (tuỳ thuộc vảo phảc đồ
điều trị) nểu bệnh nhân có cảc tảc dụng ngoại ý độ 2 đến 4 [xem Cãnh báo và Thận trọng] Khuyến
cảo điều chinh liếu khởi đẩu đối với bệnh nhân suy thận vừa phải và điều nảy có thế áp dụng cho cả
trị liệu đơn capecitabỉn và sử dụng kết hợp capecitabin với docetaxel.
Công thức Cockroft vả Gault:
(140 — tuổi [năm]) (trọng lượng cơ thể [kg])
Độ thanh thải creatinin ở nam giới = '
(72) ( creatinin huyêt thanh[mg/dLD
Độ thanh thải creatinin ở phụ nữ = 0,85 x giá trị ở nam giới
Người cao tuốt“
Bác sỹ điếu trị cần thận trọng theo dõi tảo dụng của capecítabin trên người cao tuổi do chưa có đủ dữ
lỉệu để đưa ra khuyến cáo lỉễu dùng.
Chổng chỉ định
Thỉếu Dihydropyrimidin Dehydrogenase (DPD) :
Capecitabin chống chỉ định trên bệnh nhân thiếu hụt dihydropyrimidin dehydrogenase (DPD).
Sưy thận nặng:
Capecitabin chống chỉ định trên bệnh nhân suy thận nặng (độ thanh thải creatinĩn dưới 30le phút
[công thức Cockroft vả Gault]) [xem Sử dụng trên các đổi tượng cụ thể và Dược lực học].
Quá mẫn.
Capecitabín chống chỉ định trên bệnh nhân có phản ứng quá mẫn với capecitabin hoặc với bắt kỳ
thảnh phần nảo cùa thuốc. Capecitabỉn chống chỉ định trên nhưng bệnh nhân quả mẫn với 5-
fluorouracil.
Cảnh báo và thận trọng
Cânh bảo chung:
Những bệnh nhân đang sử dụng trị liệu với capecỉtabin cần được bác sỹ có kinh nghỉệm trong vỉệc sử
dụng cảc thuốc hoả trị liệu ung thư. Phần lớn cảc tác dụng ngoại ý có thể hồi phục và không dẫn đến
việc phải ngừng điếu trị mặc dù các lỉều có thể cẩn phải ngưng lại hoặc giảm [xem Liều lượng và
cách dùng].
T zeu chảy
Capecitabỉn có thể gây ra tìêu chảy, đôi khi rất trầm trọng. Những bệnh nhân mắc tiêu chảy nặng cần
phải được thận trọng theo dõi và phải bù nước và cảc chất điện giải nếu bị mất nước. Trên 875 bệnh
nhân bị ung thư vú di cản hoặc ung thư đại trực trảng đang dùng đơn trị lỉệu capecitabin, thời gian
trung bình xuất hiện tiêu chảy độ 2 đến 4 là 34 ngảy (nằm trong khoảng từ 1 đến 369 ngảy). Thời
gỉan trung bình của tiêu chảy độ 3 đến 4 1ả 5 ngảy. Theo Viện ung thư quốc gia Canada (NCIC) tìêu
chảy độ 2 được định nghĩa là số lần đi tiêu chảy tăng từ 4 đến 6 lần] ngảy hoặc đi tíêu chảy vảo ban
đêm, tiêu chảy độ 3 được định nghia lả số lẩn đi tỉêu chảy tăng từ 7 đến 9 lần/ngảy hoặc đi tiêu chảy
mất chủ động và hấp thụ kém, tỉêu chảy độ 4 được định nghĩa lả số lần tăng_ > 10 lẩn l ngảy hoặc tiêu
chảy ra máu nhiếu hoặc cần sự hỗ trợ ngoải đường ruột. 1\ /
Nếu tiêu chảy độ 2, 3 hoặc 4 xảy ra, cần ngừng ngay capecitabỉn cho tới khi nể tiệư chảy hoặc giảm
xuống độ 1 Sau khi tiếu chảy độ 2 xuất hiện lại hoặc có bất kỳ híện tượng tỉềự ảy độ 3 hoặc 4, cân
gíảm lỉếu capecitabin theo liễu kế tiếp [xem Liều lượng vả cảch dùng]. Khuyến cáo đỉều trị chống
tìêu chảy (ví dụ như loperamid).
Đã có báo cảo về hiện tượng viêm ruột hoại tử (viêm ruột thừa).
Đóng máu:
Các bệnh nhân dùng đồng thời capecỉtabỉn và liệu phảp uống thuốc chống đông có dẫn xuất coumarìn
cần được theo dõi chặt chẽ về sự đáp ứng với thuốc chống đông (INR hoặc thời gian prothrombỉn)
hoặc cần điều chinh liều tương ứng [xem Tương tác thuốc].
Độc tính trẻn tim mạch:
Cảo độc tinh trên tim mạch được ghi nhận khi dùng capecitabỉn bao gổm nhồi máu cơ tim/ thiếu mảu,
… 1'ừ __
đau thắt ngực, loạn nhịp tim, ngừng tim, suy tim, đột từ, thay đối điện tâm đồ và bệnh cơ tim. Cảc tảc
dụng ngoại ý nảy thường gặp trên những bệnh nhân có tiền sử bị bệnh động mạch vảnh.
Ĩhiếu hụt Dihydropyrimidine Dehydrogenase:
Rất hiếm xảy ra, không dự kiến trước, độc tính trầm trọng (ví dụ như viêm miệng, tíêu chảy, giảm
bạch cầu trung tính và gây độc thần kinh) lỉên quan đến 5-fluorouracỉl là do sự thiếu hụt
dỉhydropyrimỉdíne dehydrogenase (DPD). Không loại trừ mối líên hệ giữa việc giảm nồng độ DPD
vả tãng nồng độ, nguy cơ tử vong do tảc dụng độc tính của 5-fluorouracil.
Suy thận:
Cần giảm liều đối với bệnh nhân suy thận vừa phâỉ tại đường nền [xem Liều lượng và Cách dùng].
Những bệnh nhân suy thận nhẹ và vùa phải tại đường nên cân được theo dõi chặt chẽ về các tảo dụng
ngoại ỷ. Ngừng ngay liệu pháp điều trị cùng vởỉ việc điều chĩnh liều tỉếp nối nếu bệnh nhân có cảc
hỉện tượng ngoại ý độ 2 đến 4 như mô tả ở bảng 2 [xem Liều lượng và Cách dùng, Sử dụng ở các
đối tượng cụ thể và Dược lực học].
Mang thai:
Capecitabin có thể gây hại cho bâo thai khi sử dụng trên phụ nữ mang thai Capecitabin gây chết phôi
và gây quái thai trên chuột cái vả gây chết phôi trên khi khi uống thuốc trong thời kỳ hình thảnh các
cơ quan. Khi dùng thuốc trong thời kỳ kỳ mang thai hoặc nêu bệnh nhân dự định có thai trong khi
đang dùng capecitabin, bệnh nhân cần được thông bảo về các nguy cơ có thẻ xảy ra đối với bảo thai
[xem Sử dụng trên câc đối tượng cụ thể]
Hội chứng tay chán.
Hội chứng chân tay (rối loạn đỏ da gan bản tay bản chân và ban đó vùng đỉnh đầu do hóa trị Iỉệu) là
độc tính ở da. Thời gian xây ra trung bình là 79 ngảy (nằm trong khoảng từ 11 đến 360 ngảy) với mức
độ nặng từ độ 1 dến độ 3 ở những bệnh nhân bị ung thư di căn đang dùng liệu phảp capecitabin ĐỘI
được xảc định khi có cảc hiện tượng sau: tê cóng, rối loạn cảm giác/dị cảm, đau dây thần kỉnh, sưng
đau hoặc đỏ da tay vảfhoặc chân vả/hoặc khó chịu mã không gây ảnh hưởng đến cảc hoạt động bình
thường. Hội chứng tay chân tay độ 2 được xác định khi đó da gây đau và sưng tay vả! hoặc chân và
/hoặc khó chịu lãm ảnh hướng đến cảc hoạt động bình thường hâng ngảy của bệnh nhân. Hội chứng
tay chân độ 3 được xảo định khi có hỉện tượng tróc vảy âm ướt, loét, phồng rộp da hoặc đau tay
vả/hoặc chân nặng và khó chịu nặng nề lảm cho bệnh nhân không thể thực híện được các công vỉệc
hảng ngảy. Nếu hội chứng tay chân độ 2 hoặc 3 xảy ra, cần ngừng capecitabin cho đến khi hết hắn
các triệu chứng hoặc giảm xuống độ 1. Sau khi có hội chửng tay chân độ 3, cần phải giảm liều
capecitabin [xem Liều lượng và cách đùng].
T ãng bilirubỉn trong máu:
Trên 875 bệnh nhân bị ung thư vú di căn hoặc ung thư đại trực trảng đã sử dụng it nhất 1 liều trị liệu
đơn capecỉtabin 1250 mg/m2 ngảy hai lẩn trong vòng 2 tuần tiếp theo là 1 tuần nghi, tãng bilirubỉn
trong máu dộ 3 (1,5-3 x ULN) đã xảy ra trên 15,2% (n=133) bệnh nhân và tãng bilirubỉn trong mảu
độ 4 (>3 x ULN) xảy ra trên 3, 9% (n=34) bệnh nhân. Trên 566 bệnh nhân có di căn ở gan tại đường
nến và 309 bệnh nhân không có di căn ở gan tại đường nến, tăng bilirubỉn trong máu độ 3 hoặc 4 xảy
ra trên 22, 8% và 12, 3% bệnh nhân. Trên 167 bệnh nhân tăng bilirubỉn trong mảu độ 3 hoặc 4,18,6%
(n=31) bệnh nhãn có mức tăng alkaline phosphatase sau đường nền (dộ ] đến 4, mã không có mức
tãng tại đường nền) và 27,5% (n=46) tăng transaminase sau đường nền tại bất kỳ thời gian nảo
(không nhất thiet\xảysca đồng thời). Phẩn lớn các bệnh nhân 64, 5% (n= 20) và 71,7% (n=33) có di căn
ở gan tại đường nên. Ngbải ra, 57, 5% (n=96) vả 35,3% (n= 59) trên 167 bệnh nhân tãng alkalỉn
phosphatase hoặc tran aBe (độ 1 đển 4) tại cả đường nên và sau đường nền. Chỉ có 7, 8% (n=13)
và 3, 0% (n=5) bệnh ng alkalin phosphatase hoặc transaminase độ 3 hoặc 4.
Trên 596 bệnh nhân đỂụ trị vói capecitabin như là liệu phảp điều trị bước một ung thư đại trực trảng
di căn, tỷ lệ tăng bilirubỉn trong mảu độ 3 hoặc 4 tương đương với cảc dữ liệu an toản trên lâm sảng
của đơn trị capecitabin. Thời gian trung bình xảy ra tăng bỉlirubin máu độ 3 hoặc 4 trên các đối tượng
bị ung thư đại trực trảng là 64 ngây vả bilirubỉn toản phần trung bình tăng từ 8 pm/L tại đường nến
lên 13 pm/L trong khi điều trị vởi capecitabỉn. Trên 136 bệnh nhân ung thư đại trực trảng có hiện
tượng tăng bilirubỉn trong máu độ 3 hoặc 4, 49 bệnh nhân tãng bílirubìn mảu độ 3 hoặc 4 có chỉ số
xét nghỉệm lần cuối cùng trong đó 46 bệnh nhân có di căn ở gan tại đường nền.
Trên 251 bệnh nhân bị ung thư vú dì căn sư dụng kết hợp capecitabin vả docetaxel, tãng bỉlirubín
máu độ 3 (1,5 đểu 3 x ULN) xảy ra trên 7% (n=l7) bệnh nhân và độ 4 (>3 x ULN) xảy ra trên 2%
(n=5) bệnh nhân.
Nếu xuất hỉện tăng bilirubỉn độ 3 đến 4 có liên quan tới thuốc, cần ngừng ngay capecitabin cho đến
khi bilirubỉn trong máu gỉảm xuống <3 ,0 x ULN [xem khuyến cảo thay đối Iiếu trong mục Liều
lượng và cách dùng].
Huyết học:
Trên 875 bệnh nhân bị ung thư vú dí căn hoặc ung thư đại trực trảng đơn trị với liểu 1250 mg/m2
ngảy hai lần trong vòng 2 tuần tiếp theo 1 tuần nghỉ, 3,2%, 1,7%, và 2 ,4% bệnh nhân giảm bạch câu
trung tính, giảm tỉều cầu hoặc giảm hồng cầu độ 3 hoặc 4 Trên 251 bệnh nhân bị ung thư vú di căn
dùng liều kết hợp capecỉtabin vả docetaxel, 68% giảm bạch cầu trung tính độ 3 hoặc 4, 2,8% giảm
tiều cầu độ 3 hoặc 4 và 9, 6% thiếu máu độ 3 hoặc 4.
Cảo bệnh nhân có bạch cầu trung tỉnh tại đường nến chỉếm <1,5 x 109/L vả! hoặc tiều cau chiếm
<100 x 109/L không được điếu trị với capecitabỉn. Nếu các đảnh giả chỉ số xét nghiệm không có kế
hoạch nhưng trong chu kỳ điều trị cho thấy có độc tính huyết học độ 3 hoặc 4, phải ngừng ngay việc
điếu trị với capecitabin.
Người cao tuồi.
Các bệnh nhân 2 80 tuổi có thể có cảc tác dụng ngoại ý độ 3 hoặc 4. Trên 875 bệnh nhân bị ung thư
vú di căn hoặc ung thư đại trực trảng sử dụng đơn trị capecỉtabin, 62% trên 21 bệnh nhân > 80 tuổi
điều trị bằng capecitabin có các tảc dụng ngoại ý độ 3 hoặc 4 có liên quan tới điều trị: có 6 bệnh nhân
bị tỉêu chảy (28,6%), 3 bệnh nhân bị buồn nôn (14,3%), 3 bệnh nhân có hội chửng chân tay (14,3%),
2 bệnh nhân bị nôn (9, 5%) Trong số 10 bệnh nhân từ 70 tuối trở lên (không có bệnh nhân nảo >80
tuổi) được đỉều trị bằng capecỉtabin kết hợp với docetaxel, 30% (3 trên 10) bệnh nhân có hiện tượng
tiếu chảy hoặc viêm miệng độ 3 hoặc 4, và 40% (4 trên 10) có hiện tượng hội chứng tay chân độ 3.
Trong sô 67 bệnh nhân_ > 60 tuốỉ dùng capecitabin kết hợp với docetaxel, tỷ lệ cảc tác đụng ngoại ỷ
độ 3 hoặc 4 có liên quan đến điều trị, cảc tảc dụng ngoại ý nghỉêm trọng có liên quan đến điều trị,
việc ngừng tham gia nghỉên cứu do cảc tảo dụng ngoại ỷ, ngừng điều trị do cảc tảc dụng ngoại ỷ vả
ngừng đĩều trị trong vòng hai chu kỳ đìều trị đấu tiên cao hơn nhớm bệnh nhân <60 tuổi
Trên 995 bệnh nhân dùng trị lỉệu hỗ trợ bằng capecitabin cho bệnh ung thư đại trực trảng Dukes’ C
sau khi đã phẫu thuật cẳt bỏ khối u nguyên phát, 41% trên 398 bệnh nhân > 65 tuổi được đỉều trị
bằng capecitabin có các tác dụng ngoại ý độ 3 hoặc 4 có liên quan đến điều trị: 75 bệnh nhân có hội
chứng tay chân (18 8,%), 52 bệnh nhân có tỉêu chảy (13,1%),12 bệnh nhân viêm miệng (3, 0%), 11
bệnh nhân xuất hỉện giảm bạch cầu trung tinh/mất bạch cầu hạt (2,8%), 6 bệnh nhân bị nôn (1,5 %),
và 5 bệnh nhân có buồn nôn (1,3%). Trên những bệnh nhân > 65 tưổi enh nhan ung thư đại trực
trảng Dukes’ C (tẩt cả cảc đối tượng được chọn ngẫu nhiên; điều trị bằnig Ệpeễưabin: 188 bệnh nhân,
điểu trị bằng 5 F-U:ILV 208 bệnh nhân) sau khi phẫu thuật cắt bỏ khối\ưrfguyên phát, tỷ lệ nguy cơ
sống bệnh không tiến trỉến và sống sót chung khi điều trị bằng capecỉtabin so với 5-FU/LV là 1,01
(95% C. 1. 0,80-1,27) và 1,04 (95% C.l. 0,79-1,37).
Suy gan.
Cảo bệnh nhân rối loạn chức năng gan từ nhẹ đến vừa phải do di cãn cần được theo dõi chặt chẽ khi
dùng capecitabin. Tảo dụng gây rôi loạn chức năng gan trầm trọng do capecitabin chưa được biết rõ
[xem Sử dụng trên cảc đối tượng cụ thế và Dược lực học].
Kết hợp với các Ioại thuốc khác
Sử dụng capecitabỉn kết hợp với irinotecan chưa được nghiên cứu đầy đù.
Tảc dụng không mong muốn `
Do các thử nghiệm iâm sảng được thực hiện rộng rãi dưới các điêu kiện khảo nhau, tỷ lệ cảc tảc dụng
.,/
%. 1u"f
\“0
n
ngoại ý được ghi nhận trong các thử nghiệm lâm sảng cùa thuốc không được so sánh trực tiểp với cảc
tỷ iệ cùa các thử nghiệm cùa cảc loại thuốc khảc và cũng không thế hỉện tỷ lệ đã quan sát thấy trong
quá trình thực hỉện.
Điều trị hỗ trợ ung thư đại trực trảng
Bảng 4 mô tả cảc tảo dụng ngoại ỷ xảy ra > 5% bệnh nhân từ một thử nghiệm giai đoạn 3 trên những
bệnh nhân bị ung thư đại trực trảng Dukes’ C, những bệnh nhân nảy dùng it nhất một 1ỉều thuốc
nghiên cứu và có ít nhất một đảnh giá về độ an toản. Tổng số 995 bệnh nhân đã được điếu trị với liều
capecitabỉn 1250 mg/m2 ngảy hai lần uống thuốc trong 2 tuần sau đó là một tuần nghi vả 974 bệnh
nhân dùng thuốc 5- FU vả Ieucovorin (20mglm2 leucovorìn tiêm tĩnh mạch tiếp theo lá tiêm bolus liễu
425mg/m2 5- FU vảo ngảy 1 và ngảy 5 theo chu kỳ điều trị 28 ngảy một lần). Thời gian đỉếu trị trung
bình là 164 ngảy đối với bệnh nhân đíều trị bằng capecitabỉn và 145 ngảy đối với bệnh nhân điếu trị
bằng 5- FU/LV. Tổng số 112 (11%) vả 73 (7%) bệnh nhân điều trị bằng capecitabin vả 5-FU/LV-
ngừng điều trị do cảc tảc dụng ngoại ỷ.
Tổng số 18 bệnh nhân tử vong do tất cả cảc nguyên nhân, điểu nảy xảy ra hoặc trong thời gian nghiên
cứu hoặc trong vòng 28 ngảy dùng thuốc: 8 (0,8%) bệnh nhân được chọn ngẫu nhỉên dùng
capecitabin và 10 (1,0%) chọn ngẫu nhiên dùng 5-FU/LV.
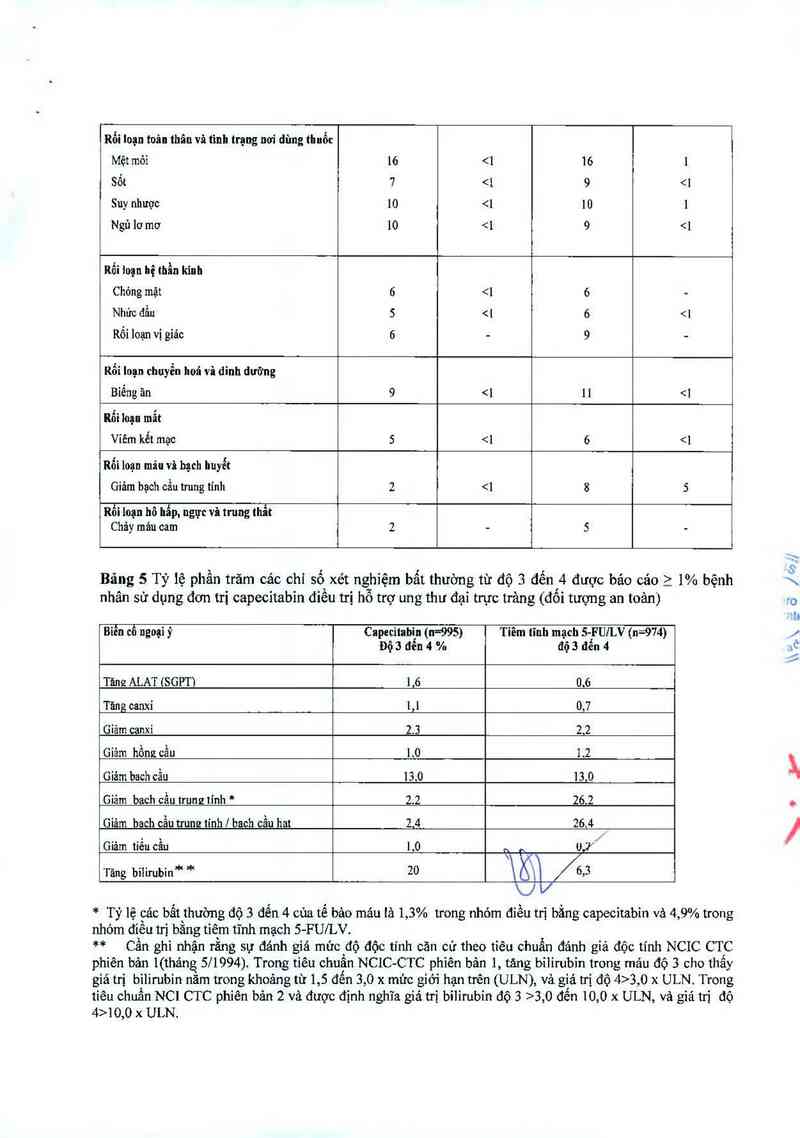
Bảng 5 mô tả các chỉ số xét nghiệm bẳt thường độ 3 đến 4 xảy ra_ > 1% bệnh nhân trong một thử
nghiệm giai đoạn 3, cảc bệnh nhân nảy bị ung thư đại trực trảng Dukes C vả dùng ít nhất một liều
thuốc nghiên cứu và có ít nhất một đảnh giả vê độ an toản cùa thuốc.
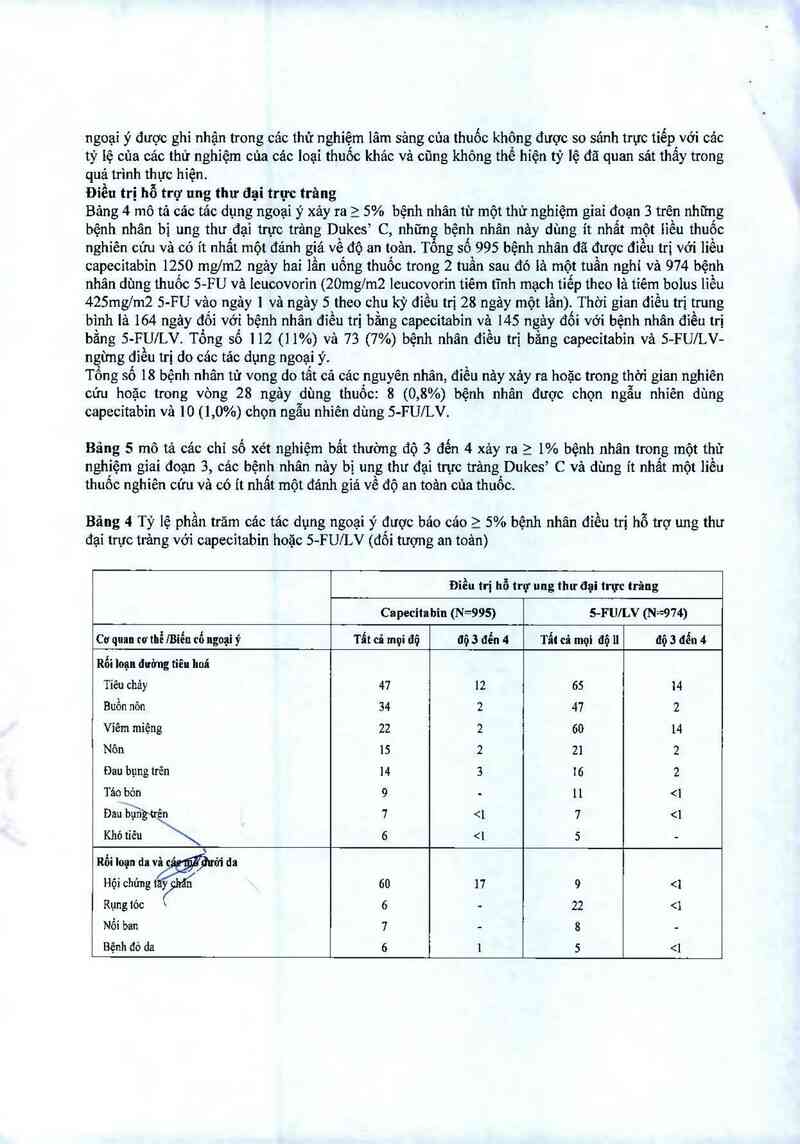
Bãng 4 Tỷ lệ phần trăm cảc tảc dụng ngoại ý được báo cảo 2 5% bệnh nhân điểu trị hỗ trợ ung thư
đại trực trảng với capecitabin hoặc 5-FU/LV (đôi tượng an toản)
Điều trị hỗ trợ ung thư đại trực trăng
Capecitahin (N=995) 5-FU/LV (N=974)
Cơ quan cơthễ/Biển cố ngoại ỷ Tẩt cả mọi 00 00 3 đểu 4 Tẩt cả mọi độ 11 dộ 3 đển 4
Rối loụn đường tiêu hoá
Tiêu chảy 47 12 65 14
Buồn nôn 34 2 47 2
Viêm miệng 22 2 60 14
Nôn 15 2 21
Đau bụng trên 14 3 16 2
Táo bớn 9 ' 11 <1
Đaniầigfcren 1 <1 1 <1
Khó tíẽu 6 <1 5 -
Rối loạn da vỉẳtýhrửi da
Hội chứngt wí 60 11 9 <:
Rụng tỏc \ 6 — 22 <1
Nổi ban 7 - 8 -
Bệnh đó da 6 1 5 3, 0 x ULN. Trong
tiêu chuẩn NC1 CTC phiên bản 2 và được định nghĩa giá trị bilirubin độ 3 >3, 0 đến 10,0 x ULN, và giá trị đó
4>10,0 x ULN.
Ung thư đại trực trảng di căn
Trị liệu đơn. Các tác dụng ngoại ý xảy ra >5% bệnh nhân từ tập hợp các dữ liệu thu được từ 2 nghiên
cứu giai đoạn 3 điều trị bước một ung thư đại trực trảng di căn. Tổng số 596 bệnh nhân bị ung thư đại
trực trảng di căn được diều trị bằng capecĩtabin liều 1250 mng ngảy hai lằn trong 2 tuần vả tiếp
theo là 1 tuần nghỉ, và 593 bệnh nhân dùng thuốc 5- FU vả leucovorin trong phảc đồ điếu trị Mayo (20
mg/m2 leucovorin tiêm tĩnh mạch tỉếp theo là 425 mg/m2 tiêm bolus tĩnh mạch 5-FU, vảo ngảy 1—5,
chu trình 28 ngảy). Trong tập hợp dữ liệu bệnh nhân bị ung thư đại trực trảng, thời gían điều trị trung
bình là 139 ngây đối với bệnh nhân điều trị bằng capecitabỉn và 140 ngảy đối với bệnh nhân đỉều trị
bằng 5- FU/LV. Tống số 78 (13%) và 63 (11%) bệnh nhân đìều trị bằng capecitabin và 5- FUILV
ngừng điều trị do cảc cảc tác dụng ngoại ý Íbệnh tải phát nhiều lần. Tổng sô 82 bệnh nhân tử vong do
tất cả các nguyên nhân xuất hỉện trong cuộc nghỉẽn cứu hoặc trong vòng 28 ngảy dùng thuốc: 50
(8, 4%) bệnh nhân được chọn ngẫu nhiên dùng capecitabin và 32 (5,4%) bệnh nhân chọn ngẫu nhiên
dùng 5-FU/LV.
Ung thư vú
Kểt họp với DoceIaxel: Trong nhỏm điếu trị kết hợp capecitabin vả docetaxel đã sử dụng thuốc uống
capecitabỉn 1250 mg/m2 ngảy hai lần như trị liệu giản đoạn (2 tuần dùng thuốc và tìếp theo là 1 tuần
nghỉ điều trị) trong ít nhắt 6 tuần và tiêm tĩnh mạch docetaxel trong vòng 1 giờ với liều 75 mg/m2
trong ngảy đầu tiên cùa mỗi chu kỳ 3 tuần trong ít nhất 6 tuần Trong nhảnh trị liệu đơn bằng
docetaxel tỉêm tĩnh mạch trong vòng 1 giờ với lỉều 100 mg/m2 trong ngảy đầu tiên của mỗi chu kỳ 3
tuần và trong ít nhất 6 tuần. Thời gỉan điếu trị trung bình là 129 ngảy ở nhóm kết hợp vả 98 ngảy ở
nhóm trị liệu đơn Tổng số 66 bệnh nhân (26%) ở nhóm kết hợp và 49 (19%) ở nhóm nhỏm trị liệu
đơn rút khỏi nghiên cứu do cảc tác dụng ngoại ý. Tỷ lệ phần trăm các bệnh nhân phải giảm liều do
cảc tảc dụng ngoại ý là 65% trong nhóm kết hợp vả 36% trong nhóm trị liệu đơn Tỷ lệ phẩn trăm
bệnh nhân phải ngừng điều trị đo các tảo dụng ngoại ý ở nhớm kết hợp là 79% Việc ngừng điều trị là
một phần của chế dộ thay đổi liều đối với nhóm trị lỉệu kết hợp nhtmg không ảp dụng vởi những bệnh
nhân trong nhóm trị lỉệu đơn docetaxel. Thông háo cho bác sĩ điều trị các tảc dụng không mong
muốn gặp phải khi dùng thuốc.
Tương tác thuốc-thuốc
Thuốc chống đỏng: Sự thay đổi cảc chỉ số chốn g đông vả/ hoặc chảy mảu đã được bảo cáo trên những
bệnh nhân dùng đổng thời thuốc capecitabỉn với thuốc chống đông dẫn xuất coumarin ví dụ như
warfarỉn vả phenprocoumon. Các hiện tượng nảy xảy ra trong vòng vải ngảy và cho đến vải thảng sau
khi bắt đầu liệu pháp capecỉtabỉn và trong một sô ỉt trường hợp, trong vòng 1 tháng sau khi ngừng
dùng thuốc capecitabin Cảc hiện tượng nảy xảy ra trên những bệnh nhân có hoặc không có di căn ở
gan. Trong nghiên cứu tương tảc thuốc với liều đơn weưfarỉn, đã xảy ra hiện tượng tãng đảng kế trung
bình AUC cùa S-warfarin [xem Dược lý học lâm sảng]. Đã ghi nhận thấy chỉ sô INR tăng lên tối đa
91% Sự tương tác có thể là do ức chế cytochrome P450 2C9 bởi capecitabin vả/hoặc các chất chuyến
hoá của nó.
Phenytoin: Cẩn theo dõi chặt chẽ nồng độ phenytoỉn trên những bệnh nhân đang dùng capecitabin và
có thế cân giảm liều phenytoỉn [xem Liều lượng và Cách dùng]. Cảo bảo các hậu mãi đã cho thấy
có một vải bệnh nhện dùng capecỉtabin vả phenytoỉn đã xuất hiện các độc tính liên quan đến nồng độ
phenytoỉn tăng. Cảớ\iịghiên cứu chính thức về tương tảo thuốc-thuốc chưa được thực híện với
phenytoỉn, nhưng cơ chế tương tác thuốc có thể coi là do việc ức chế isoenzym CYP2C9 bởi
capecitabin vả/hoặc cạc,chất chuyến hóa của nó.
Leucovorin. Nổng ỔỄffl’fuorouracil tăng và độc tính có thể tăng lên do leucovorin. Tử vong do viêm
ruột hoại tù, tiêu ciÉty hoặc mẩt nước đã được bảo cảo trên những bệnh nhân cao tuổi dùng
leucovorin vả finorơuracil hảng tuần
Chất nền CYP2C9: Ngoài warfarỉn, hiện chưa có cảc nghiên cứu chính thức về sự tương tảc thuốc-
thuốc giữa capecitabin vả cảc chất nền CYP2C9 khác. Cần chủ' y khi dùng đồng thời capecitabin vởi
cảc chat nen CYP2C9.
T ưong tác giữa thuốc và thức ăn: Thức ãn lảm giảm cả tỷ lệ và mức độ hấp thu capecitabin [xem
Dược lực học]. Trong tất cả các thứ nghỉệm lâm sảng, cần hướng dẫn bệnh nhân dùng thuốc
capecitabỉn trong vòng 30 phủt sau bữa ăn. Khuyến cảo dùng thuốc capecitabin cùng với bữa ãn
[xem Liều lượng và cách dùng].
Phụ nữ có thai hoặc cho con bú:
Phụ nữ mang thai: Capecitabin có thể gây hại cho bảo thai khi dùng trên phụ nữ mang thai. Hiện
chưa có cảc nghiên cứu kiếm chứng đầy đủ về capecitabin trên các phụ nữ mang thai. Nếu dùng thuốc
nảy trong thời kỳ mang thai hoặc nếu bệnh nhân dự định có thai trong khi dùng capecitabin, bệnh
nhân cần được thông bảo về cảc nguy cơ có thế xảy ra đối với bảo thai. Phụ nữ nên được khuyên
trảnh có thai trong khi đang điều trị với capecitabin [xem Cảnh bảo và thận trọng].
Cho con bú: Chuột cái đang cho con bú dùng liều đơn thuốc uống capecitabin bải tỉết một lượng đảng
kể chất chuyển hóa capecitabin vảo trong sữa. Hiện vẫn chưa rõ liệu loại thuốc nảy có bải tiết qua sữa
ở người hay không. Do nhỉếu loại thuốc bải tiết qua sữa người và do các tác dụng ngoại ý nghiêm
trọng cùa thuốc capecitabin có thể xảy ra khi cho con bú, cân quyết định việc ngừng cho con bú hay
ngừng thuốc sau khi tinh tới tẩm quan trọng của loại thuốc nảy đối với các bả mẹ.
Sử dụng trên trẻ em: Chưa rõ độ an toân và hiệu quả của thuốc capecitabin trên trẻ em <18 tuối.
Sử dụng ở người cao tuối: Cảc bác sỹ cần theo dõi chặt chẽ các tảo dụng ngoại ỷ cùa thuốc
capecitabin trên người cao tuổi [xem Cânh bảo và Thận trọng].
Suy giám chức năng gan: Cẩn chú ý khi cảc bệnh nhân có rối ioạn chức năng gan ở mức độ nhẹ đến
vừa phải do di căn gan được điều trị với capecitabin. Chưa biết rõi anh hưởng của rối loạn chức năng
gan trầm trọng lên capecitabin [xem Cảnh báo và Thận trọng và Dược lực học].
Suy giám chức năng thận: Các bệnh nhân suy thận ở mức độ vừa phải (độ thanh thải creatinin =30
đến 50 mL/ phút) và nặng (độ thanh thải creatinin <30 mL/phút) có mức phơi nhiễm cao hơn với
capecỉtabin, 5-FDUR vả FBAL so với cảc bệnh nhân có chức năng thận binh thường [xem Chống chỉ
định, Cảnh báo và Thận trọng, Liều lượng và cảch dùng và Dược lực học].
Ănh hưởng của thuốc đến khả nãng lái xe và vận hânh mảy móc:
Thuốc có thể gây chóng mặt, mệt mỏi và buồn nôn. Bệnh nhân cần thận trọng đánh gỉá ảnh hưởng
của thuốc trước khi quyểt định lái xe hay vận hảnh mảy móc
Quả liều:
Các hiện tượng quá liếu cấp tính bao gồm buồn nôn, nôn, tiêu chảy, khó chịu đường tỉêu hóa và chảy
máu và thỉếu hụt tủy xương. Việc xử lý hiện tượng quá liều bao gồm cảc can thiệp y tế hỗ trợ thông
thường nhằm điều chinh cảc hiện tượng quá liếu trên lâm sảng. Mặc dù chưa có cảc bảo cảo vê cảc
kinh nghiệm lâm sảng sử dụng lọc máu như lá cảch điều trị hiện tượng quá liều do dùng thuốc
capecitabin, việc lọc mảu có thế có lợi trong việc giảm nồng độ lưu thông của S’-DFUR, một chuyến
hóa của hợp chất thuốc gốc có trọng lượng phân từ thấp.
Cảc liều đơn capecitabin không gây chết chuột cải và khi với liều lên đến 2000 mg/kg (2,4, 4, 8, và
9,6 lần liếu khuyến cáo hảng ngảy ở người dựa trên mg/m2). \ /
Hạn dùng: 24 thảng kể từ ngảy sản xuất. Không dùng thuốc sau ya et hạn được ghi trên vỏ hộp.
Bảo quản: Bảo quản thuốc ở nhỉệt dộ <300 C, tránh am. Đế thuốc mtay trẻ em.
Đỏng gỏi: Hộp chứa 3 ví x 10 viên.
Tiêu chuẩn thânh phẫm: Tiêu chuẩn nhà sản xuất.
Tên và địa chỉ nhà sản xuất: Hetero Labs Limited, Unit — VI, Sy. No. 410& 411 APIiC Formulation
SEZ, Polepally village, Jadcherla Mandal, Mahaboobnagar Dis ' Andhra Pradesh, An-độ.
PHÓ cục muớne
ỌJVMỗ~ÓẮỄJCJỞv
(
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng