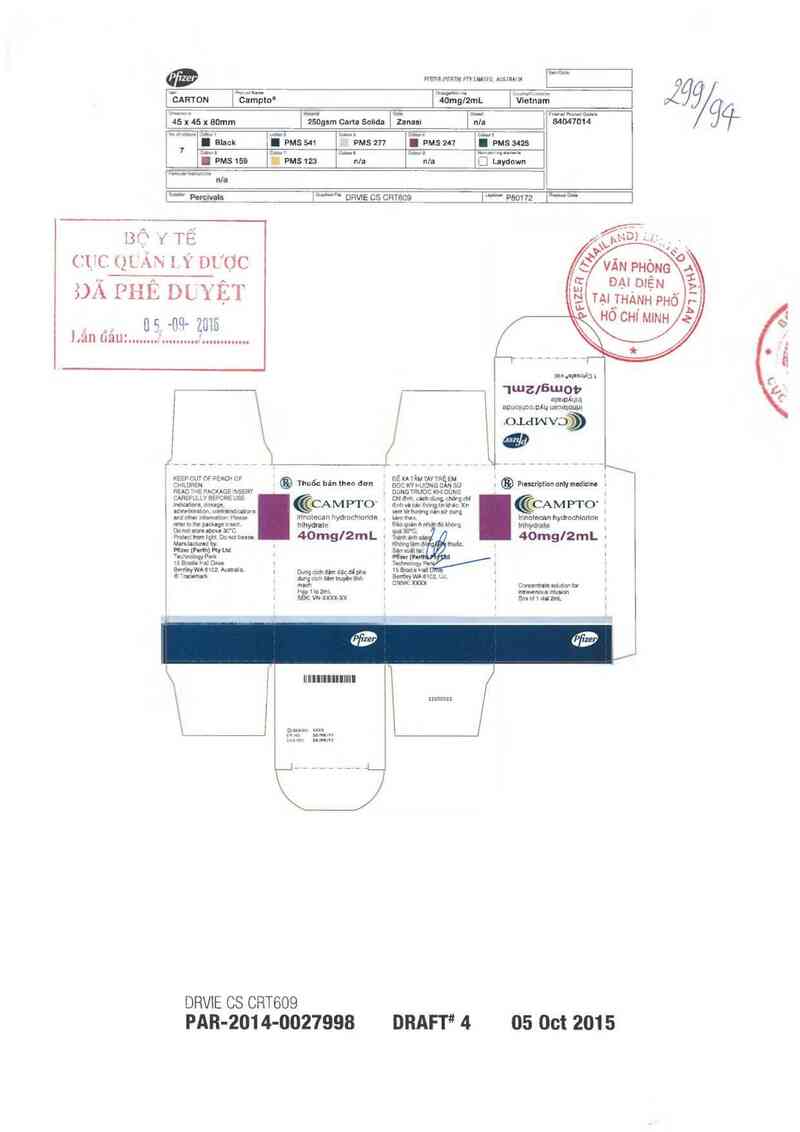




















@
PFIIFMPFWHỊ PTYIWIHD AISIMHJ
w %«xmumn ửuW n ữmlrufrwnm Z `
| CARTON Campto' l 40mgI²mL Vletnam I
I w……. … Hu on… } r… Mo:l…
[ 45 x 45 x 80mm [ ²50gsm Oarta Solìda l Zanasi n/a ỉ 84047014
- 4… ầwi w…s En…— cd-Q
[ Black I PMS 541 pms 211 . PMS zu I ms 3425
1 zu: rzdul :.aun lenm~~rqlm
I PMS159 ỉ Pms12a nla n/a [] Laydown
~mnAylmmlzm
\ n/a 1x
[“… Perckvlls ““…“ DRVIE cs cmeos |-… PBO172 [“…—²“ ]
BỐ « TỂ
CỤC QL'AN I.Ý DI"ỢC
VẢN PHÒNG
ĐAI DIỆN
TAI THANH PH
HỔ CHI MINH
ỉ)APh ÊDLìẸi
ủẽ -UQ- Zũìỉì
Lam cìảuz....….l ..
o,
uucu nuun-uu
ll!^ .nlwzưo z
1…zJBmgv
mmpÁuuị
apuogucmpAu ueneịquỊn
—`Ềl
___..J
\
r~—————Aý—ý—v ..._...- ------------
KEEP cm OF l²EACH CF ~ ., . né XA ỊMTAYTn EM ^ . . '
CMLDREN ® Thuoc han lhen đơn mc KÝ HUONG DỀN sử . @ Pmserlpnon nnly madlcìnl .
ễẵAD ME PACKAGE ịNSERY DUNGTFUÙC KHI DÙNG
. YBEFORE USE chì dd-. cù:h củng ưởsg đ! _
râĨẵẩ… …… CỂCAMPTO ………k…gnnủ ›… éCAMPTO
:d…vaum. «mha’mẹulìưa mm lờ hương unn … uunq
ưd dhlr `nlanrxmlnu Huu lrlnolecan hydrochlonde . `um ma.!hn lnnotean hydruchlorida
rulev … me pnc«nge |mễn. trihydmte Bin quin h nh mo khỏra mnydraiu
Do ml stars m. JC“ ul WC
Pmtecthomhcht Domueue. 40mgl2mL | 3… nMW _ 4omglsz
Mimllclurud by: \ Khong Ibn Oa M.
Pfizu (PlHM Ply Lm ShMII
Tncr Flbu (F:
1² RW Fli1Dlw:
BmkyWAsvũ² Acada
Tnchndnqy PuEmr/
Dung cịd1 dl… nc di pha 15Bmdm hd
BemkyWA mz. ư,
. … cích di… Imyan DNNK:
| ìUOOt
Ml'ãmìọ
l SĐK VN-XXlX-XX
e frmuk
Cơurứlìl sdưmn Ia
u…nơ,sme
BC! 01 I vill ²nt
«@ «@
\ Illllllllllllllllll
znuenu
g.…nn nn
! - m› nm…v
umum
::… …
DRVÌE CS CRTBO9
PAR-2014-0027998 DRAFT" 4 05 Oct 2015
nnm Cau:
@ pnzen ranm; … uwrso. AUSTHAUA
líun Product Nlnc DasaguNeĩume szừy/Gonlractnr
LABEL Campto® 40mgl2mL Wetnam
D-mcnsìor-s Pml Dlmonmns Ma…lll Adhulvu Wmđing anđ Product Codds
60 x 10mm 60 x 25mm Polypropylene Permanent O/S R/H Lead 84047014
Nu nl coths 0clơưr 1 cm… 2 Cclnư 3 Colou A Cdcur 5
[ Black I PMS 541 I PMS 247 | PMS 3425 I PMS 159
6 Calouv e Colour 7 Coloư O Colour 9 Nm-pmbng uhm…
. PMS 123 nla nla nla [] Laydown
Part culxhnmclens _ _ '
Barcode continuous. not die-cut. Dlgttal pnnt.
|…” Supa Stik [°'Wm DRVI CP L40 ““……
VĂN PHÒNG
ĐAI D»ỆN
TẬI THÀNH PH
HỒ CHÍ MINH
›
ịlHllllllllllllllũl
ủ’gâ ~® xxxx
n……— ~
gmm bblNH/VY
suumusxz ImINMIVY
CỆCAMPTO'
mm…uwm …n:
M
ả9J…"ẽLì"k m.....uf o
DRVI CP L4O
PAR-2014-0022622 DRAFTịlt 3 05 Aug 2014
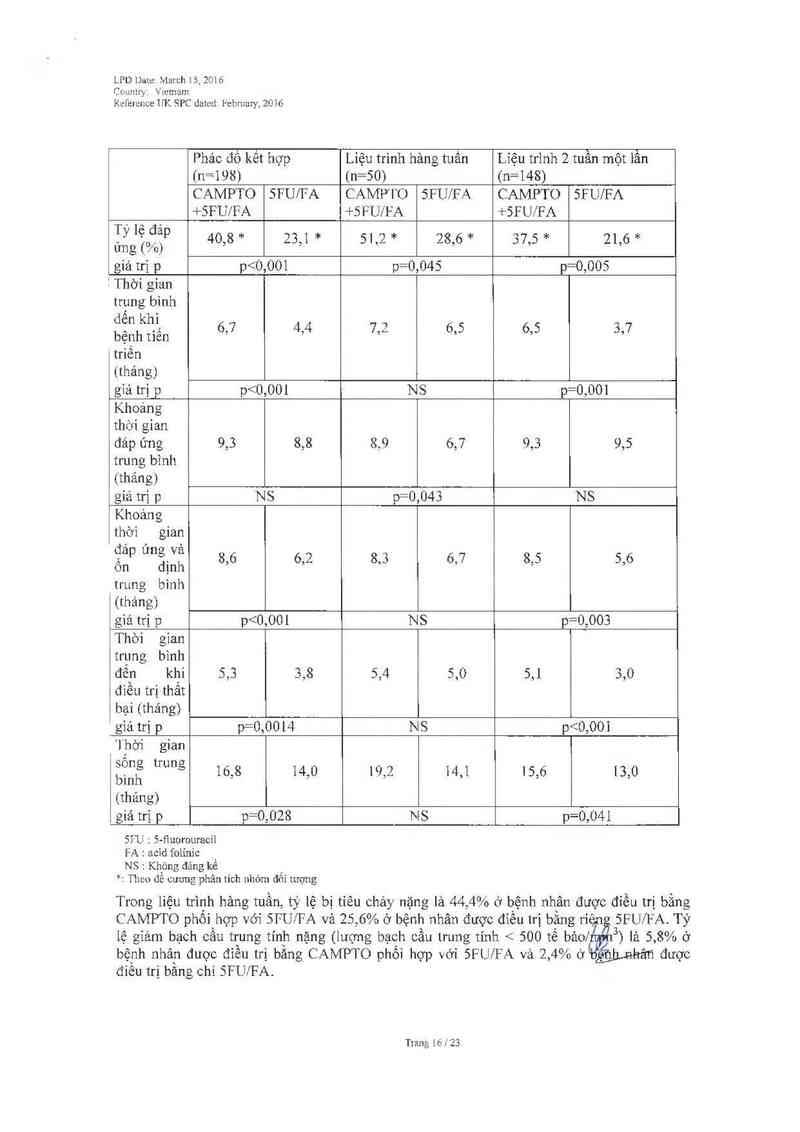
LPD Date. March 15.7.016
Country Vietnam
Reference UK SPC dated. February. 2016
vi… PHÒNG
ĐAI DIỆN
TAIJHÀNH PH
HO cui MINH
›
CAMPTO®
Irinotecan hyđrochlorid trihydrat `
(Dung dịch đậm đặc đê pha dung dịch tiêm truyền)
Rx
CẢNH BÁO ĐẶC BIỆT:
Thuốc nảy chỉ dùng theo đơn của bác sĩ.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Không dùng quá lỉều chỉ định.
Thôn bâo cho bảc sĩ những tảc dụng không mong muốn gặp phải khi sử dụng thuốc.
Nếu can thêm thông tin xin hỏi ý kiển bác sĩ.
Không sử dụng thuốc đã quá hạn dùng.
Để xa tầm tay trẻ em.
1. TÊN THUỐC
CAMPTOE 20 mg/ml, dung dịch đậm đặc để pha dung dịch tiêm truyền.
z. THÀNH PHẨN ĐỊNH LƯỢNG VÀ ĐỊNH TÍNH
Dung dịch đậm đặc chứa 20 mg/ml irỉnotecan hydrochlorid, trihydrat (tương dương vởỉ i7,33
mg/ml irinotecan). Lọ C AMPT O chửa 40 mg hoặc 100 mg irinotecan hydrochlorid, trihydrat.
Thông tin về tả dược, xin xem mục 6.1.
3. DẠNG BÀO CHẾ
Dung dịch đậm đặc để pha dung dịch tiêm truyền.
4. ĐẶC TÍNH LÂM SÀNG
4.1. Chỉ định điều trị
C AMPTO được chỉ định để điều trị cho bệnh nhân ung thư ruột kết - trực trảng tiến triển:
0 Phối hợp với 5-fiuorouracil vả acid folinic ở bệnh nhân ung thư ruột kết - trực trảng tiến
triên chưa hóa trị liệu trước đó,
o Lả liệu phảp đon Itrị liệu cho bệnh nhân không thảnh công với phác đồ điều trị chứa 5-
fluorouracil dã thiêt lập.
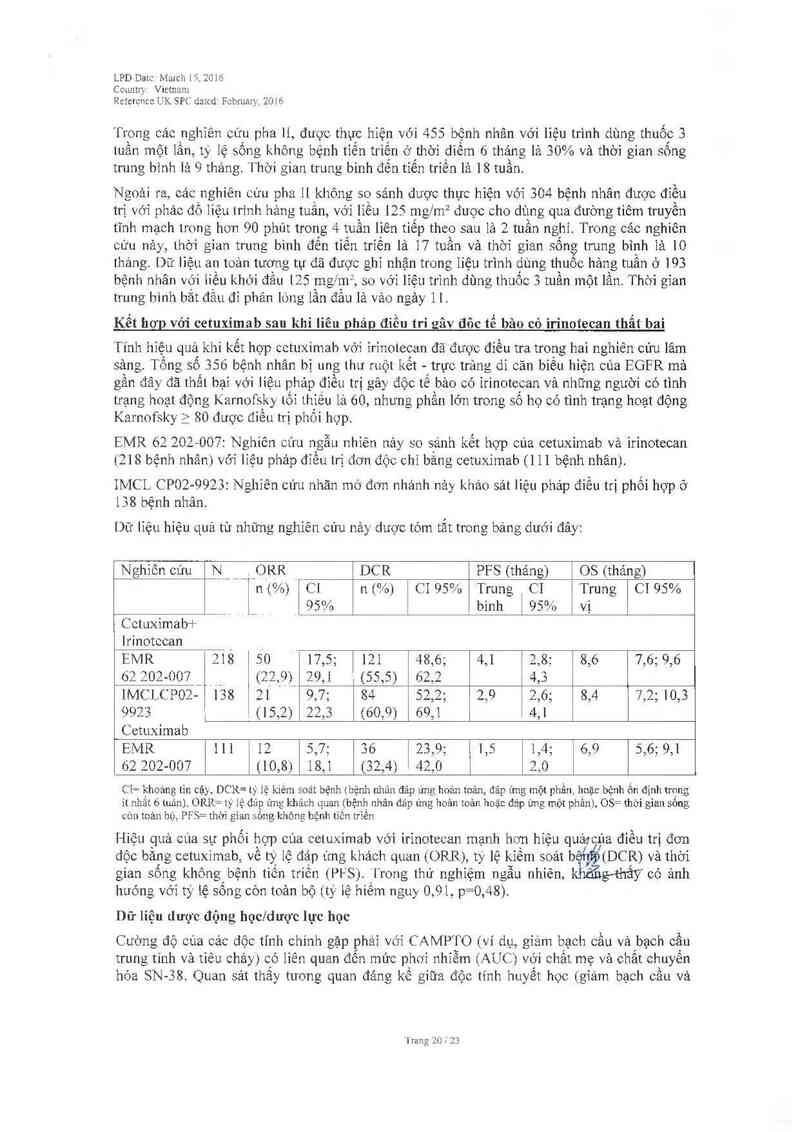
CAMPTO phối hợp với cetuxìmab được chỉ địnhqđiều trị cho bệnh nhân bị, ung thư ruột _kết -
trực trảng di căn với gen KRAS wild-type, có biêu hiện của thụ the ìu tô tăng sinh biêu bì
( EGFR — ẹpỉdermal growth factor receptor), chưa được điều trị ung mỳcăn trước đó hoặc
sau khi thât bại với liệu pháp thuốc gây độc tê bảo chứa irinotecan (xe mục 5.1).
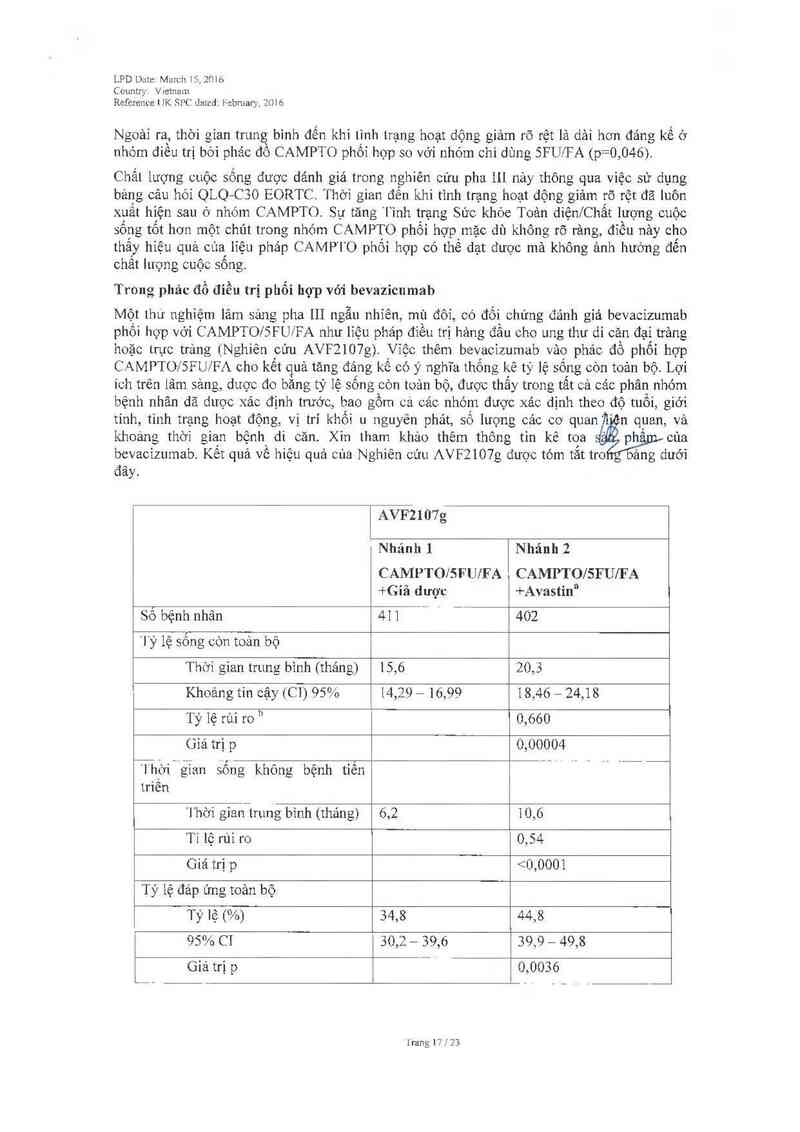
CAMPTO phối hợp với S-f1uọrouracil, acid folinic vả bevacizumab được chỉ định điểu trị đầu
tay cho bệnh nhân ung thư bỉêu mô ruột kêt hoặc trực trảng di căn.
CAMPTO phối hợp với capecitabjn, có hoặc không có bevacizumab để điều trị đẫu tay cho
bệnh nhân ung thư bỉêu mô ruột kêt - trực trảng di căn.
Trang ] /23
LPD Date. March [5` 2…6
Country Victnam
Reference UK SPC đatcđ~ February, 2016
4.2. Liều dùng và cách dùng
Chỉ dùng thuốc cho người lớn. Dung dịch tỉêm truyền CAMPTO nên dược truyền vảo tĩnh
mạch ngoại biên hoặc lrung tâm.
Liều dùng khuyến nghị:
Trong điều tri đơn dôc ( cho bênh nhân đã đuo~c điều tri trước đó): Liều khuyến nghị cùa
CAMPTO lả 350 mgỉm² dùng qua đuờng truyền lĩnh mạch trong khoảng thời gian từ 30 đến
90 phút ba tuần một iần (xem mục 6. 6 vả mục 4 4)
l'ronfz điều tri nhối hơp (cho bênh nhân chưa đươc điều tri trước đó): Sự an toản vả hiệu quả
của CAMPTO khi phỏỉ hợp với 5—tluorouracil (5FU) vả acid folinic (FA) đă được đánh giả
qua liệu trình điêu trị sau đây (xem mục 5.1):
. CAMP'I`O phối hợp với 5FlJ/FA trong liệu trinh dùng thuốc 2 tuần một lần
Liều khuyến nghị cùa CAMPTO lảịi 80 mg/m² dùng 2 tuần một lằn qua dường truyền tĩnh
mạch trong khoảng thời gian từ 30 đên 90 phút, sau đó truyên acid folinic vả 5—fiuorouracỉl.
Dế biết liều lượng và cách dùng của cetuximab dùng đồng thời, tham khảo thông tìn kê toa
cùa cetuximab.
Thông thường, liều ỉrinotecan được dùng tưong tự như Iiều đã dùng trong chu kỳ cuối cùng
cùa phảc đô chứa irinotecan trước đó. irinotccan chỉ được dùng sớm hơn 1 giờ sau khi kêt
thúc truyền cctuximab.
Dế biết liều lượng vả cảoh dùng của bevacizumab, tham khảo thông tin kê toa của
bcvacìzumab.
Đê biết liều lượng và cách dùng khi phối hợp vởi capecitabin, xem mục 5.1 và tham khảo các
thông tin thích hợp trong thông tin kê toa của capecitabin.
Điều chỉnh liều:
C AMPTO nên được đùng sau khi tất cả cảc tảc dụng không mong muốn hồi phục về đến cẳp
0 hcặc [ theo phân loại của NCI—CTC (Tiêu chuân vê`Dộc tính Chung cùa Viện Ung thư
Quôc gia UC) và khi tình trạng tiêu chảy liên quan đên đỉêu trị đã được giải quyêt hoản toản.
Khi bắt đầu liệu pháp điều trị tiếp theo, iiều CAMPI 0 và SFU nếu dùng, nên được giảm theo
cấp xấu nhắt của tảo dụng không mong muốn quan sảt thầy trong lằn tiêm truyền trước. Nên
điều trị chậm iại từ ] dến 2 tuần để hồi phục từ các tác dụng không mong muôn liên quan đến
điều trị
Với các tác dụng không mong muốn sau đây nên giám liều từ 15 đến 20% CAMPTO vả/hoặc
5FU nêu cân:
o Độc tính về huyết học (giảm bạch cầu tnmg tính cấp 4, giảm bạch cầu trung tính kèm sốt
(giảm bạch câu trung tính câp 3 — 4 và sôt câp 2 — 4), giảm tiêu câu vả giảm bạch câu (câp
4),
. Độc tính không phái huyết học (cẳp 3 — 4).
Khuyến nghị sửa đối liều cetuximab khi dùng kết họp vởi irìnotecan phải tuân theo thông tin
lhông tin kê toa cùa cetưxỉmab. a …
Kết hợp vói capccitabin cho bệnh nhân từ 65 tuối trở lên. nên giảm] liều.Ểapecịtabin khởi đầu
xuống 800 mgf²m hai iẩn mỗi ngảy theo thông tin kê toa cùa capec1tabtđ’ T'hẵn khảo khuyến
Tuang 2 23
LPD Datc March 15. 201c
Country Victnam
Rct'crcncc UK SPC datcd' February. 2016
nghị sưa đối lỉều trong phảc đồ điều trị kết hợp được cung cấp trong thông tin kê toa cúa
capecitabỉn.
Khoảng thời gìan điều trị:
Nên tiếp tục điềthrị hằng CAMPTO đến khi bệnh đạt được mưc tiến triến mục tiêu hoặc có
độc tính không thê châp nhận.
Các nhóm đặc biệt:
Bênh nhân bi suv chửc năng 2an: Trong đỉều trị đơn độc: Nồng độ bilirubin huyết (lên đến 3
lần giới hạn trên cùa phạm vi bình thường (UNL)) ở bệnh nhân có tỉnh trạng hoạt động 5 2,
nên xác định liều Campto khởi đầu. Ở những bệnh nhân bị tăng bilirubin huyết vả thời gian
prothrombin nhiều hơn 50%, độ thanh thải irinotecan giảm (xem mục 5.2) và do đó nguy co
nhỉễm độc huyết tăng lên. Do đó nên tìến hảnh theo dõi hảng tuần công thức mảu trong nhóm
bệnh nhãn nảy.
o ` Ở bệnh nhân có bilirubin lên đến 1,5 lẩn giởi hạn trên cùa phạm vi binh thường ( ULN),
iiêu CAMPTO khuyên nghị là 350 mg/m²,
. ò bệnh nhân có bỉlỉrubintừ 1,5 đến 3 iần ULN, liều CAMPTO khuyến nghị là 200 mg/m²,
- Bệnh nhân có bilirubin vượt quá 3 iẩn LJLN không nên được điều trị bằng CAMPTO [xem
mục 43 vả mục 4.4).
Không có vsẵn dữ liệu ở bệnh nhân bị suy gan được đỉều trị bằng CAMPTO trong liệu pháp
điêu trị phôi hợp.
Bênh nhân bỉ suv giảm chức năng thân: CAMPTO không được khuyến cảo sử dụng ở bệnh
nhân bị suy chức năng thận, do cảc nghiến cưu trong nhóm nảy chưa được thực hiện (xcm
mục 4.4 và mục 5.2).
N_qườỉ cao tuối: Chưa thực hỉện nghỉên cừu dược động học cụ thế,ớ người cao tuổi. Tuy
nhiên, liêu dùng nên được chọn lựa cân thận trong nhóm nảy do tâlể ât gìảm chức năng sinh
học cùa họ cao hơn. Nhóm nảy phải được gỉảm sảt chặt chẽ hơn (xe' _
4.3. Chống chỉ định
0 Bệnh viêm ruột mạn tinh vả/hoặc tắc ruột (xem mục 4.4).
0 Tiền sử có phản ứng quá mẫn nghiêm trọng với irìnotecan hydrochlorid trihydrat hoặc một
trong các tá dược cùa CAMPTO.
0 Phụ nữ cho con bú (xem mục 4.6 và mục 4.4).
0 Bilirubin > 3 lần giới hạn trên cùa phạm vi bỉnh thường (xem mục 4.4).
0 Suy tùy xương nặng.
0 Tỉnh trạng hoạt động WHO > 2.
0 Sử dụng đồng thòi với St J ohn’s Wort (xem mục 4.5).
Để biết thêm thông tin chống chi định của cetuxỉmab hoặc bevacizumab hcặc capecitabỉn,
tham khảo thông tin kê toa cùa cảc sản phãm nảy.
Trang 3 l23
LPD Date March 15I 20iỏ
Cuuntry Vlêũ'lũm
Reference l_Hx' SPC dated February, 2016
4.4. Cánh bảo và thận trọng đặc biệt khi sử dụng
Chi nên sử dung CAMPTO ó các đon vị chuỵên về hóa trị liệu các chẩt gây độc tế bảo và chỉ
nên được dùng đướỉ sự giảm sát của một thầy thuốc đủ năng iưc trong vỉệc sư dụng hóa trị
liệu chống ung thư.
Do tinh chắt vảtv tvlệ tác dụng khộng mong muốn C` AMPTO sẽ chỉ được kê đơn trong cảc
trường hợp sau đây sau khi cân nhắc nhũng lợi ich dụ kỉến mang lại vượt trội so với cảc nguy
cơ có thế có khi trị liệu:
o Ô hệnh nhân có một yếu tố nguy cơ, đặc biệt là nhũng người có tình trạng hoạt động WHO
= 2.
o Trong một số ít truờng họp hiếm gặp khi mà bệnh nhân dường như không theo được
những chỉ dẫn kiếm soát cảc tảo dụng không mong muốn (cần đỉều trị tiếu chảy ngay lập tửc
và kéo dải kết hợp uống/truyền nhìổu nước khi bắt đầu xuất hiện tiếu chảy muộn) Khuyến
cáo cần có giảm sát chặt chẽ tại bệnh viện cho cảc bệnh nhân nảy
Khi sư dụng trong điều trị dơn dộc, CAMPTO thường được kê đơn với liệu trình dùng 3 tuần
niột lân. Tuy nhiến, líệu trình dùng hảng tuân (xem m ục 5) có thế được- cân nhăc ở bệnh nhân
cân theo đõi chặt chẽ hơn hoặc bệnh nhân có nguy cơ giảm bạch câu trung tính nghiếm trọng.
Tiêu chây muộn
Bệnh nhân cần được cho biết về nguy cơ bị tiêu chảy muộn xảy ra sau hon 24 giờ sau khi
dùng CAMPTO vả vảo bất cứ iúc nảo trước chu kỳ tiếp thoo. 'I`rong điều trị đon độc, thời
gian trung bỉnh của tình trạng bắt đầu đi phân lòng đầu tiên là vảo ngảy thứ 5 sau khi truyền
C A".MPTO Bệnh nhân phải nhanh chóng thông báo cho bác sĩ cùa họ khi bị tỉêu chảy vả bất
dầu diếu trị thich hợp ngay lập tức
Bệnh nhân có nguy cơ tiêu chảy tăng lả những người đã được xạ trị bụng/chậu trước dó,
nhưng nguời dã bị tăng bạch cầu từ ban đầu, những ngưòi có tinh trạng hoạt động > 2 và phụ
nu. Nếu thông đưọc điếu trị thích hợp, tiêu chảy có thể đe dọa tính mạng, đặc bỉệt lả nêu
bệnh nhân đồng thời cũng bị giảm bạch cầu trung tĩnh.
Ngay sau lần đi phân lỏng đầu tiên, bệnh nhân nên bắt đầu uống một lượng lớn đồ uống có
chứa chất điện gỉải vả thục hiện ngay lập túc liệu phảp điều trị liêu cháy thich hợp. Biện pháp
điều trị tiếu chảy nảy phải đuợc chỉ định bới khoa phòng đã cho dùng CAMPTO. Sau khi xuât
viện, cần cắp cho bệnh nhân các thuốc theo đơn để họ có thể điều trị tiếu chảy ngay khi bị
Ngoài ra, họ phải thông báo cho bác sĩ của họ hoặc khoa cho dùng CAMPTO khi/nếu bị tiêu
chảy.
Biện phảp điều trị tiêu chảy hiện đang duọc khuyến các lá sủ dụng lỉầu loperamid cao (4 mg
cho lần uõng đầu tiên vả 2 mg sau môi 2 giờ). Nên liếp tục liệu pháp ấÍgJ trị nảy trong 12 giờ
sau lần đi phân lóng cuối cưng và không nên điều chính. '[rong mg ọ~p lopcramid
không nên được dùng hơn 48 giờ liên tục ở nhũng liều điều trị nảy, vả cũng không nên dùng it
hon 12 giờ do nguy cơ bị liệt ruột.
Ngoài điều trị chống tiêu chảy, nên dùng một khảng sinh phố rộng dự phòng, khi tiêu chảy có
liên quan với giảm bạch cầu trung tính nghiêm trọng (lượng bạch câu trung tinh < 500 tế
bảo/rnmJ).
Ngoài điều trị bằng kháng sinh, khuyến cáo bệnh nhân nhập viện để kiếm soát tiêu chảy, trong
các trường họp sau đây:
… Tiêu chảy kết hợp với sốt,
Trang 4 ’23
LPD Date March ]5 2016
L'Ĩ'ountw. Vletnam
[lcierence UK SPC dateđ. February, 2016
— Tiêu chảy nặng (cần truyền nước qua đường tĩnh mạch),
- Tiêu chảy kéo dải hơn 48 giờ sau khi bắt đầu điều trị bằng lopcramid liếu cao.
Không nên dùng loperamíd để dự phòng, ngay cả ở bệnh nhân từng bị tỉếu chảy muộn trong
cảc chu kỳ trước dó.
Ô bệnh nhân bị tiêu chảy nặng, nên giảm liếu Ở các chu kỳ tiếp theo (xem mục 4.2).
Huyết học
Trong các nghiên cứu lâm sảng, tần sưắt giám bạch cầu trung tính cẩp 3 và 4 theo NC! CTC
cao hơn rõ rảng ở bộnh nhân được xạ trị vùng chậu/bụng trước đó so với những người đã
không được xạ trị. Bệnh nhân có tông nông độ bilirubin trong huyêt thanh ở thời điêm ban
đâu là 1,0 m gi’dL hoặc cao hon cũng có khả năng cao hơn đảng kê bị giám bạch câu trung tính
câp 3 vả 4 trong chu kỳ đâu tiên so với nhũng người có nông độ bỉlirubin thâp hơn I.,0 mgi'dL.
Nên theo dõi hảng tuần công thức máu toản phẩn trong quả trinh điều trị bằng CAMPTO.
Bệnh nhân cân phải được bỉêt trước nguy cơ giảm bạch câu trung tính vả sôt. Giảm bạch câu
trung tính kèm sôt (nhiệt độ > 38°C và lượng bạch cầu trung tính 3 1.000 tê bảo/mm²) nên
được điêu trị khân câp tại bệnh viện băng kháng sinh phô rộng qua đường tĩnh mạch.
Ó bệnh nhân có các phản ứng huyết học nặng, nến giảm liếu dùng cho lần dùng tiếp theo
{xem mục 4.2).
N guy cơ nhiễm trùng vả nhiễm độc huyết tảng ở bệnh nhân bị tiêu chảy nặng. Ở bệnh nhân bị
tiêu chảy nặng, nên kiêm tra công thức máu toản phân.
Suy gan
Nên thực hiện xét nghiệm chức năng gan lủc ban đầu vả trước mỗi chu kỳ.
Nên theo dõi hảng tuần công thức máu toản phần ở bệnh nhân có bilirubin từ 1,5 dến 3 lần
ULN, do giảm dộ thanh thải irinotecan (xem mục5.2) và do đó tãng nguy cơ nhiễm dộc huyêt
trong nhóm nảy. Vởi bệnh nhân có bilirubin > 3 lân ULN (xem mục 4.3).
Buồn nôn vả nôn
Nên điều trị dự phòng bằng thuốc chống nôn trước mỗi lần điếu trị bằng CA MPTO. Buồn nôn
vả nôn đã được báo cảo thường xuyên. Bệnh nhân bị nôn kèm tỉêu cháy muộn cần phải nhập
viện cảng sởm cảng tôt đê điêu trị.
Hội chứng cholinergic cẩp
Nếu xảy ra hội chứng cholinergỉc cấp tính (đuợc xảc định gồm tiêu cháy sớm vả nhiếu dấu
hiệu vả cảc triệu chưng khảc nhau như vã mô hôi, đau quặn bụng, co đồng tử vả tiết nước
bọt), nên cho dùng atropin Sulphal (0,25 mg tiêm dưới da) trừ khi bị chống chỉ định trên lâm
sáng (xem mục 4. 8)
Có thể quan sảt thấy những triệu chủng nảy trong hoặc ngay sau khi ủquềh irinotecan, các
triệu chứng nảy được cho iả có liên quan đến hoạt tính kháng choii crase của chất gốc
irinotecan, và được cho là sẽ xảv ra thưởng xuyên hơn với các liều ưinot eartĩão hơn.
Cần thận trọng ở bệnh nhân bị hen suyễn. Ở bệnh nhân bị hội chứng cholinergic nặng và cẩp
tính, nên sử dụng atropin sulphat dự phòng với các liêu C AMPT O tiêp theo.
Rối Ioạn hô hẫp
Bệnh phồi mô kẽ xuất hiện dưới dạng thâm nhiễm phối không hay xảy ra trong điều trị bằng
irinotecan. Bệnh phồi mô kê có thể gây tử vong Cảc yêu tố nguy co có thề iiên quan tới sự
Trang 3 x“ 23
LPD Date. Match 1:12016
Countly Victnam
Reference UK SPC datcd~ February. 201ỏ
tiến triến cúa bệnh phối mô kẽ bao gồm việc sư dung các loại thuốc nhiễm độc phồi, xạ trị và
các yếu tố kich thích khuấn lạc Bệnh nhân có yêu tố nguy cơ cần được theo dõi chặt chẽ đối
vói các triệu chúng hô hẩp trước vả trong khi điếu trị bằng ìi~ìnotecan.
Thoát mạch
Mặc dù irinotccan không phải là chẳt lảm rộp da, cẩn thận trỌng để tránh thoát mạch và cằn
theo dõi dân hiện viêm ở vị trí tiêm truyên. Nêu xảy ra hiện tượng thoát mạch, nên rừa sạch vị
trí tìôm truyền vả chưòm đả.
Người cao tuổi
Do tần suất lảrn giảm chức năng sinh học cao hơn ở bệnh nhân cao tuổi, đậc biệt lả chức năng
gan, nên thận trọng lụa chọn liếư CAMPTO cho nhóm nảy (xem mục 4.2).
Bệnh viêm ruột mạn tính vâlhoặc tắc ruột
Bệnh nhân không được điều trị bằng CAMPTO nếu chưa điều trị xong tắc- ruột (xem mục
4.3).
Chức nãng thận
Đã quan sát thấy có sự tăng creatinin trong huyết thanh hoặc nitơ urê trong máu. Đã có những
trường hợp suy thận cấp. Các tác dụng nảy thường được cho lả do biến chứng nhiễm trùng
hoặc do mất nước liên quan đốn buốn nôn, nôn, hoặc tiêu chảy. Các trường hợp hiếm gặp bị
rối loạn chức năng thận do hội chứng ly giải khối u cũng đã được bản cáo.
Liệu pháp xạ trị
Bệnh nhân mả trước đó đã được xạ trị vùng chậulbụng có nguy cơ suy tủy cao hơn sau khi
cho dùng irinotecan. Bác sĩ nên thận trọng khi điếu trị bệnh nhân được xạ trị nhiếu trước đó
(ví dụ >25% tủy xương được xạ trị vả trong vòng 6 tuần trưởc khi bắt đầu điếu trị bằng
irinotecan). Có thế áp dụng điều chinh liếu cho nhóm nảy (xem mục 4.2).
Rôí loạn tim
Dã quan sát thấy các tác- dụng lhiếu máu cục bộ cơ tim sau điếu trị bằng irinotecan xuất hiện
chủ yêu ở những bệnh nhân có bệnh tim tiêm ân, các yêu tô nguy cơ bệnh tìm mạch khác đã
biêt, hay bệnh nhân đã được hóa trị lìệu gây độc tế bảo trước đó (xem mục 4.8).
Do đó, bệnh nhân có các yếu tố nguy cơ đã biết cần được theo dõi chặt chẽ, và cần có hảnh
động để cố gắng giảm thiểu tất cả cảc yếu tố ngưy cơ có thế điếu chỉnh được (ví dụ nhu hủt
thuốc lả, tăng huyết áp, vả tăng mỡ mảu),
Rối loạn mạch máu
Irinotecan hiếm khi liên quan dến các tảo dụng nghẽn mạch do huyết khối (nghẽn mạch phổi.
huyết khối tĩnh mạch vả nghẽn huyết khối động mạch) ở bệnh nhân có nhiếu yêu tố nguy cơ
ngoải khối u tiềm ần gây nên.
Tảc đụng ức chế miễn dịch/tăng nguy cơ bị nhiễm khuẩn
Cho dùng vắc xin sống hay vẳc xin sống đã được lảm suy yếu ở bệnh nhân suy giảm miễn
dịch do các tác nhân hóa trị liệu bao gôm irinotecan, có thế dân đên llĩ ếm khuân nghìêrn
trọng hoặc gây tử vong. Nên tránh tiêm chùng văc xin sông cho bệnh dùngirỉnotecan.
Có thế cho dùng văc xin chêt hoặc bât hoạt; tuy nhỉên, đảp ứng vởi các xin nảy có thế bị
suy yêu.
Trang 6 J' 23
LPD Date March 15, 2016
L`nuntija Vlctnam
Reference UK SPC daicd Fcbmarv 2016
Các thận trọng khác
Do thuốc nảy có chứa sorbitol, nó không thích hợp cho bệnh nhân không dung nạp fructose di
truyền.
Không thường xuyên quan sảt thẩy các trường hợp bị sưy thận, hạ huyết ảp hoặc suy tuần
hoản ở bệnh nhân có cảc giai đoạn mắt nước liên quan đến tiếu chảy vả/hoặc nôn, hoặc nhiễm
trùng huyết.
Phải thục hiện các biện pháp tránh thai trong quá trình điếu trị và trong it nhất ba thảng sau
khi ngung điếu trị
Nên trảnh dùng đỗng thời irinotecan với một chất ủ~c chế mạnh (ví dụ như ketoconazol) hoặc
chât gây cảm ứng (ví dụ như rifampicin, carbamazepin, phenobarbital, phenytoin, câv St
John' s) cúa CYP3A4 do có thế 1ảm thay đổi sự chuyến hóa irinotecan (xem mục 4 5).
4.5. Tương tác với cảc thuốc khác và các loại tương tác khác
Tương tảc giữa irinotecan vả các chắt chặn thần kinh cơ không thế được Ioại trù: Do
CAMPTO có hoạt tính khảng cholinesterase, cảc loại thuốc có hoạt tính kháng cholinesterase
có thế kéo dải tác dụng chặn thẩn kinh co cùa suxamcthonium và đối kháng tác dụng chặn
thần kỉnh cơ của cảc ioại thuốc không khử cực.
Một số nghiên cứu đã cho thấy dùng đồng thời cảc thuốc chống co giật gây cảm ứng CYP3A
[ví dụ như carbamazepin, phenobarbital hoặc phenytoin) dẫn đến giảm phơi nhiễm irinotecan,
SN-38 vả glucuronid SN-38 vả giảm tảo dụng dược 1ực. Các tác dụng của các loại thuốc
chống co giật nảv được phán ảnh bời mửc giám AUC của SN— 38 vả SN -38G 50% hoặc nhiếu
hon. Ngoài cảm ứng enzym cytochrom P450 3A, tình trạng tăng cường glucuronid hóa và
tăng cường hải tiết mật có thể đóng một vai trò trong vỉệc lảm giảm phơi nhiễm irinotecan vả
các chẩt chuyến hóa cúa nó
Một nghiến cưu đã cho thẳ_v dùng đồng thời kctoconazol dẫn đến giảm AUC cùa APC 87% vả
tăng AUC cưa SN- 38 109° ’o so với khi chi dùng irinotecan.
C an thận trọng ó~ những bộnh nhân uống đồng thời các thưốc đã biết là gây ức chế (ví dụ như
ketoconazol } hoặc gây cảm ứng {ví dụ như rifampicin, carbamazepin phenobarbital hoặc
phenytoin) chuyến hóa thuốc bới cytochrom P450 3A4. Nên trảnh dùng đồng thời irinotecan
với chẳt ức chế/cảm ứng con đường chuyến hóa nảy do khả năng lảm thay đổi sự chuyến hóa
irinotccan (xem mục 4.4).
Trong một nghiên cứu dược động học nhờ (n—5), trong đó irinotecan 350 mg/m2 đuợc dùng
kết hợp với St John's Wort (Hypericum perforatum) 900 mg, đã quan s.ẵt được mửc giảm
42% nông độ chất chuyến hóa có hoạt tính cùa irinotecan SN- 38 Myết tư.ơng
St. John s Won Iảm giảm nông độ trong huyết tuong cùa SN—38. Do đó, không nên dùng St.
John' s Wort với irinotecan txem mục 4. 3)
Dùng đồng thời 5— fluorouracil. acid folinic trong phảc đồ phối hợp không lảm thay đổi cảc
tính chất dược động học của irinotecan
Atazạnavir sulphat. Dùng đồng thời atazanavir suifat, một chắt ưc chế CYP3A4 vả UGTIAÌ,
có thế sẽ lảm tăng mưc phoi nhiếm toản thân của SN-38, châl chuyên hóa có hoạt tính của
irinotecan. Bác sĩ nên cân nhăc điêu nảy khi cho dùng đông thời cảc loại thuôc nảy.
Tương tác thường gặp với“ zẩt cả các chăt gây cỂộc tế bảo
Việc dùng thuốc chống đông lả phổ biến do tãng nguy cơ gặp các biến cố huyết khối ở bệnh
ung thư. Nén có chỉ định dùng các thuôc chông dông kháng vitamin K, phải tăng tân suât theo
dõi [NR (Chí sô Binh thường hóa Quôc tế) do chi sô điếu trị hẹp của cảc thuôc nảy, khả năng
Trang 7 ( 23
LPD Date March 15. 2010
Country Vietnam
Reference UK SPC“ dated February, 2016
biển thiên cao củarsụ~ dòng mảu tùy theo cả thế vả khả năng tuong tảc giữa cảc thuốc chống
đông qua đường uõng với hóa trị liệu chông ung thư.
Thuốc chống chí đinh sử dung đồng thời
- Vắc xin sốt vảng da: nguy cơ bị phản ứng toản thân gây tử vong với vắc xin
Thuốc khỏng đươc khuvển cáo khi sư dung đồng thời
- Vắc xin sống đã được lảm suy yếu (trừ vẳc xin bệnh sốt vảng da): nguy cơ mắc bệnh toản
thân có thể gây tử vong (ví dụ như nhiễm trùng). Nguy cơ nảy tăng lên ở những đối tượng đã
bị ức chế miên dịch do bệnh đã có từ trước.
Sử dụng một vẳc xin dã dược bẩt hoạt trong trường họp tồn tại nguy cơ nảy (bại 1iệt).
- Phenytoin Nguy co bị co giật nặng hon do giảm hấp thu phenvtoin qua đường tiêu hóa bởi
thuốc gây độc tế bảo hoặc nguy cơ bị tăng cường độc tính do tăng chuyến hóa ở gan bởi
phenytoin.
Thuốc cần cân nhắc khi sư dung đồng thời“
— Ciclosporin, 1`acrolimus: Ức chế miễn dịch quá mức với nguy cơ bị tăng sinh lympho
Không có bằng chứng cho thấy rằng tính an toản cùa irinotecan bị ảnh hưởng bởi cetuximab
hoặc ngược lại.
Kết quả từ một thử nghiệm tương tác thuốc - thuốc chuyên biệt cho thấy bevacizumab không
có ảnh hường rõ rảng lến đặc tính dược động hợc cùa irinotecan vả chât chuyến hóa có hoạt
tính SN-38 của nó. Tuy nhiên, điêu nảy không ngăn ngừa được tình trạng tăng độc tính đo đặc
tính dược lý cùa chúng.
4.6. Ảnh hướng đến khả năng sinh sản, phụ nữ có thai và cho con bú
Phu nữ có khả năng mang thai/ Tránh thai ở nam vả nữ
Phụ nữ có khảnăng mang thai và nam giới phái sử dụng biện phảp ngừa thai hiệu quả trong 1
tháng vả lên đên 3 thảng sau điêu trị.
Mang thai
Không có dữ liệu từ việc sử dụng irinotccan ở phụ nữ mang thai. lrinotecan đã được chứng
minh là gây nhiễm độc phôi thai và gây quái thai 0 động vật Do đó, dựa trên kết quả từ
nghiên cứu động vật vả cơ chế hoạt động của irinotecan, không nên dùng C AMPTO trong khi
mang thai trừ khi việc dưng thuốc rõ rảng iả cần thiết.
Phu nữ cho con bú
Ở chuột cống cho con bú, l4C—irinotecan đã được phát hiện trong s a. Chưa được biết
irinotecan có được bải tiêt vảo sữa người không. Do đó, vì khả năng có p n ứng bât lợi ở trẻ
bú mẹ, nến ngừng cho con bú trong thời gian diếu trị băng CAMPTO (x
Khả nãng sinh sản
Không có dữ lỉệu trên người về ảnh hướng của irinotecan lên khả năng sinh sản. Ở động vật
đã ghi nhận ánh hưởng bât lợi cùa irinotecan iên khả năng sinh sản cùa con con (xem mục
5.3).
4.7. Ánh hưởng ]ẽn khả năng lái xe và vận hảnh máy móc
Bệnh nhân nến được cảnh bảo về khả nãng bị chóng mặt hoặc rối loạn thị giảc có thể xảy ra
trong vòng 24 giờ sau khi dùng CAMPTO, vả nên được khuyên không Iải xe hoặc vận hảnh
mảy móc nêu cảc triệu chửng nảy xảy ra.
Trang 8 «' 23
LPD Date: March 15, 2016
Country Vietnam
Rcference UK SPC duted February, 2016
4.8. Các tác dụng không mong muốn
CÁC NGHIÊN CỨU LÀM SÀNG
Du liệu về cảc tảo dụng không mong muốn đã được thu thập rộng rãi từ các nghiên cứu về
ung thư đại trực trảng di căn với tần suất như ở duới. Cảc tảc dụng không mong muôn cho các
chỉ định khác được đự báo là tương tự như đối với các tảc dụng không mong mưốn cho ung
thư đại trực trảng.
Cảo tác dụng không mong muốn có giói hạn iiều thường gặp nhất (>1~ 10) của irinotccan iả
tiêu chảy muộn (xảy ra hơn 24 giờ sau khi dùng thuốc) và rôi loạn về mảu bao gồm giảm bạch
cầu trung tinh, thiếu máu vả giảm tiếu cầu
Giảm bạch cầu trung tinh là một tác dụng không mong muốn có giới hạn liếu Giảm bạch cầu
trung tinh có thể hồi phục vả không tich lũy; sô ngảy trung bình cho đến thời điếm giảm bạch
câu nghiêm trợng nhất là 8 ngảy bất kể dung trong đ ieu trị đon độc hay điếu trị phối hợp.
Ilộỉ chứng cholinergic cẳp thoảng qua nghiếm trọng đã được ghi nhặn rắt thường gặp.
Cảo triệu chứng chinh đuợc xác định lả tiêu chảy sớm vả cảc triệu chưng khảc nhau khác như
dau bụng, 1a mô hôi, co đồng tư vả tăng tiết nước bọt xảy ra trong khi trưyền hoặc trong vòng
24 giờ đẩu tiên sau khi tiêm truyền CAMPTO Cảc triệu chưng nảy biến mất sau khi cho dùng
atropin (xcm mục 4. 4).
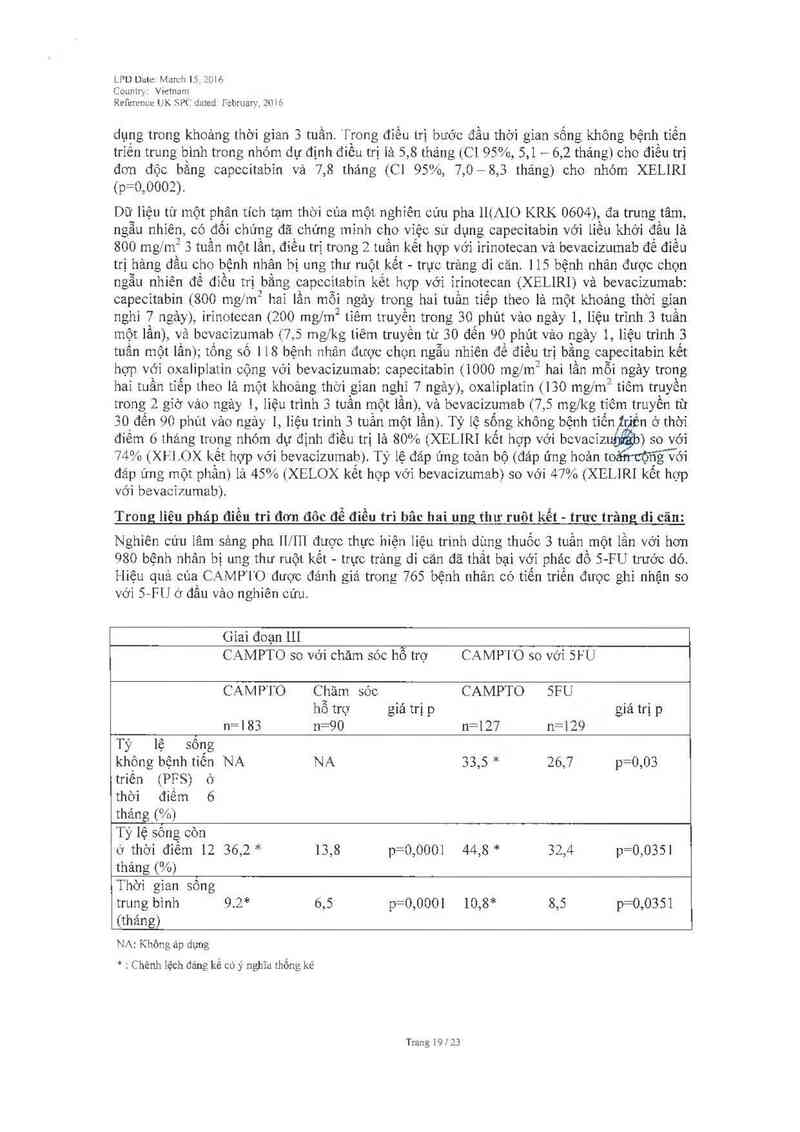
TRỊ LIỆU ĐON ĐỘC
Các tác dụng không mong muốn sau đây được xem lá có thế hoặc có khả năng liên quan đến
việc cho dùng C AMPTO đã được báo cảo từ 765 bệnh nhân ở liếu khuyến cáo iả 350 mg/m²
trong đìều trị đơn độc Trong mỗi nhớm tần suất các tảc dụng không mcng muốn được thế
hiện theo thứ tự múc dộ nghiếm trọng giảm dần. Tần suất được xác định 1ả: rất thuờng gặp
(>1/10), thường gặp (>1f100 đến <1'10), ít gặp (>lfi 000 đến <11100), hiếm gặp (>11’10. 000
đến <11'1 000) vả rât hỉếm gặp (<1. ’10 000)
Cảc tảo dụng không mong muốn được báo cáo về CAMPTO trong điểu trị đơn độc (350
mg/m ² liệu trình 3 tuần một lẫn)
Phân loại theo hệ co quan cúa Phân loại theo tần Thuật ngữ Ưu tiên
MedDỊỀA _ suất _
Nhiễm trùng vả nhiễm ký sinh trùng Thường gặp Nhiễm trùng
Rối loạn máu và hệ bạch huyết Rất thường gặp Giảm bạch cầu trung tính
Rất thường gặp Thiêu máu
Thường gặp Giảm tiếu cầu
Thường gặp Giảm bạch cẩu trung tính kèm sốt
Rôi ioạn chưyên hóa vả dinh dưỡng Rắt thường gặp _ Giảm cảm giảc thèm ăn
Rối loạn hệ thần kinh Râ_t thường gặp IIội chúỵhẵcholincrgic
Rôi 1oạn tiêu hóa Rất thường gặp Tiêu chảỄ/
Rất thường gặp Nôn mửa
Rắt thường gặp Buôn nôn
Rất thường gặp Đau bụng
Thường gặp Tảo bón
_R_ội_ l_oạn da vả mô dưới da Rất thường gặp Rụng tóc {có thể hồi phục)
Rối loạn chung và tình trạng tại nơi Rắtthường gặp Viêm niêm mạc
tiêm thuốc Rất thường gặp _ Sốt
Rât thường gặp | Suy nhược
`[`rzing 9“ .~` 23
LPD Dđte March 15, 2010
Country Vietnam
Reference [.Jk' SPC dated: February, 21116
Kêt quả xét nghiệm Thường gặp Tăng creatinin trong mảu
Thường gặp Tăng transaminase (SGPT vả
SGOT)
Thường gặp , Tăng bilirubin
`l`hường gặp ] Tảng phosphatase kiềm trong máu
Mô tả các tảc dụng không mong muốn chọn lợc (điều trị đon độc)
Tiêu chảy nặng được quan sait thấy ớ 20% bệnh nhân thực hiện theo chi dẫn kiếm soát tiêu
chảy. '1`rong các chu kỳ có thế đảnh giả, 14% bệnh nhân bị\tiếu chảy nặng. T`hời gian trung
bình băt đâu đi phân lóng lả vẽto ngảy thứ 5 sau khi tiếm truyên CAMPTO.
Buồn nôn vả nôn nặng ở khoáng 10% bệnh nhân được điều trị bằng thuốc chống nôn.
Táo bón được cho thắy ở dưới 10% bệnh nhân.
Giảm bạch cầu trung tính được thấy ở 78,7% bệnh nhân và nặng (lượng bạch cầu trung tính
< 500 tế bâo/mrn3) ờ 22,6% bệnh nhân. Trong các chu kỳ có thế đánh giả, 18% bệnh nhân có
lượng bạch cằn trung tính dưới 1.000 tổ bảofmm3 trong đó có 7,6% có lượng bạch cẩu trung
tính < 500 tễ bảo]mtn².
Tinh trạng nảy hồi phục hoản toản muộn nhất vảo ngảy 22.
Sốt kèm giảm bạch cầu trung tính nặng được báo cáo ở 6,2% bệnh nhãn và trong 1,7% các-
chu kỳ.
Các đot bị nhiễm khuấn xảy ra ở khoảng 10,3% bệnh nhân (2,5% cảc chu kỳ) và có 1ìên quan
tới giam bạch câu trưng tính nặng ở khoảng 5,3% bệnh nhân (“1,1% các chu kỳ), và dân đên từ
vong trong 2 trường hợp.
Thiếu máu được bảo cáo ở khoảng 58,7% bệnh nhân (8% có hemoglobin < 8 gde và 0,9% có
hcmoglobin < 6,5 gf'dl).
Giảm tiễu cầu [< 100.000 tễ bảoImm²) được ghi nhận ở 7,4% bệnh nhân vả 1,8% các chu kỳ
với 0,9% có lượng tiếu cầu s 50.000 tế bảov’mm3 vả 0,2% các chu kỳ.
Gần như tất ca cảc bệnh nhản đều hổi phục muộn nhẩt vảo ngảy 22.
Hội chứng cholinergic cẫp
Quan sảt thấy hội chứng cholincrgic cấp nghiêm trỌng thoáng qua Ở 9% bệnh nhân được điếu
trị don dộc.
Suy nhược nghiêm trợng xay ra ở ít hon 10% bệnh nhân được điếu trị trong liệu pháp đơn
dộc. Mối quan hệ nhân quả giữa tác dụng nảy với vỉệc sử dụng CAMPTO chưa được biết rõ.
Sốt trong trường họn không nhiễm khuấn vả không đồng thời bị giảm bạch cầu trung tính
nặng xáy ra ở 12% bệnh nhân được điều trị trong điếu trị đon độc.
Xét nghiệm
Qưan sát thấy tăng nhất thời về từ nhẹ đến trung bình nồng độ của tranẫ inase, phOSphẽitase
kiêm hoặc bỉiirubin trong huyêt thanh lân lượt ở 9,2%, 8,1% vả 1,8% W không bị di
cãn gan tiến triền.
Quan sát thắy tăng nhất thời và từ nhẹ đến trung bình nồng độ creatinin trong huyết thanh ở
7,3% bệnh nhân.
ĐIỂU TRI PHÒI HOP
Cảo tảc dụng không mong muốn được nêu chi tiết trong phần nảy lả cùa irinotecan.
Trang 10 23
1PD Date Marth 13, 2016
Coưntiy Victnam
Reference UK SPC datcd. Fcbruary. 2016
Không có bằng chứng chứng minh rằng tinh an toản cùa irinotccan bị ảnh hu~ờng bởi
cctuximab hoặc ngược lại. Khi kết hợp với cetuximab, các tác dụng không mong muốn bổ
sung được báo các lá các tảc dụng không mong muốn dự đoản sẽ gặp với cctuximab (như
phát ban dạng mụn 88%) Để biết thông tin vẽ các tảo dụng không mong muốn khi irinotec-an
kết hợp với cetuximab, hãy tham khảo thêm thông tin kê toa tường ứng của các sán phẩm nảy
Các tảC dụng không mong muốn cua thuốc dược báo cáo ờ bệnh nhân được điều trị bằng
capecítabin kết hợp với irinotecan ngoải nhưng phản ứng quan sát được vói điều trị đon độc
bằng capecitabin hoặc quan sát thấy trong nhóm tần suất cao hon so với nhóm điều trị đơn
độc bằng capecitabin bao gôm: Rất lhỉt’Ờng gặp, lấf cả các cấp đo tác dung khóng mong muốn
cưa thuốc: huyết khốh~tẳc mạch; Thưởng gặp, lấl cả các câp tác dtmg khóng mong muôn của
thuốc. phản ứng quá mẫn, thiếu máu cục boi n1101 máu cơ tim; Thương gặp, tác dụng khóng
mong muôn czia zhuỏe cẩp độ 3 vò 4. giảm bạch cầu trung tính kèm sốt Dế biết thông tin đầy
đủ vẽ các tảc dụng không mong muôn cùa capccitabin, tham khảo thông tin kê toa cùa
capecitabin.
Cảc tác đụng không mong muốn cùa thuốc cấp độ 3 và 4 được báo cáo ở bệnh nhân được điếu
trị bẳng capecitabin kết hợp với irinotecan vả bcvacizumab ngoải nhũng tảo dụng quan sát
thắy trong điều trị đơn độc bằng capecit'abin hoặc quan sảt thấy ttong nhỏm tần suất cao hon
so với nhóm điều trị đơn độc bầng capecìtabin bao gôm: Thư150 mgfmj). Không thiết lập dược
mối quan hệ giữa kiến gen UG'1`1 Al vả sự phảt sinh bệnh tiêu cháy gây ra bời irinotecan.
Bệnh nhân được biết là đồng hợp tử đối vởi UGTIAI*28 nên được cho dùng liều khói đầu
irinotccan thông thường được chỉ định. Tuy nhiên, những bệnh nhân nảy nên được theo dõi
độc tính huyết học. Nên xem xót giảm liễu khởi đầu ỉrinotccan cho bệnh nhân đã bị nhiễm độc
mảu trưởc đó với liệu pháp đỉểu trị trước đó. Chưa thiết 1ập được mức độ giảm chính xác liều
khởi đầu trong nhóm bệnh nhân nảy và bất kỳ việc thay đổi liều dùng tiếp theo nảo cũng phải
dược dựa trên khả năng dung nạp thuốc điều trị cùa bệnh nhân (xem mục 4.2 và 4.4)
Hiện không có dữ liệu đầy đủ để kết luận về lợi ích lâm sảng cùa việc xác định kỉếu gen
UGTIAl.
5.2. Các đặc tính được động học
Trong một nghiên cứu pha 1 (T 60 bệnh nhân có phảc đồ liều dùng tiêm truyền tĩnh mạch trong
30 phút từ 100 đến 750 mg/m² ha tuần một 1ần, irinotecan cho thấy CÓ tính chất đảo thải theo
hai giai đoạn hoặc ba giai đoạn. Độ thanh thải trung bình trong huyết tương là 15 Li’giờ/m² vả
thể tích phân bố ớ trạng thải ốn định (Vss): 157 1./m². 'l`hòi gian bán thái trung bình trong
huyết tương cùa giai đoạn đẩu tiên cưa mô hinh ba giai đoạn lả 12 phút, cúa giai đoạn thứ hai
là 2,5 giờ, và thời gian bán thải của giai đoạn cuối là 14,2 giờ. SN-38 cho thấy tính chất đảo
thải hai giai đoạn với thời gian hản thái cuối trung vị lả 13,8 giờ. Sau khi kết thúc tiêm truyền,
ớ liều khuyến cảo là 350 mgtm², nồng độ đinh irung bình trong huyết tương cùa ỉrinotecan vả
SN-38 tương ứng lá 7,7 ụgf'ml vả 56 ng/ml, vả gìả trị lrung bình của diện tích dưới đường
cong (AUC) tượng ứng lả 34 ụg.hfml vả 451 ng.hfml. Có sự biến thiên lớn giữa các cá thế về
cảc thông số dược động học đối với SN-38.
Một phân tích dược động học cùa irinotccan đã được thưc hiện Ở 148 bệnh nhân bị ung thư
ruột kết - trực trảng di cãn, được điều trị với các liệu trình khác nhau vảjixcác liều khác nhau
trong các thử nghiệm pha 11. Các thông số đuợc động học được ước ệ' hbăng mô hinh ba
vùng tuong tự như các thông số dược động học quan sát thắy trong các _ 11 pha 1. l`ất
cả các nghiên cứu đã cho thấy mức phơi nhiễm irinotecan (C PT-l 1) vả SN-38 tảng tưong ứng
vói liều dùng CPT-l 1; tính chất dược động học của chúng độc lập vởi số lượng các chu kỳ
trưởc đó và liệu trình dùng thuốc.
In vitro, liên kết protein trong huyết tương cùa irinotecan vả SN-38 tưcmg ửng là khoảng 65%
và 95%.
Cảo nghiên cứu cân bằng và chuy ển hớa khối vởi thuốc được đánh dấu bằng đồng vị carbon
C14 đã cho thấy hon 50% liều đuợc cho dùng qua tinh mạch của irinotecan được bải tiết duới
dạng thuốc không thay đổi, vởi 33% trong phân chủ yếu qua mật vả 22% trong nước tiếu.
Trang 21 l23
LPD Date` Match 15, 2016
Country. Vietnam
Reference UK SPC dateđ Febmanz 2016
Có hai đường chuyên hóa, mỗi đường đám trảch it nhất 12% lỉều:
0 Thủy phân rbởi carboxylesterasc thảnh chất chuyến hóa có hoạt tính SN-38, SN-3S được
đảo thải chú yêu bởi quá trình glucuronid hóa, và tỉêp theo bời bải tiêt qua mật và thận (ít hơn
0,5% liêu irìnotecan) Cảo SN-38 giucuronid sau dó có lẽ bị thủy phân trong rưột.
0 Các phán ứng oxy hóa phụ thuộc enzym Cytochrom P450 3A dẫn đến mờ vòng piperidin
ngoải với sự hinh thảnh APC (dân xuât acid amỉnopentanoic) vả NPC (dân xuât amin chính)
(xcm mục 4.5).
Chất mẹ ỉrinotccan không đồi là dạng tồn tại chính trong huyết tượng, tiếp theo lá APC, SN-
38 glucuronid vả SN-38. Chi SN-38 mới có tảo dụng gây độc tê bảo mạnh.
Độ thanh thải irinotecan giảm khoảng 40% ở bệnh nhân bị giảm bilirubin mảu từ 1,5 đến 3
1ẩn giới hạn bình thường trên. Ở những bệnh nhân nảy liều irinotccan 200 mglm² dẫn dến
mức phơi nhiễm của thuốc trong huyết tương tương tự vói giá trị quan sải được khi dùng liếu
350 mgfm² ở bệnh nhân ung thư có các thông số gan binh thường.
5.3. Dữ liệu an toản tỉên lâm sảng
1rinotecan vả SN-38 đã được chứng minh lả gây đột biến in vitch trong các thử nghiệm sai
1ệch nhiêm săc thế trên tê bảo CHO cũng như trong thử nghiệm vĩ nhân in vivo ở chuột.
’l`uy nhiên, chúng đã được chứng minh lá không có bẩt kỳ khả năng gây đột biến nảo trong
lhứ nghiệm Ames.
Ở chuột cống được điều trị một iần một tuần trong 1 › tuần ở liều tối đa 150 mglm² (ít hơn một
nưa liễn khuyến cáo ở người), không có háo cảo về khối u liên quan đến liệu phảp điều trị nảo
ờ 91 tuần sau khi kết thúc điều trị.
Cảc nghiên cún độc tính liều đon và liều nhắc lại với CAMPTO đã được tiến hảnh ở chuột
nhắt, chuột cống và chó. Các tác dụng gây độc chỉnh đã được thấy trong hệ mảu và hệ bạch
huyết Ở chó, tiêu chảy muộn liên quan đến teo vả hoại tử ố của niêm mạc ruột đã được báo
cáo. Rụng lông cũng được quan sát thẩy () chó.
Mức độ nghiêm trọng của các tác dụng nảy liên quan đến Iìồu và có thể hồi phục được.
Sinh sản
1rjnotecan gây quấi thai ở chuột cống vả thò vởì liều thấp hơn liều điều trị ở n ười. Ở chuột
cống, chuột con sinh ra lừ động vật đuợc điều trị có ngoại hinh bắt thường ch ắy giảm khả
nãng sinh sản. Không thắy điều nảy ở chuột con có hinh thải bình thường. Ở c t Ônggnang
thai có tình trạng giám trọng iượng nhau thai vả ở đời con có tỉnh trạng giảm khả năng tôn tại
cùa thai nhi vả tãng hảnh vi bât thường.
6. CÁC ĐẶC TÍNH DƯỢC HỌC
6.1. Danh mục tá dược
Sorbitol, acid lactic, natri hydroxid vả acid hydrochlorid (để điều chỉnh pH), nước cất pha
tiêm.
6.2. Tương kỵ
Không có trường hợp tưong kỵ nảo được biết đến.
Không được pha thuốc với các thuốc khác ngoại trừ những th uốc được đề cập trong mục 6.6
6.3. Hạn dùng
Campto 40mg/2m1: 24 thảng kể từ ngảy sản xuất.
Trang 22 23
1.PD Date March 15, 2016
Country Vietnam
Reference UK SPC datcd February. 2016
Campto lOOmg/Sml: 36 thảng kế từ ngảy sản xuất.
Hạn dùng của dung dịch sau khi pha: 28 ngảy bảo quản trong tủ lạnh (xem mục 6. 4)
Để giảm nguy cơ nhỉễm khuấn nên pha dung dịch tiêm truyền ngay trước khi sử dụng và tiến
hảnh truyền cảng sớm cảng tốt sau khi pha. Nếu không sử dụng ngay, người dùng có trách
nhiệm bảo đảm cho thời gian bảo quản để sử dụng không quá 24 gìờ và ở điều kiện 2— 8°C
trước khi sử dụng, trừ khi đã được pha loãng trong điều kiện vô trùng được kỉểm soát và xảo
nhận họp lệ
6.4. Thận trọng đặc biệt khi bảo quản
Không bảo quản ở nhiệt độ trên 30°C. Trảnh ảnh sáng. Không đề đông lạnh.
Các dung dịch pha loãng Dung dịch nảy đă được chứng minh là ổn định về mặt vật lý và hóa
học khi pha loãng với các dung dịch tiêm truyền (dung dịch natri clorid 0,9% vả _dung dịch
glucose 5%) trong tối đa 28 ngảy khi bảo quản trong lọ poiycthylen tỷ trọng thấp (LDPẸ)
hoặc polyvinyl clorid (PVC) ớ_ S°C hoặc 30°C/độ am môi trường vả tránh ảnh sảng. Khi tiếp
xúc với ánh sáng, dung dịch ốn định về mặt lý hóa trong vòng 3 ngảy Lâm đông 1ạnh lọ
thuốc irinotecan hoặc dung dịch pha loãng ỉrỉnotecan có thế lảm kết tùa thuốc, vì vậy phải
tránh đông lạnh. (Xem mục 6. 3. Hạn dùng)
6.5. Tính chẩt và dung lượng bao bì đóng gỏi
Lọ polypropylen mảu hố phảch chứa iiếu đon, 40 mg/2 mL, 100 mg/S mL, hộp 1 lọ.
6.6. Hưởng dẫn sử dụng và pha chế
Cũng như những t_huốc chống ung thư khảo, CAMPTO phải được pha chế vả xử lý một cách
thận trọng Cân sủ dụng kính, mặt nạ vả găng tay khi thao tảc.
Nếu dung dịch thuốc CAMPTO hoặc dung dịch tiêm truyền tiếp xúc vởỉ da, cần rửa sạch da
ngay lập tức và kỹ bằng xả phòng và nước. Nếu thuốc CAMPTO hoặc dung dịch tiêm truyền
tiêp xúc với niêm mạc, phải rưa ngay với nước
Pha thuốc để tiêm truyền qua tĩnh mạch:
Như với bất kỳ loại thuốc tiêm nảo khác, dung dịch CAMPTO phải được pha trong đìều kiện
vô trùng (xem mục 6.3. Hạn dùng).
Nếu quan sát thấy bất kỳ 1_<ết tùa nảo trong lọ hoặc _sau khi pha Ioãng, sản phấm cần được loại
bo theo quy trình tỉêu chuân cho cảc chât gây độc tê bảo.
Dùng kỹ thuật vô trùng, rút lượng dung dịch CAMPI`O cần dùng ra từ lọ bằng ống tiêm đă
hiệu chuẩn và tiêm vảo túi hoặc chai truyền 250 ml chúa dung dịch natri cỆd 0,9% hoặc
dung dịch giucose 5%. Sau đó, trộn đều dung dịch tiêm truyền bằng cảch xoa ng bằng tay.
Thải bỏ:
Tất cả cảc vật liệu được sử dụng để pha Ioãng và truyền thuốc phải được thải bỏ theo quy
trinh tiêu chuân cùa bệnh viện ảp dụng cho chât gây độc tê bảo.
Tiêu chuẩn kỹ thuật: Nhà sản xuất
Nhà sả_n xuất: Ptizer (Perth) Pty Ltd, Technology P ' . ~ Hall Drive Bentley WA
6102, Uc. ~~
”Nhãn hiệu đã đăng ký
LPD Date: March 15. 2016
Reference UK SPC date: February, 2016
Trang 23 123
TUQ. CỤC TRUỘNG
P.TRUỞNG PHONG
Jiỷuyến inlảl Jfânfạ
+ "Lưu ý những sản phẩm đăng trên website thuộc loại thực phẩm chức năng: những sản phẩm này không phải là thuốc và không có tác dụng thay thế thuốc chữa bệnh"
+ Dùng thuốc theo chỉ định của Bác sĩ
+ Đọc kỹ hướng dẫn sử dụng trước khi dùng